Похожие презентации:
Синтез полимеров
1.
Синтез полимеров1
ЛЕКЦИЯ 1
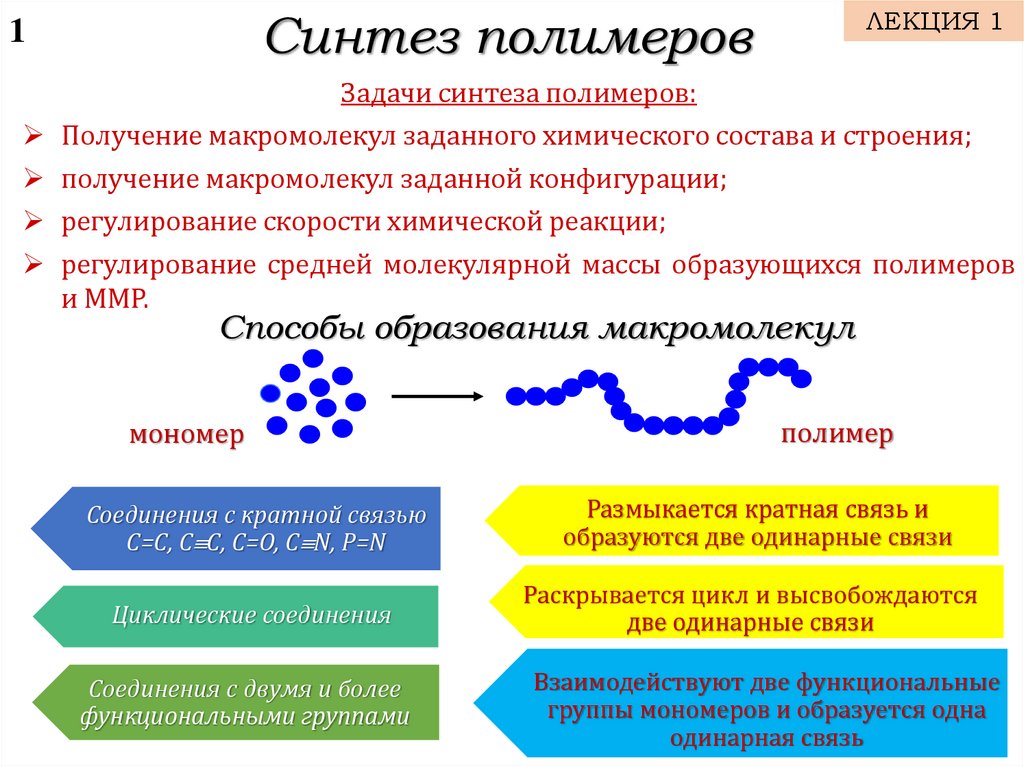
Задачи синтеза полимеров:
Получение макромолекул заданного химического состава и строения;
получение макромолекул заданной конфигурации;
регулирование скорости химической реакции;
регулирование средней молекулярной массы образующихся полимеров
и ММР.
Способы образования макромолекул
мономер
полимер
Соединения с кратной связью
С=С, С С, С=О, С N, P=N
Размыкается кратная связь и
образуются две одинарные связи
Циклические соединения
Раскрывается цикл и высвобождаются
две одинарные связи
Соединения с двумя и более
функциональными группами
Взаимодействуют две функциональные
группы мономеров и образуется одна
1
одинарная связь
2.
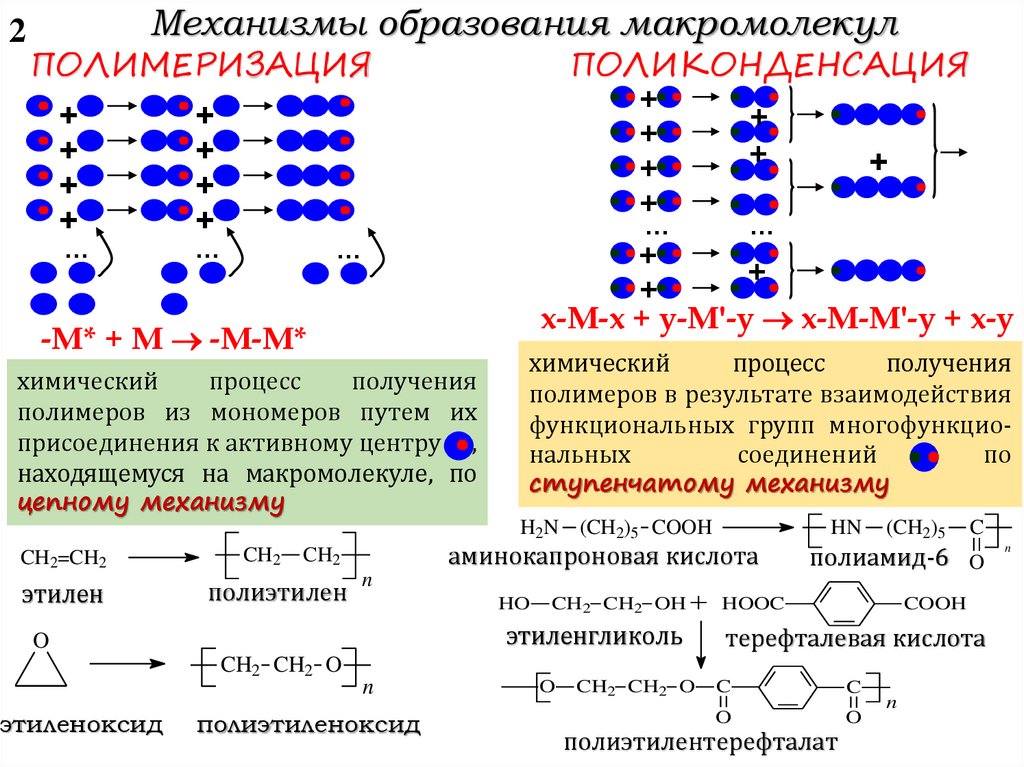
2Механизмы образования макромолекул
ПОЛИКОНДЕНСАЦИЯ
+
+
+
+
+
+
+
ПОЛИМЕРИЗАЦИЯ
+
+
+
+
…
+
+
+
+
…
…
…
+
+
+
x-M-x + y-M'-y x-M-M'-y + x-y
-M* + M -M-M*
химический
процесс
получения
полимеров из мономеров путем их
присоединения к активному центру ,
находящемуся на макромолекуле, по
цепному механизму
химический
процесс
получения
полимеров в результате взаимодействия
функциональных групп многофункциональных
соединений
по
ступенчатому механизму
H2N
CH2=CH2
этилен
CH2
HO
CH2 CH2 OH
этиленгликоль
CH2 CH2 O
HN
n
O
этиленоксид
(CH2)5 COOH
аминокапроновая кислота
CH2
полиэтилен
…
n
полиэтиленоксид
O
CH2 CH2 O
(CH2)5
C
полиамид-6 O
HOOC
COOH
терефталевая кислота
C
C
O
O
полиэтилентерефталат
n
n
3.
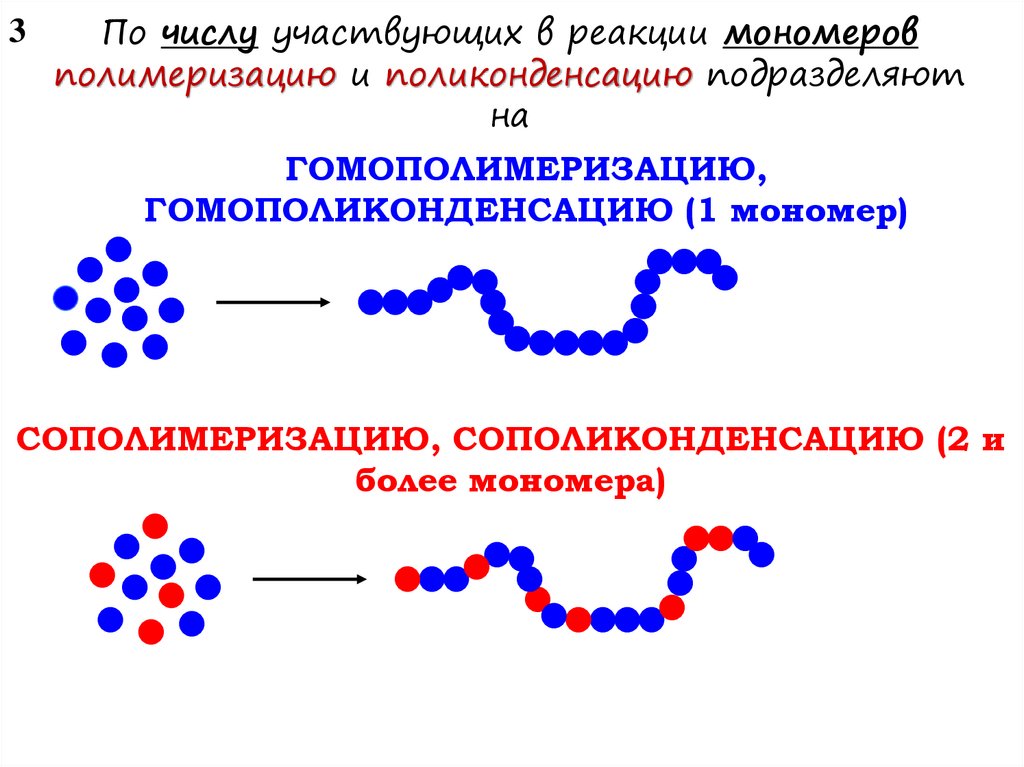
3По числу участвующих в реакции мономеров
полимеризацию и поликонденсацию подразделяют
на
ГОМОПОЛИМЕРИЗАЦИЮ,
ГОМОПОЛИКОНДЕНСАЦИЮ (1 мономер)
СОПОЛИМЕРИЗАЦИЮ, СОПОЛИКОНДЕНСАЦИЮ (2 и
более мономера)
4.
4ПОЛИМЕРИЗАЦИЯ
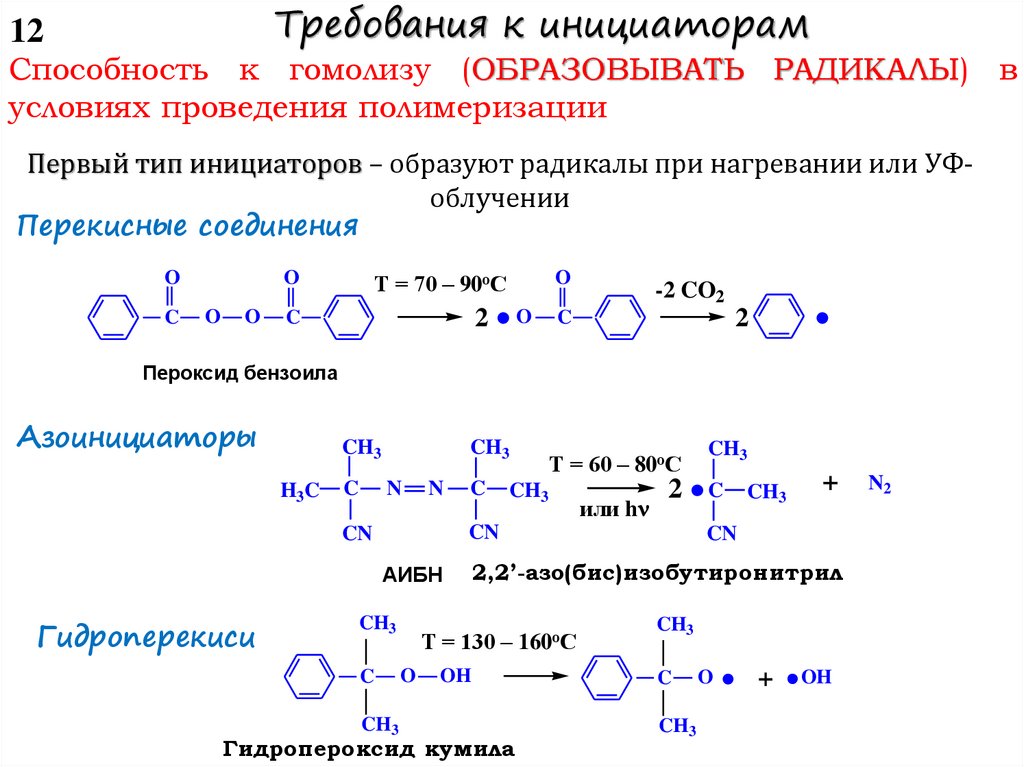
В зависимости от природы активного центра
механизма роста цепи выделяют
и от
РАДИКАЛЬНУЮ – активный центр свободный радикал
(радикал роста, макрорадикал)
ИОННУЮ – активным центром может быть ион, ионная
пара или поляризованная молекула
КАТИОННУЮ – концевой атом растущей цепи несет полный
или частичный положительный заряд
АНИОННУЮ – концевой атом растущей цепи несет полный или
частичный отрицательный заряд
КООРДИНАЦИОННО-ИОННУЮ – если противоион, входящий в
состав активного центра, принимает участие в акте роста,
образуя
с
присоединяющейся
молекулой
мономера
координационный комплекс или циклическое переходное
состояние
5.
5Цепная полимеризация. Общая схема.
1 – Инициирование :
I I*
I* + M I-M*
I – молекула инициатора
M– молекула мономера
I* - активированный инициатор
I-M* - активный центр
ПОЛИМЕРИЗАЦИЯ
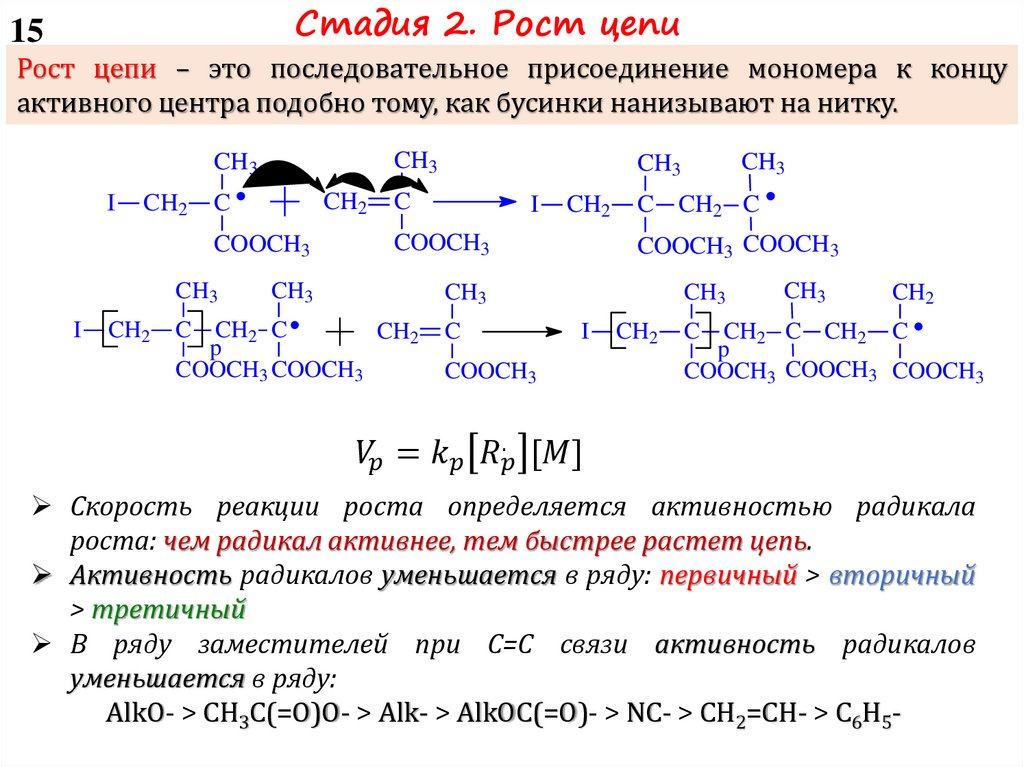
2 – Рост цепи:
I-M* + M I-M-M*
I-M-M* + M I-M-M-M*
I-(M)n-1-M* + M I-(M)n-M*
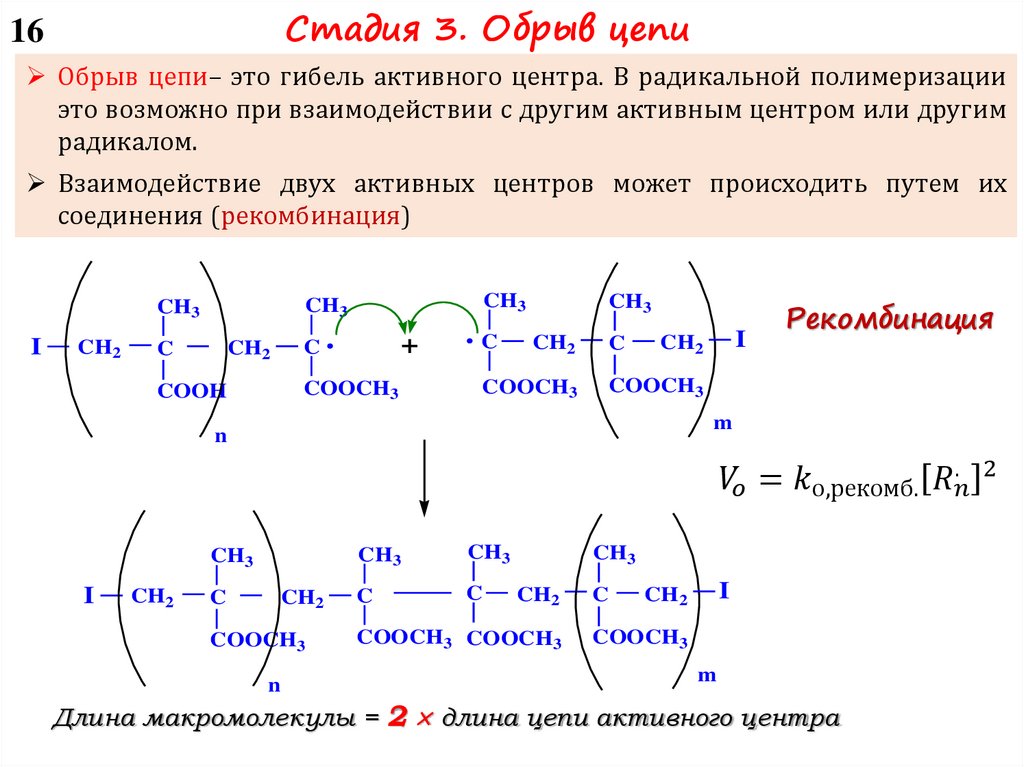
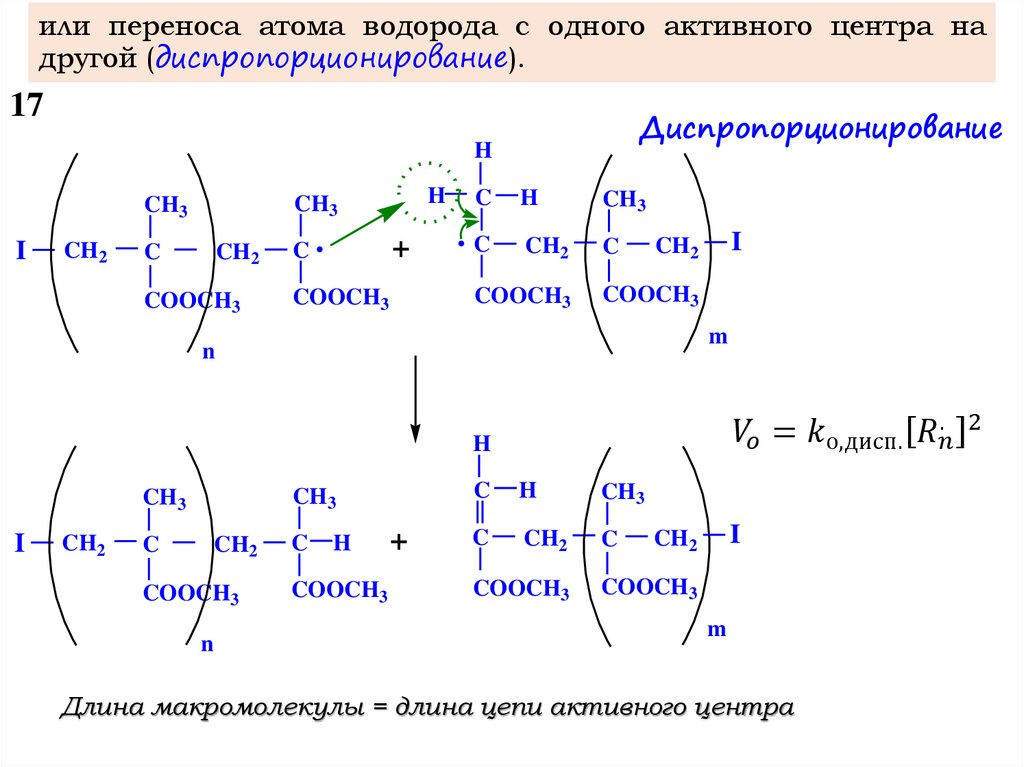
3 – Обрыв цепи:
I-M-M-M-…-M-M* I-M-M-M-…-M-M
I-M-M-M-…-M-M – молекула полимера
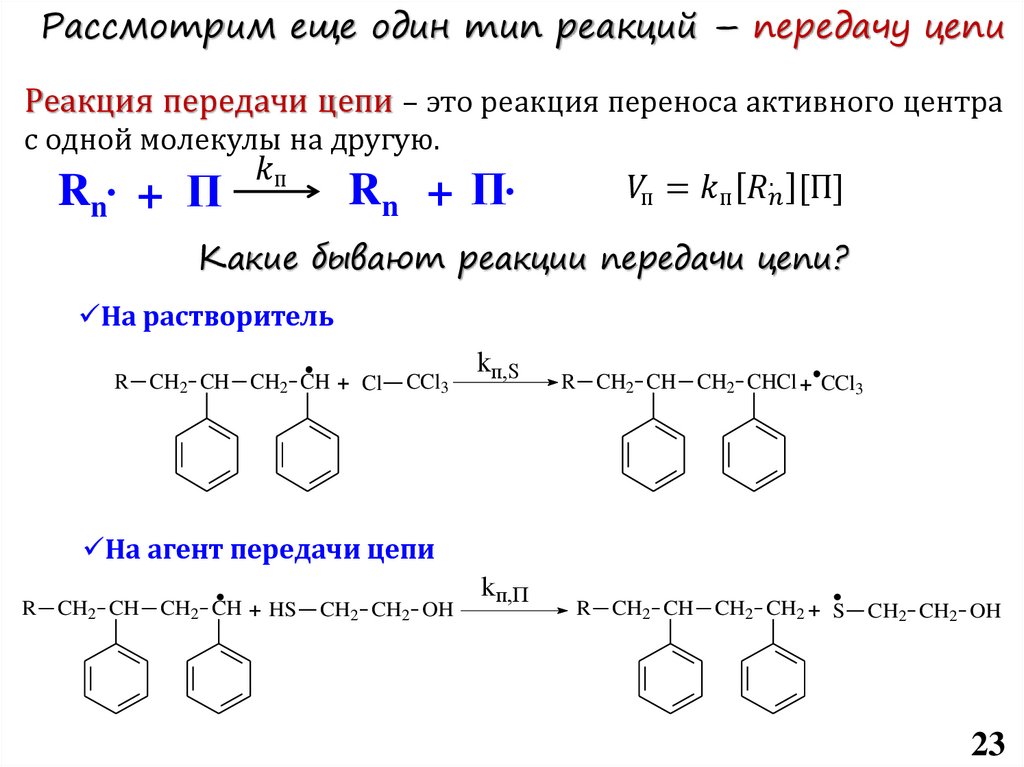
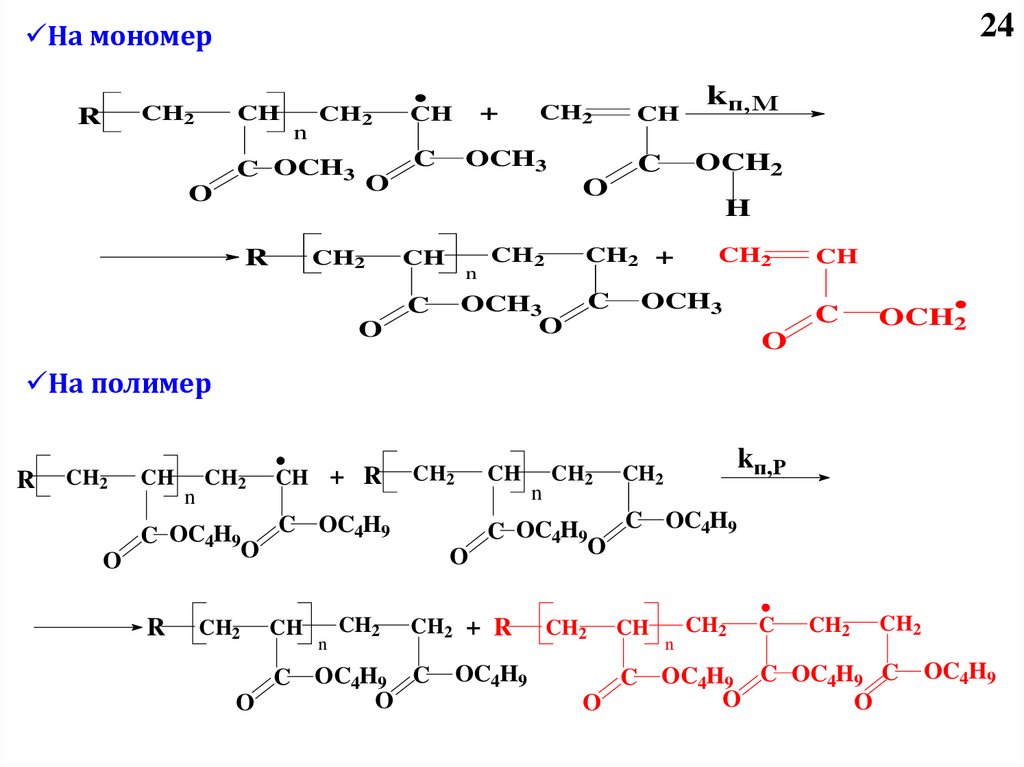
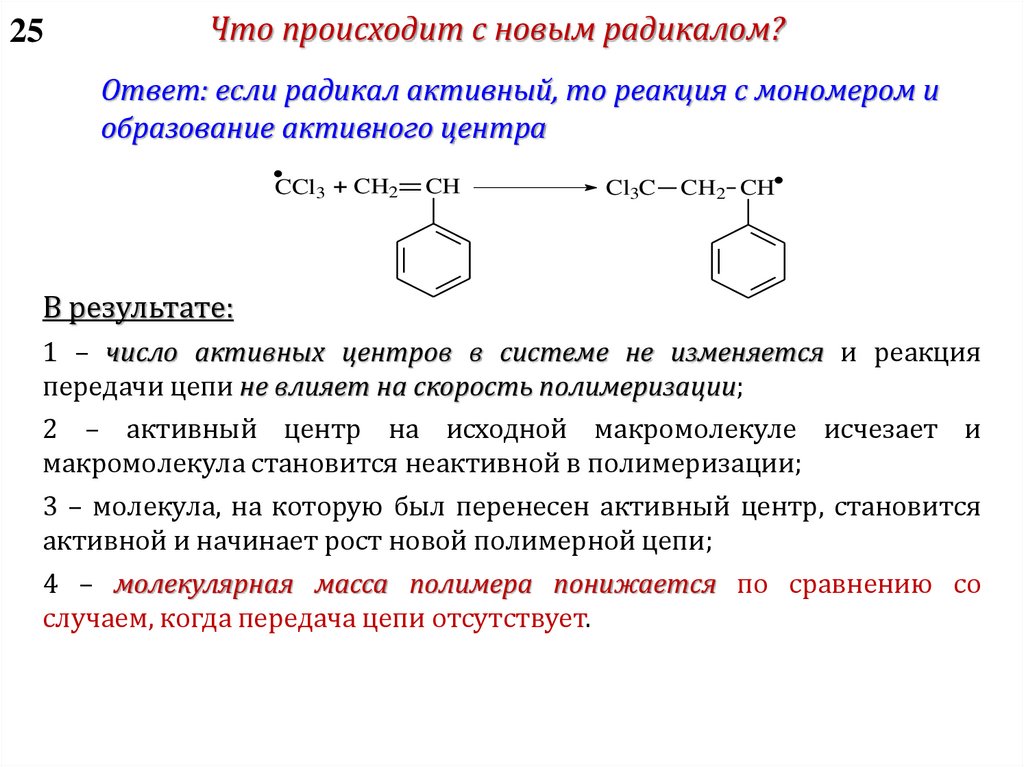
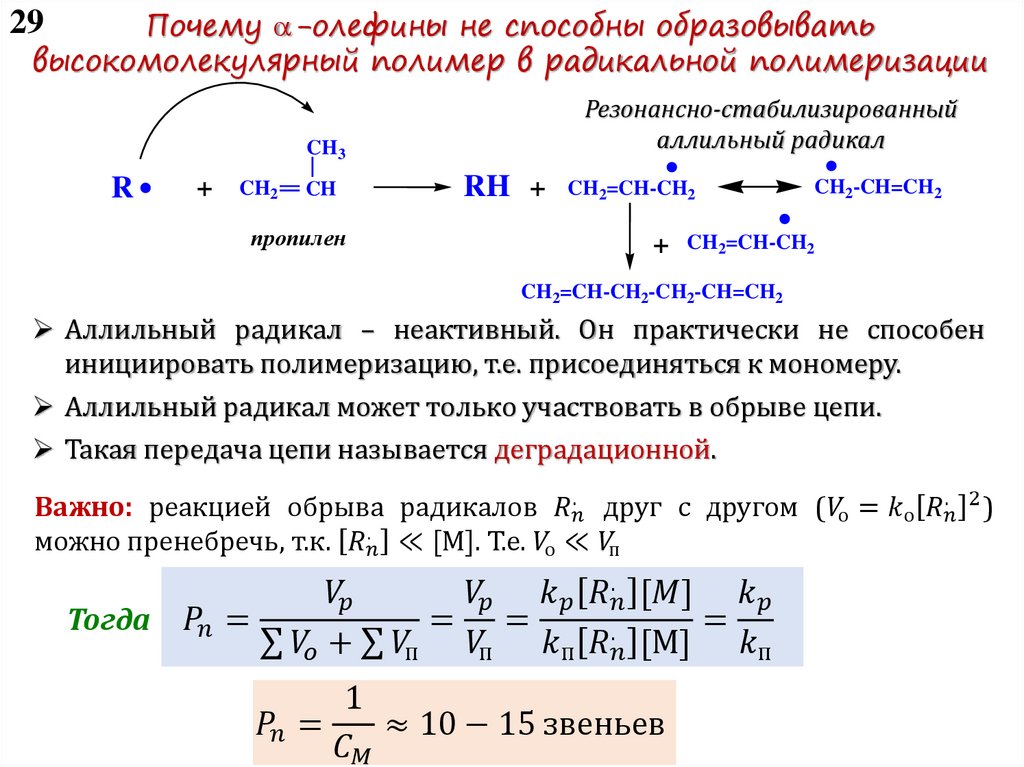
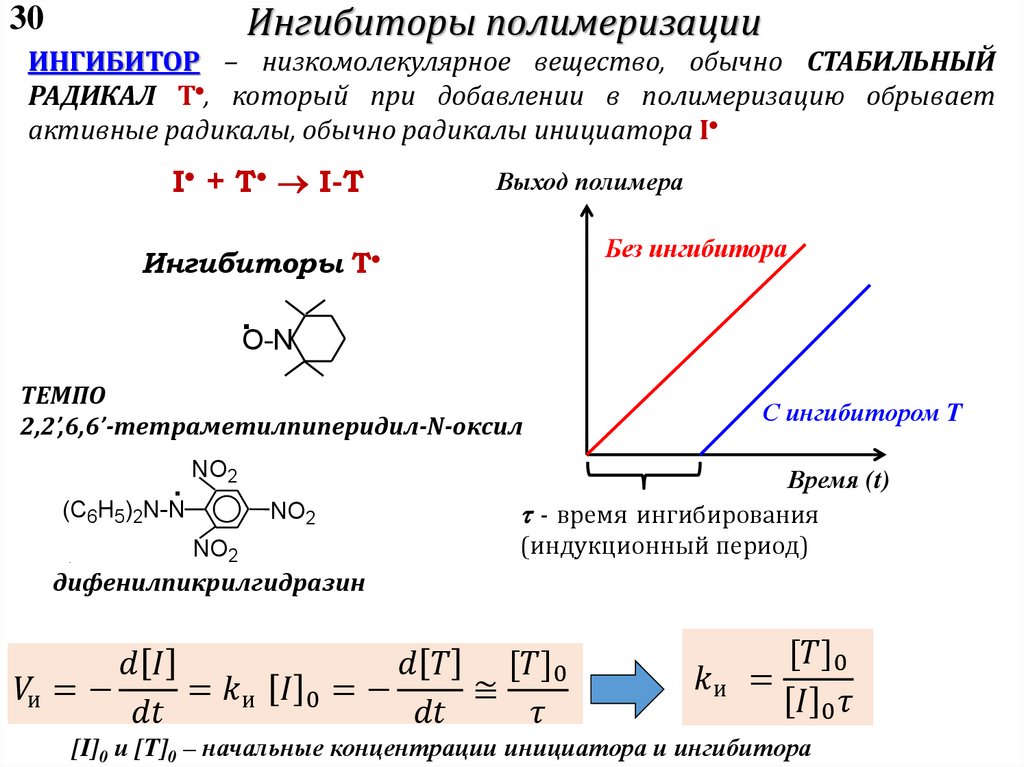
4 – Передача цепи:
I-(M)n-M*+ XY X*+I-(M)n-M-Y
I-M
РАДИКАЛЬНАЯ
I-M+
КАТИОННАЯ
I-M-
АНИОННАЯ
6.
6Любая химическая реакция является обратимой
Основной стадией, определяющей длину полимерной цепи в
ПОЛИМЕРИЗАЦИИ, является реакция роста цепи.
I-(M)n-M* + M I-(M)n+1-M*
Эта реакция обратима.
I-(M)n+1-M* I-(M)n-M* + M
Если
равновесие
сдвинуто
ВПРАВО,
то
преобладает
полимеризация.
Если
равновесие
сдвинуто
ВЛЕВО,
то
преобладает
деполимеризация.
Если
равновесие
установилось,
то
его
называют
полимеризационно-деполимеризационным равновесием .
полимеризация
I-(M)n-M* = Rn*
I-(M)n+1-M* = Rn+1*
R n*
+
M
Rn+1*
деполимеризация
Рассмотрим факторы, влияющие на это равновесие
7.
7Термодинамика полимеризации
G = H –T S
Процесс протекает самопроизвольно при условии G < 0
Процесс невозможен при условии G > 0
Система находится в равновесии при условии G = 0
Энтальпия полимеризации ( H)
Полимеризация по кратным связям
Происходит разрыв 1 двойной связи и
образование 2 одинарных связей.
В
Hмон. Внутренняя энергия двойной связи ( -связь)
С = С 120
выше, чем одинарной ( -связь).
А
Изменение энтальпии полимеризации, равное
разности
энтальпий
образования
двух
Hпол.
С-С А
одинарных и диссоциации одной двойной связи,
отрицательно H = Hпол. – Hмон. < 0
109
Величина
H
определяется
природой
В
заместителей при кратной связи
Полимеризация с раскрытием цикла
Изменение энтальпии определяется ТОЛЬКО напряженностью цикла:
разностью энергий цикла и линейной структуры и мало зависит от
природы заместителей в цикле
8.
8Изменение энтропии полимеризации ( S)
S = Sпост. + Sвращ. + Sколеб. + Sвн.вращ.
В общем случае
Sпол = Sполимер - Sмономер < 0
Уменьшение энтропии при полимеризации происходит главным образом
вследствие потери поступательных степеней свободы.
S МОНОМЕРОВ с КРАТНЫМИ СВЯЗЯМИ слабо зависит от химической
природы мономера.
S ЦИКЛИЧЕСКИХ МОНОМЕРОВ зависит также от напряженности цикла.
Влияние температуры на термодинамику
полимеризации
Если при полимеризации Hпол < 0; Sпол < 0
При низких Т: Hпол > T Sпол и Gпол < 0, равновесие
сдвинуто в сторону полимера;
При высоких Т: Hпол < T Sпол и Gпол > 0, равновесие
сдвинуто в сторону мономера.
Понижение температуры делает выгодной полимеризацию.
При нагревании полимеры должны деполимеризоваться.
9.
9 При температуре, называемой верхней предельной температуройполимеризации
Тпр
устанавливается
полимеризационно–
деполимеризационное равновесие: Gпол = Hпол Тпр Sпол = 0
Верхняя предельная температура полимеризации – температура, выше
которой полимеризация термодинамически запрещена
Если при полимеризации H > 0 и S > 0, с увеличением температуры G
понижается, то при температуре, называемой нижней предельной
температурой полимеризации Тпр: Gпол = Hпол Тпр Sпол = 0
Нижняя предельная температура полимеризации – температура, ниже
которой полимеризация термодинамически запрещена
Примеры мономеров и верхних предельных температур
полимеризации
-Метилстирол
Тпр = 67оС
H = –33.5 кДж/моль
Формальдегид (г)
Тпр = 119оС
H = – 69.9 кДж/моль
Метилметакрилат
Тпр = 197оС
H = – 58.2 кДж/моль
Тетрафторэтилен
Тпр = 1097оС
H = – 172 кДж/моль
Ацетон
Тпр = 209оС
H = – 12 кДж/моль
10.
Связь температуры с равновесной концентрацией мономера10
kпол
*
*
Rn + M
kдепол
Rn+1
при Т = Тпр скорости прямой и обратной
реакций равны
Допущения:
1) Степень полимеризации Pn>>1
2) Активность Rn* не зависит от Pn, тогда
Rn* и Rn+1* тождественны
1
K
[M ]
Δ


















 Химия
Химия








