Похожие презентации:
Молекулярная абсорбционная спектрометрия. Инфракрасная спектроскопия
1.
Кафедра аналитической химииМолекулярная абсорбционная
спектрометрия
2. Инфракрасная спектроскопия
К.х.н. Лифанов Ю.Г.
2.
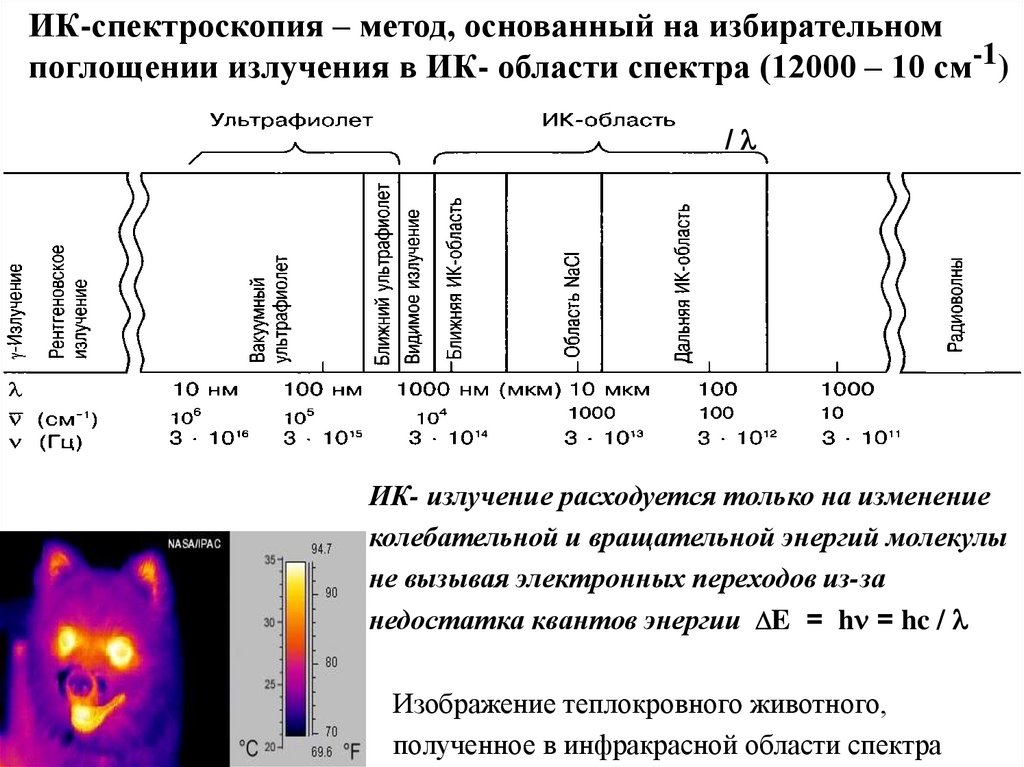
ИК-спектроскопия – метод, основанный на избирательномпоглощении излучения в ИК- области спектра (12000 – 10 см-1)
/l
ИК- излучение расходуется только на изменение
колебательной и вращательной энергий молекулы
не вызывая электронных переходов из-за
недостатка квантов энергии DE = hn = hc / l
Изображение теплокровного животного,
полученное в инфракрасной области спектра
3.
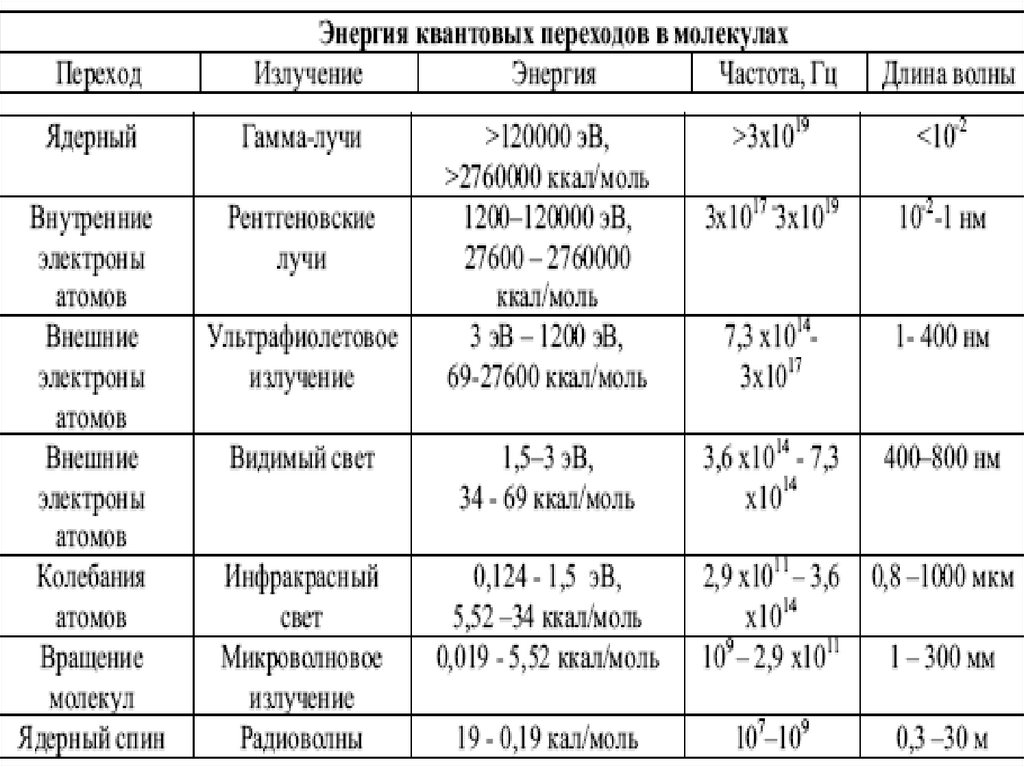
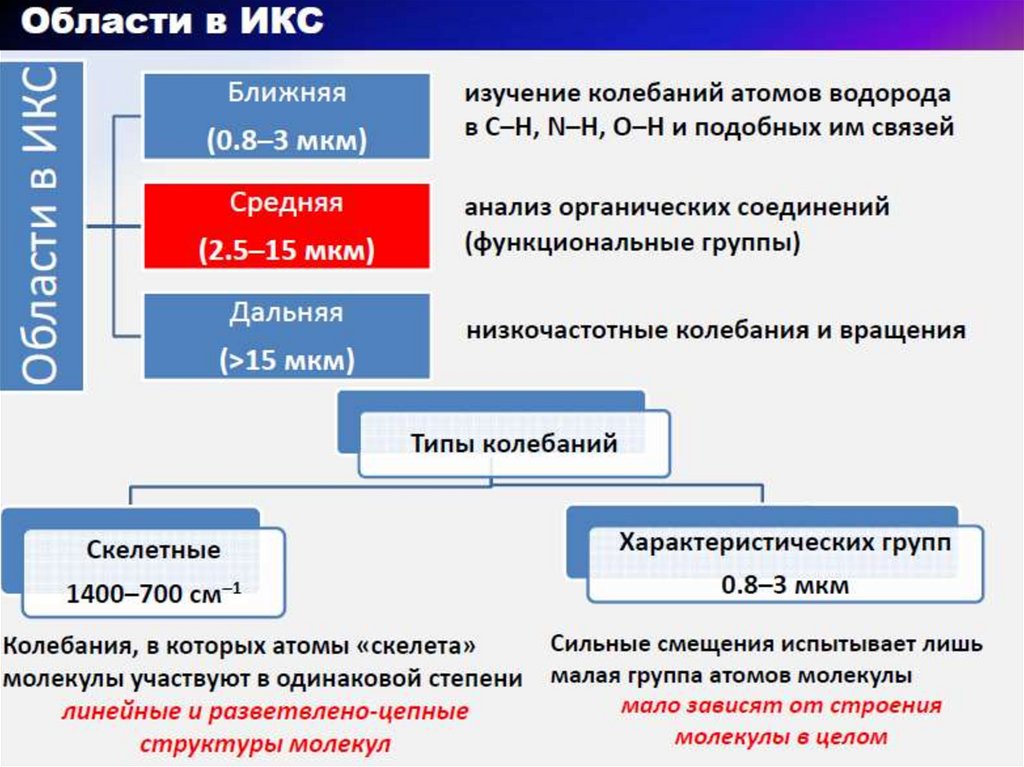
4. Области спектра электромагнитных излучений, используемые в ИК-спектрометрии
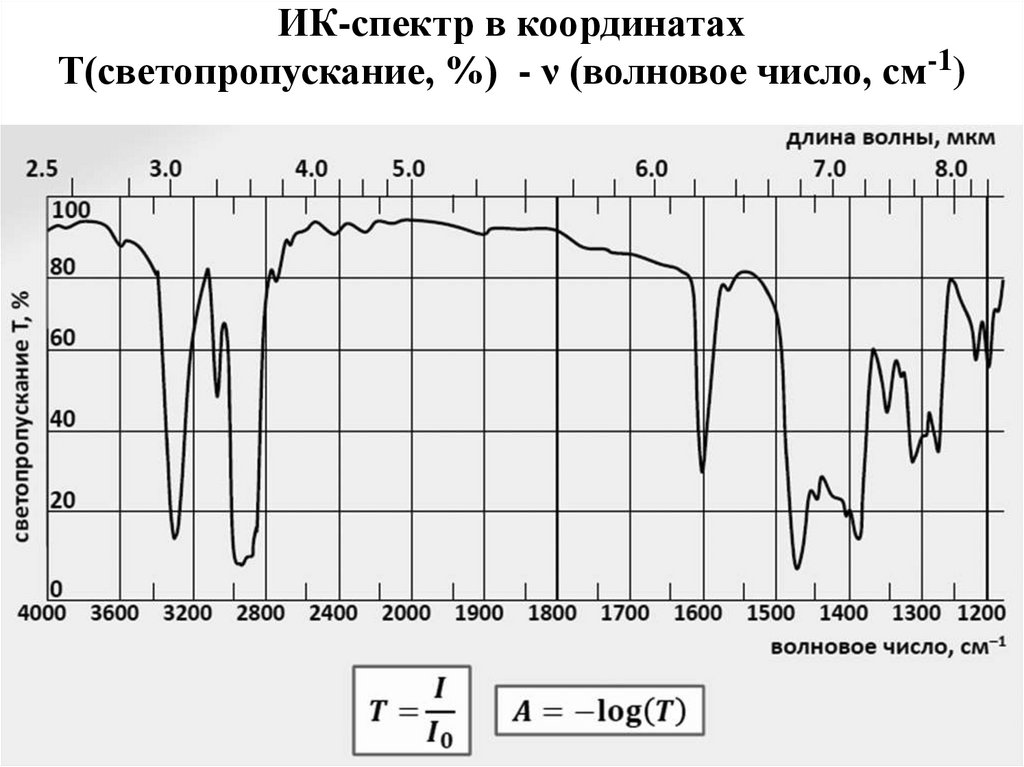
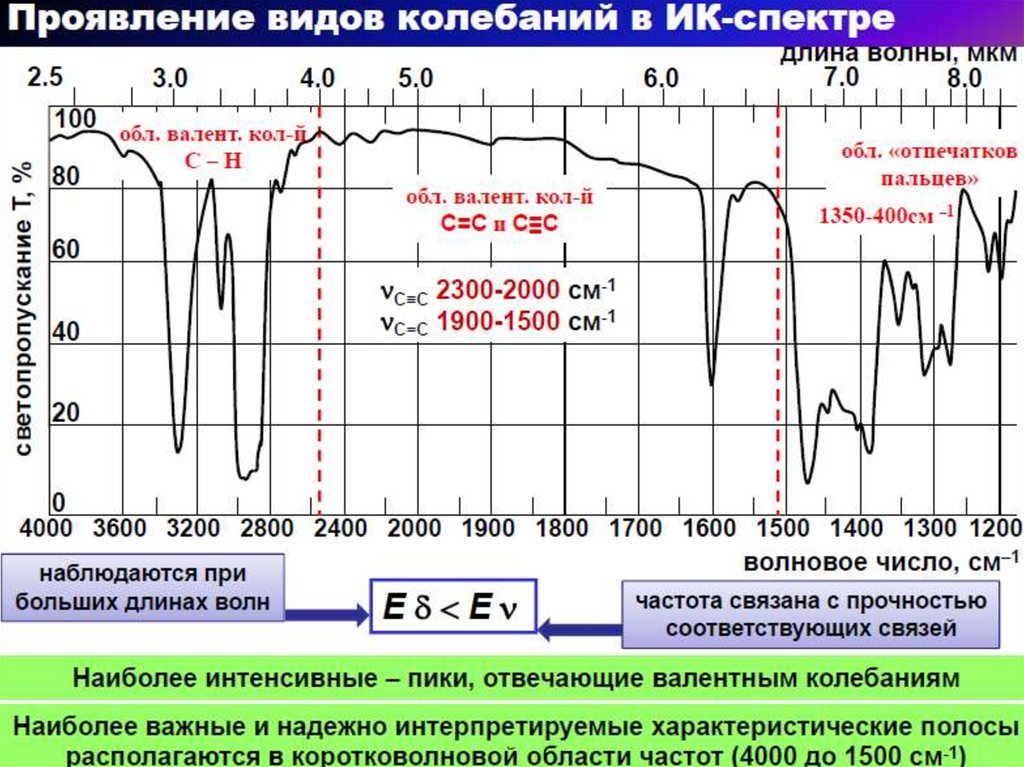
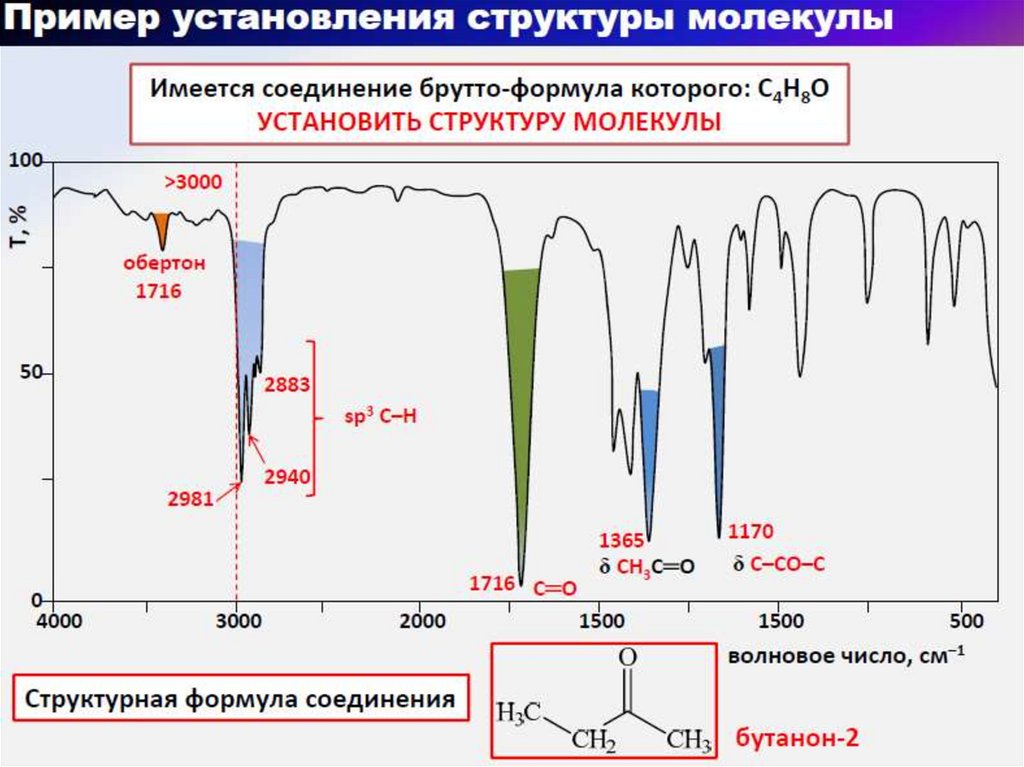
5. ИК-спектр в координатах Т(светопропускание, %) - ν (волновое число, см-1)
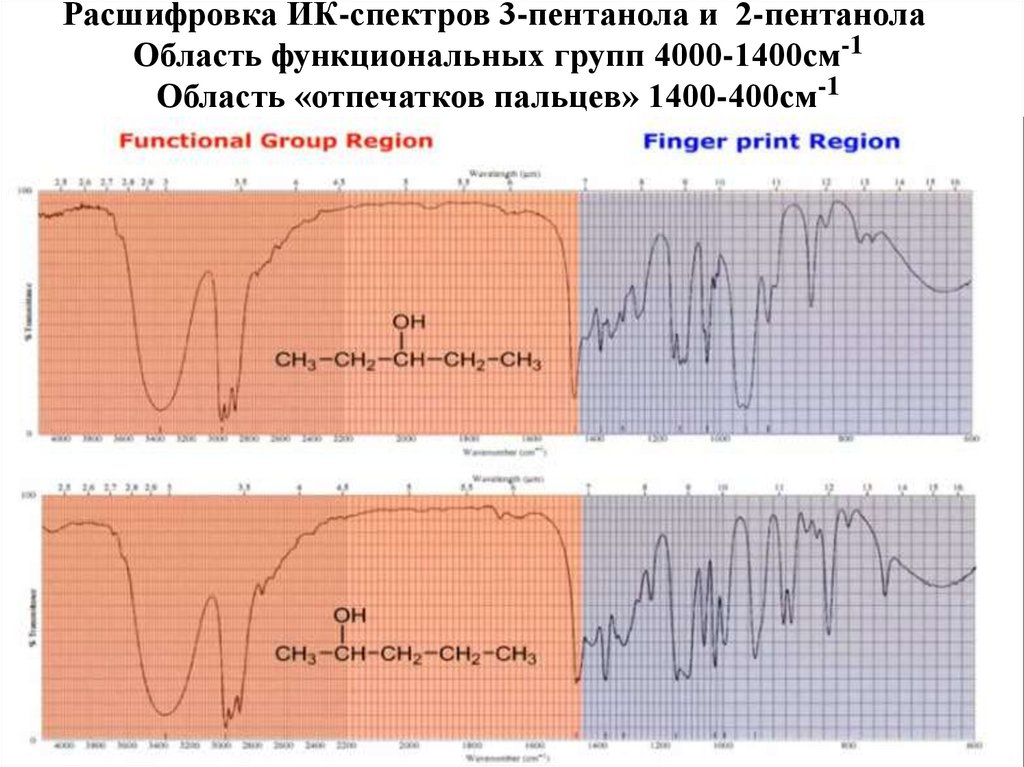
6. Расшифровка ИК-спектров 3-пентанола и 2-пентанола Область функциональных групп 4000-1400см-1 Область «отпечатков пальцев»
1400-400см-17.
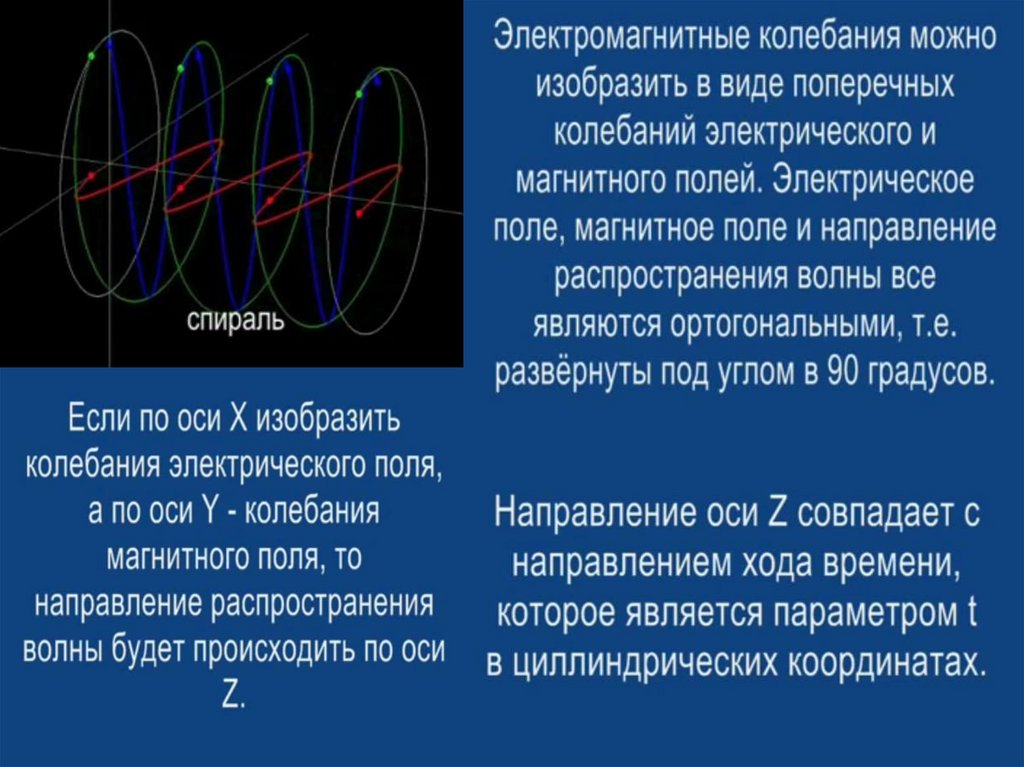
8. Взаимодействие электромагнитного излучения с веществом
В электромагнитной волне постоянно происходят изменения в ортогональнойсистеме величин электрического и магнитного полей, которые, взаимодействуя с
веществом, приводят в конечном итоге к возникновению откликов в виде спектра
Основные характеристики волны электромагнитного излучения
длина l
частота n
волновое
амплитуда
-1
число, см
где с –скорость света = 3*108 м/с
Энергия фотона (кванта излучения) связана
с частотой (длиной волны) электромагнитного
излучения соотношением
DE = hn = hc / l
Представление гармонического колебательного
движения в виде синусоидальной волны,
описываемой функцией y = Asinθ
В практической ИК-спектроскопии
- основное уравнение волнового движения
, где (ν) - частота волны
9.
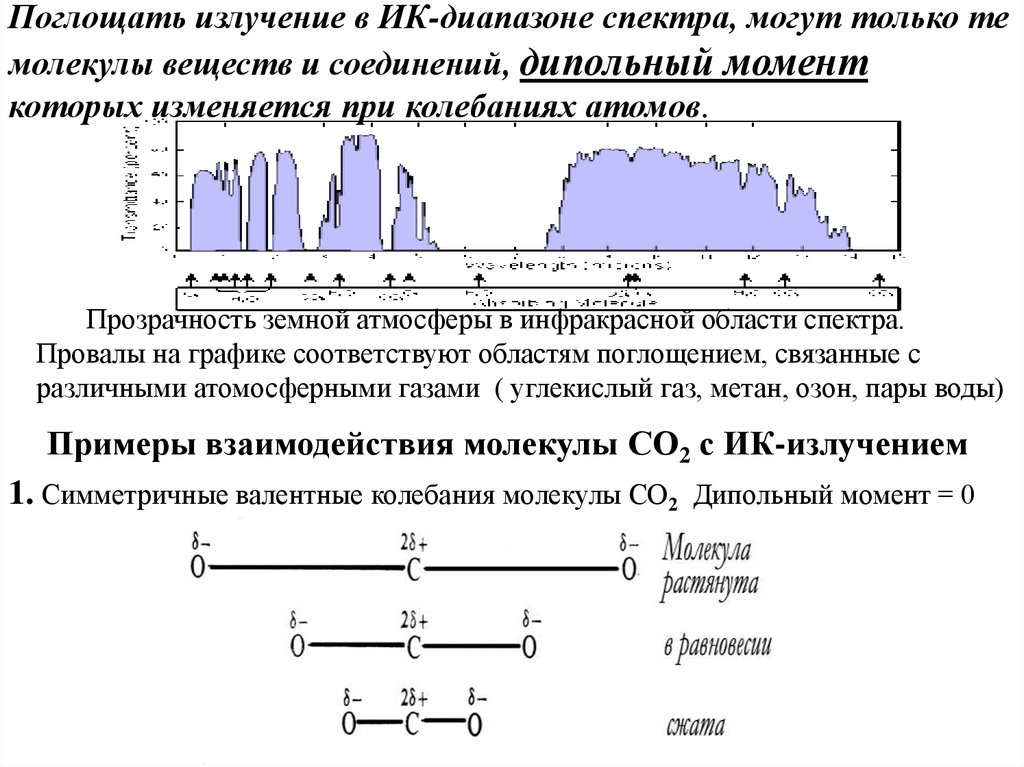
Поглощать излучение в ИК-диапазоне спектра, могут только темолекулы веществ и соединений, дипольный момент
которых изменяется при колебаниях атомов.
Прозрачность земной атмосферы в инфракрасной области спектра.
Провалы на графике соответствуют областям поглощением, связанные с
различными атомосферными газами ( углекислый газ, метан, озон, пары воды)
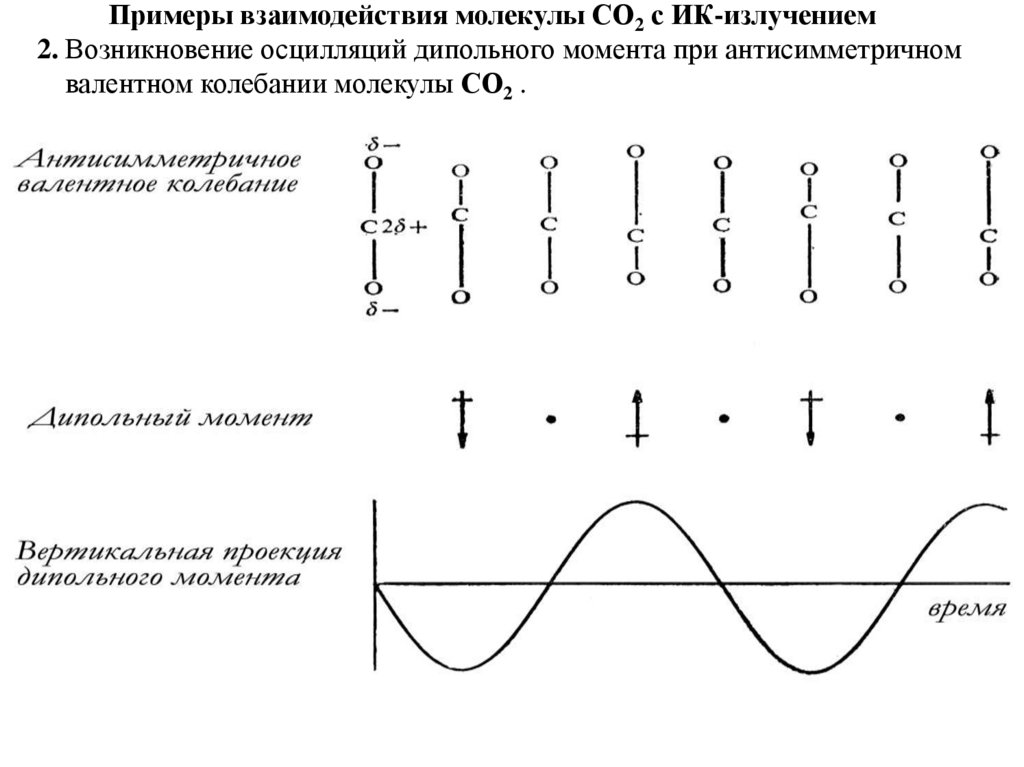
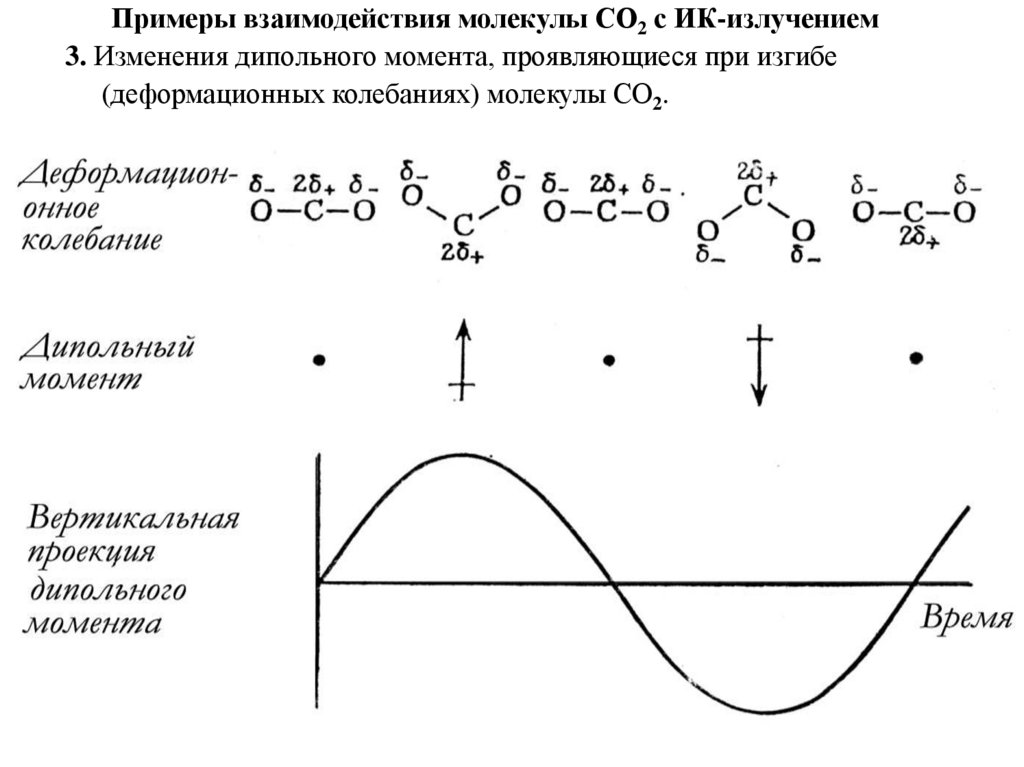
Примеры взаимодействия молекулы СО2 с ИК-излучением
1. Симметричные валентные колебания молекулы СО2 Дипольный момент = 0
10.
Примеры взаимодействия молекулы СО2 с ИК-излучением2. Возникновение осцилляций дипольного момента при антисимметричном
валентном колебании молекулы СО2 .
11.
Примеры взаимодействия молекулы СО2 с ИК-излучением3. Изменения дипольного момента, проявляющиеся при изгибе
(деформационных колебаниях) молекулы СО2.
12.
13.
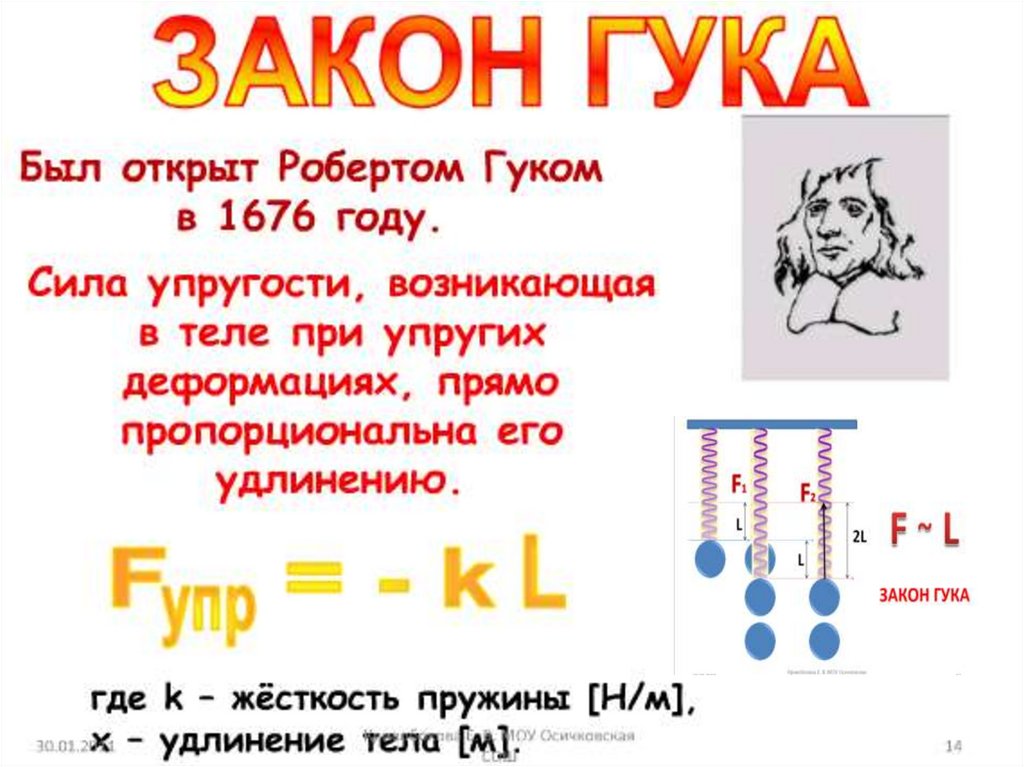
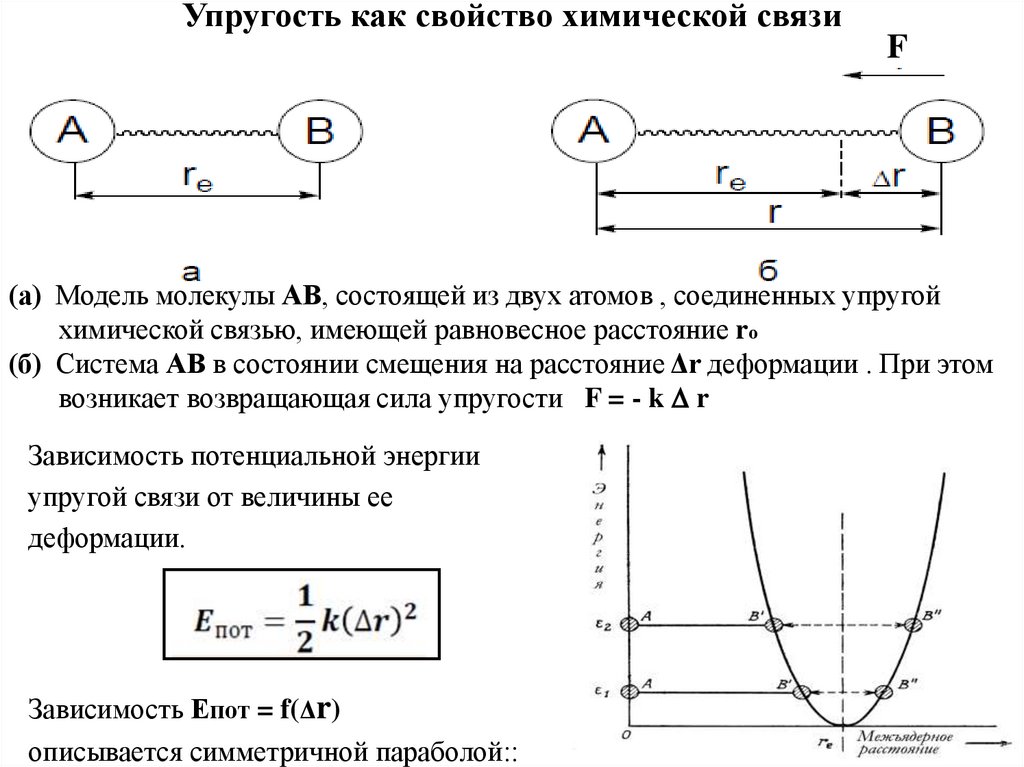
14. Упругость как свойство химической связи
F(а) Модель молекулы АВ, состоящей из двух атомов , соединенных упругой
химической связью, имеющей равновесное расстояние rо
(б) Система АВ в состоянии смещения на расстояние Δr деформации . При этом
возникает возвращающая сила упругости F = - k D r
Зависимость потенциальной энергии
упругой связи от величины ее
деформации.
Зависимость Епот = f(Δr)
описывается симметричной параболой::
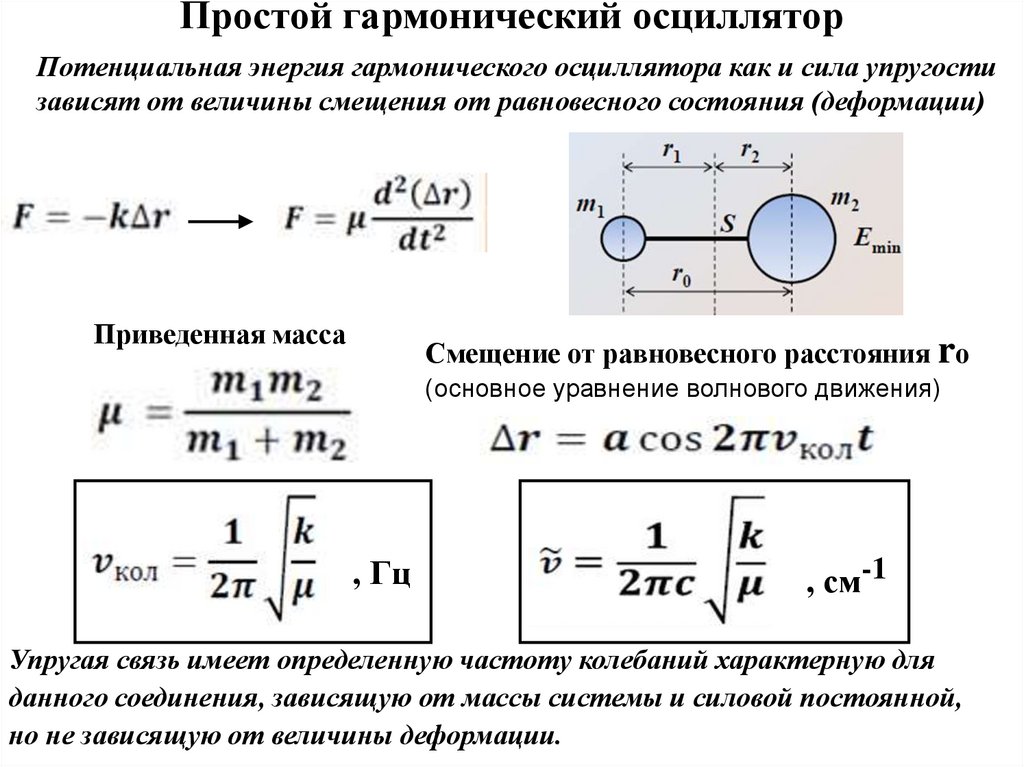
15. Простой гармонический осциллятор
Потенциальная энергия гармонического осциллятора как и сила упругостизависят от величины смещения от равновесного состояния (деформации)
Приведенная масса
Смещение от равновесного расстояния rо
(основное уравнение волнового движения)
, Гц
, см-1
Упругая связь имеет определенную частоту колебаний характерную для
данного соединения, зависящую от массы системы и силовой постоянной,
но не зависящую от величины деформации.
16.
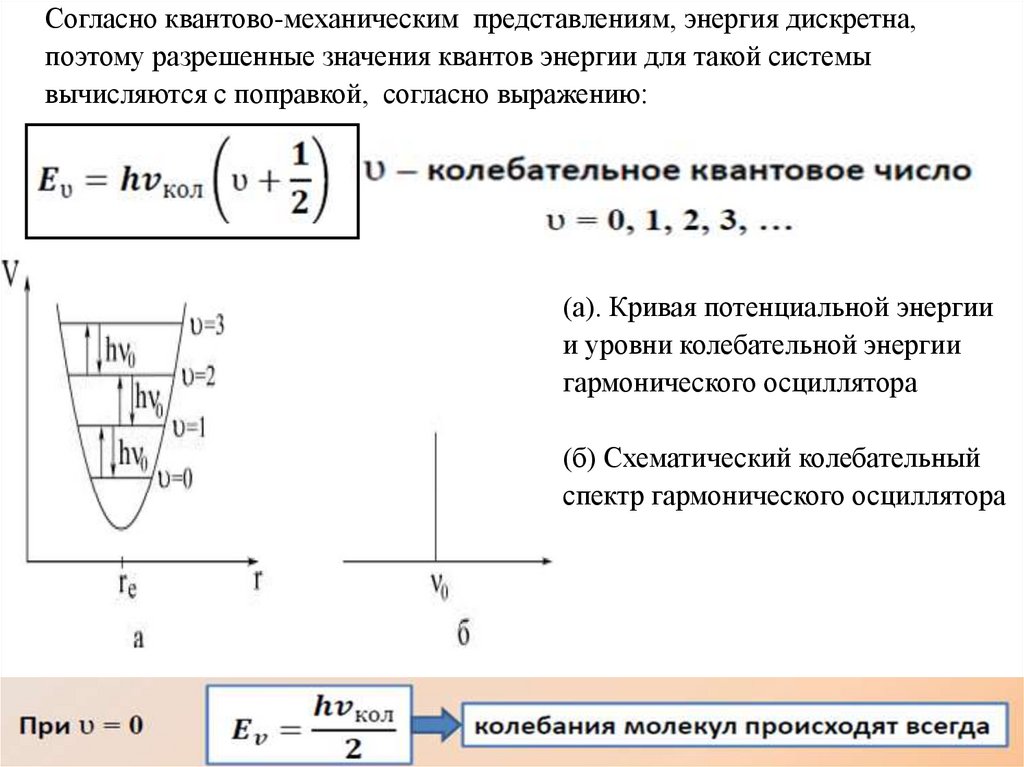
Согласно квантово-механическим представлениям, энергия дискретна,поэтому разрешенные значения квантов энергии для такой системы
вычисляются с поправкой, согласно выражению:
(а). Кривая потенциальной энергии
и уровни колебательной энергии
гармонического осциллятора
(б) Схематический колебательный
спектр гармонического осциллятора
17.
- Наличие нулевой энергии является отражением основного различия междуквантово-механическим и классическим описаниями молекулярных колебаний
- Изменения колебательной энергии только тогда будут порождать наблюдаемый
спектр, когда колебание может взаимодействовать с излучением, изменяя
дипольныхй момент молекулы.
- В случае двухатомных молекул, колебательные спектры могут наблюдаться
только для гетероядерных молекул, например HCl..
- Гомоядерные молекулы (О2 , N2)) не имеют дипольного момента,
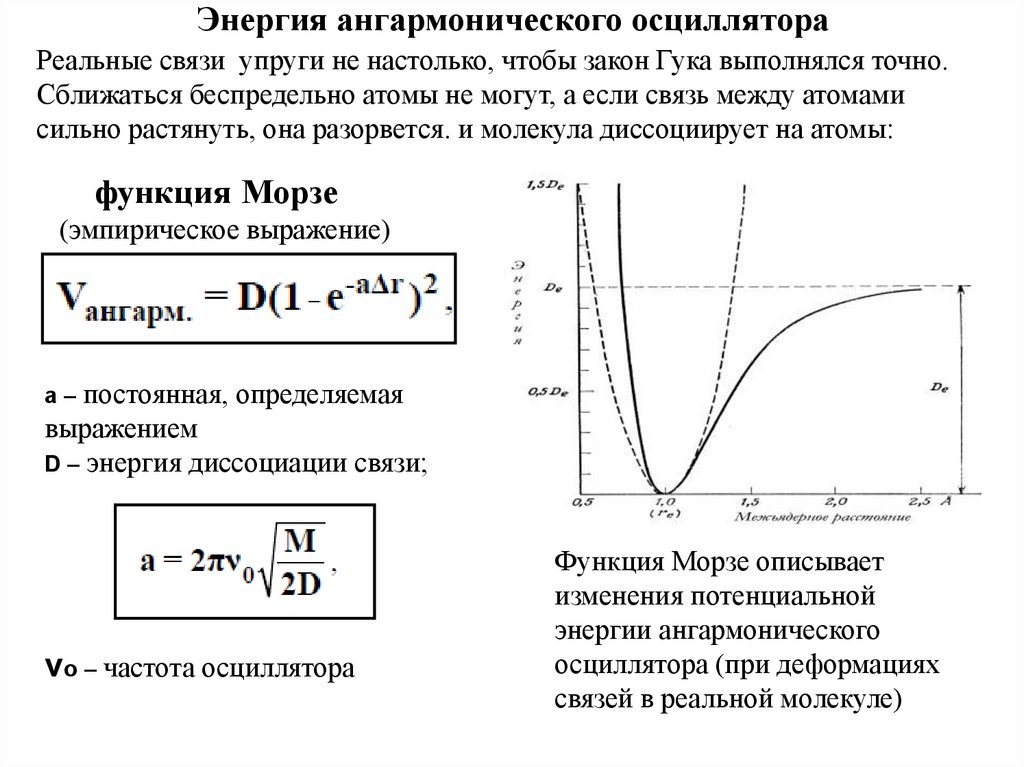
18. Энергия ангармонического осциллятора
Реальные связи упруги не настолько, чтобы закон Гука выполнялся точно.Сближаться беспредельно атомы не могут, а если связь между атомами
сильно растянуть, она разорвется. и молекула диссоциирует на атомы:
функция Морзе
(эмпирическое выражение)
a – постоянная, определяемая
выражением
D – энергия диссоциации связи;
νо – частота осциллятора
Функция Морзе описывает
изменения потенциальной
энергии ангармонического
осциллятора (при деформациях
связей в реальной молекуле)
19.
Как и в случае гармонического осциллятора, колебательная энергияангармонического осциллятора квантуется согласно выражению
h – постоянная Планка; υ = 0, 1, 2, 3,…– колебательное квантовое число;
νо – частота осциллятора;
(а). Кривая потенциальной энергии
и уровни колебательной энергии
ангармонического осциллятора
(б).Схематический колебательный
спектр ангармонического осциллятора
- по мере увеличения квантового числа υ колебательные уровни
постепенно сближаются, сливаясь на уровне E = D
- правило отбора для перехода между колебательными
уровнями ангармонического осциллятора
1
2
20.
21.
22.
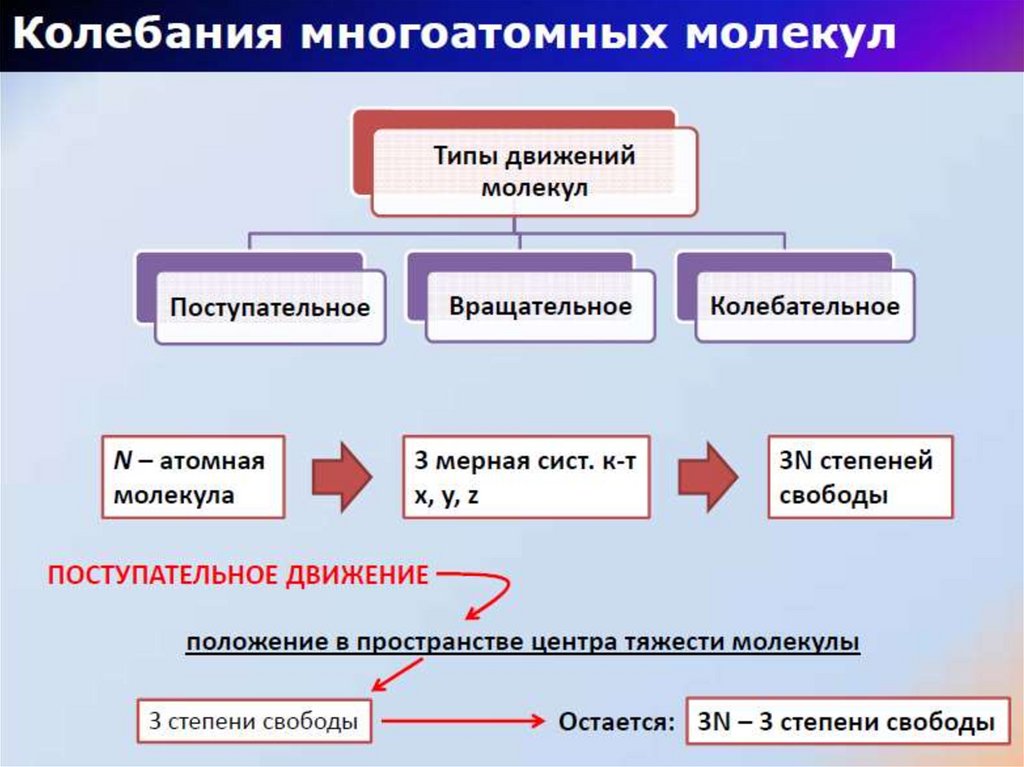
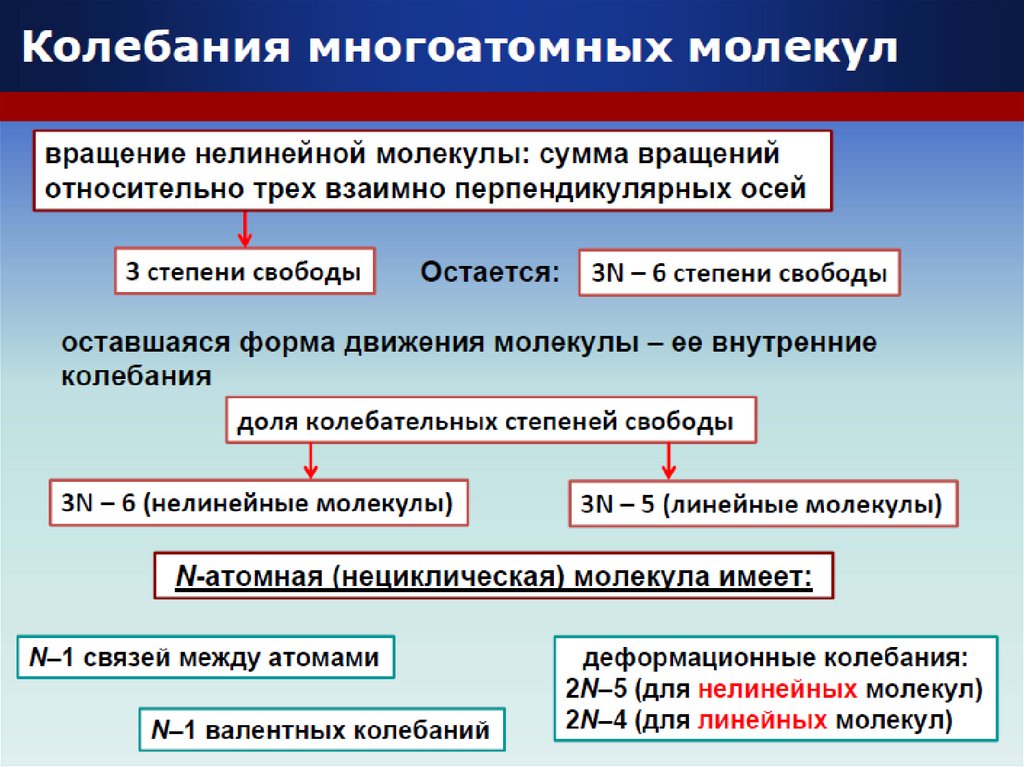
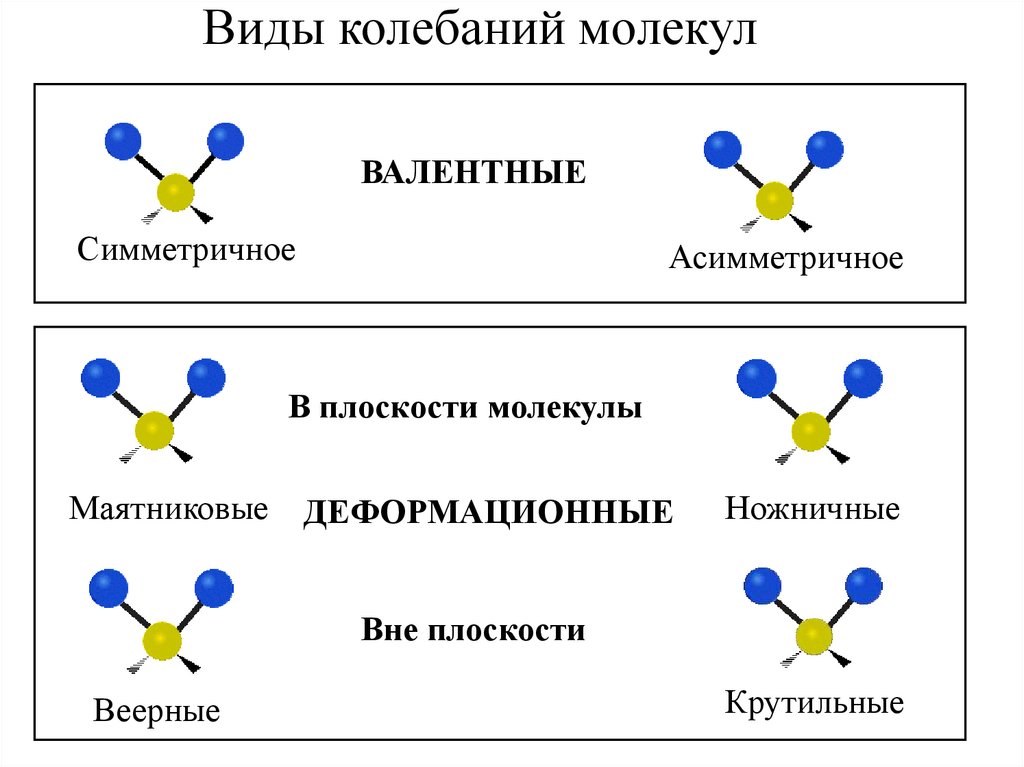
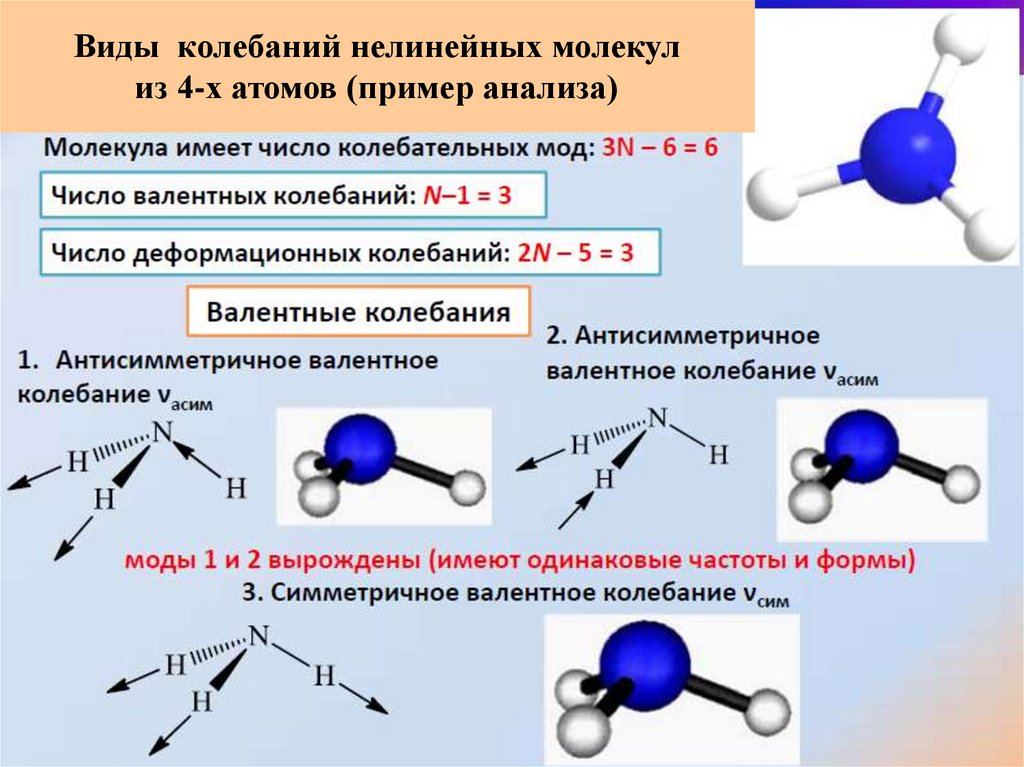
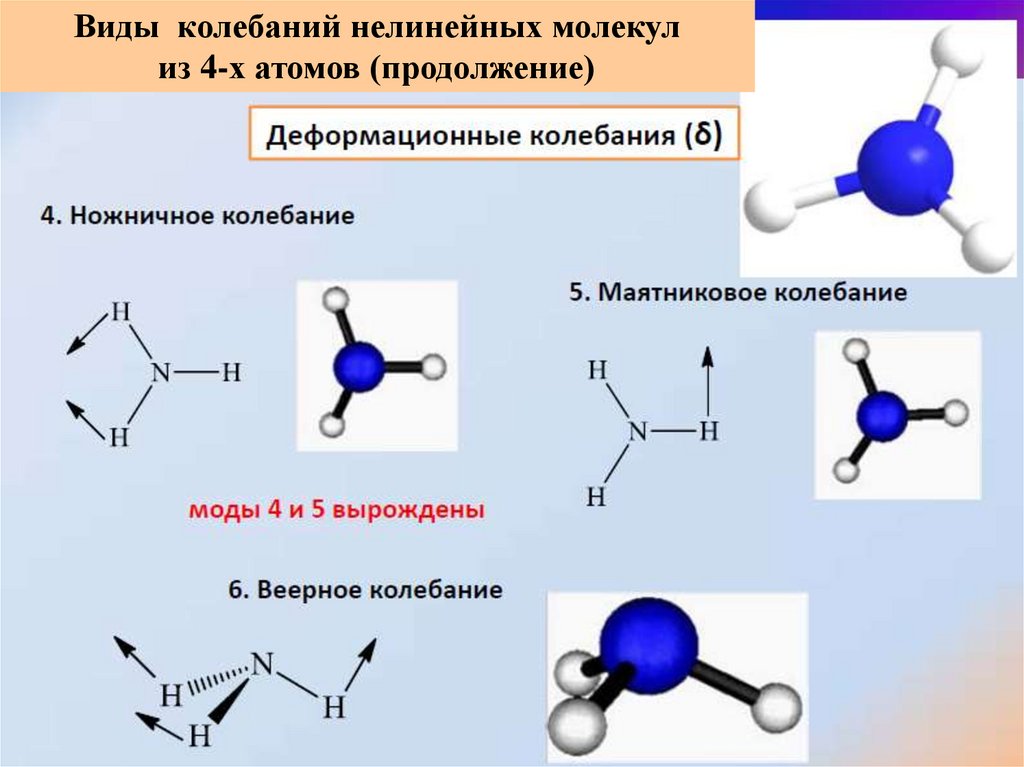
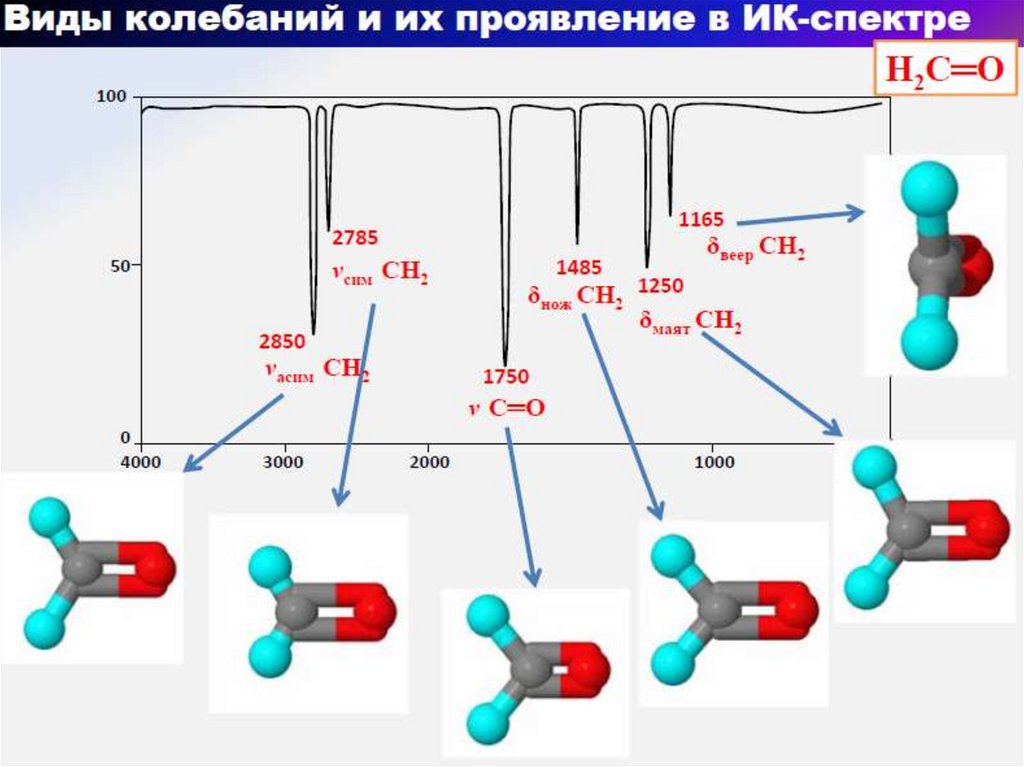
23. Виды колебаний молекул
ВАЛЕНТНЫЕСимметричное
Асимметричное
В плоскости молекулы
Маятниковые
ДЕФОРМАЦИОННЫЕ
Ножничные
Вне плоскости
Веерные
Крутильные
24.
Виды колебаний нелинейных молекулиз 4-х атомов (пример анализа)
25.
Виды колебаний нелинейных молекулиз 4-х атомов (продолжение)
26.
27.
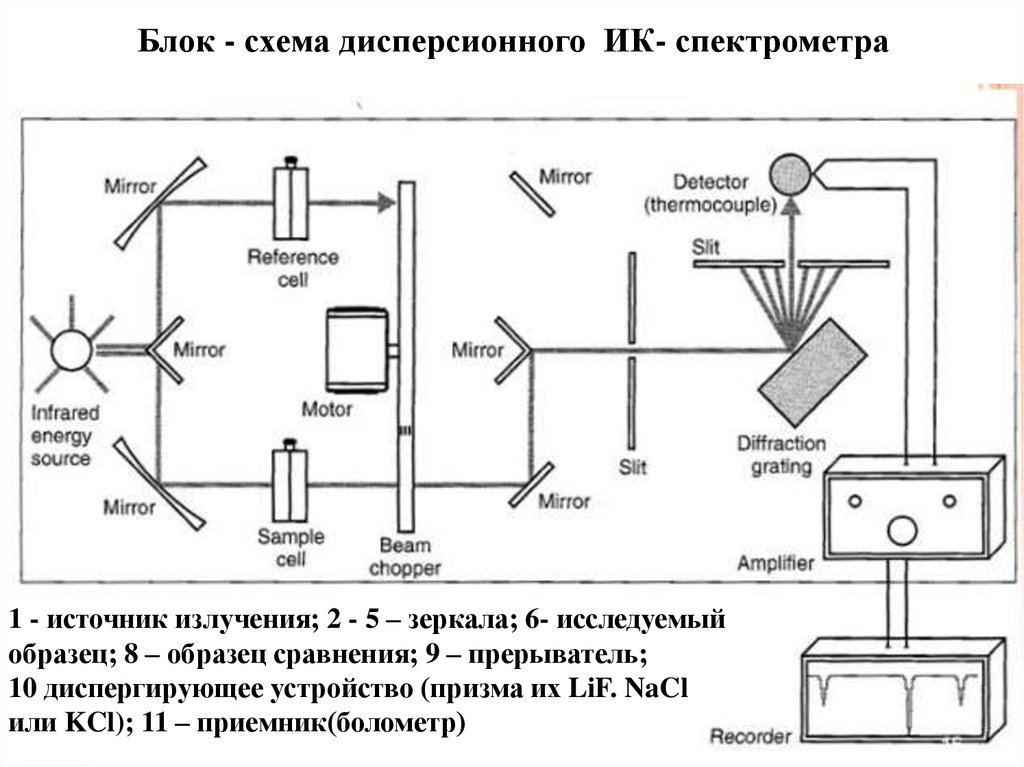
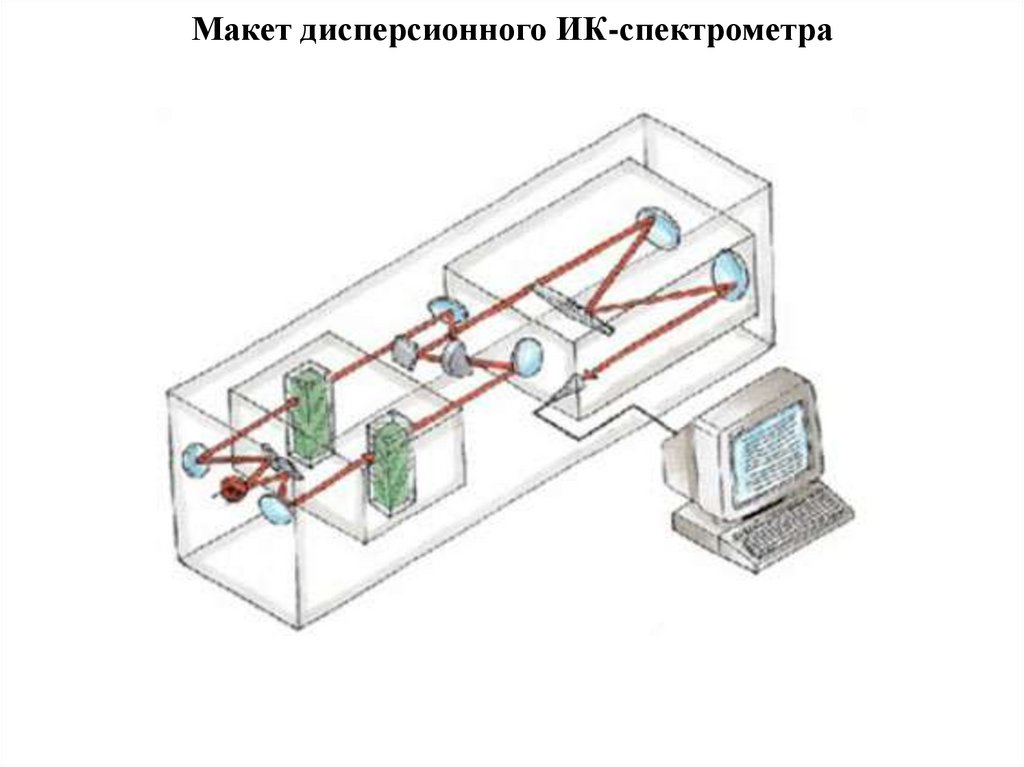
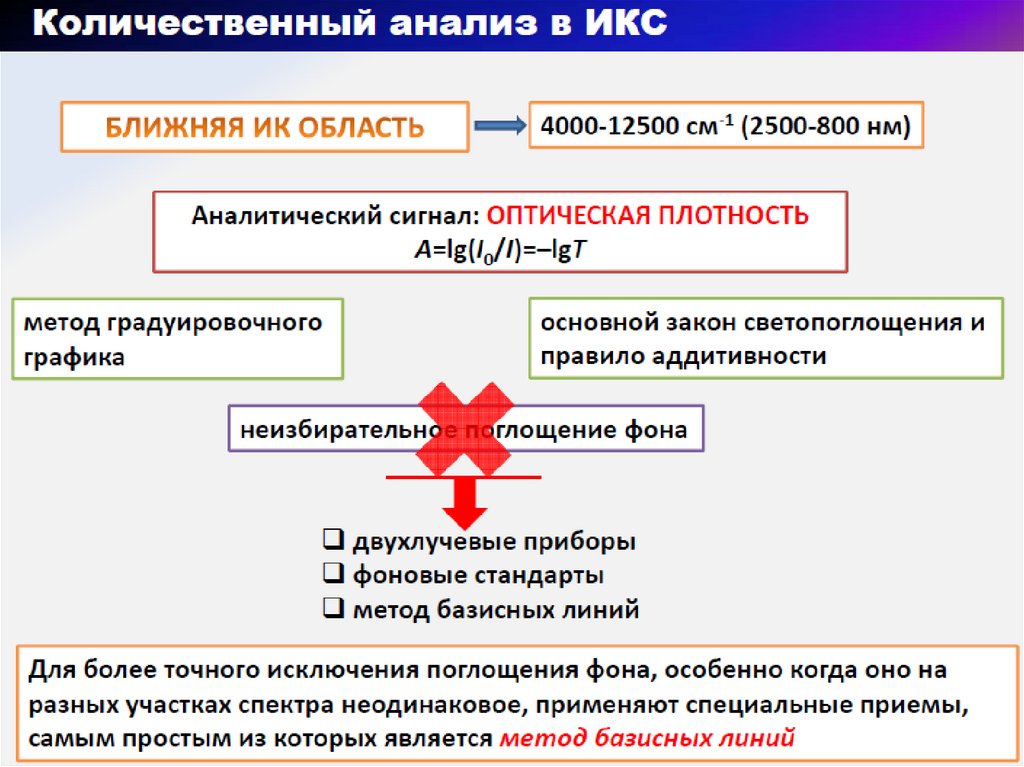
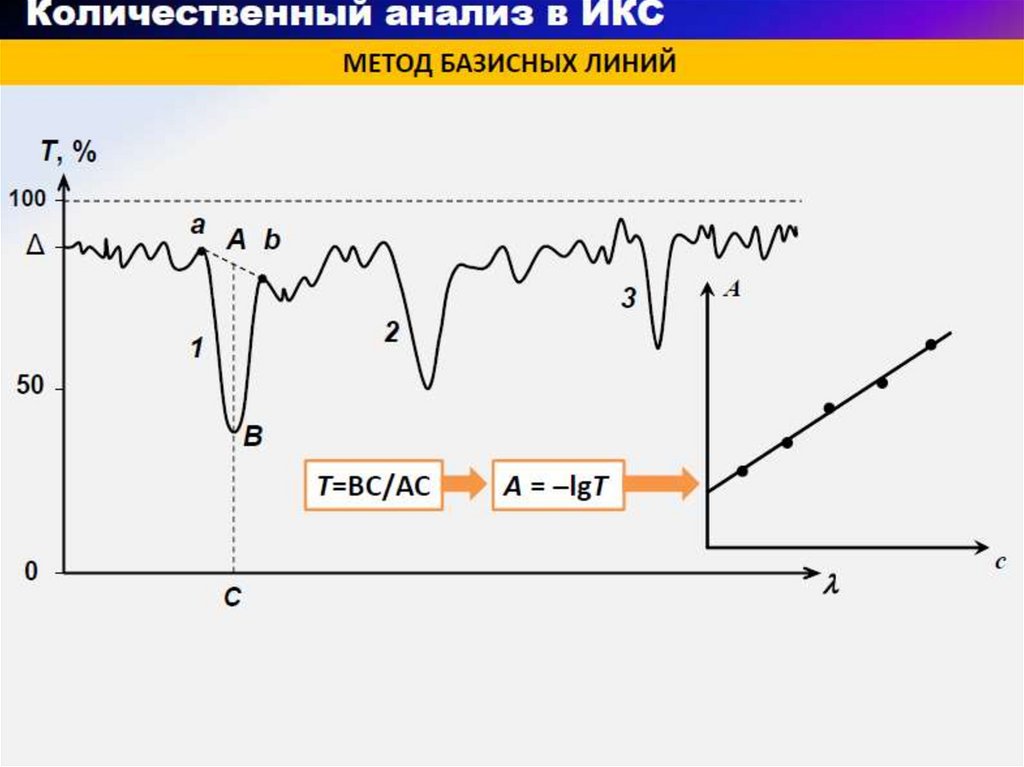
28. Блок - схема дисперсионного ИК- спектрометра
1 - источник излучения; 2 - 5 – зеркала; 6- исследуемыйобразец; 8 – образец сравнения; 9 – прерыватель;
10 диспергирующее устройство (призма их LiF. NaCl
или KCl); 11 – приемник(болометр)
29. Макет дисперсионного ИК-спектрометра
30. Оптическая схема фурье-спектрометра:
1 - неподвижное зеркало интерферометра Майкельсона;2 – подвижное зеркало; 3 – светоделительная пластина;
4 - источник излучения; 5 - образец; 6 - детектор излучения.
31.
Типы источников ИК-излучения32.
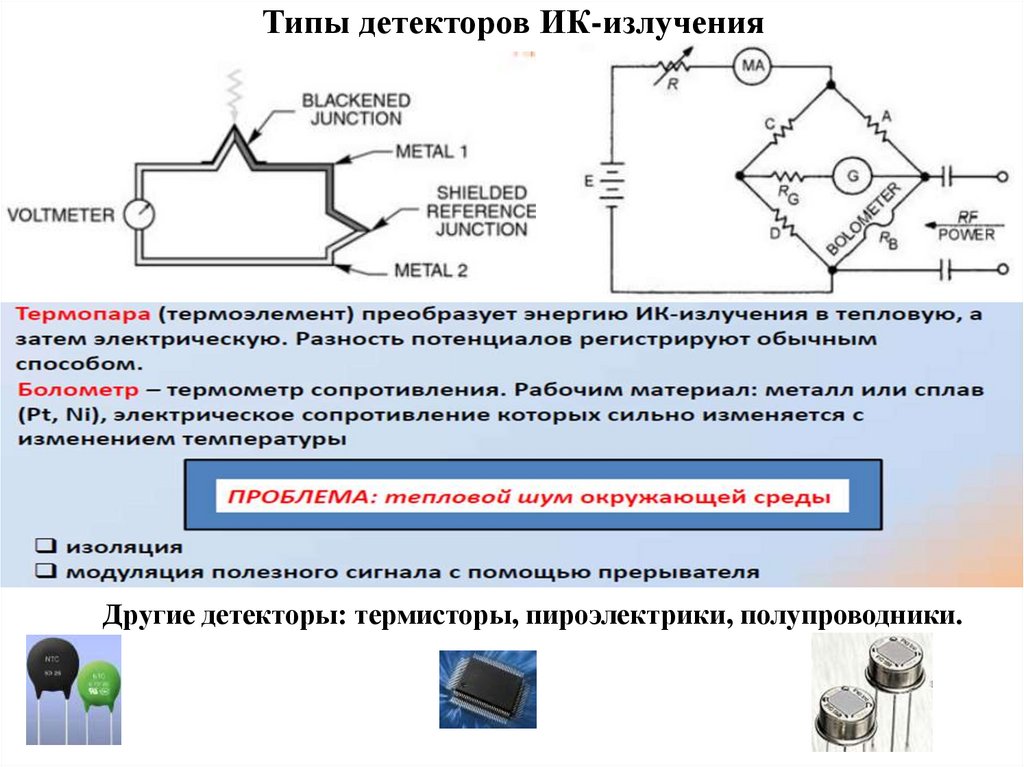
Типы детекторов ИК-излученияДругие детекторы: термисторы, пироэлектрики, полупроводники.
33.
34.
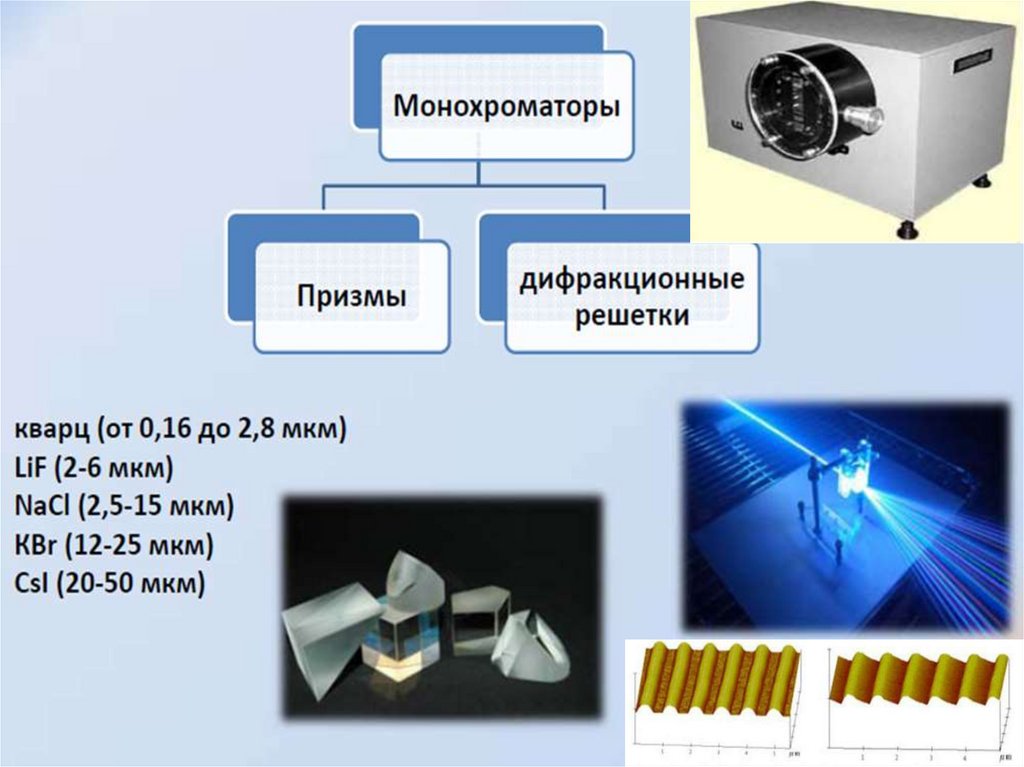
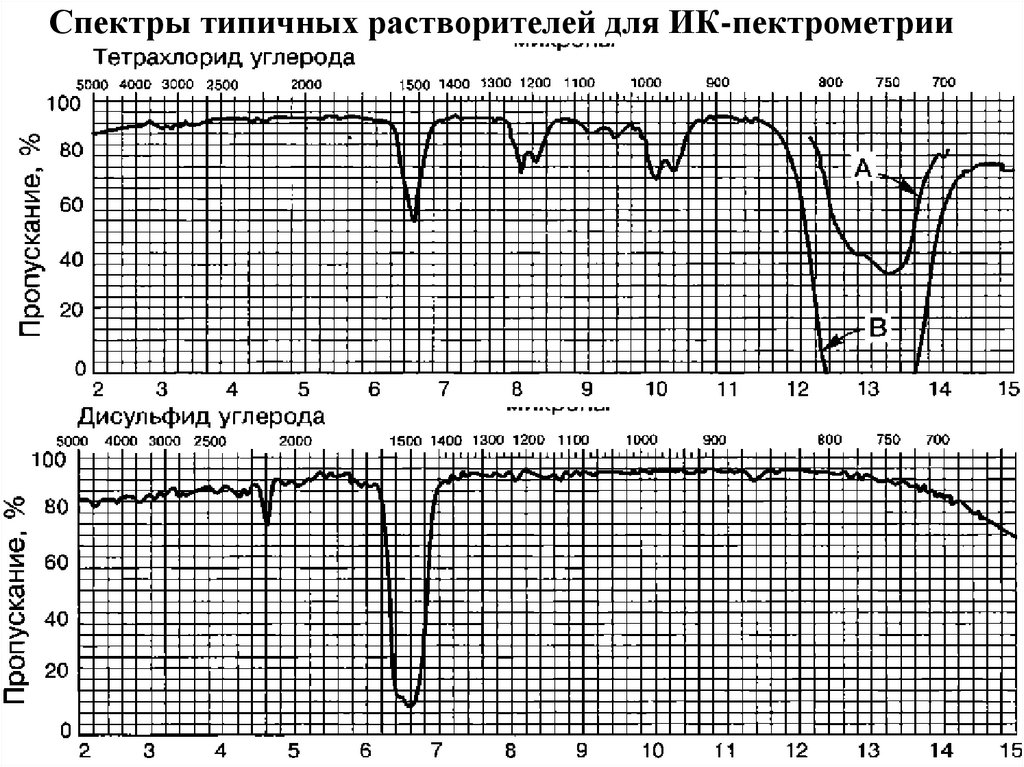
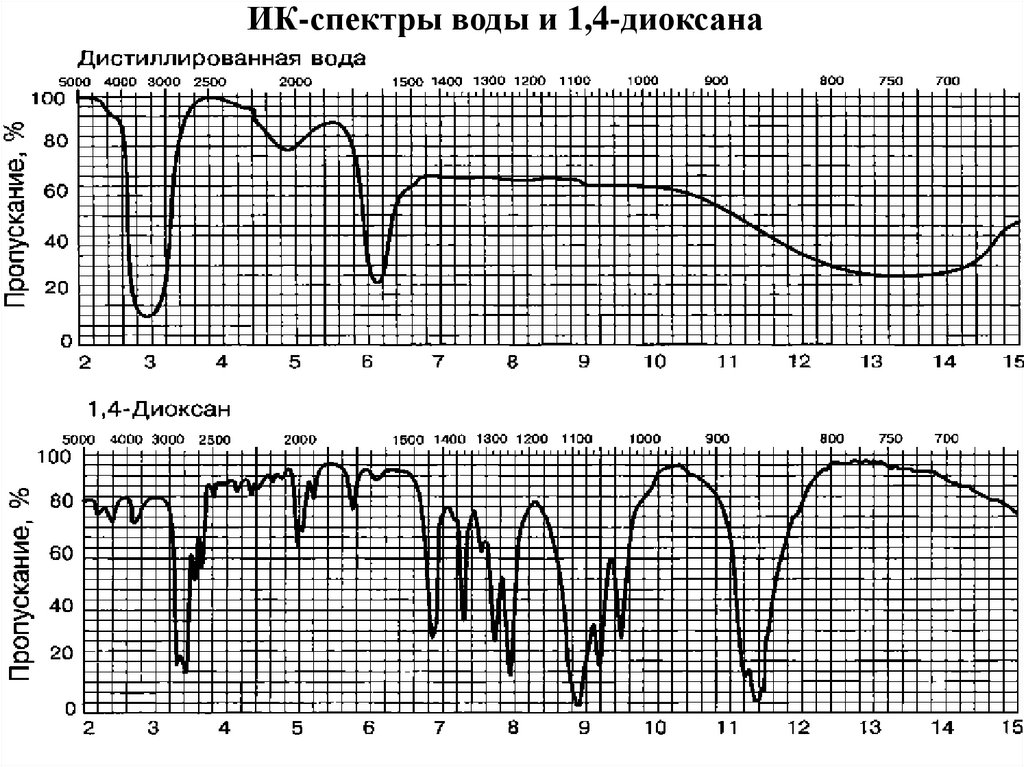
35. Области прозрачности растворителей в ИК-диапазоне
36. Спектры типичных растворителей для ИК-пектрометрии
37. ИК-спектры воды и 1,4-диоксана
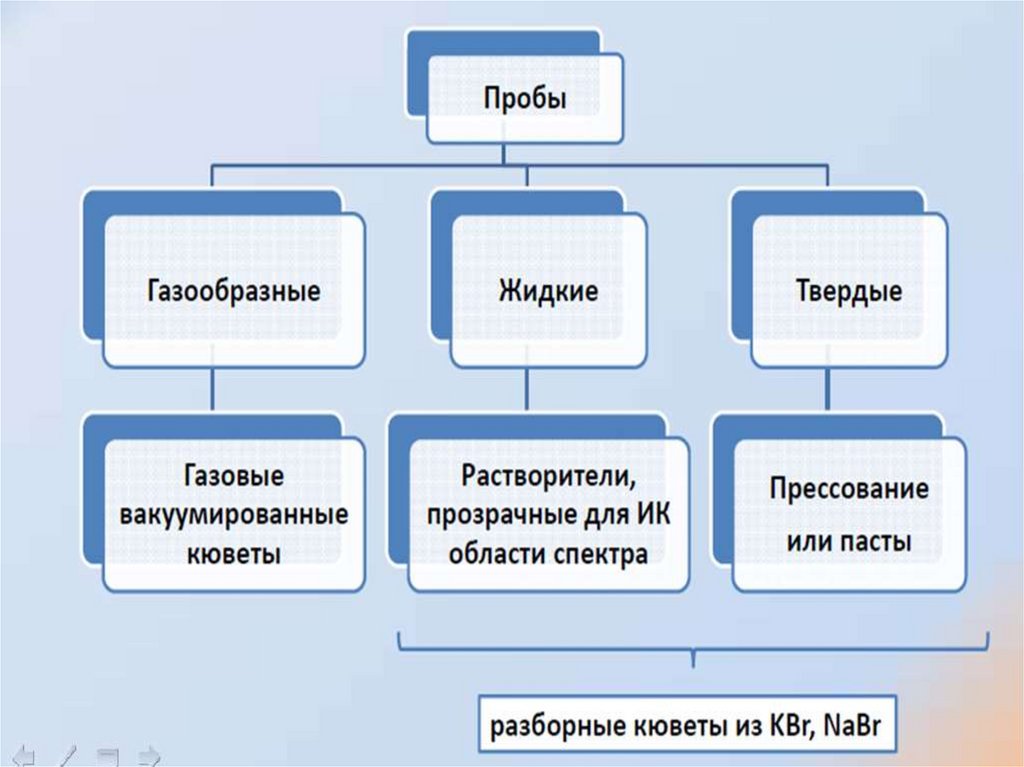
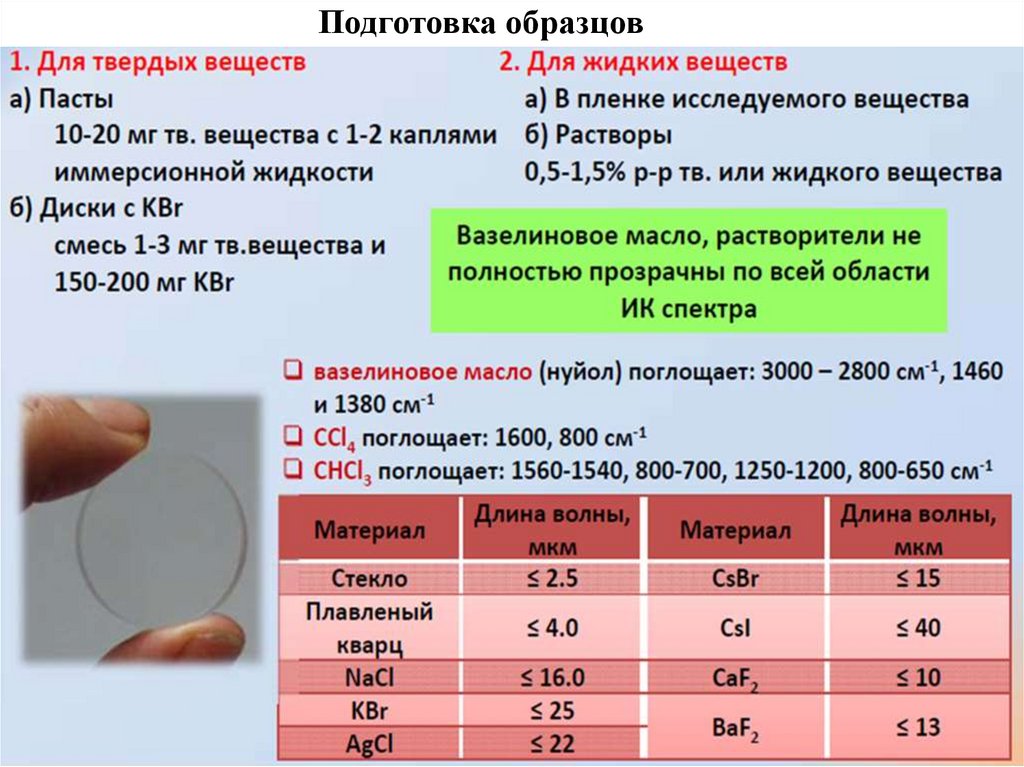
38. Подготовка образцов
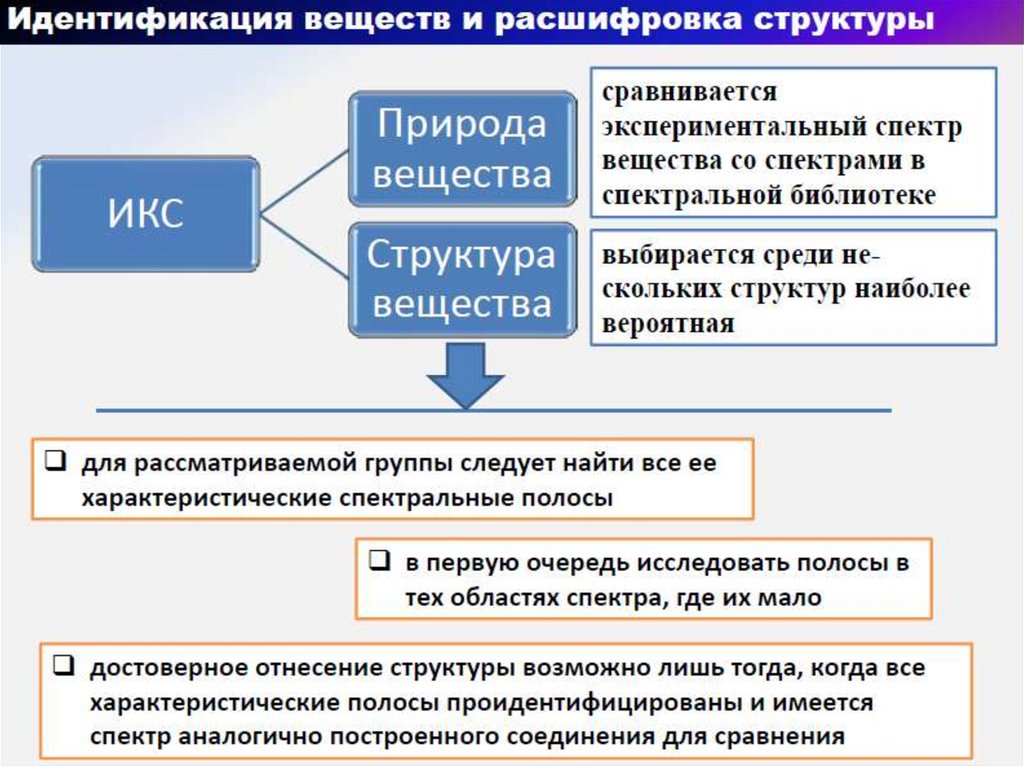
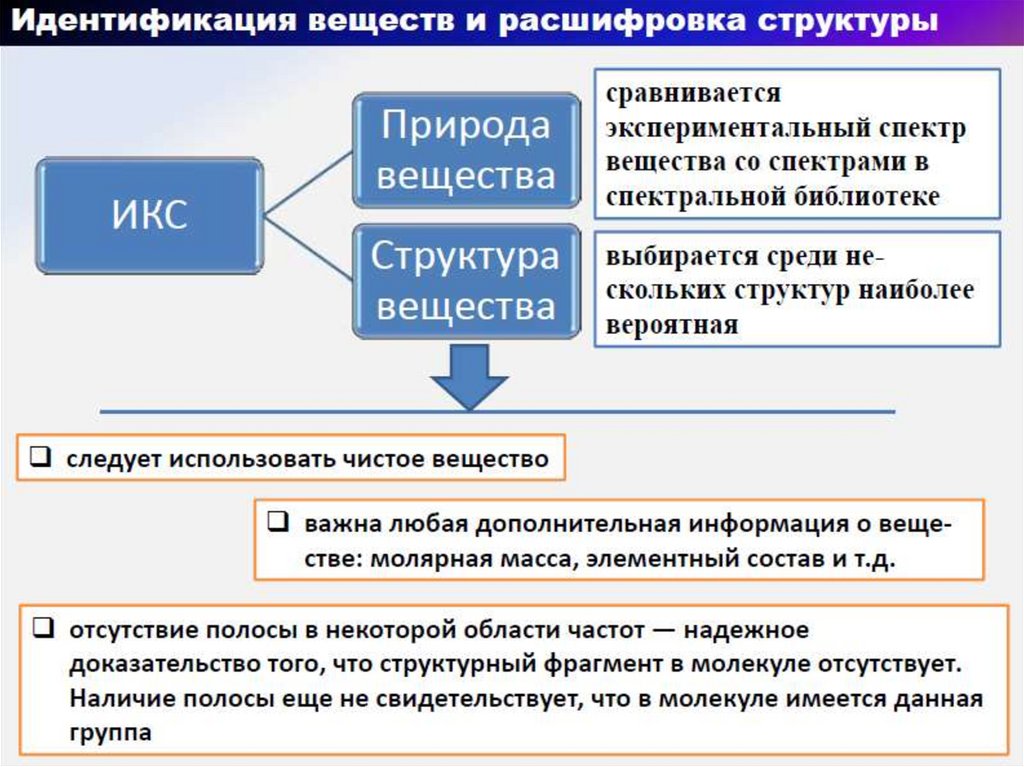
39.
40.
41.
42.
43.
44.
45.
46.
47.
48.
49.
50.
51.
52.
53.
54.
55.
56.
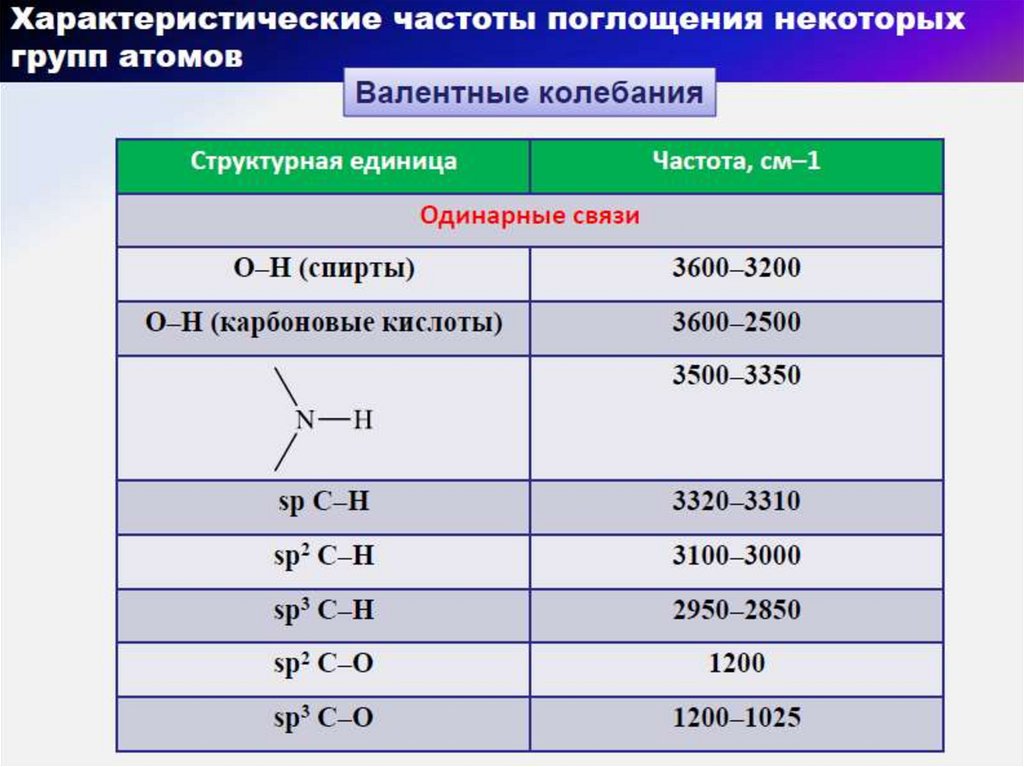
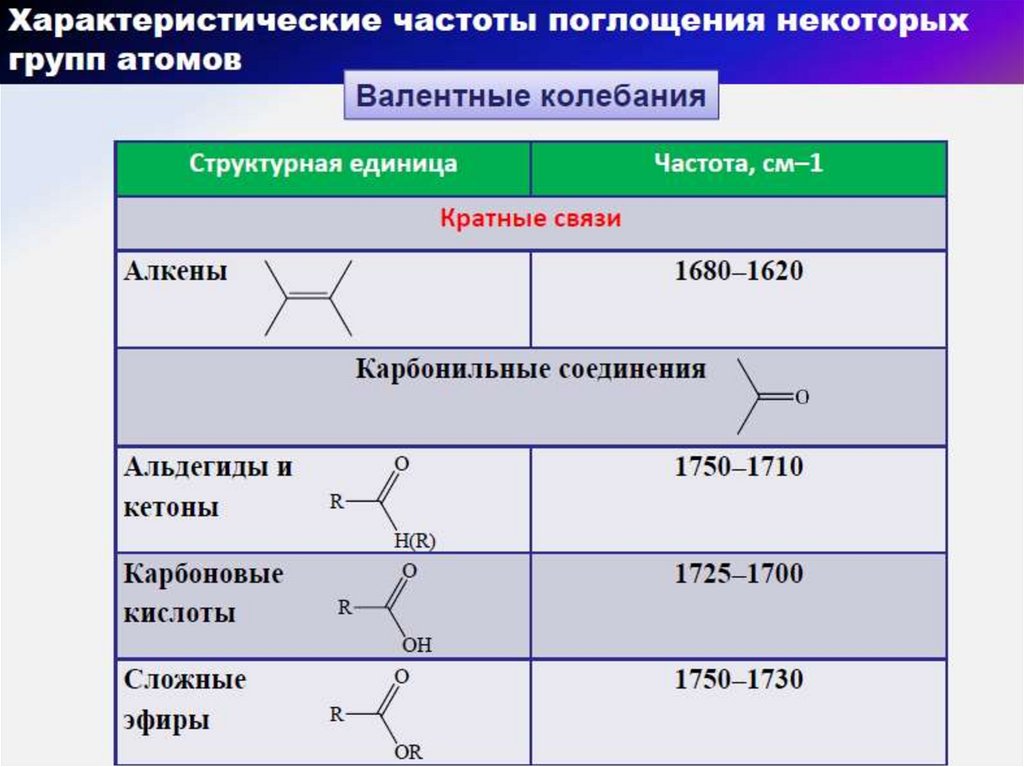
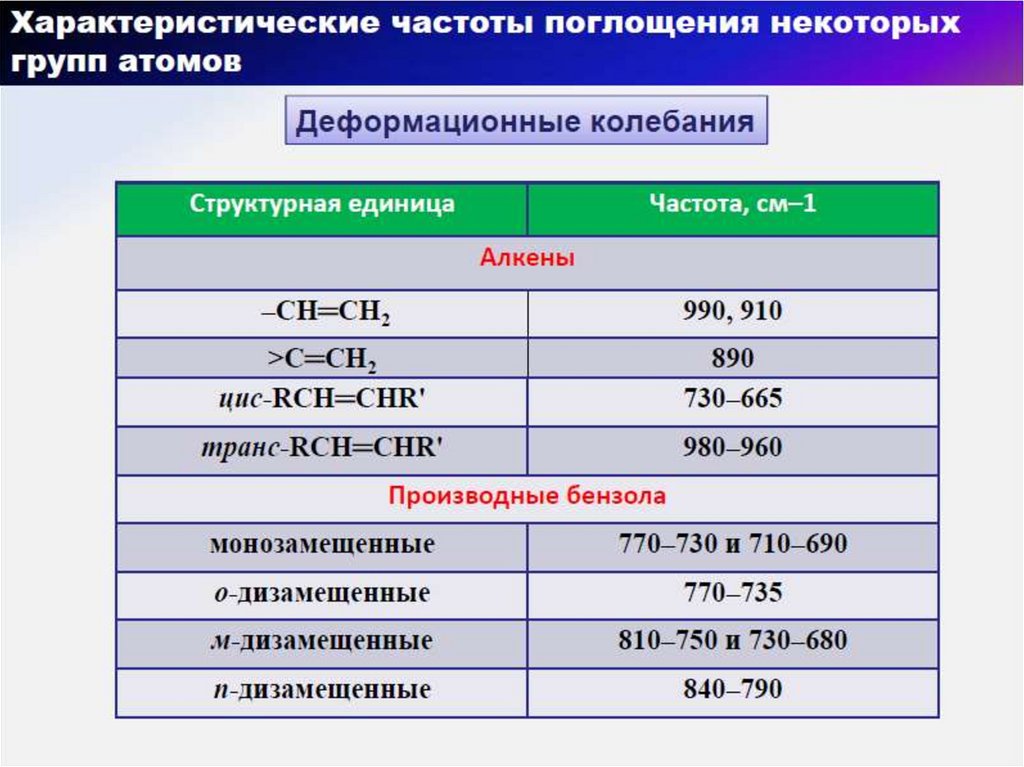
57. Области характеристических групповых колебаний в ИК-диапазоне
58. Алканы
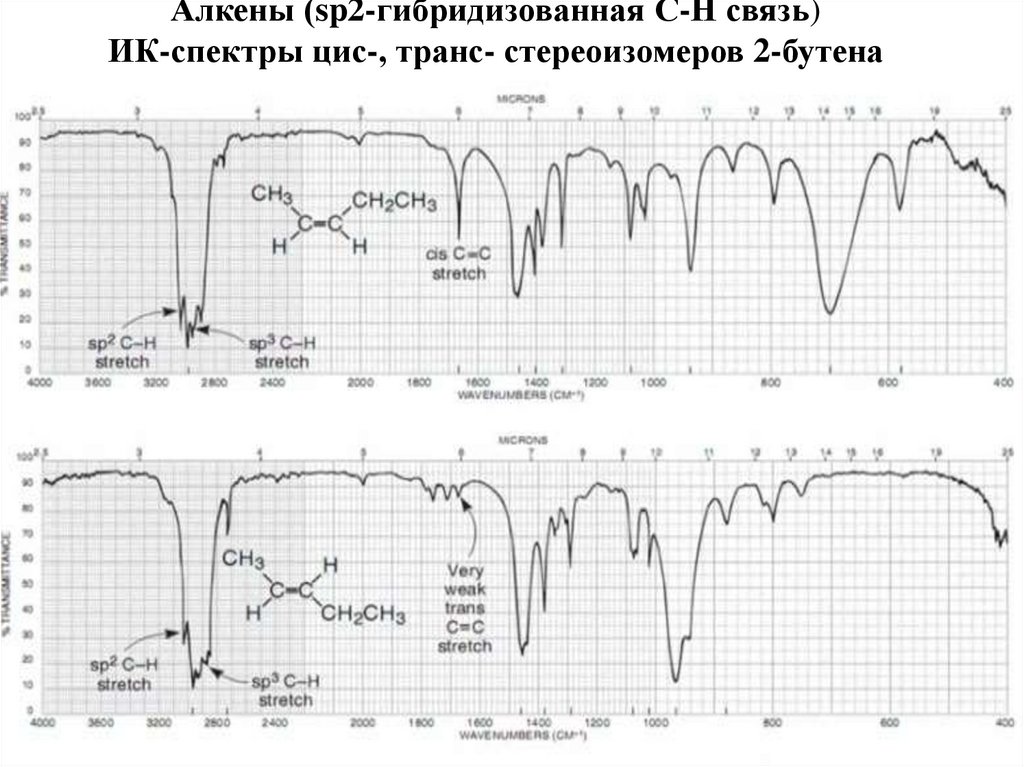
АлкеныАлкины
Симметричные алкены и алкины дают или очень слабый сигналили совсем
не поглощают ИК-излучения
59. Области деформационных колебаний = С - Н связи в спектрах стереоизомерах алкенов
60. Алкены (sp2-гибридизованная С-Н связь) ИК-спектры цис-, транс- стереоизомеров 2-бутена
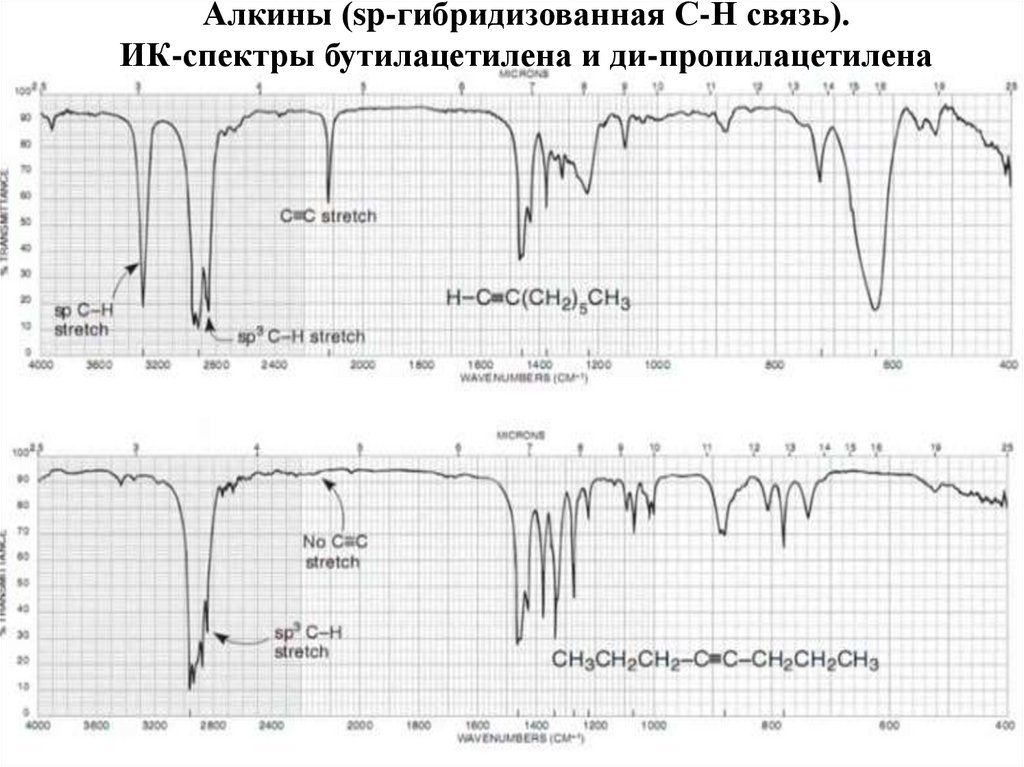
61. Алкины (sp-гибридизованная С-Н связь). ИК-спектры бутилацетилена и ди-пропилацетилена
62. Кислородсодержащие углеводороды
Спирты и фенолыАльдегиды и кетоны
Карбоксикислоты
Эфиры
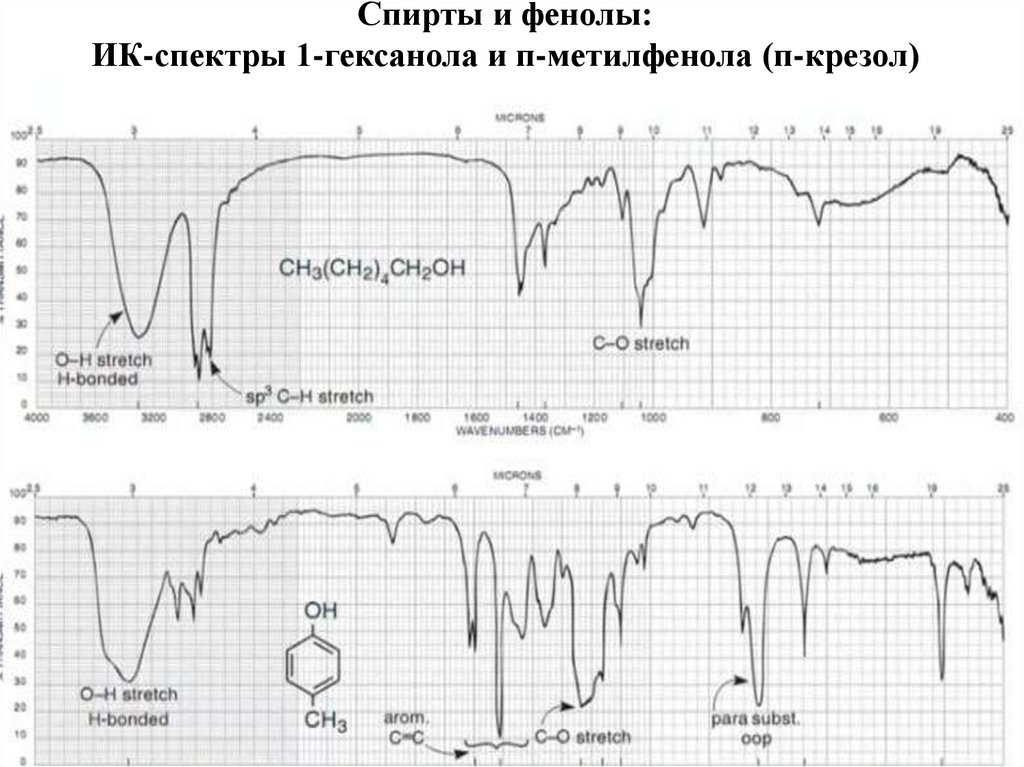
63. Спирты и фенолы: ИК-спектры 1-гексанола и п-метилфенола (п-крезол)
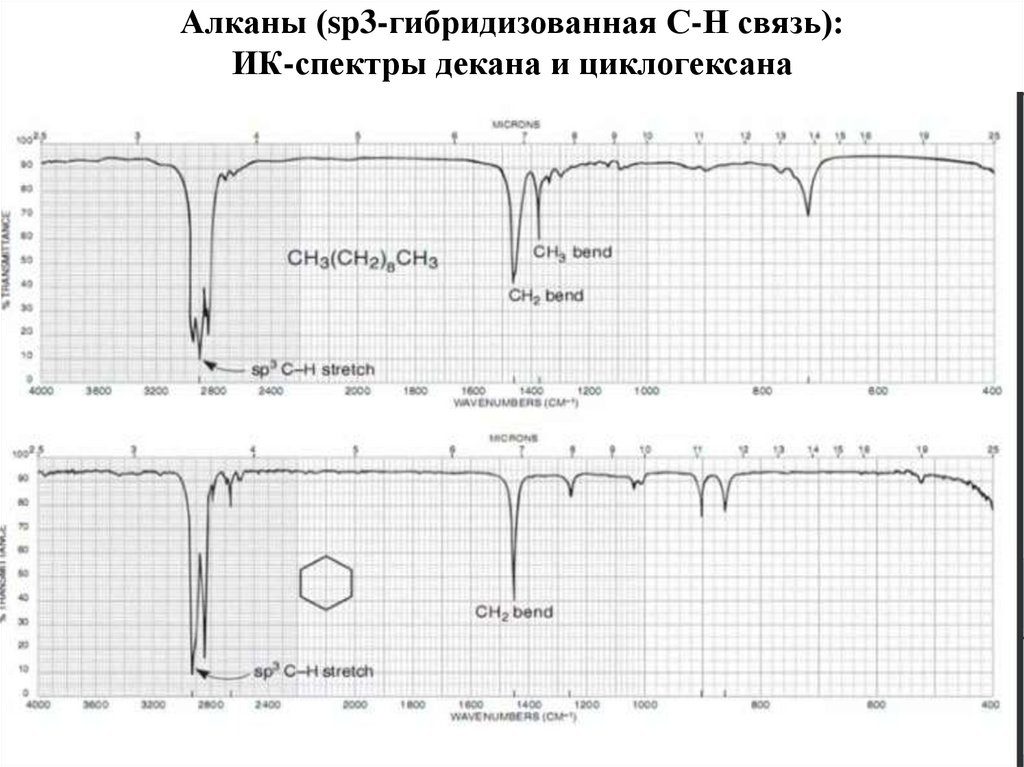
64. Алканы (sp3-гибридизованная С-Н связь): ИК-спектры декана и циклогексана
65. Альдегиды и кетоны. ИК-спектры ноналя и метилфенилкетона ( ацетофенон )
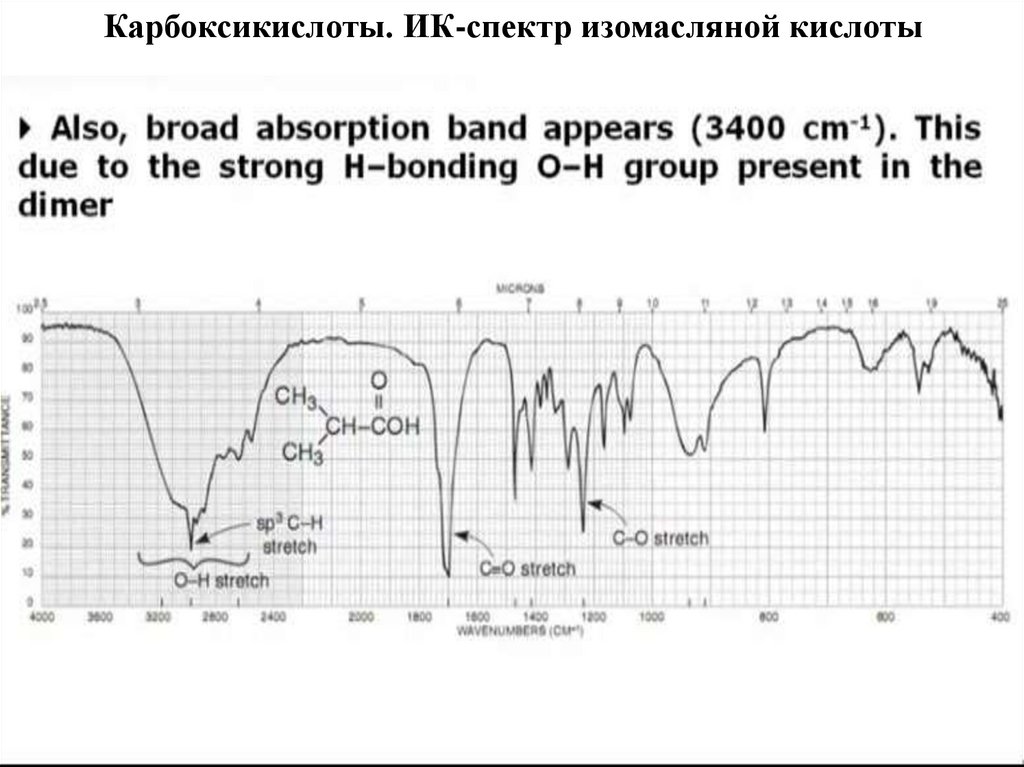
66. Карбоксикислоты. ИК-спектр изомасляной кислоты
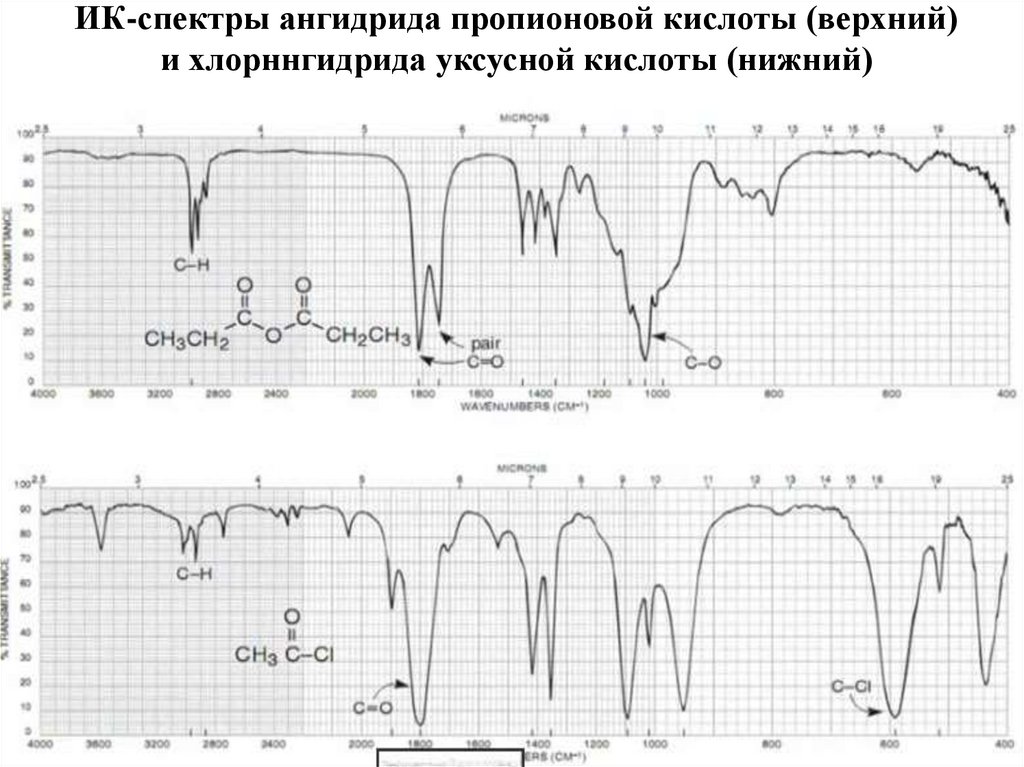
67. ИК-спектры ангидрида пропионовой кислоты (верхний) и хлорннгидрида уксусной кислоты (нижний)
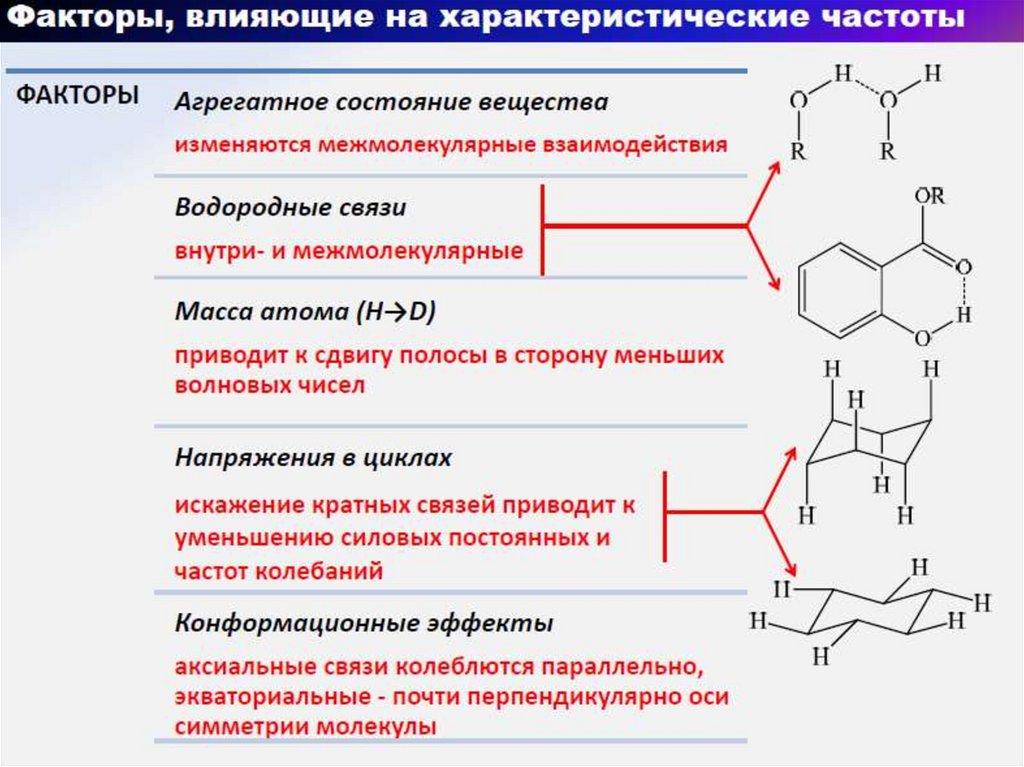
68. Изменение в ИК-спектре с изменением структуры органического соединения
69. Бензол и здругие ароматические соединения
70. Моно– и дизамещенные ароматические соединения. ИК-спектры толуола и о-диэтилбензола
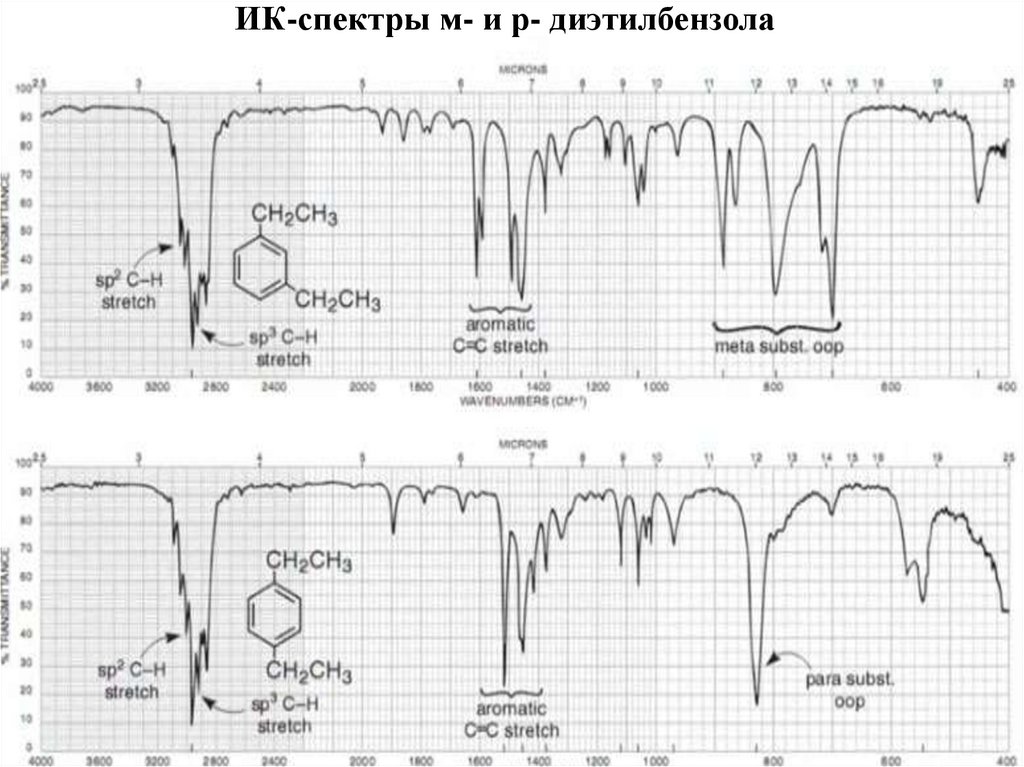
71. ИК-спектры м- и р- диэтилбензола
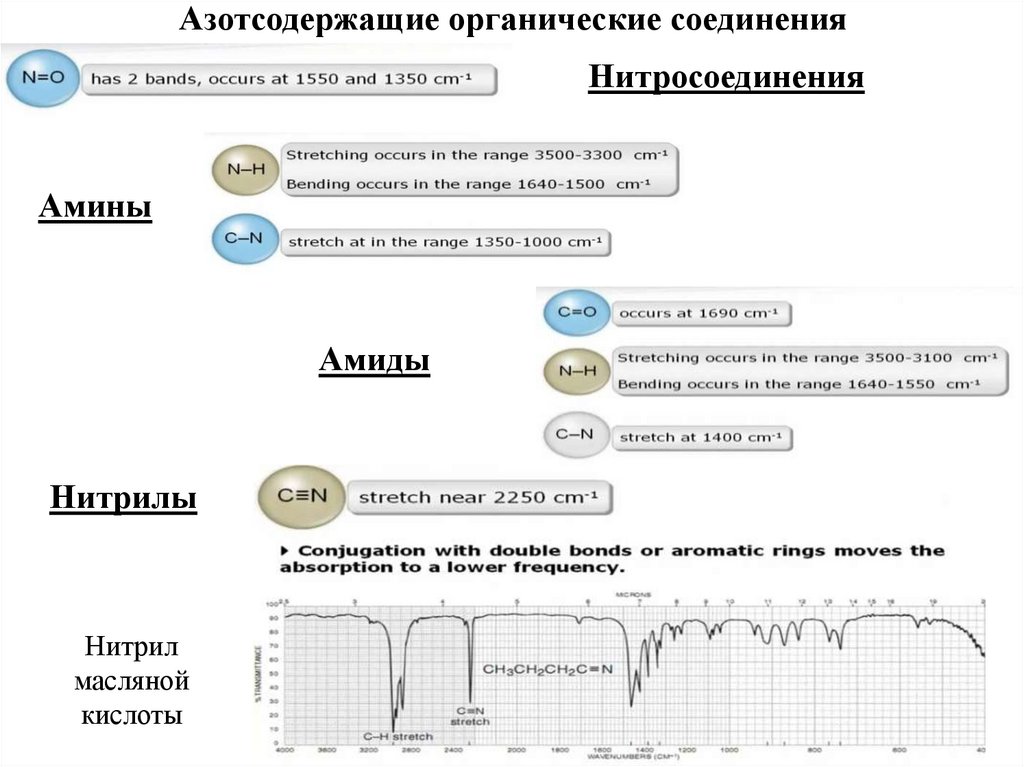
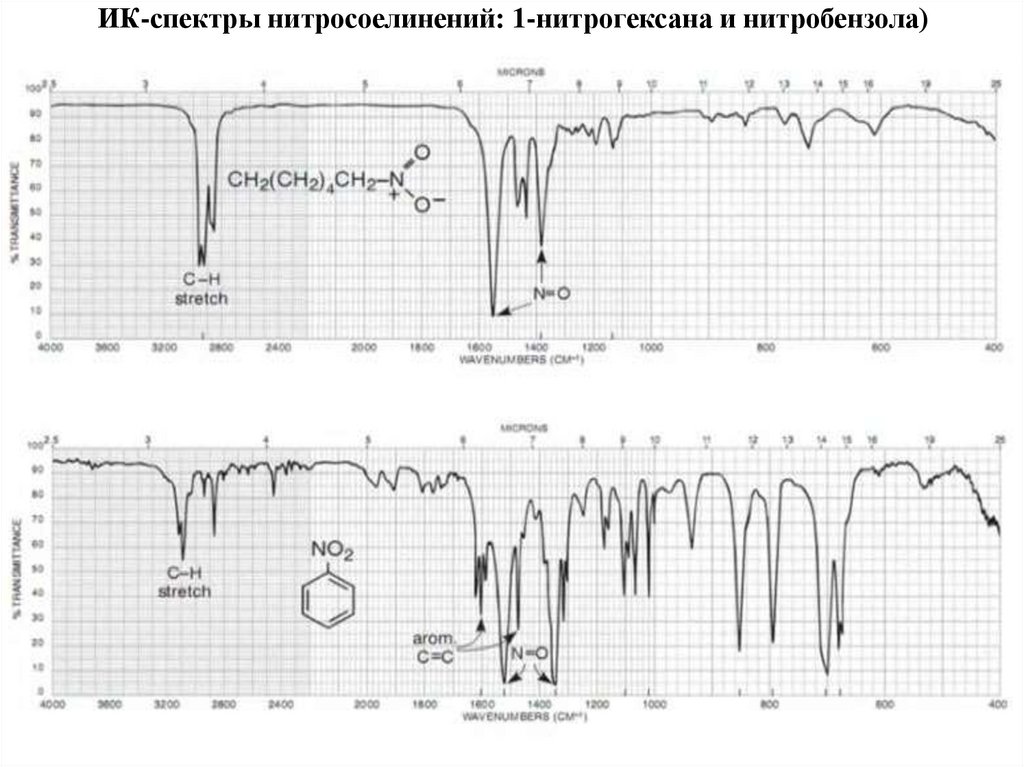
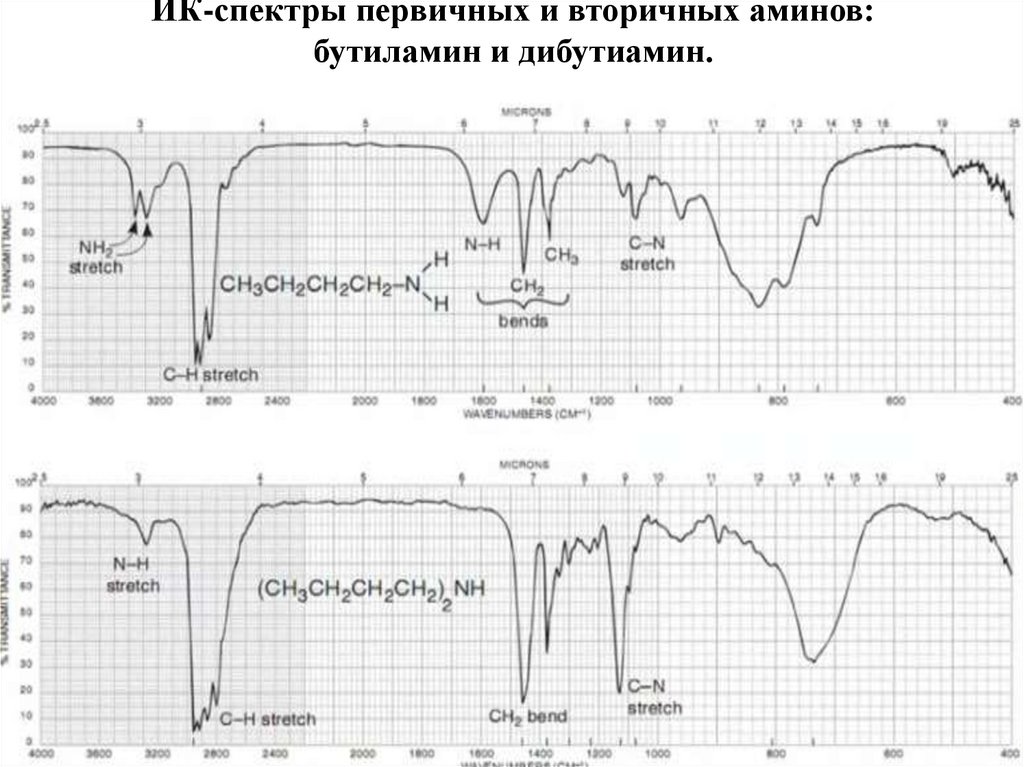
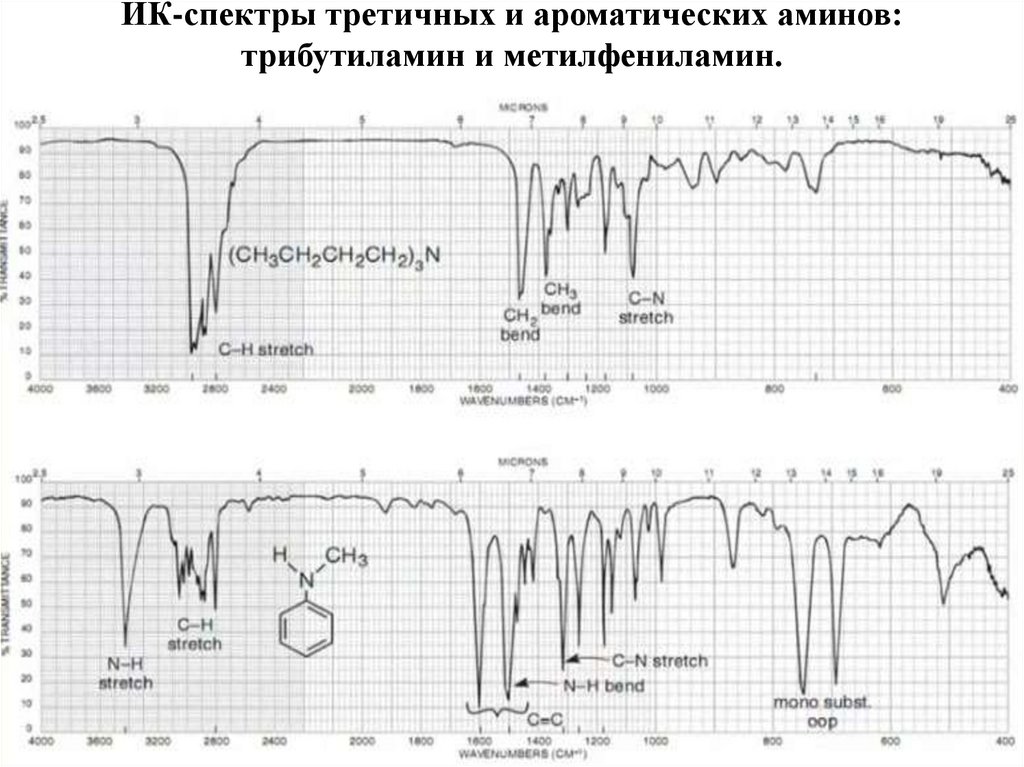
72. Азотсодержащие органические соединения
НитросоединенияАмины
Амиды
Нитрилы
Нитрил
масляной
кислоты

























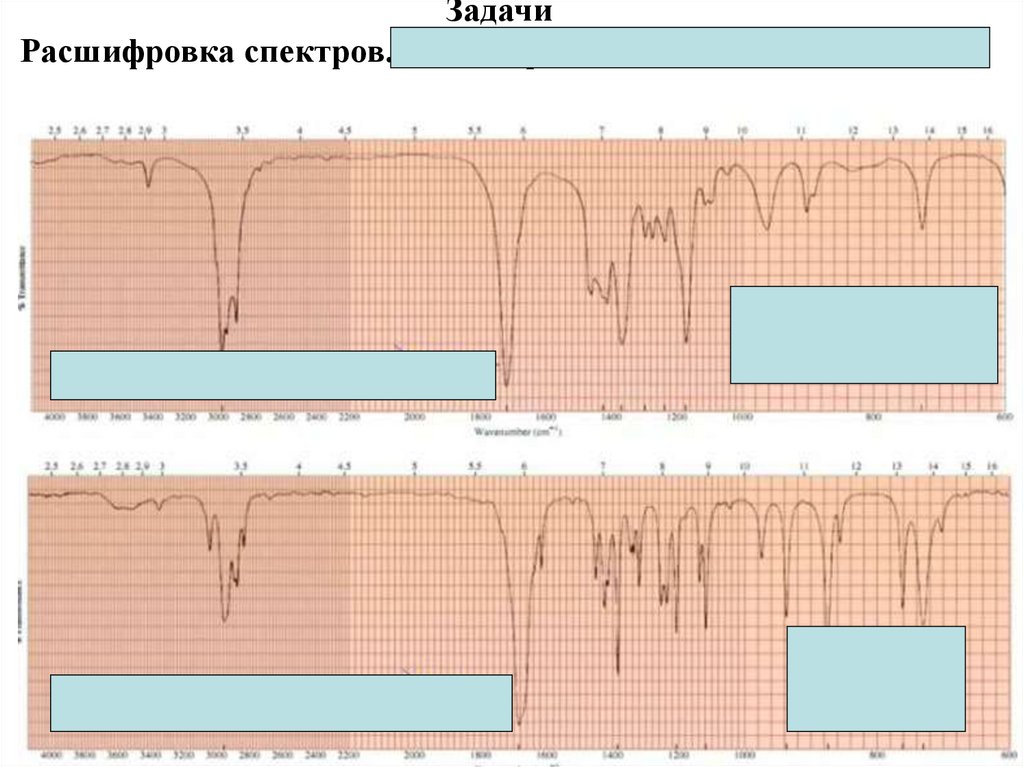
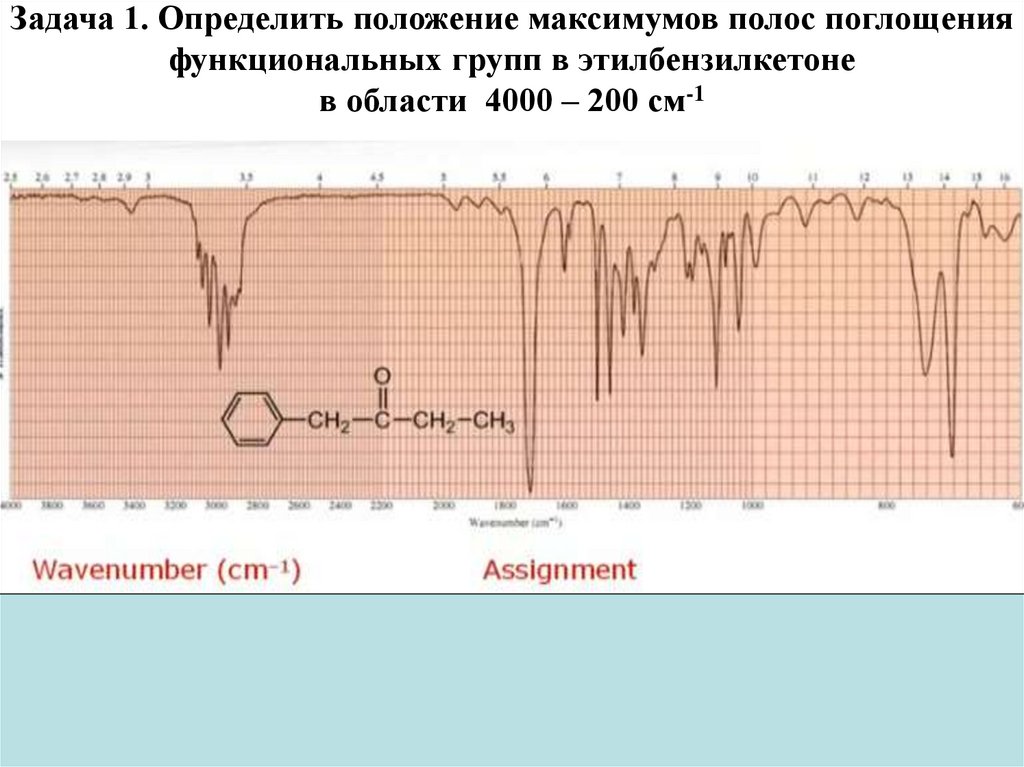
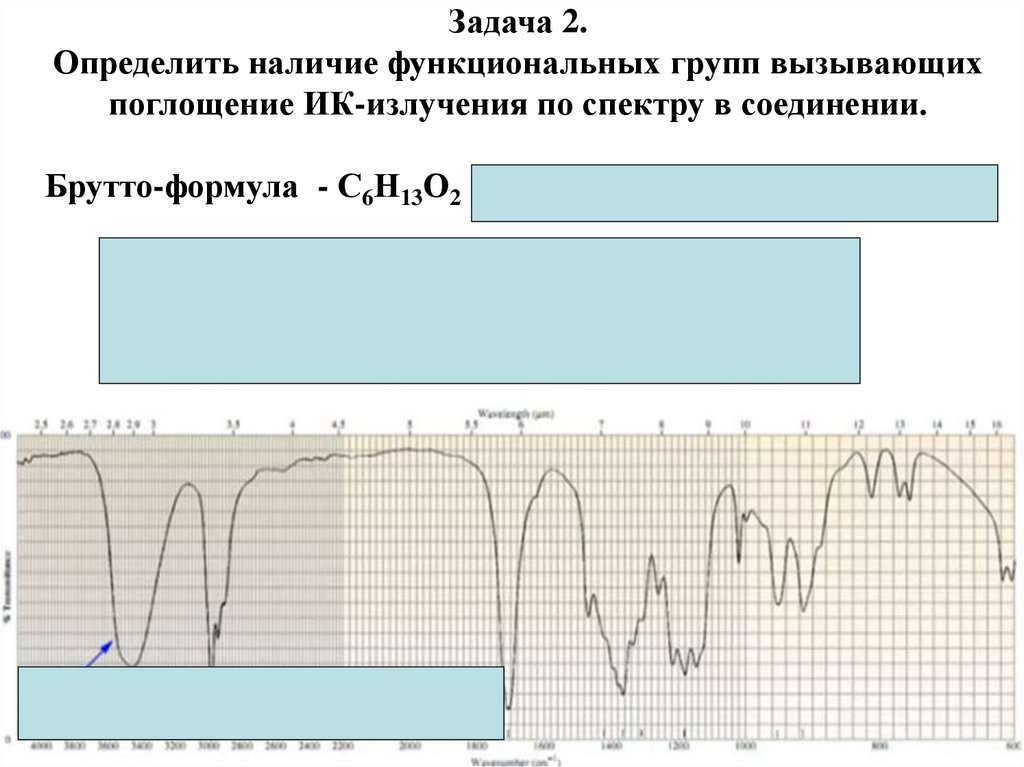
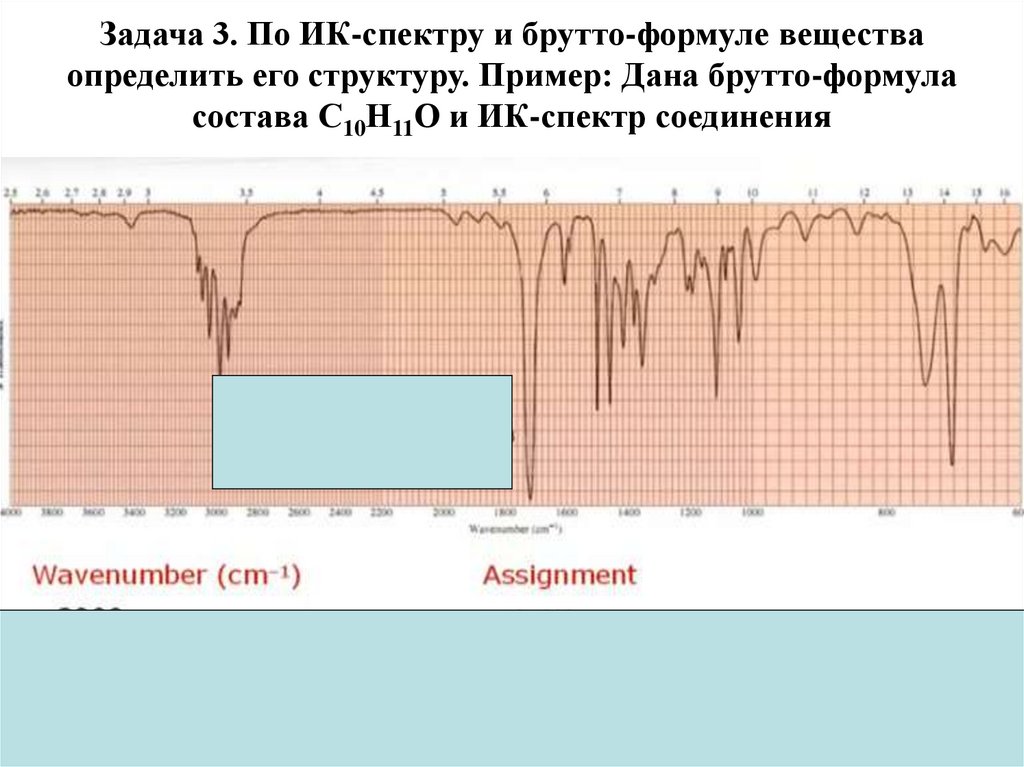


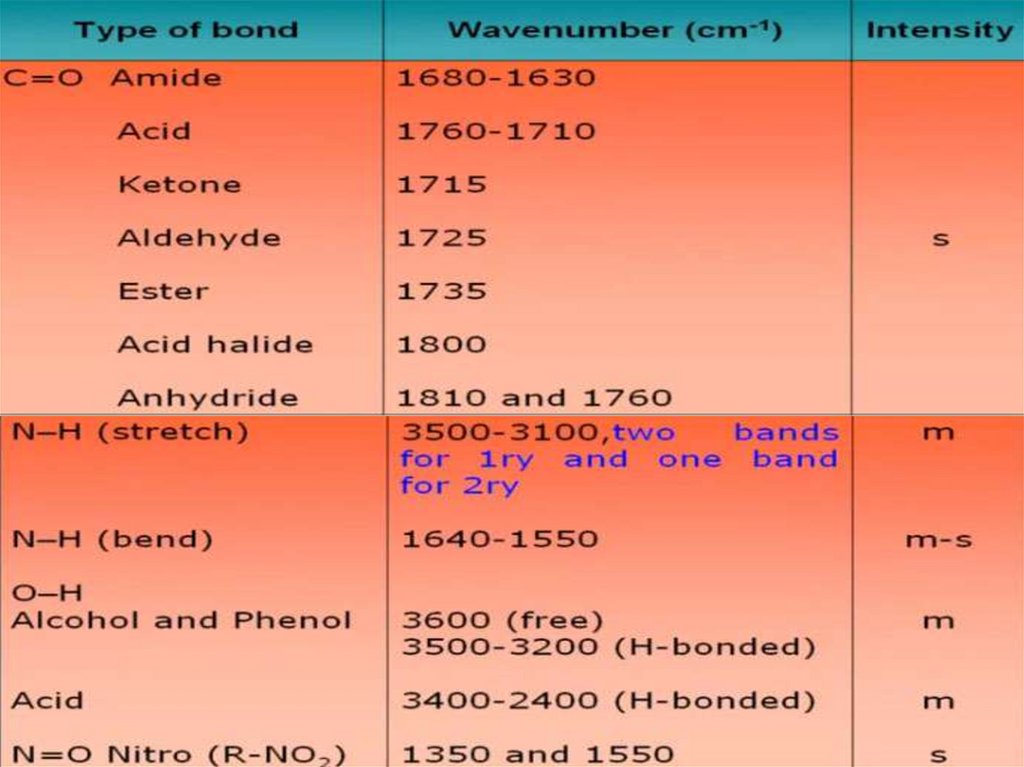
 Физика
Физика








