Похожие презентации:
Карбонильные соединения
1. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
2. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
К этому классу относятся соединения, в составкоторых входит карбонильная группа
C O ,
соединенная с углеводородным радикалом и
O
водородом (альдегиды R C H )
или с двумя углеводородными радикалами
O
(кетоны
R
C
O
R 1, Ar
C
R
)
3.
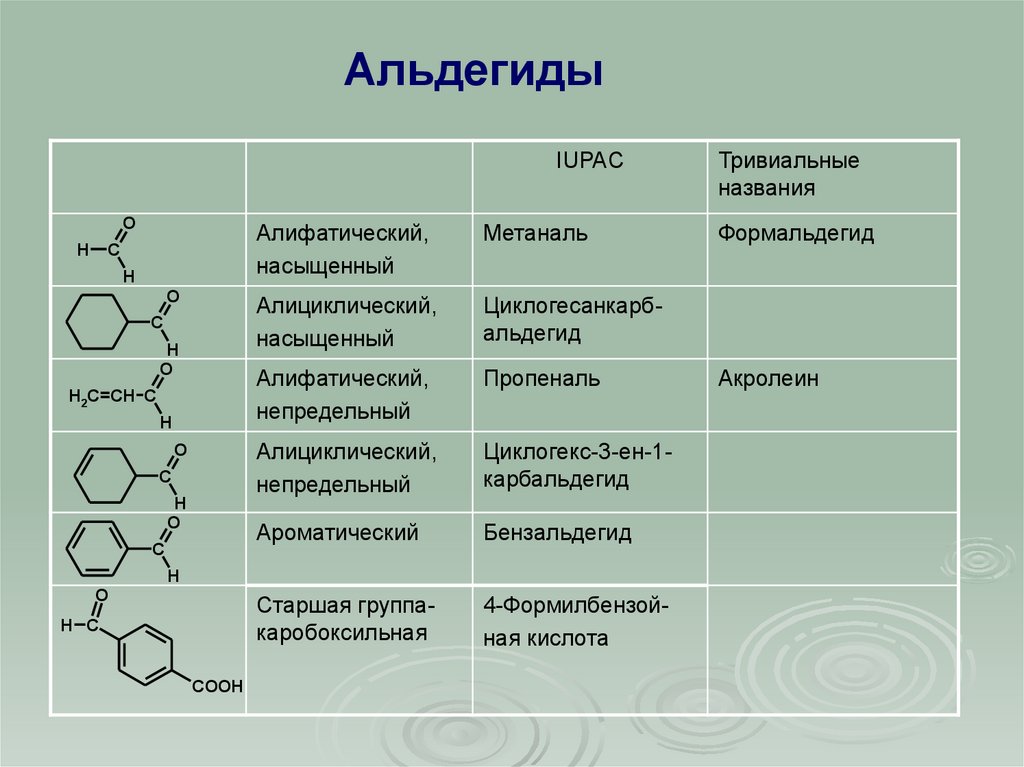
АльдегидыIUPAC
O
H
C
H
O
C
H
O
H2C CH C
H
O
C
H
O
C
Алифатический,
насыщенный
Метаналь
Алициклический,
насыщенный
Циклогесанкарбальдегид
Алифатический,
непредельный
Пропеналь
Алициклический,
непредельный
Циклогекс-3-ен-1карбальдегид
Ароматический
Бензальдегид
Старшая группакаробоксильная
4-Формилбензойная кислота
H
O
H C
COOH
Тривиальные
названия
Формальдегид
Акролеин
4.
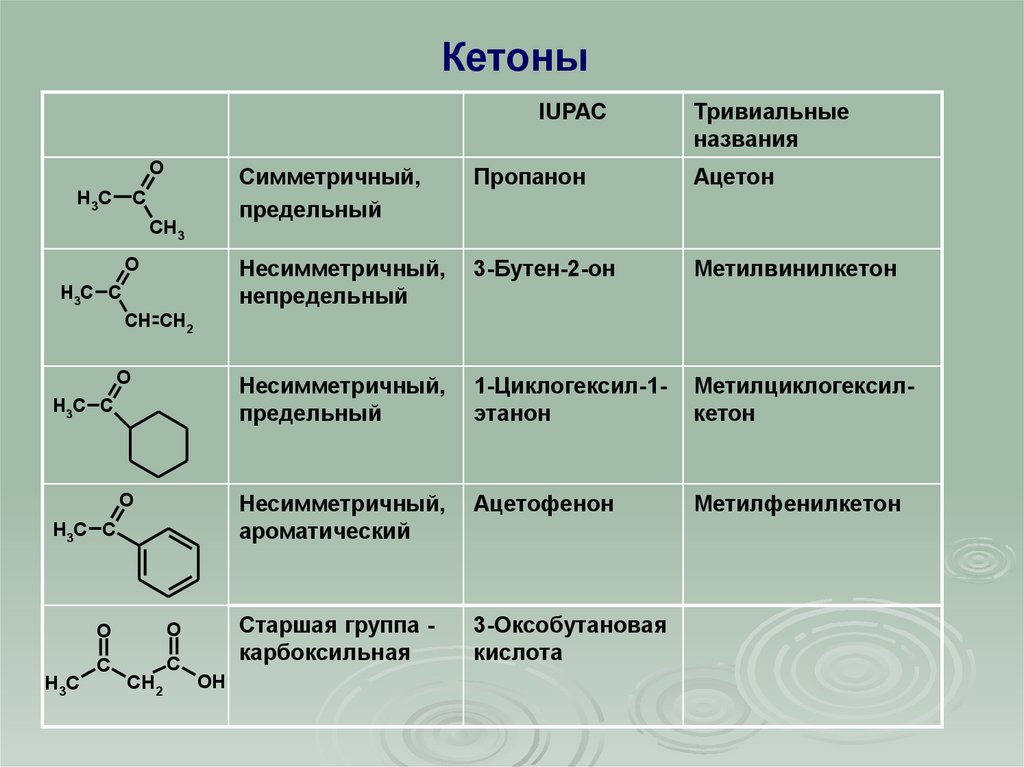
КетоныIUPAC
O
Тривиальные
названия
Симметричный,
предельный
Пропанон
Ацетон
Несимметричный,
непредельный
3-Бутен-2-он
Метилвинилкетон
O
Несимметричный,
предельный
1-Циклогексил-1этанон
Метилциклогексилкетон
O
Несимметричный,
ароматический
Ацетофенон
Метилфенилкетон
Старшая группа карбоксильная
3-Оксобутановая
кислота
H3C
C
CH3
O
H3C C
CH CH2
H3C C
H3C C
H3C
O
O
C
C
CH2
OH
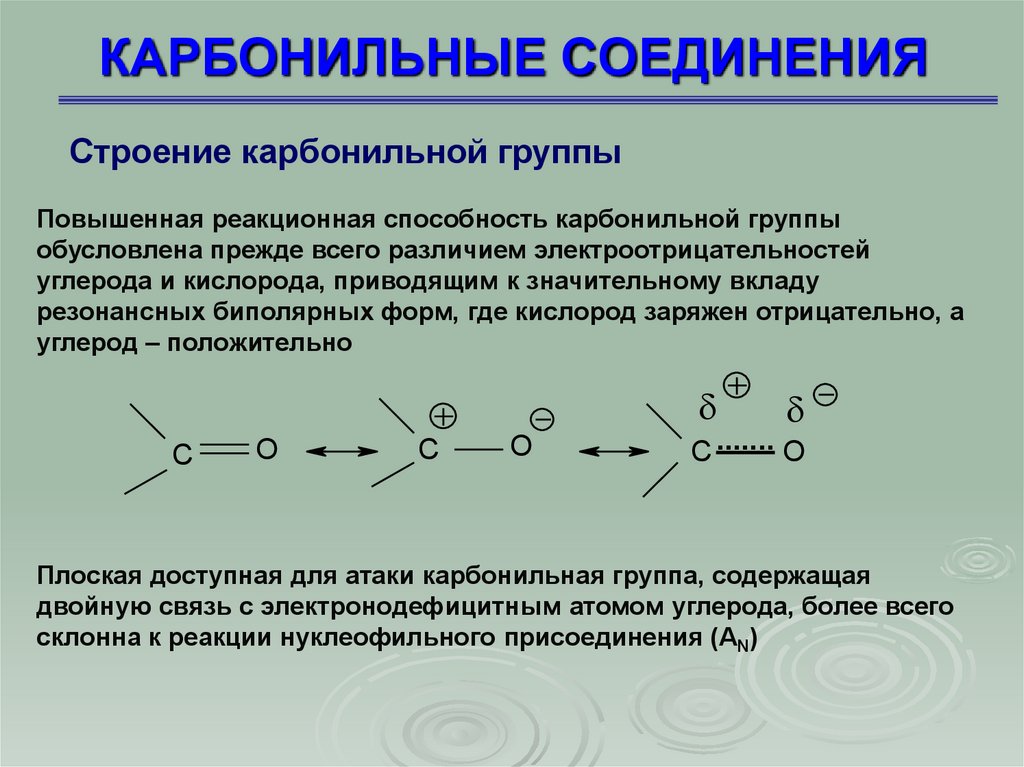
5. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Строение карбонильной группыАтом углерода карбонильной группы находится в sp2-гибридном
состоянии, он соединен с тремя другими атомами (С, Н, О или С, С, О) связями, остающаяся р-орбиталь перекрывается с р-орбиталью атома
кислорода, образуя -связь. Карбонильный углерод и атомы, связанные
с ним, лежат в одной плоскости
R2
120 o
(H) R1
C
120 o
O
6. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Строение карбонильной группыПовышенная реакционная способность карбонильной группы
обусловлена прежде всего различием электроотрицательностей
углерода и кислорода, приводящим к значительному вкладу
резонансных биполярных форм, где кислород заряжен отрицательно, а
углерод – положительно
C
O
C
O
C ....... O
Плоская доступная для атаки карбонильная группа, содержащая
двойную связь с электронодефицитным атомом углерода, более всего
склонна к реакции нуклеофильного присоединения (АN)
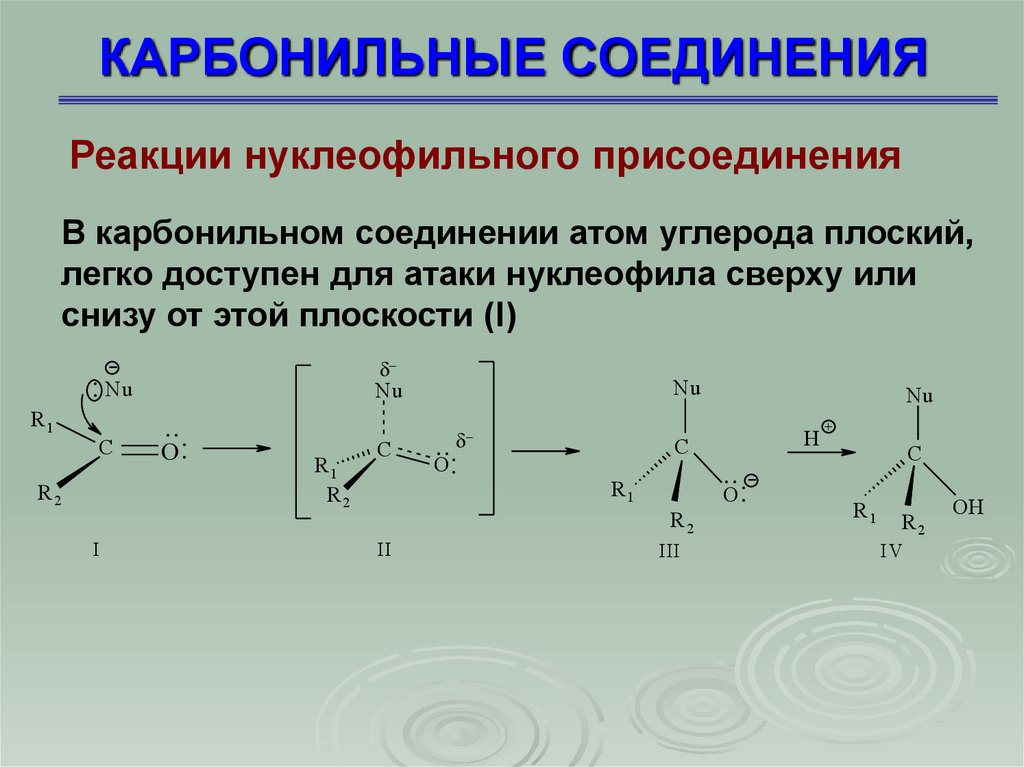
7. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Реакции нуклеофильного присоединенияВ карбонильном соединении атом углерода плоский,
легко доступен для атаки нуклеофила сверху или
снизу от этой плоскости (I)
Nu
: Nu
R1
C
R2
I
..
O:
R1
R2
C
Nu
..
O:
C
H
III
+
C
..
O:
R1
R2
II
Nu
R1
R2
IV
OH
8. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Реакции нуклеофильного присоединенияНуклеофил, подавая электроны на атом углерода
начинает образовывать с ним -связь, а кислород приобретает электроны. Атом углерода становится
близок к тетраэдрическому. Продукт реакции
присоединения (III) - ион, в котором атом углерода
находится в sp3-гибридном состоянии – тетраэдр,
на кислороде - целый отрицательный заряд.
Именно способность кислорода нести
отрицательный заряд обусловливает реакционную
способность карбонильных соединений по
отношению к нуклеофилам. Стабилизация
полученного иона происходит за счет
присоединения протона воды или кислоты (IV)
9. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Реакции нуклеофильного присоединенияРеакционная способность карбонильных соединений
определяется пространственными и электронными факторами.
Поскольку в переходном состоянии углерод карбонила начинает
принимать тетраэдрическую конфигурацию и атомы, связанные с
ним несколько сближаются, то чем больше группы R1 и R2, тем
сильнее они препятствуют такому сближению. При увеличении
объема заместителей, расположенных у карбонила, реакционная
способность уменьшается
В том же направлении действуют и электронные факторы.
Алкильные группы проявляют электронодонорный
индукционный эффект, дестабилизируют переходное состояние,
увеличивая отрицательный заряд на атоме углерода, который
подвергается атаке нуклеофила
10. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
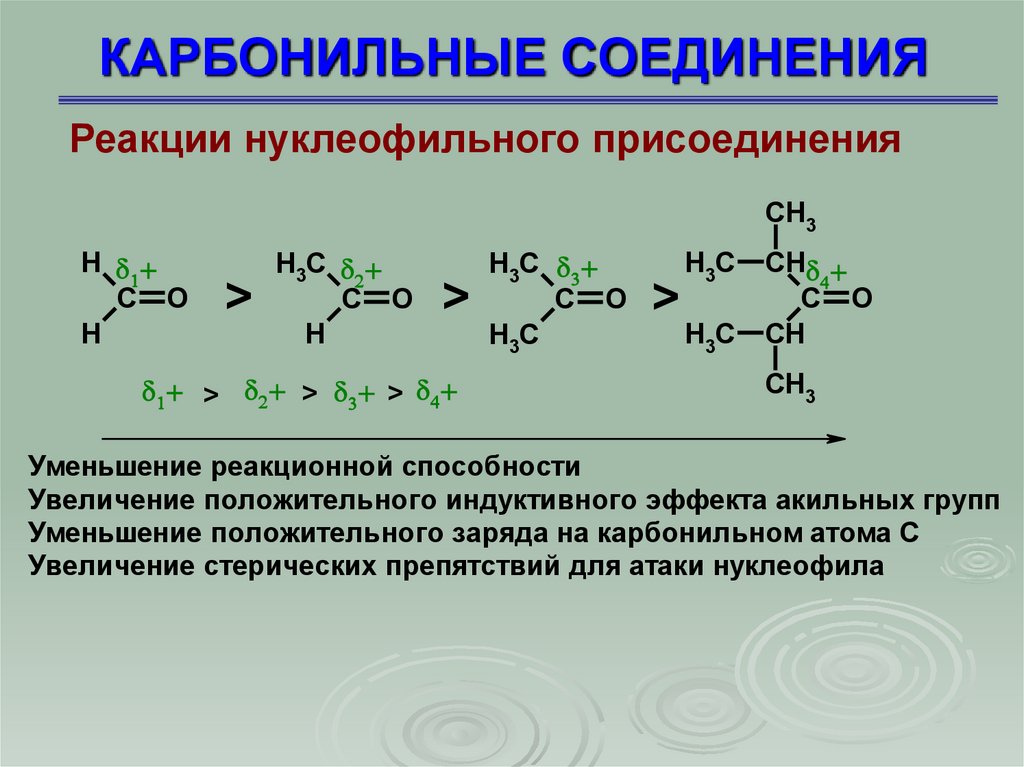
Реакции нуклеофильного присоединенияCH3
H
C O
H
>
H3C
C O
H
>
> > >
H3C
C O
H3C
>
H3C
H3C
CH
C O
CH
CH3
Уменьшение реакционной способности
Увеличение положительного индуктивного эффекта акильных групп
Уменьшение положительного заряда на карбонильном атома С
Увеличение стерических препятствий для атаки нуклеофила
11. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
12. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Присоединение О-нуклеофилов1. Гидратация
Многие карбонильные соединения подвергаются в водном
растворе обратимой гидратации
R
C O
R1
+ H2O
OH
R
C
R1
OH
Продуктами гидратации альдегидов и кетонов являются
геминальные диолы
13. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Присоединение О-нуклеофилов1. Гидратация
Гидратация может протекать в условиях как общего кислотного,
так и основного катализа, т.е. скорость лимитирующая стадия
включает или протонирование карбонильного соединения
(кислотный катализ), или превращение Н2О в более сильный
нуклеофил –ОН
14. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
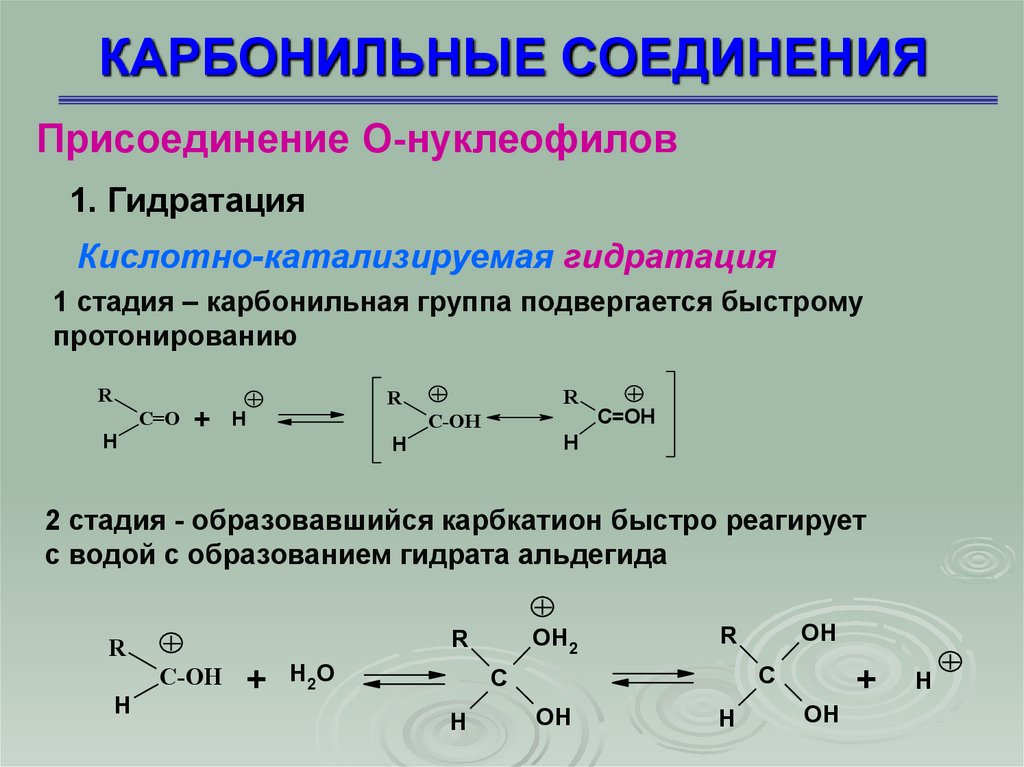
Присоединение О-нуклеофилов1. Гидратация
Кислотно-катализируемая гидратация
1 стадия – карбонильная группа подвергается быстрому
протонированию
R
H
C=O +
R
R
C=OH
C-OH
H
H
H
2 стадия - образовавшийся карбкатион быстро реагирует
с водой с образованием гидрата альдегида
C-OH
H
OH2
R
R
+ H2O
+
C
C
H
OH
R
OH
H
OH
H
15. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
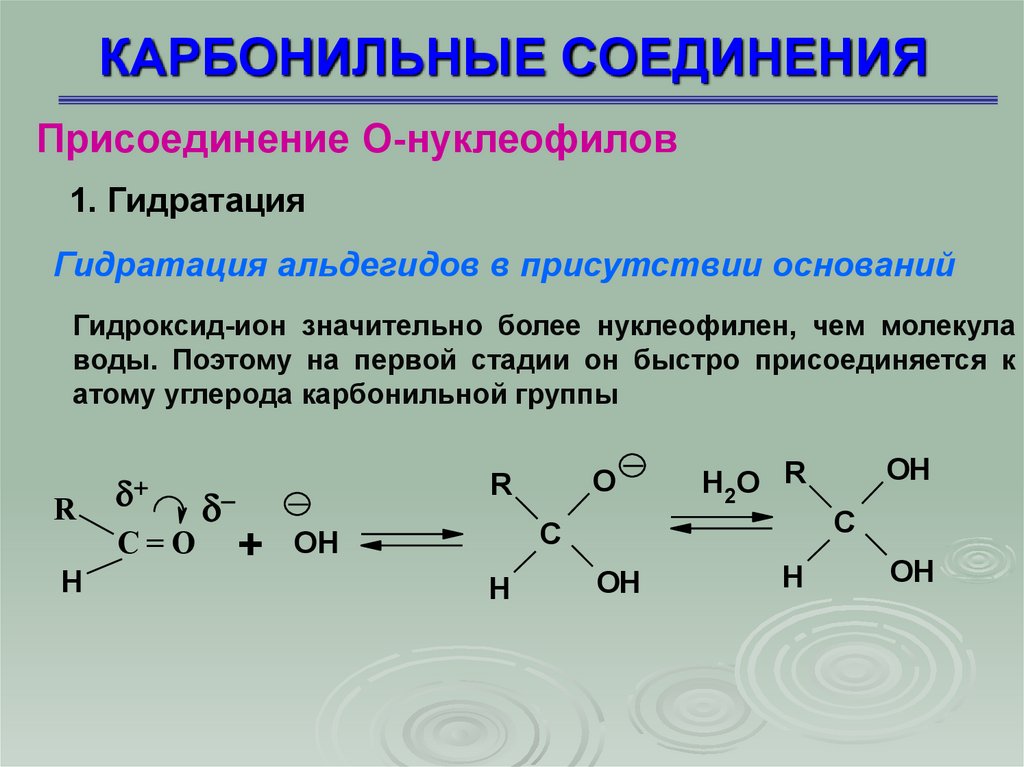
Присоединение О-нуклеофилов1. Гидратация
Гидратация альдегидов в присутствии оснований
Гидроксид-ион значительно более нуклеофилен, чем молекула
воды. Поэтому на первой стадии он быстро присоединяется к
атому углерода карбонильной группы
R
C=O
H
O
R
C
C
+ OH
H
OH
H2O R
OH
H
OH
16. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
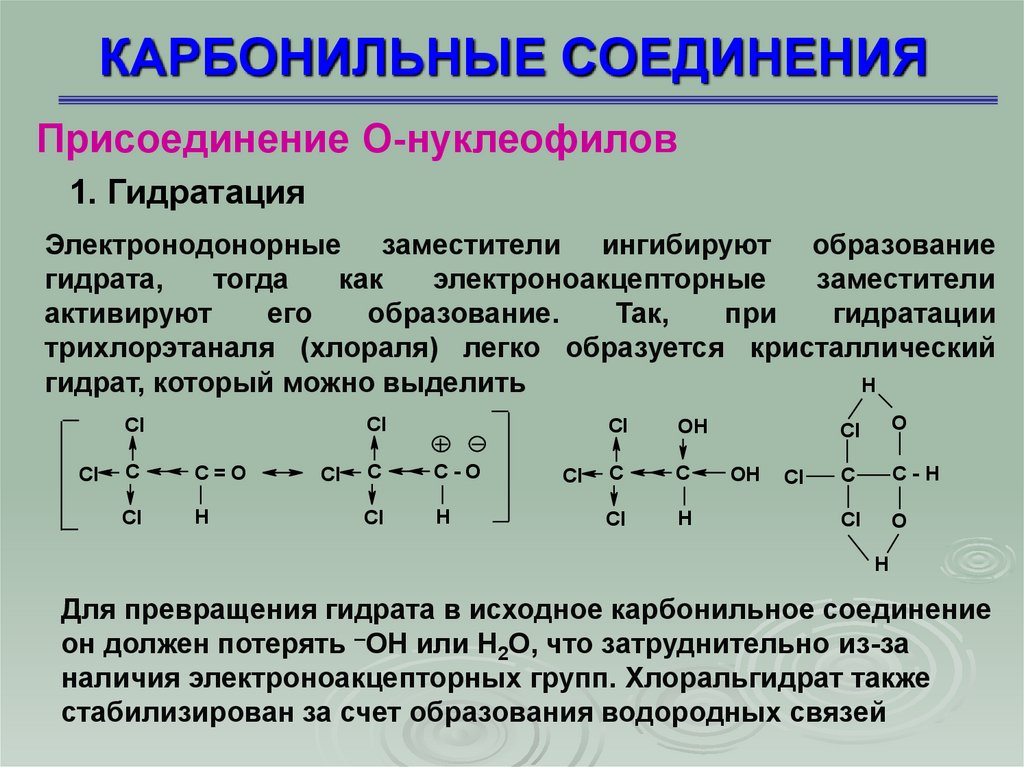
Присоединение О-нуклеофилов1. Гидратация
Электронодонорные заместители ингибируют образование
гидрата,
тогда
как
электроноакцепторные
заместители
активируют
его
образование.
Так,
при
гидратации
трихлорэтаналя (хлораля) легко образуется кристаллический
гидрат, который можно выделить
H
Cl
Cl
Cl
C
C=O
Cl
H
Cl
C
C-O
Cl
H
Cl
Cl
OH
C
C
Cl
H
OH
Cl
Cl
O
C
C-H
Cl
O
H
Для превращения гидрата в исходное карбонильное соединение
он должен потерять –ОН или Н2О, что затруднительно из-за
наличия электроноакцепторных групп. Хлоральгидрат также
стабилизирован за счет образования водородных связей
17. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Присоединение О-нуклеофилов1. Гидратация
O
Cl3C
H
OH
H2O
Cl3C
OH
H
хлоральгидрат (антисептик для КРС)
18. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
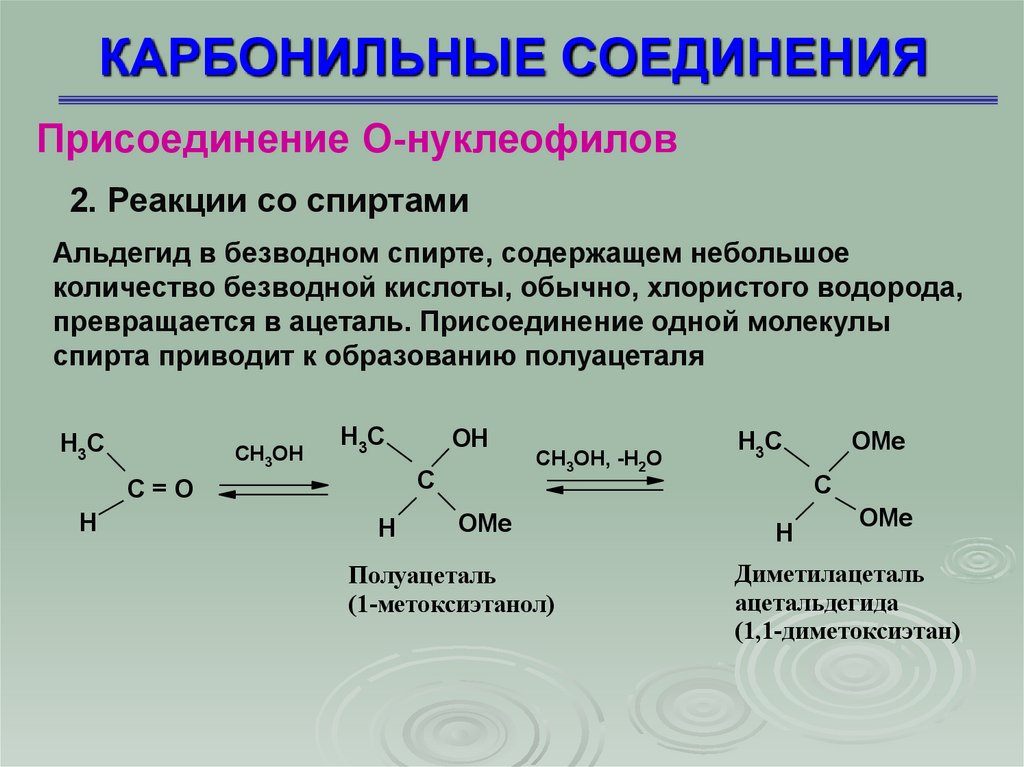
Присоединение О-нуклеофилов2. Реакции со спиртами
Альдегид в безводном спирте, содержащем небольшое
количество безводной кислоты, обычно, хлористого водорода,
превращается в ацеталь. Присоединение одной молекулы
спирта приводит к образованию полуацеталя
H3C
CH3OH
H3C
C
C=O
H
OH
H
CH3OH, -H2O
H3C
OMe
C
OMe
Полуацеталь
(1-метоксиэтанол)
H
OMe
Диметилацеталь
ацетальдегида
(1,1-диметоксиэтан)
19. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
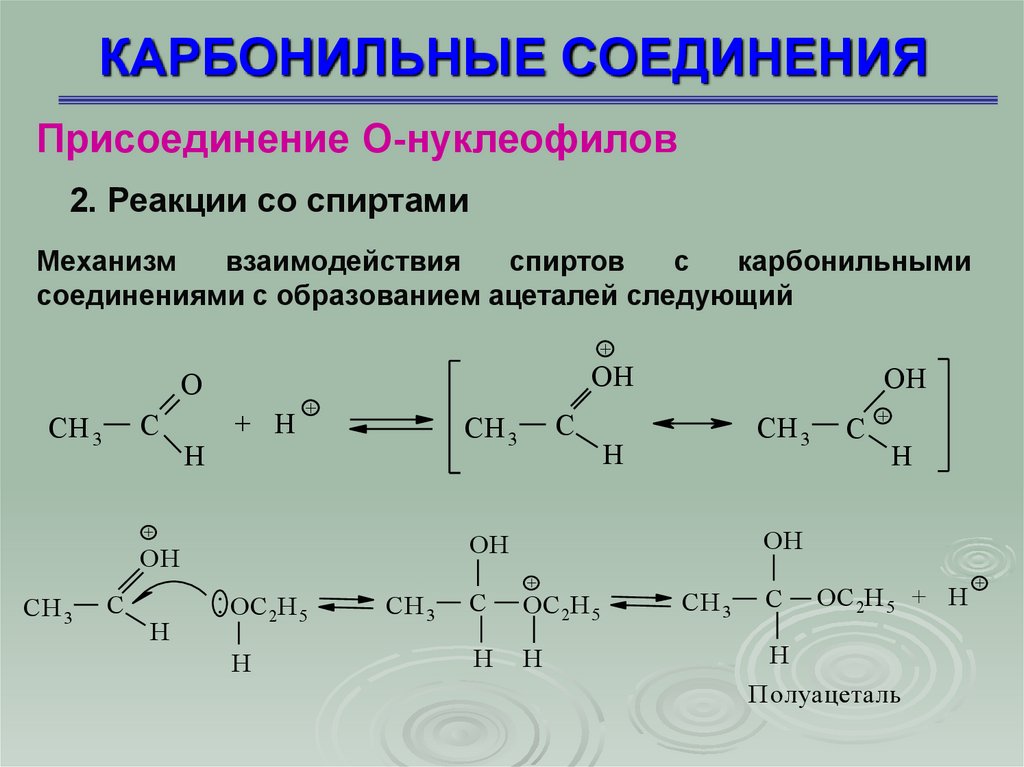
Присоединение О-нуклеофилов2. Реакции со спиртами
Механизм
взаимодействия
спиртов
с
карбонильными
соединениями с образованием ацеталей следующий
+
OH
O
C
СH 3
+ H
+
H
+
C
H
СH 3
H
: OC 2H 5
H
СH 3
C
+
H
OH
OH
OH
СH 3
C
СH 3
OH
+
C
OC 2H 5
H
H
СH 3
C
OC 2H 5 + H
H
Полуацеталь
+
20. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
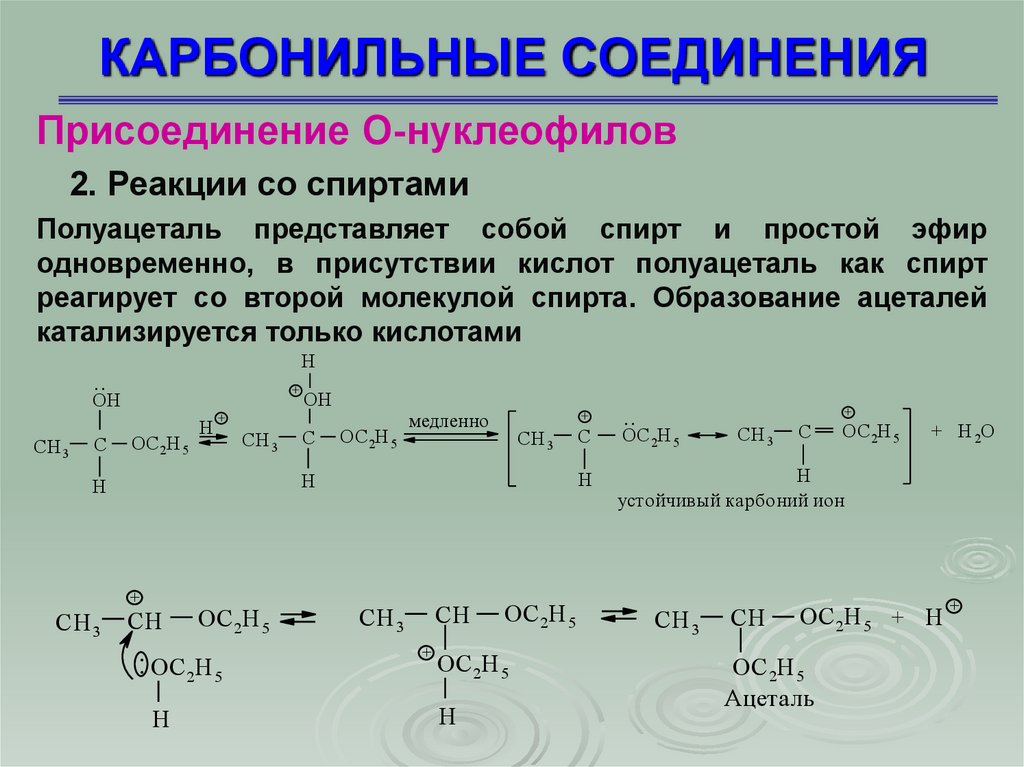
Присоединение О-нуклеофилов2. Реакции со спиртами
Полуацеталь представляет собой спирт и простой эфир
одновременно, в присутствии кислот полуацеталь как спирт
реагирует со второй молекулой спирта. Образование ацеталей
катализируется только кислотами
H
..
+
OH
СH 3
C
OC 2H 5
H
СH 3
C
OC 2H 5
+
медленно
СH 3
H
H
+
СH 3
OH
+
CН
OC 2H 5
: OC 2H 5
H
CН
СH 3
+
OC 2H 5
OC 2H 5
H
..
+
СH 3
C
OC 2H 5
C
OC 2H 5
H
H
устойчивый карбоний ион
СH 3
CН
+ H 2О
OC 2H 5 + H
OC 2H 5
Ацеталь
+
21. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Присоединение О-нуклеофилов2. Реакции со спиртами
Ацетали – простые эфиры и как простые эфиры устойчивы по
отношению к основаниям, но в отличие от них, расщепляются
кислотами значительно легче. Это объясняется тем, что на
лимитирующей стадии обеих реакций – образование и
расщепление ацеталей – образуется устойчивый карбониевый
ион.
22. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
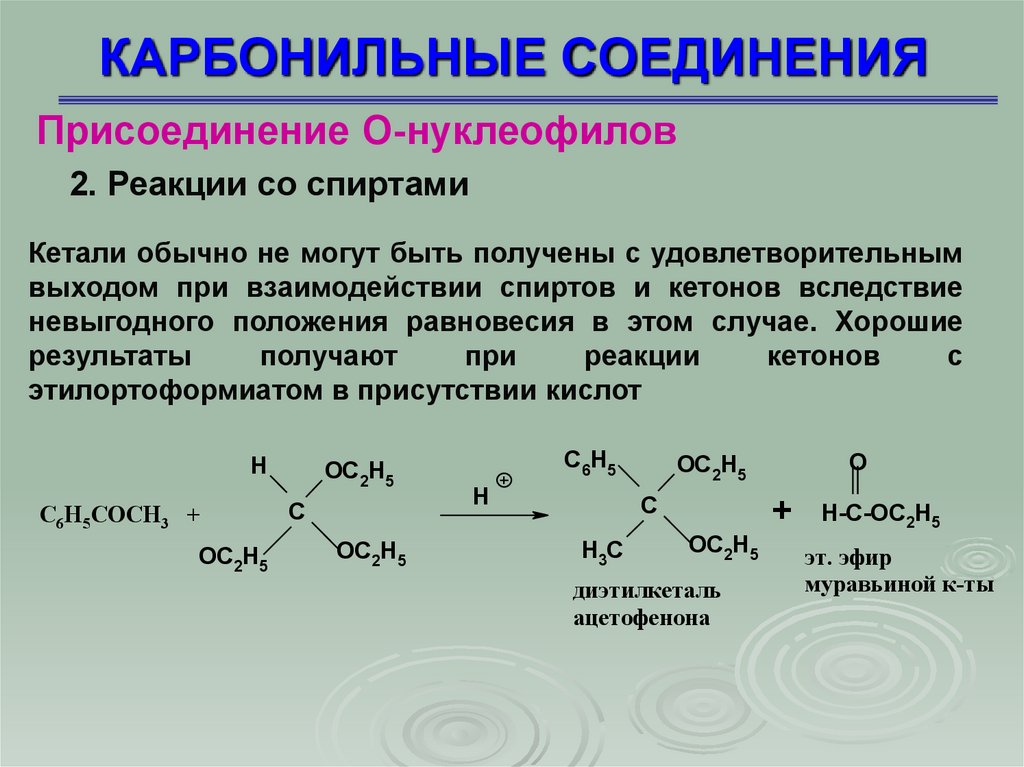
Присоединение О-нуклеофилов2. Реакции со спиртами
Кетали обычно не могут быть получены с удовлетворительным
выходом при взаимодействии спиртов и кетонов вследствие
невыгодного положения равновесия в этом случае. Хорошие
результаты
получают
при
реакции
кетонов
с
этилортоформиатом в присутствии кислот
H
С6H5COCH3 +
OC2H5
OC2H5
C
OC2H5
C6H5
H
C
H3C
O
OC2H5
+
OC2H5
диэтилкеталь
ацетофенона
H-C-OC2H5
эт. эфир
муравьиной к-ты
23. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
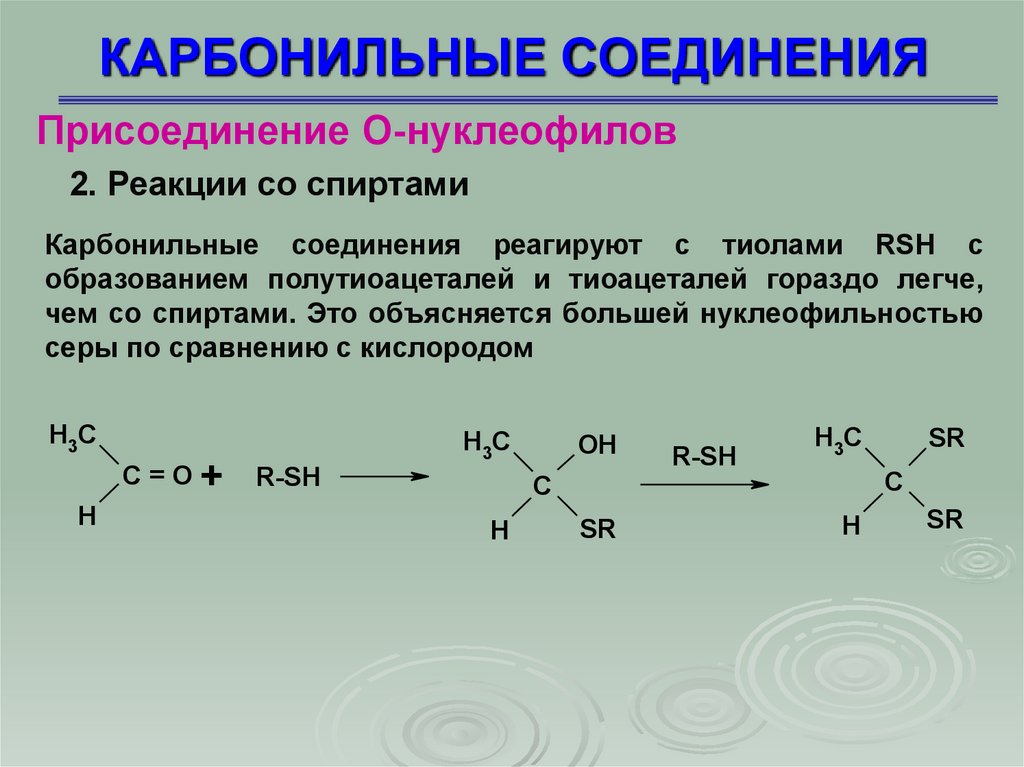
Присоединение О-нуклеофилов2. Реакции со спиртами
Карбонильные соединения реагируют с тиолами RSH с
образованием полутиоацеталей и тиоацеталей гораздо легче,
чем со спиртами. Это объясняется большей нуклеофильностью
серы по сравнению с кислородом
H3C
C=O+
H
H3C
R-SH
OH
R-SH
H3C
C
C
H
SR
SR
H
SR
24. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
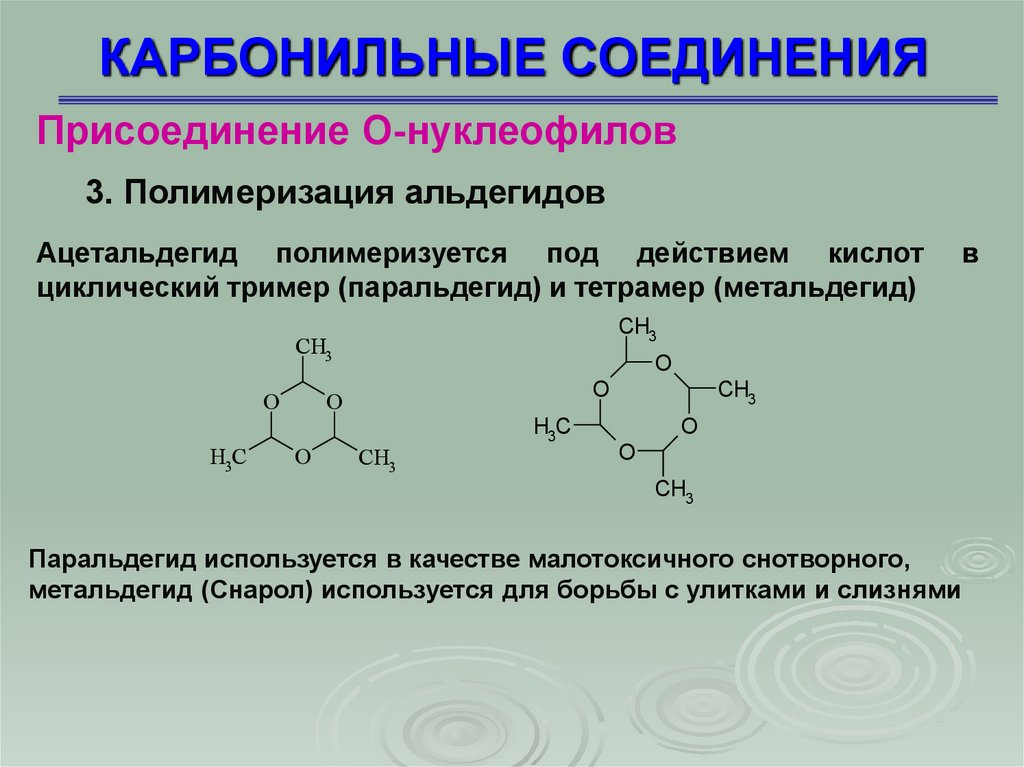
Присоединение О-нуклеофилов3. Полимеризация альдегидов
Реакция имеет много общего с образованием ацеталей.
Образуются как линейные, так и циклические полимеры
n CH2 = O + H2O
HO-CH2-(-O-CH2-)n-2 -O-CH2-OH
парафрмальдегид (полиоксиметилен)
Это вещество при нагревании регенерирует формальдегид,
поэтому служит удобным источником газообразного
формальдегида
25. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Присоединение О-нуклеофилов3. Полимеризация альдегидов
При нагревании с разбавленной кислотой пароформ образует
твердый тример – триоксиметилен (т.пл 61 С)
CH2
O
O
H2C
O
CH2
Полимеры формальдегида нашли в последнее время большое
значение в качестве пластических масс. Для получения более
стабильных полимеров защищают концевые гидроксильные
группы путем алкилирования или ацилирования. Фирма Дюпон
выпускает полимер «Дельрин», обладающий исключительной
прочностью и легко формующийся
26. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Присоединение О-нуклеофилов3. Полимеризация альдегидов
Ацетальдегид полимеризуется под действием кислот
циклический тример (паральдегид) и тетрамер (метальдегид)
CH3
CH3
O
O
O
O
H3C
H3C
O
в
CH3
CH3
O
O
CH3
Паральдегид используется в качестве малотоксичного снотворного,
метальдегид (Снарол) используется для борьбы с улитками и слизнями
27. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Присоединение С-нуклеофилов1. Присоединение цианид-иона
Цианистый водород присоединяется ко многим альдегидам и
кетонам, образуя циангидриды
OH
O
CH 3 C
H + HCN
CH 3 C
C
N
H
Циангидринацетальдегида,
2-Гидроксипропанонитрил
Это первая органическая реакция, для которой был установлен
механизм (Лэпворт, 1903 г). Особенностью реакции является
необходимость основного катализа. HCN – недостаточно сильный
нуклеофил, чтобы атаковать С = О. Для превращения HCN в более
сильный нуклеофил –СN реакцию проводят в условиях основного
катализа
28. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Присоединение С-нуклеофилов1. Присоединение цианид-иона
Присоединение –CN обратимо и в отсутствие донора протонов
смещается в сторону исходных веществ. В присутствии донора
протонов равновесие смещается вправо, так как равновесие,
включающее циангидрин, более благоприятно, чем равновесие,
включающее промежуточный анион
R
R1
+
C
O
-
O
CN
R
медленно
C
R1
OH
HY
CN
R
быстро
C
CN
+Y
R1
Реакцию проводят, добавляя минеральную кислоту к смеси
карбонильного соединения и цианистого натрия для образования
цианистого водорода, количество добавляемой кислоты должно быть
недостаточно для связывания всех цианид-ионов
29. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Присоединение С-нуклеофилов1. Присоединение цианид-иона
Эти реакции имеют практическое применение для получения
-оксикислот, цианалкенов и непредельных кислот
OH
CH 3 C
C
N
Н 2О, H
H
-Н 2О
+
OН
CH 3 CН CООН
- Н 2О
Молочная кислота
CH 2 CН C N
Акрилонитрил
CH 2 CН CООН
Акриловая кислота
30. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
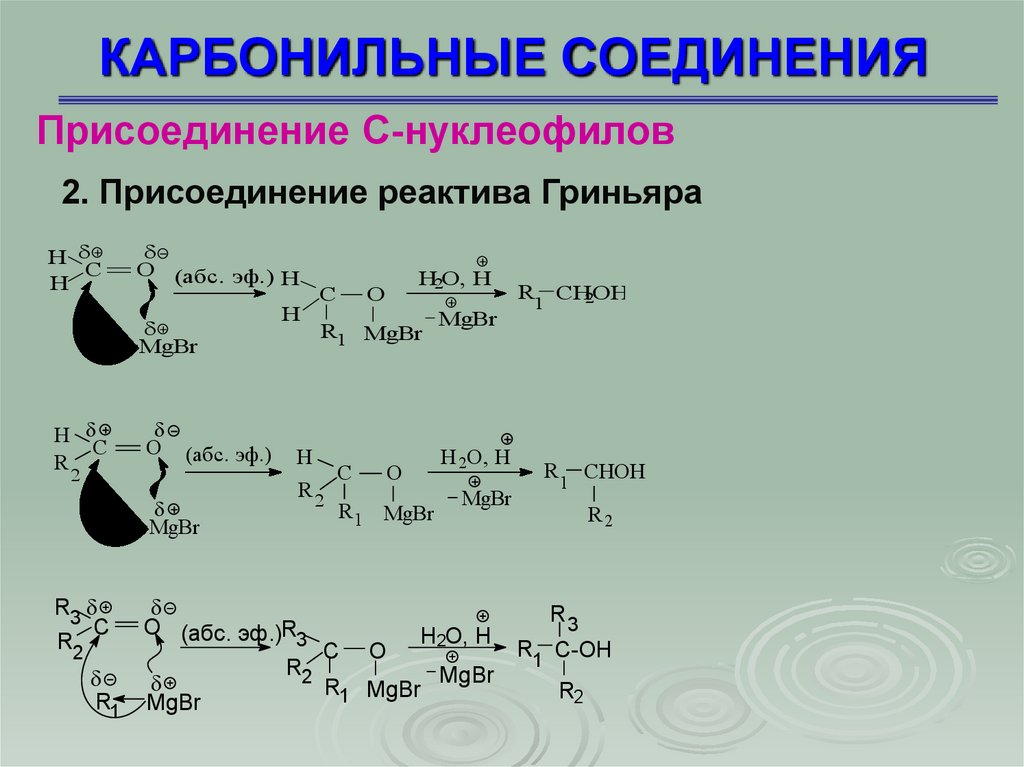
Присоединение С-нуклеофилов2. Присоединение реактива Гриньяра
H
C
H
R1
H
C
R
2
R1
R3
C
R2
R1
O (абс. эф.) H
MgBr
O (абс. эф.)
MgBr
H
C
H2O, H
O
R1 MgBr
H
R2
C
O
R 1 MgBr
MgBr
H 2O, H
MgBr
O (абс. эф.)R
H2O, H
3
C O
R2
MgBr
R1 MgBr
MgBr
R
1
CH2OH
R
1
CHOH
R2
R3
R1 C-OH
R2
31. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
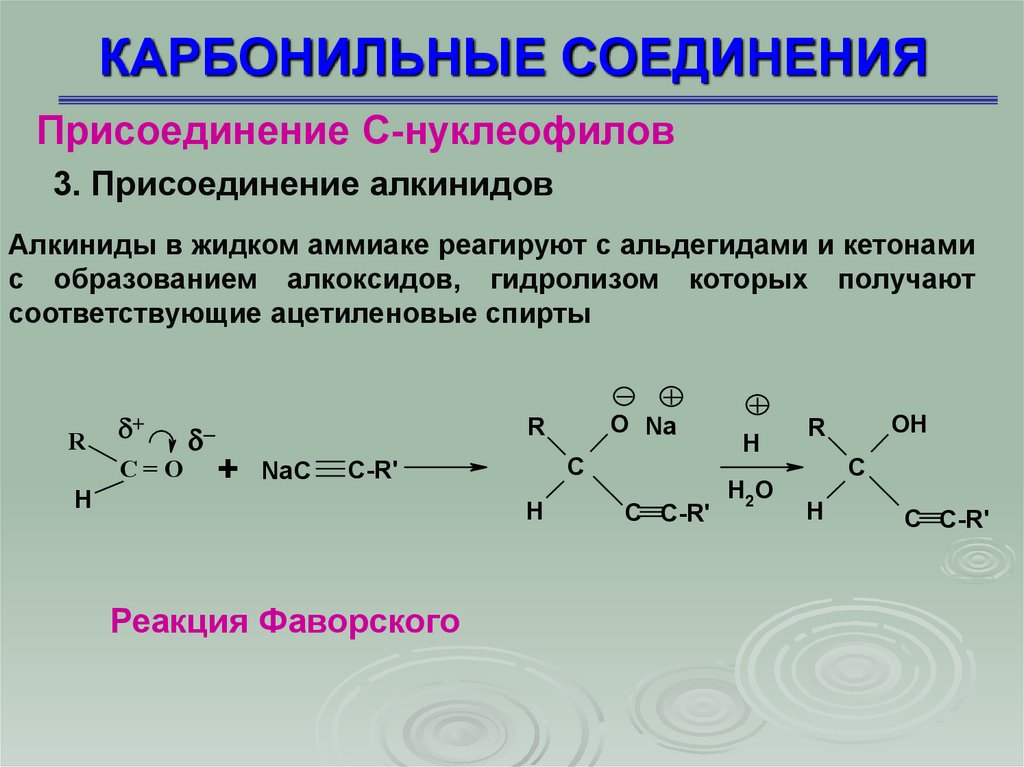
Присоединение С-нуклеофилов3. Присоединение алкинидов
Алкиниды в жидком аммиаке реагируют с альдегидами и кетонами
с образованием алкоксидов, гидролизом которых получают
соответствующие ацетиленовые спирты
R
C=O
O Na
R
+ NaC
H
Реакция Фаворского
OH
R
C
C-R'
H
H
C
C C-R'
H2O
H
C C-R'
32. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
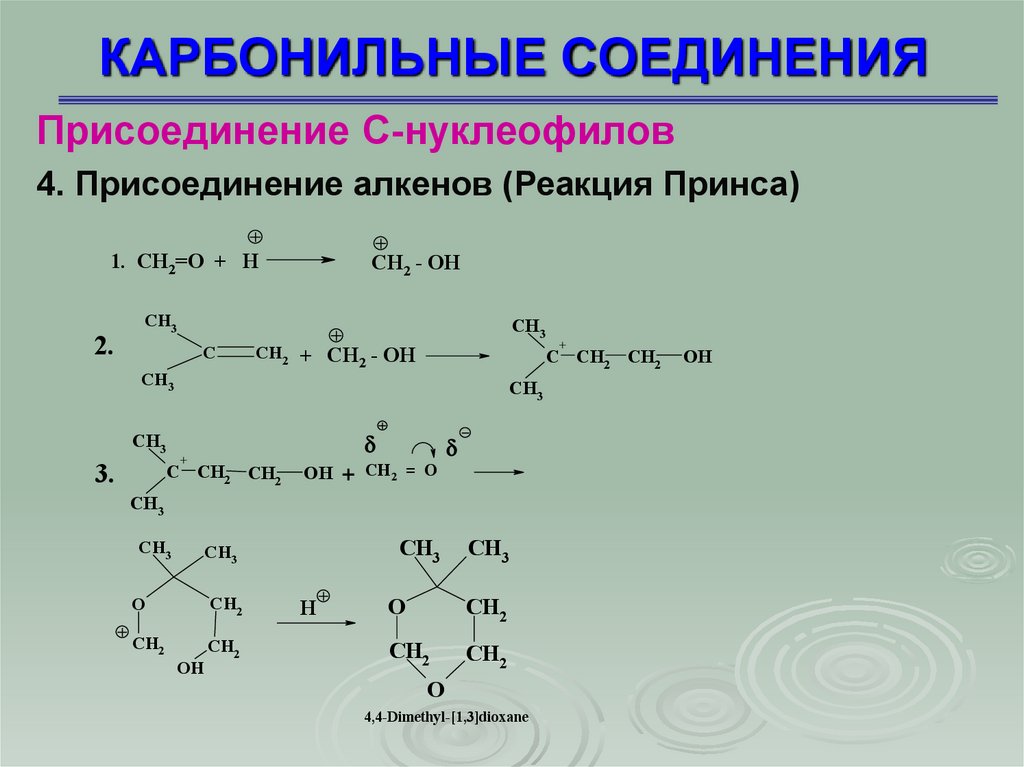
Присоединение С-нуклеофилов4. Присоединение алкенов (Реакция Принса)
1. CH2=O + H
2.
CH2 - OH
CH3
CH3
C
CH3
CH3
3.
CH2 + CH2 - OH
CH3
+
C CH2 CH2
OH CH2 = O
CH3
CH3
CH3
O
CH2
CH2
CH2
OH
H
+
C CH2 CH2
CH3
CH3
O
CH2
CH2
CH2
O
4,4-Dimethyl-[1,3]dioxane
OH
33. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Присоединение С-нуклеофилов4. Присоединение алкенов (Реакция Принса)
При кислотном разложении 4,4-диметил-1,3диоксана
получается изопрен
CH3
CH3
O
CH2
CH2
CH2
O
H,
t
CH2
C
CH3
CH
CH2 + CH2= O + H2O
34. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
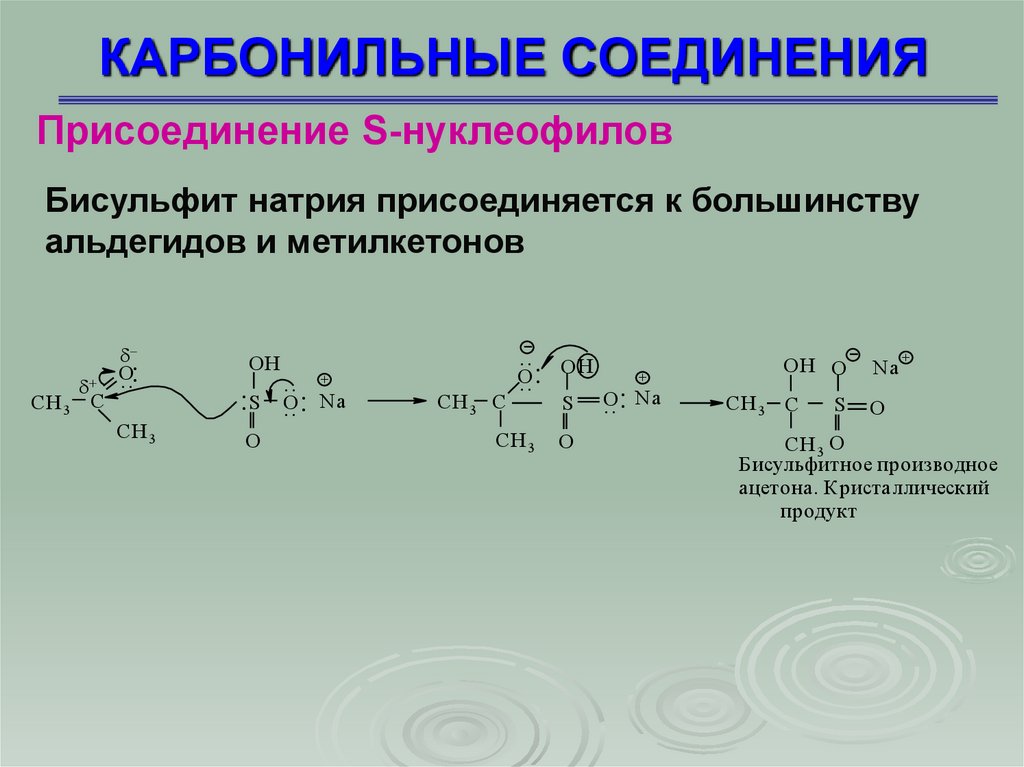
Присоединение S-нуклеофиловБисульфит натрия присоединяется к большинству
альдегидов и метилкетонов
CH 3 C
O
..:
CH 3
OН
:S
O
.. +
O
.. : Na
CH 3 C
.. O Н
O
.. :
CH 3
S
O
+
O
.. : Na
OH O
CH 3 C
S
Na
+
O
CH 3 O
Бисульфитное производное
ацетона. Кристаллический
продукт
35. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
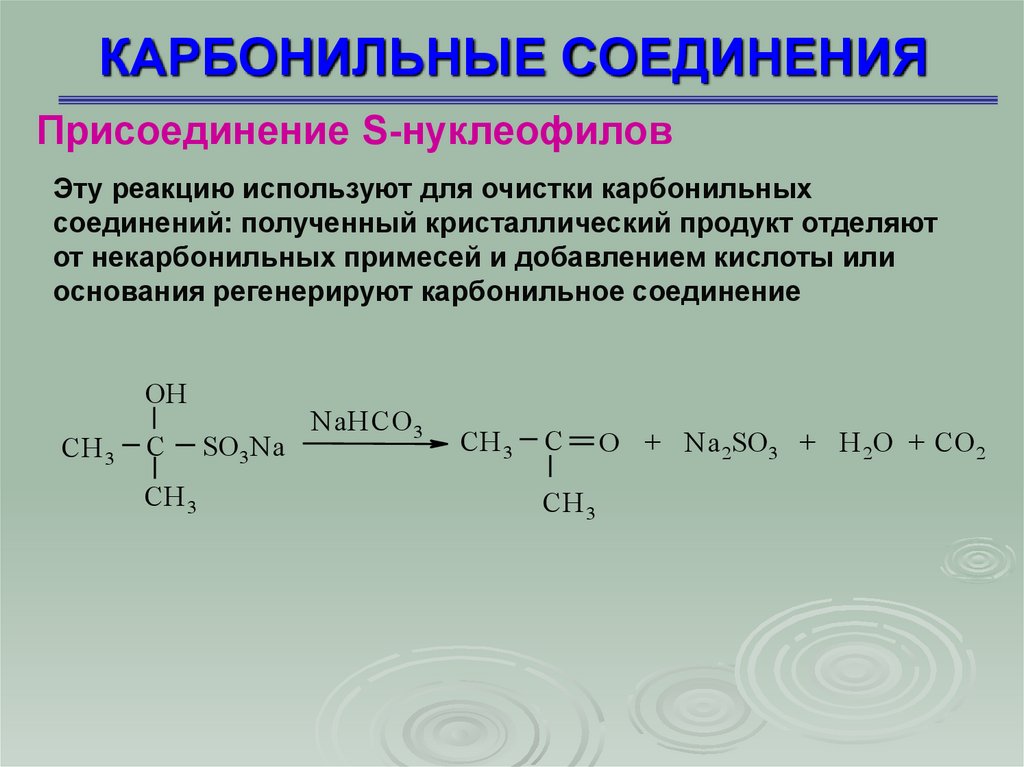
Присоединение S-нуклеофиловЭту реакцию используют для очистки карбонильных
соединений: полученный кристаллический продукт отделяют
от некарбонильных примесей и добавлением кислоты или
основания регенерируют карбонильное соединение
OH
CH 3
C
CH 3
SО 3Na
NaHCO 3
CH 3
C
CH 3
O + Na 2SO 3 + H 2O + CO 2
36. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Нуклеофильное присоединение - отщеплениеИзвестен ряд реакций нуклеофильного присоединения к группе
С = О , в которых присоединяющийся нуклеофил содержит
кислый протон, поэтому становится возможным последующее
отщепление Н2О, т.е. происходит замещение атома кислорода.
Например, с альдегидами и кетонами взаимодействуют
соединения, родственные аммиаку G-NH2. В этом случае
реакция протекает как нуклеофильное присоединение с
последующим отщеплением воды (AdN, E)
37. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Нуклеофильное присоединение - отщеплениеРеакция с N-нуклеофилами представляет собой различные
реакции аммиака, первичных и вторичных аминов, гидразина и
его производных, гидроксиламина и семикарбазида
..
Нуклеофил
Амин
H2 N
Продукт взаимодействия
R CH N G
G
H2N - H.. (G = Alk, Ar)
Гидразин
H2 N
..
Фенилгидразин H2 N
N H2
HNС6Н5
Семикарбазид
NH
..
H2 N
..
Гидраксиламин H2 N
CO
OH
H2N-G, H
R2C = O
Азометин (Имин) R-CH = NH (=N-Alk, =N-Ar)
R
CH
N
NH2
Фенилгидразон R
CH
N
NH
Семикарбозон
R
CH
N
NH
Оксим
R
CH
N
OH
Гидразон
N H2
OH
R2C - NH-G
- H2O
C6H5
CO
R2C = N-G
NH2
38. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Нуклеофильное присоединение - отщеплениеПоскольку нуклеофил слабый – частица, не имеющая заряда, его
присоединение катализируется кислотой. Предварительное
протонирование карбонильного соединения делает его более
реакционноспособным: на карбонильном углероде увеличивается
положительный заряд (I), что позволяет кислороду приобрести пару
электронов в результате нуклеофильной атаки, не получая при этом
отрицательного заряда (II)
R1
R1
C
R2
O + H
C
+
R1
+
+
C
OH
R2
R2
I
OH
39. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Нуклеофильное присоединение - отщеплениеG
NH2
..
R1
G
NH2
+
OH
C
C
R1
R2
R2
G
OH
R1
R1
R2
G
-H2O
..
H
..
OH
R2
R1
+
H
N
C
+
OH2
H
II
NH
C
N
C
I
G
+
G
+
N
H
R1
C
R2
R1
R2
R2
C
NG + H
+
IV
III
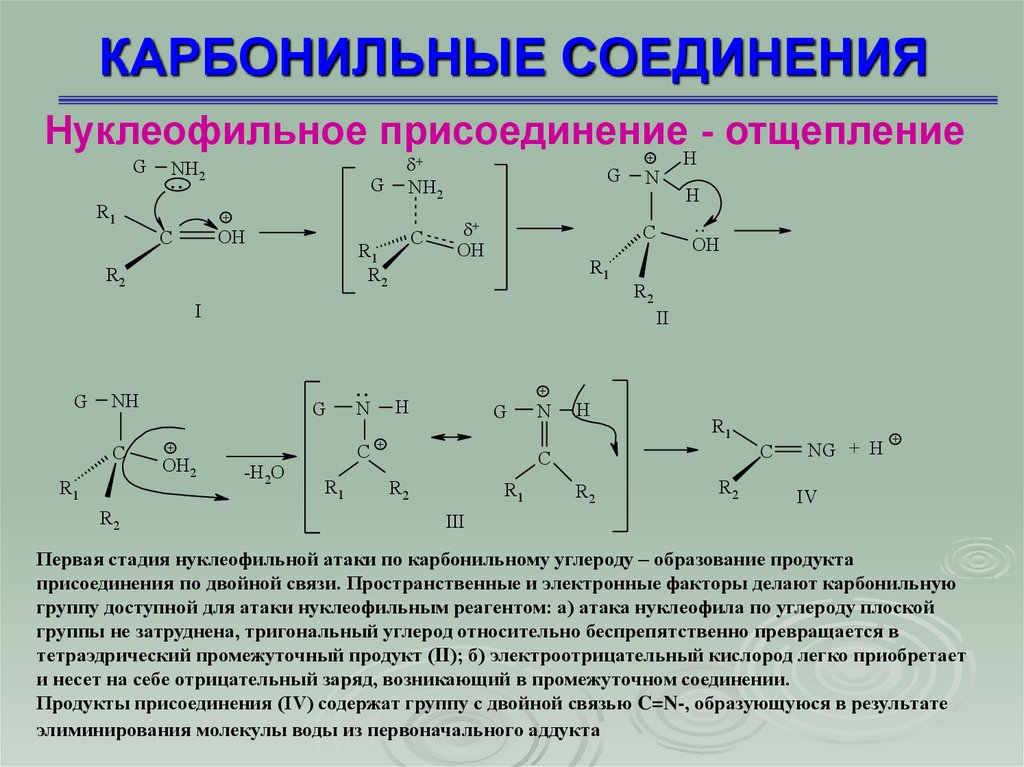
Первая стадия нуклеофильной атаки по карбонильному углероду – образование продукта
присоединения по двойной связи. Пространственные и электронные факторы делают карбонильную
группу доступной для атаки нуклеофильным реагентом: а) атака нуклеофила по углероду плоской
группы не затруднена, тригональный углерод относительно беспрепятственно превращается в
тетраэдрический промежуточный продукт (II); б) электроотрицательный кислород легко приобретает
и несет на себе отрицательный заряд, возникающий в промежуточном соединении.
Продукты присоединения (IV) содержат группу с двойной связью C=N-, образующуюся в результате
элиминирования молекулы воды из первоначального аддукта
40. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
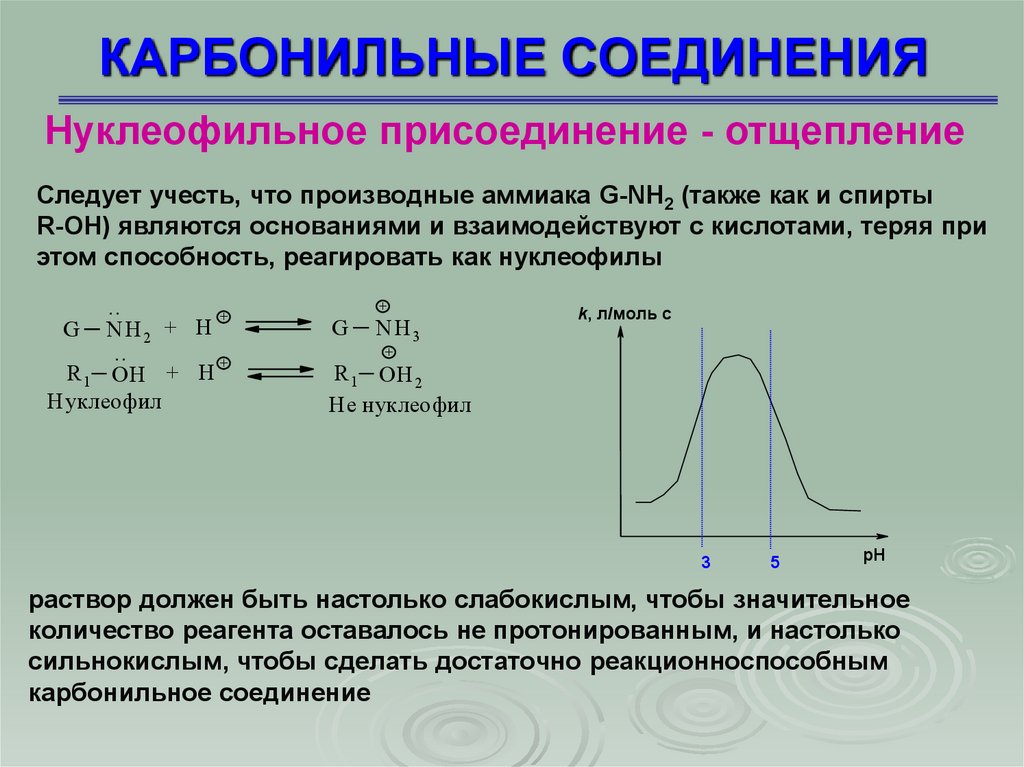
Нуклеофильное присоединение - отщеплениеСледует учесть, что производные аммиака G-NH2 (также как и спирты
R-OH) являются основаниями и взаимодействуют с кислотами, теряя при
этом способность, реагировать как нуклеофилы
..
NH 2 + H
+
..
R 1 OH + H
Нуклеофил
+
G
+
G
NH 3
k, л/моль с
+
R 1 OH 2
Не нуклеофил
3
5
pH
раствор должен быть настолько слабокислым, чтобы значительное
количество реагента оставалось не протонированным, и настолько
сильнокислым, чтобы сделать достаточно реакционноспособным
карбонильное соединение
41. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
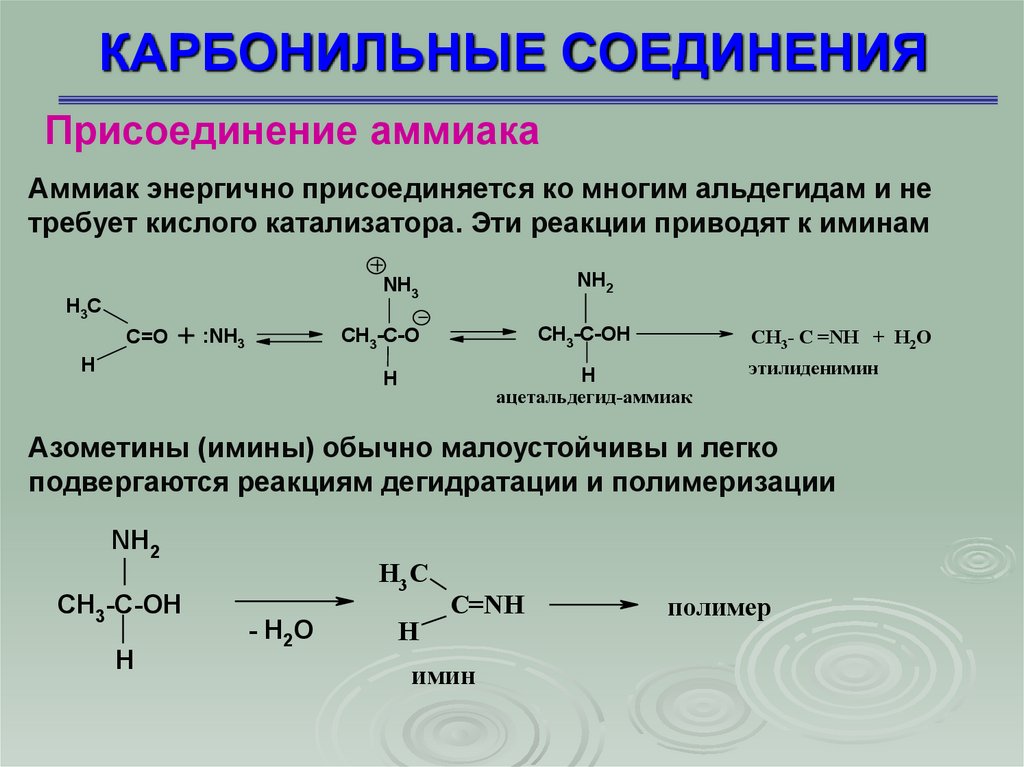
Присоединение аммиакаАммиак энергично присоединяется ко многим альдегидам и не
требует кислого катализатора. Эти реакции приводят к иминам
H3C
NH2
NH3
C=O :NH3
H
CH3- C =NH + H2O
CH3-C-O
CH3-C-OH
H
H
ацетальдегид-аммиак
этилиденимин
Азометины (имины) обычно малоустойчивы и легко
подвергаются реакциям дегидратации и полимеризации
NH2
CH3-C-OH
H
H3C
- H2O
H
C=NH
имин
полимер
42. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
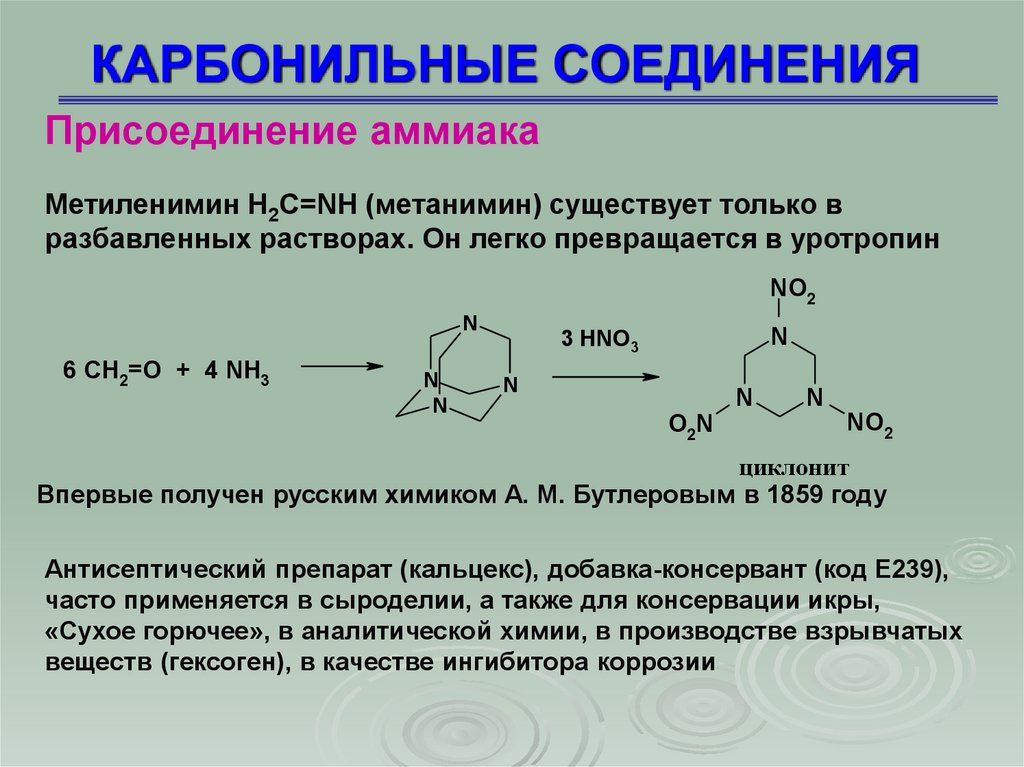
Присоединение аммиакаМетиленимин H2C=NH (метанимин) существует только в
разбавленных растворах. Он легко превращается в уротропин
NO2
N
6 CH2=O + 4 NH3
N
N
N
3 HNO3
N
N
O2N
N
NO2
циклонит
Впервые получен русским химиком А. М. Бутлеровым в 1859 году
Антисептический препарат (кальцекс), добавка-консервант (код E239),
часто применяется в сыроделии, а также для консервации икры,
«Сухое горючее», в аналитической химии, в производстве взрывчатых
веществ (гексоген), в качестве ингибитора коррозии
43. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
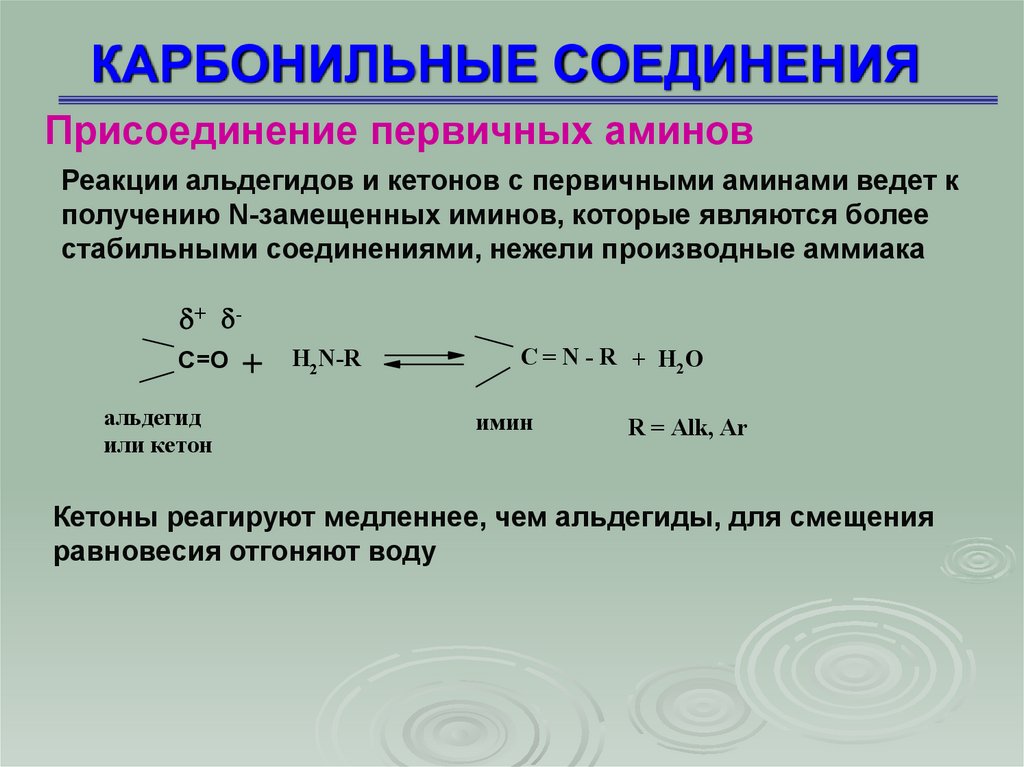
Присоединение первичных аминовРеакции альдегидов и кетонов с первичными аминами ведет к
получению N-замещенных иминов, которые являются более
стабильными соединениями, нежели производные аммиака
+ C=O
альдегид
или кетон
H2N-R
C = N - R + H2 O
имин
R = Alk, Ar
Кетоны реагируют медленнее, чем альдегиды, для смещения
равновесия отгоняют воду
44. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
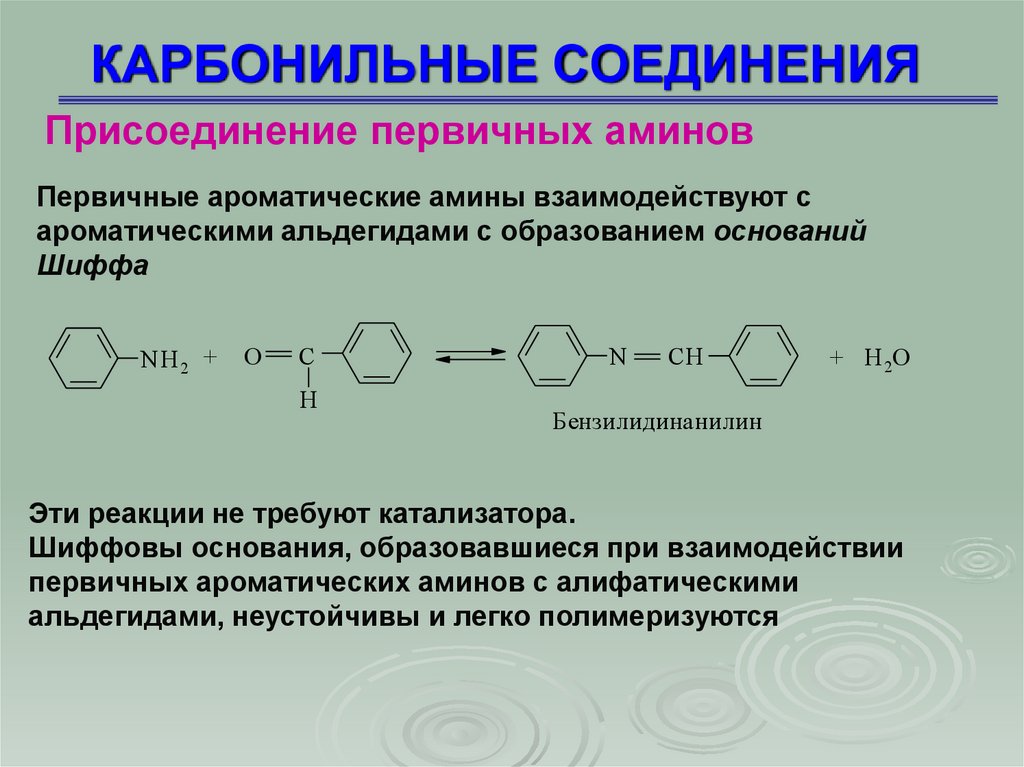
Присоединение первичных аминовПервичные ароматические амины взаимодействуют с
ароматическими альдегидами с образованием оснований
Шиффа
NH 2 +
O
C
H
N
CH
+ H 2O
Бензилидинанилин
Эти реакции не требуют катализатора.
Шиффовы основания, образовавшиеся при взаимодействии
первичных ароматических аминов с алифатическими
альдегидами, неустойчивы и легко полимеризуются
45. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Присоединение первичных аминовШИФФ
Хуго Йозеф
1834 – 1915
Хуго Йозеф Шифф – итальянский химик. В
1857 г. окончил Гёттингенский университет,
где учился у Ф. Вёлера. Основные
исследовательские работы относятся к
органической химии. В 1857 г. получил
тионилхлорид действием диоксида серы на
пентахлорид фосфора. Описал (1859)
методику капельного анализа. В 1864 г.
открыл продукты конденсации альдегидов с
анилином и другими аминами – азометины,
позднее названные основаниями Шиффа.
Предложил качественную реакцию на
альдегиды с фуксинсернистой кислотой
(реакция Шиффа), а также на фурфурол.
Синтезировал дигалловую кислоту. Создал
прибор для определения азота по способу,
предложенному Ж. Б. А. Дюма.
Совместно с другими выдающимися
итальянскими химиками, в числе которых
были Э. Патерно и С. Канниццаро, основал
в 1871 г. журнал «Gazzetta Chimica Italiana».
Написал биографию Дж. Пристли.
46. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
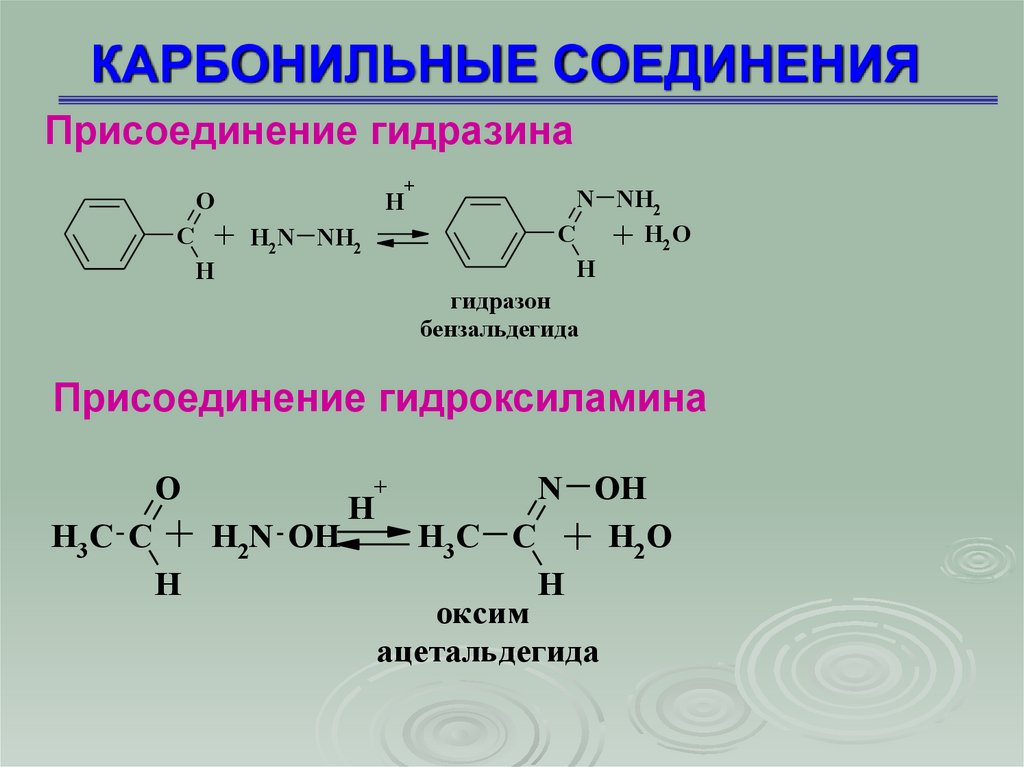
Присоединение гидразинаO
C
+ H2N NH2
+
H
H
N NH2
C
+ H2O
H
гидразон
бензальдегида
Присоединение гидроксиламина
O
N OH
H
H3 C C + H2N OH
H3 C C + H2 O
H
H
оксим
ацетальдегида
+
47. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
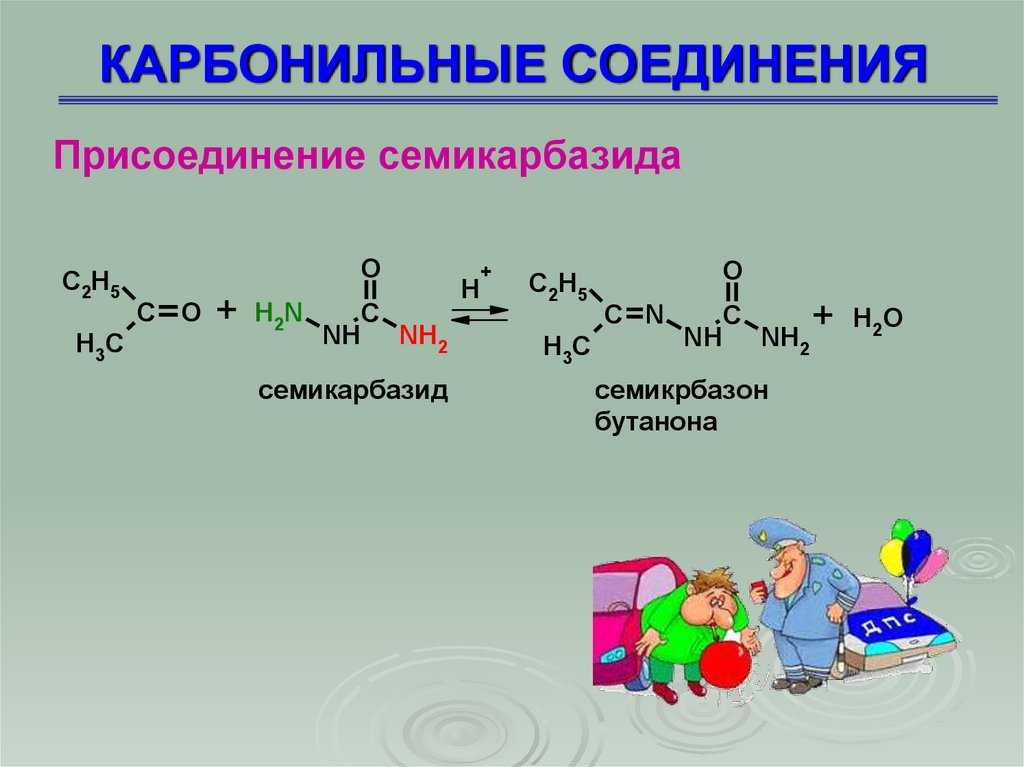
Присоединение семикарбазидаC2H5
H3C
O
C O + H2N
C
NH NH2
семикарбазид
H
+
C2H5
H3C
O
C N
C
+ H 2O
NH NH2
семикрбазон
бутанона
48. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
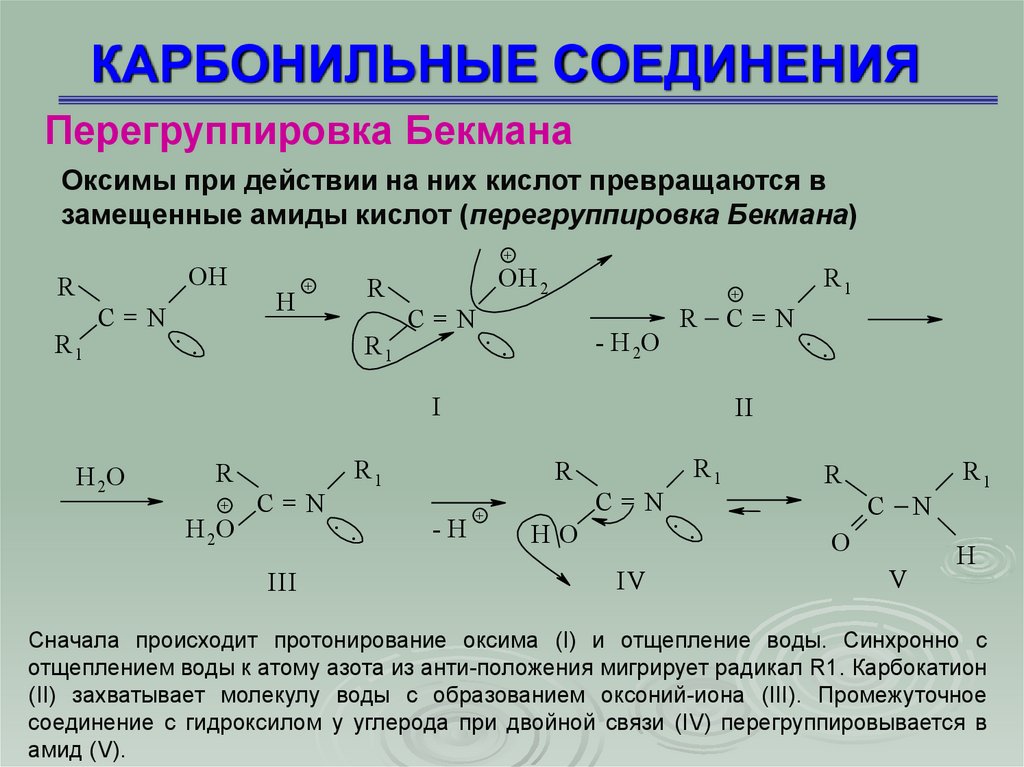
Перегруппировка БекманаОксимы при действии на них кислот превращаются в
замещенные амиды кислот (перегруппировка Бекмана)
OH
R
R1
С=N
..
+
H
OH 2
R
+
R1
С=N
+
..
- H 2O
R
I
H 2O
R
+
H 2O
С=N
III
R
-H
..
II
R1
..
С=N
R1
+
С=N
HO
IV
R1
..
R1
R
С
N
O
V
H
Сначала происходит протонирование оксима (I) и отщепление воды. Синхронно с
отщеплением воды к атому азота из анти-положения мигрирует радикал R1. Карбокатион
(II) захватывает молекулу воды с образованием оксоний-иона (III). Промежуточное
соединение с гидроксилом у углерода при двойной связи (IV) перегруппировывается в
амид (V).
49. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
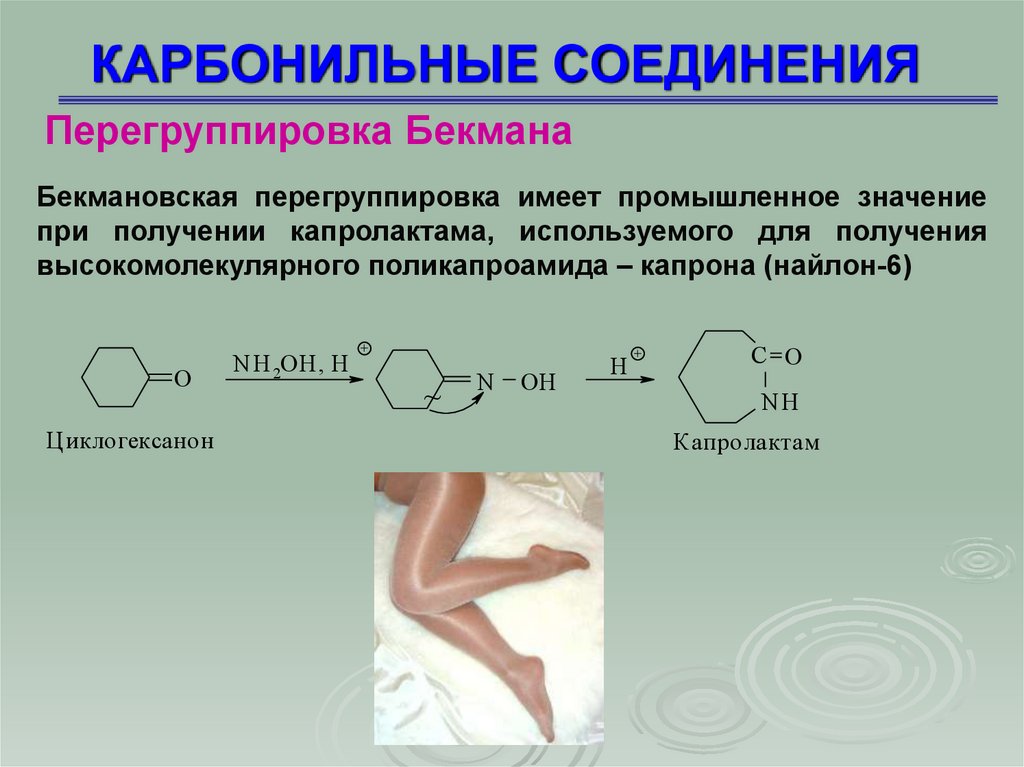
Перегруппировка БекманаБекмановская перегруппировка имеет промышленное значение
при получении капролактама, используемого для получения
высокомолекулярного поликапроамида – капрона (найлон-6)
O
Циклогексанон
NH 2OH, H
+
~
N
OH
H
+
C O
NH
Капролактам
50. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
БЕКМАНЭрнст Отто
1853 – 1923
Немецкий химик Эрнст Отто Бекман родился в
Золингене. С 1875 по 1878 гг. изучал химию и
фармацию в Лейпцигском университете.
Научные работы Бекмана относятся к
органической и физической химии. Исследовал
строение оксимов; в 1886 г. показал, что оксимы
под действием кислых агентов
перегруппировываются в амиды кислот
(перегруппировка Бекмана). В 1891 г. действием
металлического натрия на диарилкетоны
получил металлкетилы. Разработал методы
определения молекулярных масс растворённых
веществ на основании открытых Франсуа
Раулем законов – по понижению температуры
замерзания (1888) и по повышению температуры
кипения (1889) их разбавленных растворов.
Изобрёл термометр, позволяющий точно
определять температуры вблизи точек
замерзания или кипения – метастатический
(дифференциальный) термометр Бекмана.
51. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Реакции енольных форм альдегидов и кетоновОставить надежду,
всяк сюда входящий
52. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Реакции енольных форм альдегидов и кетоновСН-Кислотность и кетоенольная таутомерия
Под влиянием карбонильной группы атомы водороды,
находящиеся в -положении к карбонилу, приобретают кислый
характер, т.е. проявляют СН-кислотность. Этот эффект относится
только к -С – Н –связям. Это можно объяснить в терминах
резонансной стабилизации карбаниона, образующегося при
отщеплении протона у -угелеродного атома
O
O
O
CH3- C -CH3
CH2 - C CH3
CH2= C -CH3
+H
53. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
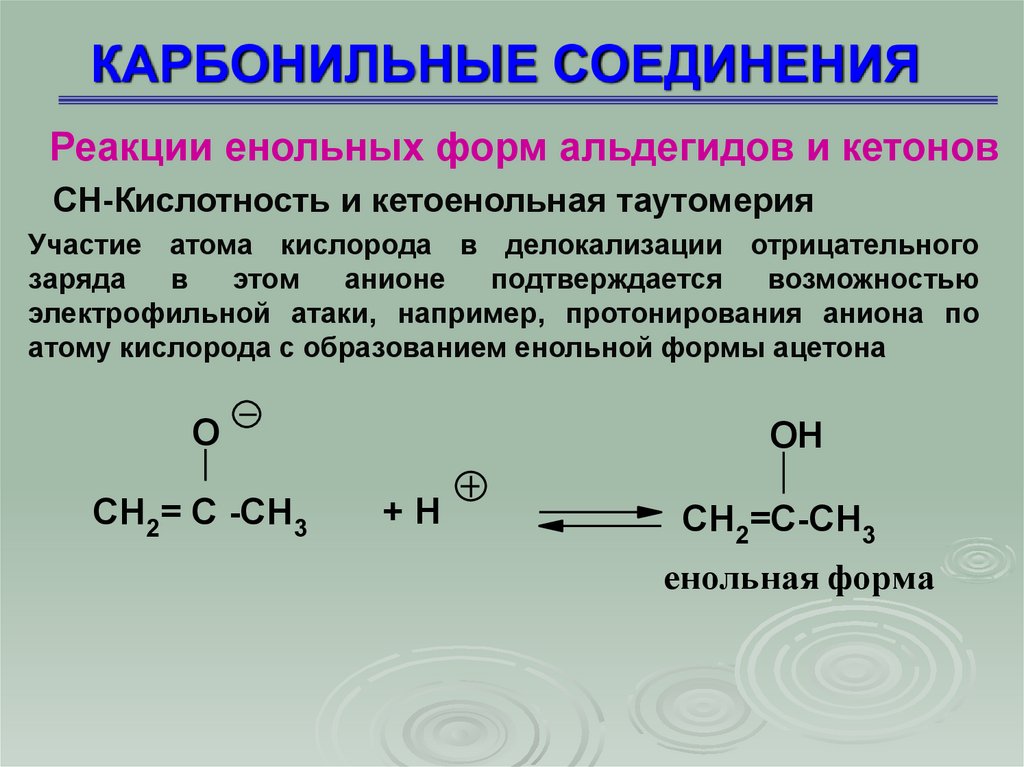
Реакции енольных форм альдегидов и кетоновСН-Кислотность и кетоенольная таутомерия
Участие атома кислорода в делокализации отрицательного
заряда
в
этом
анионе
подтверждается
возможностью
электрофильной атаки, например, протонирования аниона по
атому кислорода с образованием енольной формы ацетона
O
CH2= C -CH3
OH
+H
CH2=C-CH3
енольная форма
54. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
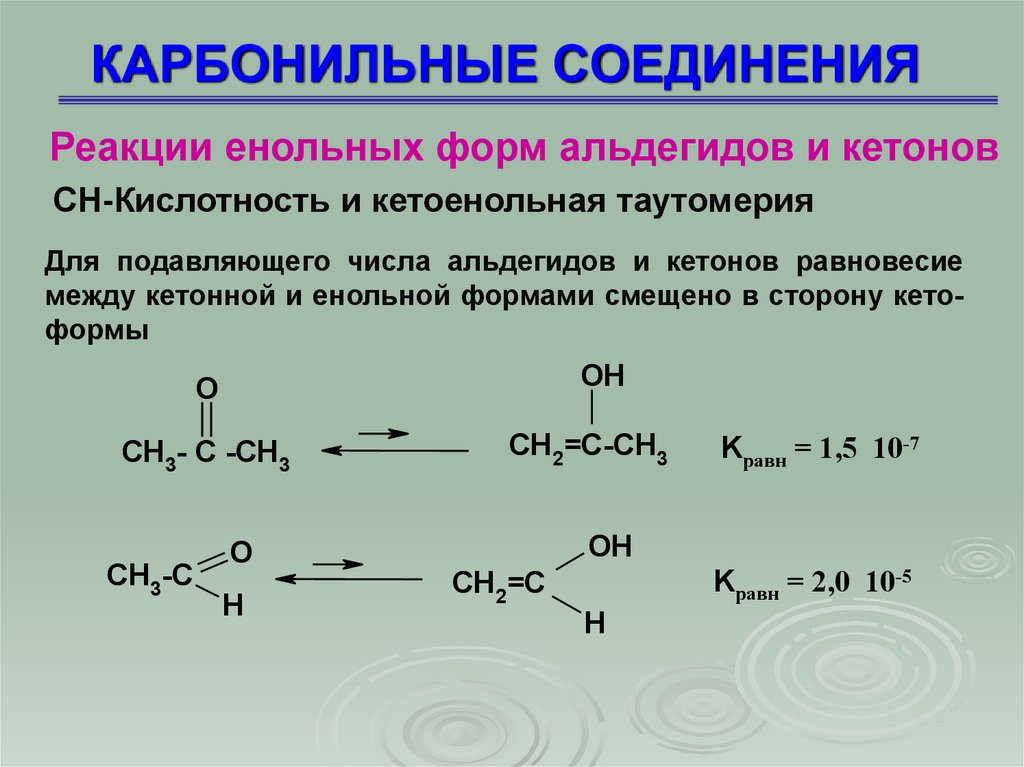
Реакции енольных форм альдегидов и кетоновСН-Кислотность и кетоенольная таутомерия
Для подавляющего числа альдегидов и кетонов равновесие
между кетонной и енольной формами смещено в сторону кетоформы
O
OH
CH3- C -CH3
CH2=C-CH3
CH3-C
OH
O
H
Kравн = 1,5 10-7
Kравн = 2,0 10-5
CH2=C
H
55. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Реакции енольных форм альдегидов и кетоновСН-Кислотность и кетоенольная таутомерия
Кетонная и енольная форма являются изомерами. Они
различаются положением атома водорода, двойной и простой
связей. Такой вид изомерии называется таутомерией. Для
альдегидов и кетонов это кето-енольная таутомерия. Хотя
содержание енольной фомы в альдегидах и кетонах невелико,
их способность переходить в енольную форму в значительной
мере определяет их химические свойства
56. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
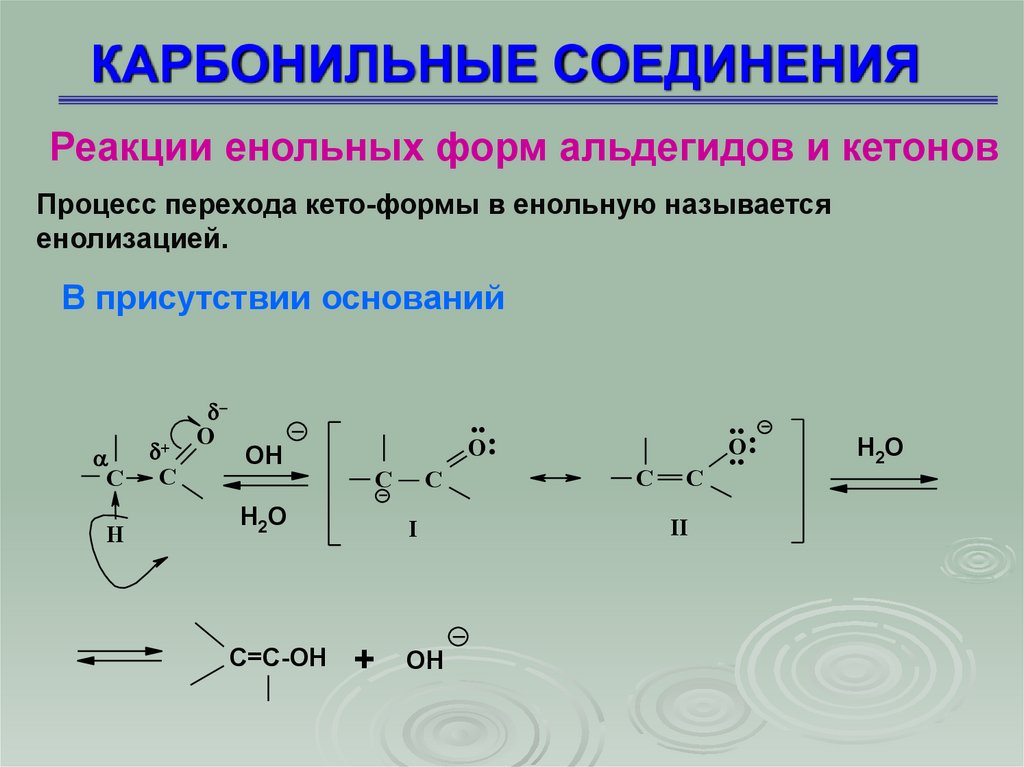
Реакции енольных форм альдегидов и кетоновПроцесс перехода кето-формы в енольную называется
енолизацией.
В присутствии оснований
C
H
C
O
..
OH
C
H2O
C=C-OH
..
O:
C
I
+
OH
C
C
II
O
.. :
H2O
57. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Нуклеофильное присоединение, нуклеофил– карбанион. Альдольная конденсация
Альдольная конденсация - это реакция, в которой карбонильное
соединение является одновременно и субстратом,
подвергающимся атаке нуклеофилом по карбонильной группе группе, и источником карбанионов – нуклеофилов
O
O
СH 3
C
+
H
СH 3
C
H
OH
OH
СH 3
C
H
O
СH 2
C
H
Альдоль
3-Гидроксибутаналь
58. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
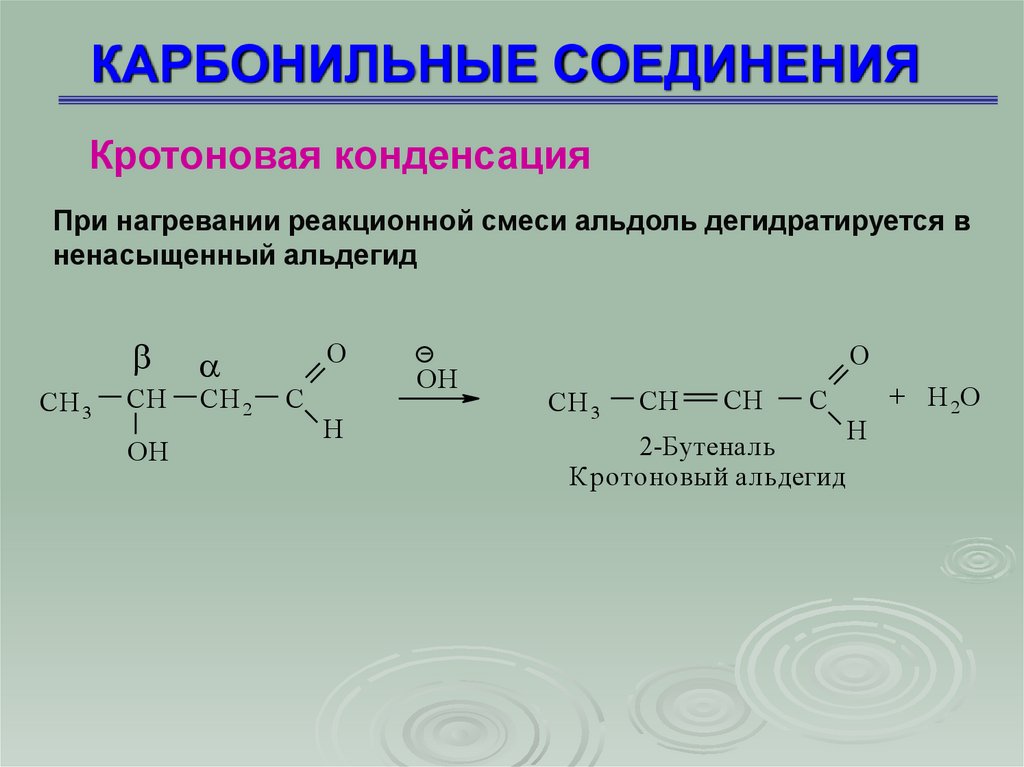
Кротоновая конденсацияПри нагревании реакционной смеси альдоль дегидратируется в
ненасыщенный альдегид
СH 3
CН
OH
СH 2
O
C
H
OH
O
СH 3
CН
СH
C
2-Бутеналь
Кротоновый альдегид
H
+ H 2O
59. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Кротоновая конденсацияПротекание реакции дегидратации можно объяснить тем, что
альдоль содержит -Н-атомы, которые могут легко отщепляться
основанием с образованием карбаниона, имеющего достаточно
хорошо уходящую группу –ОН у соседнего ( ) атома углерода
OH
H
CH3 - C - CH2 - CH-CHO
OH
+ OH
СH3 CH-CH-CHO
- OH
O
CH3 CH CH
C
H
Легкость протекания и направление реакции дегидратации также
обусловлены устойчивостью образующегося алкена: двойная
углерод–углеродная связь сопряжена с двойной углеродкислородной связью карбонила. В тех случаях, когда в
образующихся алкенах в систему сопряжения включено
ароматическое кольцо, альдоль выделить не удается
60. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
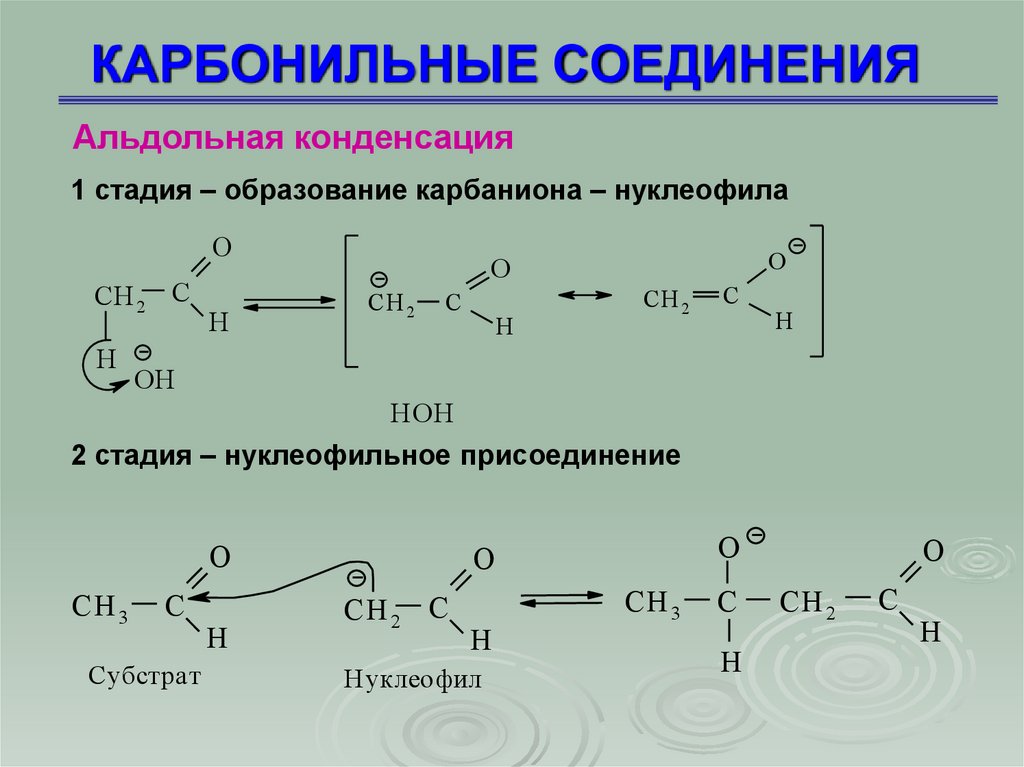
Альдольная конденсация1 стадия – образование карбаниона – нуклеофила
O
СH 2 C
H
H
O
O
CН 2
C
H
CН 2
C
H
OH
HOH
2 стадия – нуклеофильное присоединение
O
СH 3
C
Субстрат
H
O
O
СH 2 C
H
Нуклеофил
СH 3
C
H
O
СH 2
C
H
61. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
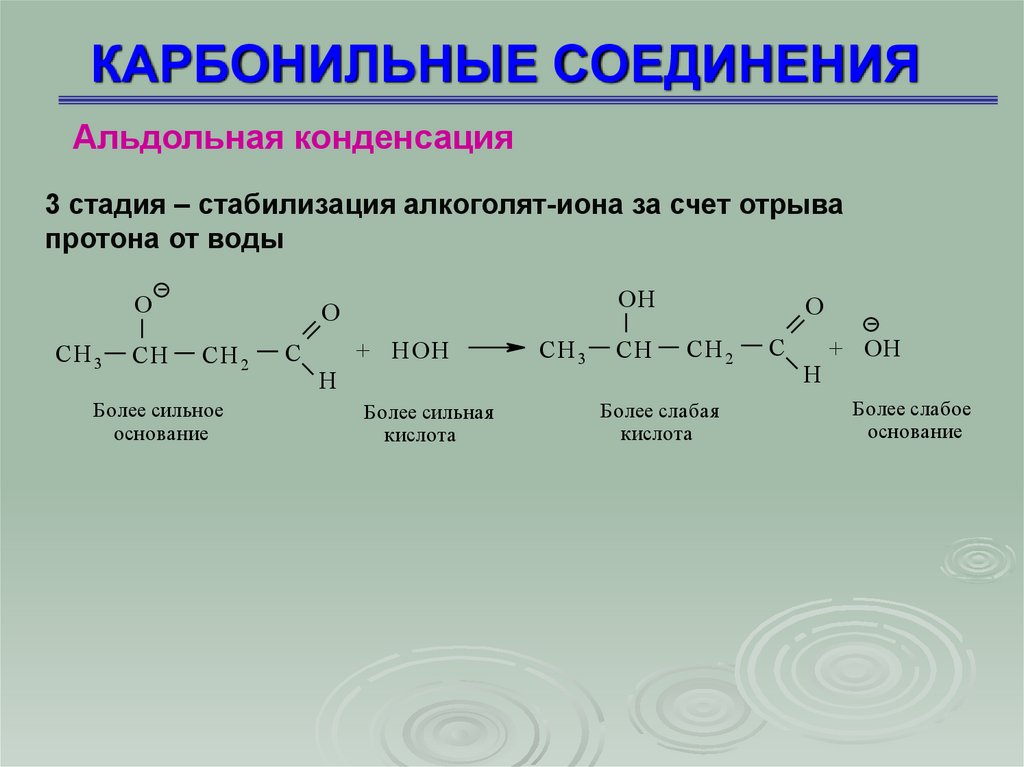
Альдольная конденсация3 стадия – стабилизация алкоголят-иона за счет отрыва
протона от воды
O
СH 3
CH
OH
O
СH 2
Более сильное
основание
C
+ H OH
H
Более сильная
кислота
СH 3
CH
O
СH 2
Более слабая
кислота
C
H
+ OH
Более слабое
основание
62. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
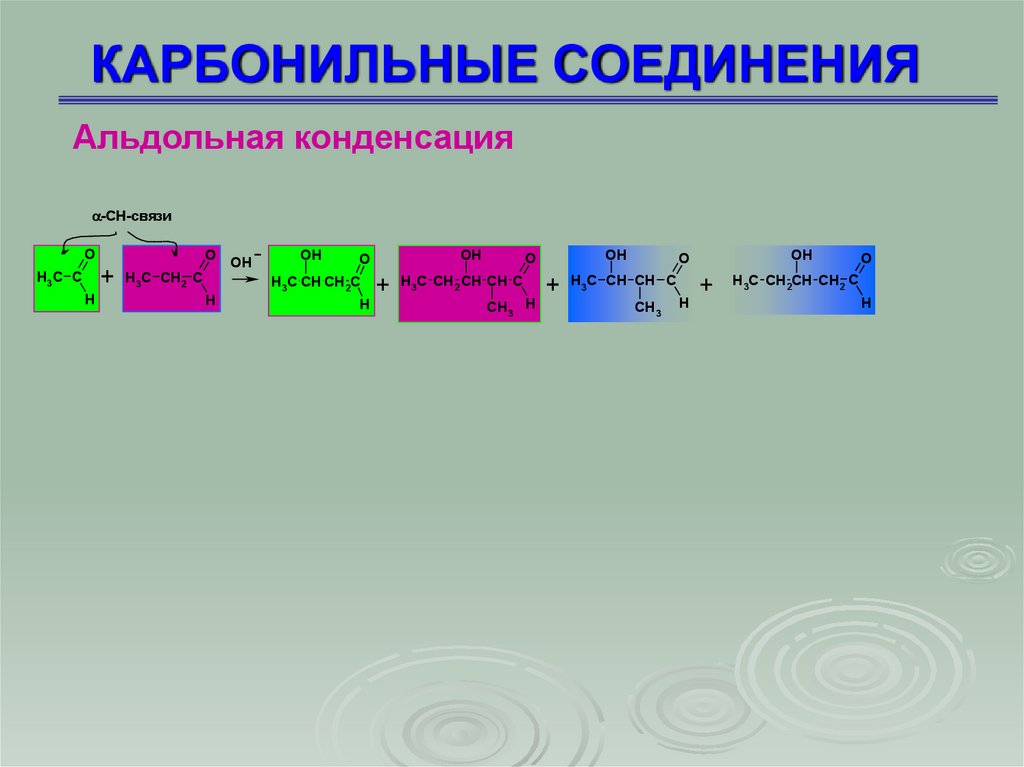
Альдольная конденсация-СН-связи
O
O
+
H3 C C
H
H3C CH2 C
H
OH
OH
O
H3C CH CH2C
H
OH
O
OH
O
+ H3C CH2 CH CH C + H3C CH CH C +
CH3 H
CH3
H
OH
O
H3C CH2CH CH2 C
H
63. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Альдольная конденсацияЕсли карбонильное соединение не содержит -водородного
атома, то простой альдольной конденсации не происходит
O
O
C
H
; H
C
H
; CH
3
CH 3
O
;
C C
H
CH 3
C
CH 3
C C CH 3
O
O
N aOH (разб.)
Aльдольной конденсации не происходит,
отсутствуют водородные атомы у углерода
;
CH 3
64. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
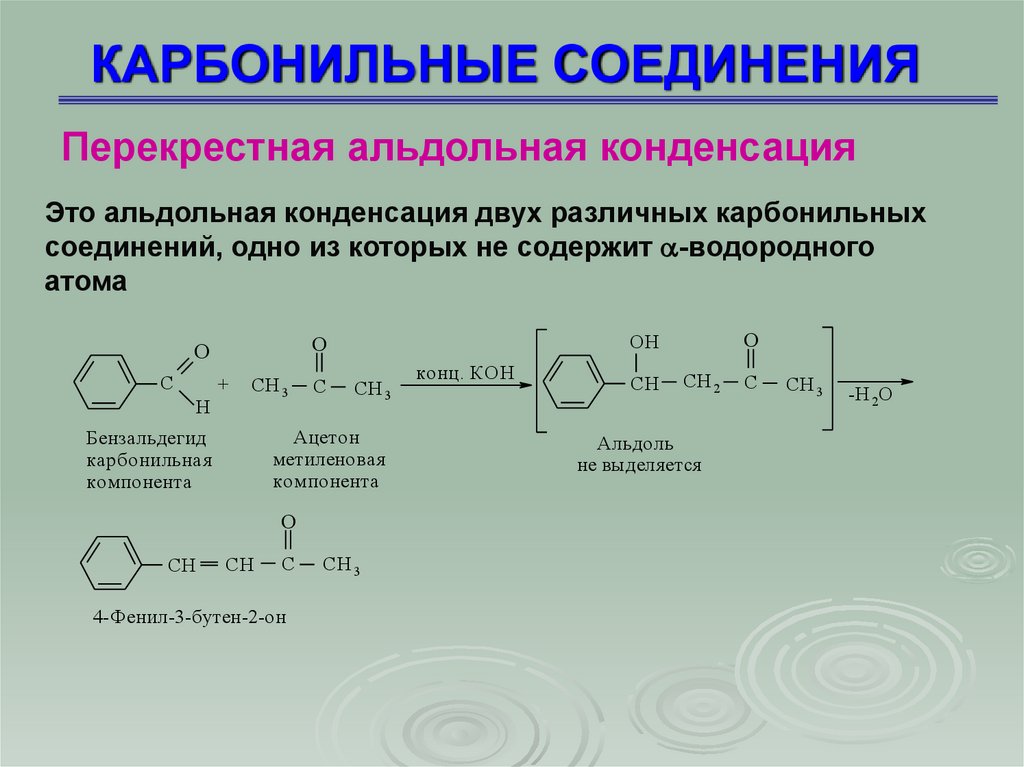
Перекрестная альдольная конденсацияЭто альдольная конденсация двух различных карбонильных
соединений, одно из которых не содержит -водородного
атома
C
+
H
СH 3
C
СH 3
Ацетон
метиленовая
компонента
Бензальдегид
карбонильная
компонента
O
CH
СH
C
4-Фенил-3-бутен-2-он
O
OH
O
O
СH 3
конц. КОН
CH
СH 2
Альдоль
не выделя ется
C
СH 3
-H 2O
65. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Перекрестная альдольная конденсация-СН-связи
O
+ H3C CH2 C
C
O
H
бензальдегид
H
пропаналь
карбонильная
компонента
метиленовая
компонента
O
O
3 H
C
H
+HC C
3
H
O
NaOH, H2O, 60 OC
HC C C
(68%)
CH3 H
2-метил-3-фенилпентеналь
Na2СO3, H2O, 40 OC
CH2OH O
HOCH2 C
C
(82%)
CH2OH H
3-гидрокси-2,2-ди(гидроксиметил)пропаналь
66. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Перекрестная альдольная конденсация-СН-связи
O
H3C CH2 C
NaOH, H2O, 60 OC
O
O
H3C CH C
CH3 CH C
H
H
пропаналь
H
метиленовая
компонента
O
+
H3C CH C
H
O
O
C
+
H
карбонильная
компонента
CH C
CH3
OH
HC
HC
O
O
O
CH C
CH3
H
H
HC C C
CH3 H
2-метил-3-фенилпентеналь
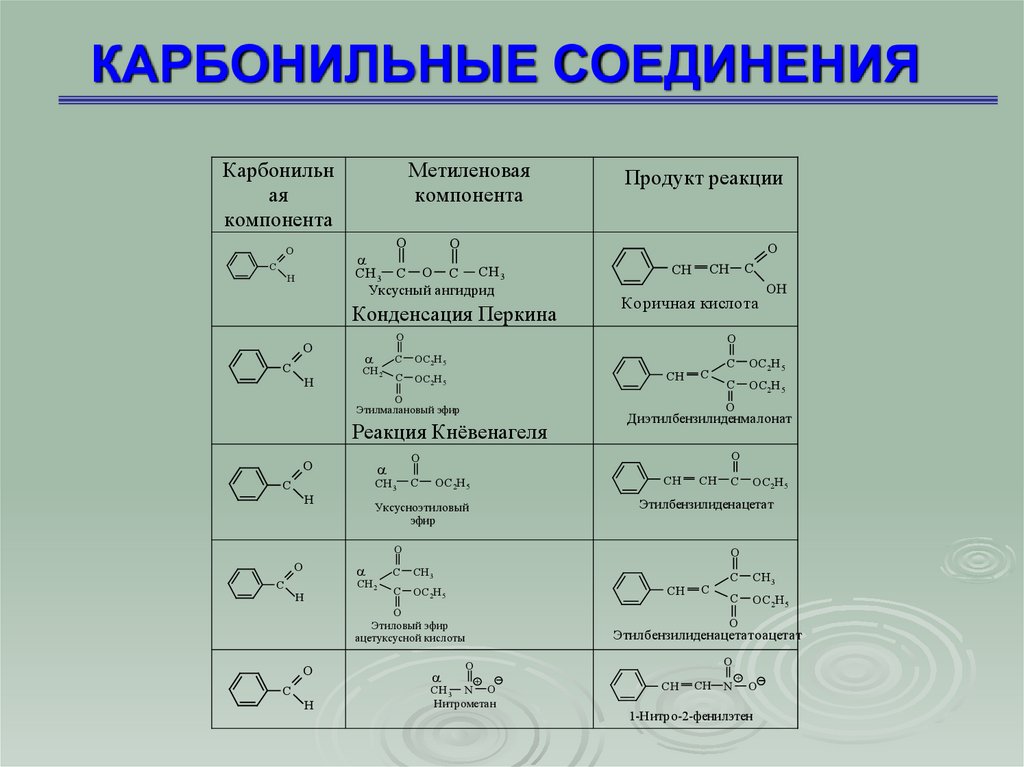
67. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Карбонильная
компонента
Метиленовая
компонента
O
O
СH 3 C O C СH 3
Уксусный ангидрид
O
C
H
Конденсация Перкина
O
C
H
Продукт реакции
O
Коричная кислота
O
СH 2
OC 2H 5
C
OC 2H 5
CH
H
C
CH
OC 2H 5
СH 2
H
C
H
OC 2H 5
СH
C
OC 2H 5
O
C
CH 3
C
OC 2H 5
CH
O
Этиловый эфир
ацетуксусной кислоты
O
C
Этилбензилиденацетат
Уксусноэтиловый
эфир
C
OC 2H 5
O
O
O
C
Диэтилбензилиденмалонат
O
CH 3
C
С
O
Реакция Кнёвенагеля
OH
O
C
O
Этилмалановый эфир
O
C
CH
CH
С
C
CH 3
C
OC 2H 5
O
Этилбензилиденацетатоацетат
O
O
+
CH 3 N O
Нитрометан
CH
СH
N
+
O
1-Нитро-2-фенилэтен
68. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
ПеркинУильям Генри
1838 - 1907
С 1853 ученик, а затем ассистент Августа Гофмана в
Королевском химическом колледже в Лондоне. В
1884—1885 гг. президент британского Общества
химической промышленности.
В 1856 году Перкин пытался создать новое лекарство
от малярии и, экспериментируя с каменноугольной
смолой, получил пурпурную краску, которую позже
назвал мовеин (от английского названия цветка
мальвы) — один из первых синтетических
органических красителей.
Огромная заслуга Перкина в том, что он оценил
практическое значение своего открытия и уже через
год организовал производство мовеина, а также
нитробензола и анилина, необходимых для его
синтеза. Поэтому 1856 год считается датой
возникновения промышленности синтетических
красителей и производства смоляных (анилиновых)
красителей. Также он открыл (1868 г.) способ
получения ароматических ненасыщенных (βарилакриловых) кислот; исследовал зависимость
вращения плоскости поляризации света в магнитном
поле от структуры соединения. В конце концов Перкин
так преуспел в производстве красителей, что бросил
науку и под конец жизни был возведен в рыцари и
стал сэром.
69. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
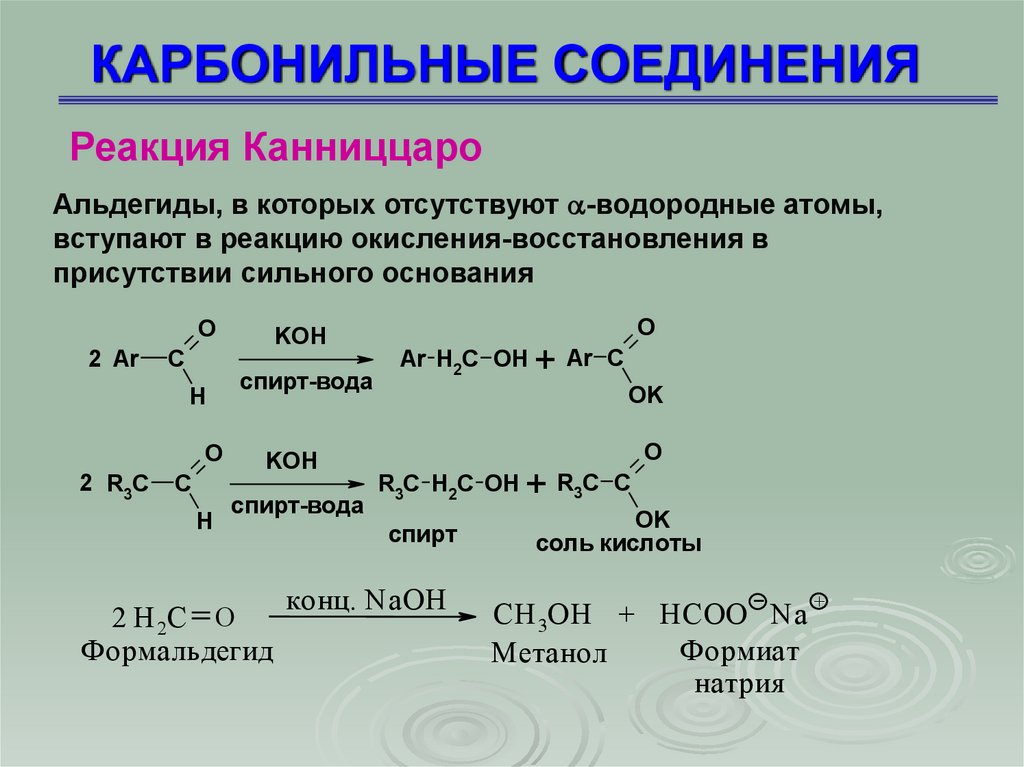
Реакция КанниццароАльдегиды, в которых отсутствуют -водородные атомы,
вступают в реакцию окисления-восстановления в
присутствии сильного основания
O
2 Ar
C
H
O
2 R3C
C
H
KOH
спирт-вода
KOH
спирт-вода
2 H 2C O
Формальдегид
Ar H2C OH
R3C H2C OH
спирт
конц. NaOH
+ Ar C
O
OK
+ R3C C
O
OK
соль кислоты
CH 3OH + HCOO Na
Формиат
Метанол
натрия
+
70. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
СтанислаоКанниццаро
:
1826 - 1910
71. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
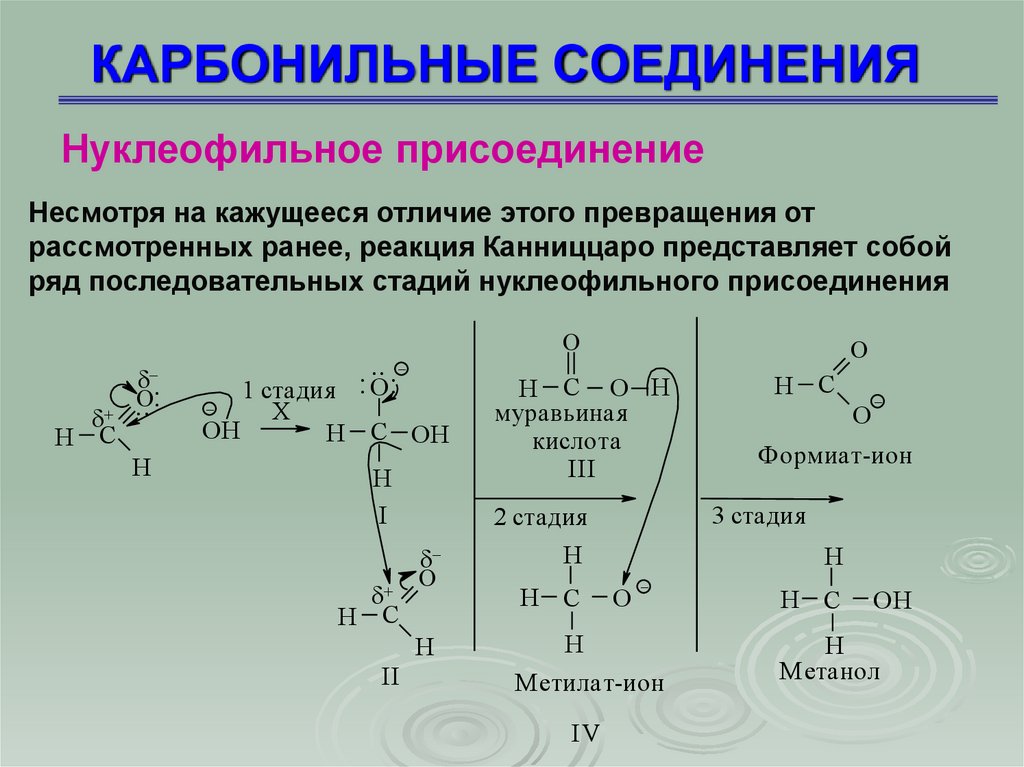
Нуклеофильное присоединениеНесмотря на кажущееся отличие этого превращения от
рассмотренных ранее, реакция Канниццаро представляет собой
ряд последовательных стадий нуклеофильного присоединения
H
..O:
C
H
..
O
_
1 cтадия : O :
Х
OH
H C OH
_
H
I
H C
H C O H
муравьиная
кислота
III
O
H
О
С
Н
О
_
Н
М етилат-ион
IV
_
Формиат-ион
Н
Н
C
3 cтадия
2 cтадия
H
II
O
Н
С
ОН
Н
М етанол
72. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Нуклеофильное присоединение1 стадия – нуклеофильное присоединение иона ОН с
образованием промежуточного соединения (I);
2 стадия – превращение иона (I) в молекулу кислоты путем
отщепления от него гидрид-иона Н , который является
нуклеофилом в реакции присоединения ко второй молекуле
альдегида (II), анион (I) превращается в муравьиную кислоту
(III);
3 стадия – перенос протона от более слабого основания
формиат-иона к более сильному метилат-иону (IV)
73. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
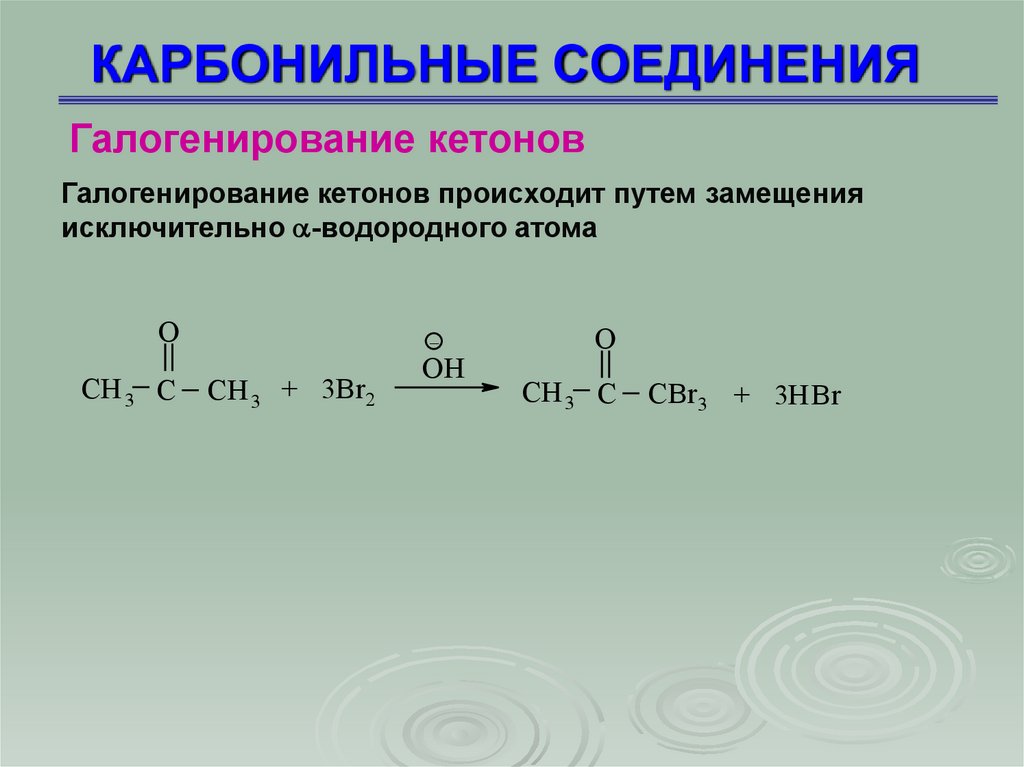
Галогенирование кетоновГалогенирование кетонов происходит путем замещения
исключительно -водородного атома
O
CH 3 C
_
CH 3 + 3Br 2
OH
O
CH 3 C
CBr 3 + 3HBr
74. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Галогенирование кетонов1 стадия – медленная: основание отрывает протон от ацетона,
образуя карбанион (I)
_
O
CH3 C
_
CH3 + OH
O
медленно
CH3 C
О
_
CH2
CH3 C
CH2
+ H
OH
I
еноля т-ион
2 стадия – быстрая: анион (I) взаимодействует с молекулой брома,
поляризованной под влиянием отрицательного заряда
карбаниона
O
CH 3 C
O
_
CH 2
Br : Br
быстро
CH 3 C
_
CH 2Br
+ Br
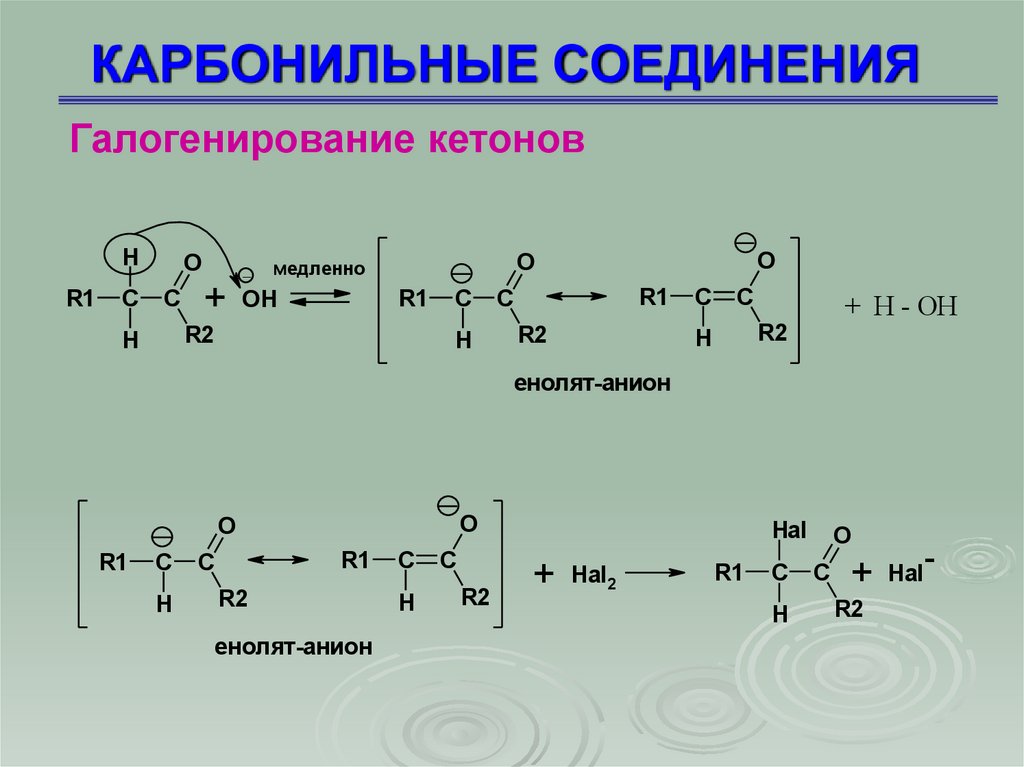
75. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Галогенирование кетоновH
R1
C
O
C
_
+ OH
R1
R2
H
O
O
медленно
C
H
R1
C
R2
C
C
+ H - OH
R2
H
енолят-анион
O
O
R1
C
H
R1
C
R2
енолят-анион
C
H
C
R2
Hal
+ Hal2
R1
C
H
O
C
+ Hal-
R2
76. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Галогенирование кетоновСкорость реакции зависит от концентрации ацетона и основания,
но не зависит от концентрации брома; скорость галогенирования
не зависит также от природы галогена, будь то хлор, бром или
иод.
Последующее замещение атомов водорода протекает быстрее
O
CH 3 C
CH 2Br
Br 2, OH
O
CH 3 C
CHBr 2
Br 2, OH
O
CH 3 C
CBr 3
77. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
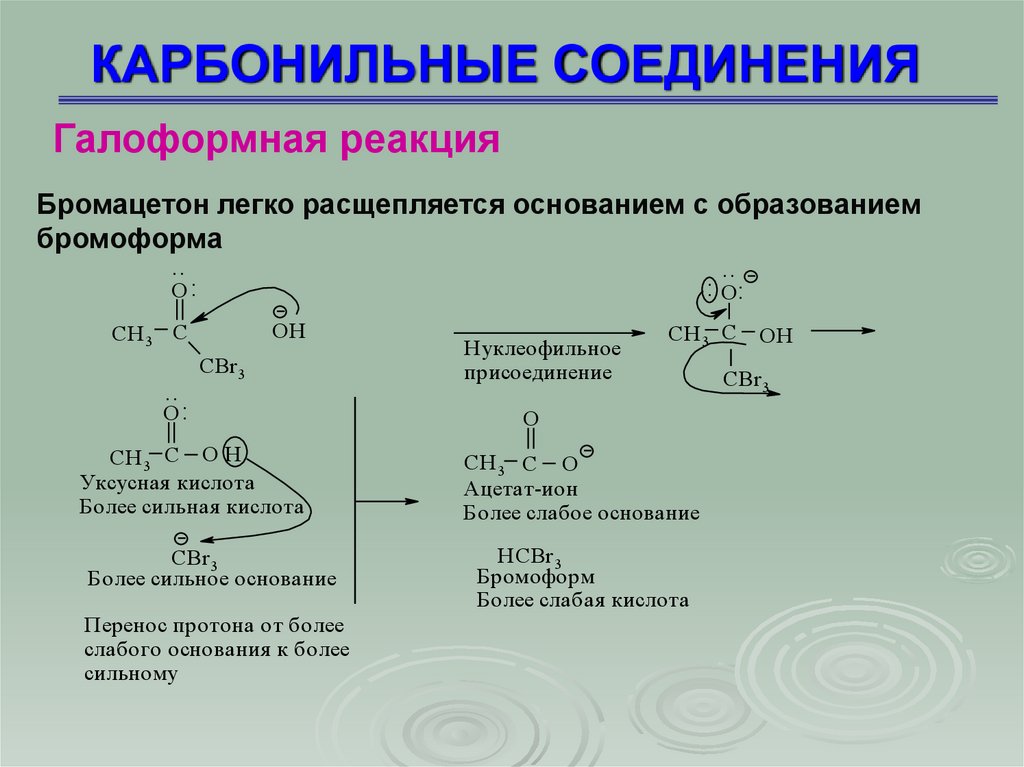
Галоформная реакцияБромацетон легко расщепляется основанием с образованием
бромоформа
..
..
: O:
O:
OH
CH 3 C
..
CBr 3
O:
Н уклеофильное
присоединение
CH 3 C
O
CH 3 C O H
Уксусная кислота
Более сильная кислота
CH 3 C O
Ацетат-ион
Более слабое основание
CBr 3
Более сильное основание
H CBr 3
Бромоформ
Более слабая кислота
Перенос протона от более
слабого основания к более
сильному
OH
CBr 3
78. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
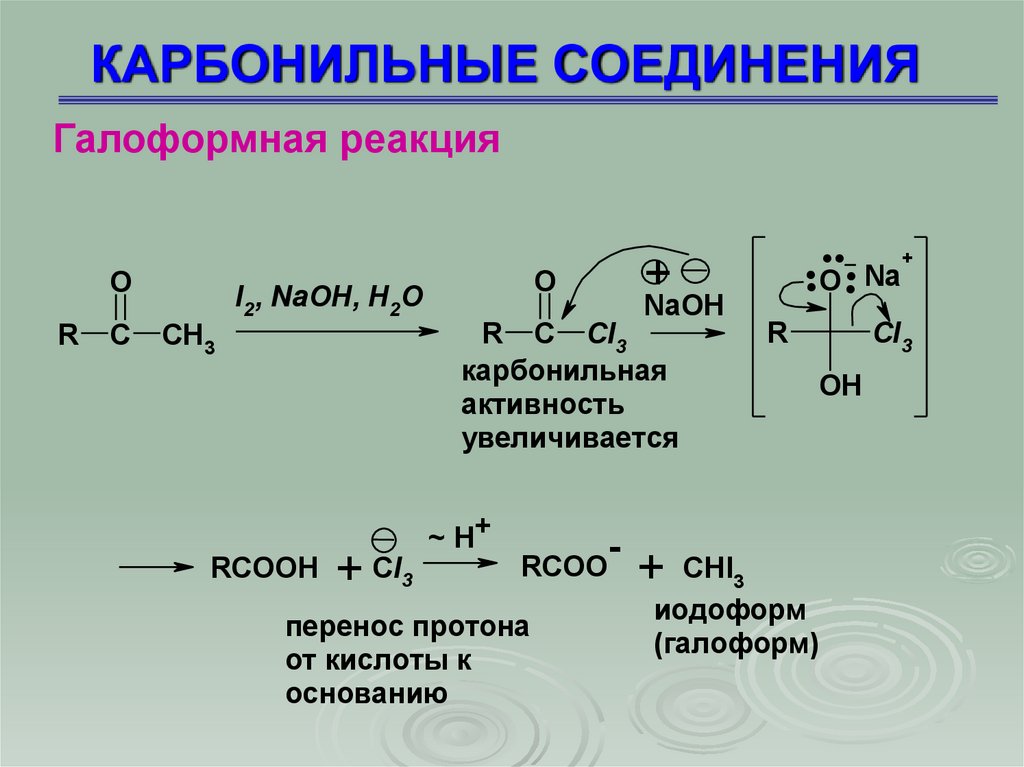
Галоформная реакцияO
R
C
CH3
I2, NaOH, H2O
RCOOH
+
CI3
+
O
NaOH
R C CI3
карбонильная
активность
увеличивается
~ H+
RCOO
перенос протона
от кислоты к
основанию
....
-
O Na
+
CI3
R
OH
+ CHI3
иодоформ
(галоформ)
79. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
80. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Взаимодействие альдегидов и кетоновс пентахлоридом фосфора
Альдегиды и кетоны при взаимодействии с РCl5 обменивают атом
кислорода на два атома хлора, что используется для получения
геминальных дихлоралканов (оба атома хлора присоединяются к
одному и тому же атому углерода
Cl
С Cl
O
СН 3СН 2
С
+ PCl5
СН 3СН 2
H
H
Пропионовый
альдегид
1,1-Дихлорпропан
O
Cl
СН 3СН 2 С
Бутанон
СН 3 + PCl5
+ POCl3
СН 3СН 2
С
СН 3 + POCl3
Cl
2,2-Дихлорбутан
81. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
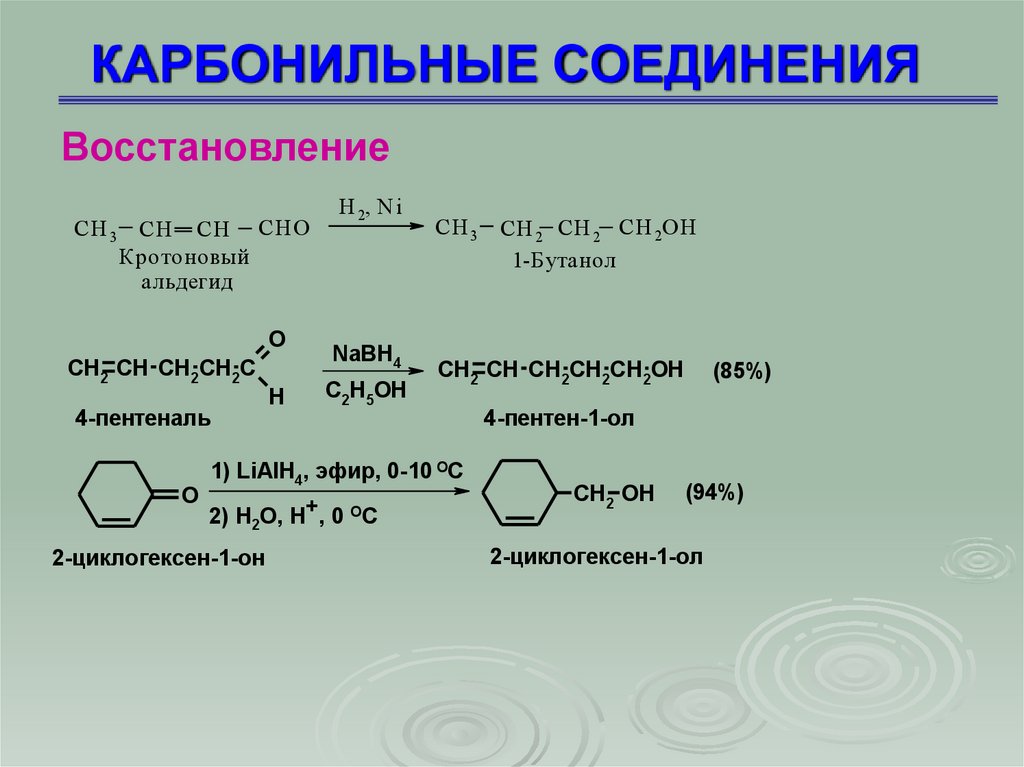
ВосстановлениеCH 3 CН CH СНО
Кротоновый
альдегид
O
CH2 CH CH2CH2C
4-пентеналь
O
H
Н 2, N i
NaBH4
C2H5OH
CH 3 CН 2 CH 2 СН 2ОH
1-Бутанол
CH2 CH CH2CH2CH2OH
1) LiAlH4, эфир, 0-10 ОС
2) H2O, H+, 0 OC
2-циклогексен-1-он
(85%)
4-пентен-1-ол
CH2 OH
(94%)
2-циклогексен-1-ол
82. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
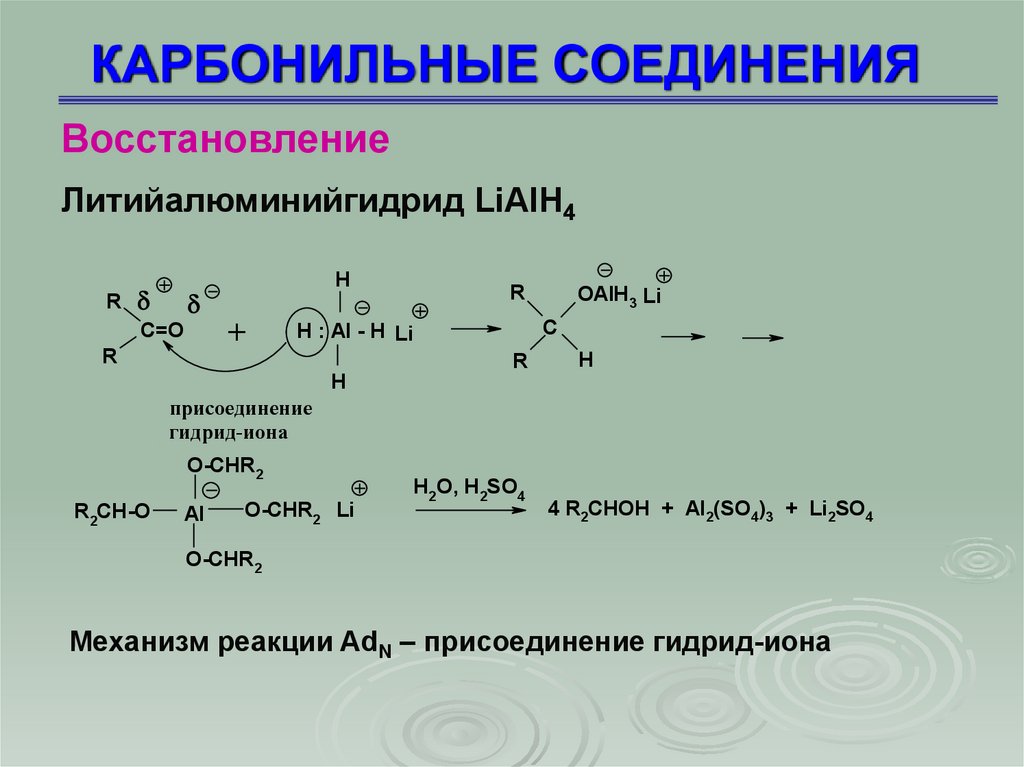
ВосстановлениеЛитийалюминийгидрид LiAlН4
R
C=O
R
H
+
R
OAlH3 Li
C
H : Al - H Li
R
H
H
присоединение
гидрид-иона
O-CHR2
R2CH-O
Al
O-CHR2 Li
H2O, H2SO4
4 R2CHOH + Al2(SO4)3 + Li2SO4
O-CHR2
Механизм реакции AdN – присоединение гидрид-иона
83. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
ВосстановлениеВосстановление по Клеменсону
СOCH 2CH 3
Zn(H g), H Cl
СH 2CH 2CH 3
Восстановление по Кижнеру-Вольфу
CH2
CH2
C=O
H2C
CH2
+ NH2-NH2
KOH, 150 oC
H2C
CH2
CH2
+ N2 + H2O
84. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
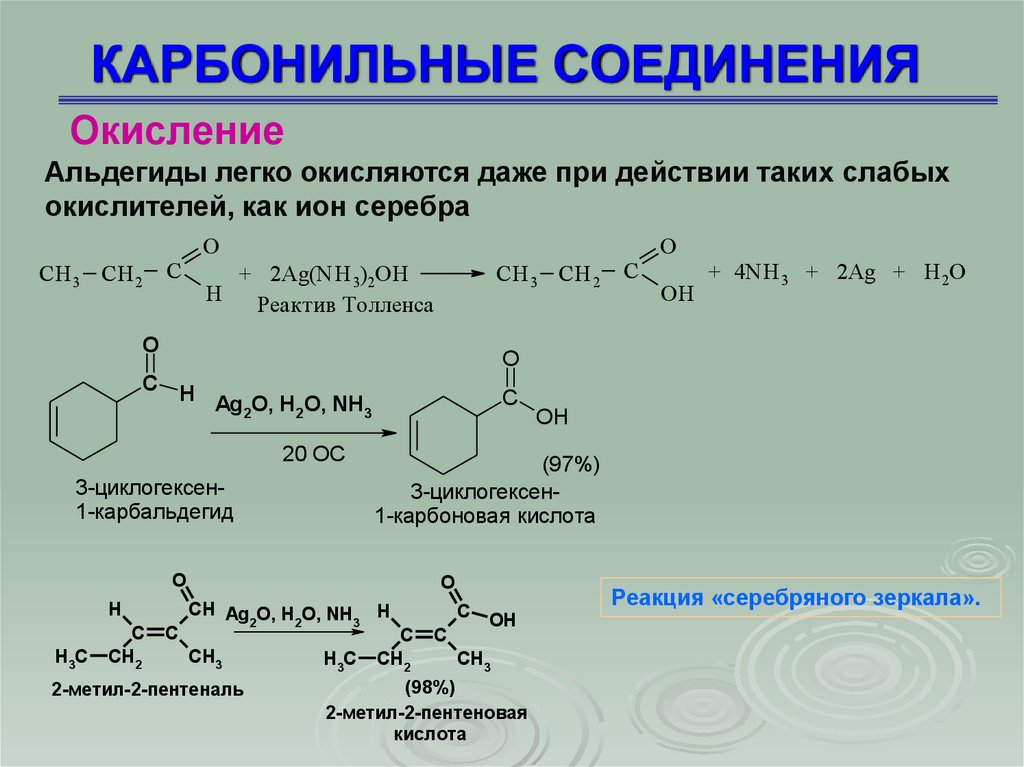
ОкислениеАльдегиды легко окисляются даже при действии таких слабых
окислителей, как ион серебра
CH 3 CH 2
C
O
CH 3 CH 2
+ 2Ag(NH 3)2OH
H
Реактив Толленса
O
20 OC
C
O
H
C
O
CH Ag O, H O, NH
2
CH3
2-метил-2-пентеналь
2
OH
(97%)
3-циклогексен1-карбоновая кислота
3-циклогексен1-карбальдегид
H3C
ОH
+ 4NH 3 + 2Ag + Н 2О
O
C H
Ag2O, H2O, NH3
C
CH2
C
O
3
H3C
H
C
CH2
C
C OH
CH3
(98%)
2-метил-2-пентеновая
кислота
Реакция «серебряного зеркала».
85. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
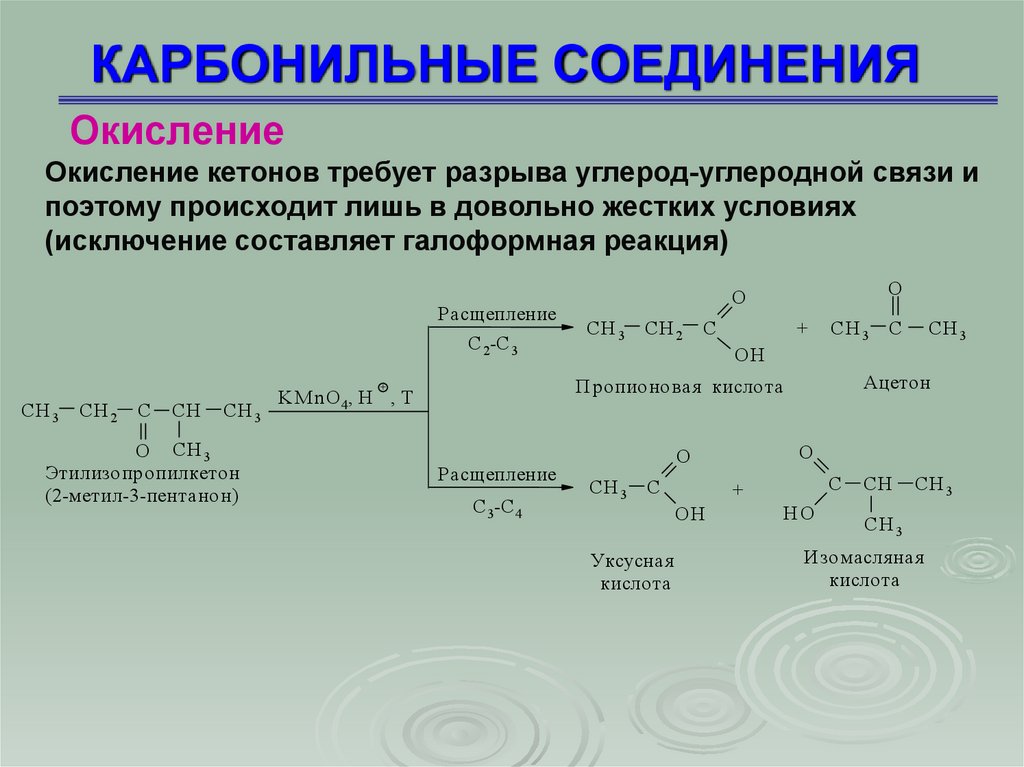
ОкислениеОкисление кетонов требует разрыва углерод-углеродной связи и
поэтому происходит лишь в довольно жестких условиях
(исключение составляет галоформная реакция)
Расщепление
С 2-С 3
CH 2
C
CH
CH 3
O CH 3
Этилизопропилкетон
(2-метил-3-пентанон)
СН 3
СН 2
С
+
СН 3
KM nO 4, H , T
Расщепление
С 3-С 4
С
СН 3
ОН
Ацетон
Пропионовая кислота
+
СH 3
O
O
O
O
СН 3
С
ОН
Уксусная
кислота
С
+
НО
СН
СН 3
СН 3
Изомасля ная
кислота
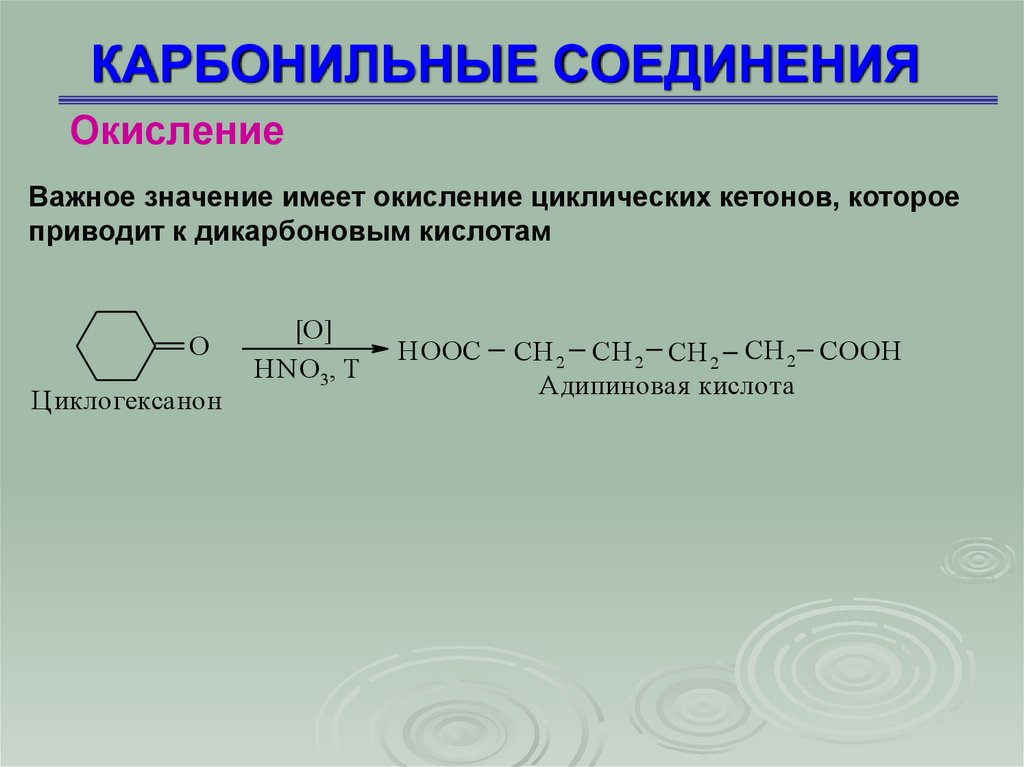
86. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
ОкислениеВажное значение имеет окисление циклических кетонов, которое
приводит к дикарбоновым кислотам
O
Циклогексанон
[O]
HNO 3, T
HOOC
CH 2 CH 2 CH 2 CH 2 COOH
Адипиновая кислота
87. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Отдельные представителиМуравьиный альдегид
Муравьиный альдегид (формальдегид) – бесцветный газ с резким
запахом, очень ядовит. Хорошо растворим в воде (40 % р-ор
формалин). Получают в промышленности неполным окислением
метана и каталитическим окислением метанола при 650-700 Сна
серебряном катализаторе. Используется для получения
фенолформальдегидных смол, уротропина, пентаэритрита
CH2OH
CH3CHO + 3 CH2O
OH
HOCH2 -C- CHO
CH2OH
OH
CH2OH
CH2OH
HOCH2 -C- CH2OH
CH2OH
При нитровании получают пентаэритриттетранитрат – ВВ
88. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Отдельные представителиУксусный альдегид
Уксусный альдегид получают гидратацией ацетилена,
дегидрированием этилового спирта, изомеризацией окиси
этилена. Используется для получения уксусной кислоты,
уксусного ангидрида, альдоля, этилового спирта, этилацетата и
других эфиров
Ацетон
Ацетон получаю кислотным разложением гипериза, окислением
или дегидрированием изопропилбензола, ацетон-бутанольным
брожением углеводов, из надсмольной воды при сухой перегонке
древесины. Ацетон широко используется в качестве растворителя,
для получения метилметакрилата
89. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Способы получения1. Окисление и дегидрирование первичных и вторичных спиртов
R
CH 2OH
Первичный
спирт
[O]
O
R
C
H
Альдегид
R
CH
R1
OH
Вторичный
спирт
[O]
O
R
C
R1
Кетон
В качестве окислителей чаще всего используют K2Cr2O7. Окисление
вторичных спиртов не сопряжено с осложнениями. Окисление
первичных спиртов требует осторожности, поскольку образующийся на
первой стадии альдегид способен к быстрому окислению до карбоновой
кислоты. В этом случае одновременно с окислением ведут отгонку
легкокипящих альдегидов
90. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Способы получения2. Гидратация алкинов (реакция Кучерова)
СН
СН
O
Н 2О
HgSO 4, H
CH 3
+
C
H
Ацеальдегид
3. Ацилирование по Фриделю-Крафтсу
O
Ar
H
Арен
+
R
C
Cl
Хлорангидрид
AlCl3
Ar
C
O
Кетон
R
+
HCl
91. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
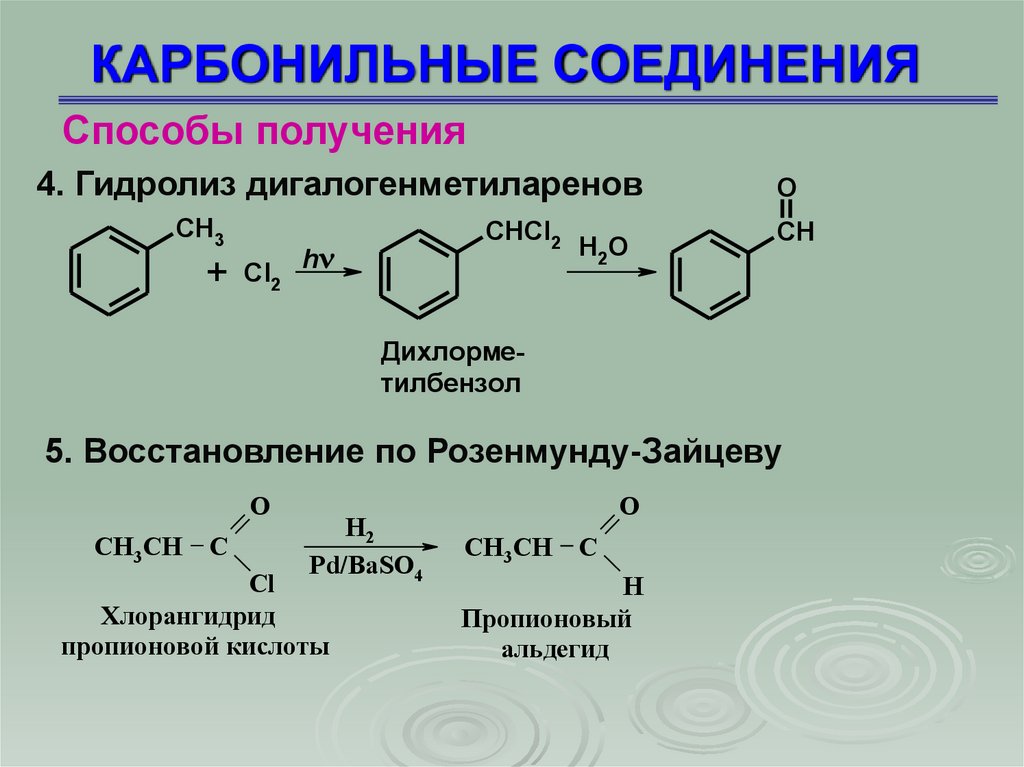
Способы получения4. Гидролиз дигалогенметиларенов
CH3
CHCl2
+ Cl2 h
H 2O
O
CH
Дихлорметилбензол
5. Восстановление по Розенмунду-Зайцеву
O
СН3СН
С
Н2
Pd/BaSO4
Cl
Хлорангидрид
пропионовой кислоты
O
СН3СН
С
Н
Пропионовый
альдегид
92. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
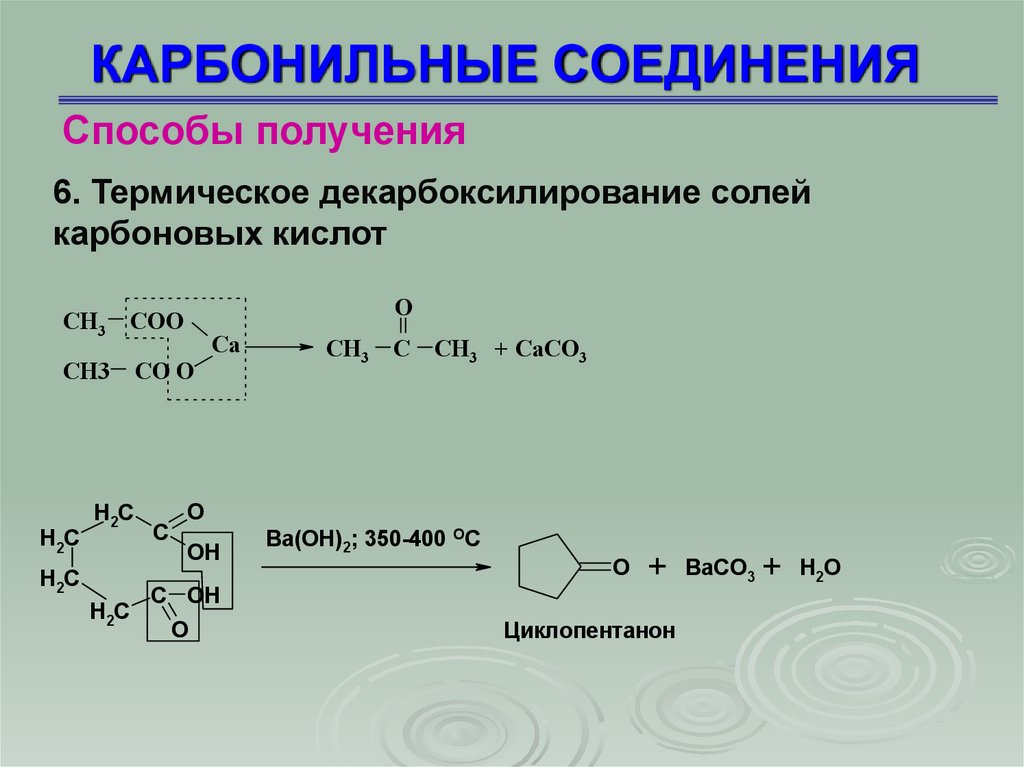
Способы получения6. Термическое декарбоксилирование солей
карбоновых кислот
O
СН3 СОО
Са
СН3 СО О
H2C
H2C
H2C
H2C
C
СН3 С СН3 + СаСО3
O
OH
C OH
O
Ba(OH)2; 350-400 OC
O
+ BaCO3 + H2O
Циклопентанон
93. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Способы получения6. Термическое декарбоксилирование солей
карбоновых кислот
Для получения альдегидов и кетонов используют пиролиз
кислот в виде паров над окислами некоторых металлов (ThO2,
MnO, CaO, ZnO) при температуре 400-450 oC
O
R
C
OH
R
C
OH
O
O
Соединения M n, Th
R
C
R + H 2O + CO 2
94. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Способы получения7. Взаимодействие сложных эфиров с реактивом
Гриньяра
Реакция эфиров муравьиной кислоты с алкил- или
арилмагнийгалогенидами дает альдегиды
RO
BrMg
H
C=O
O
абс. эфир
RO MgBr
+
R1 C
R1
Из эфиров других кислот получаются кетоны
H
95. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Способы получения7. Взаимодействие сложных эфиров с реактивом
Гриньяра
Синильная кислота или нитрилы при взаимодействии с
реактивом Гриньяра также дают альдегиды или соответственно –
кетоны
R
C
BrMg
N
R1
где R= H, Alk, Ar
абс. эфир
R
С=N
H2O, H+
R1 MgBr
R
C
R1
+
+
O + MgBr + NH3 ,
96. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Способы получения8. Гидроформилирование алкенов – оксосинтез
O
СН3 СН2 СН2 С
Масляный альдегид Н
O
Со2(СО)8, Т, Р
СН3 СН=СН2 + СО + Н2
Пропилен
СН3 СН С
Н
СН3
Изомасляный альдегид
9. Дегидрирование спиртов.
R
CH2
OH
Первичный
спирт
Cu; 300 OC
-H2
O
R
C
H
Альдегид
R
HC
OH
R1
Вторичный
спирт
Cu; 300 OC
-H2
R
C
R1
Кетон
O
97. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Способы получения10. Окисление алкенов
Дизамещенный алкен → два альдегида → две кислоты
Тризамещенный алкен → альдегид и кетон → кислота и кетон
Тетразамещенный алкен → два кетона
+
KMnO4, H
CH3 C CH CH3 нагревание
H3C C O
O C CH3
CH3
CH3
OH
Ацетон
Уксусная кислота
+
CH3 CH CH CH2
CH3
+
KMnO4, H
O
CH3 CH C + CO2 + H2 O
OH
CH
3
изомасляная кислота
98. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
Способы получения10. Окисление алкенов
Вакер-процесс: каталитическое окисление этена в ацетальдегида.
Основной промышленный способ получения ацетальдегида.
H2C CH2 + PdCl2 + H2O
Pd + 2 CuCl2
CuCl2
O
PdCl2 + Cu2Cl2
2 Cu2Cl2 + O2 + 4 HCl
+ Pd + 2 HCl
H3C C
H
2 CuCl2 + 2 H2O
99. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
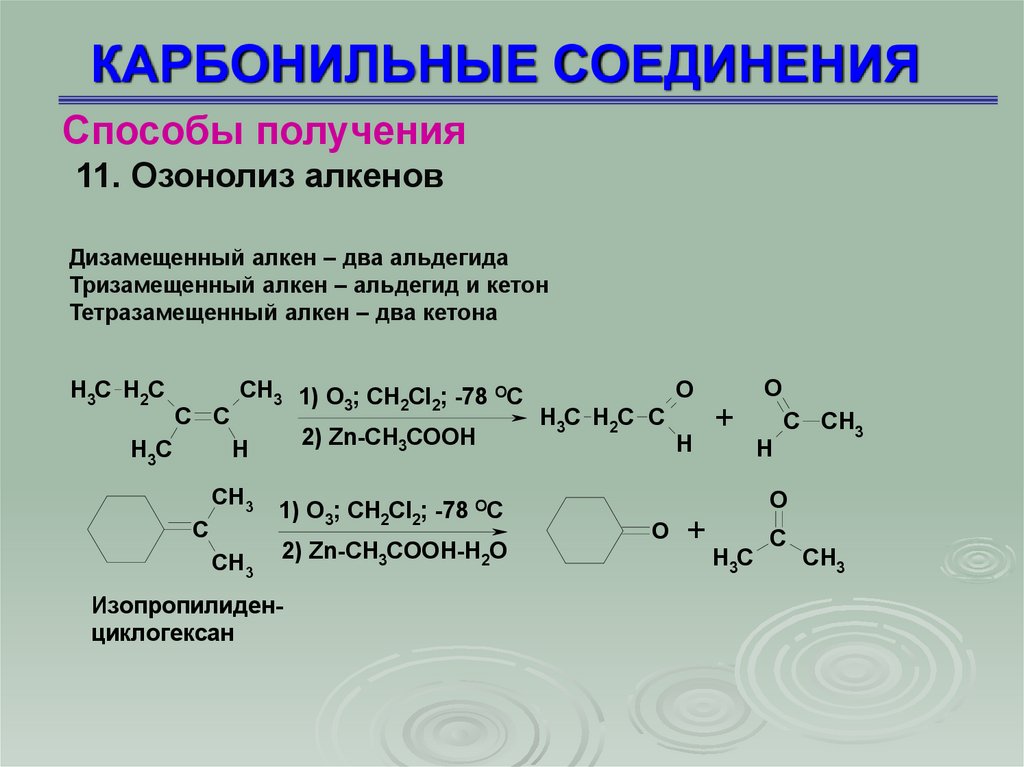
Способы получения11. Озонолиз алкенов
Дизамещенный алкен – два альдегида
Тризамещенный алкен – альдегид и кетон
Тетразамещенный алкен – два кетона
H3C H2C
C C
H3C
CH3 1) O ; CH Cl ; -78 OC
3
2 2
2) Zn-CH3COOH
H
CH3
C
CH3
1) O3; CH2Cl2; -78 OC
2) Zn-CH3COOH-H2O
Изопропилиденциклогексан
O
O
H3C H2C C
H
+
H
C CH3
O
O
+
H3C
C
CH3
100. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
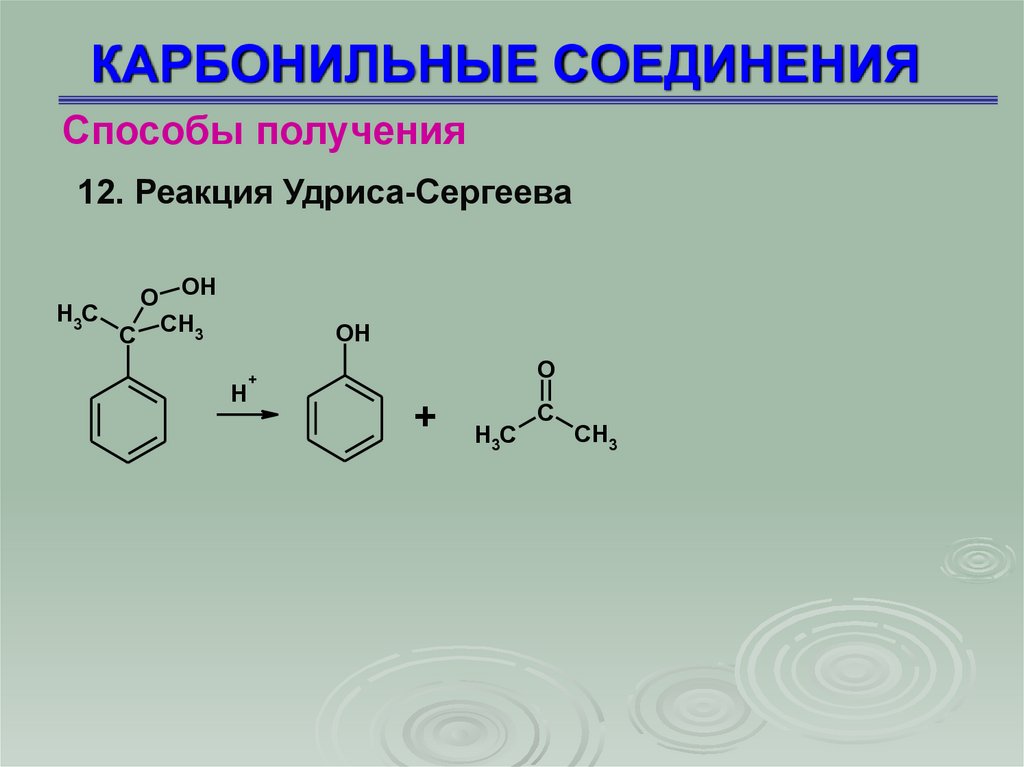
Способы получения12. Реакция Удриса-Сергеева
O OH
H3C
C CH3
OH
H
O
+
+
H3C
C
CH3















































 Химия
Химия








