Похожие презентации:
Анализ спермы. Спермограмма. Обработка эякулята для программ ВРТ
1.
Анализ спермы.Спермограмма. Обработка
эякулята для программ ВРТ
2.
Спермограмма:• самая простая проверка фертильности
мужчины
• критерий выбора метода ВРТ
3.
Подготовка пациента к проведению исследования1. Для первичной оценки эякулята рекомендуется провести два исследования
с интервалом не менее 7 дней и не более 3 недель. Период полового
воздержания при этом рекомендуется сохранять одинаковым.
2. Половое воздержание в течение 2 - 7 дней.
3. Отказ от алкоголя в любых количествах в течение 6-7 дней перед
исследованием.
4. Необходимо отказаться от процедур с перегреванием (УВЧ, сауны, бани).
5. Необходимо отказаться от исследования эякулята, если в течение 7-10 дней
перед анализом у пациента были заболевания, протекавшие с лихорадкой.
6. Рекомендуется исследовать эякулят спустя 2 недели после проведения
лечения основного заболевания (для ликвидации медикаментозной
интоксикации).
7. Исключить воздействие токсических факторов в течение 2 месяцев перед
исследованием.
8. Накануне сдачи эякулята необходимо исключить тяжелые физические
нагрузки, конфликтные ситуации. Психоэмоциональный дискомфорт может
привести к нарушению процесса получения эякулята.
4.
Получение эякулята и возможные погрешностипри этой процедуре
Эякулят получают путем мастурбации в условиях медицинского
учреждения.
Если мастурбация невозможна по этическим или религиозным
причинам, допустимо получение эякулята в процессе полового
акта с помощью специальных пластмассовых кондомов.
Не рекомендуется для получения эякулята использовать
прерванный половой акт
Допустима сдача эякулята в домашних условиях, но в этом случае
пациент должен в течение часа доставить полученный
материал в лабораторию в тепле (при температуре тела). На
контейнере указывается Ф. И. О. пациента, дата и точное время
получения эякулята.
Необходимо объяснить пациенту, что материал должен быть
собран полностью. Если этого не произошло, то пациент
должен сообщить врачу о том, что именно случилось:
материал был собран не полностью, произошло неполное
семяизвержение, эякулят был получен с трудом, после
длительной мастурбации (более 10 мин).
5.
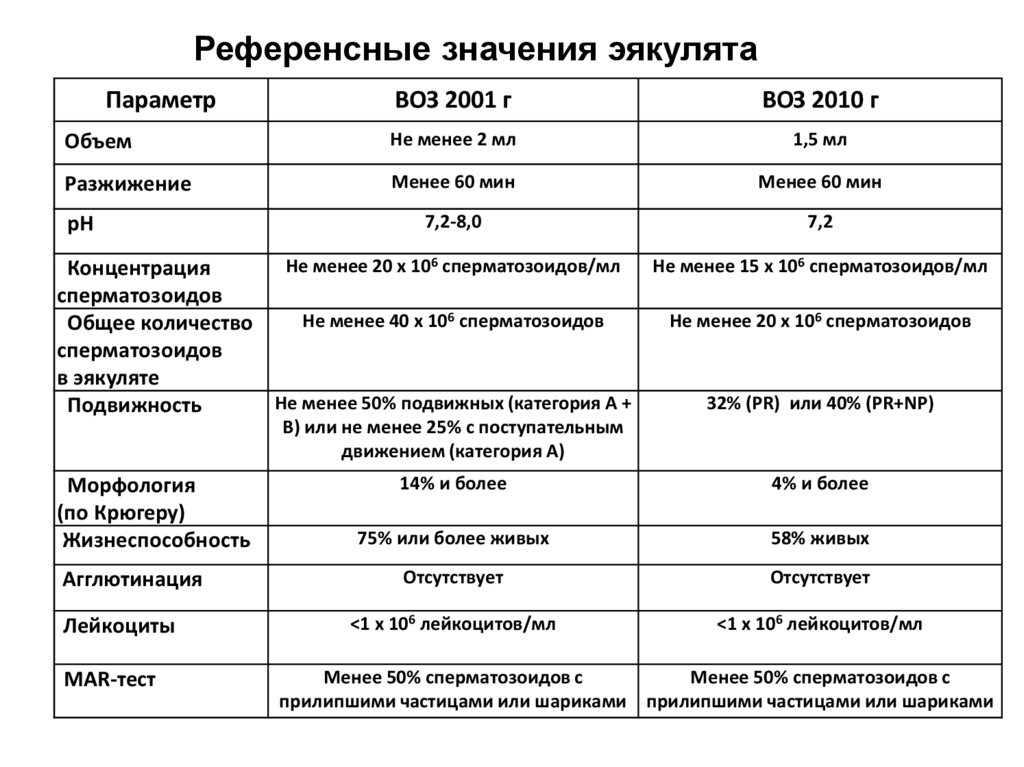
Референсные значения эякулятаПараметр
ВОЗ 2001 г
ВОЗ 2010 г
Объем
Не менее 2 мл
1,5 мл
Разжижение
Менее 60 мин
Менее 60 мин
7,2-8,0
7,2
рН
Не менее 20 х 106 сперматозоидов/мл
Не менее 15 х 106 сперматозоидов/мл
Концентрация
сперматозоидов
Не менее 40 х 106 сперматозоидов
Не менее 20 х 106 сперматозоидов
Общее количество
сперматозоидов
в эякуляте
Не менее 50% подвижных (категория А +
32% (PR) или 40% (PR+NP)
Подвижность
В) или не менее 25% с поступательным
движением (категория А)
14% и более
4% и более
75% или более живых
58% живых
Агглютинация
Отсутствует
Отсутствует
Лейкоциты
<1 х 106 лейкоцитов/мл
<1 х 106 лейкоцитов/мл
Морфология
(по Крюгеру)
Жизнеспособность
МАR-тест
Менее 50% сперматозоидов с
Менее 50% сперматозоидов с
прилипшими частицами или шариками прилипшими частицами или шариками
6.
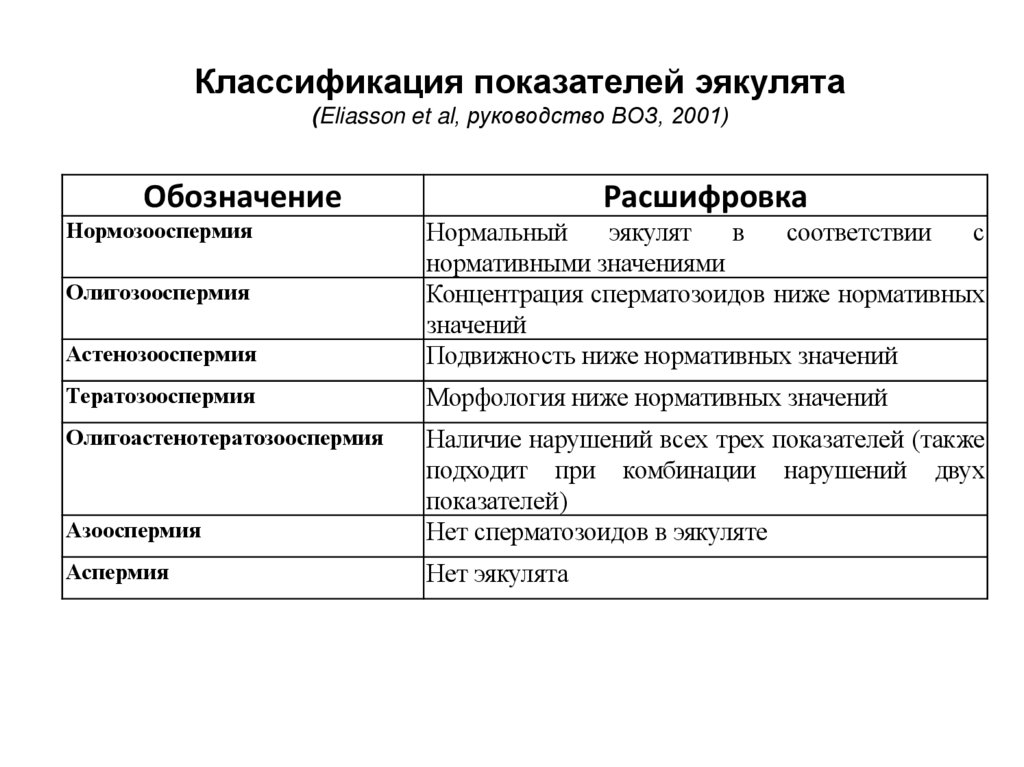
Классификация показателей эякулята(Eliasson et al, руководство ВОЗ, 2001)
Обозначение
Нормозооспермия
Расшифровка
Астенозооспермия
Нормальный
эякулят
в
соответствии
с
нормативными значениями
Концентрация сперматозоидов ниже нормативных
значений
Подвижность ниже нормативных значений
Тератозооспермия
Морфология ниже нормативных значений
Олигоастенотератозооспермия
Азооспермия
Наличие нарушений всех трех показателей (также
подходит при комбинации нарушений двух
показателей)
Нет сперматозоидов в эякуляте
Аспермия
Нет эякулята
Олигозооспермия
7.
Исследование эякулятаМакроскопическое:
Объем
Время разжижения
Вязкость
Цвет
Запах
рН
Микроскопическое:
Агрегация и агглютинация
Концентрация
Подвижность
Оценка морфологии сперматозоидов
MAR-тест
Тест на жизнеспособность сперматозоидов (тест на витальность)
HBA-тест (тест на зрелость сперматозоидов)
Фрагментация ДНК сперматозоидов (Halosperm)
Акросомальная реакция
8.
Макроскопическое исследование1) Объем
1,5 мл
Измеряется с помощью посуды для сдачи эякулята, на которую нанесена
мерная шкала либо с помощью пастеровской пипетки, мерной пробирки или
штатива.
2) Время разжижения
60 мин (большинство образцов разжижается за 20-30 мин).
3) Вязкость
0,2 – 2,0 см
Измеряется стеклянной палочкой или пипеткой с широким носиком.
4) Цвет
Мутный, молочно-белый или серовато-желтый.
5) Запах
«Запах цветов каштана»
6) рН
7,2 ед.
Определяется с помощью универсальных тест-полосок для определения рН
9.
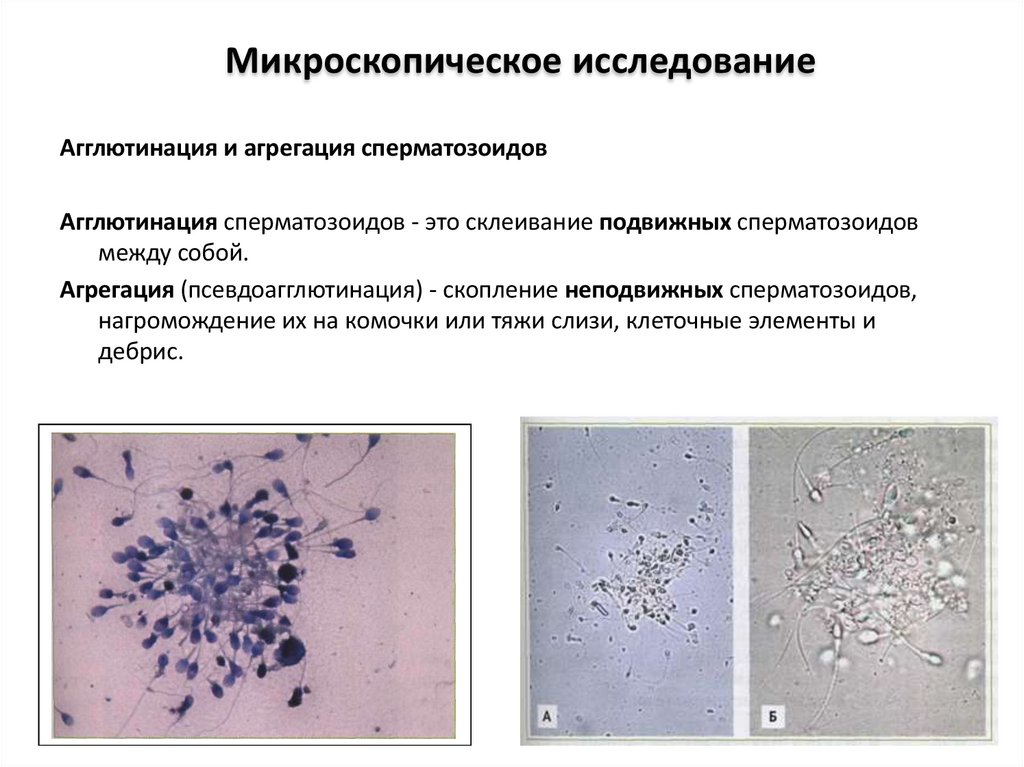
Микроскопическое исследованиеАгглютинация и агрегация сперматозоидов
Агглютинация сперматозоидов - это склеивание подвижных сперматозоидов
между собой.
Агрегация (псевдоагглютинация) - скопление неподвижных сперматозоидов,
нагромождение их на комочки или тяжи слизи, клеточные элементы и
дебрис.
10.
Микроскопическое исследованиеСлизь
Вытягивается в виде волокон и тяжей или густой липкой массы, комочков.
В норме отсутствует. Обнаруживается при воспалительном процессе уретры,
бульбоуретральных желез, простаты, простатических ходов и т. д.
Липоидные тельца
Мелкие блестящие зернышки, содержащиеся в нормальной сперме.
Присутствуют в норме. При простатите их количество уменьшается, а при
длительном воспалении липоидные тельца исчезают из спермы.
Амилоидные тельца (конкременты)
Образования округлой формы, серого или желтоватого цвета
с характерной слоистостью, напоминающей спил дерева.
В норме отсутствуют. Появляются при застое секрета предстательной железы.
Кристаллы спермина (Беттхера)
бесцветные, удлиненной формы с заостренными или прямоугольными концами.
11.
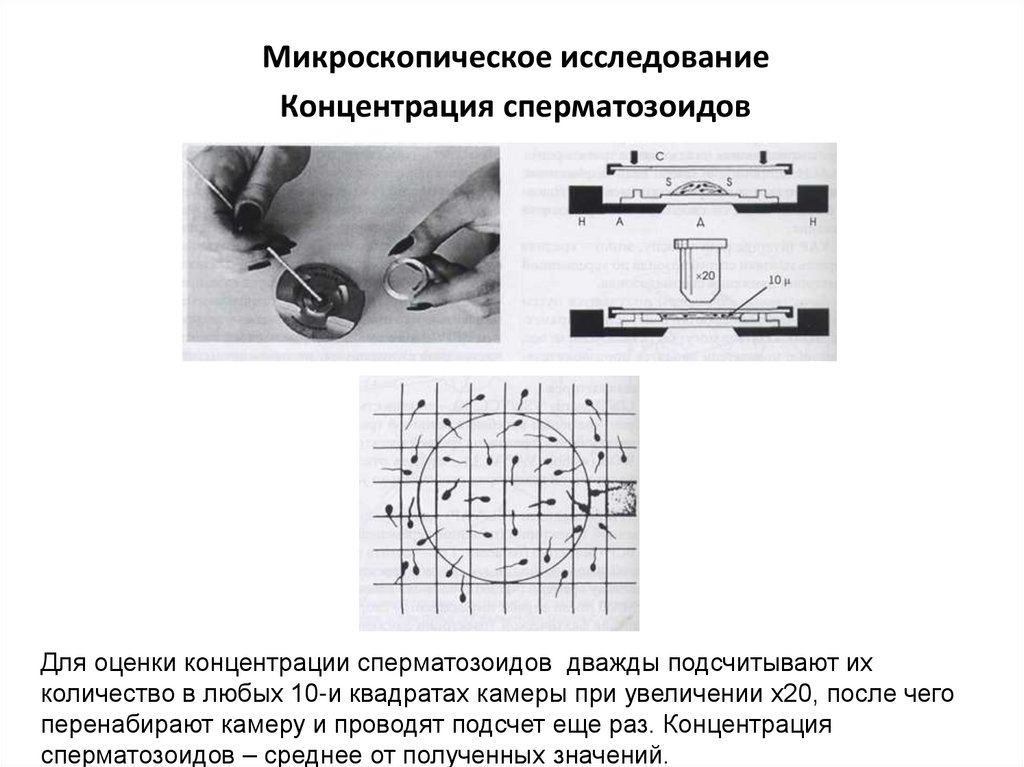
Микроскопическое исследованиеКонцентрация сперматозоидов
Для оценки концентрации сперматозоидов дважды подсчитывают их
количество в любых 10-и квадратах камеры при увеличении х20, после чего
перенабирают камеру и проводят подсчет еще раз. Концентрация
сперматозоидов – среднее от полученных значений.
12.
При малых концентрациях подсчитывают количествосперматозоидов во всей камере (100 квадратов) и делят на 10.
При отсутствии сперматозоидов в камере эякулят центрифугируют
и изучают осадок: возможно, в осадке присутствуют единичные
подвижные или неподвижные сперматозоиды
13.
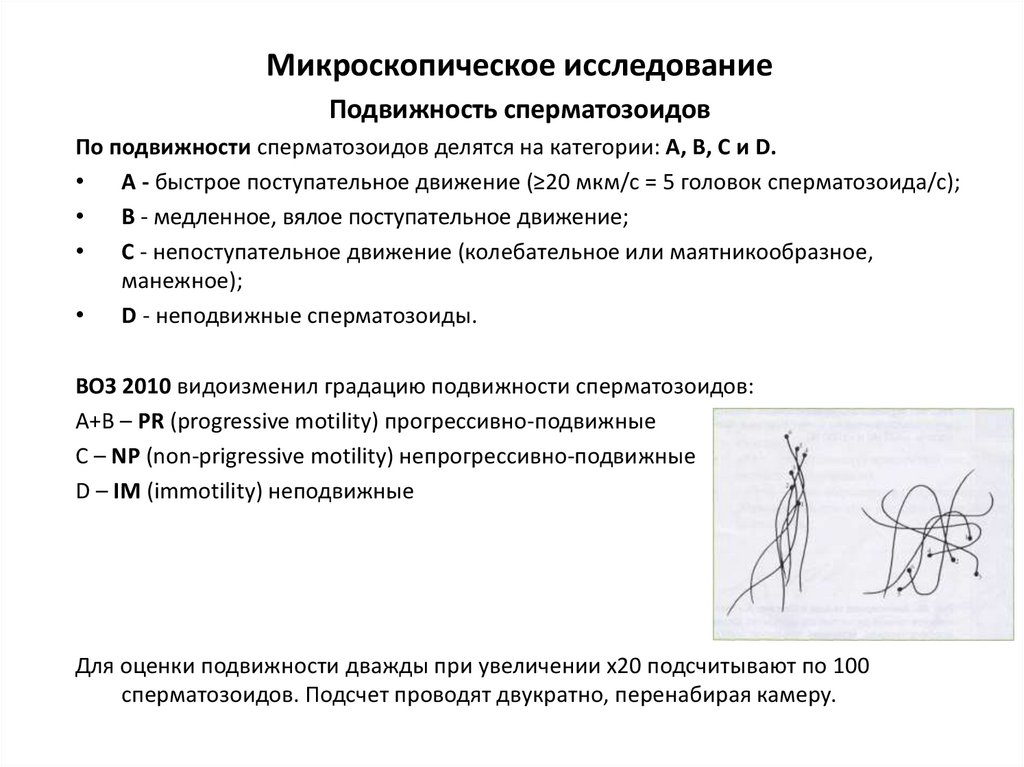
Микроскопическое исследованиеПодвижность сперматозоидов
По подвижности сперматозоидов делятся на категории: А, В, С и D.
А - быстрое поступательное движение (≥20 мкм/с = 5 головок сперматозоида/с);
В - медленное, вялое поступательное движение;
С - непоступательное движение (колебательное или маятникообразное,
манежное);
D - неподвижные сперматозоиды.
ВОЗ 2010 видоизменил градацию подвижности сперматозоидов:
А+В – PR (progressive motility) прогрессивно-подвижные
C – NP (non-prigressive motility) непрогрессивно-подвижные
D – IM (immotility) неподвижные
Для оценки подвижности дважды при увеличении х20 подсчитывают по 100
сперматозоидов. Подсчет проводят двукратно, перенабирая камеру.
14. Морфология сперматозоидов
Установление норм количества аномальных сперматозоидовзависит от метода оценки морфологии сперматозоидов.
ВОЗ 1992 года рекомендовал исследовать морфологию в
нативном эякуляте с помощью оптики «светлого поля»; при
таком методе доля нормальных сперматозоидов не менее 50 %
в эякуляте.
ВОЗ 1999 рекомендует исследовать морфологию в нативном
эякуляте с помощью оптики «фазового контраста»; при таком
методе доля нормальных сперматозоидов не менее 30 % в
эякуляте.
ВОЗ 2010 рекомендует следовать «строгим критериям Крюгера»:
исследование морфологии проводят на фиксированном
окрашенном мазке спермы. Согласно этим критериям
(применимым только для мазка) доля нормальных
сперматозоидов не менее 4 %.
Наиболее точным методом считается исследование окрашенного
мазка.
15.
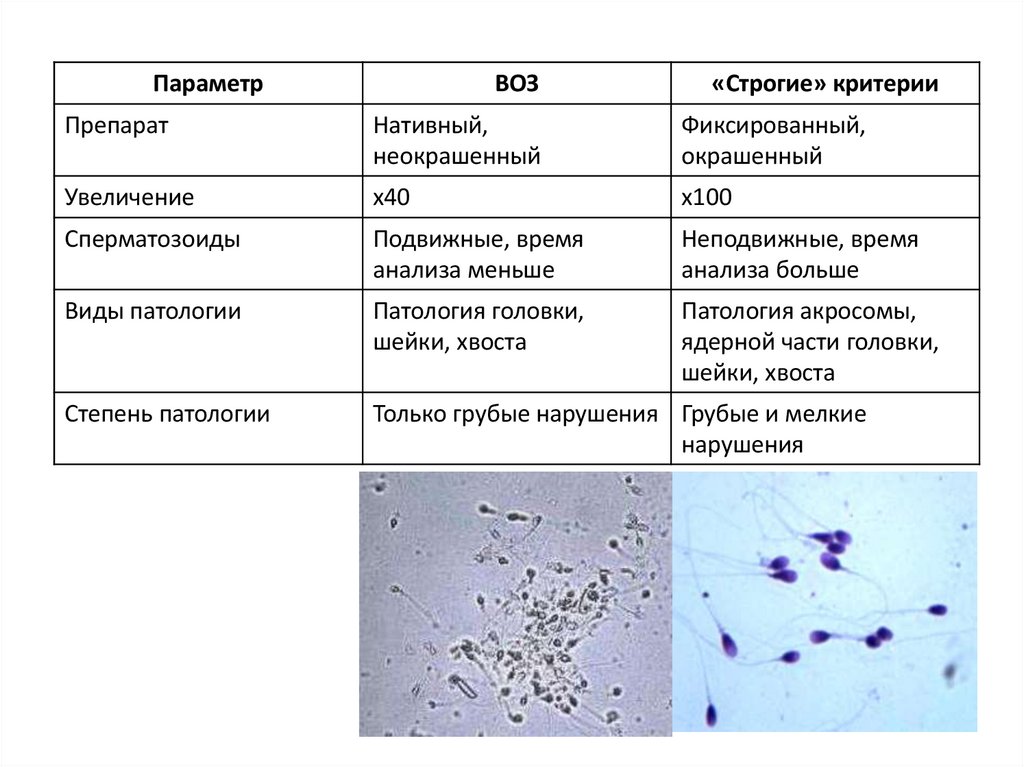
ПараметрВОЗ
«Строгие» критерии
Препарат
Нативный,
неокрашенный
Фиксированный,
окрашенный
Увеличение
х40
х100
Сперматозоиды
Подвижные, время
анализа меньше
Неподвижные, время
анализа больше
Виды патологии
Патология головки,
шейки, хвоста
Патология акросомы,
ядерной части головки,
шейки, хвоста
Степень патологии
Только грубые нарушения Грубые и мелкие
нарушения
16.
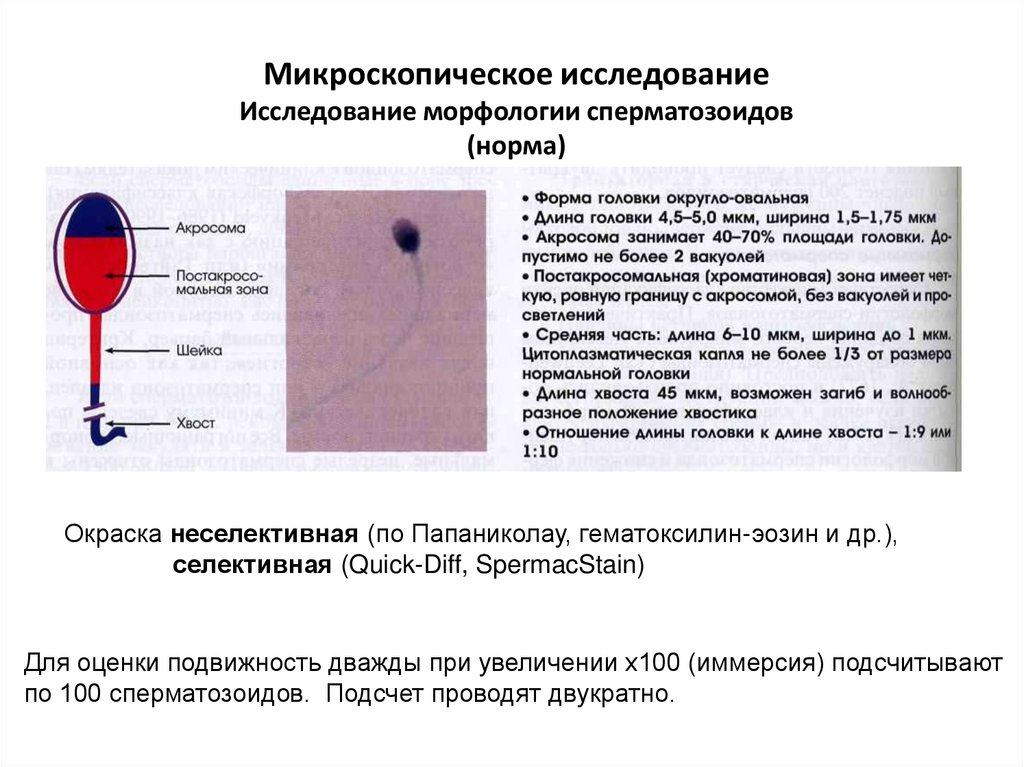
Микроскопическое исследованиеИсследование морфологии сперматозоидов
(норма)
Окраска неселективная (по Папаниколау, гематоксилин-эозин и др.),
селективная (Quick-Diff, SpermacStain)
Для оценки подвижность дважды при увеличении х100 (иммерсия) подсчитывают
по 100 сперматозоидов. Подсчет проводят двукратно.
17.
Микроскопическое исследованиеИсследование морфологии сперматозоидов
(патология)
18.
Значимость различных видов патологиисперматозоидов
Если в эякуляте доля сперматозоидов с патологией головки превышает
30%, то вероятность оплодотворения в ЭКО резко снижается. По
данным исследователей, более 70% морфологически аномальных
сперматозоидов несут грубые генетические поломки в ядре.
Ни для каких других видов патологических форм сперматозоидов границ
норм нет.
По «строгим» критериям Крюгера вид патологии не имеет значения:
любой патологический сперматозоид имеет минимальные шансы
достичь ооцита.
19.
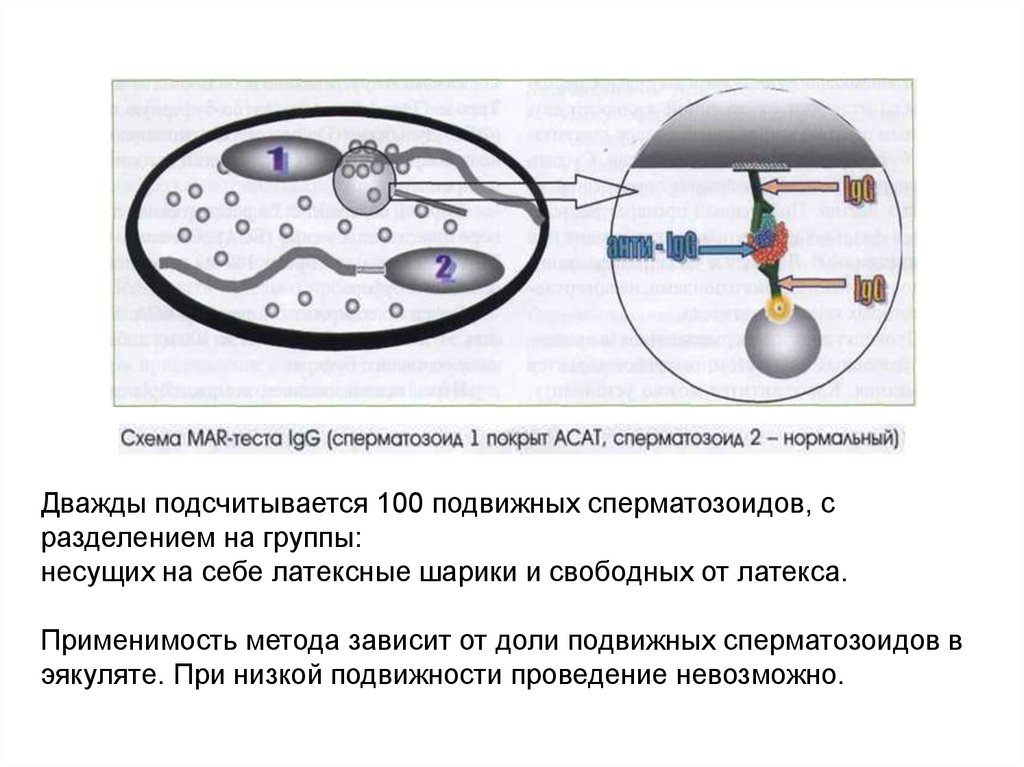
Микроскопическое исследованиеMAR-тест
В ряде случаев в организме мужчины вырабатываются антитела
против своих собственных сперматозоидов –
антиспермальные антитела (АСАТ). Основной причиной их
выработки является нарушение гематотестикулярного
барьера.
Причины:
непроходимость семявыносящего тракта,
варикоцеле,
травмы яичек
хирургические вмешательства на яичках
воспалительные заболевания различной этиологии
наследственная предрасположенность
20.
Негативное влияние АСАТ:АСАТ вызывают:
• снижение скорости движения и жизнеспособности сперматозоидов
за счет образования агрегатов,
• нарушают функциональную целостность мембраны
сперматозоидов.
• ослабление оплодотворяющей способности эякулята (поиск
яйцеклетки, контакт с оболочкой яйцеклетки, проникновение внутрь
яйцеклетки),
АСАТ обнаруживаются у 15% бесплодных пациентов,
не существует корреляции с остальными параметрами спермограммы:
концентрацией, подвижностью и морфологией
степень нарушения процесса оплодотворения определяется классом
АСАТ, количеством антител в секретах репродуктивного тракта,
плотностью покрытия ими поверхности сперматозоида и
локализацией их на поверхности сперматозоидов. Прикрепление
АСАТ к хвосту, как правило, обездвиживает сперматозоиды,
прикрепление их к головке – препятствует оплодотворению
21.
Дважды подсчитывается 100 подвижных сперматозоидов, сразделением на группы:
несущих на себе латексные шарики и свободных от латекса.
Применимость метода зависит от доли подвижных сперматозоидов в
эякуляте. При низкой подвижности проведение невозможно.
22.
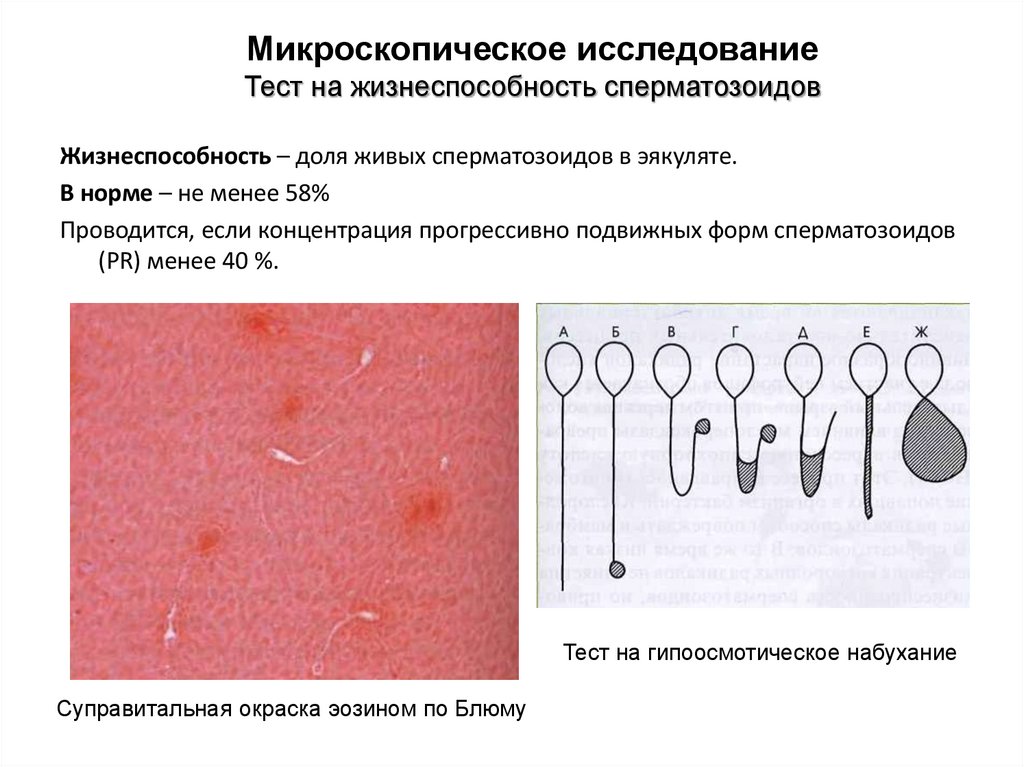
Микроскопическое исследованиеТест на жизнеспособность сперматозоидов
Жизнеспособность – доля живых сперматозоидов в эякуляте.
В норме – не менее 58%
Проводится, если концентрация прогрессивно подвижных форм сперматозоидов
(PR) менее 40 %.
Тест на гипоосмотическое набухание
Суправитальная окраска эозином по Блюму
23.
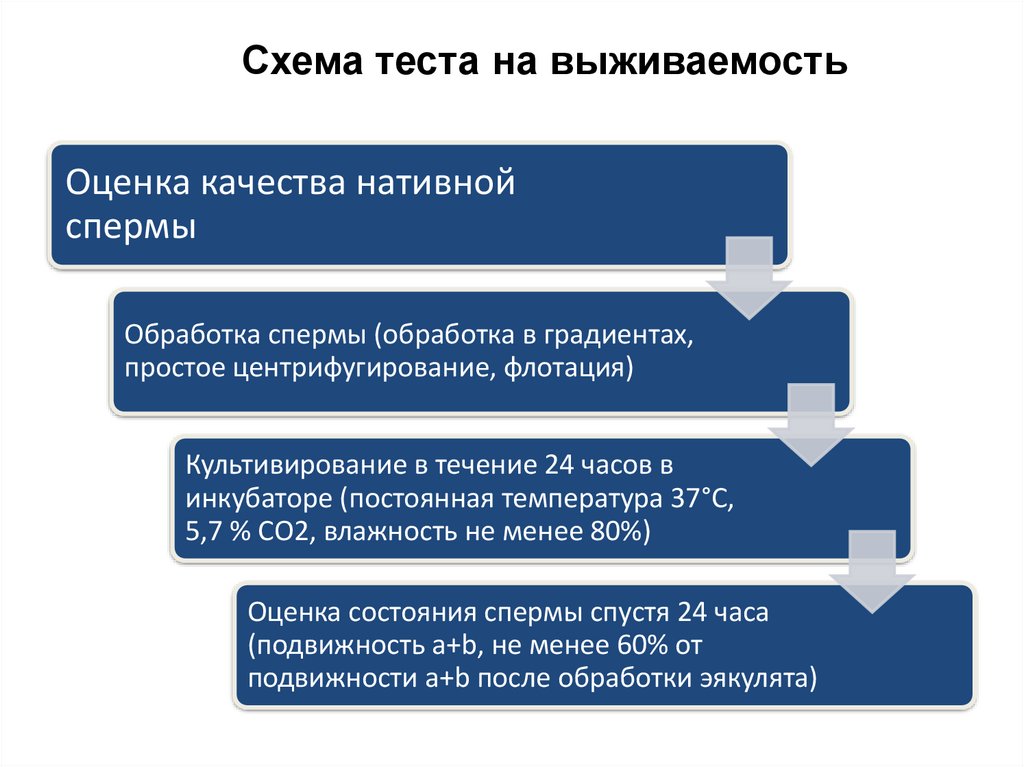
Микроскопическое исследованиеВыживаемость сперматозоидов
Средняя продолжительность жизни сперматозоида после
эякуляции 3-5 дней. В норме этого достаточно для встречи
сперматозоида с яйцеклеткой и ее оплодотворения.
Однако существует патология, при которой сперматозоиды
обладают меньшей продолжительностью жизни: менее 24 часов.
В этом случае, естественное оплодотворение такой спермой
затруднено, а ее использование для ВМИ даст низкий процент
оплодотворения и маленькую вероятность наступления
беременности.
Основная цель теста – определить, способны ли сперматозоиды
прожить достаточный для оплодотворения ооцита срок (18-20
часов), или они погибнут раньше.
Если верно последнее, то использование такой спермы для ВМИ
или ЭКО даст низкий процент оплодотворения и маленькую
вероятность наступления беременности.
24.
Схема теста на выживаемостьОценка качества нативной
спермы
Обработка спермы (обработка в градиентах,
простое центрифугирование, флотация)
Культивирование в течение 24 часов в
инкубаторе (постоянная температура 37°С,
5,7 % СО2, влажность не менее 80%)
Оценка состояния спермы спустя 24 часа
(подвижность а+b, не менее 60% от
подвижности а+b после обработки эякулята)
25.
Микроскопическое исследованиеСостояние генетического материала
Повреждения ДНК включают в себя одно- и двухцепочечные разрывы,
формирующие т.е. фрагментацию ДНК сперматозоида.
Сперматозоиды с поврежденной ДНК способны к оплодотворению
ооцита, но дальнейшее развитие эмбриона блокируется на
различных этапах.
При фрагментации более 10% вероятность оплодотворения снижается.
Показано, что достоверное снижение частоты оплодотворения
происходит начиная с фрагментации 18%.
Доказано, что фрагментация ДНК сперматозоидов оказывает негативное
влияние на формирование бластоцист и имплантацию. В парах, где
мужчины имели высокий процент фрагментации (≥30%) была
низкой частота получения бластоцист и частота наступления
беременности в ЭКО и ИКСИ, повышалась вероятность абортов.
26.
Среди мужчин с нормальными показателями спермограммы 18%мужчин имеют повышенный уровень фрагментации ДНК.
Одновременно с этим, 39% мужчин с нарушениями спермограммы
имеют нормальные параметры фрагментации и, следовательно,
хорошие шансы на оплодотворение в программах ЭКО и ИКСИ
27.
Потенциальные причины фрагментацииДНК ядер сперматозоидов
- Перенесенные инфекционные заболевания (ЗПП)
- Лихорадочные состояния
- Диеты
- Употребление наркотиков
- Повышение тестикулярной температуры
- Курение, стрессы
- Проживание в неблагоприятных условиях
- Возраст старше 45 лет
28.
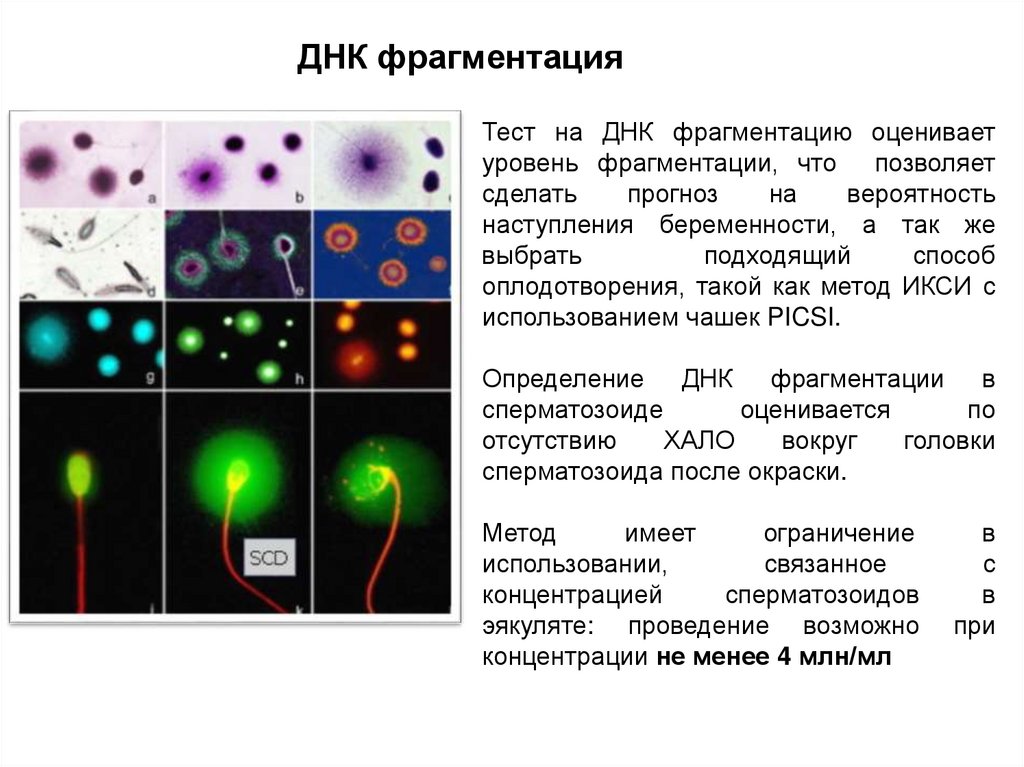
ДНК фрагментацияТест на ДНК фрагментацию оценивает
уровень фрагментации, что позволяет
сделать
прогноз
на
вероятность
наступления беременности, а так же
выбрать
подходящий
способ
оплодотворения, такой как метод ИКСИ с
использованием чашек PICSI.
Определение ДНК фрагментации в
сперматозоиде
оценивается
по
отсутствию
ХАЛО
вокруг
головки
сперматозоида после окраски.
Метод
имеет
ограничение
использовании,
связанное
концентрацией
сперматозоидов
эякуляте: проведение возможно
концентрации не менее 4 млн/мл
в
с
в
при
29.
Микроскопическое исследованиеЗрелость сперматозоидов
Для того, чтобы правильно и полноценно функционировать,
сперматозоиды должны созреть. Процесс созревания происходит
на поздних стадиях сперматогенеза и во время прохождения
сперматозоида через эпидидимис.
При этом происходят очень важные процессы:
• оформление акросомы
• уплотнение генетического материала (гистоны заменяются
протаминами)
• элиминация РНК (в ядре остается только ДНК)
• оформление антигенного и рецепторного аппарата сперматозоида
30.
Если по каким-либо причинам (преходящим или постоянносуществующим) сперматозоиды не достигают зрелости,
вероятность оплодотворения снижается.
Самая простая причина этого – частые эякуляции.
Границей, за которой изменения становятся значимыми, является
показатель в 65% зрелых сперматозоидов в эякуляте.
Если индекс связывания менее 65% -пациентам рекомендовано
проведение процедуры ИКСИ (PICSI) вне зависимости от
параметров эякулята.
31.
HBA - тестЭкспресс - анализ связываемости
сперматозоидов с гиалуроновой
кислотой в нативном эякуляте.
Метод имеет ограничение в
использовании, связанное с
подвижностью.
На
стекле
должно быть подсчитано не
менее
38
подвижных
сперматозоидов
Только зрелые сперматозоиды
связываются
с
гиалуроновой
кислотой
с
помощью
специфических
рецепторов,
находящихся на мембране.
Связавшиеся
сперматозоиды
теряют
прогрессивную
подвижность,
хотя
хвосты
совершают активные колебания.
Незрелые
сперматозоиды
связываются с поверхностью.
не
32.
Микроскопическое исследованиеЛейкоциты
В норме в эякуляте содержится менее 1 млн/мл лейкоцитов
Лейкоциты активируются при наличии антигенной стимуляции и
продуцируют большое количество активных форм кислорода
(анион супероксида, перекись водорода, гидроксильный
радикал), направленных против различных инфекционных
агентов.
В норме повреждающий эффект кислородных радикалов на
сперматозоиды отсутствует, т.к. сперматозоиды и семенная
плазма имеют защитную систему, регулирующую их
концентрацию (альбумин, глутатион, пируват, витамины Е и С).
В семенной плазме мужчин, страдающих бесплодием, содержание
антиоксидантов часто значительно ниже, чем у фертильных
мужчин.
33.
Лейкоспермия коррелирует с бактериоспермией, когда выявляетсяболее 1000 бактериальных клеток на 1 мл эякулята.
Лейкоспермия может свидетельствовать о наличии
воспалительных процессов органов репродуктивной системы.
Лейкоспермия влияет на процессы, происходящие в
репродуктивной системе, снижая вероятность оплодотворения.
34.
ЭритроцитыГематоспермия (присутствие эритроцитов в сперме) м.б ложная и
истинная.
Ложная гематоспермия – появление эритроцитов в эякуляте в
результате микротравмы: катетеризация, забор материала из
уретры для микробиологического исследования, мастурбация
при сдаче материала.
Истинная гематоспермия – появление эритроцитов в эякуляте в
результате нарушения гематотестикулярного барьера,
воспалительных заболеваний придаточных желез или при
наличии опухолевого процесса.
В норме эритроцитов в сперме нет.
35.
БактерииВ бесплодных парах среди мужчин, не предъявляющих жалоб, высок
процент определения в эякуляте патогенных бактерий, т.е. они
играют потенциальную роль в снижении мужской фертильности.
Различают инфицирование спермы и ее контаминацию.
Контаминация обычно происходит при прохождении через уретру, и
при этом обнаруживаются грампозитивные бактерии.
При инфицировании, как правило, обнаруживается значительная
бактериоспермия (≥103/мл)
36.
В результате инфицирования:• развиваются неспецифические воспалительные реакции
• происходит специфическое взаимодействие инфекции с
соматическими и половыми клетками
Острые воспалительные процессы приводят к временному
нарушению сперматогенеза
Хронический воспалительный процесс еще более опасен, т.к.
большинство из них протекает бессимптомно, что затрудняет
диагностику.
При этом рутинные посевы анаэробной и аэробной флоры не
слишком информативны для выявления природы
инфертильности
37. Акросомальная реакция
Микроскопическое исследованиеАкросомальная реакция
Акросома - структура, находящаяся в верхней части головки,
содержащая внутри ферменты: протеазу, акрозин и
гиалуронидазу.
Эти ферменты способствуют проникновению сперматозоидов
через блестящую оболочку яйцеклетки.
Разрыв мембраны акросомы и высвобождение ферментов носят
название акросомальной реакции (АР). В норме АР происходит
при связывании сперматозоида с блестящей оболочкой
яйцеклетки.
Существуют два основных типа нарушений, препятствующих
оплодотворению и приводящих к бесплодию:
• спонтанная АР, которая происходит еще до взаимодействия
сперматозоида и яйцеклетки,
• отсутствие индукции АР при связывании сперматозоида с zona
pellucida.
38.
Для бесплодных пациентов характерен высокий процентспонтанной АР и низкий процент индуцированной АР,
У фертильных доноров отмечается преобладание уровня
индуцированной АР над спонтанной.
Для исследования АР используют
• флюоресцентную микроскопию
• проточную цитофлюориметрию с применением
флюоресцирующих меченых лектинов или моноклональных
антител.
39. Биохимическое исследование эякулята
Определение концентрации фруктозыФруктоза синтезируется в семенных пузырьках под действием
тестостерона. Отвечает за поддержание обмена веществ и
подвижность сперматозоидов.
При снижении жизнеспособности сперматозоидов уровень
фруктозы повышается, при воспалении, атрезии, дисфункции
семенных пузырьков или семявыносящего протока – снижается.
Норма: 6,7 – 33,3 мкмоль/мл.
40. Биохимическое исследование эякулята
Исследование микроэлементов в эякулятеСущественное влияние на подвижность и фертильность
сперматозоидов оказывают микроэлементы, содержащиеся в
семенной плазме: Fe, Mg, Mn, Zn.
Синтезируются в предстательной железе.
Чаще всего определяют концентрацию Zn
Цинк принимает участие в сперматогенезе: входит в состав более
70 внутриядерных ферментов, катализирующих ключевые
этапы синтеза ДНК и РНК, поэтому цинк улучшает процессы
деления и дифференцировки сперматозоидов.
41. Биохимическое исследование эякулята
Исследование свободных радикалов в эякулятеЕще одна причина, приводящая к нарушению мужской
репродуктивной функции - избыточная продукция активных форм
кислорода (АФК/ROS).
Наиболее значимыми источниками повышения уровня ROS
считаются:
• инфекционно-воспалительные заболевания мужских
репродуктивных органов, в частности хронический бактериальный
простатит;
• аутоиммунные реакции против сперматозоидов
• варикоцеле
• действие хлорорганических загрязнителей и других вредных
веществ окружающей среды.
Причинами гиперпродукции АФК являются также возраст, диабет и
другие системные заболевания, тяжелые физические нагрузки,
нехватка в пище антиоксидантов.
42.
Повышение концентрации кислородных радикалов приводит куменьшению подвижности сперматозоидов за счет влияния на
сократительные белки жгутика.
При высокой концентрации кислородные радикалы вступают в
реакцию с фосфолипидами клеточных мембран, индуцируют
перекисное окисление жирных кислот в мембранах и приводят
к гибели клеток. Способны влиять на структуру ДНК в ядра,
нарушая ее целостность.
Оптимальный метод, позволяющий получить представления о
процессах свободнорадикального окисления, непосредственно
обнаруживая свободные радикалы, — регистрация
хемилюминесценции, возникающей при рекомбинации
радикалов. Содержание СР выражают в максимальной
интенсивности свечения через 2—10 мин после добавления
люминола.
43.
Большинство факторов, влияющих на эффективность ВРТвозможно так или иначе скорректировать путем:
• выбора метода оплодотворения,
• использования отбора сперматозоидов,
• использования донорской спермы в случаях, когда иное
невозможно по различным причинам.
44. Обработка спермы для программ ВРТ
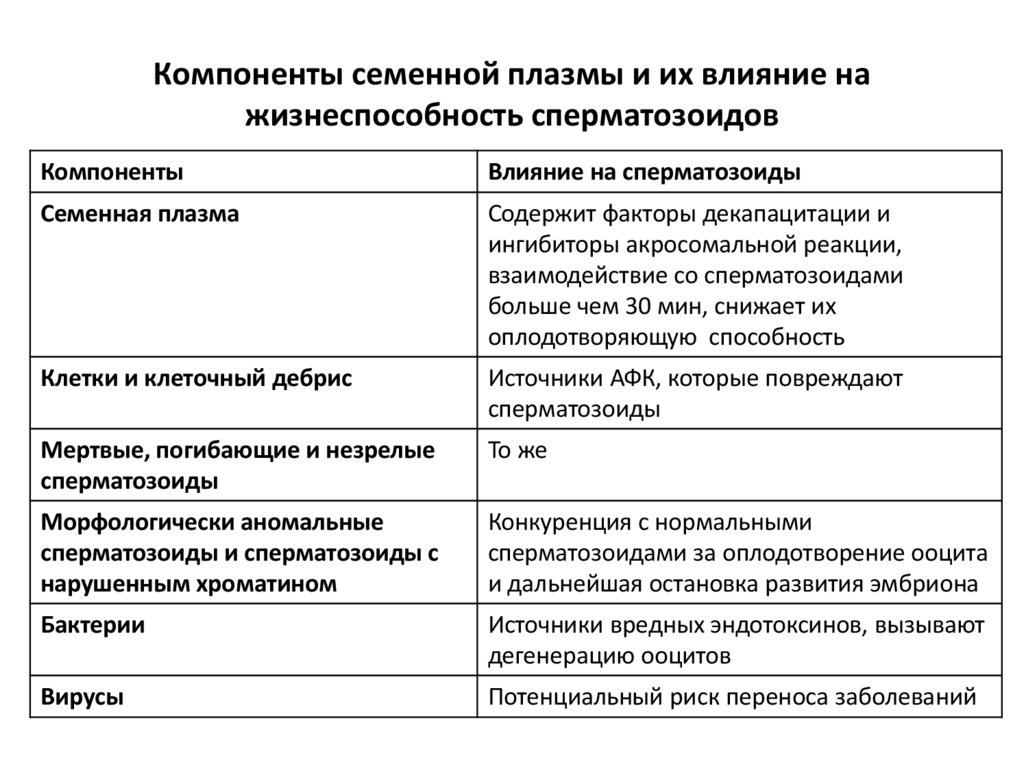
45. Компоненты семенной плазмы и их влияние на жизнеспособность сперматозоидов
КомпонентыВлияние на сперматозоиды
Семенная плазма
Содержит факторы декапацитации и
ингибиторы акросомальной реакции,
взаимодействие со сперматозоидами
больше чем 30 мин, снижает их
оплодотворяющую способность
Клетки и клеточный дебрис
Источники АФК, которые повреждают
сперматозоиды
Мертвые, погибающие и незрелые
сперматозоиды
То же
Морфологически аномальные
сперматозоиды и сперматозоиды с
нарушенным хроматином
Конкуренция с нормальными
сперматозоидами за оплодотворение ооцита
и дальнейшая остановка развития эмбриона
Бактерии
Источники вредных эндотоксинов, вызывают
дегенерацию ооцитов
Вирусы
Потенциальный риск переноса заболеваний
46.
In vivo подвижные сперматозоиды быстро мигрируют изразжижающегося эякулята в шейку матки, в процессе чего
освобождаются от семенной плазмы и достигают капацитации.
Через шейку матки сперматозоиды быстро распространяются по
женскому репродуктивному тракту и достигают отдел, где
происходит оплодотворение
Цель обработки спермы в программе ВРТ – получение
фракции активно подвижных капацитированных
сперматозоидов, наиболее способных к оплодотворению
47. Идеальный способ обработки спермы
ИДЕАЛЬНЫЙ СПОСОБ ОБРАБОТКИ СПЕРМЫ•Быстрый, простой, дешевый
•Способствует получению максимального числа подвижных
сперматозоидов
•Не повреждает сами сперматозоиды
•Убирает мертвые сперматозоиды, лейкоциты и бактерии
•Убирает токсичные субстанции (АФК) и факторы
декапацитации
•Позволяет обрабатывать большие объемы эякулята
48. Методы обработки спермы
Фильтрация через стеклянное волокно
Фильтрация через колонку с сефадексом
Трансмембранная миграция
Метод всплытия (swim-up)/swim-up+миграцияседиминтация
• Центрифугирование в градиентах плотности
49. Фильтрация через стеклянное волокно
Предложен 1977 г Poulson, PolakoskiПринцип основан на фильтрации эякулята через плотно
упакованные нити стеклянного волокна, через которые проходят
подвижные сперматозоиды, для неподвижных волокна
выступают как фильтр.
Достоинства: хорошо задерживают лейкоциты, которые
производят в 100 раз больше АФК, чем сперматозоиды.
Недостатки:
• Проходит клеточный дебрис
• Требуются специальные расходные материалы
• Наличие остатков стекла в фильтрате
• Фильтрация идет долго (2-3 часа)
• Низкий выход подвижных сперматозоидов
50. Фильтрация через колонку с сефадексом
Предложен Lopez, 1993Принцип основан на прохождении сперматозоидов через колонку
PD10 с сефадексом G25, который обычно используется для
разделения белков, и разделении их по подвижности.
Преимущества: выход морфологически нормальных сперматозоидов
выше, чем при swim-up
Недостатки: меньше выход подвижных сперматозоидов, имеется
определенное травмирование сперматозоидов, идет долго, т.к. есть
дополнительный этап – вымывание сперматозоидов из колонки
51. Трансмембранная миграция
Предложен Chijioke. 1988Принцип основан на миграции подвижных сперматозоидов через
фильтр Nuklepore. Поры цилиндрической формы и
располагаются под углом к плоскости. Подвижные
сперматозоиды заходят в поры и проходят насквозь.
Метод был экспериментально-научным
Преимущества: материал фильтра заряжен отрицательно. И
сквозь него могут пройтитолько правильно заряженные
сперматозоиды («здоровые»), хорошая очисти от лейкоцитов.
Недостатки: экстремально низкий выход подвижных
сперматозоидов.
52. SWIM-UP
Предложен Mahadevan, Baker, 1984Принцип основан на перемещении подвижных сперматозоидов из
семенной жидкости в культуральную среду. На несколько аликвот
семенной жидкости по 250 мкл наслаивают по 600 мкл среды. Время
всплытия – 1 ч. Надосадочную жидкость собирают и используют, при
необходимости дополнительно концентрируя.
Преимущества: высокий процент выхода подвижных сперматозоидов,
простота, дешевизна
Недостатки:
• плохой выход подвижных сперматозоидов из нижних слоев эякулята
• длительный контакт между клетками способствует образованию АФК,
которые повреждают хроматин и мембрану, снижают подвижность
сперматозоидов
• метод применим при относительно нормальных параметрах спермы
• ниже доля сперматозоидов с нормальной конденсацией хроматина,
по сравнению с обработкой в градиентах
• не удаляются бактерии и вирусы
53. Модификация SWIM-UP – всплытие в гиалуроновую кислоту
Вместо культуральной среды используется гиалуроновая кислота 1мг/мл
Зрелые сперматозоиды имеют аффинность к гиалуроновой
кислоте
Преимущества: выше выход подвижных сперматозоидов
Недостатки: дороговизна, гиалуронат может активировать
кальциевые каналы сперамтозоидов и вызывать
преждевременную акросомальную реакцию
54. SWIM-UP+миграция-седиминтация
Предложен одновременно со swim-up.Модификация метода для образцов спермы со сниженными
показателями подвижности. Включает дополнительную
концентрацию сперматозоидов путем мягкого
центрифугирования и более долгое время всплытия (2-3 часа).
Достоинства: в некоторых случаях дает лучший выход подвижных
сперматозоидов, чем swim-up и центрифугирование в
градиентах.
Недостатки: те же, что и у swim-up
55. Центрифугирование в градиентах плотности
Предложен Bolton 1984г.Принцип: эякулят помещается на градиент плотности, состоящий
из 2 или более растворов, причем раствор с максимальной
плотностью занимает нижнее положение, и центрифугируется.
В процессе центрифугирования подвижные сперматозоиды под
действием центробежной силы и собственных движений
достигают нижнего слоя быстрее, чем дебрис и неподвижные
сперматозоиды
В более плотном слое концентрируются сперматозоиды с
неповрежденной ДНК, которая обладает большей плотность
(помимо подвижности – еще один фактор разделения)
56. Центрифугирование в градиентах плотности
Эволюция градиентов:Ficoll (полисахарид)
Percoll (водный р-р частиц двуокиси кремния, связанных с ПВП +
соли для выравнивания осмолярности)
Новое поколение: силансвязанные частицы двуокиси кремния в
растворе солей
Преимущества:
Высокий выход подвижных сперматозоидов со зрелым
хроматином, хорошая очистка от дебриса, лейкоцитов, быстрота
и стандартность обработки. Вместе со swim-up дает практически
полную очистку от бактерий и некоторых вирусов (ВИЧ)
Недостатки
Дороговизна градиентов, необходимость дополнительной отмывки
после градиентов












































 Медицина
Медицина








