Похожие презентации:
Амфотерные органические и неорганические соединения
1. Амфотерные органические и неорганические соединения
2.
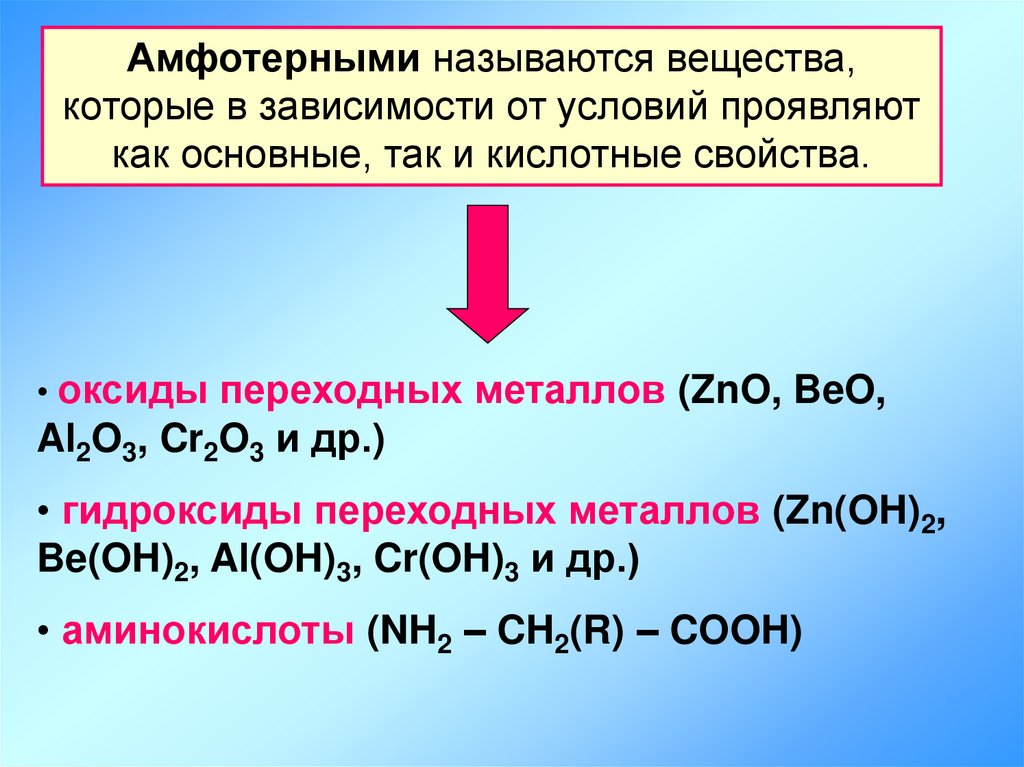
Амфотерными называются вещества,которые в зависимости от условий проявляют
как основные, так и кислотные свойства.
• оксиды переходных металлов (ZnO, BeO,
Al2O3, Cr2O3 и др.)
• гидроксиды переходных металлов (Zn(OH)2,
Be(OH)2, Al(OH)3, Cr(OH)3 и др.)
• аминокислоты (NH2 – CH2(R) – COOH)
3. Какие элементы образуют эти соединения?
Металлы в степени окисления +3 и+4,а также металлы, металлические
свойства которых выражены неярко
(в периодической системе элементов
они находятся между металлами и
неметаллами, вдоль диагонали)
Например: Be, Zn, Ge и др
4. Физические свойства амфотерных гидроксидов
Амфотерные гидроксиды– это нерастворимые в воде
твердые вещества, как
правило, белого цвета
5. Получение
Реакцией обмена междурастворимой солью
соответствующего металла и
щелочью
ZnCl2 + 2NaOH = Zn(OH)2 + 2NaCl
Zn2+ + 2OH - = Zn (OH)2
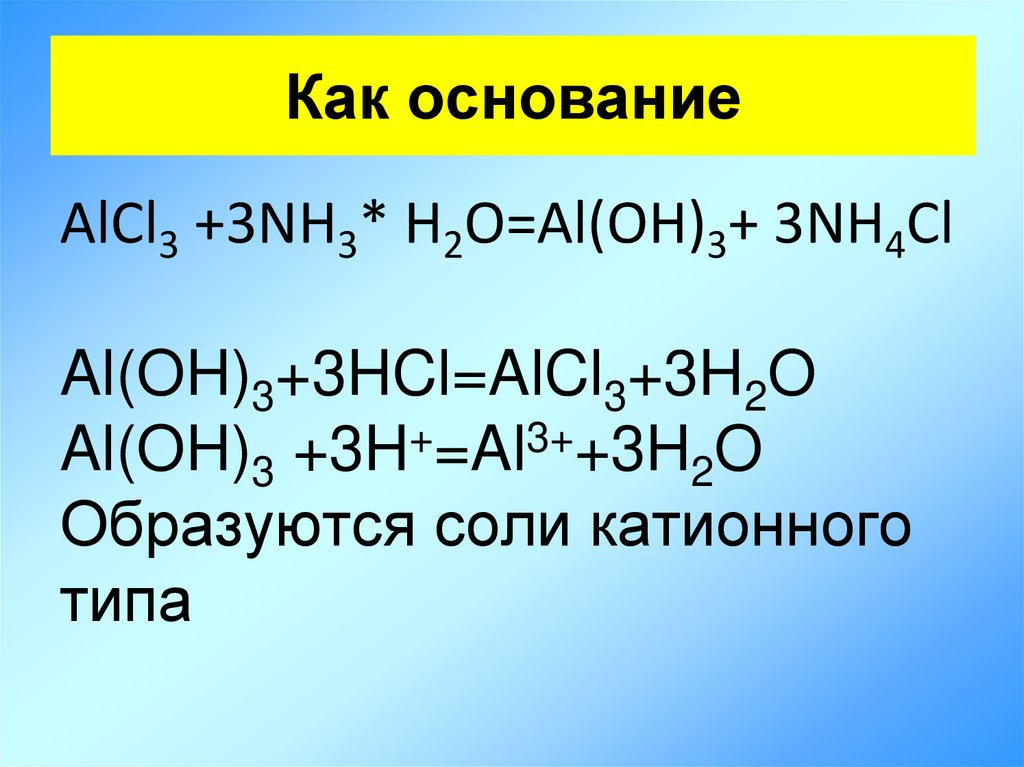
6. Как основание
AlCl3 +3NH3* H2O=Al(OH)3+ 3NH4ClAl(OH)3+3HCl=AlCl3+3H2O
Al(OH)3 +3H+=Al3++3H2O
Образуются соли катионного
типа
7. Как кислота
Al(OH)3+NaOH = Na[Al(OH)4]тетрагидроксоалюминат натрия
Al(OH)3+OH- = [Al (OH)4] –
Образуются соли анионного типа
Вывод: гидроксид алюминия взаимодействует и с
кислотами, и с основаниями, т.е. проявляет
амфотерные свойства
8. Соли анионного типа устойчивы в щелочной среде, но разрушаются при подкислении растворов
Na[Al(OH)4]+4HCl=NaCl+AlCl3+4H2O9. Амфотерные гидроксиды, как и нерастворимые основания, при нагревании разлагаются:
2Al(OH )3Al2O3 + 3H2O
10.
1. NaCl2 + NaOH =/= реакция не идет2. MgCl2 + 2NaOH = Mg (OH)2 + 2NaCl
– выпадает белый осадок, нерастворимый
в щелочах
3. AlCl3 + 3NaOH = Al (OH)3 + 3NaCl
– выпадает белый осадок
Al(OH)3 + NaOH = Na[ Al(OH)4 ]
– осадок растворяется в избытке щелочи
11.
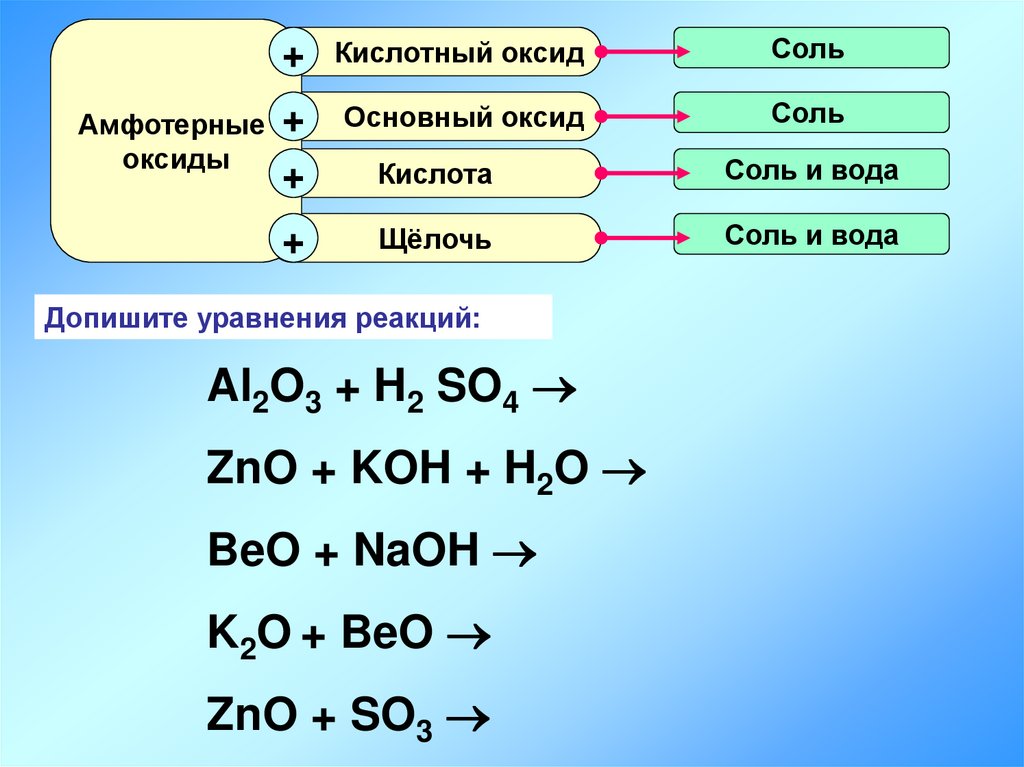
+Кислотный оксид
Соль
Амфотерные +
оксиды
Основный оксид
Соль
+
Кислота
Соль и вода
+
Щёлочь
Соль и вода
Допишите уравнения реакций:
Al2O3 + H2 SO4
ZnO + KOH + H2O
BeO + NaOH
K2O + BeO
ZnO + SO3
12.
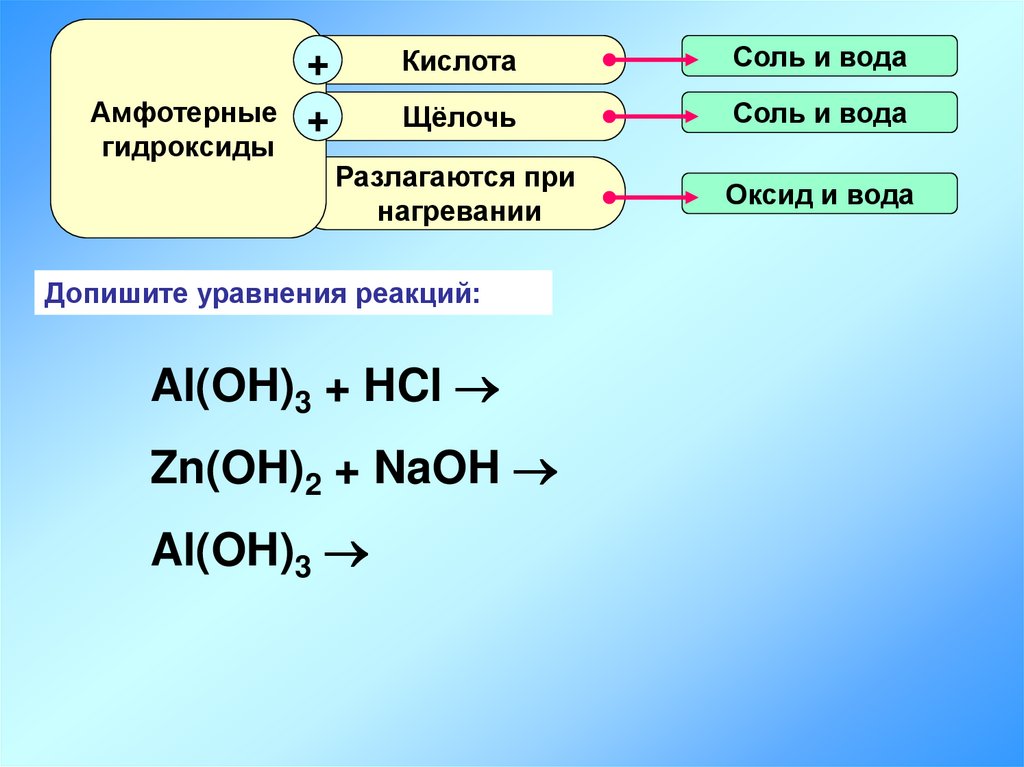
Амфотерныегидроксиды
Кислота
Соль и вода
Щёлочь
Соль и вода
Разлагаются при
нагревании
Оксид и вода
+
+
Допишите уравнения реакций:
Al(OH)3 + HCl
Zn(OH)2 + NaOH
Al(OH)3
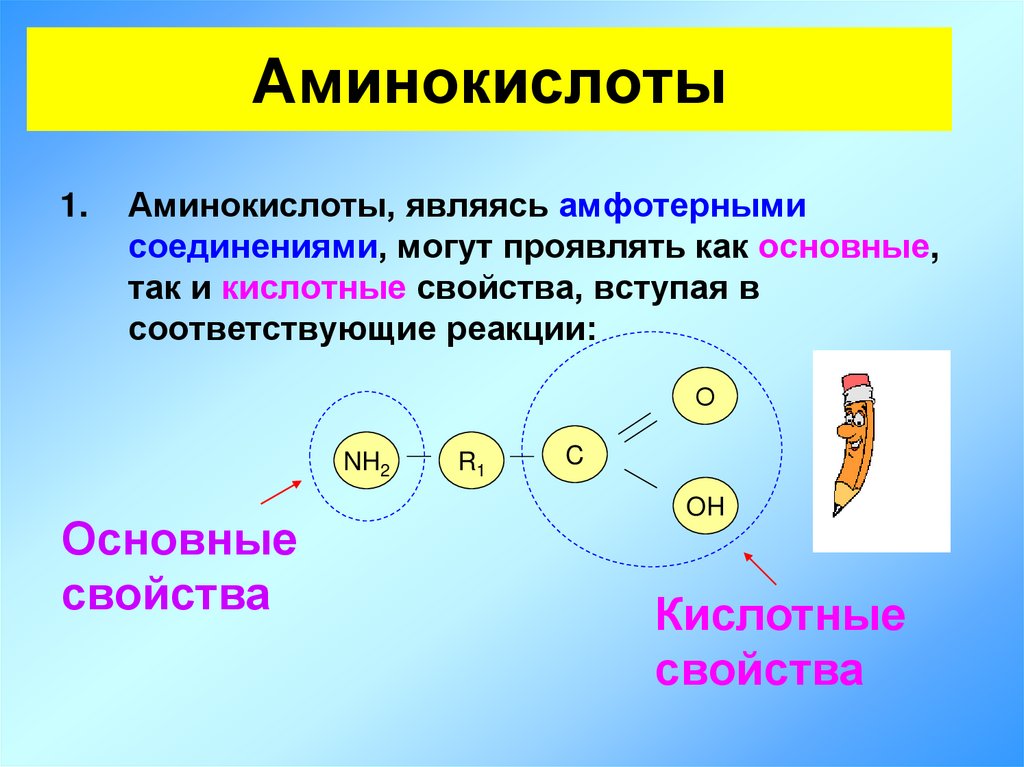
13. Аминокислоты
1.Аминокислоты, являясь амфотерными
соединениями, могут проявлять как основные,
так и кислотные свойства, вступая в
соответствующие реакции:
О
NH2
Основные
свойства
R1
C
OH
Кислотные
свойства
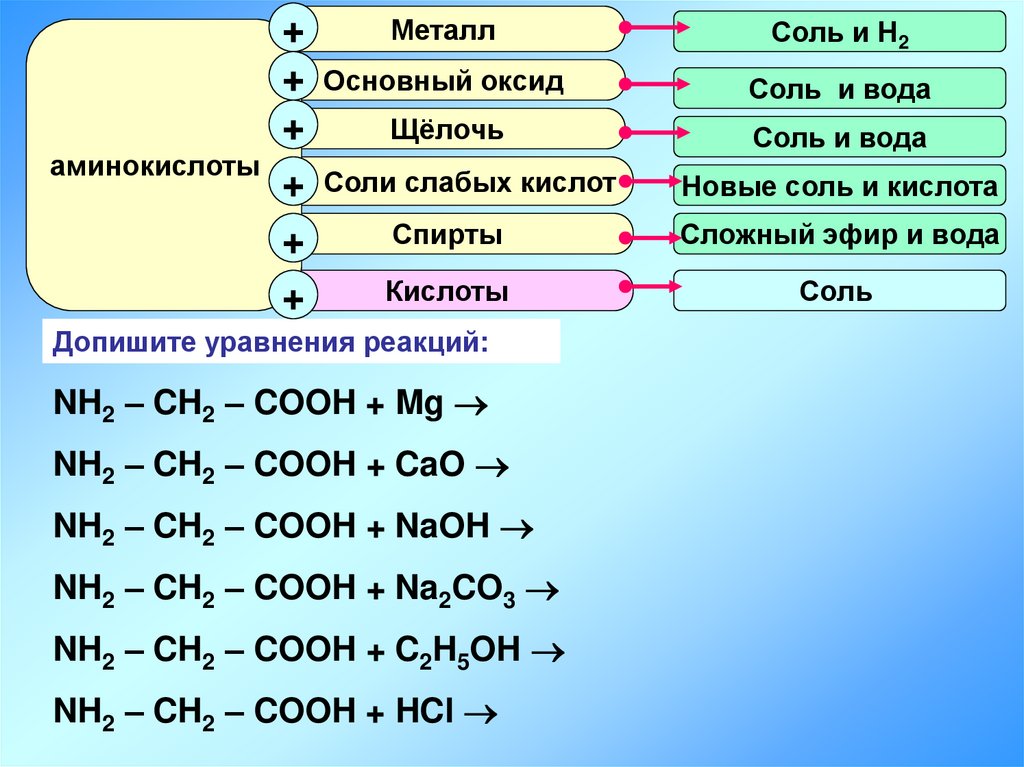
14.
Металл+
+ Основный оксид
Щёлочь
+
аминокислоты
+ Соли слабых кислот
Спирты
+
Кислоты
+
Допишите уравнения реакций:
NH2 – CH2 – COOH + Mg
NH2 – CH2 – COOH + CaO
NH2 – CH2 – COOH + NaOH
NH2 – CH2 – COOH + Na2CO3
NH2 – CH2 – COOH + C2H5OH
NH2 – CH2 – COOH + HCl
Соль и Н2
Соль и вода
Соль и вода
Новые соль и кислота
Сложный эфир и вода
Соль
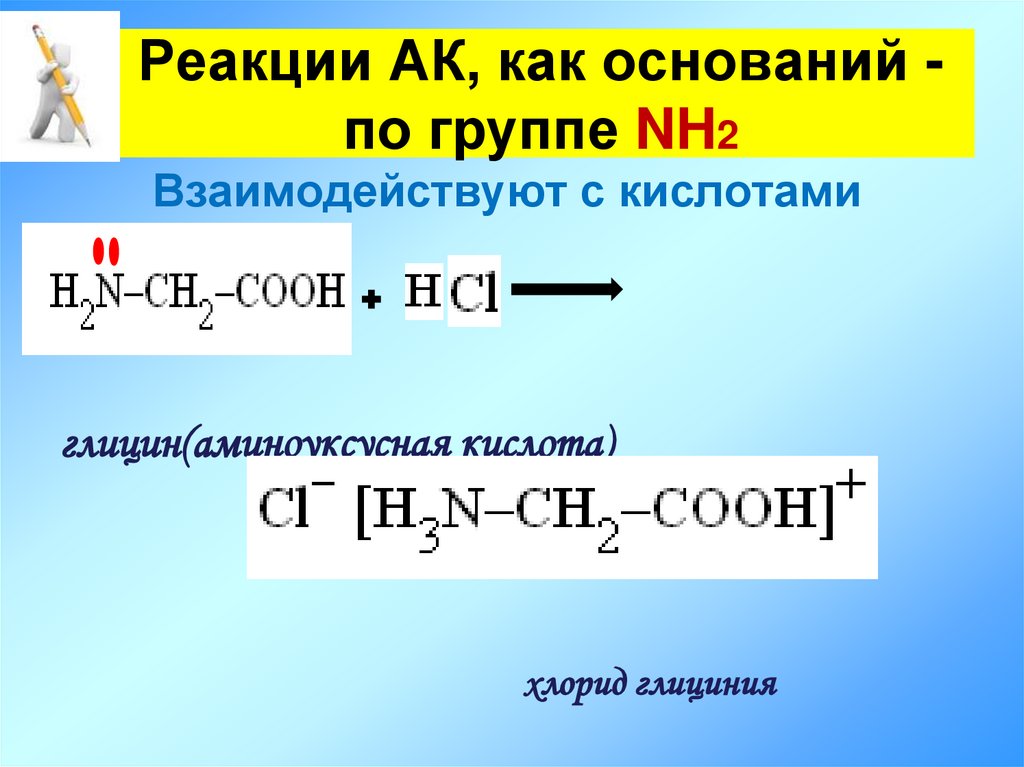
15. Реакции АК, как оснований - по группе NH2
Реакции АК, как оснований по группе NH2Взаимодействуют с кислотами
глицин(аминоуксусная кислота)
хлорид глициния
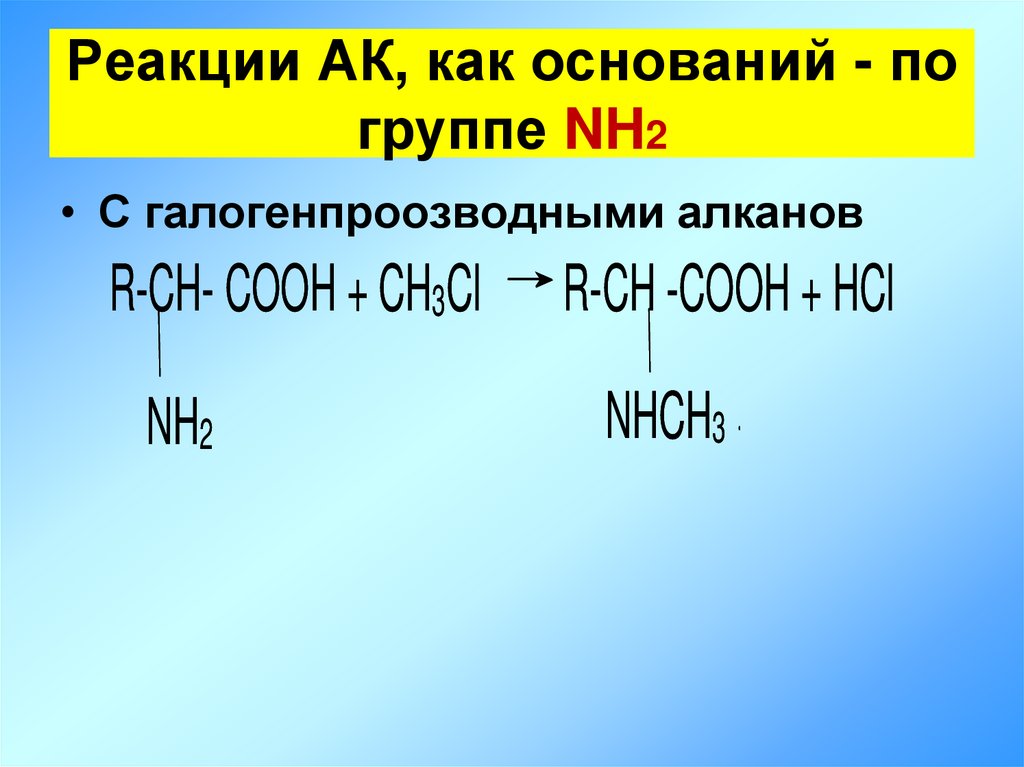
16. Реакции АК, как оснований - по группе NH2
• С галогенпроозводными алкановR-CH- COOH + CH3Cl
R-CH -COOH + HCl
NH2
NHCH3
17. Реакции АК, как кислот - по группе СООН
аминоацетат натрияВзаимодействие с основаниями.
18. Реакции АК, как кислот - по группе СООН
• Взаимодействуют сосновными оксидами,
так при нагревании
проходит реакция
между оксидом меди
(II) и глутаминовой
кислотой с
образованием соли
ярко синего цвета –
глутамата меди
• С металлами
2H2N-CH-COOH + Mg
R
(H2N-CH-COO)2Mg + H2
R
19. Реакция этерификации со спиртами
H2SO4 (к)NH2CH2COOH + C2H5OH
NH2CH2COOC2H5 + H2O
этиловый эфир аминоуксусной кислоты
20.
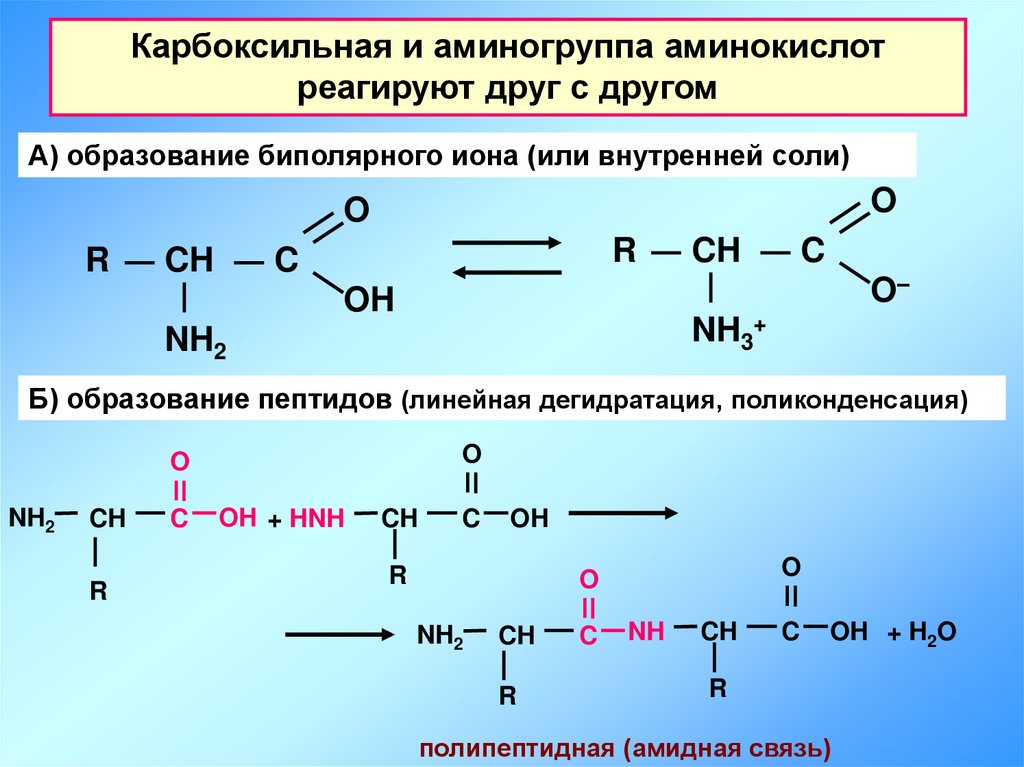
Карбоксильная и аминогруппа аминокислотреагируют друг с другом
А) образование биполярного иона (или внутренней соли)
O
O
R
CH
R
C
CH
C
O–
OH
NH3+
NH2
Б) образование пептидов (линейная дегидратация, поликонденсация)
O
O
NH2
CH
R
C
OH + HNH
CH
C
OH
R
O
O
NH2
CH
R
C
NH
CH
C
OH + H2O
R
полипептидная (амидная связь)
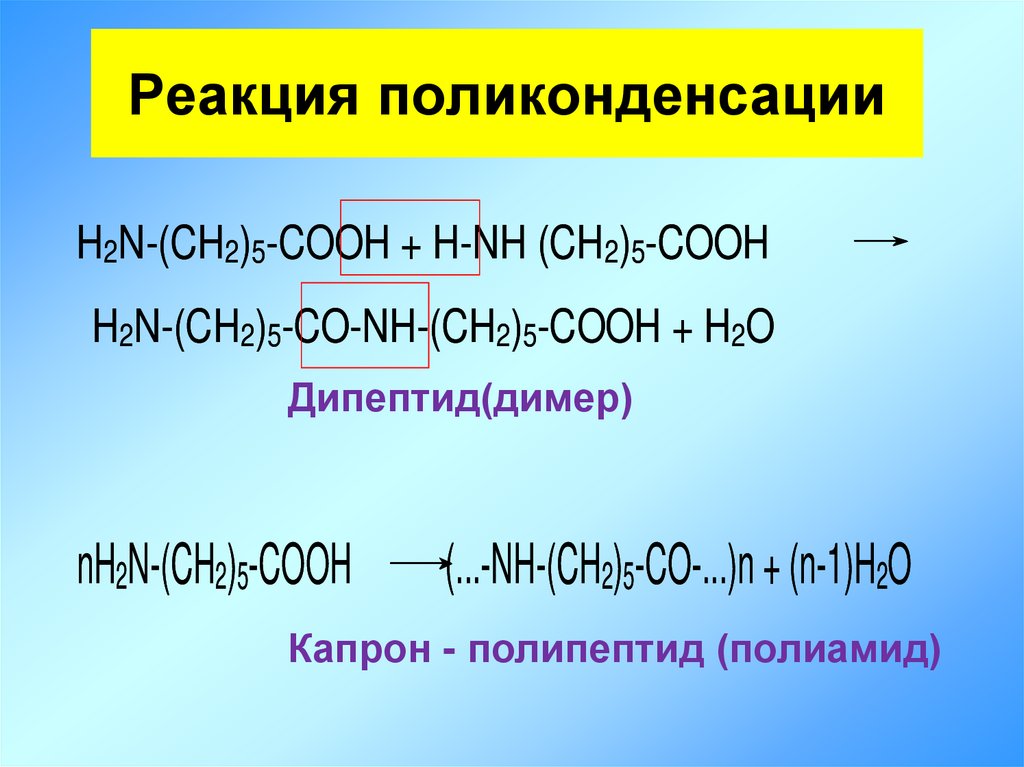
21. Реакция поликонденсации
H2N-(CH2)5-COOH + H-NH (CH2)5-COOHH2N-(CH2)5-CO-NH-(CH2)5-COOH + H2O
Дипептид(димер)
nH2N-(CH2)5-COOH
(...-NH-(CH2)5-CO-...)n + (n-1)H2O
Капрон - полипептид (полиамид)
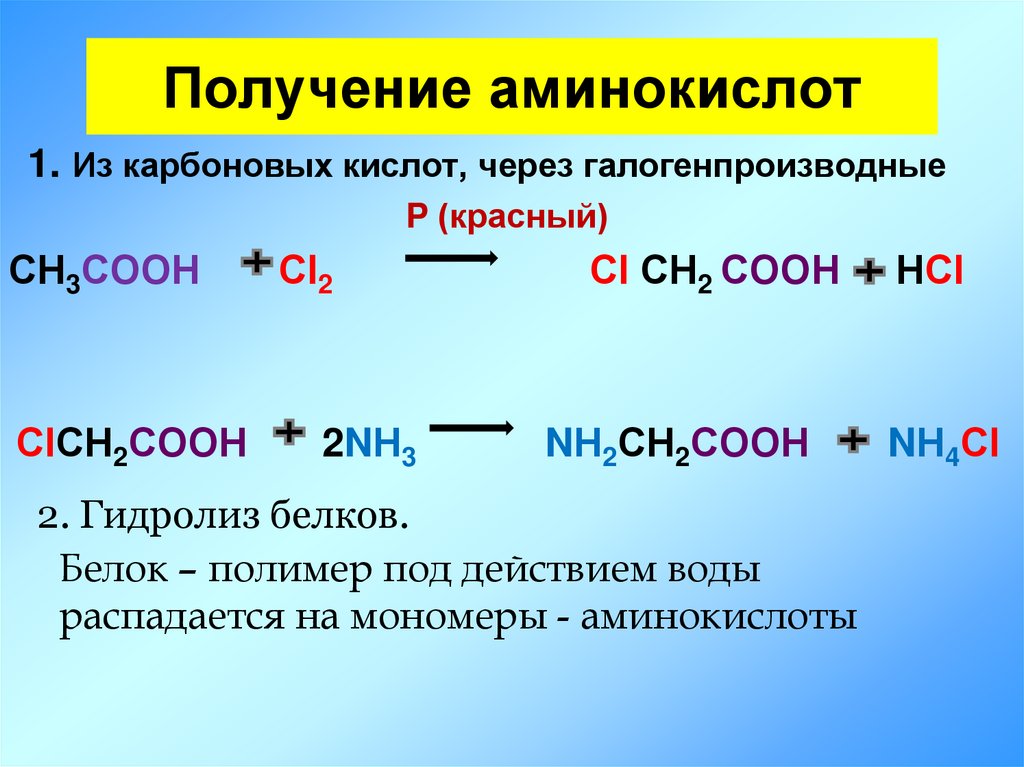
22. Получение аминокислот
1. Из карбоновых кислот, через галогенпроизводныеP (красный)
СН3СООН
СlСН2СООН
Сl2
2NН3
Сl СН2 СООН
NН2СН2СООН
2. Гидролиз белков.
Белок – полимер под действием воды
распадается на мономеры - аминокислоты
НСl
NН4Сl












 Химия
Химия








