Похожие презентации:
Неорганические и органические кислоты. Неорганические и органические основания
1.
Неорганические и органические кислоты.Неорганические и органические основания.
2.
Кислоты – это…• сложные вещества, состоящие из атомов водорода, способных
замещаться на атомы металла, и кислотного остатка.
• электролиты, при диссоциации которых в качестве катионов
образуются катионы водорода.
3.
Кислоты в природе• В растениях: плоды цитрусовых - лимонная и яблочная кислоты, травы —
щавелевая кислота.
• В организмах животных и насекомых: муравьи с помощью специальных желёз
вырабатывают муравьиную кислоту, тропический паук стреляет во врагов струйкой
жидкости, содержащей 84% уксусной кислоты.
• В организме человека: соляная кислота создаёт кислую среду в желудке,
необходимую для действия ферментов желудочного сока, уничтожает чужеродные
микроорганизмы, которые попадают в желудок с пищей, молочная кислота
образуется в мышцах при физической нагрузке.
• В дождевой воде: за счёт растворения углекислого газа из атмосферы она является
раствором угольной кислоты.
• В водах минеральных источников: сероводородная (Н2S) и угольная (H2CO3)
кислоты.
4.
Классификация кислот• По наличию атомов кислорода: бескислородные, кислородсодержащие
• По количеству атомов водорода, способных замещаться на металл (по
основности): одноосновные, двухосновные, многоосновные
• По силе (степени электролитической диссоциации): сильные, слабые
• По летучести: летучие, нелетучие
• По стабильности (устойчивости): стабильные (устойчивые), нестабильные
(неустойчивые)
5.
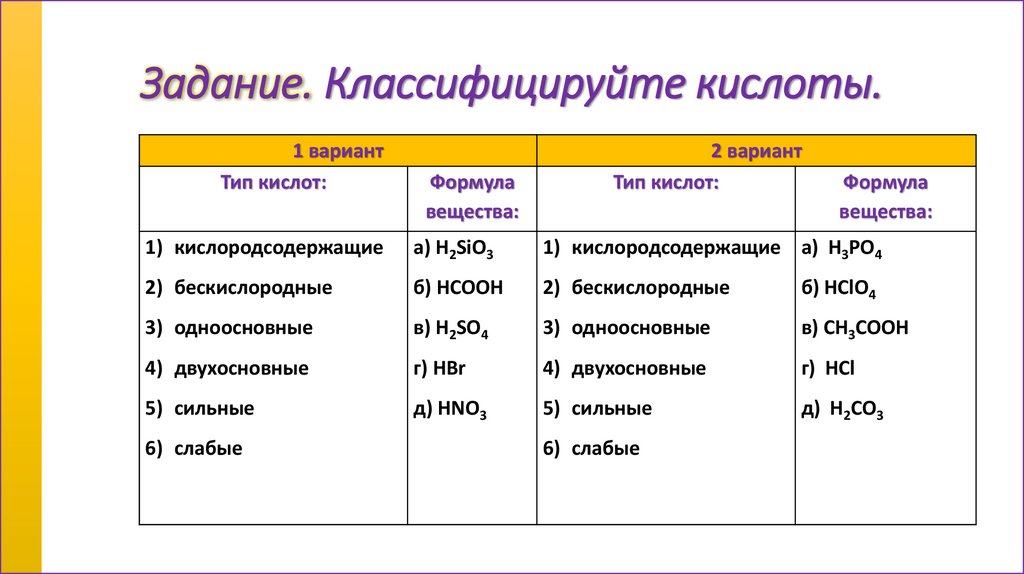
Задание. Классифицируйте кислоты.1 вариант
Тип кислот:
Формула
вещества:
2 вариант
Тип кислот:
Формула
вещества:
1) кислородсодержащие
а) H2SiO3
1) кислородсодержащие а) H3PO4
2) бескислородные
б) HCOOH
2) бескислородные
б) HClO4
3) одноосновные
в) H2SO4
3) одноосновные
в) CH3COOH
4) двухосновные
г) HBr
4) двухосновные
г) HCl
5) сильные
д) HNO3
5) сильные
д) H2CO3
6) слабые
6) слабые
6.
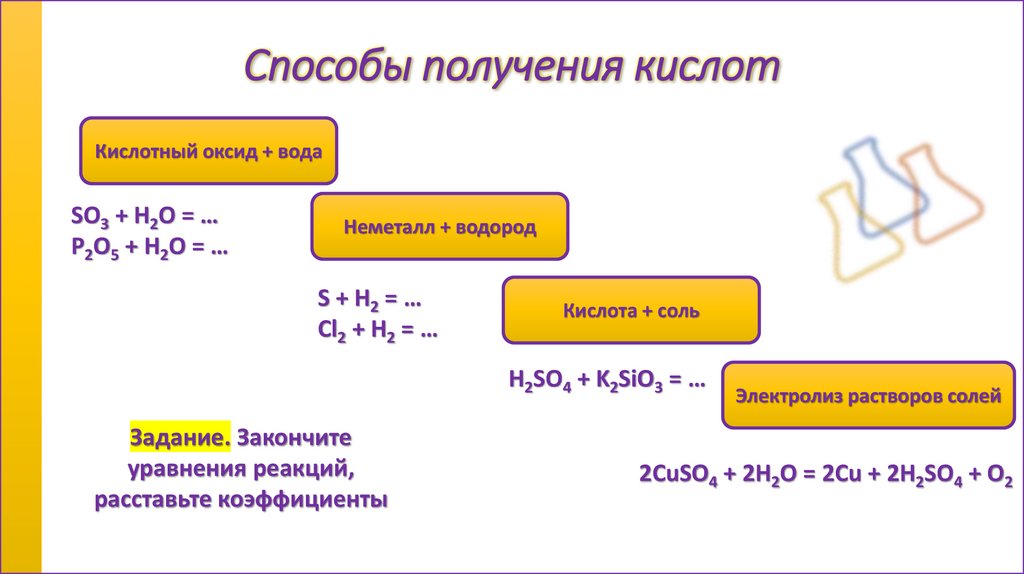
Способы получения кислотКислотный оксид + вода
SO3 + H2O = …
P2O5 + H2O = …
Неметалл + водород
S + H2 = …
Cl2 + H2 = …
Кислота + соль
H2SO4 + K2SiO3 = …
Задание. Закончите
уравнения реакций,
расставьте коэффициенты
Электролиз растворов солей
2CuSO4 + 2H2O = 2Cu + 2H2SO4 + O2
7.
Химические свойства кислот• Диссоциация
• Взаимодействие с металлами
• Взаимодействие с основными и амфотерными оксидами
• Взаимодействие с основаниями
• Взаимодействие с солями
8.
Задание. Закончите уравнения реакций,расставьте коэффициенты
• H2SO4 = …
CH3COOH = …
• HCl + Zn = …
CH3COOH + Mg = …
• HCl + Al2O3 = …
CH3COOH + CuO = …
• H2SO4 + Cu(OH)2= …
CH3COOH + NaOH = …
• HCl + AgNO3 = …
CH3COOH + Na2CO3 = …
9.
Применение кислот• Производство удобрений: серная, азотная, ортофосфорная.
• Синтез веществ: полимеры, красители, лекарства, растворители,
волокна.
• Производство аккумуляторов.
• Пищевая промышленность.
• Производство средств бытовой химии.
• В быту.
10.
Основания – это…• сложные вещества, молекулы которых состоят из атома металла
и одной или нескольких гидроксогрупп.
• электролиты, которые при диссоциации в водных растворах
образуют один вид анионов — гидроксид-ионы OHˉ.
11.
Основания в природе• широко распространённые минералы. Образуются при
химическом выветривании горных пород, а также в процессе
осадконакопления в морских и континентальных водоёмах
(болота, озёра).
гётит
бёмит
12.
Классификация оснований• По растворимости в воде: растворимые (щёлочи), нерастворимые
• По количеству гидроксогрупп (по кислотности): однокислотные,
двухкислотные
• По силе (степени электролитической диссоциации): сильные,
слабые
• По летучести: летучие, нелетучие
• По стабильности (устойчивости): стабильные (устойчивые),
нестабильные (неустойчивые)
13.
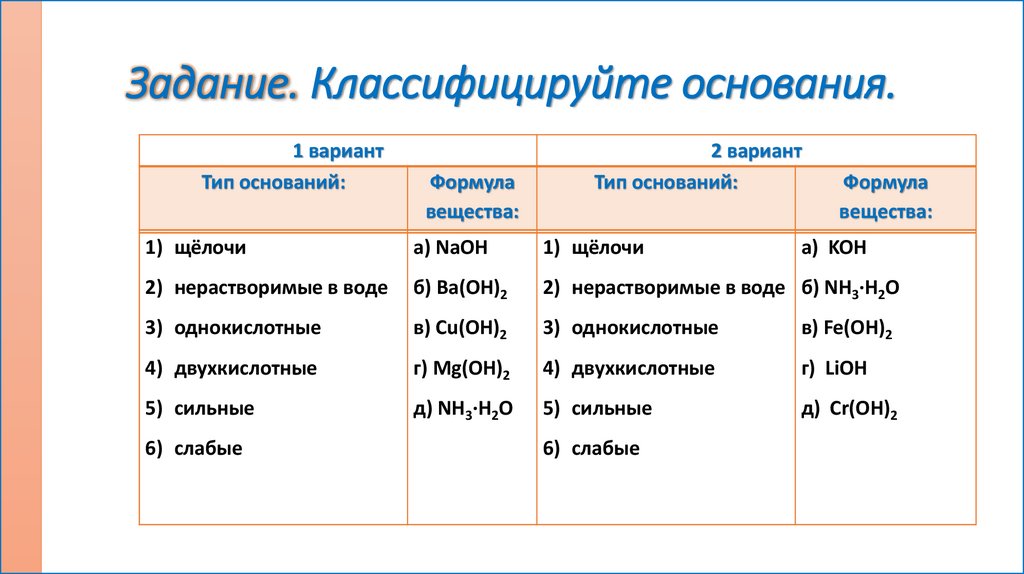
Задание. Классифицируйте основания.1 вариант
Тип оснований:
Формула
вещества:
2 вариант
Тип оснований:
Формула
вещества:
1) щёлочи
а) NaOH
1) щёлочи
2) нерастворимые в воде
б) Ba(OH)2
2) нерастворимые в воде б) NH3∙H2O
3) однокислотные
в) Cu(OH)2
3) однокислотные
в) Fe(OH)2
4) двухкислотные
г) Mg(OH)2
4) двухкислотные
г) LiOH
5) сильные
д) NH3∙H2O
5) сильные
д) Cr(OH)2
6) слабые
6) слабые
а) KOH
14.
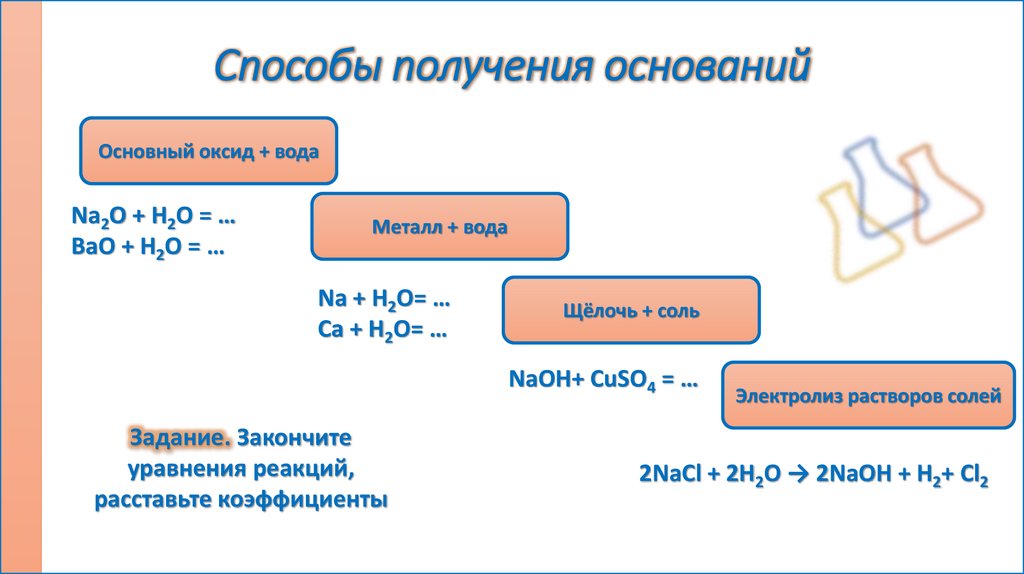
Способы получения основанийОсновный оксид + вода
Na2O + H2O = …
BaO + H2O = …
Металл + вода
Na + H2O= …
Ca + H2O= …
Щёлочь + соль
NaOH+ CuSO4 = …
Задание. Закончите
уравнения реакций,
расставьте коэффициенты
Электролиз растворов солей
2NaCl + 2H2O → 2NaOH + H2+ Cl2
15.
Химические свойства оснований• Диссоциация
• Взаимодействие с кислотными оксидами
• Взаимодействие с кислотами
• Взаимодействие с солями
• Разложение при нагревании
16.
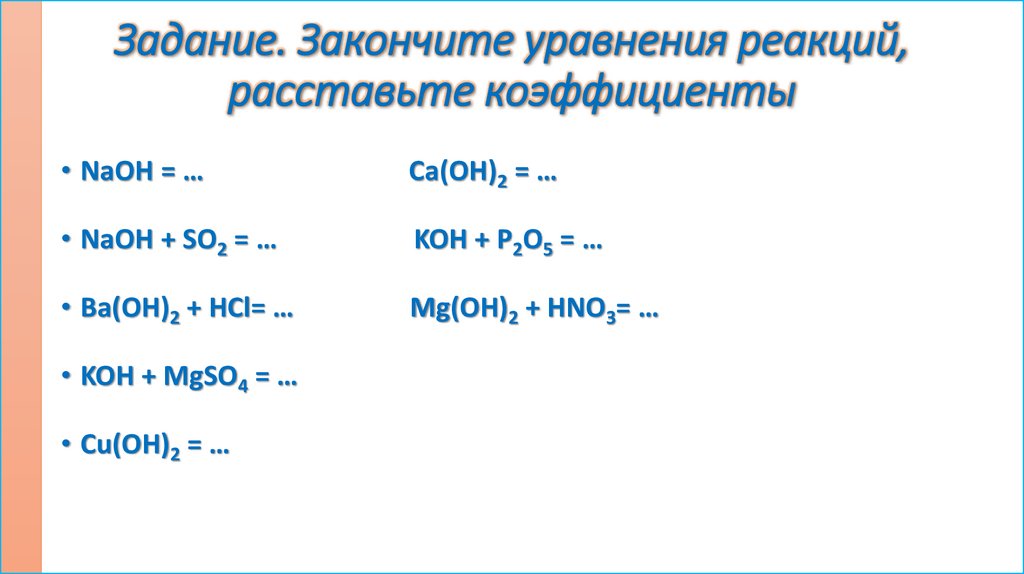
Задание. Закончите уравнения реакций,расставьте коэффициенты
• NaOH = …
Ca(OH)2 = …
• NaOH + SO2 = …
KOH + P2O5 = …
• Ba(OH)2 + HCl= …
Mg(OH)2 + HNO3= …
• KOH + MgSO4 = …
• Cu(OH)2 = …
17.
Применение оснований• Средства бытовой химии: щёлочи используют для растворения
жира.
• Медицина: гидроксид магния для нейтрализации кислоты и
снятия симптомов изжоги изжоги. Очистка сточных вод:
гидроксид кальция используют на водоочистных сооружениях
для смягчения воды и осаждения примесей.
• Пищевая
промышленность:
гидроксид
кальция
для
производства сахара.
• Окрашивание и отделка волокон: помогают улучшить действие
красителей и свойства ткани.
• Строительство: гидроксид кальция – побелка.












 Химия
Химия








