Похожие презентации:
Потенциометрическое определение произведения растворимости гидроксида меди
1.
Потенциометрическое определениепроизведения растворимсоти
гидроксида меди
Выполнил - студент ВГУ, Химического факультета
Волков Владислав Дмитриевич
Руководитель - к.х.н, доцент С.Н. Грушевская
2.
ВведениеАктуальность работы:
Изучение растворимости малорастворимых соединений, таких как гидроксид меди(II),
позволяя углубить знания о гетерогенных равновесиях, процессах комплексообразования и факторах, влияющих на растворимость.
Объект исследования:
Гидроксид меди(II)
Предмет исследования:
Произведение растворимости Cu(OH)₂ и метод её потенциометрического определения
3.
Цели и задачиЦель:
Исследовать растворимость гидроксида меди(II) в зависимости от pH с использованием
потенциометрического метода
Задачи:
1.Анализ литературных данных по ПР Cu(OH)₂ и потенциометрии
2. Приготовление насыщенных растворов Cu(OH)₂ различной концентрации
3. Измерение потенциалов электрохимической ячейки
4. Построение калибровочных кривых и кривых титрования
5. Расчет произведения растворимости
6. Оценка точности метода и анализ погрешностей
4.
5.
Экспериментальная частьОборудование и реактивы: Потенциометрическая установка со стеклянным электродом,
хлоридсеребряный электрод сравнения, магнитная мешалка, бюретка, мерные колбы,
стандартные буферные растворы (pH 1.68-12.43), CuSO₄ (0.05, 0.02, 0.01, 0.005 М),
NaOH, 1 М H₂SO₄, дистиллированная вода.
Методика эксперимента:
1. Приготовление растворов CuSO₄ (0.05 М, 0.02 М, 0.01 М, 0.005 М)
2. Калибровка электрода по 6 стандартным буферным растворам
3. Потенциометрическое титрование р-ров разной концетрации CuSO₄ р-ром NaOH
6.
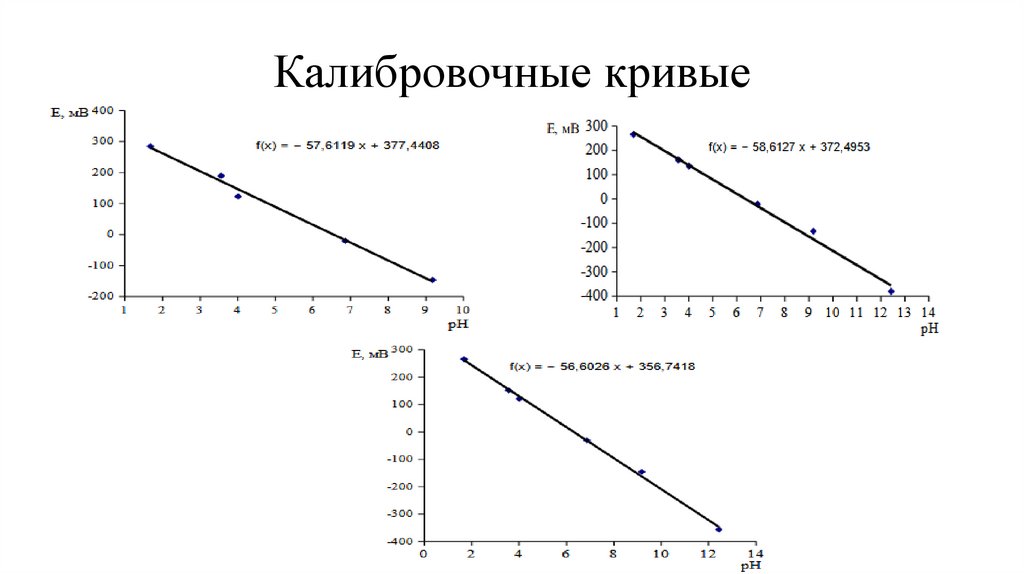
Обработка данныхПостроение калибровочных кривых E - pH
Наклоны кривых титрования соответствуют теоритическому значению из уравнени
я
Нернста(-58.6 мВ ) -57.6 ÷ -58.6 мВ
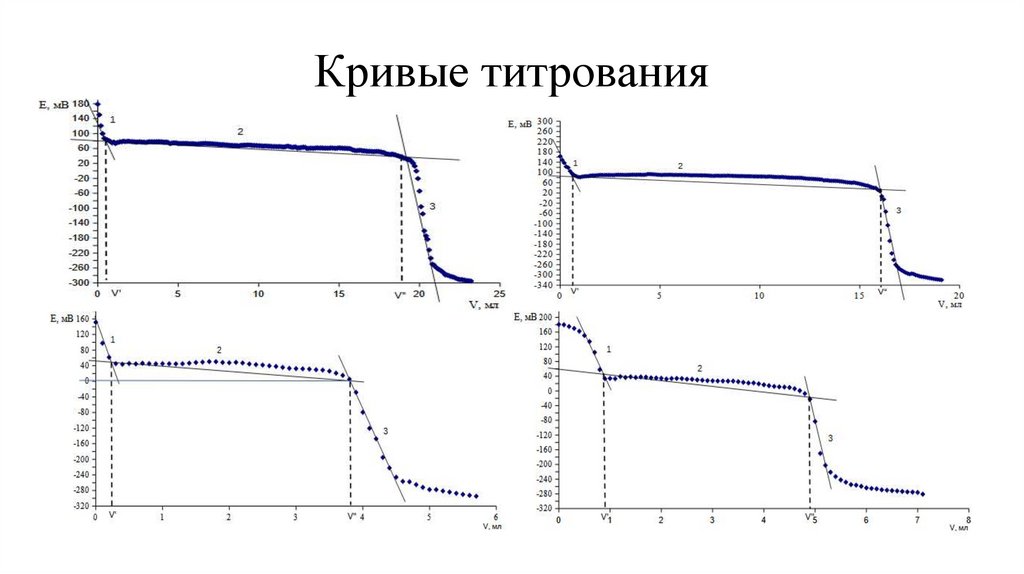
Построение кривых титрования E - V(NaOH)
Определение точек эквивалентности методом касательных
Расчет:
Активностей ионов Cu²⁺
pH начала и конца осаждения
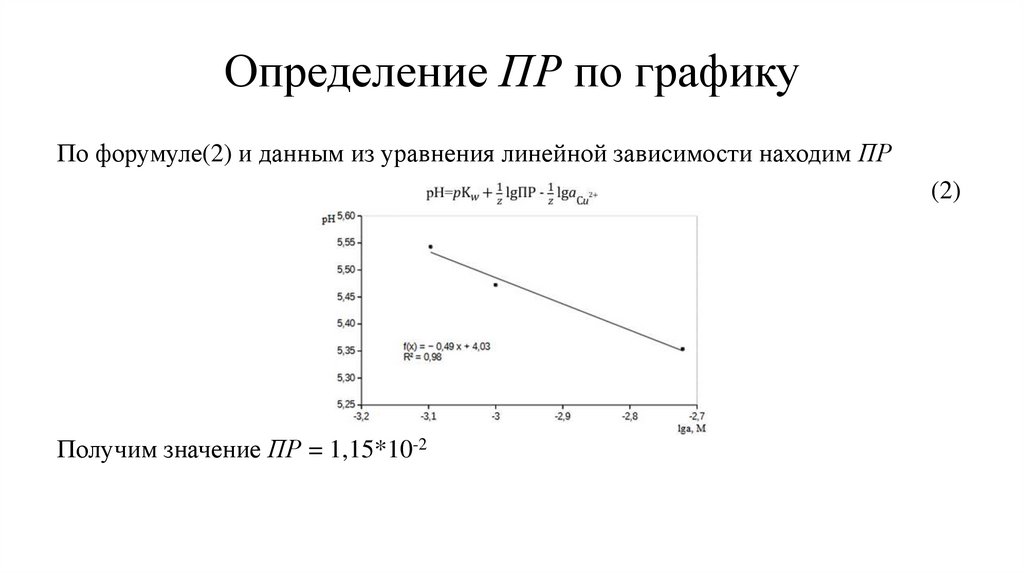
Определение ПР по графику зависимости pH - lga(H+)
7.
Калибровочные кривые8.
Кривые титрования9.
Полученнные данныеАктивности находятся по формуле:
Рассчитанные данные:
10.
Определение ПР по графикуПо форумуле(2) и данным из уравнения линейной зависимости находим ПР
(2)
Получим значение ПР = 1,15*10-2
11.
ЗаключениеВ ходе выполнения работы было проведено изучение литературы по темам
“Потенциаметрическое титрование”, “Произведение растворимости и его
опредение потенциаметрическим методом”. Также экспериментально получено
произведение растворимости гидроксида меди потенциаметрическим титрованием.
Произведенно сравнение с теоретическими данными и








 Химия
Химия








