Похожие презентации:
Строение многоэлектронных атомов. Периодическая система элементов Д.И.Менделеева Оптические спектры
1.
ШПАРГАЛКА №3Строение многоэлектронных атомов.
Периодическая система элементов Д.И.Менделеева
Оптические спектры.
Результирующий момент многоэлектронного атома
1
2.
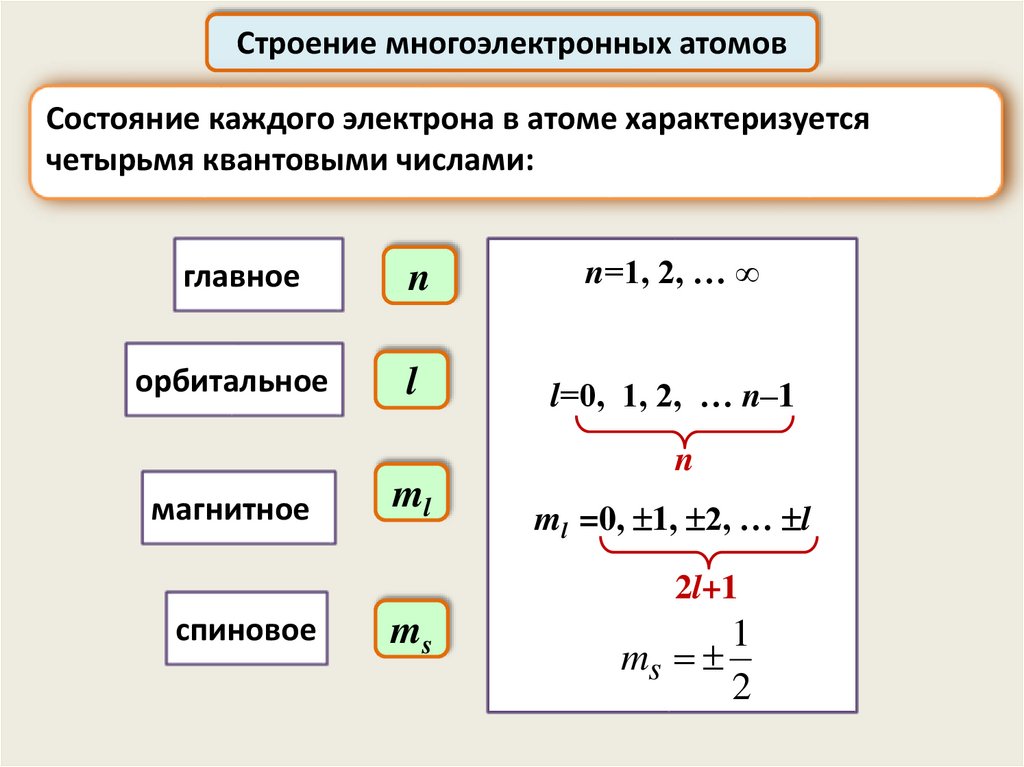
Строение многоэлектронных атомовСостояние каждого электрона в атоме характеризуется
четырьмя квантовыми числами:
главное
n
n=1, 2, … ∞
орбитальное
l
l=0, 1, 2, … n–1
n
магнитное
ml
ml =0, 1, 2, … l
2l+1
спиновое
ms
1
ms
2
3.
Данному n соответствуют n2 состояний,отличающихся значениями l и ml
В атоме водорода энергия электрона:
- зависит от n
- слабо зависит от ms
- не зависит от l и ml
Каждый уровень энергии является вырожденным,
причём кратность вырождения равна n2
n 1
2l 1 n
l 0
2
4.
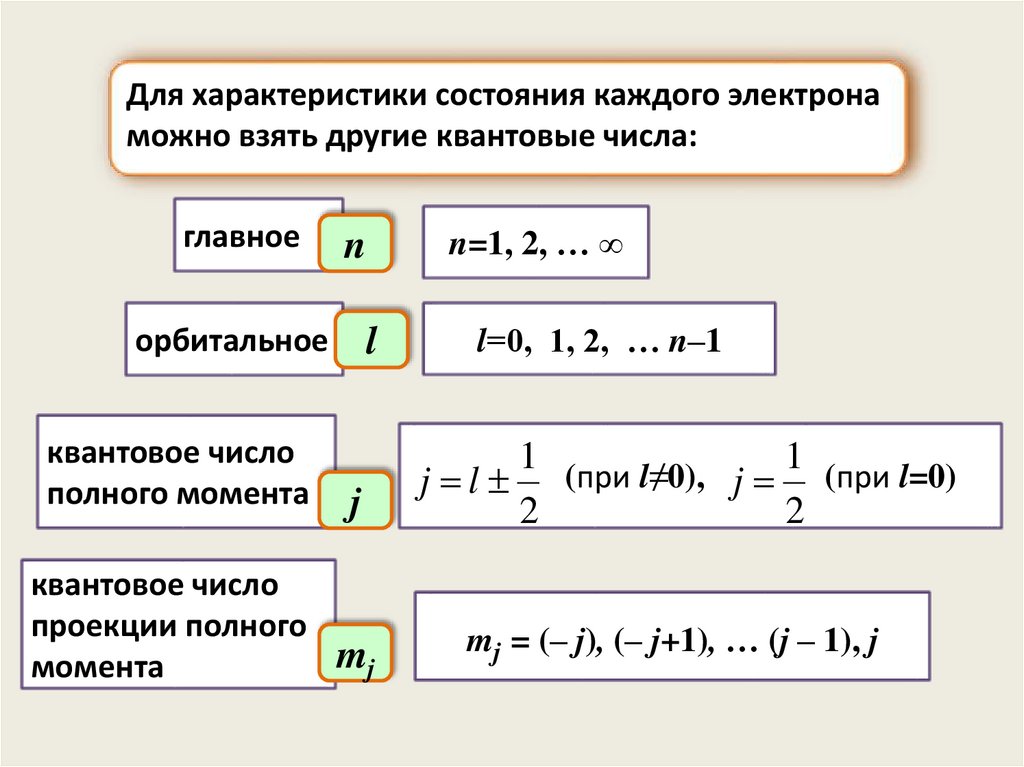
Для характеристики состояния каждого электронаможно взять другие квантовые числа:
главное
n
орбитальное
l
квантовое число
полного момента
j
квантовое число
проекции полного
mj
момента
n=1, 2, … ∞
l=0, 1, 2, … n–1
1 (при l≠0),
1 (при l=0)
j l
j
2
2
mj = (– j), (– j+1), … (j – 1), j
5.
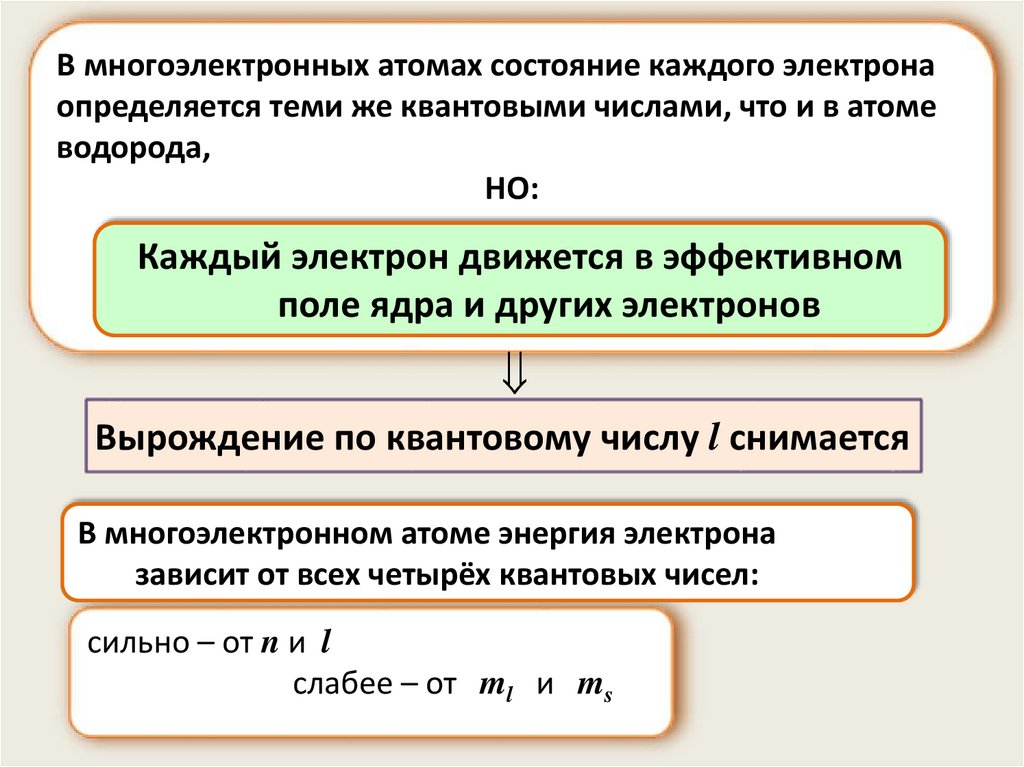
В многоэлектронных атомах состояние каждого электронаопределяется теми же квантовыми числами, что и в атоме
водорода,
НО:
Каждый электрон движется в эффективном
поле ядра и других электронов
Вырождение по квантовому числу l снимается
В многоэлектронном атоме энергия электрона
зависит от всех четырёх квантовых чисел:
сильно – от n и l
слабее – от ml и ms
6.
Распределение электронов в атоме по уровнямэнергии осуществляется в соответствии с принципами:
Принцип Паули:
В одном атоме не может быть двух и более электронов,
находящихся в одинаковом стационарном состоянии, то
есть с одинаковым набором всех четырёх квантовых
чисел
Принцип минимума энергии
В первую очередь заполняются уровни с минимальной
энергией, то есть с наименьшими квантовыми числами
n, l, ml, ms
7.
Почти всегда:Состояние с большим n обладает большей энергией
В нормальном (невозбуждённом) состоянии атома
электроны располагаются на самых низких уровнях
Оболочка - совокупность электронов, имеющих одинаковые
nиl
Слой - совокупность оболочек с одинаковым n
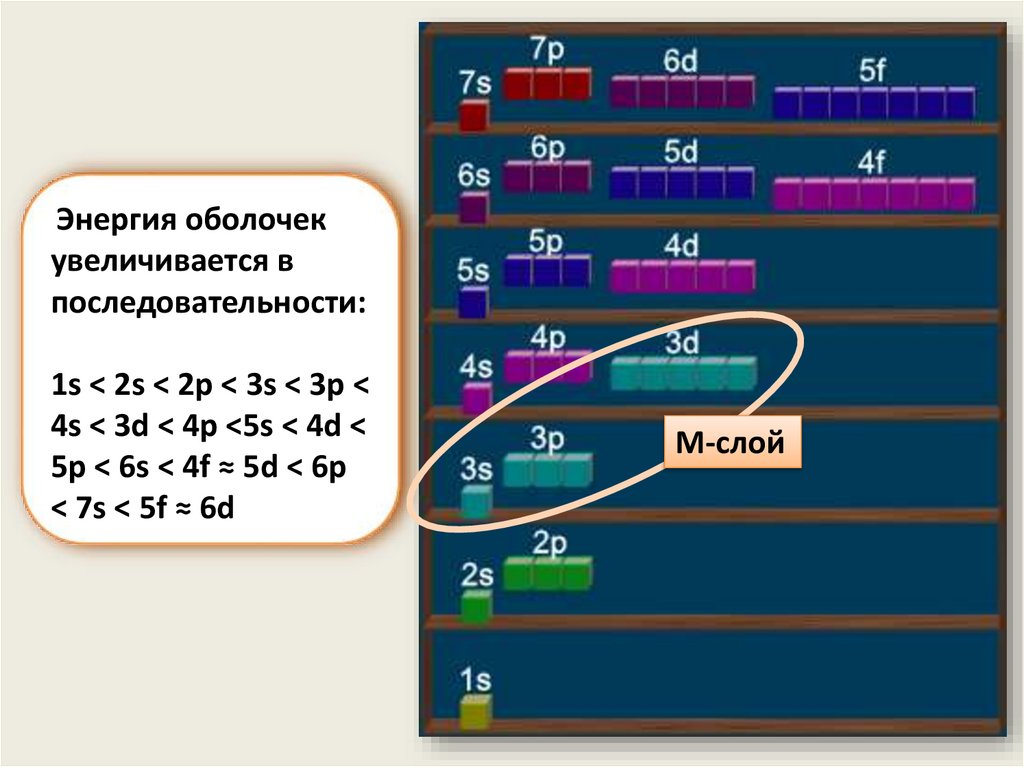
8.
Энергия оболочекувеличивается в
последовательности:
1s < 2s < 2p < 3s < 3p <
4s < 3d < 4p <5s < 4d <
5p < 6s < 4f ≈ 5d < 6p
< 7s < 5f ≈ 6d
M-слой
9.
Заполняется K-слой:Водород; электронная конфигурация 1s
Гелий; электронная конфигурация 1s2
K-слой
Водород 1s
Гелий 1s2
10.
Заполняется L-слой; n=2:Литий; три электрона; электронная конфигурация 1s22s
Третий электрон слабее связан с ядром
Он определяет оптические и химические свойства атома
Бериллий; 4 электрона; 1s22s2
Оболочка 2s заполнена
Дальше (B, C, N, O, F, Ne) заполняется оболочка 2p
Неон (10): полностью заполненные слои K (2 электрона) и L (8
электронов); образуют устойчивую систему (как у гелия),
которая определяет специфические свойства инертных газов
L-слой
K-слой
Литий 1s22s
Неон 1s22s22p6
11.
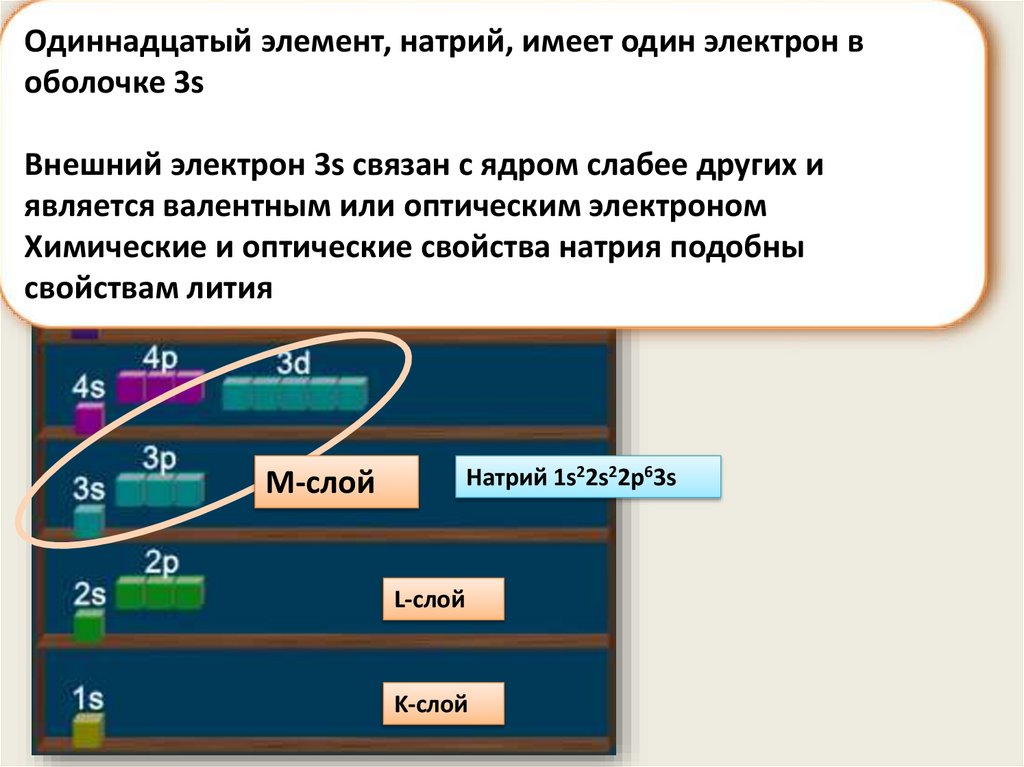
Одиннадцатый элемент, натрий, имеет один электрон воболочке 3s
Внешний электрон 3s связан с ядром слабее других и
является валентным или оптическим электроном
Химические и оптические свойства натрия подобны
свойствам лития
Натрий 1s22s22p63s
M-слой
L-слой
K-слой
12.
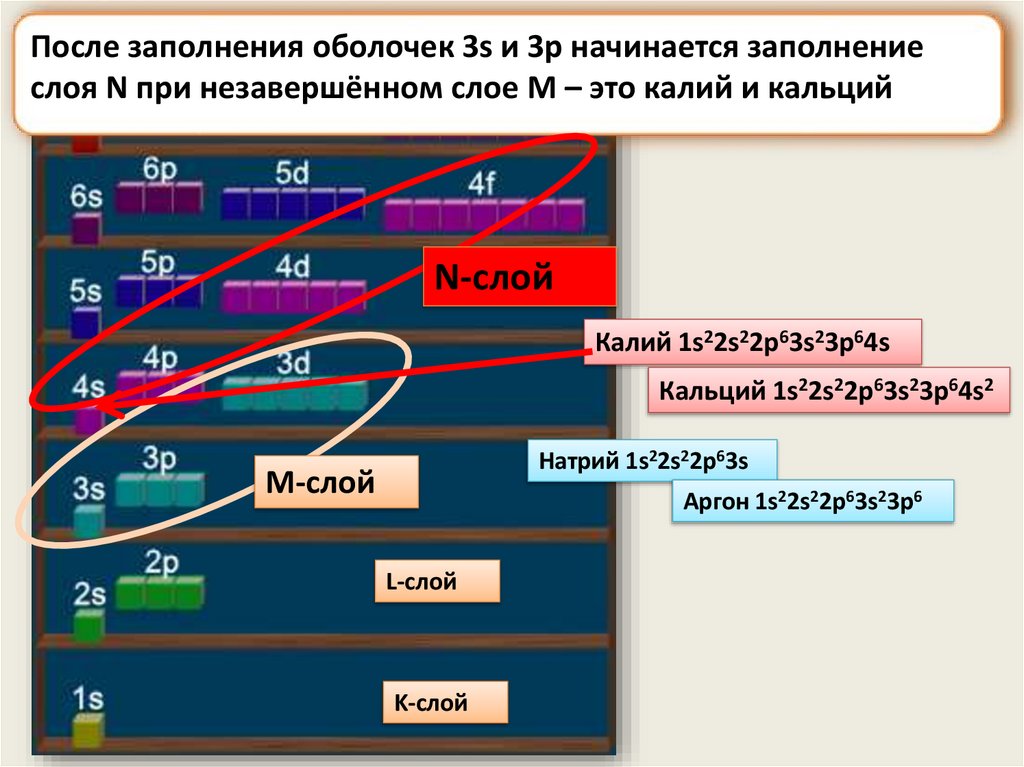
После заполнения оболочек 3s и 3p начинается заполнениеслоя N при незавершённом слое M – это калий и кальций
N-слой
Калий 1s22s22p63s23p64s
Кальций 1s22s22p63s23p64s2
Натрий 1s22s22p63s
M-слой
Аргон 1s22s22p63s23p6
L-слой
K-слой
13.
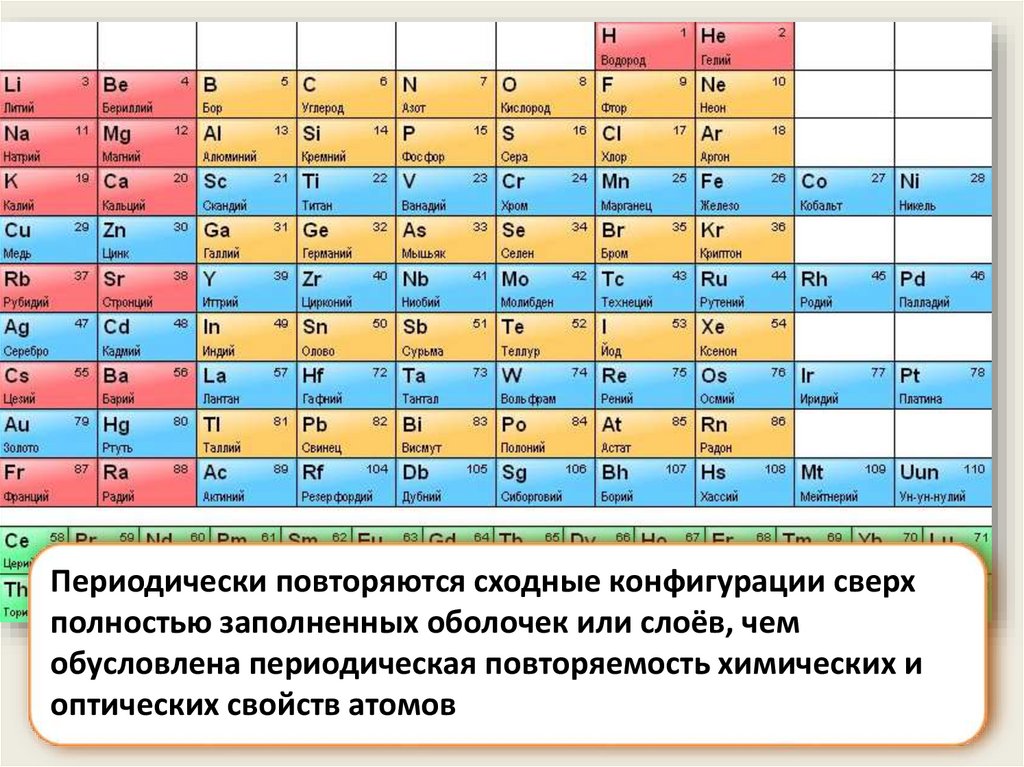
Периодически повторяются сходные конфигурации сверхполностью заполненных оболочек или слоёв, чем
обусловлена периодическая повторяемость химических и
оптических свойств атомов
14.
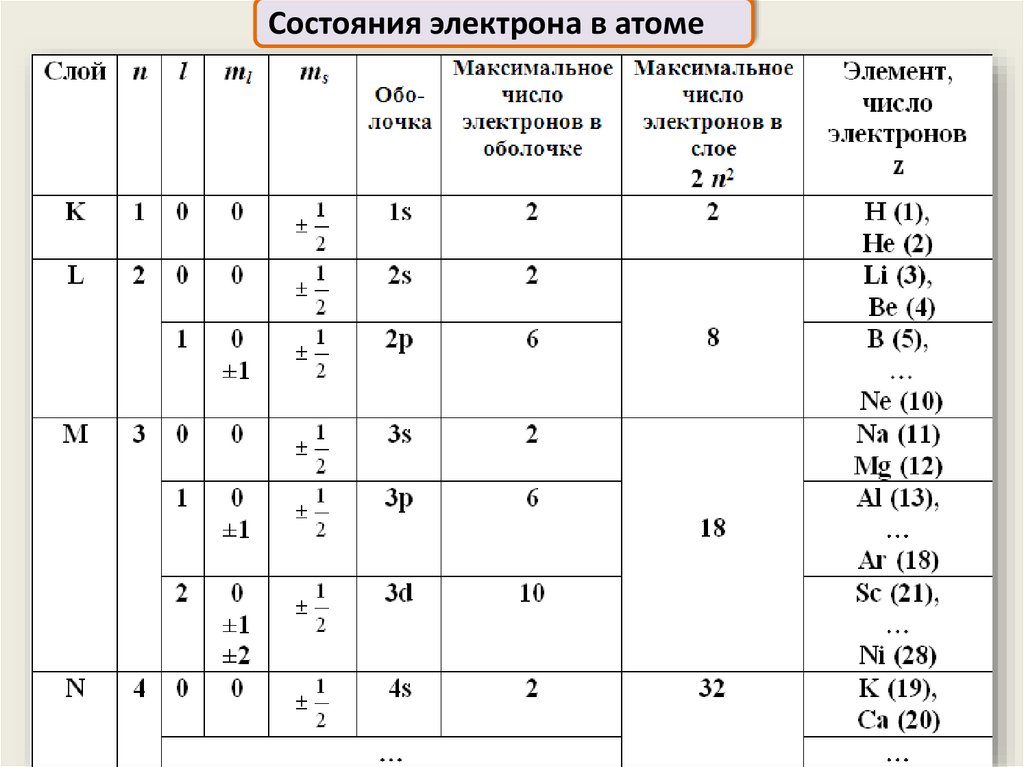
Состояния электрона в атоме15.
Результирующий момент многоэлектронного атомаКаждый электрон в атоме обладает орбитальным моментом
импульса
Ll
Ls
и собственным (спиновым) моментом
Механические моменты связаны с соответствующими
магнитными моментами
Поэтому между моментами электронов атома есть
взаимодействие
Механический и магнитный моменты атома складываются из
орбитальных и спиновых моментов отдельных электронов
У лёгких и средних атомов орбитальные моменты электронов
взаимодействуют сильнее между собой, чем со спиновыми
моментами
Спиновые связаны сильнее друг с другом, чем с
орбитальными
16.
Результирующий момент многоэлектронного атомаВсе орбитальные моменты электронов атома складываются
в результирующий момент
LL
Спиновые моменты электронов складываются в
результирующий спиновый момент
LS
Суммарный момент атома:
LJ LL LS
Все они квантуются
17.
Результирующий момент многоэлектронного атомаLJ LL LS
Квантование моментов:
LL L L 1
LS S S 1
LJ J J 1
L – орбитальное квантовое число атома
S – спиновое квантовое число атома
J – квантовое число результирующего момента
Квантовое число J результирующего момента импульса
атома может иметь одно из следующих значений:
J=L+S; L+S–1 ; L+S–2; …│L–S│
18.
Результирующий момент многоэлектронного атомаПример: в атоме два электрона
Квантовое число L атома может иметь значения:
L = l1+l2,
l1+l2–1,
l1+l2–2, … |l1– l2|
где l1 и l2 – орбитальные квантовые числа,
определяющие модули складываемых моментов:
Ll l l 1
19.
Результирующий момент многоэлектронного атомаПроекции тоже квантуются:
проекция результирующего орбитального момента на
некоторое направление Z : L
m
Lz
L
mL= – L, – L+1, … , L – 1,
L
Проекция результирующего спинового момента на ось Z:
LSz mS
mS= – S, – S+1, … , S – 1,
S
Проекция полного механического момента атома на
направление Z : L
m
Jz
J
mJ= – J, – J+1, … , J – 1,
J
20.
Результирующий момент многоэлектронного атомаС механическими моментами связаны магнитные
моменты, которые взаимодействуют между собой
Поэтому энергия атома зависит от взаимной
ориентации всех моментов
21.
Результирующий момент многоэлектронного атомаЕсли внутренние оболочки атома полностью
заполнены, нужно учитывать только внешние,
валентные (оптические) электроны
Пример:
Для одноэлектронного атома (или атома с
единственным валентным электроном) s=½,
возможны 2 значения квантового числа
результирующего момента: j=l±½, если l≠0; а
при l=0 j принимает единственное значение j=½
22.
Оптические спектрыОптические спектры, возникающие при переходах слабее
всего связанных с ядром оптических (валентных)
электронов, лежат в видимой и ультрафиолетовой
областях
Схема энергетических уровней внешней электронной
оболочки многоэлектронных атомов гораздо сложнее, чем
у водородоподобных атомов
Поэтому оптические спектры атомов чрезвычайно сложны
23.
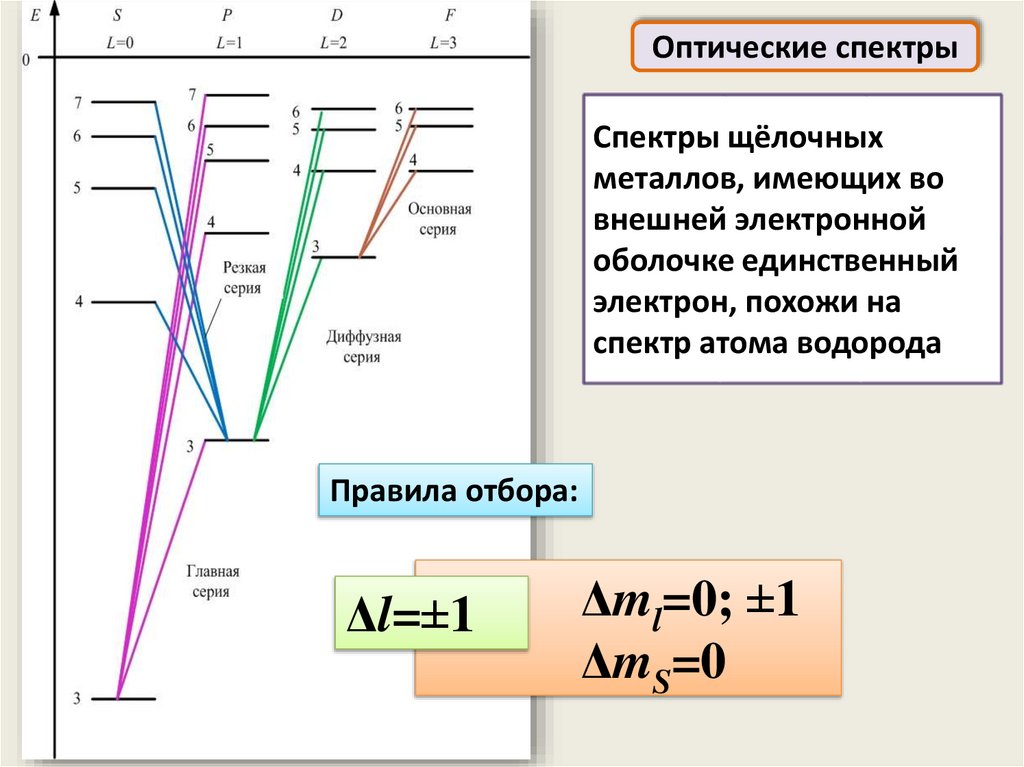
Оптические спектрыСпектры щёлочных
металлов, имеющих во
внешней электронной
оболочке единственный
электрон, похожи на
спектр атома водорода
Правила отбора:
Δl=±1
Δml=0; ±1
ΔmS=0
24.
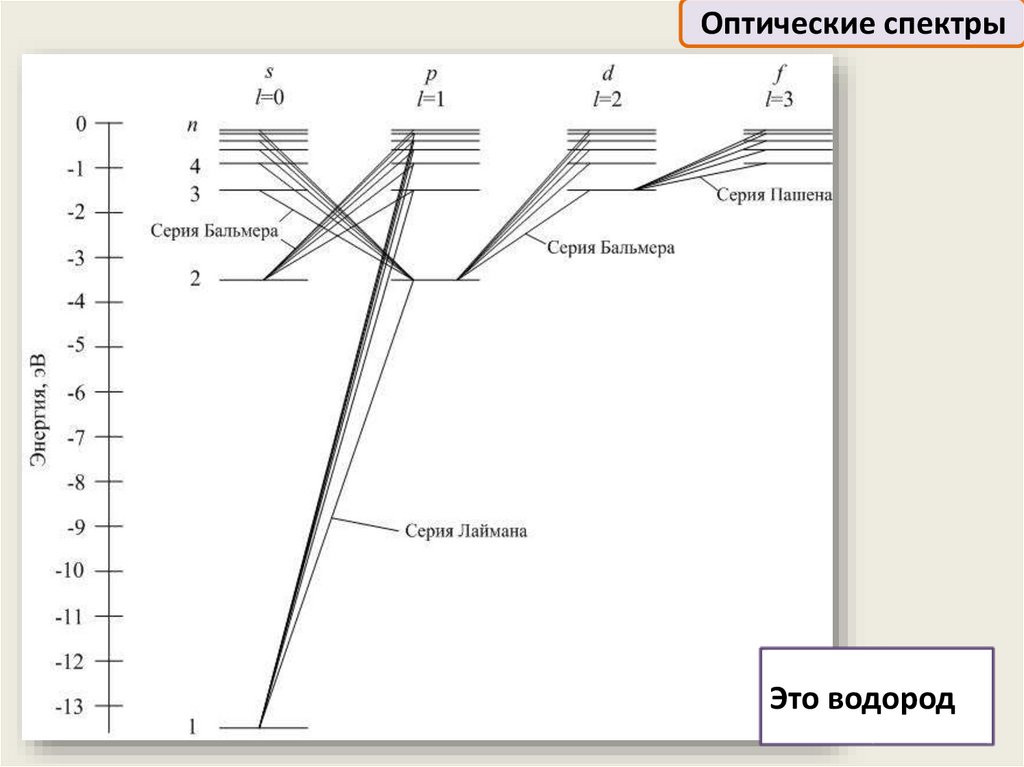
Оптические спектрыЭто водород














 Физика
Физика








