Похожие презентации:
Строение атома. Химия. Лекция
1. Химия
ЛекцияСтроение атома
2. Свойства электрона
• Электрон имеет двойственную природу. В разныхэкспериментах он может проявлять свойства как
частицы, так и волны. Движение электрона подчиняется
законам квантовой механики.
• Связь между волновыми и корпускулярными
свойствами электрона отражает соотношение де
Бройля:
l =h/mv ,
• где l - длина волны электрона; m - его масса; v скорость;
h = 6.62 10-34 Дж с - постоянная Планка.
3. Свойства электрона
• Положение и скорость электрона невозможноодновременно измерить с абсолютной точностью
(принцип неопределенностиГейзенберга). Поэтому
движение электрона в атоме или в молекуле нельзя
описать с помощью траектории. Электрон может
находиться в любой точке пространства, но с
разной вероятностью.
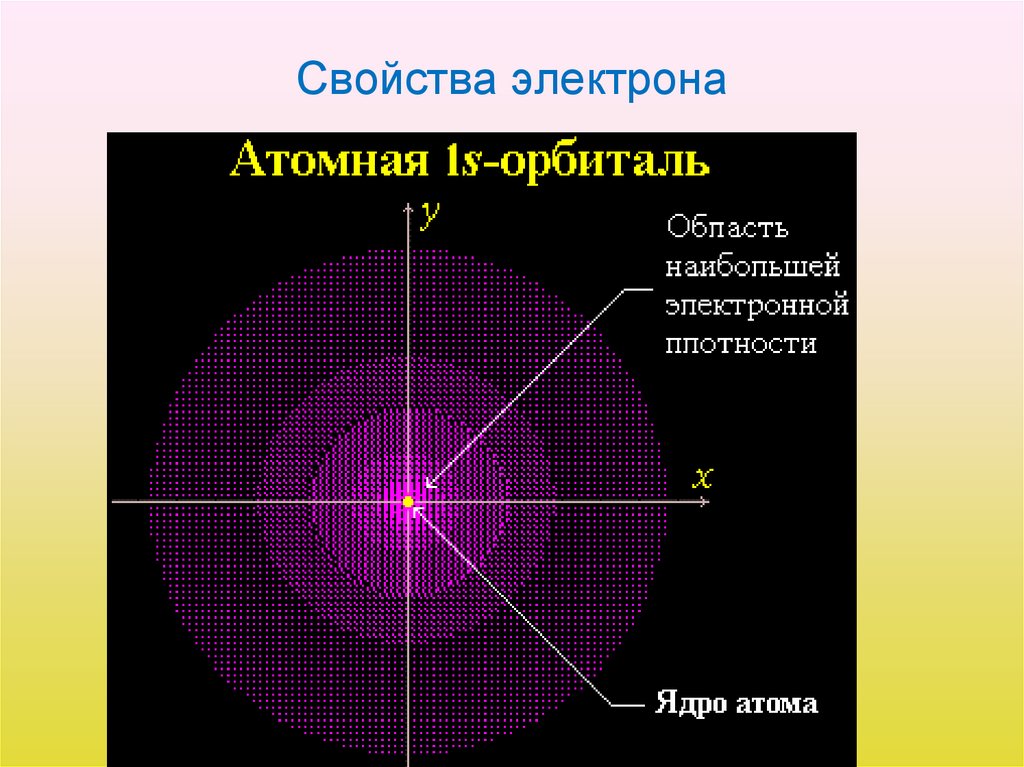
• Часть пространства, в котором велика вероятность
нахождения электрона, называют орбиталью или
электронным облаком.
4. Свойства электрона
5. Атомная орбиталь
• Атомная орбиталь (АО) – область атомногопространства, в которой движется электрон. Форму
АО характеризуют линиями и поверхностями с
одинаковым значением ψ2, которую называют
плотностью электронного облака.
• Таким образом, атомной орбитали соответствует
волновая функция ψ. Атомная орбиталь
характеризуется энергией, формой и
направлением в пространстве. Все эти
характеристики квантованы (изменяются
скачками), они описываются с помощью квантовых
чисел.
6. Квантовые числа
• Состояние электрона в атоме описываютчетыре квантовых числа, которые характеризуют
энергию электрона, форму электронного облака,
его ориентацию в пространстве и его спин.
• При переходе атома из одного состояния в
другое происходит перестройка электронного
облака, то есть изменяются значения квантовых
чисел, что сопровождается поглощением или
испусканием атомом квантов энергии.
7.
8.
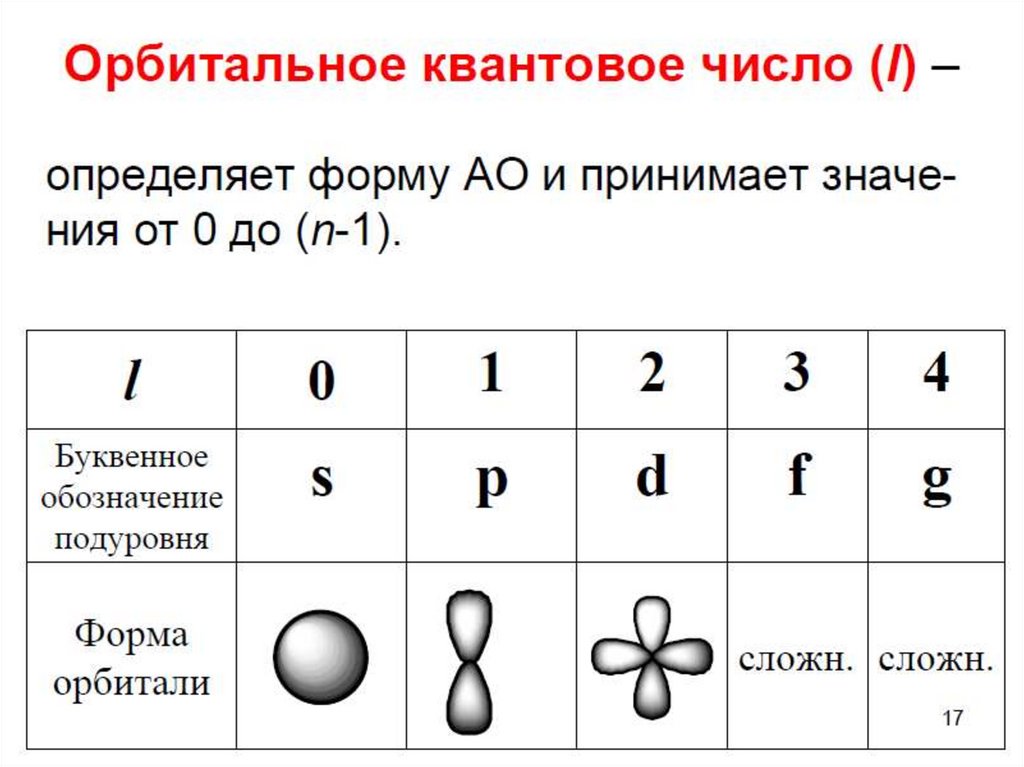
9. Орбитальное квантовое число
• Каждому значению l соответствуеторбиталь определенной формы.
• Решение уравнения Шредингера показало,
что s-орбиталь (l = 0) имеет форму шара, pорбиталь (l =1) форму гантели и т. д.
10. Орбитальное квантовое число
• Для электронов первого энергетическогоуровня (n = 1) возможна только одна форма
орбитали (s), для второго (n = 2) две (s и
p) и т. д.
• Таким образом, энергетические уровни
состоят из одного или нескольких
энергетических подуровней. Для n = 1
возможен только один подуровень с l = 0,
для n = 2 два с l = 0 и l =1 и т д.
11. Орбитальное квантовое число
• Состояние электрона в атоме обозначаютцифрами и буквами.
• Например, электрон, у которого n = 1 и l =
0, обозначают 1s.
• Состояние 4p означает, что электрон
находится на четвертом энергетическом
уровне (n = 4); форма орбитали
соответствует гантели (l = 1) и т.д.
12.
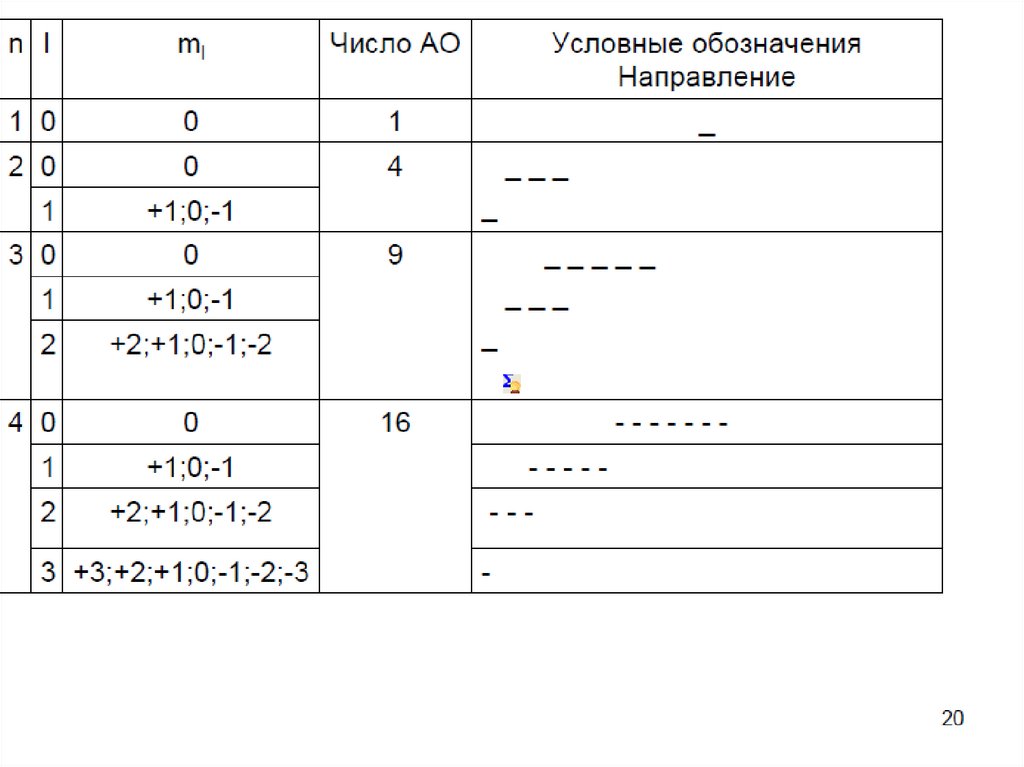
13. Магнитное квантовое число
• Например, если орбитальное квантовое числоравно 0 (s-орбиталь), то магнитное квантовое
число имеет одно значение (0), если орбитальное
квантовое число равно 1 (р-орбиталь), то
магнитное квантовое число имеет три значения:
–1, 0 и +1, а если орбитальное квантовое число
равно 2 (d-орбиталь), то магнитное квантовое
число имеет пять значений: –2, –1, 0, +1 и +2 и
т.д.
• Таким образом, для каждого значения l
имеется (2l + 1) значений m.
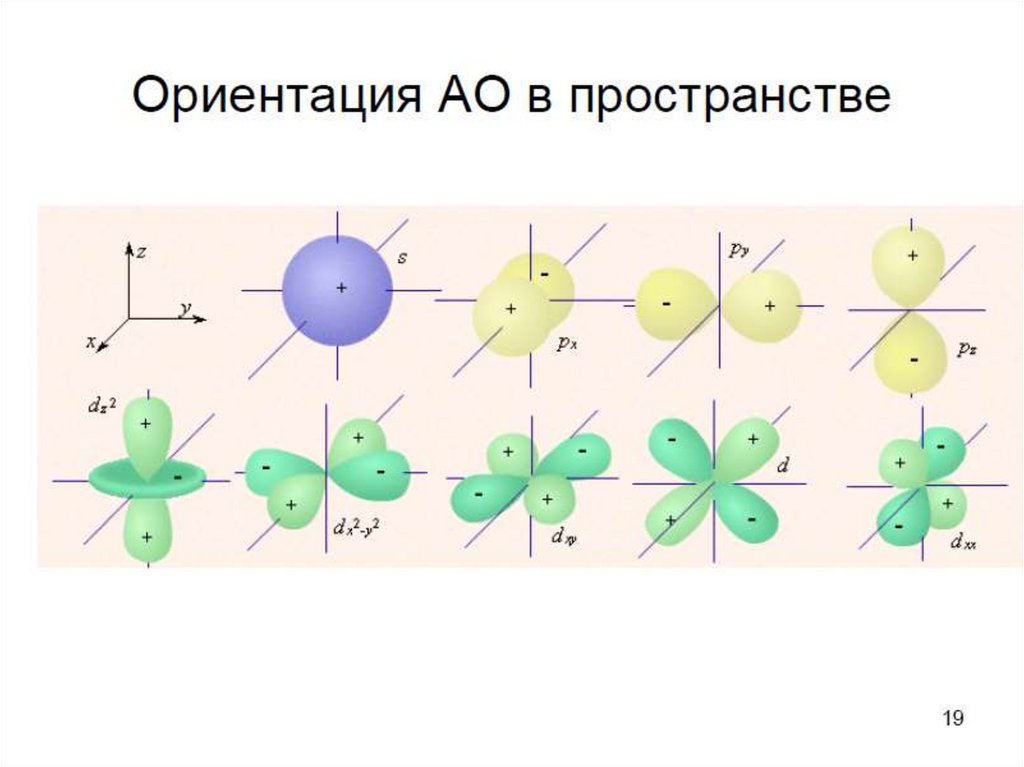
14. Магнитное квантовое число
• Все орбитали одного подуровня l обладаютодинаковой
энергией,
но
по-разному
ориентированы относительно друг друга (рис).
• Такие состояния электронов в квантовой
механике называются вырожденными: рсостояние трехкратно вырождено, d-состояние
пятикратно и т.д.
15.
16.
17.
18. Спиновое квантовое число
• Дополнительное четвертое квантовое число спиновое(s) ("spin" вращение, веретено) характеризует
собственный механический момент движения электрона,
которое условно представляют как вращение вокруг
собственной оси.
• Оно
может
происходить
в
двух
взаимно
противоположных направлениях.
• Поэтому спиновое квантовое число имеет только два
значения: +1/2 и 1/2.
• Наличие спина у электрона было подтверждено
экспериментально. Электроны с разными спинами
обозначаются стрелками, направленными вверх и вниз .
19.
20.
21. Правила Хунда
• Два правила Хунда описывают порядокзаполнения электронами АО одного
подуровня:
• Первое правило: в данном подуровне
электроны
стремятся
заполнять
энергетические состояния (АО) таким
образом, чтобы сумма их спинов по
абсолютной
величине
была
максимальна. При этом энергия системы
минимальна.
22.
23.
24.
25.
26.
27. Периодическая система
• Периодическая система в современномпонимании является отражением
электронного строения атомов.
• В ней период соответствует постепенному
заполнению электронами электронного
уровня, характеризуемого главным
квантовым числом n (равным номеру
периода).
28. Периодическая система
• Периоды состоят из семейств s-, р-, d-, fэлементов.• Периоды располагают в параллельных
строках так, чтобы элементы с одинаковым
строением (одинаковые l и число
электронов внешних подуровней nвэ)
располагались друг под другом, образуя
группы и подгруппы (одинаковые nвэ и l ).
29. Периодическая система
• Таким образом, в периодах при увеличенииномера элемента Z происходит заполнение
электронами подоболочек (подуровней) s,
p, d, f, а в подгруппах элементы имеют
одинаковое электронное строение внешнего
уровня и, следовательно, похожие
физические и химические свойства.
30. Периодическая система
• Периодичность изменения свойств состоитв их постепенном изменении в периодах и
рядах, резком изменении при переходе к
новому периоду и повторению в нем
свойств элементов предшествующего
периода.
31.
32.
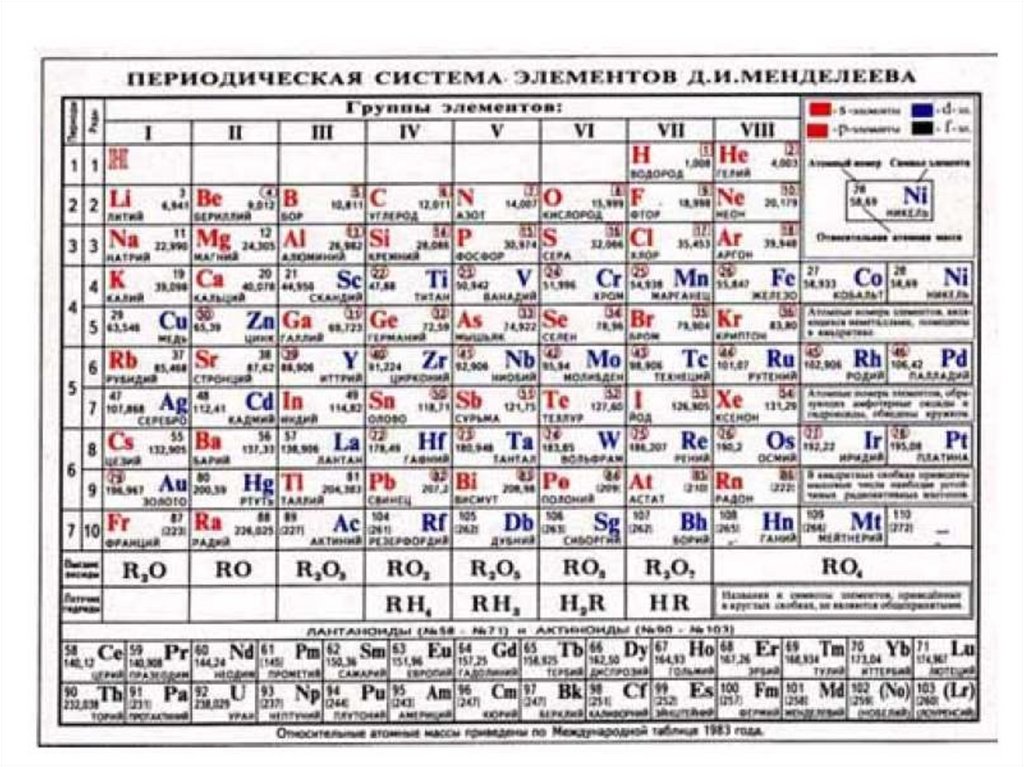
• Короткопериодный вариант (8-клеточный), совпадающийв основных чертах с таблицей, предложенной Д.И.
Менделеевым.
• В этой таблице элементы с одинаковым nвэ расположены в
группе: при этом разные типы элементов s, p и d образуют
разные подгруппы, f-элементы вынесены в виде двух 14элементных рядов и считаются принадлежащими одной
клетке таблицы каждый: лантан и лантаноиды (III группа,
6-й период) и актиний и актиноиды (III группа, 7-й период).
• Эта форма весьма популярна из - за своей компактности.
• Основной ее недостаток состоит в том, что в одной группе
оказываются элементы разного типа, иногда с разным
числом валентных электронов (VIII и I группы).
33.
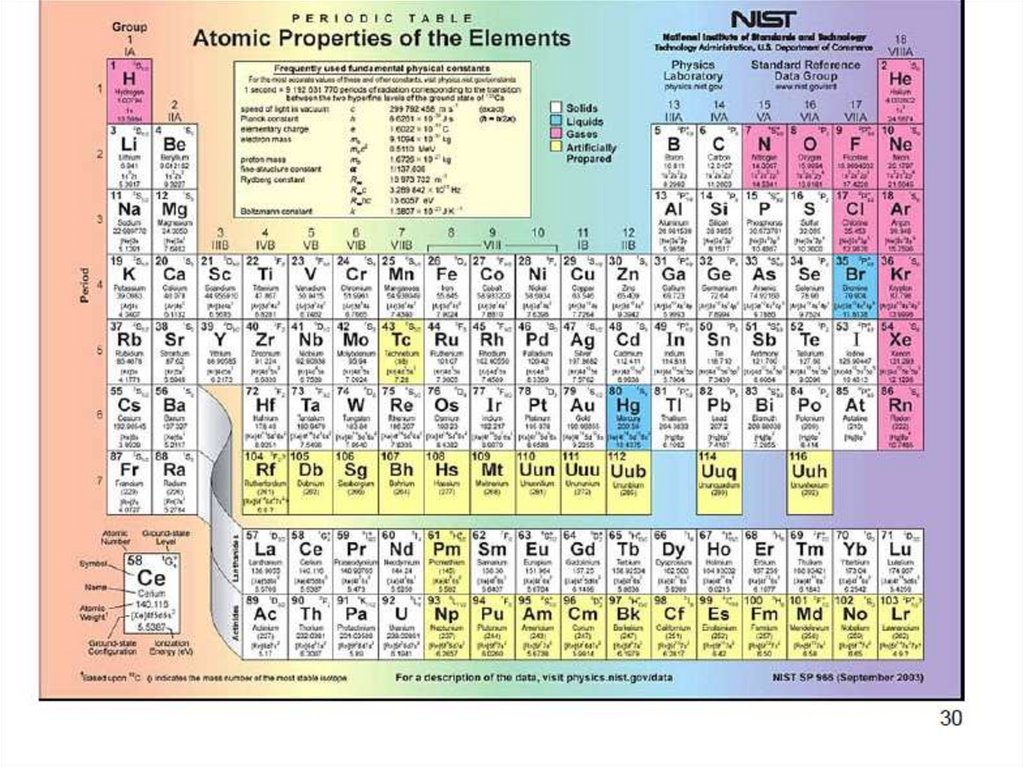
34. Полудлиннопериодный вариант
• В промежуточном, полудлиннопериодномварианте , который в настоящее время
признается (IUPAC) основным, все элементы
располагаются в группах с одинаковым
электронным
строением,
но
f-элементы
выносятся за пределы основной таблицы в виде
2-х рядов. Таким образом, в этом случае имеется
18 групп, что считается приемлемым.
35.
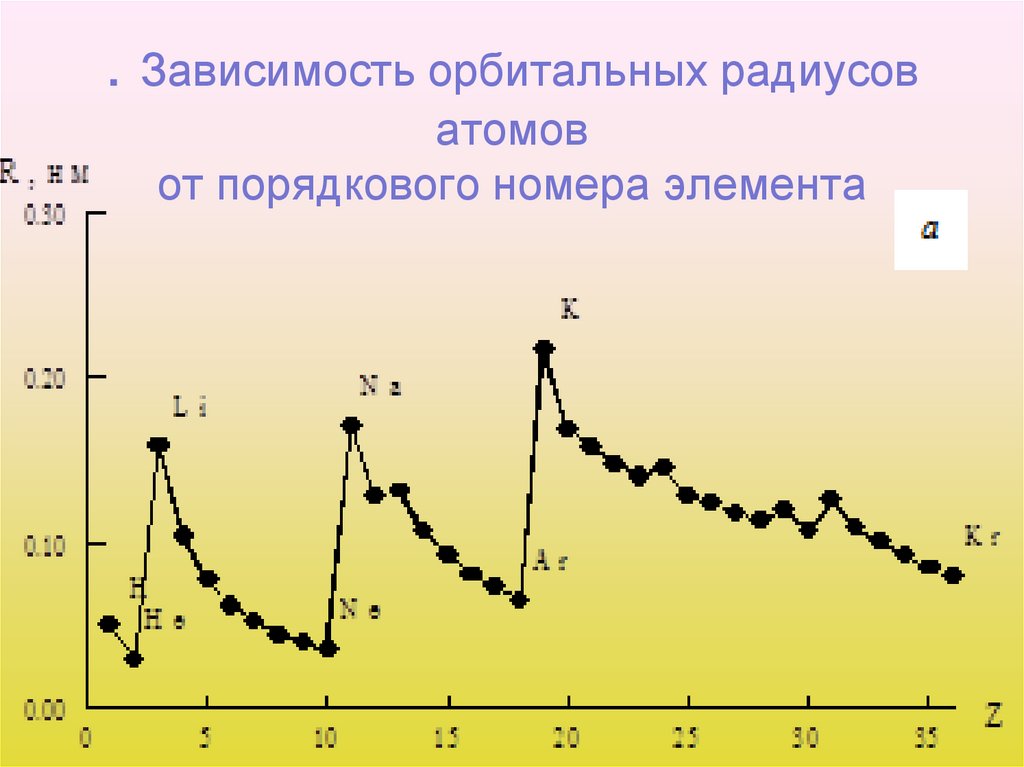
36. . Зависимость орбитальных радиусов атомов от порядкового номера элемента
37.
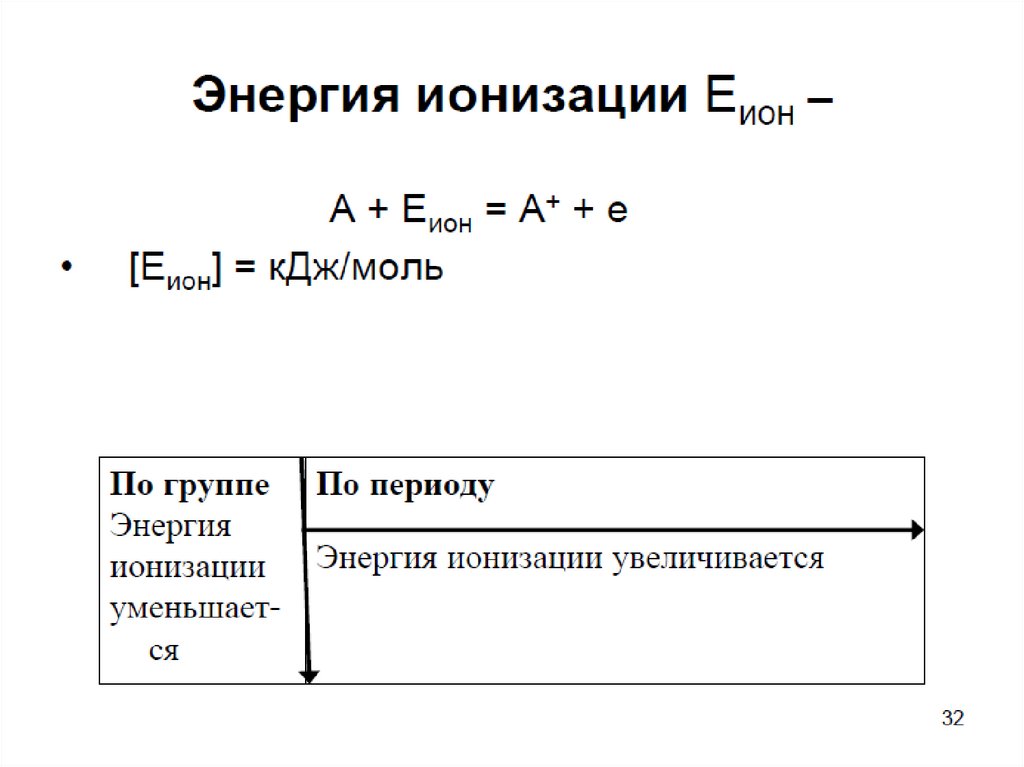
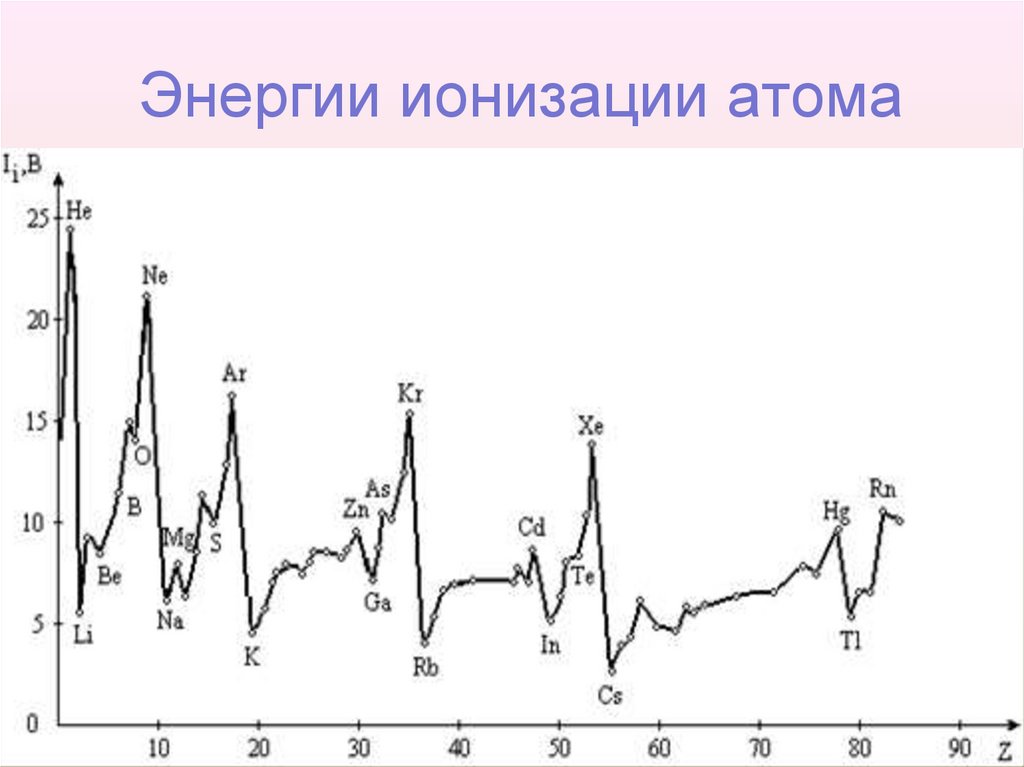
38. Энергии ионизации атома
39.
40.
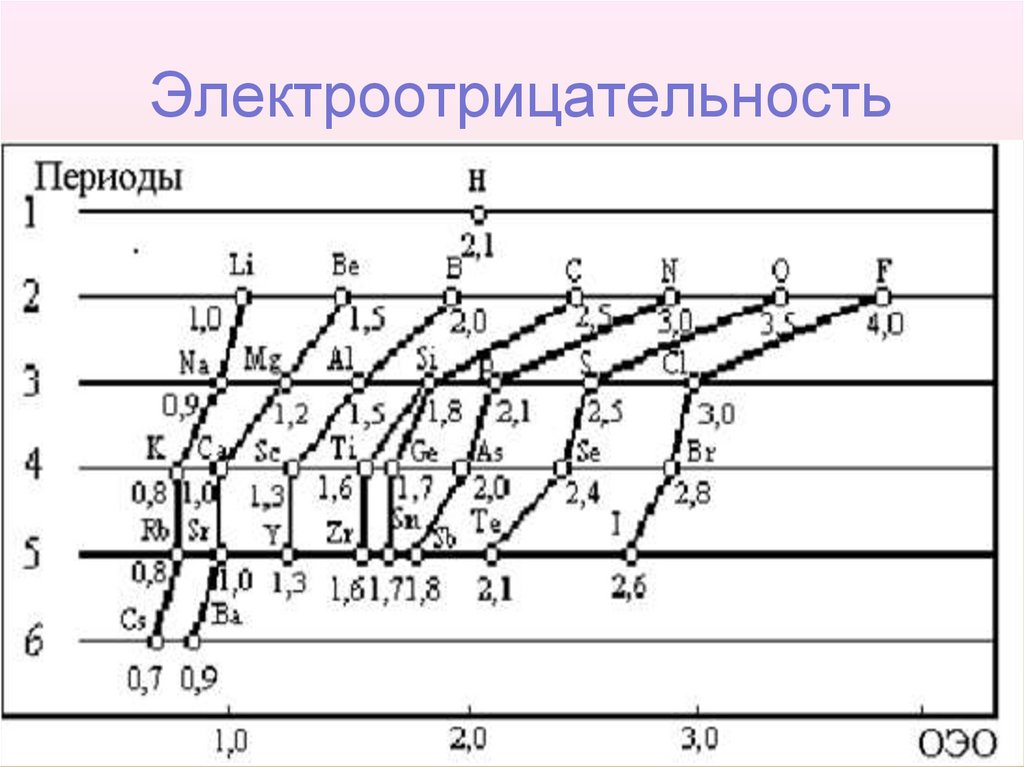
41. Электроотрицательность
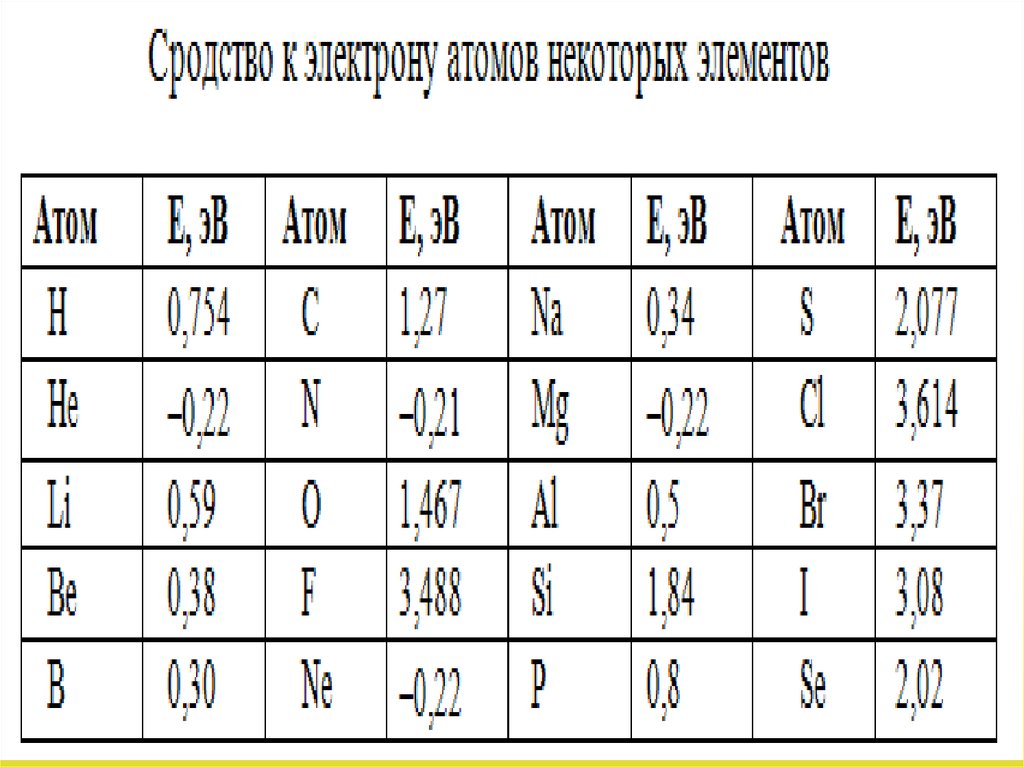
• Интересной и важной для химии величинойявляется сумма (I1 +Еср ),
где
• электроотрицательность. Согласно
Полингу, "электроотрицательность есть
способность атома в молекуле или сложном
ионе притягивать к себе электроны,
участвующие в образовании связи".
42. Электроотрицательность
• Очевидно,у
инертных
газов
электроотрицательность
отсутствует,
т.к.
внешний уровень в их атомах завершен и
устойчив.
• Электроотрицательность
возрастает
в
направлении слева направо для элементов
каждого периода и уменьшается в направлении
сверху вниз для элементов каждой главной
подгруппы ПC

































 Химия
Химия








