Похожие презентации:
Основы молекулярно-кинетической теории
1.
10. Основы молекулярно-кинетической теорииВсе тела состоят из молекул, находящихся в беспрерывном
хаотическом движении, скорость которого зависит от
температуры.
Данное движение молекул и определяет свойства тел.
Чтобы найти движение всех молекул тела надо решить
совместно систему уравнений Ньютона для этих молекул.
Однако, число молекул огромно, поэтому для описания
свойств тел используется не динамический метод, требующий
детального знания о движении молекул, а статистический
метод, в котором свойства тел объясняются как усредненный
результат действия всех молекул.
Совокупность макротел, обменивающихся энергией между
собой и внешней средой, называется термодинамической
системой.
Состояние системы характеризуется термодинамическими
параметрами – температурой, давлением, объемом и т.д.
Если эти параметры не меняются со временем, то говорят,
что система находятся в состоянии термодинамического
равновесия.
2.
10.2 Уравнение состояния идеального газаИдеальным газом называется газ, в котором можно
пренебречь взаимодействием между молекулами.
Молекулы такого газа большую часть времени
движутся свободно и лишь иногда сталкиваются. К
свойствам идеального газа близки свойства
разряженных газов.
Опыт показывает, что термодинамическое
состояние идеального газа описывается тремя
параметрами P, V, T - давлением, объемом и
температурой.
Связь между ними называется уравнением
состояния идеального газа.
Из экспериментальных исследований были
установлены 3 газовых закона:
1) закон Бойля
РV = const, если Т = const
2) закон Шарля
V ~ T, если Р = const
3) закон Гей-Люссака
P ~ T, если V = const
3.
Из них следует, что в общем виде связь междуP, V, T может быть записана как
PV
=b
T
где b – некоторая константа, пропорциональная
массе газа m .
Уравнение (10.2.1) называется уравнением
состояния идеального газа или уравнением
Клайперона.
4.
Закон АвогадроАвогадро нашел, что моли любых газов при
одинаковых температуре и давлении занимают
одинаковые объемы.
В частности, при нормальных условиях
Тл = 273,15 °К = 0 °С
Ра = 1 атм = 1.013 · 105 Па
1 моль любого газа занимает один и тот же объем
Vm0 = 22.41·10-3 м3/моль
Моль – это количество вещества, в котором
содержится число частиц, равное числу атомов изотопа
углерода С12 в 0.014 кг.
5.
Запишем уравнение состояния идеального газа (10.2.1)при нормальных условиях для 1 - го моля газа
PаVm0 1.013 10 22.4 10
=
Tл
273.15
5
-3
Дж
=
моль K
Дж
= 8.31
=R
моль K
где через R обозначена константа b для 1 - го моля
газа, она называется газовой постоянной.
При изменении температуры и давления масса
(количество) вещества не меняется, поэтому при
условиях, отличных от нормальных, в уравнение
состояния 1 - го моля идеального газа должна входить
та же самая константа
PVm
уравнение Клайперона
=
R
для 1-го моля идеального газа
T
6.
Получим уравнение состояния для произвольногообъема газа V массой m. Если М – масса одного моля
вещества, то из пропорции
получаем
M
- Vm
m
- V
MV
Vm =
m
Подставляя молярный объем Vm в (10.2.2), получаем
уравнение
Клайперона-Менделеева
(10.2.3)
где
m
M
m
PV
RT = RT
M
- число молей газа.
7.
Опытным путем найдено, что в 1-м моле веществасодержится число частиц, равное числу Авогадро
N A 6.02213 1023 моль-1
Из пропорции
получаем
NA
-
N
- m
mN A
M=
N
,
M
N
=
NA
Подставляя эту формулу в (10.2.3), находим
mN
R
PV
RT =
NT
N Am
NA
8.
ВеличинаR
-23 Дж
k=
1.38 10
NA
К
называется постоянной Больцмана.
Введем концентрацию молекул
N
n=
V
Тогда уравнение Клайперона-Менделеева примет
вид
PV nkT
9.
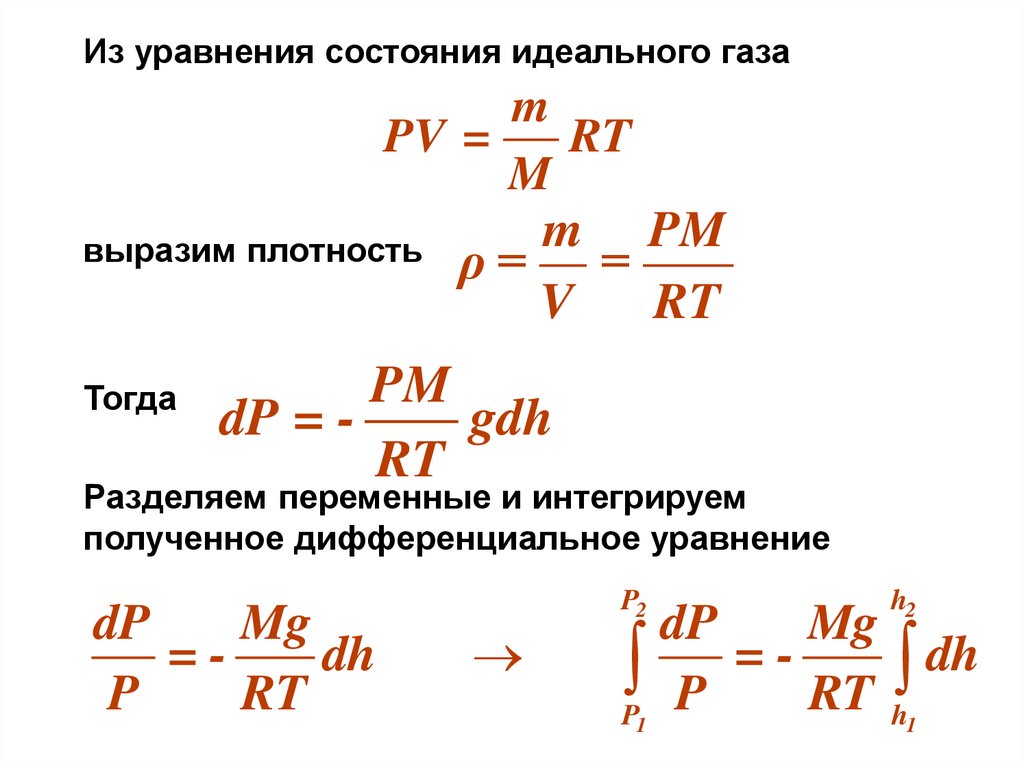
10.7 Барометрическая формулаНайдем закон изменения давления газа с высотой
за счет влияния силы тяжести. Считаем поле
тяготения однородным, температуру постоянной, а
массы молекул одинаковыми.
Разность давлений на высотах h и h+dh
равна весу газа, заключенного в объеме
цилиндра высотой dh и основанием
с площадью 1 м2
P2
h2
(Р+dP) – P = - gdh
dP = - gdh
где - плотность газа
на высоте h.
P+dP
P
dh
P1
h1
10.
Из уравнения состояния идеального газаm
PV =
RT
M
выразим плотность
Тогда
m PM
ρ= =
V
RT
PM
dP = gdh
RT
Разделяем переменные и интегрируем
полученное дифференциальное уравнение
dP
Mg
=dh
P
RT
P2
h2
dP
Mg
P P = - RT h dh
1
1
11.
В результате находимP2
Mg
ln( ) = (h2 - h1 ) P2 P1e
P1
RT
-
Mg
(h2 -h1 )
RT
Пусть h1 - высота на уровне моря, а Р1 – давление на
уровне моря. Обозначим Р0 = Р1 , а через h = h2 - h1 –
высоту над уровнем моря. Тогда давление газа на
высоте h (Р = Р2) определяется барометрической
формулой
Mgh
RT
0
P= Pe
Из нее следует, что чем тяжелее газ (больше
молярная масса газа М) и ниже температура Т, тем
быстрее давление газа падает с высотой.
12.
10.8 Распределение БольцманаСогласно уравнению состояния идеального газа
P = nkT давление пропорционально концентрации
молекул газа n, кроме того из закона Авогадро
вытекает равенство M
m0
R
=
k
где m0 – масса одной молекулы. Поэтому из
барометрической формулы получаем
n = n0 e
Поскольку m0gh = U – потенциальная энергия
молекулы в поле тяготения, то можно
записать распределение Больцмана
-
m0 gh
kT
n = n0 e
-
U
kT
Распределение Больцмана справедливо для любого
потенциального поля, если молекулы газа находятся в
состоянии хаотического теплового движения.
13.
11. Основы термодинамики11.1 Первое начало термодинамики
При термодинамическом описании свойств
макросистем используют закономерности,
наблюдающиеся в опытных данных.
Первый закон термодинамики представляет
собой закон сохранения энергии, обобщенный на
тепловые процессы.
В этот закон входят 3 величины :
1) внутренняя энергия макросистемы U
2) работа A
3) теплота Q
Рассмотрим эти величины подробно.
14.
Внутренняя энергия макросистемы Uсостоит из двух частей:
1) кинетической энергии хаотического
движения молекул в системе координат,
связанной с центром масс системы
2) потенциальной энергии взаимодействия
между молекулами системы
При этом кинетическая энергия системы как
целого и ее потенциальная энергия во внешнем
поле во внутреннюю энергию U не входят.
Если система состоит из нескольких тел, то ее
внутренняя энергия равна сумме внутренних
энергий тел и потенциальных энергий
взаимодействия между ними.
15.
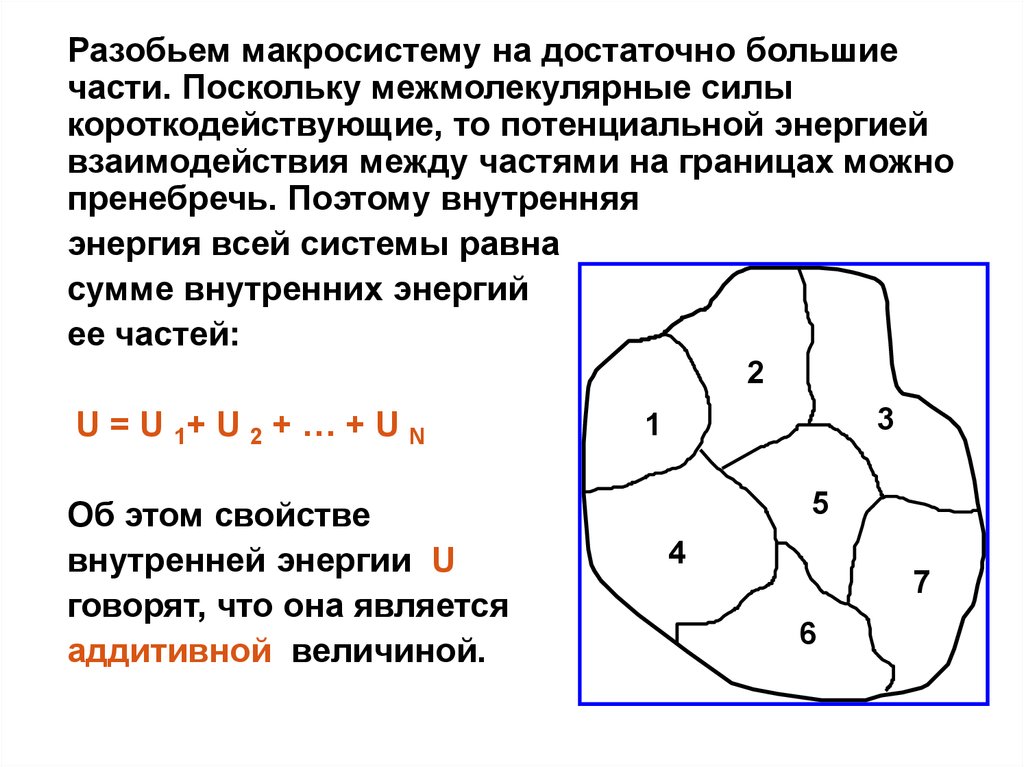
Разобьем макросистему на достаточно большиечасти. Поскольку межмолекулярные силы
короткодействующие, то потенциальной энергией
взаимодействия между частями на границах можно
пренебречь. Поэтому внутренняя
энергия всей системы равна
сумме внутренних энергий
ее частей:
2
U = U 1+ U 2 + … + U N
Об этом свойстве
внутренней энергии U
говорят, что она является
аддитивной величиной.
3
1
5
4
7
6
16.
Внутренняя энергия U обладает еще однимсвойством – она является функцией
состояния.
Это значит, что величина внутренней энергии
U не зависит от того, каким способом
макросистема была переведена в данное
состояние.
Поэтому изменение внутренней энергии U при
переходе системы из одного состояния в другое
состояние равно разности внутренних энергий
в конечном и начальном состояниях.
17.
Из закона сохранения энергии следует, что изменениевнутренней энергии системы U при ее переходе из
начального состояния 1 в конечное состояние 2 равно
сумме совершенной над системой работы внешних тел
A и переданного системе тепла Q, то есть
U = U2 - U1 = A + Q
Поскольку A = - A, то
Q = U + A
Эта формула выражает собой первое начало
термодинамики:
Количество теплоты Q, переданное системе, идет
на приращение ее внутренней энергии U и на
совершение работы A над внешними телами.
18.
Если U > 0, то совершенная системой работаменьше полученного количества теплоты, то есть Q
> A и наоборот.
Для элементарных процессов, когда два
состояния системы близки друг к другу, формула
(11.1.1) принимает вид
d'Q = dU + d'A
Штрихи означают, что изменение теплоты d Q и
совершенная работа d A зависят от способа
перехода системы из одного состояния в другое
состояние.
Значит в отличие от внутренней энергии U
теплота Q и работа A не являются функциями
состояния.
Поэтому величины d Q и d А не являются
полными дифференциалами, тогда как dU полный дифференциал.
19.
Пусть макросистема совершает процесс, в ходекоторого она периодически возвращается в
исходное состояние, тогда ее внутренняя энергия
U не будет меняться в таком процессе
U = 0
Согласно (11.1.1) в этом случае работа А,
совершаемая системой будет равна переданной
ей теплоте Q
А = Q
Следовательно:
невозможен периодически действующий
двигатель, совершающий работу А большую,
чем переданная ему тепловая энергия Q.
Вечный двигатель первого рода невозможен.
20.
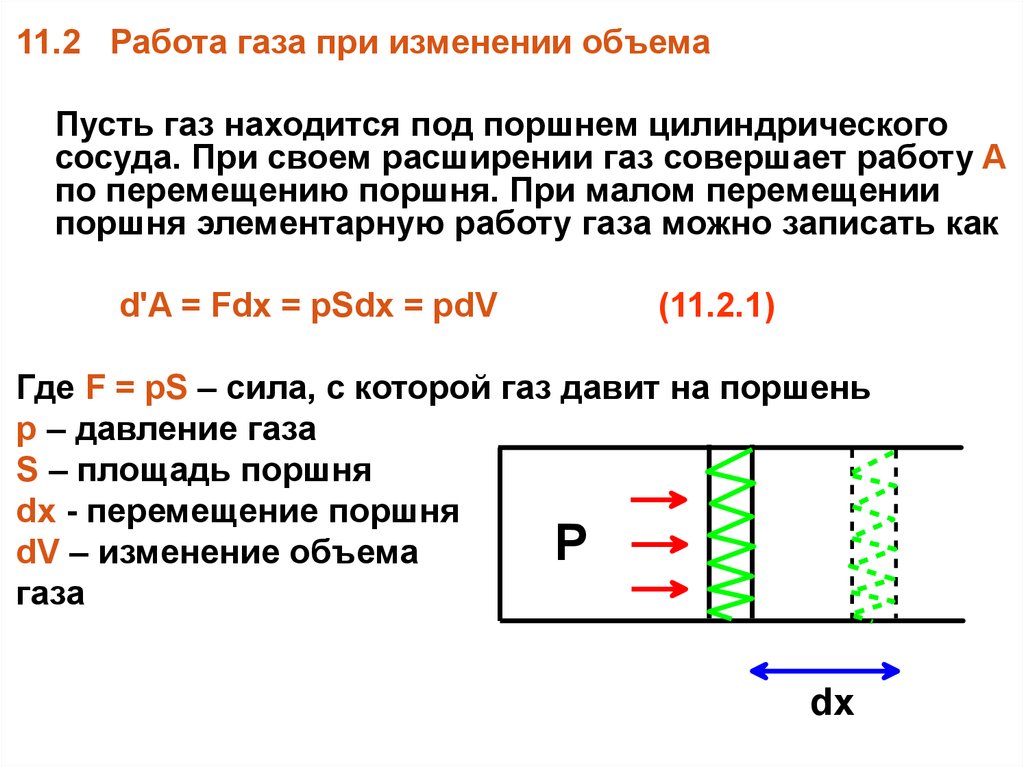
11.2 Работа газа при изменении объемаПусть газ находится под поршнем цилиндрического
сосуда. При своем расширении газ совершает работу A
по перемещению поршня. При малом перемещении
поршня элементарную работу газа можно записать как
d'A = Fdx = pSdx = pdV
(11.2.1)
Где F = pS – сила, с которой газ давит на поршень
р – давление газа
S – площадь поршня
dx - перемещение поршня
P
dV – изменение объема
газа
dx
21.
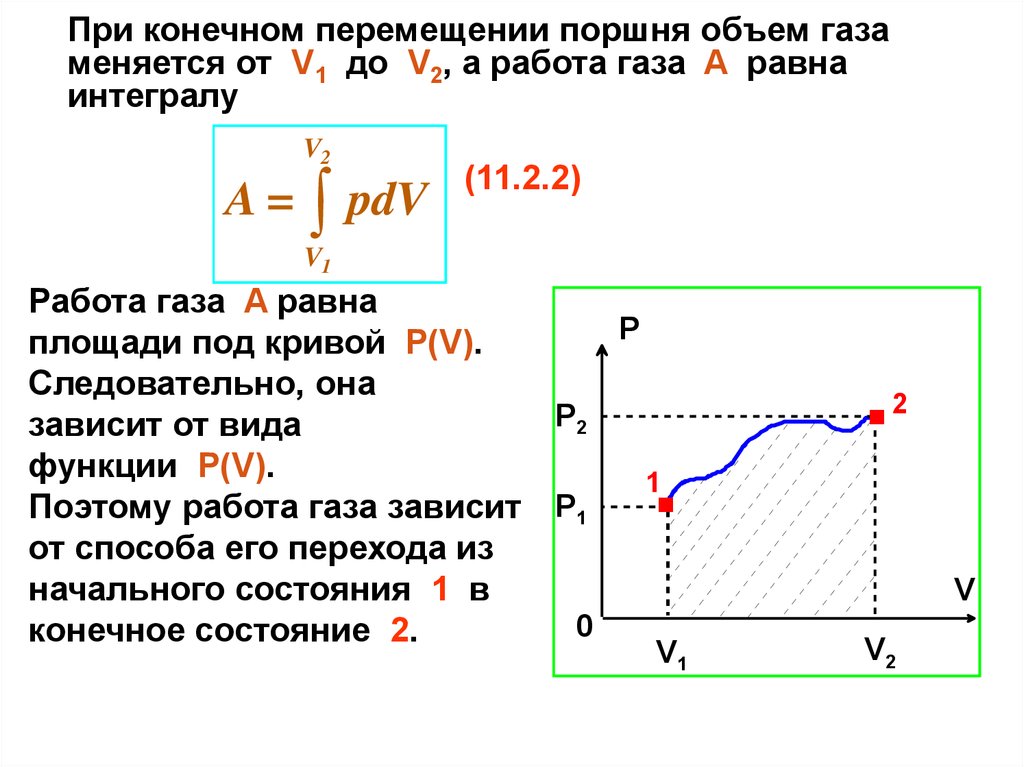
При конечном перемещении поршня объем газаменяется от V1 до V2, а работа газа A равна
интегралу
V2
A=
pdV
(11.2.2)
V1
Работа газа A равна
P
площади под кривой P(V).
Следовательно, она
P2
зависит от вида
функции P(V).
1
Поэтому работа газа зависит P1
от способа его перехода из
начального состояния 1 в
0
конечное состояние 2.
.
V1
.
2
V
V2
22.
11.3 Теплоемкость идеального газаТеплоемкость равна количеству теплоты, которое
нужно передать телу, чтобы повысить его
температуру на 1° К
d'Q
C=
dT
Теплоемкость измеряется в Дж/K°.
Удельная теплоемкость есть количество теплоты,
необходимое для нагревания 1 кг вещества на 1° К
1 d'Q
c=
m dT
где m – масса газа.
Удельная теплоемкость измеряется в Дж/(кг·K°).
23.
Молярная теплоемкость – количество теплоты,необходимое для нагревания 1 моля вещества
на 1° К
1 d'Q
cm =
ν dT
где
= m/M
-
(11.3.3)
количество молей вещества.
Молярная теплоемкость измеряется в
Дж/(моль·K°).
24.
Теплоемкость зависит от условий измерения.Различают молярную теплоемкость при
постоянном объеме cV и постоянном давлении
cP :
если газ нагревается при постоянном объеме
1 d'Q
cV =
ν dT V
если газ нагревается при постоянном давлении
1 d'Q
cP =
ν dT P
25.
Введем отношениеcP
R
γ=
= 1+
cV
cV
Величина называется постоянной
адиабаты.
26.
11.4 Число степеней свободыЧислом степеней свободы механической системы
называется число независимых величин, с
помощью которых определяется ее положение в
пространстве.
Положение материальной точки определяется
заданием 3-х координат, поэтому у нее 3 степени
свободы.
Положение твердого тела определяется
заданием 3-х координат его центра масс и любой,
проходящей через него, плоскости. Ориентация
такой плоскости задается вектором нормали,
который имеет три проекции. Поэтому у твердого
тела всего имеется 6 степеней свободы. Из них 3
степени свободы описывают поступательное
движение центра масс, а другие 3 степени свободы
описывают вращение тела вокруг этого центра.
27.
У системы из N невзаимодействующихматериальных точек имеется 3N степеней свободы.
Если между 2-мя точками имеется жесткая связь,
устанавливающая неизменное взаимное
расположение точек, то число степеней свободы
уменьшается на 1 и становится равным 5.
Если 2 точки связаны друг с другом упругими
силами, то расстояние между ними может меняться,
поэтому число степеней свободы снова будет равно
6. Расстояние между точками описывает колебания
между точками около равновесного положения.
Поэтому данную степень свободы называют
колебательной.
28.
У системы из N упруго связанных точек имеется3N степеней свободы, из которых:
3 степени – отвечают движению центра
масс,
3 степени – описывают вращение системы
точек вокруг центра масс - это вращательные
степени свободы,
оставшиеся 3N-6 степеней - описывают
колебания точек около равновесных положений –
это колебательные степени свободы.
29.
Теперь рассмотрим молекулы. При определениичисла степеней свободы молекулы входящие в
нее атомы надо рассматривать как материальные
точки.
Гелий Не, неон Ne, аргон Ar – одноатомные
газы.
У двухатомной молекулы с жесткой связью
между атомами имеется 5 степеней свободы.
Из них :
3 степени – поступательные - они определяют
положение центра масс и
2 степени – вращательные - они задают
направление в пространстве линии, проходящей
через два атома, и характеризуют вращение
молекулы вокруг двух взаимно перпендикулярных
осей, ортогональных к указанной линии.
Молекулами с жесткой связью являются N2, O2,
Н2, воздух.
30.
Если два атома в двухатомной молекуле связаныне жестко, а упруго, то расстояние между атомами
может меняться и тогда степеней свободы будет
6.
6 - ая степень свободы описывает колебания
двух атомов около их равновесного положения,
поэтому ее называют колебательной степенью.
У трехатомной молекулы с жесткими связями
имеется 6 степеней свободы, как у твердого тела
(3 – поступательные степени и 3 –
вращательные степени).
Пример – вода H2O.
6 степеней свободы имеет и любая
многоатомная молекула с жесткими связями.
Пример – аммиак NH3.
31.
среднее значение кинетической энергиипоступательного движения молекулы идеального
газа равно
3
εпост = kT
2
Так как все 3 поступательные степени свободы
молекулы равноправны, то на 1 поступательную
степень приходится энергия
1
εпост = kT
2
В статистической физике доказывается, что
такая же энергия приходится не только на
поступательную, но и на каждую степень свободы
молекулы.
Это утверждение называется законом
равнораспределения по степеням свободы.
32.
Например, на 1 вращательную степень свободытоже приходится энергия, равная kT
.
2
У молекулы, испытывающей колебания,
имеется
не только кинетическая, но и
потенциальная энергия. В среднем эти энергии
равны друг другу. Поэтому на колебательную
степень свободы молекулы приходится энергия в 2
раза большая и равная kT.
В общем случае полное число степень
молекулы равно
i = iпост + iвр + 2iкол
(11.4.2)
Тогда средняя энергия любой молекулы может
быть записана как
i
kT
2
33.
В идеальном газе молекулы не взаимодействуютдруг с другом, поэтому его внутренняя энергия
равна сумме энергий отдельных молекул. Для
одного моля идеального газа внутренняя энергия
равна
i
i
U m = N A N A kT = R T
2
2
С другой стороны, согласно (11.3.7) Um = сVT ,
отсюда следует, что молярная теплоемкость
идеального газа при постоянном объеме равна
i
cV = R
2
34.
Учтем, что для идеального газапоэтому
сР = сV + R ,
i
(i + 2)
cP = R + R =
R
2
2
(11.4.6)
Следовательно, обе молярные теплоемкости
определяются лишь числом степеней свободы.
Выразим постоянную адиабаты через число
степеней свободы
(11.4.7
R (i + 2)
= 1+
cV
2
Значит > 1. Опыт показывает, что для разных
газов
= 1.3 1.67
35.
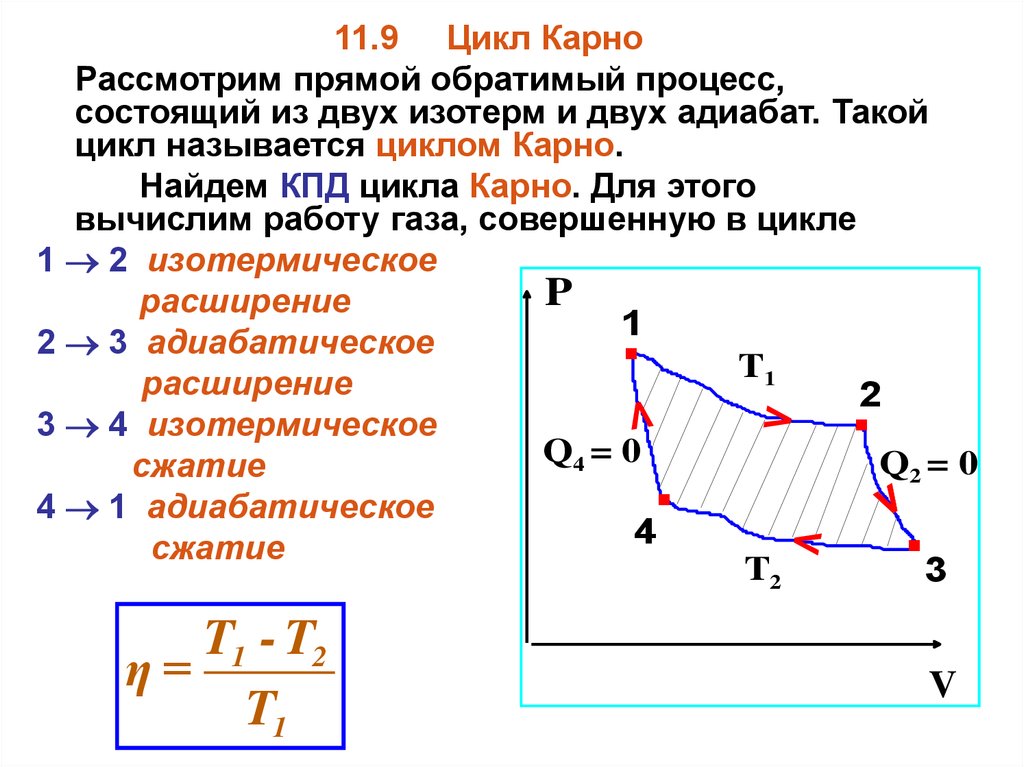
11.9 Цикл КарноРассмотрим прямой обратимый процесс,
состоящий из двух изотерм и двух адиабат. Такой
цикл называется циклом Карно.
Найдем КПД цикла Карно. Для этого
вычислим работу газа, совершенную в цикле
1 2 изотермическое
P
расширение
1
2 3 адиабатическое
T1
расширение
2
>
3 4 изотермическое
Q4 = 0
Q2 = 0
сжатие
4 1 адиабатическое
4
сжатие
T2
3
.
>
.
.
>
T1 - T2
η=
T1
.
V
36.
Следовательно, КПД в цикле Карно зависит только оттемператур нагревателя Т1 и холодильника T2 , но не
зависит ни от устройства двигателя, ни от рода
рабочего тела (газа).
Чтобы повысить КПД надо увеличивать
разность температур нагревателя и холодильника.
Действительно, если Т1 >> T2 , то 1.
Отношение отданного в цикле Карно тепла от одного
тела к полученному теплу другим телом, равно
отношению температур этих тел.
'
T2 Q2
T1 Q1
(11.9.2)
Формула (11.9.2) положена в основу определения
термодинамической шкалы температур.
37.
11.10Энтропия. 2-е начало термодинамики
Рассмотрим соотношение (11.9.2), полученное для
цикла Карно
'
2
2
T Q
=
T1 Q1
где Т1 – температура нагревателя, Q1 – тепло,
полученное газом от нагревателя, Т2 –
температура холодильника, Q2´ – тепло, отданное
газом холодильнику, Т1 > Т2.
Перепишем это соотношение в виде
'
2
(11.10.1)
Q1 Q
0
T1 T2
38.
Формулу (11.10.1) можно рассматривать какинтеграл по замкнутому циклу Карно
(11.10.2)
Отношение
d'Q
T 0
d'Q
T
называется
приведенным количеством теплоты.
Следовательно, приведенное количество
теплоты в цикле Карно равно нулю.
39.
Обозначим его как(11.10.3)
d'Q
= dS
T
где функция S называется энтропией.
Понятие энтропии ввел Клаузиус в 1865 г.
Энтропия есть функция состояния,
приращение которой в ходе обратимого
процесса равно отношению количества
полученной системой теплоты к температуре
теплоотдающего тела.
Формула (11.10.3) справедлива только для
обратимых процессов.
40.
Если процесс не замкнутый, то при переходе изначального состояния 1 в конечное состояние 2
энтропия системы изменяется на величину
2
d'Q
ΔS = S 2 - S1 =
T
1
Данное изменение энтропии не зависит от
вида процесса, с помощью которого система
перешла из состояния 1 в состояние 2, а зависит
лишь от начального и конечного состояний.
Поэтому энтропия определена лишь с
точностью до произвольной постоянной и
физический смысл имеет не сама энтропия, а ее
изменение.
Произвольную постоянную принято полагать
равной нулю.
41.
Для изолированной (замкнутой) системы, необменивающейся теплом с окружающими телами
d'Q = 0
Если при этом процесс, совершаемый
замкнутой системой обратимый, то к нему можно
применить формулу (11.10.3), из которой следует
dS = 0
,
и значит
S = const
то есть энтропия изолированной системы в
обратимом процессе не меняется.
42.
Если же изолированная система совершаетнеобратимый процесс, то ее энтропия всегда
возрастает
S > 0
Объединяя результаты для обратимого и
необратимого процессов, получаем
неравенство Клаузиуса для изолированной
системы
(11.10.4)
S 0
Энтропия изолированной системы либо
возрастает (для необратимых процессов), либо
остается неизменной (для обратимых процессов)
– это закон возрастания энтропии или второе
начало термодинамики.
43.
Все реальные процессы необратимы, поэтомуони протекают так, что энтропия замкнутой
системы возрастает.
Второе начало термодинамики указывает
направление протекания термодинамических
процессов в изолированной системе.
Из всех возможных, разрешенных первым
началом термодинамики процессов реализуются
лишь такие процессы, при которых энтропия
увеличивается.
Энтропия изолированной системы
достигает своего максимального значения в
равновесном состоянии.
44.
При необратимом процессе энтропиянеизолированной системы получает
дополнительное приращение. Например, при
трении это происходит за счет того, что энергия
упорядоченного движения тела переходит в
энергию беспорядочного (теплового) движения
молекул. Поэтому для необратимых процессов
d'Q
dS >
T
Объединяя результаты для обратимых и
необратимых процессов, протекающих в
неизолированной системе, можем записать
неравенство Клаузиуса
d'Q
dS
T
(11.10.5)







































 Физика
Физика








