Похожие презентации:
Основные положения молекулярно-кинетической теории
1. Основные положения молекулярно-кинетической теории.
1. Любое вещество состоит из мельчайших частицмолекул и атомов. Они расположены в пространстве
на некоторых расстояниях друг от друга.
2. Атомы или молекулы вещества находятся в
состоянии беспорядочного движения, которое
никогда не прекращается.
3. Атомы или молекулы вещества взаимодействуют
друг с другом силами притяжения и отталкивания,
которые зависят от расстояний между частицами.
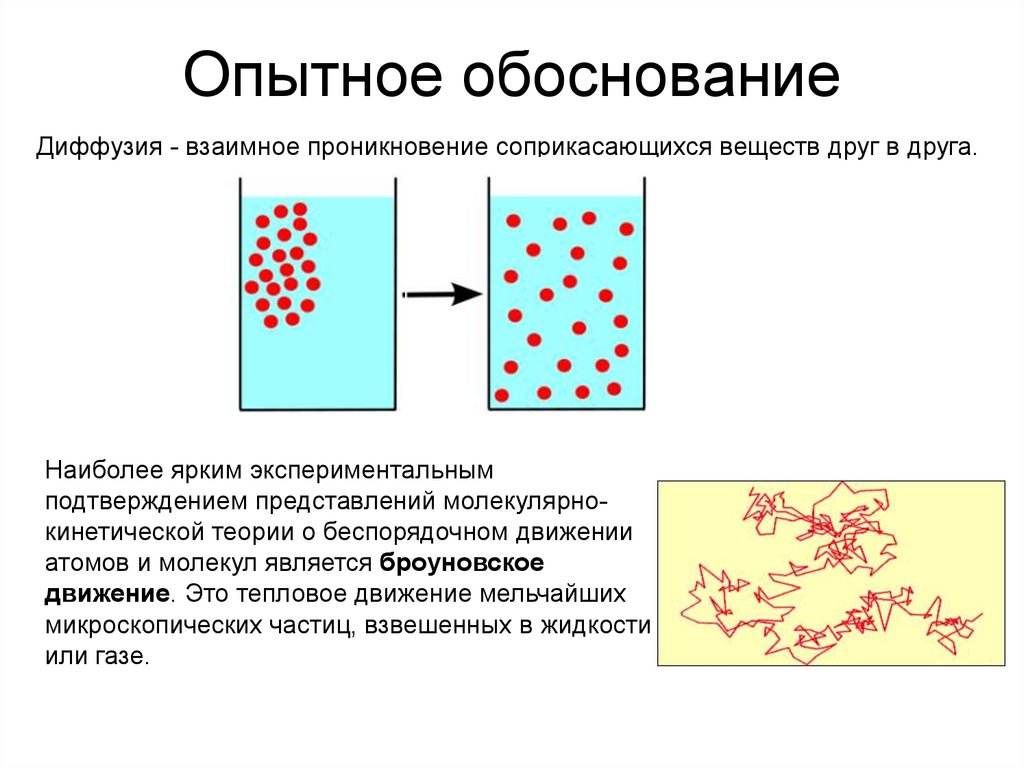
2. Опытное обоснование
Диффузия - взаимное проникновение соприкасающихся веществ друг в друга.Наиболее ярким экспериментальным
подтверждением представлений молекулярнокинетической теории о беспорядочном движении
атомов и молекул является броуновское
движение. Это тепловое движение мельчайших
микроскопических частиц, взвешенных в жидкости
или газе.
3. Скорость газовых молекул
Прямые измерения скоростей теплового движения молекул быливыполнены в 1920 г. Отто Штерном в опытах с молекулярными
пучками.
При неподвижных цилиндрах пучок атомов серебра оседал узкой
полоской 1, образуя как бы изображение щели.
Когда оба цилиндра приводились в равномерное атомы попадали в место 2 и
пучок становился размытым.
Вывод: атомы (молекулы) движутся с разными скоростями.
4.
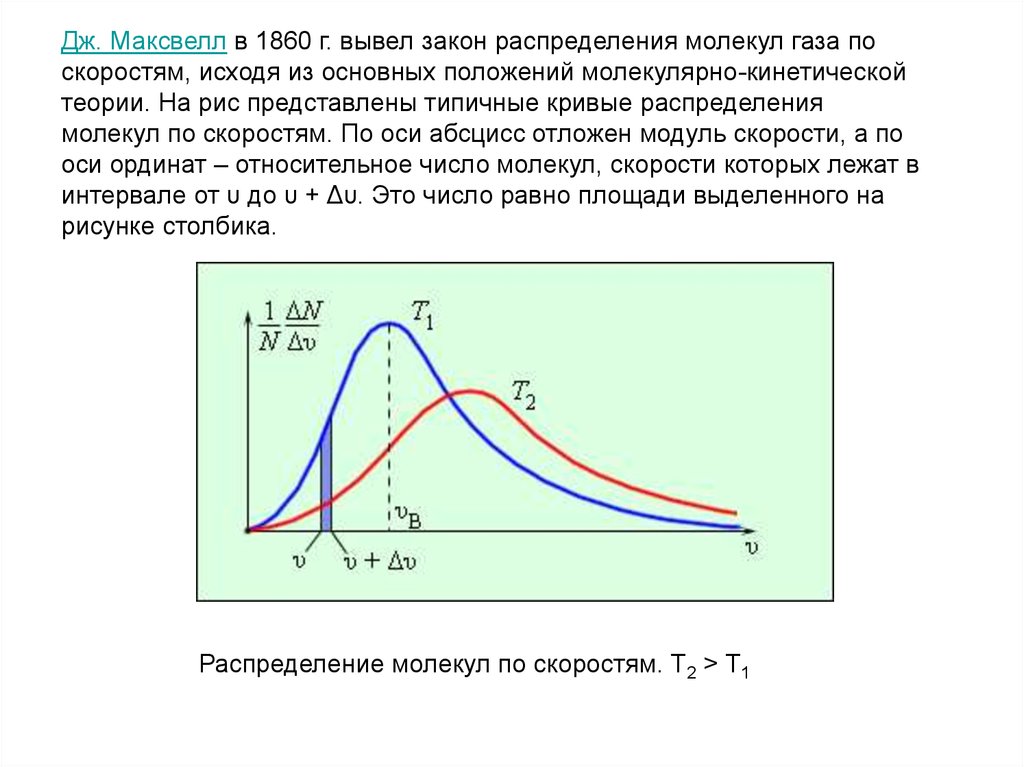
Дж. Максвелл в 1860 г. вывел закон распределения молекул газа поскоростям, исходя из основных положений молекулярно-кинетической
теории. На рис представлены типичные кривые распределения
молекул по скоростям. По оси абсцисс отложен модуль скорости, а по
оси ординат – относительное число молекул, скорости которых лежат в
интервале от υ до υ + Δυ. Это число равно площади выделенного на
рисунке столбика.
Распределение молекул по скоростям. T2 > T1
5.
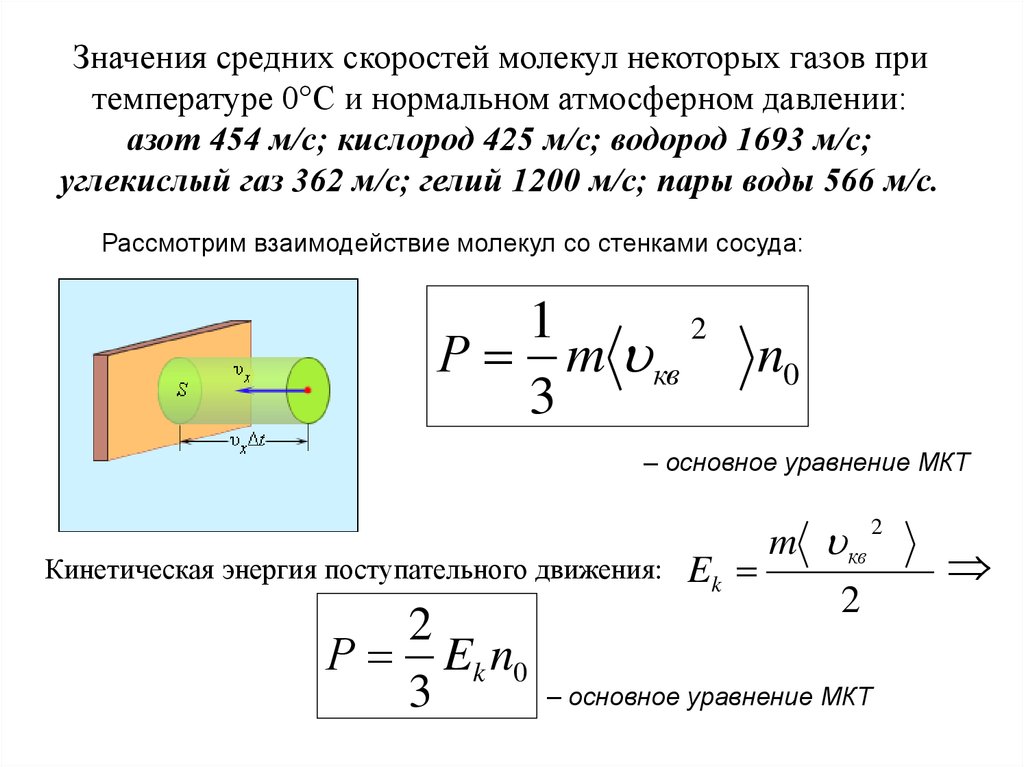
Значения средних скоростей молекул некоторых газов притемпературе 0°С и нормальном атмосферном давлении:
азот 454 м/с; кислород 425 м/с; водород 1693 м/с;
углекислый газ 362 м/с; гелий 1200 м/с; пары воды 566 м/с.
Рассмотрим взаимодействие молекул со стенками сосуда:
1
2
Р m кв n0
3
– основное уравнение МКТ
Кинетическая энергия поступательного движения:
2
Р Ek n0
3
Ek
m кв
2
2
– основное уравнение МКТ
6. Уравнение состояния идеального газа
Идеальным газом называется газ, между частицамикоторого отсутствуют силы взаимного притяжения. При
соударениях между собой, частицы газа ведут себя как
упругие шарики крайне малого размера.
Уравнение состояния
идеального газа
7.
Термодинамические параметры системы:
Температура – T(К)
Давление – P(Па)
Объем – V(м3)
m
PV
RT RT
M
Уравнение состояния идеального газа или уравнение Менделеева–Клапейрона
R=8,31 Дж/(моль∙К) – универсальная газовая постоянная
ν – количество вещества
Изопроцессы - это процессы, в которых один из параметров (p, V или T)
остается неизменным при неизменной массе вещества.
8. Изобарный процесс
const V constP const
T
Изохорный процесс
const P const
V const
T
Изотермический процесс
const PV const
T const
9.
Пример 1.При сжатии газа его объем уменьшился на 2 л, а давление увеличилось в
2 раза. Найти первоначальный объем газа V1.
Дано:
Решение:
const
T const
PV const
P1V1 P2V2
3
3
V1 2 V 4 10 ( м )
V
V
V
2
1
P 2P
1
2
10.
Пример 2.Определить на сколько изменилась масса гелия, находящегося в баллоне
объемом 0,25 м3 под давлением 106 Па при температуре 200С, если из баллона
была выпущена часть массы газа, после чего давление понизилось до 105 Па,
а температура уменьшилась до 100С.
Дано:
Решение:
P1V
m1
RT1
P2V
m2
RT 2
m m1 m2
V P1
P2
m
R T1 T2
Ответ: 0,36 кг.
11.
Пример 3.Определить объем баллона со сжатым углекислым газом, находящимся под
давлением в 100 атмосфер при температуре 270С, если при нормальных
условиях то же количество углекислого газа занимает объем 1,3 м3.
Нормальные условия: T0=273К, Р0=760 мм.рт.ст=1∙105Па.
Дано:
Решение:
m const
P0V0T
V
PT0
P0V0 PV
T0
T
Ответ: 0,014 м3.
12.
Работа газа.Изменение объема при изобарном нагревании:
Газ совершает элементарную работу:
А p dV
Полная работа, совершенная газом:
A12
V h S
V2
p dV
V1
Работа газа есть функция процесса
13.
Внутренняя энергия газа.14.
15.
16.
17.
Внутренняя энергия одноатомного газа3 m
dU
RdT
2M
Изменение внутренней энергии
одноатомного газа
Работа газа
3 m
U
RT
2M
А p dV
Первое начало термодинамики
Q dU A
Количество теплоты, переданное телу,
расходуется на изменение внутренней энергии
тела и совершение телом работы над внешними
телами.
18.
Изобарный процессconst
Q dU pdV
P const
Изохорный процесс
const А 0 Q dU
V const
Изотермический процесс
const dU 0 Q А
T const
Адиабатный процесс
A dU
Q 0
19.
Пример 1.В стальном баллоне находится гелий массой 0,5 кг при температуре 10 0С.
Как изменится внутренняя энергия гелия, если его температура повысится
до 30 0С?
Дано:
m = 0,5 кг
T1 = 283 К
T2 = 303 К
M = 4∙10-3 кг/моль
ΔU - ?
Решение:
3 m
U1
RT1.
2 M
3 m
U2
RT2 .
2M
3m
3m
3m
RT 2
RT1
R T2 T1
U U 2 U1
2M
2M
2M
3 m
U
R T
2M
Ответ:31,2 кДж.
20.
Пример 2.Какова внутренняя энергия гелия, заполняющего аэростат объёмом 50 м3
при давлении 80 кПа?
Дано:
V = 50 м3
р = 80 кПа=8∙104 Па
U-?
Решение:
3 m
U
RT
2M
m
PV
RT
M
3
U pV
2
Ответ: 6 МДж.
21.
Пример 3.Идеальный газ переходит из состояния 1 в состояние 4 так, как показано
на рисунке. Вычислите работу, совершаемую газом.
Дано:
Решение:
А А12 А23 А34
А12 р1 (V2 V1 )
А23 0, т.к. V 0
A34 p3 (V4 V3 )
Ответ: 2,4 кДж.
22.
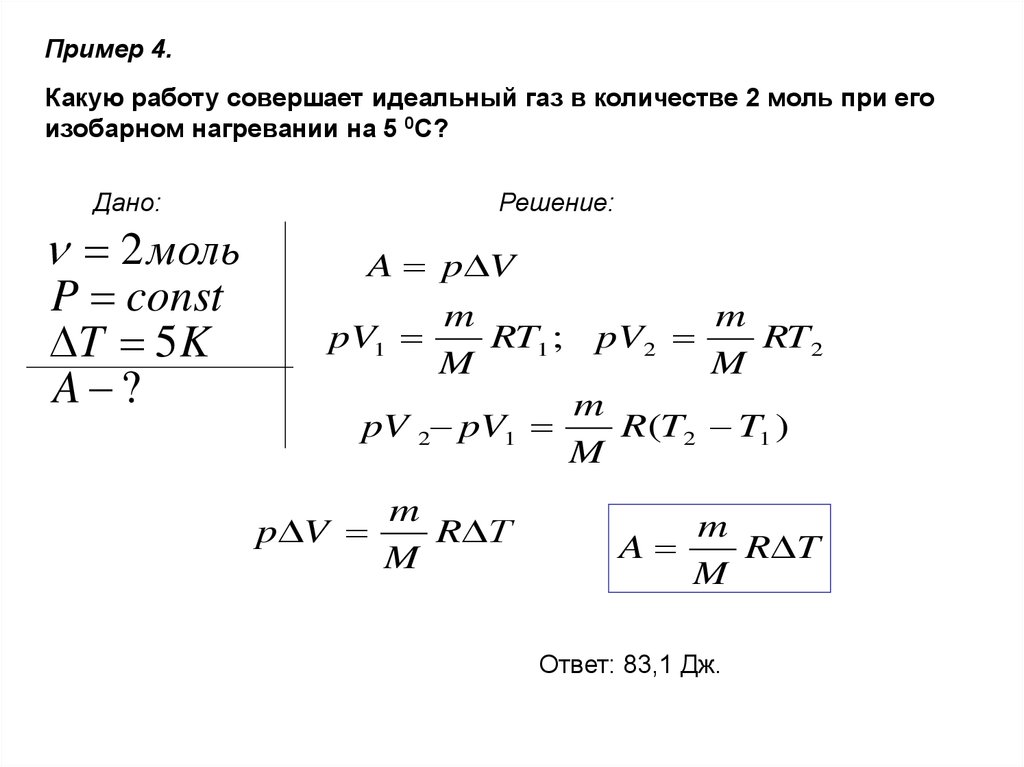
Пример 4.Какую работу совершает идеальный газ в количестве 2 моль при его
изобарном нагревании на 5 0С?
Дано:
2 моль
P const
T 5 K
A ?
Решение:
A p V
m
m
pV1
RT1 ; pV2
RT 2
M
M
m
pV 2 pV1
R (T2 T1 )
M
m
p V
R Т
M
m
A
R T
M
Ответ: 83,1 Дж.
23.
Пример 5.В закрытом баллоне находится газ. При охлаждении его внутренняя
энергия уменьшилась на 500 Дж. Какое количество теплоты отдал газ?
Совершил ли он работу?
Дано:
U 500 Дж
Q ?
A ?
Решение:
Газ находится в закрытом баллоне (V = const) → ΔV = 0.
Газ работу не совершает
A p V A 0.
Q U
Q U 500 Дж
- Газ выделяет теплоту
Ответ: А=0, Q=-500 Дж.
24.
Пример 6.Для изобарного нагревания газа, количество вещества которого 400 моль,
на 300 К ему сообщили количество теплоты 5,4 МДж. Определите работу
газа и изменение его внутренней энергии.
Дано:
400 моль
P const
T 300 K
Q 5,4 МДж
A ? U ?
Решение:
Q U A
m
A p V
R T R T
M
U Q A
Ответ: А=1 МДЖ, ΔU=4,4 МДж.
25.
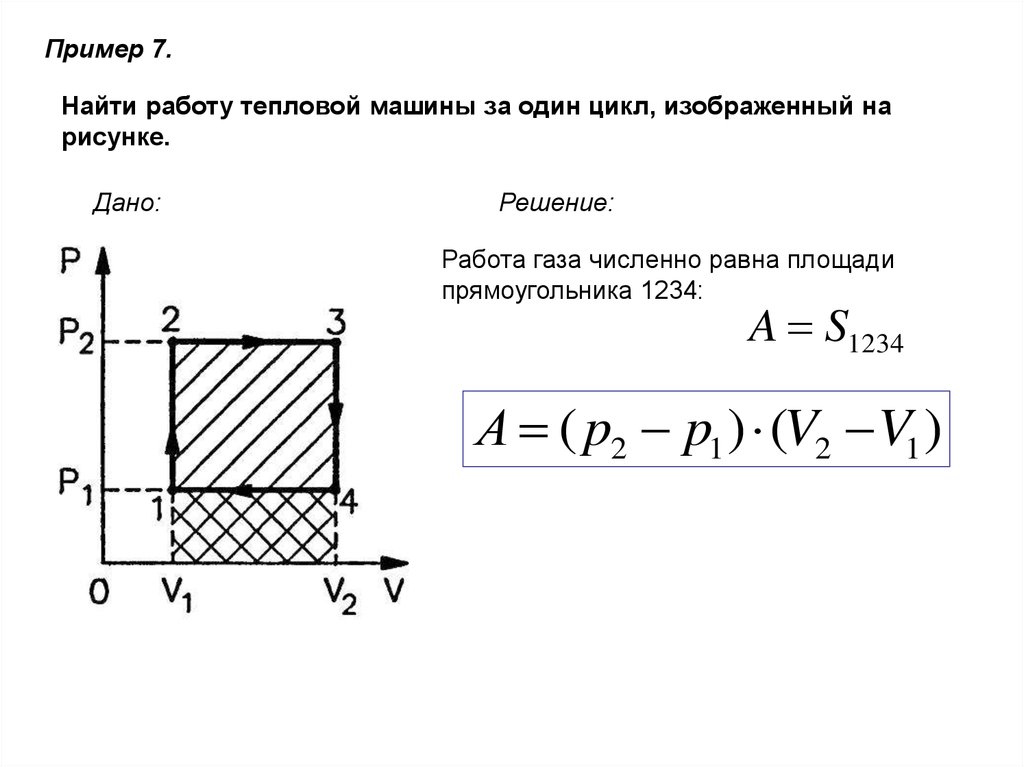
Пример 7.Найти работу тепловой машины за один цикл, изображенный на
рисунке.
Дано:
Решение:
Работа газа численно равна площади
прямоугольника 1234:
A S1234
А ( p2 p1 ) (V2 V1 )
26.
Пример 8.Какую работу – положительную или отрицательную – совершает газ за
один цикл (см. рисунок)? На каких участках количество теплоты
поглощается, отдаётся?
Дано:
Решение:
Перенесём этот график на диаграмму (рV).
1→2: T=const, p↑ → V↓ - изотермическое сжатие.
2→3: p=const, T↑ → V↑ - изобарное расширение.
3→1: p↓ и T↓ → V=const – изохорное охлаждение.
1→2: А12<0, ΔU12=0, Q12<0
2→3: A23>0, ΔU23>0, Q23>0
3→1: A31=0, ΔU31<0, Q31<0
27.
Теплоемкость идеального газа28.
Молярная теплоемкость идеального газа при постоянном объеме СVМолярная теплоемкость идеального газа при постоянном давлении СР
Уравнение Майера:
29.
Классическая теория теплоемкости30.
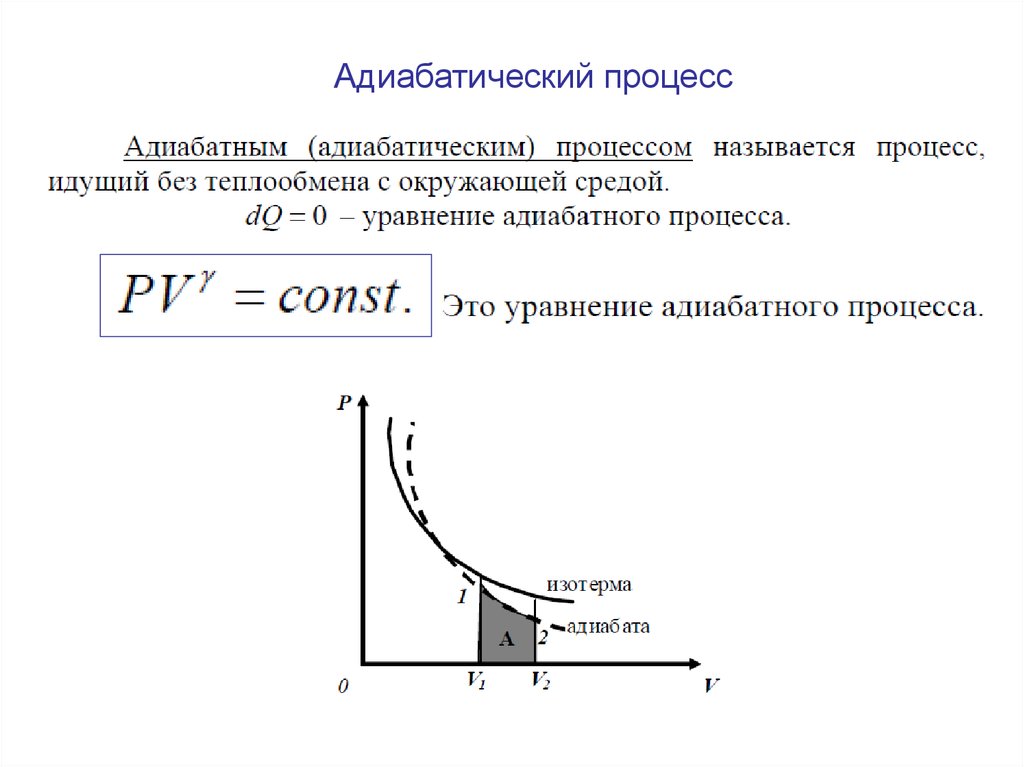
Адиабатический процесс31.
Второе начало термодинамикиОбратимыми процессами называют процессы перехода системы из
одного равновесного состояния в другое, которые можно провести в
обратном направлении через ту же последовательность
промежуточных равновесных состояний. При этом сама система и
окружающие тела возвращаются к исходному состоянию.
Процессы превращения механической работы во внутреннюю энергию
тела являются необратимыми из-за наличия трения, процессов
диффузии в газах и жидкостях, процессы перемешивания газа при
наличии начальной разности давлений и т. д. Все реальные процессы
необратимы, но они могут сколь угодно близко приближаться к
обратимым процессам. Обратимые процессы являются идеализацией
реальных процессов.
32.
Второе начало термодинамики33.
Энтропия34.
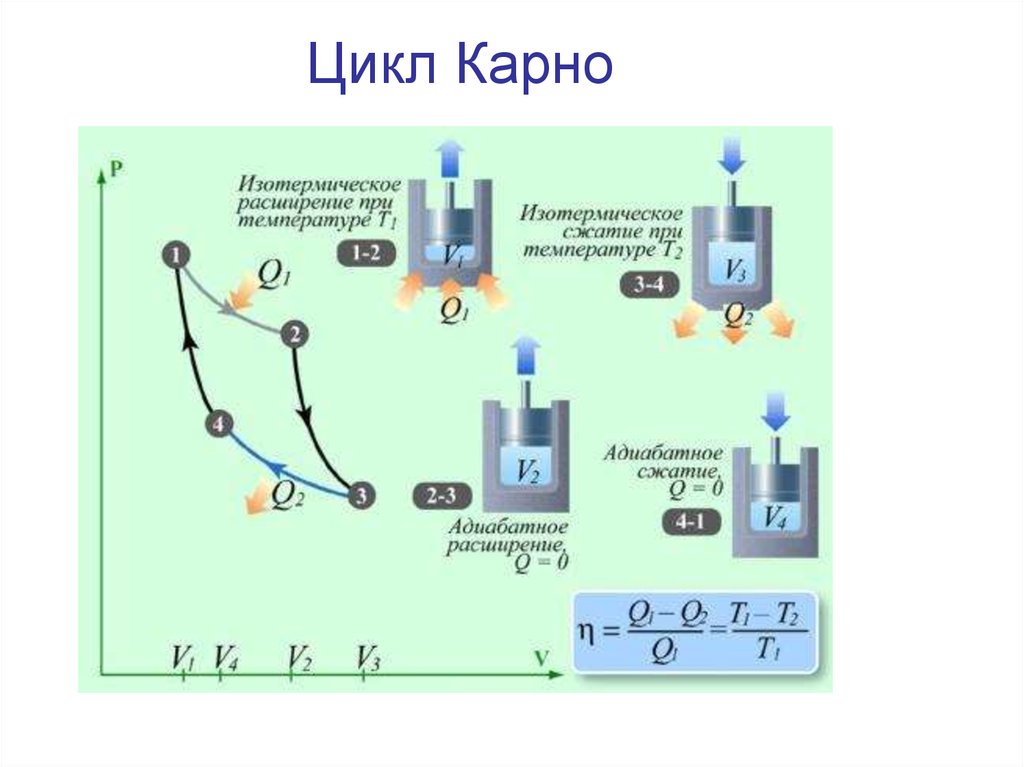
Цикл Карно35.
36.
Первая теорема Карно: КПД любой тепловой машины не можетбыть больше КПД машины Карно.
Вторая теорема Карно: КПД машины Карно не зависит от
устройства машины и вида работающего вещества, а
определяется только температурой нагревателя и холодильника.
37. Газ Ван-дер-Ваальса
38.
Уравнение Менделеева-Клапейрона достаточно хорошо описываетгазы приближенные к идеальным.
PV RT
Для реального газа приходится учитывать потенциальную энергию
взаимодействия молекул между собой.
.
На молекулы газа действуют силы притяжения и отталкивания.
Простейшим уравнением состояния, описывающим неидеальный
газ, является уравнение, предложенное в 1873 г. Иоханнесом
Дидериком Ван-дер-Ваальсом
39.
Силы притяжения внутри газа в среднем скомпенсированы длякаждой отдельной молекулы.
На молекулы, расположенные в тонком слое вблизи стенки сосуда,
действует сила притяжения со стороны других молекул,
направленная внутрь газа, которая создает давление, добавочное к
создаваемому самой стенкой. Это давление иногда называют
внутренним давлением. Для суммарного давления внутри газа можно
2
записать:
a0 N
P P
V2
Р - давление газа, которое действует на стенку сосуда, а0 постоянная,
определяемая физико-химическими характеристиками молекул газа, N число молекул газа в объеме V.
Обозначим
a a0 N A
2
Тогда выражение для давления примет видP
P
a 2
V2
40.
Сила отталкивания проявляется во всём объёме газа и зависит отрасстояния между молекулами. Поэтому необходимо ввести
поправку, учитывающую объём, занимаемый молекулами. Её
величина будет пропорциональна общему числу молекул N, а также
зависеть от их физико-химических свойств.
Тогда свободный от молекул объем можно определить следующим
/
образом:
V V b0 N ,
V – объем сосуда с газом, b0 - коэффициент, определяемый
свойствами молекул.
Обозначим
b b0 N A
Получим выражение для объема
V V b
/
41.
Если в левой части уравнения Менделеева – Клапейрона провести заменуa 2
P V P 2 V b ,
V
то получится уравнение Ван-дер-Ваальса:
a 2
P 2 V b RT
V
Газ, описываемый уравнением Ван-дер-Ваальса называется
газом Ван-дер-Ваальса.

































 Физика
Физика








