Похожие презентации:
Презентация 3 хим связь
1.
Общая и неорганическая химияРаздел: Строение вещества
Тема: Природа химической связи
Ковалентная химическая связь
Метод валентных связей
2.
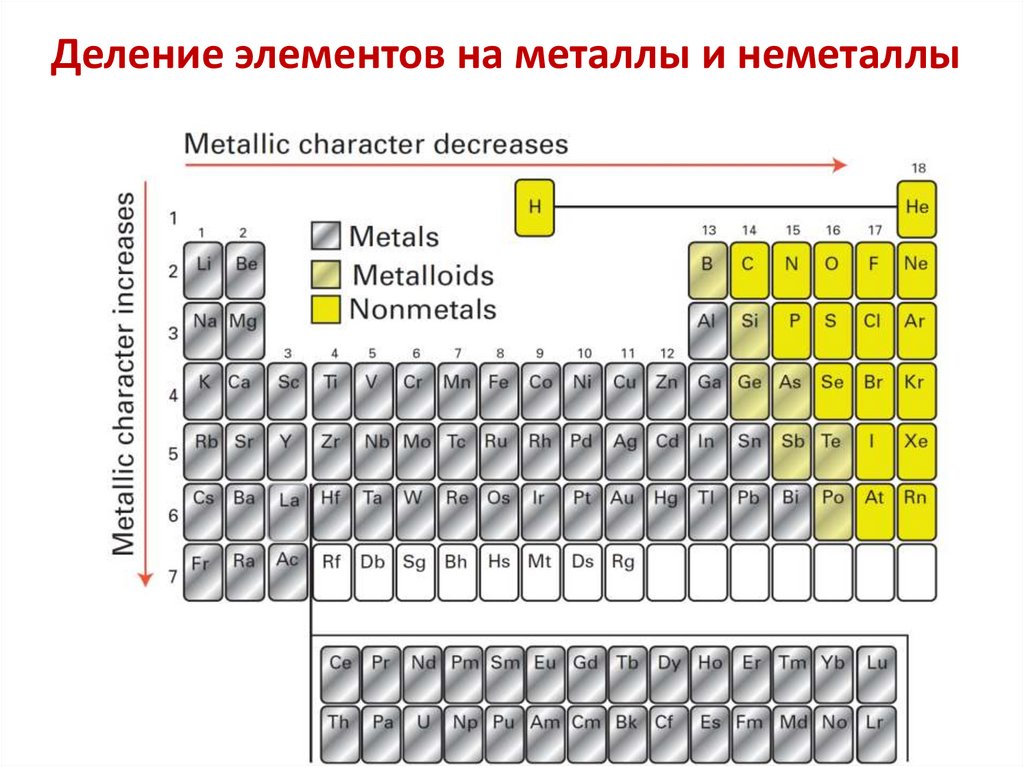
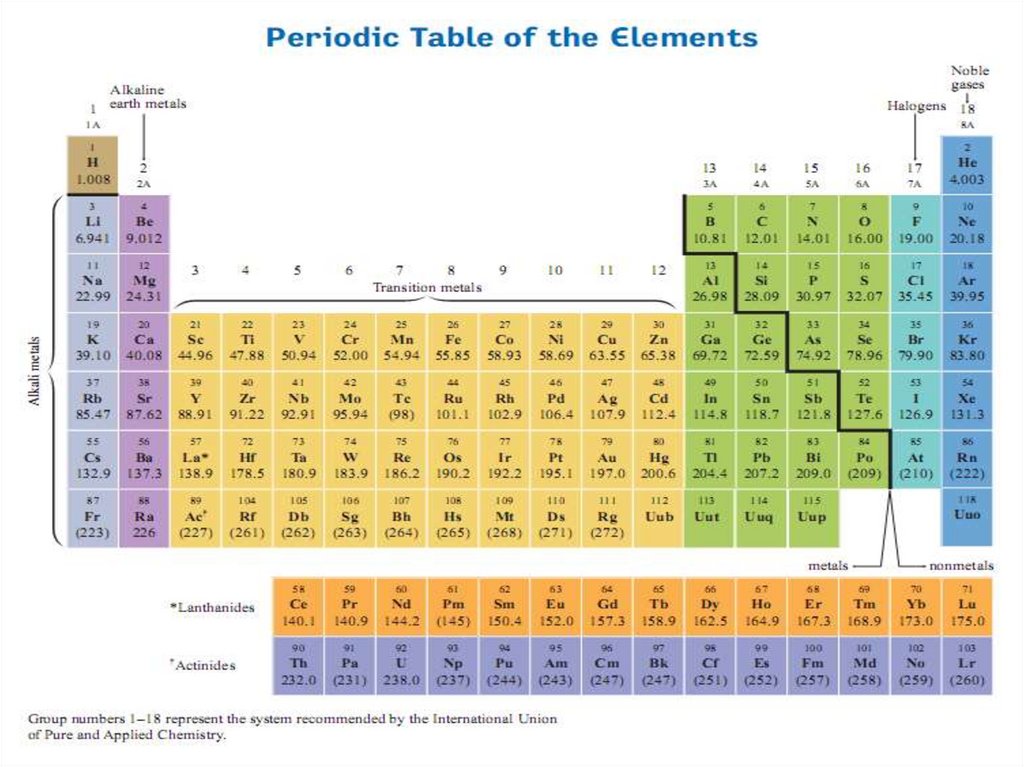
Деление элементов на металлы и неметаллы3.
4.
5.
Типы химической связиИонная химическая связь осуществляется посредством
электростатического притяжения противоположно
заряженных ионов.
Na + Cl → Na+ +
Cl-
Металл + неметалл → ионная связь
Na 3s1
Cl 3s2 3p5
∆ЭО > 1,7
Простые и сложные ионы:
NH4+
SO42-
[Zn(OH)4]2-
[Ni(NH3)6]2+
6.
Металлическая связьМеталлическая связь — катионы металлов
располагаются в регулярном порядке в поле внешних
электронов, образующих «электронный газ». Валентные
электроны делокализованы.
Металлическая связь возникает между атомами
металлов в простых веществах, сплавах или в
интерметаллических соединениях
Атомы металла
катионы металла
валентные делокализованные
электроны
7.
Типы химической связиКовалентная связь осуществляется посредством
общей электронной пары с противоположно
направленными спинами.
Cl + Cl →
Cl—Cl
Cl 3s2 3p5
а) Неметалл + неметалл → ковалентная связь
∆ЭО < 1,7
б) Металл в высокой степени окисления + неметалл→
ковалентная связь
CrO3, Mn2O7
в) В комплексных соединениях
комплексообразователь + лиганд → ковалентная
связь
NH4+
[Zn(OH)4]2[Ni(NH3)6]2+
[Fe(CO)5]
8. Ковалентная химическая связь
Методы описания природы ковалентной связи1.Теория Льюиса – Косселя (построение структурных,
электроно-графических формул молекул и ионов, определение
геометрии по методу ОВЭП )
2.Метод валентных связей (МВС)
(объяснение
насыщаемости ковалентной связи и валентных возможностей
атомов, геометрии молекул, полярности и поляризуемости
молекул)
3.Метод
молекулярных
орбиталей
(ММО)
(объяснение устойчивости молекул и ионов, магнитных свойств,
спектральных свойств, окраски молекул и ионов, энергии
ионизации)
МВС и ММО основаны на квантово-механических
расчетах и дополняют друг друга
9.
Молекула — устойчивая электронейтральнаямногоатомная наименьшая частица химического
вещества, обладающая его химическими свойствами.
Связи между атомами в молекуле — ковалентные.
Молекула характеризуется :
- определенным составом
- брутто и структурной формулой
- геометрией (длиной связей, валентными углами)
- полярностью
- поляризуемостью
Молекулярный ион — заряженная частица,
образованная из нескольких атомов посредством
ковалентных связей.
10.
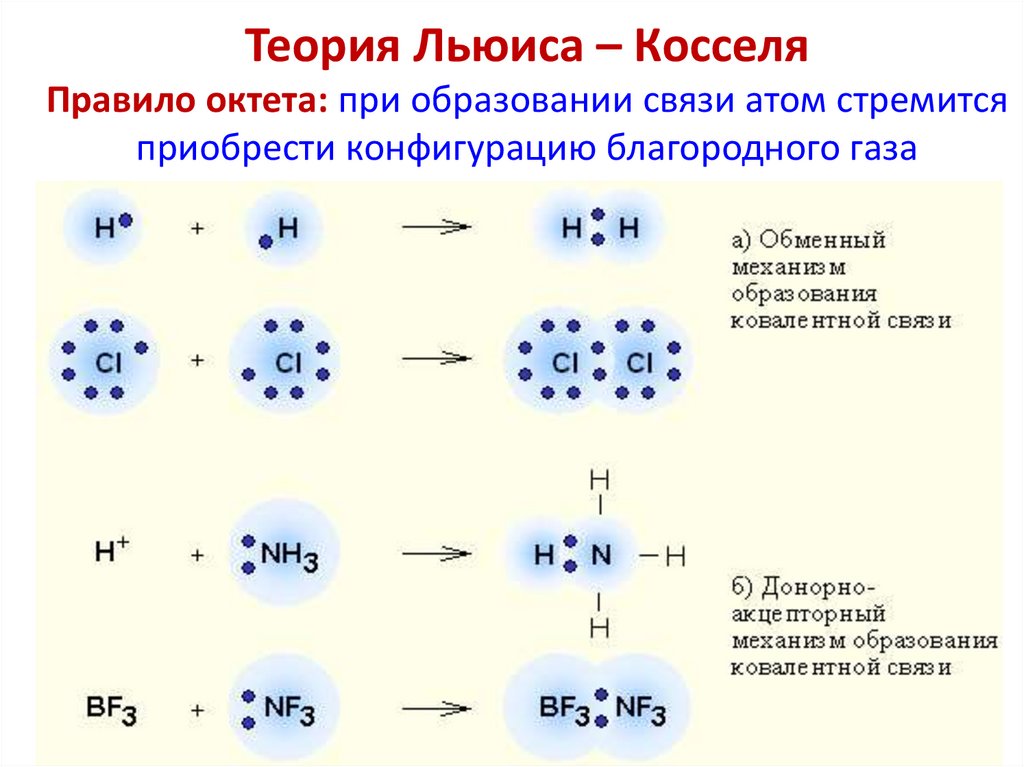
Теория Льюиса – КосселяПравило октета: при образовании связи атом стремится
приобрести конфигурацию благородного газа
→
Ионная связь
→
Ковалентная связь
11. Теория Льюиса – Косселя Правило октета: при образовании связи атом стремится приобрести конфигурацию благородного газа
12.
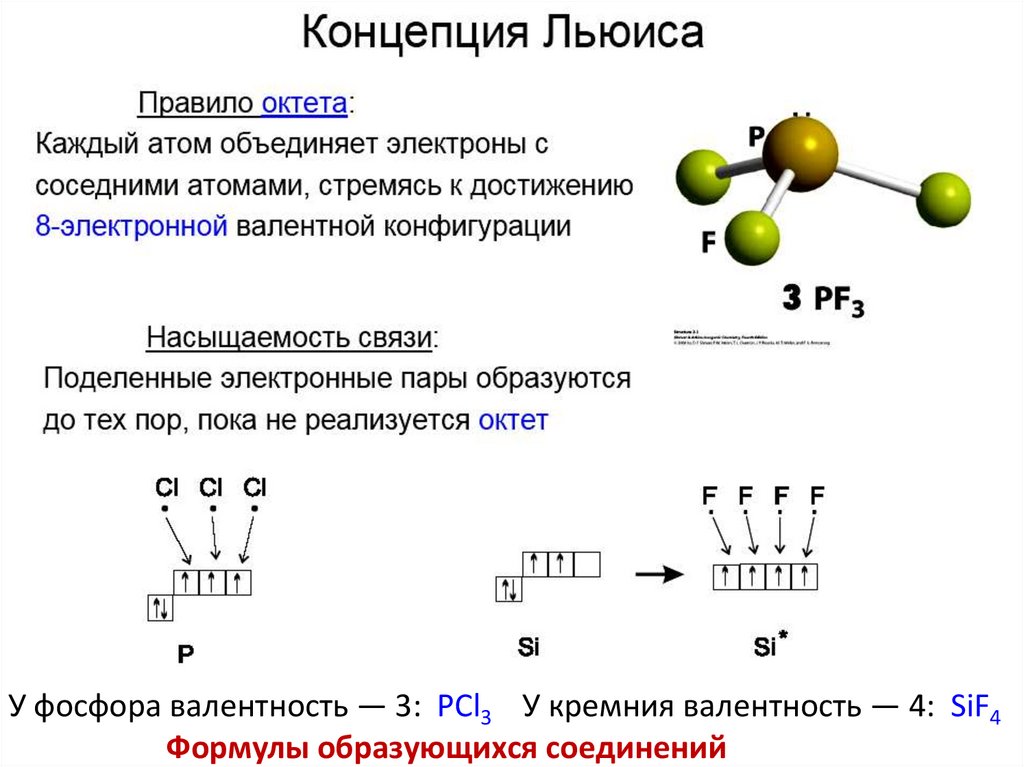
У фосфора валентность — 3: PCl3 У кремния валентность — 4: SiF4Формулы образующихся соединений
13.
Правила составления электронно-графических(структурных) формул молекул (молекулярных ионов)
1. Определяют суммарное число всех валентных электронов в
молекуле. Если молекула образована нейтральными частицами,
это число совпадает с суммой валентных электронов атомов,
входящих в молекулу. При рассмотрении отрицательно
заряженного иона к числу его валентных электронов следует
добавить число зарядов иона, а при рассмотрении
положительно заряженного иона из числа валентных
электронов следует вычесть заряд иона.
2. Записывают символы входящих в молекулу атомов таким
образом, чтобы показать, какие из них соединены друг с
другом.
а)Выбирают центральный атом с наибольшей валентностью
б) Учитывают «чередование зарядов».
3. Соединяют черточками простой связью каждую пару
атомов, между которыми предполагается наличие связи,
учитывая валентные возможности атомов .
14.
Правила составления электронно-графических(структурных) формул молекул (молекулярных ионов)
4. Указывают, около каждого атома остающиеся у него
неподеленные электронные пары.
5. Проверяют, удовлетворяет ли правилу октета общее число
электронов, приписываемых атому.
Если такое отнесение всех имеющихся электронов
удовлетворяет правилу октета для каждого атома,
предполагаемая валентная структура является правильной.
Если же таким образом не удается удовлетворить правилу октета
для каждого атома, атомы соединяют двойными или тройными
связями, одновременно уменьшая число неподеленных
электронных пар.
15.
Правила составления электронно-графических(структурных) формул молекул (молекулярных ионов)
Исключения из правила октета
1. Молекулы с нечетным числом электронов.
В молекулах, как ClO2, NO, NO2, число электронов нечетное.
Например, молекула N0 содержит (5 + 6 = 11) валентных
электронов. Очевидно, при этих условиях полное спаривание
электронов оказывается невозможным и нельзя окружить каждый
атом октетом электронов.
2. Вокруг какого-либо атома оказывается меньше восьми
электронов. Такая ситуация: относительно редка и характерна для
элементов начала периода – IA, IIA, IIIA-подгрупп. Например , BF3
3. В валентной оболочке одного или нескольких атомов имеется
больше восьми электронов.
Характерно для элементов 3-го и больших периодов. Например,
РF ,
16.
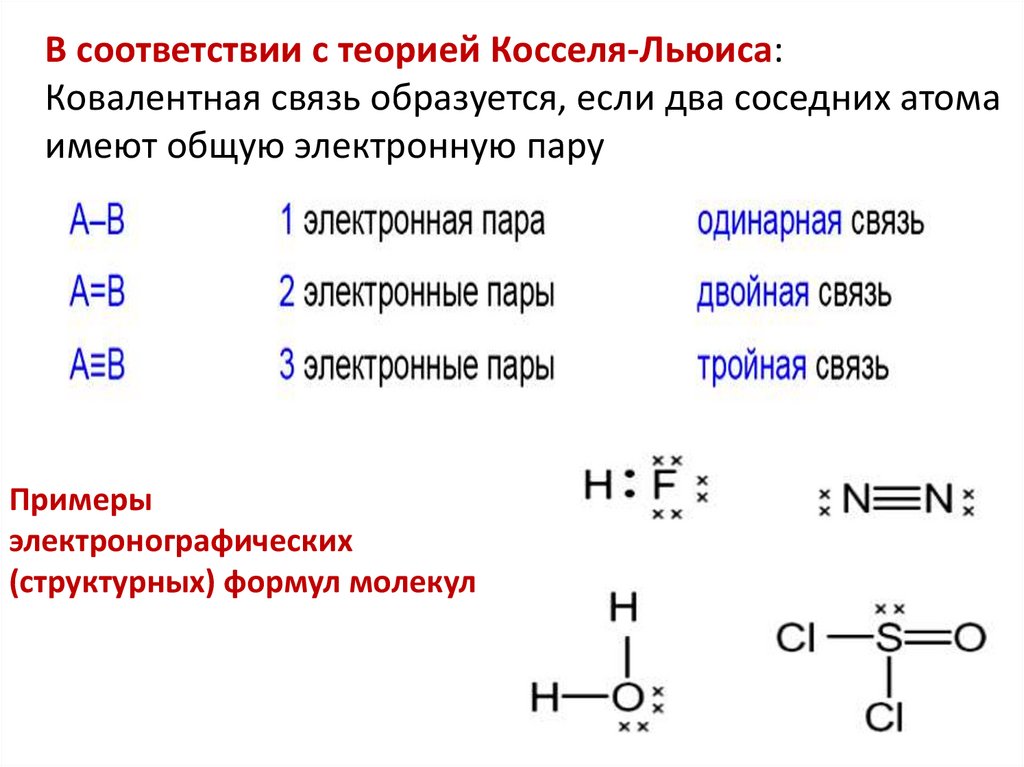
В соответствии с теорией Косселя-Льюиса:Ковалентная связь образуется, если два соседних атома
имеют общую электронную пару
Примеры
электронографических
(структурных) формул молекул
16
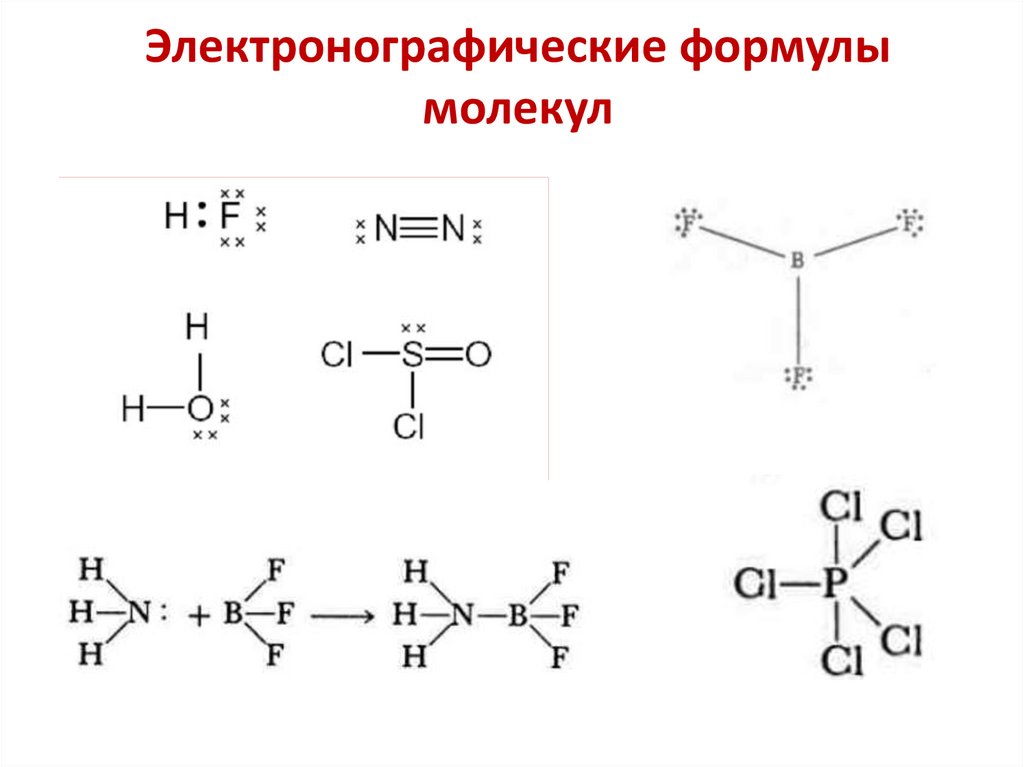
17. Электронографические формулы молекул
18.
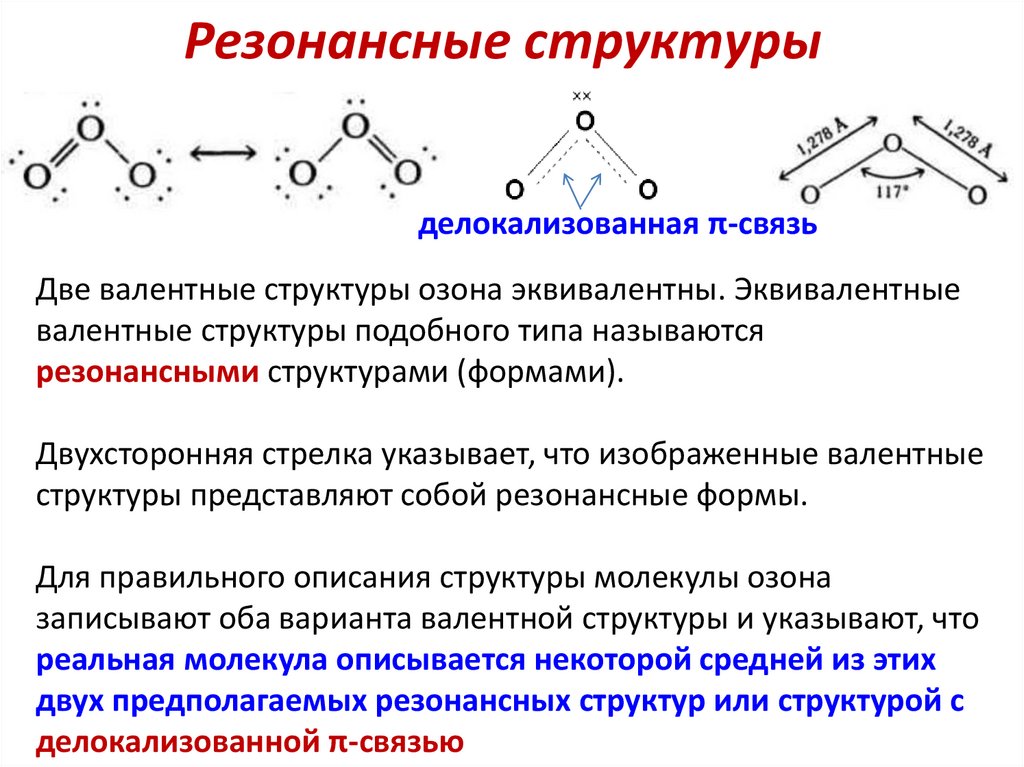
Резонансные структурыделокализованная π-связь
Две валентные структуры озона эквивалентны. Эквивалентные
валентные структуры подобного типа называются
резонансными структурами (формами).
Двухсторонняя стрелка указывает, что изображенные валентные
структуры представляют собой резонансные формы.
Для правильного описания структуры молекулы озона
записывают оба варианта валентной структуры и указывают, что
реальная молекула описывается некоторой средней из этих
двух предполагаемых резонансных структур или структурой с
делокализованной π-связью
19.
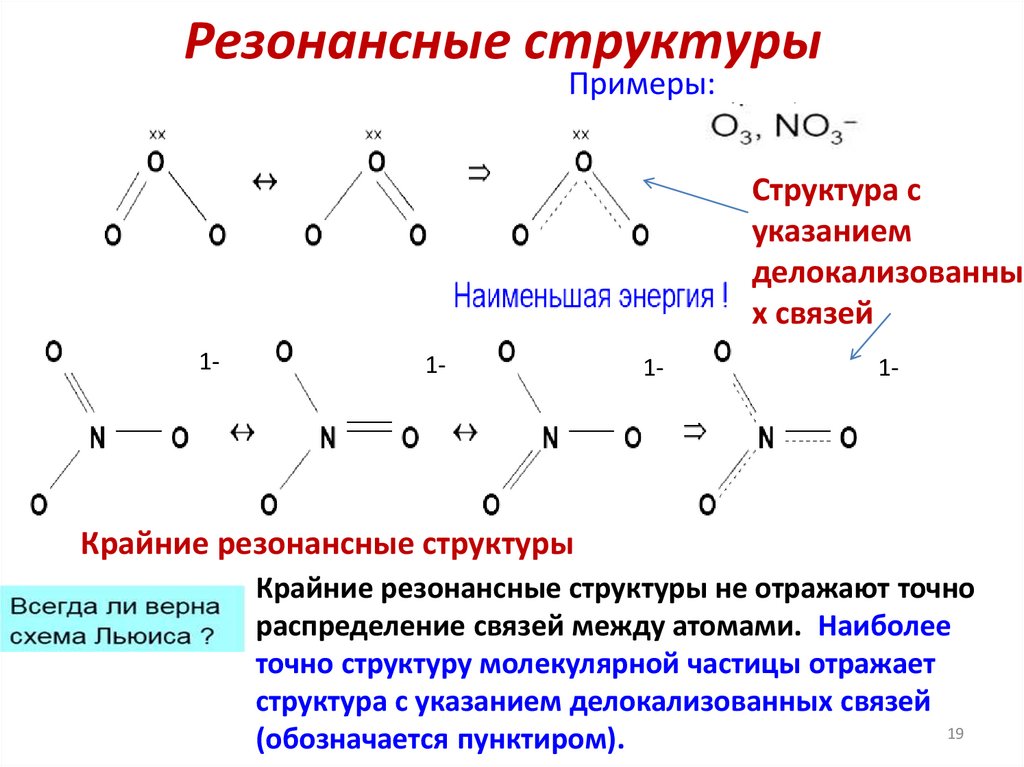
Резонансные структурыПримеры:
Структура с
указанием
делокализованны
х связей
1-
1-
1-
1-
Крайние резонансные структуры
Крайние резонансные структуры не отражают точно
распределение связей между атомами. Наиболее
точно структуру молекулярной частицы отражает
структура с указанием делокализованных связей
19
(обозначается пунктиром).
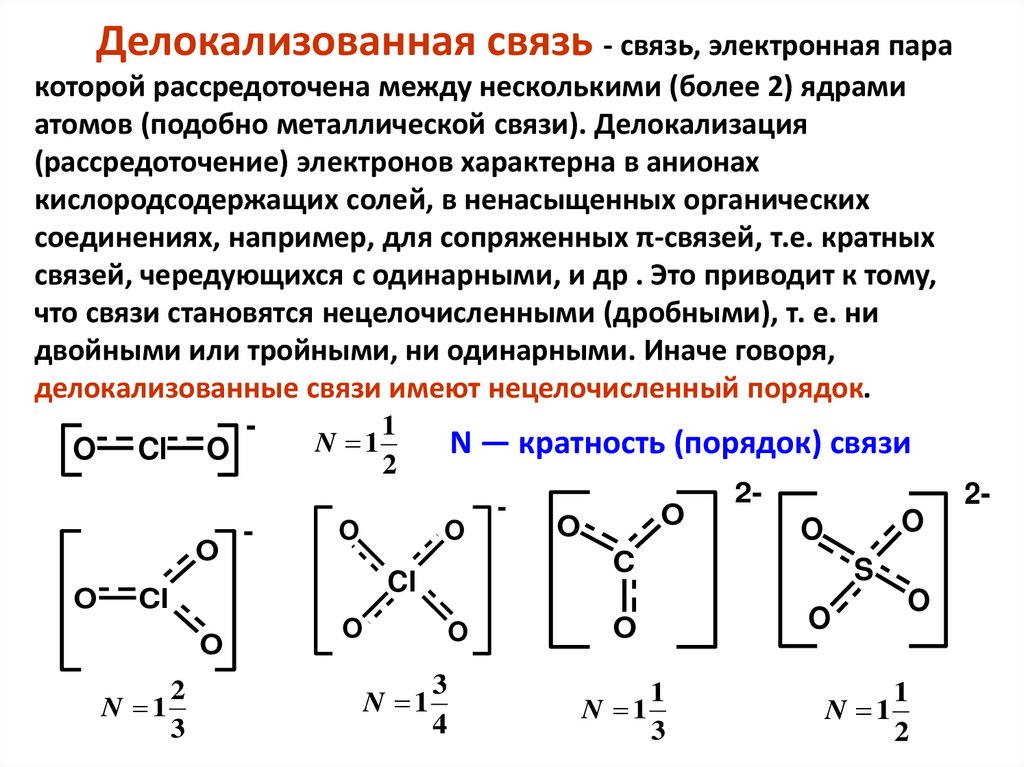
20.
Делокализованная связь - связь, электронная паракоторой рассредоточена между несколькими (более 2) ядрами
атомов (подобно металлической связи). Делокализация
(рассредоточение) электронов характерна в анионах
кислородсодержащих солей, в ненасыщенных органических
соединениях, например, для сопряженных π-связей, т.е. кратных
связей, чередующихся с одинарными, и др . Это приводит к тому,
что связи становятся нецелочисленными (дробными), т. е. ни
двойными или тройными, ни одинарными. Иначе говоря,
делокализованные связи имеют нецелочисленный порядок.
1
N
1
N — кратность (порядок) связи
O Cl O
2
O
O
-
O
O
O
O
N 1
O
O
2-
O
O
C
Cl
Cl
2
N 1
3
O
-
3
4
S
O
O
N 1
1
3
N 1
O
1
2
2-
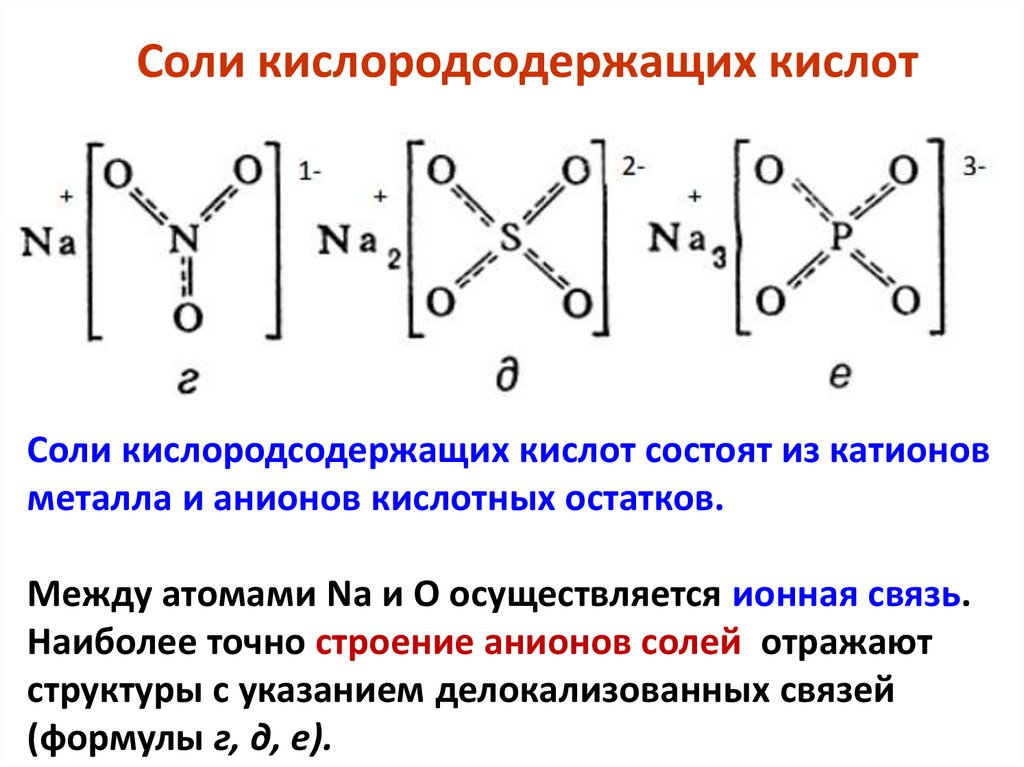
21.
Соли кислородсодержащих кислотСоли кислородсодержащих кислот состоят из катионов
металла и анионов кислотных остатков.
Между атомами Na и O осуществляется ионная связь.
Наиболее точно строение анионов солей отражают
структуры с указанием делокализованных связей
(формулы г, д, е).
22.
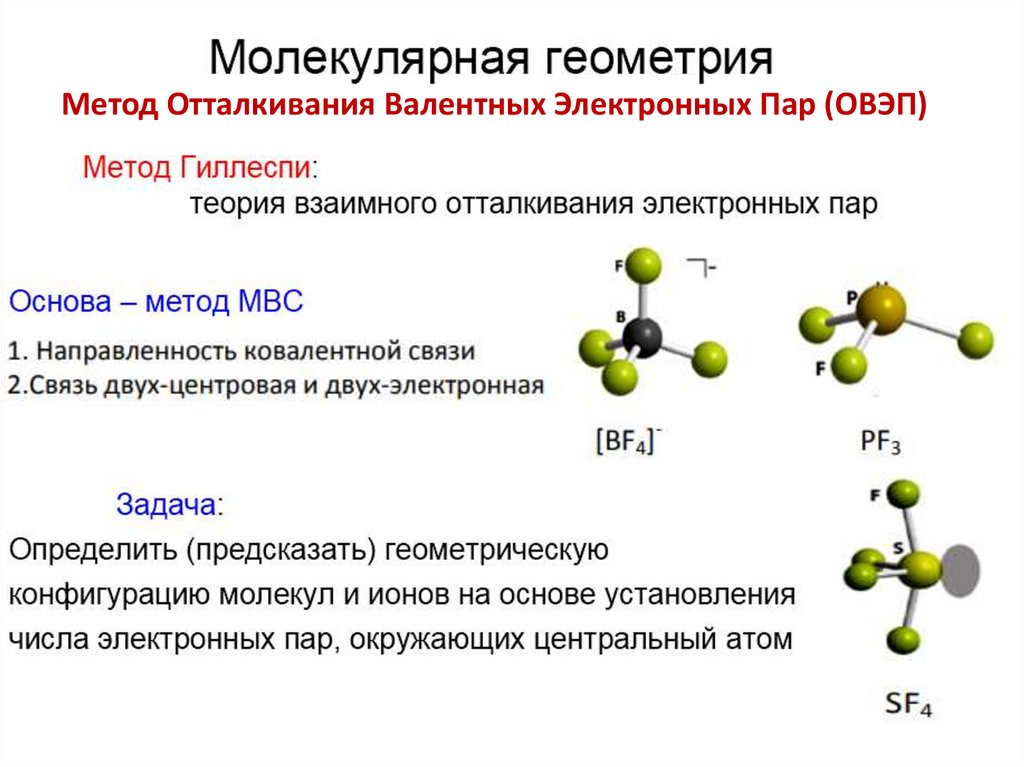
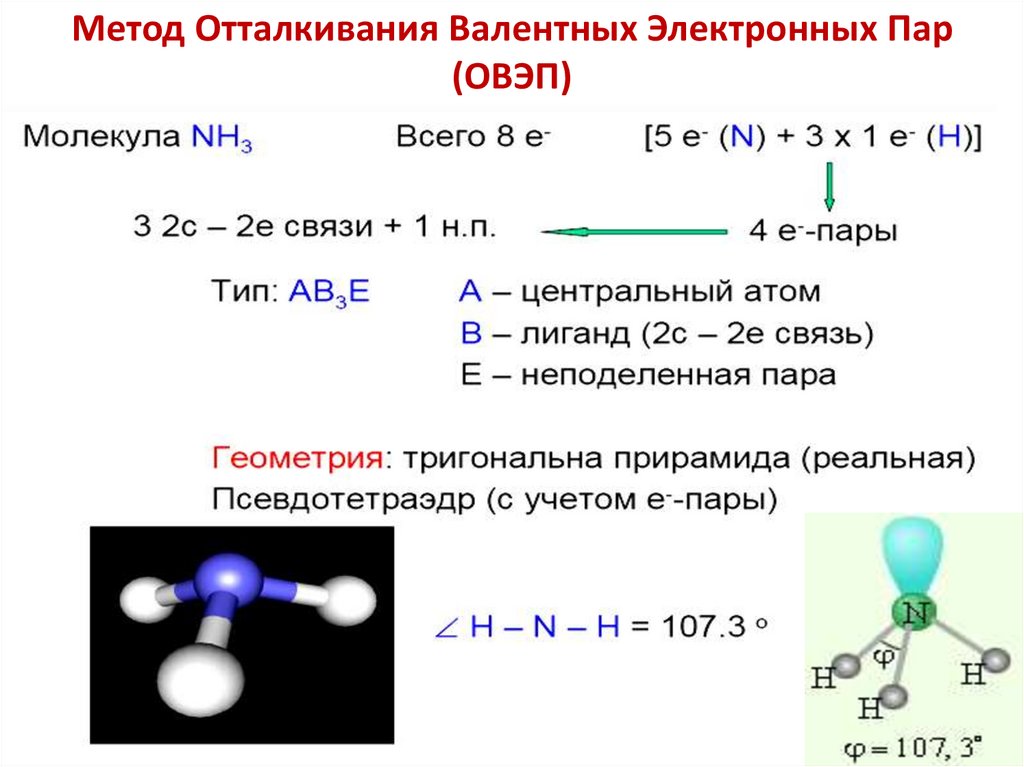
Метод Отталкивания Валентных Электронных Пар (ОВЭП)23.
Метод Отталкивания Валентных Электронных Пар(ОВЭП)
24.
Метод Отталкивания Валентных Электронных Пар(ОВЭП)
25.
Метод Отталкивания Валентных Электронных Пар(ОВЭП)
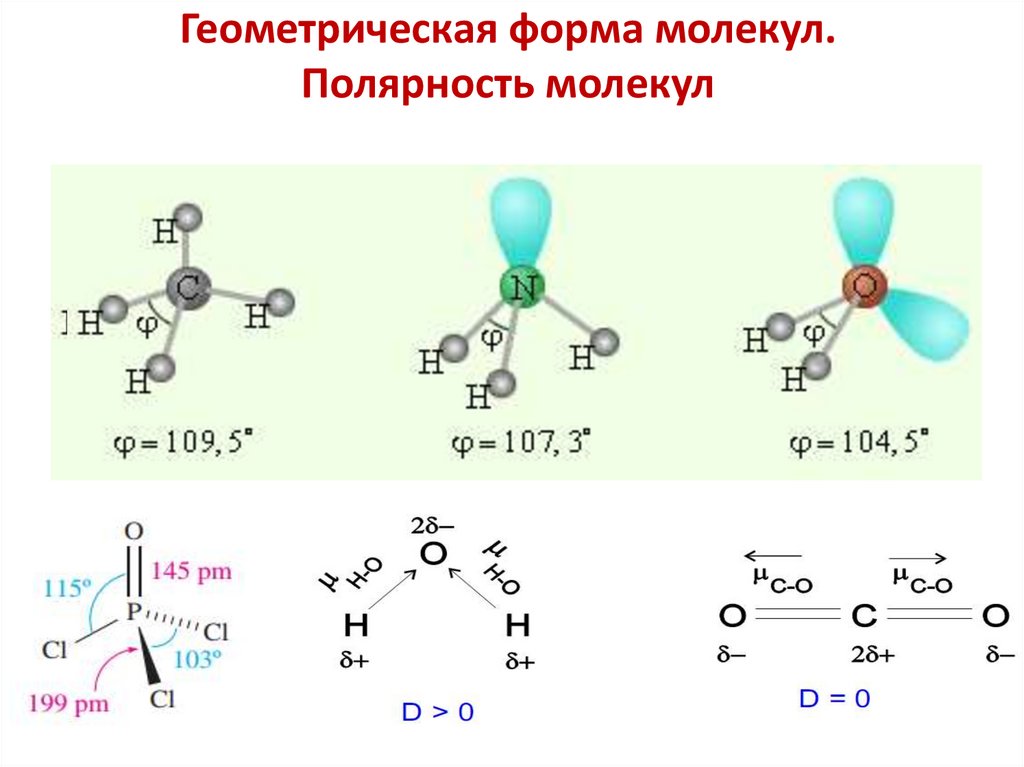
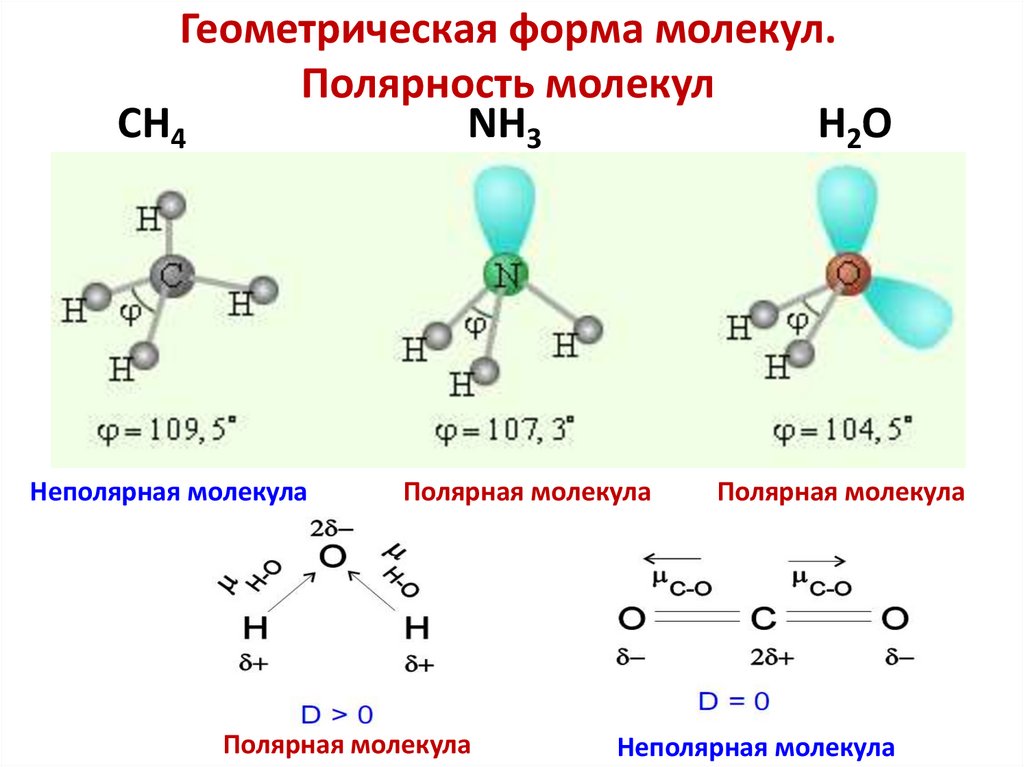
26. Геометрическая форма молекул. Полярность молекул
27.
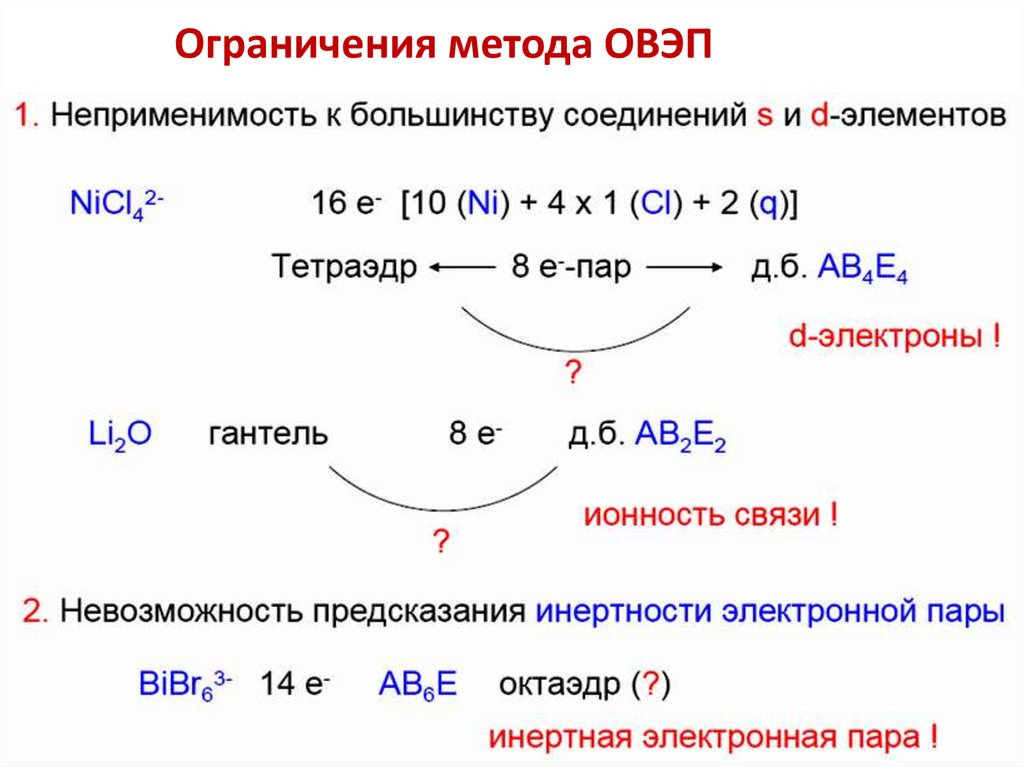
Ограничения метода ОВЭП28.
Метод Валентных Связей (МВС)29.
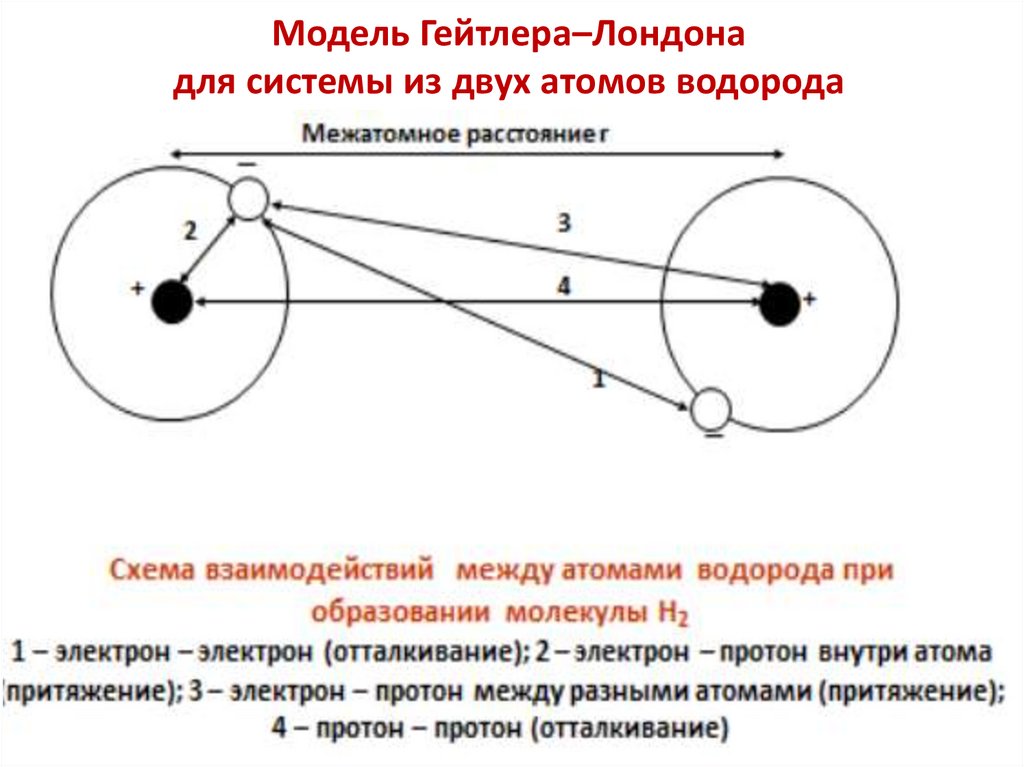
Модель Гейтлера–Лондона молекулы H2В 1927 году английские ученые Гейтлер и Лондон
составили волновое уравнение для системы, состоящей
из двух атомов водорода, и рассчитали энергию системы
в зависимости от расстояния между атомами водорода.
За состояние с нулевой энергией принято состояние
бесконечно удаленных друг от друга атомов водорода.
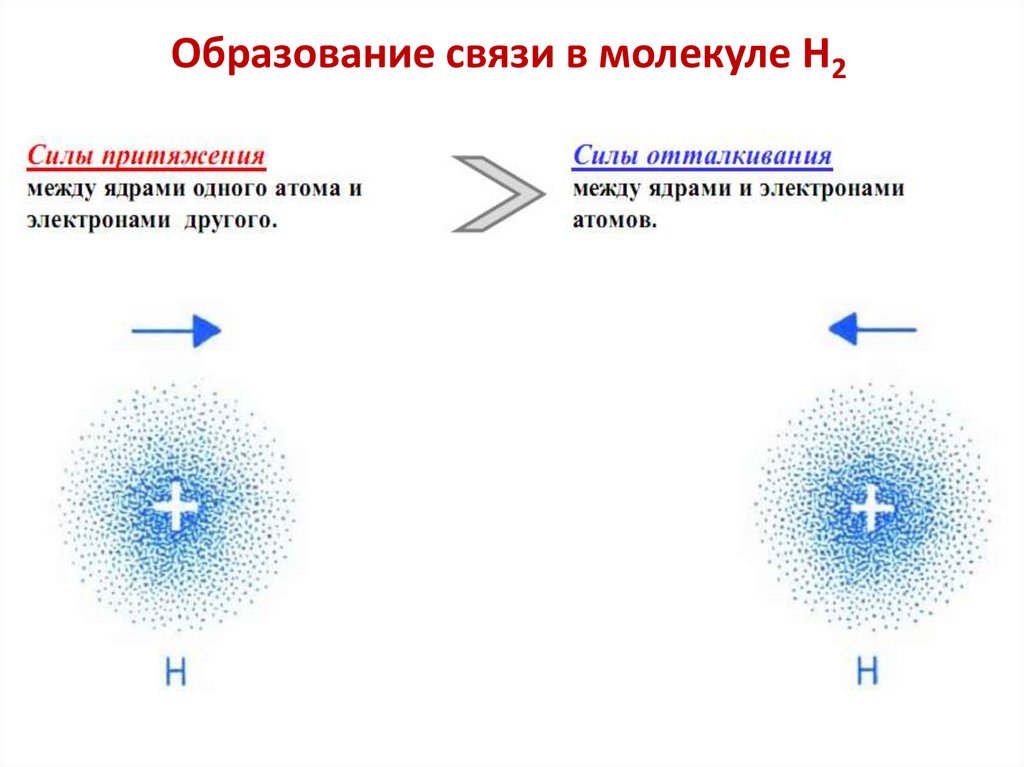
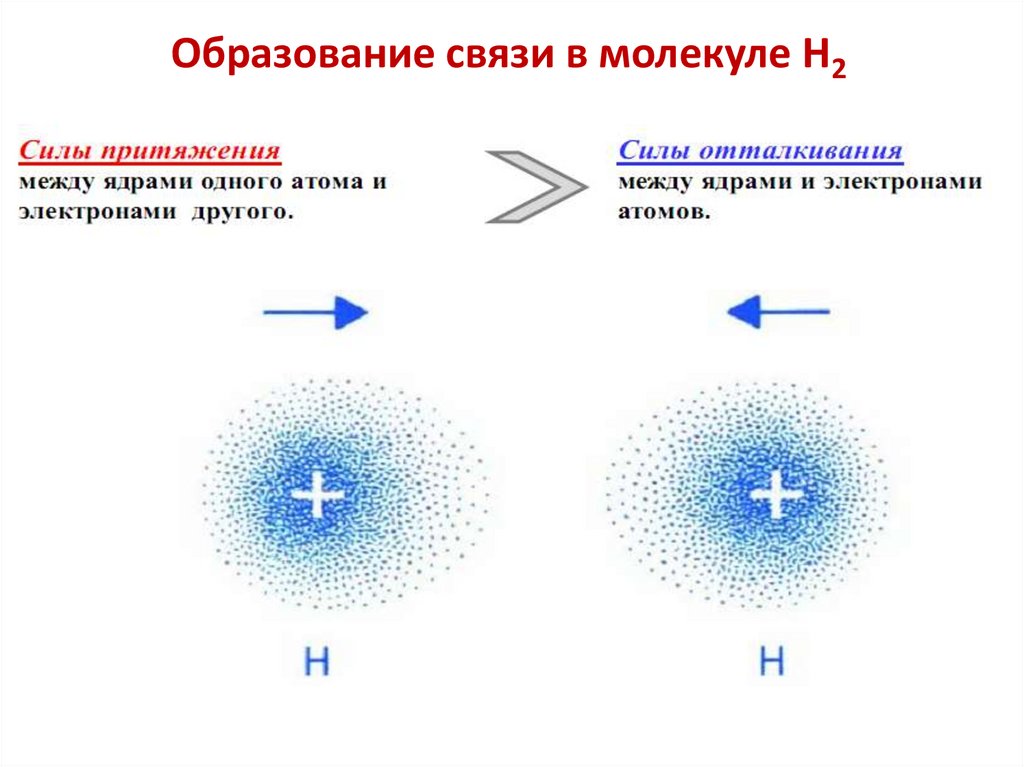
По мере сближения между атомами возникают силы
притяжения и силы отталкивания.
30.
Модель Гейтлера–Лондонадля системы из двух атомов водорода
31.
Модель Гейтлера–Лондона молекулы H2По мере сближения между атомами водорода возникают силы
притяжения и силы отталкивания.
Расчет показал, что если спины электронов параллельны, то на
всех расстояниях преобладают силы отталкивания (кривая 1).
Если спины электронов антипараллельны, по мере сближения
между атомами преобладают сначала силы притяжения (кривая
2), но затем силы отталкивания.
На расстоянии L0 силы притяжения уравновешиваются силами
отталкивания. В этом состоянии система характеризуется
минимальной энергией (кривая 2).
Согласно принципу Паули электроны с антипараллельными
спинами могут находиться в одной области пространства. В
результате притяжения ядра одного атома и электронов другого,
пара электронов принадлежит обоим ядрам в равной степени и
в области между ядрами возрастает электронная плотность.
Между атомами возникает ковалентная химическая связь, если
спины электронов антипараллельны.
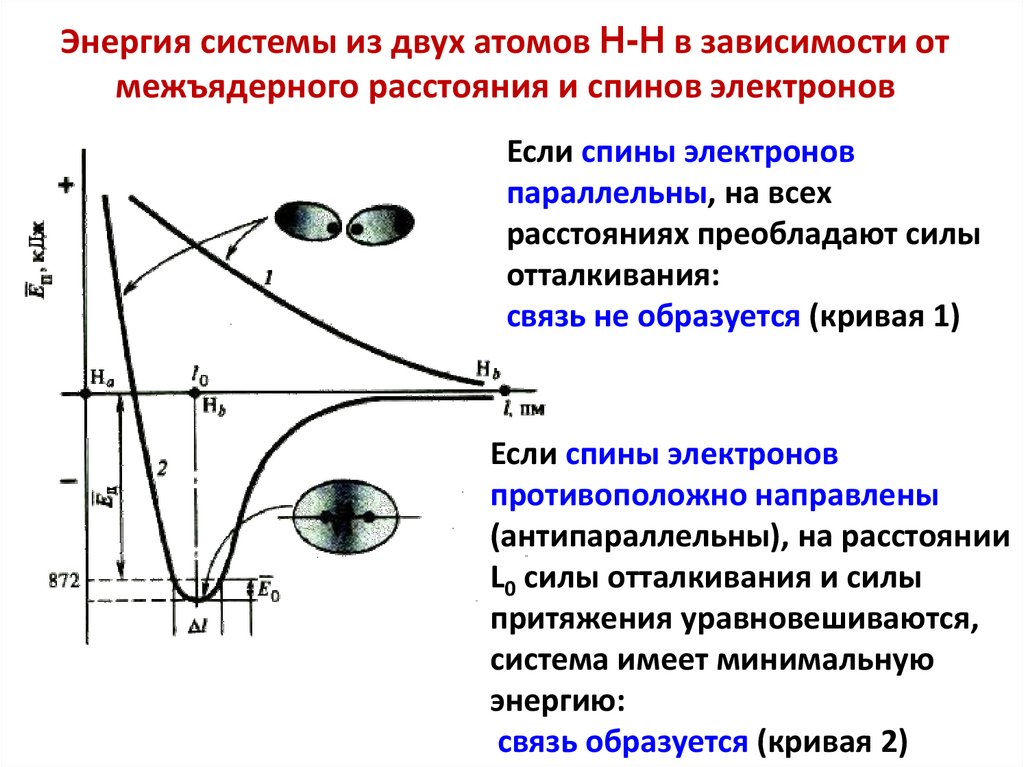
32. Энергия системы из двух атомов Н-Н в зависимости от межъядерного расстояния и спинов электронов
Если спины электроновпараллельны, на всех
расстояниях преобладают силы
отталкивания:
связь не образуется (кривая 1)
Если спины электронов
противоположно направлены
(антипараллельны), на расстоянии
L0 силы отталкивания и силы
притяжения уравновешиваются,
система имеет минимальную
энергию:
связь образуется (кривая 2)
33.
Образование связи в молекуле Н234.
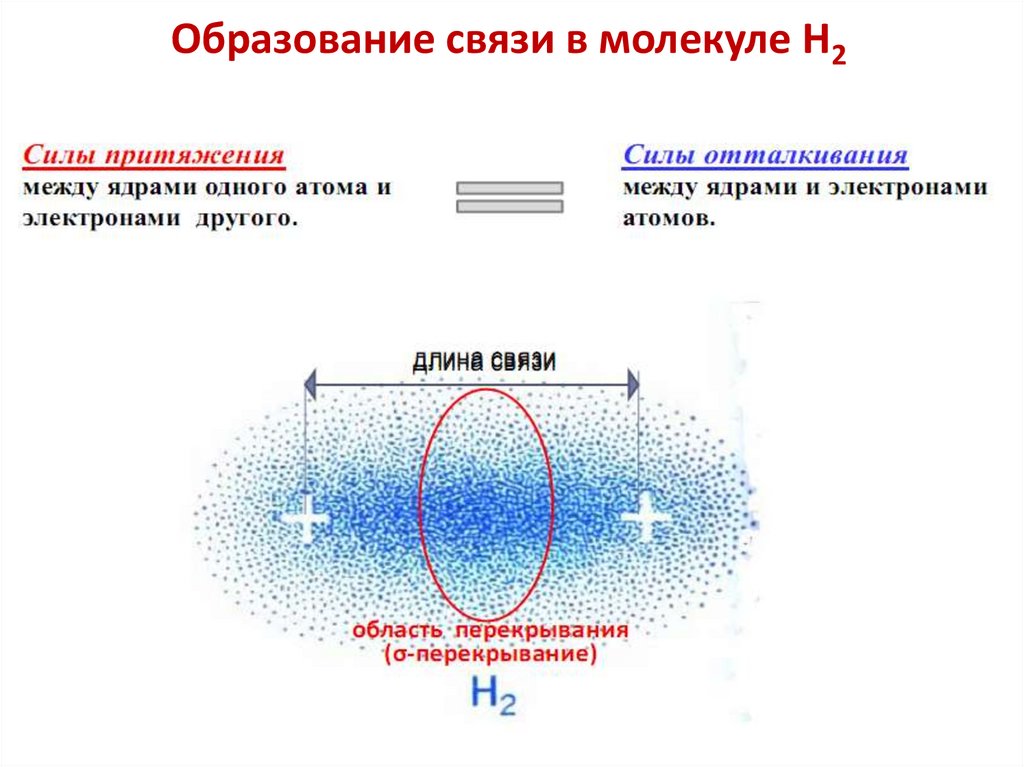
Образование связи в молекуле Н235.
Образование связи в молекуле Н236.
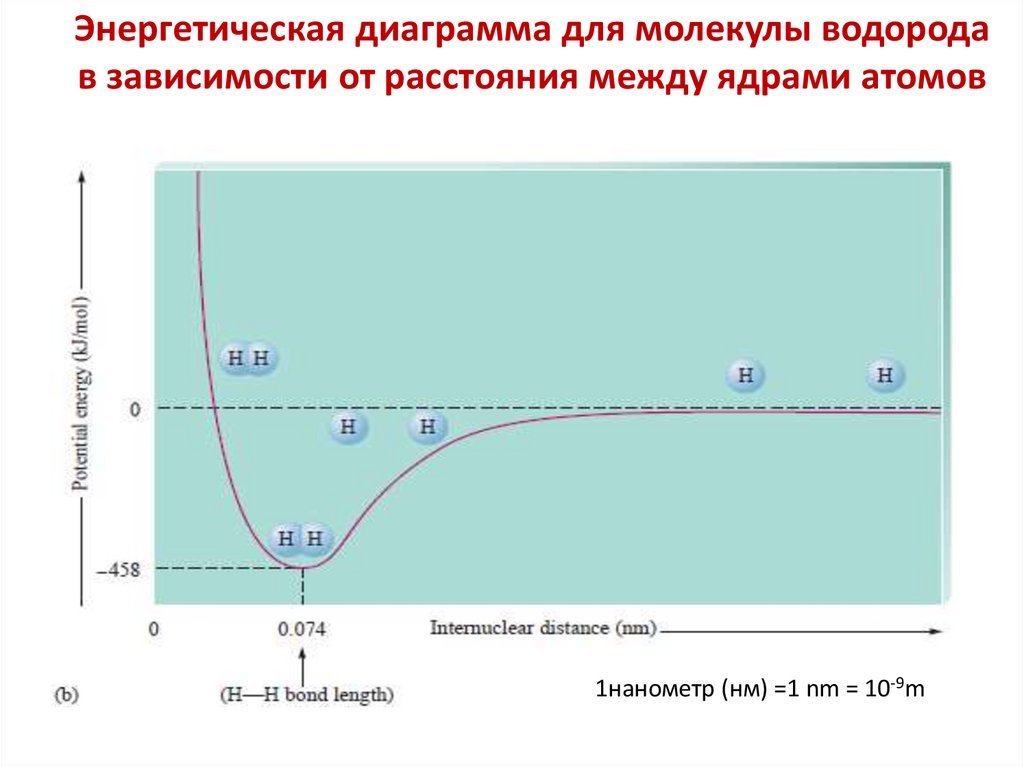
Энергетическая диаграмма для молекулы водородав зависимости от расстояния между ядрами атомов
1нанометр (нм) =1 nm = 10-9m
37.
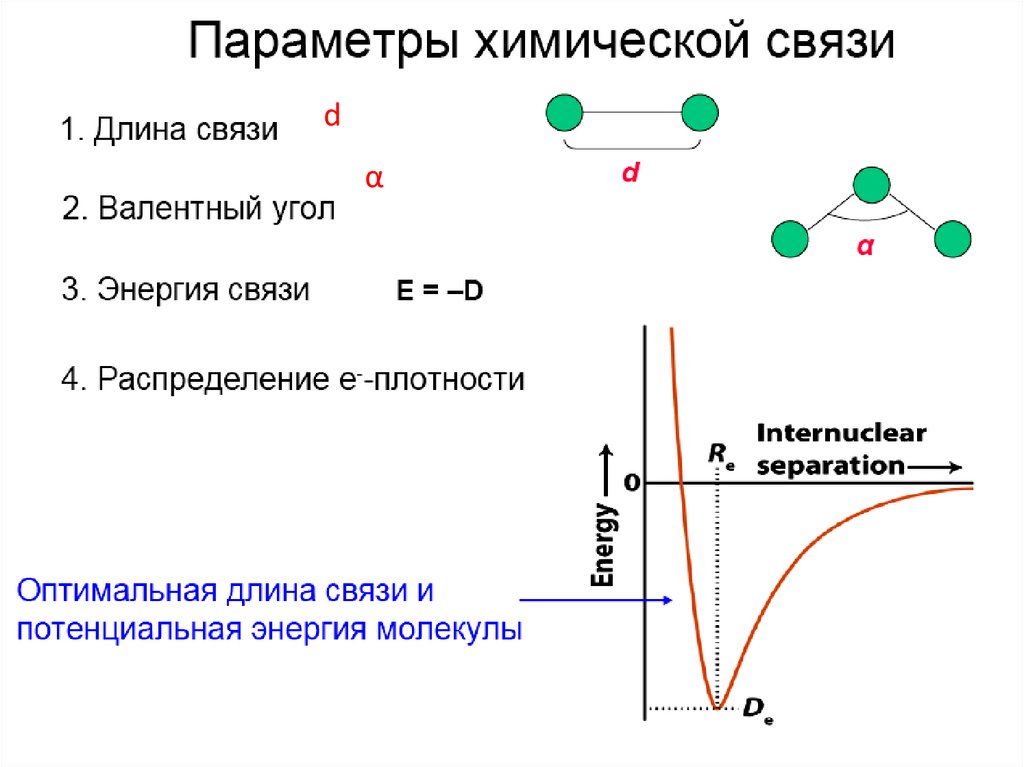
dα
38.
Энергия связи — энергия, необходимая для разрывасвязи и удаления атомов на бесконечно большое
расстояние друг от друга
Есвязи [кДж/моль] > 0 — энергия затрачивается на
разрыв связи.
Есвязи [кДж/моль] < 0 — энергия выделяется при
образовании связи.
Равновесное расстояние (L0 или R0 ) между ядрами
взаимодействующих атомов, соответствующее
минимальной энергии системы называют
равновесной длиной связи
39.
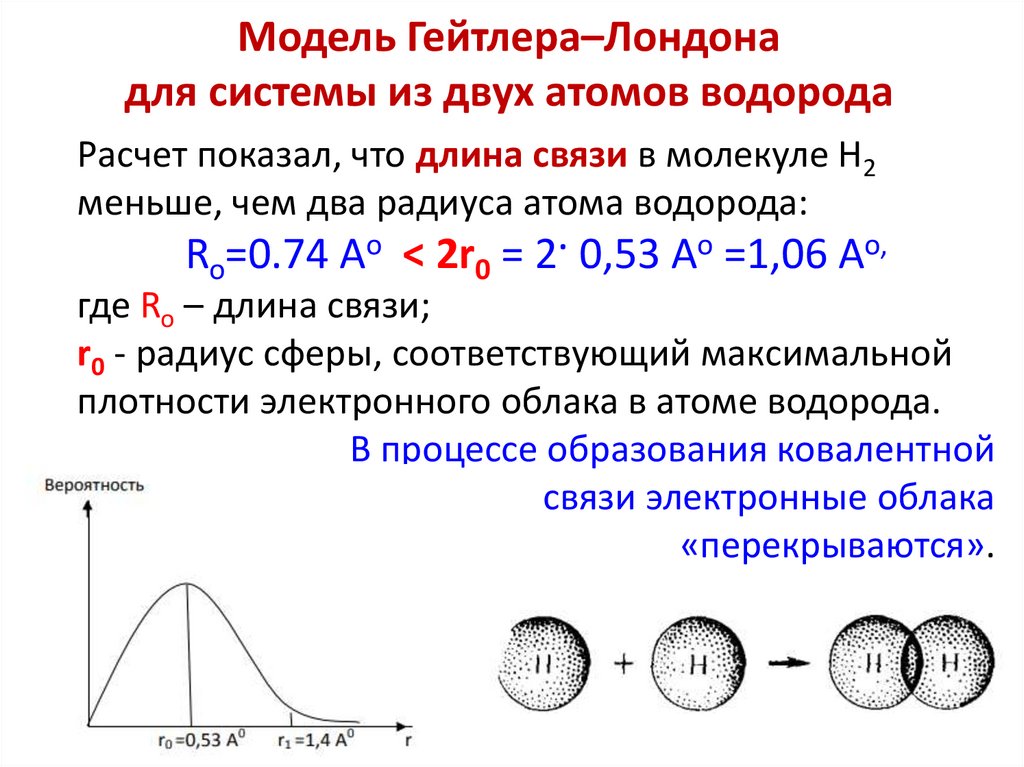
Модель Гейтлера–Лондонадля системы из двух атомов водорода
Расчет показал, что длина связи в молекуле H2
меньше, чем два радиуса атома водорода:
Ro=0.74 Ao < 2r0 = 2· 0,53 Ao =1,06 Ao,
где Ro – длина связи;
r0 - радиус сферы, соответствующий максимальной
плотности электронного облака в атоме водорода.
В процессе образования ковалентной
связи электронные облака
«перекрываются».
40.
Основные положения метода валентных связей1. Ковалентная химическая связь образуется при
обобществлении атомами пары электронов с
противоположно направленными спинами
Метод валентных связей (МВС) иначе называют
теорией локализованных электронных пар.
В основе метода лежит предположение, что
химическая связь между двумя атомами
осуществляется с помощью одной или нескольких
электронных пар, которые локализованы между
ядрами взаимодействующих атомов.
Число химических связей, которые способен
образовывать атом или ион, равно его валентности.
41.
Основные положения метода валентных связей2. В образовании ковалентной связи принимают
участие валентные электроны атомов и валентные
атомные орбитали.
3. Два механизма образования ковалентной связи
а) обменный — объединение неспаренных электронов
А↑ + ↓ В → А↑↓В
б) донорно-акцепторный механизм
А↑↓
донор
пары е
+
□В →
акцептор
пары е
А↑↓В
42. Метод валентных связей Образование донорно-акцепторной связи
Кислота ЛьюисаОснование Льюиса
- Кислота Льюиса
- Основание Льюиса
43.
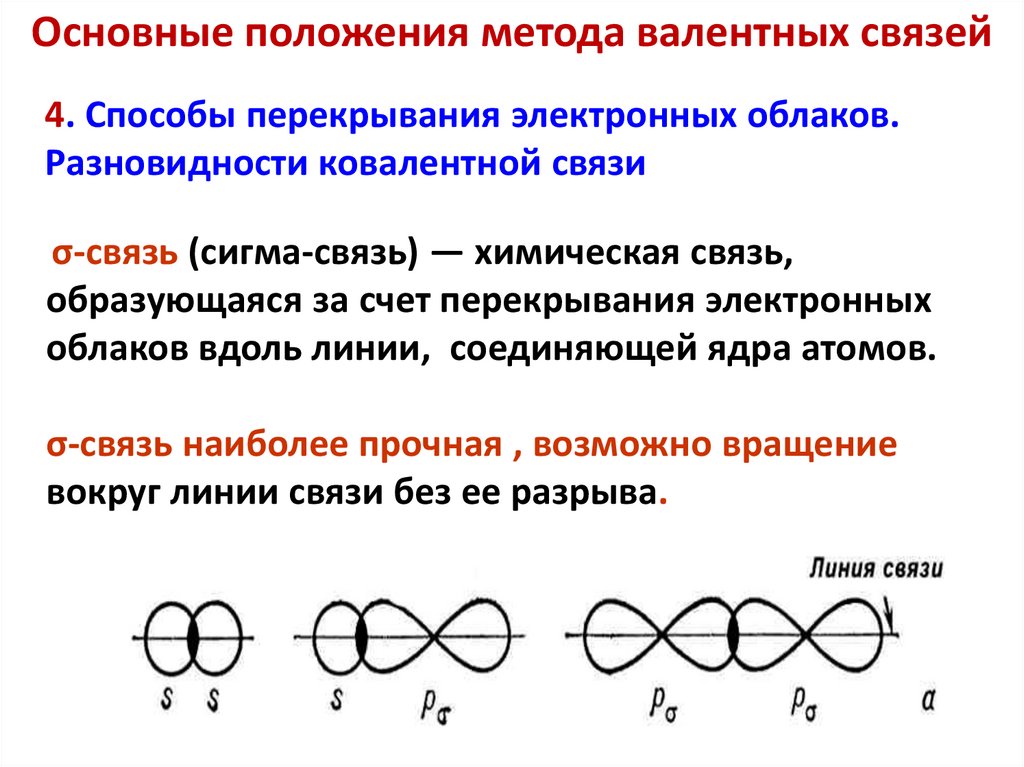
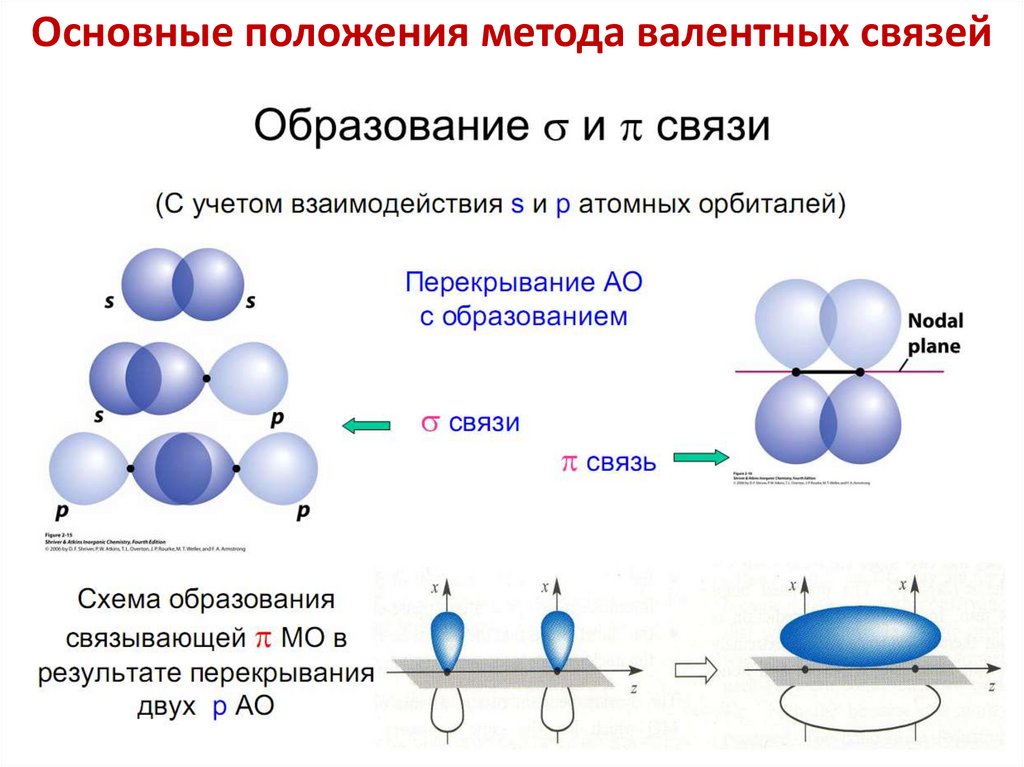
Основные положения метода валентных связей4. Способы перекрывания электронных облаков.
Разновидности ковалентной связи
σ-связь (сигма-связь) — химическая связь,
образующаяся за счет перекрывания электронных
облаков вдоль линии, соединяющей ядра атомов.
σ-связь наиболее прочная , возможно вращение
вокруг линии связи без ее разрыва.
44.
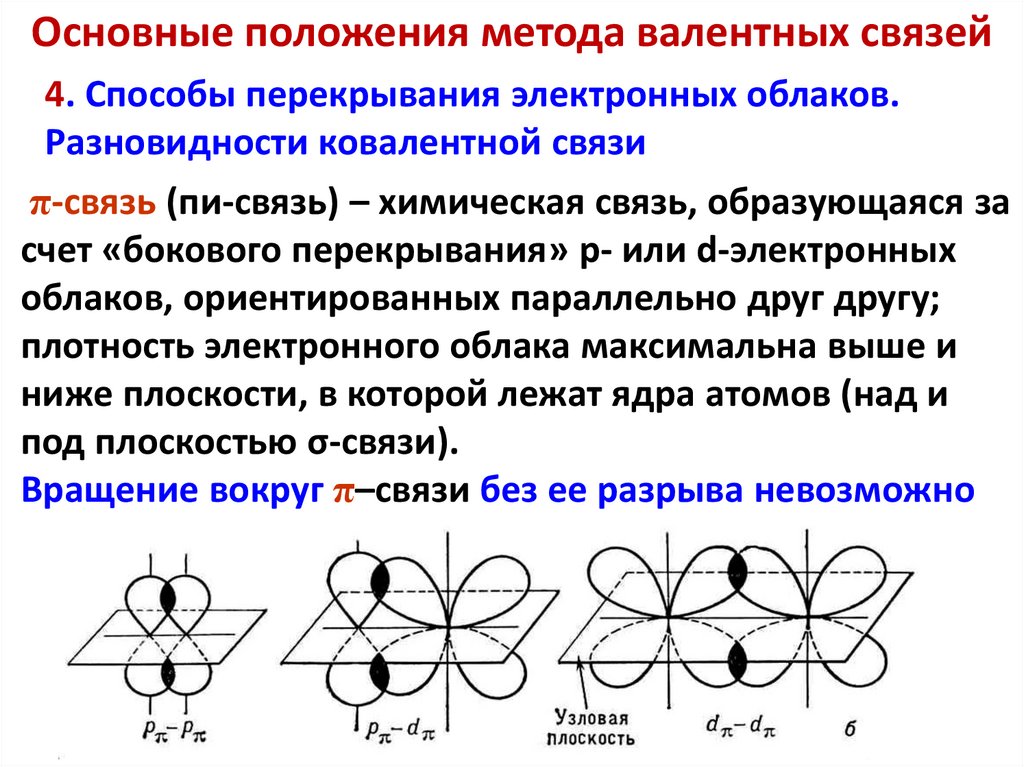
Основные положения метода валентных связей4. Способы перекрывания электронных облаков.
Разновидности ковалентной связи
π-связь (пи-связь) – химическая связь, образующаяся за
счет «бокового перекрывания» p- или d-электронных
облаков, ориентированных параллельно друг другу;
плотность электронного облака максимальна выше и
ниже плоскости, в которой лежат ядра атомов (над и
под плоскостью σ-связи).
Вращение вокруг π–связи без ее разрыва невозможно
45.
Основные положения метода валентных связей46.
Основные положения метода валентных связей4. Способы перекрывания электронных облаков.
Разновидности ковалентной связи
δ -связь образуют только d-электроны за счет
перекрывания всех четырех своих лепестков
электронных облаков, расположенных в параллельных
плоскостях.
Такое возможно, когда в образовании связи участвуют
(dXY – dXY), (dXZ – dXZ), (dYZ – dYZ) - электроны.
47.
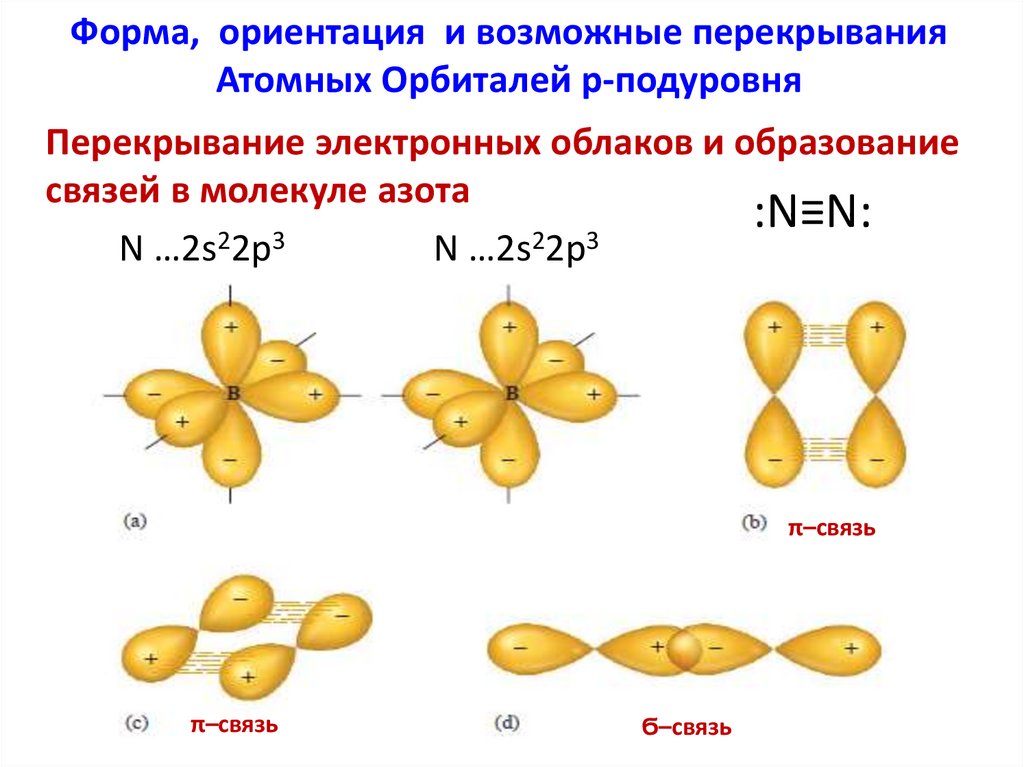
Форма, ориентация и возможные перекрыванияАтомных Орбиталей р-подуровня
Перекрывание электронных облаков и образование
связей в молекуле азота
:N≡N:
2
3
2
3
N …2s 2p
N …2s 2p
π–связь
π–связь
Ϭ–связь
48.
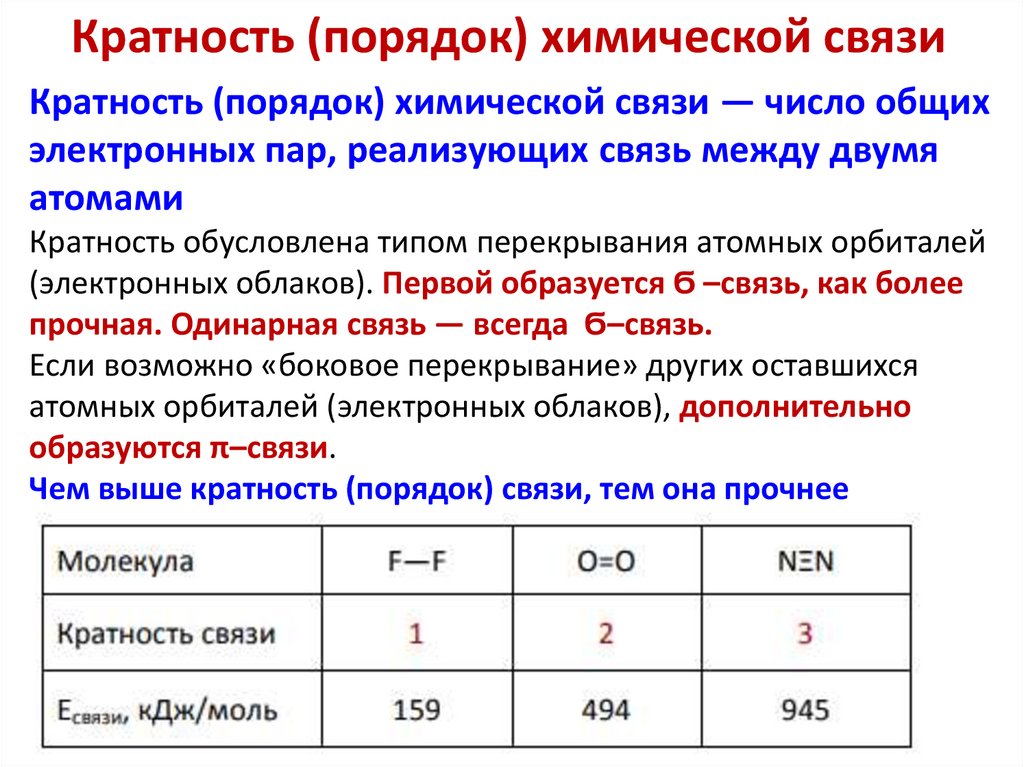
Кратность (порядок) химической связиКратность (порядок) химической связи — число общих
электронных пар, реализующих связь между двумя
атомами
Кратность обусловлена типом перекрывания атомных орбиталей
(электронных облаков). Первой образуется Ϭ –связь, как более
прочная. Одинарная связь — всегда Ϭ–связь.
Если возможно «боковое перекрывание» других оставшихся
атомных орбиталей (электронных облаков), дополнительно
образуются π–связи.
Чем выше кратность (порядок) связи, тем она прочнее
49.
Энергии связей, кДж/мольОдинарные связи
Кратные связи
Кратные связи
50.
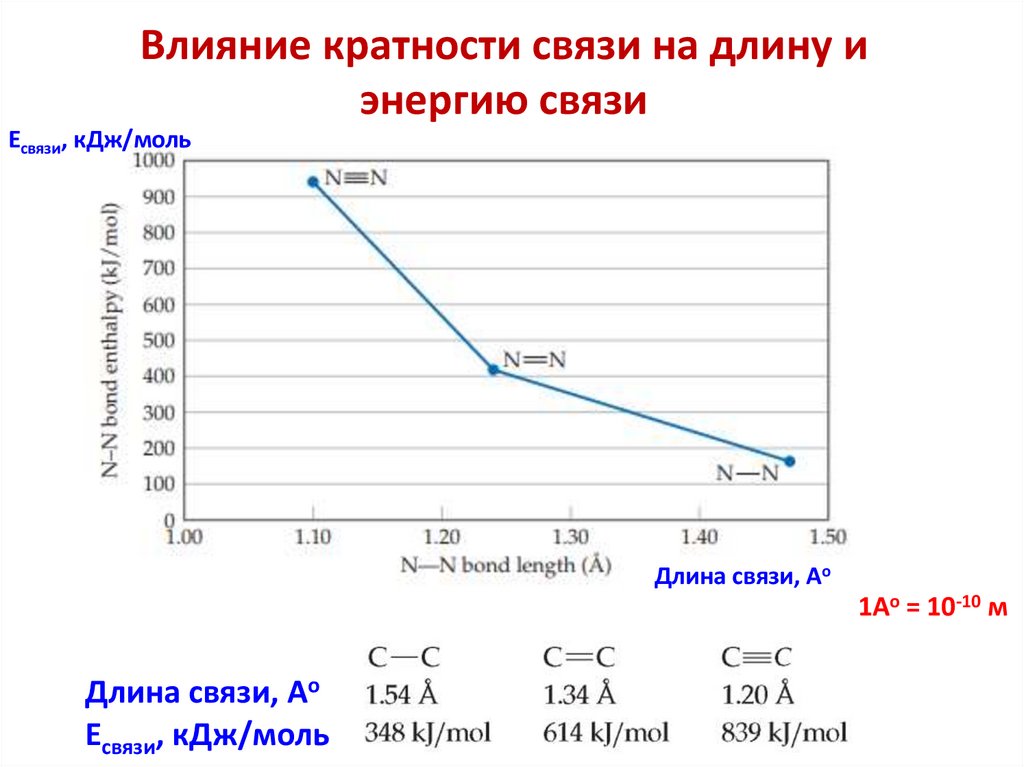
Влияние кратности связи на длину иэнергию связи
Есвязи, кДж/моль
Длина связи, Ао
1Ао = 10-10 м
Длина связи, Ао
Есвязи, кДж/моль
51.
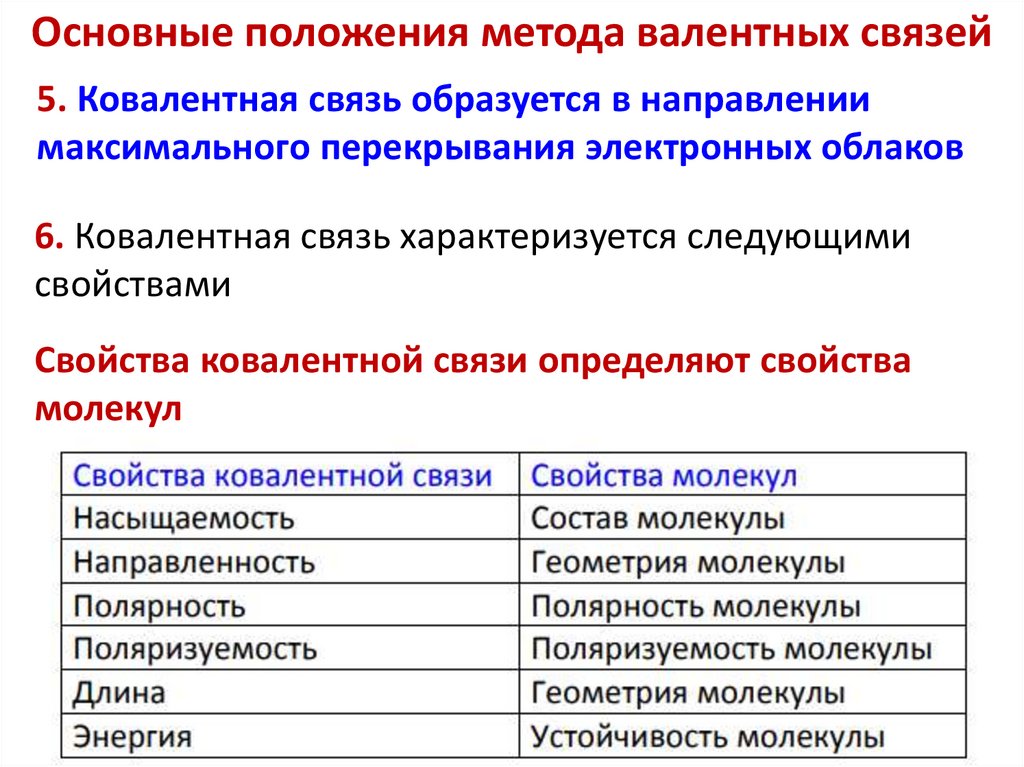
Основные положения метода валентных связей5. Ковалентная связь образуется в направлении
максимального перекрывания электронных облаков
6. Ковалентная связь характеризуется следующими
свойствами
Свойства ковалентной связи определяют свойства
молекул
52.
Насыщаемость ковалентной связи.Валентные возможности атомов
Насыщаемость ковалентной связи — способность атома
к образованию ограниченного числа ковалентных
связей.
В образовании ковалентных связей принимают участие
валентные электроны и валентные атомные орбитали.
Валентные возможности атомов ограничены. Атомы
вступают во взаимодействие в определенных
соотношениях. Молекулы имеют определенный состав
(закон постоянства состава молекул).
53.
Насыщаемость ковалентной связи.Валентные возможности атомов
При определении валентных возможностей атома
следует учитывать два механизма образования связей:
обменный и донорно-акцепторный
1 период: H 1s1 только 1 связь
2 период: 2s2p подуровни содержат 4 атомные
орбитали, возможно образование
мах 4 связи
3 и большие периоды: ns- np- nd- подуровни содержат
суммарно 9 атомных орбиталей , теоретически
возможно образование мах 9 связей, реализуются по
пространственным ограничениям , как правило – 6
связей
54.
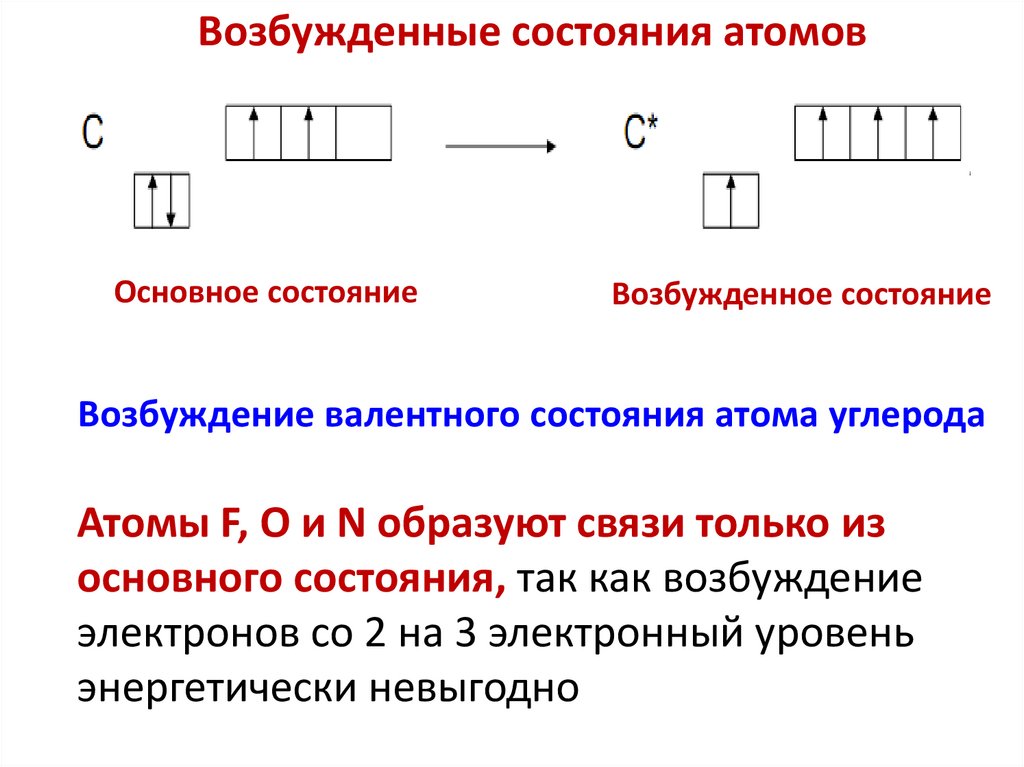
Возбужденные состояния атомовОбразование ковалентных связей возможно из
основного или возбужденного состояния атомов.
Возбужденные состояния атомов образуются из
основного состояния при переходе одного или
нескольких электронов с занятых орбиталей на
свободные атомные орбитали с большей энергией.
Возбуждение атома в процессе образования связей
возможно в пределах одного уровня, если затраченная
энергия компенсируется энергией которая выделяется
при образовании дополнительных ковалентных связей.
55.
Возбужденные состояния атомовОсновное состояние
Возбужденное состояние
Возбуждение валентного состояния атома углерода
Атомы F, O и N образуют связи только из
основного состояния, так как возбуждение
электронов со 2 на 3 электронный уровень
энергетически невыгодно
56.
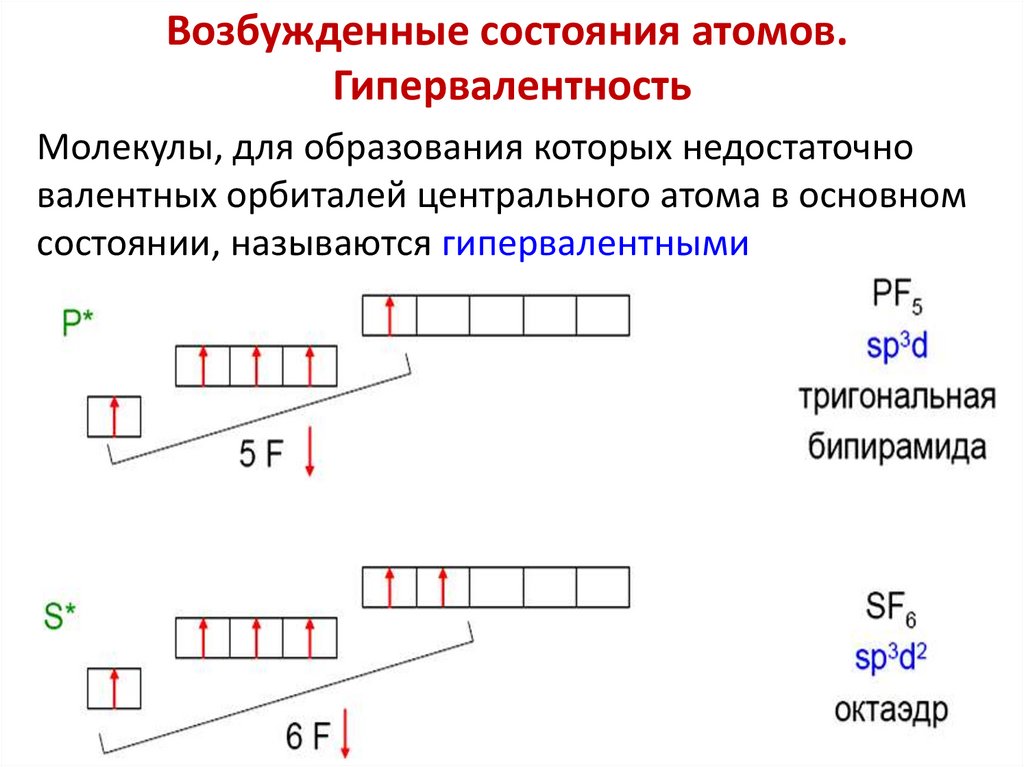
Возбужденные состояния атомов.Гипервалентность
Молекулы, для образования которых недостаточно
валентных орбиталей центрального атома в основном
состоянии, называются гипервалентными
57.
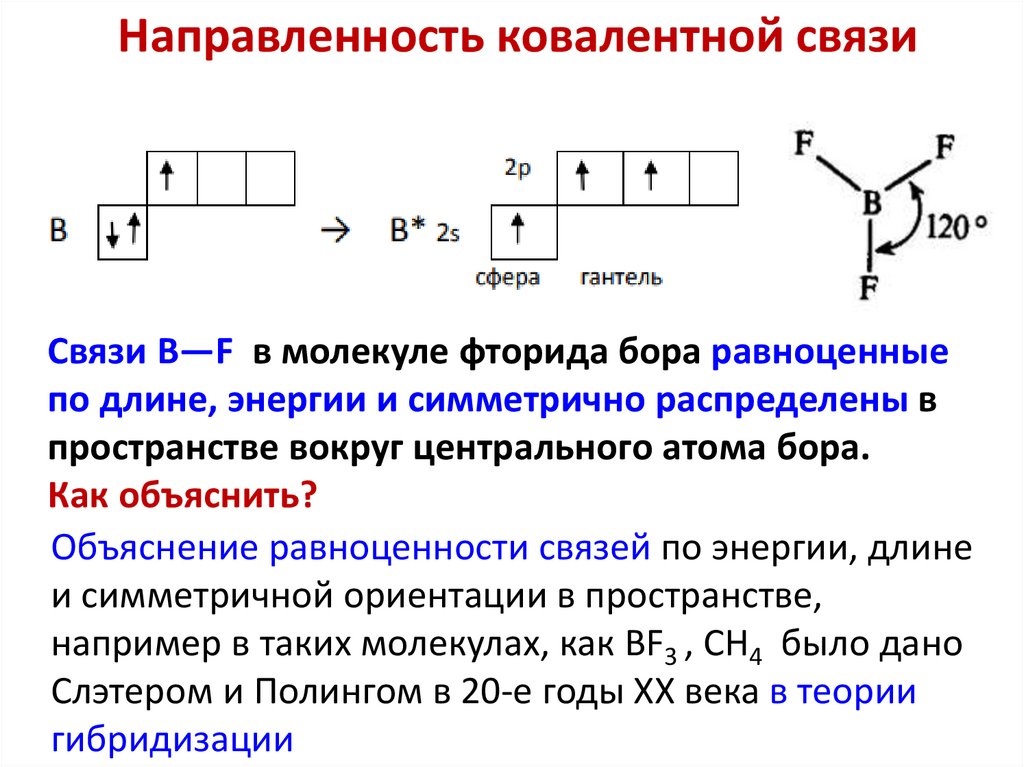
Направленность ковалентной связиНаправленность ковалентной связи обусловлена
перекрыванием электронных облаков так, чтобы
максимальная электронная плотность отрицательного
заряда была между ядрами атомов
-определяется направленностью в пространстве атомных
орбиталей
-Атомные орбитали px, py и pz расположены под углами 900
-Атомные d- орбитали: лепестки образуют угол 900, а между
различными d- АО могут быть углы 1800; 900
24p4
Se
…4s
1
H 1s
Угловая молекула
Угол(теорет) HSeH =900
Угол(экспер) HSeH =910
58.
Направленность ковалентной связиСвязи B—F в молекуле фторида бора равноценные
по длине, энергии и симметрично распределены в
пространстве вокруг центрального атома бора.
Как объяснить?
Объяснение равноценности связей по энергии, длине
и симметричной ориентации в пространстве,
например в таких молекулах, как BF3 , CH4 было дано
Слэтером и Полингом в 20-е годы XX века в теории
гибридизации
59.
Теория гибридизацииПонятие гибридизации является теоретическим и было
обосновано расчетами, введено Лайнусом Полингом в 20-е
годы XX века для объяснения равноценности связей по энергии,
длине и симметричной ориентации в пространстве, например в
таких молекулах, как BF3, CH4
Различные орбитали, не сильно отличающиеся энергиями,
образуют соответствующее число гибридных орбиталей. Число
гибридных орбиталей равно числу атомных орбиталей,
участвующих в гибридизации. Гибридные орбитали одинаковы
по форме электронного облака и по энергии. По сравнению с
атомными орбиталями они более вытянуты в направлении
образования химических связей и поэтому обуславливают
лучшее перекрывание электронных облаков и образование
более прочных связей.
60.
Теория гибридизацииГибридизация - выравнивание исходных электронных
облаков (атомных орбиталей) по форме и энергии в
процессе образования ковалентных связей
Форма гибридных
орбиталей
Из исходных атомных орбиталей
центрального атома, различающихся
по энергии, форме образуется то же
число атомных орбиталей одинаковых
по энергии, форме и симметрично
расположенных в пространстве вокруг
ядра
61.
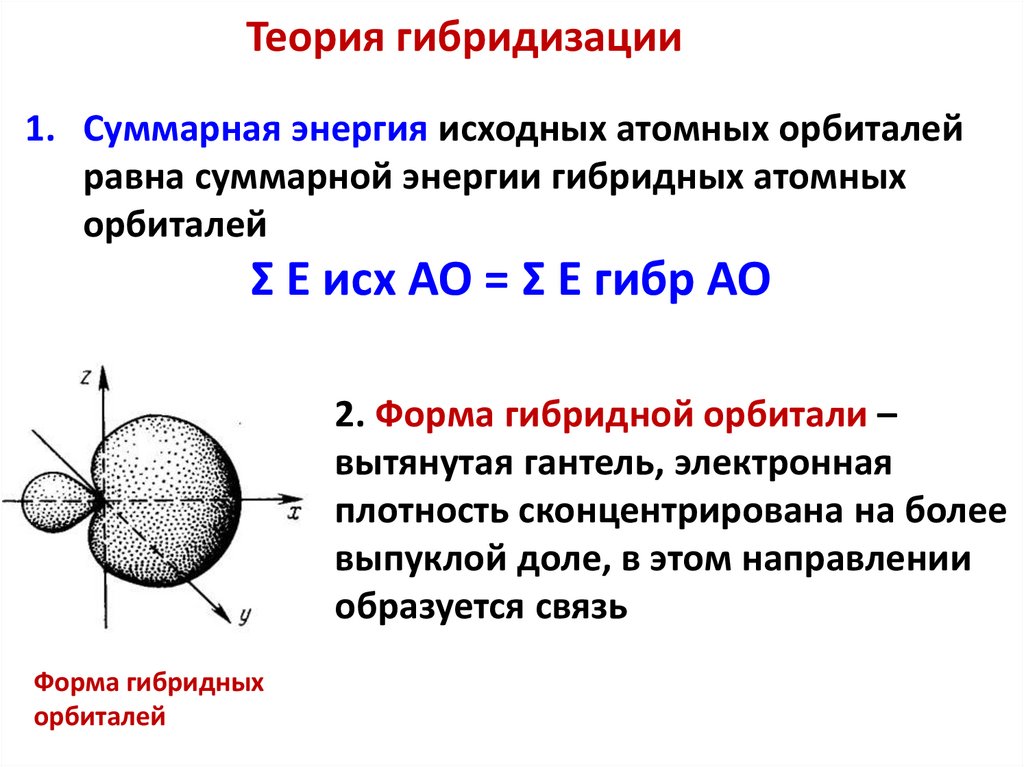
Теория гибридизации1. Суммарная энергия исходных атомных орбиталей
равна суммарной энергии гибридных атомных
орбиталей
Σ Е исх АО = Σ Е гибр АО
2. Форма гибридной орбитали –
вытянутая гантель, электронная
плотность сконцентрирована на более
выпуклой доле, в этом направлении
образуется связь
Форма гибридных
орбиталей
62.
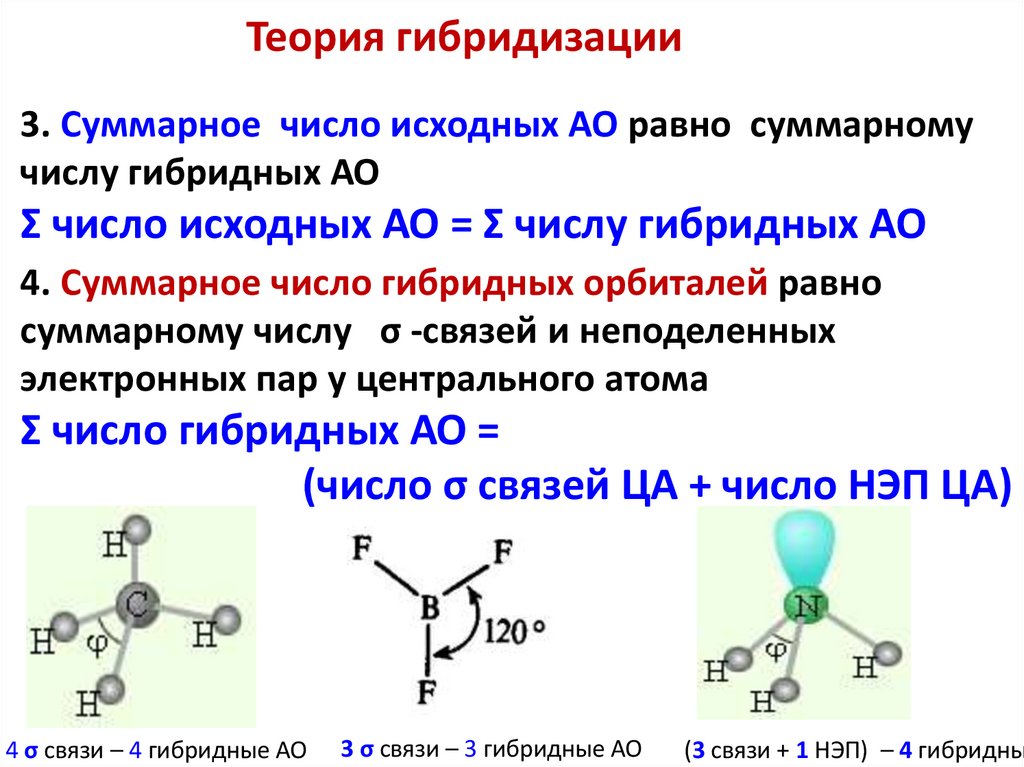
Теория гибридизации3. Суммарное число исходных АО равно суммарному
числу гибридных АО
Σ число исходных АО = Σ числу гибридных АО
4. Суммарное число гибридных орбиталей равно
суммарному числу σ -связей и неподеленных
электронных пар у центрального атома
Σ число гибридных АО =
(число σ связей ЦА + число НЭП ЦА)
4 σ связи – 4 гибридные АО
3 σ связи – 3 гибридные АО
(3 связи + 1 НЭП) – 4 гибридны
63.
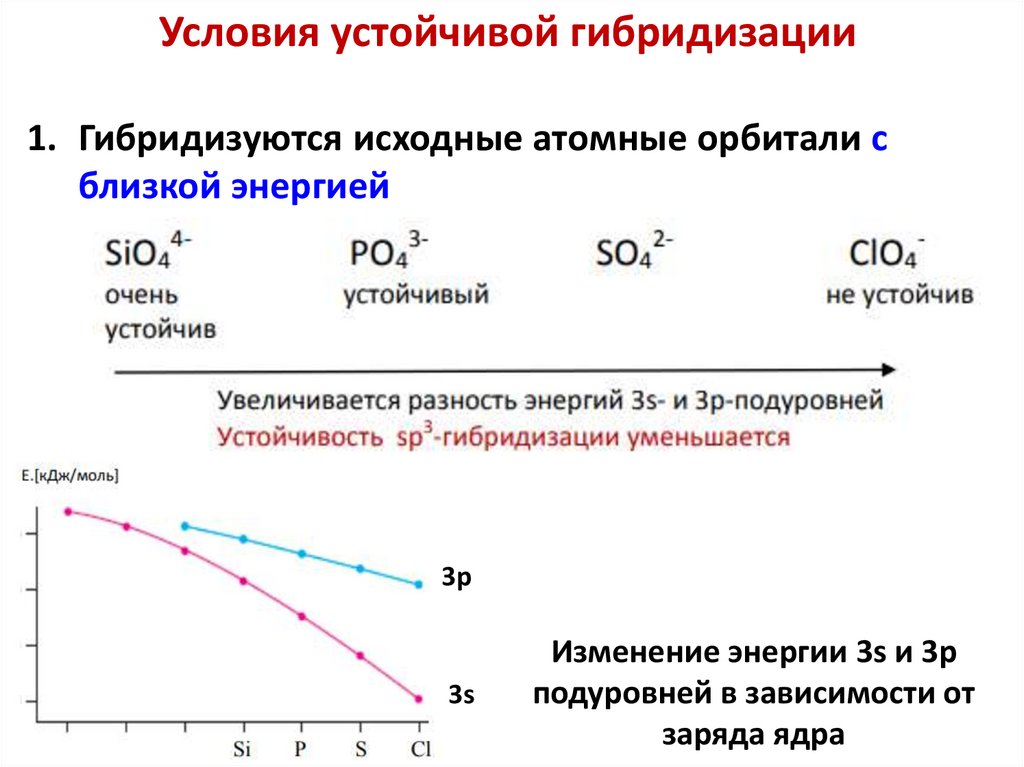
Условия устойчивой гибридизации1. Гибридизуются исходные атомные орбитали с
близкой энергией
3p
3s
Изменение энергии 3s и 3p
подуровней в зависимости от
заряда ядра
64.
Условия устойчивой гибридизации2. Высокая электронная плотность исходных атомных
орбиталей центрального атома
3. Высокая степень перекрывания гибридных
орбиталей с орбиталями соседних атомов, в
результате образуются более прочные связи, чем
связи с исходными атомными орбиталями
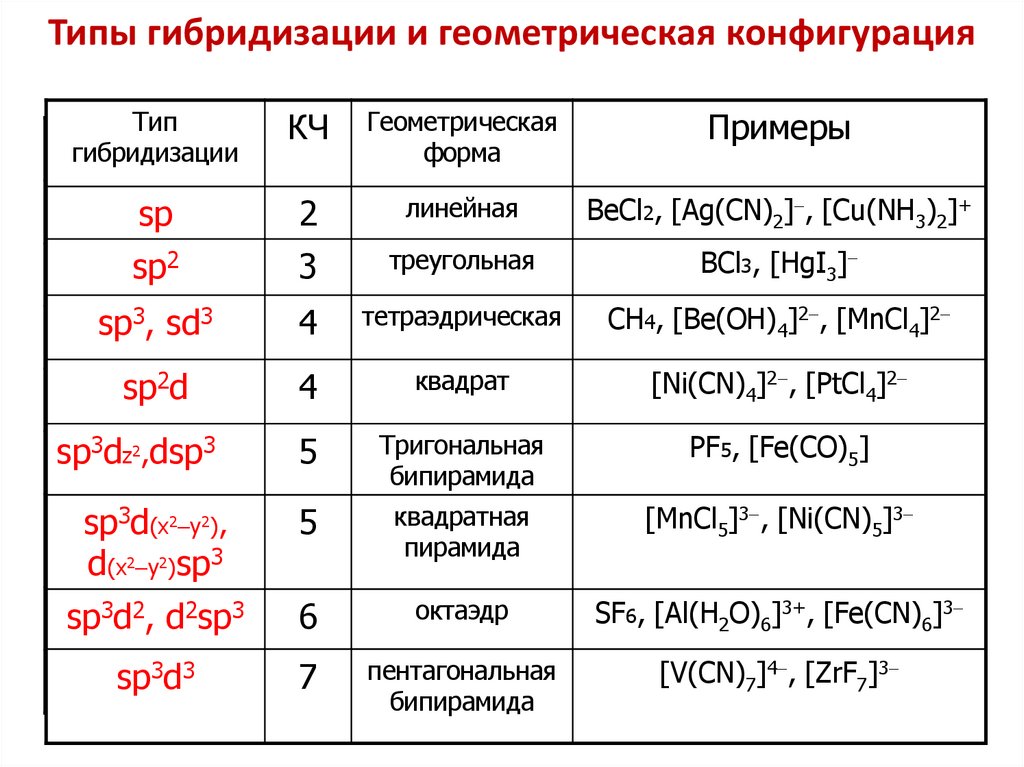
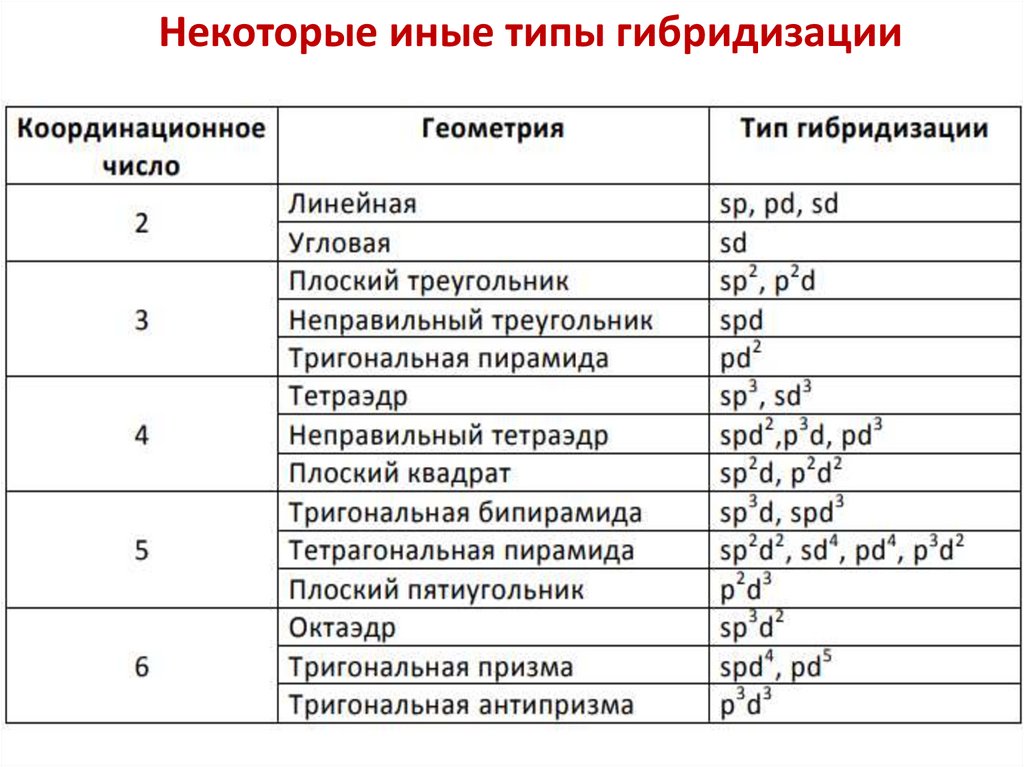
65. Типы гибридизации и геометрическая конфигурация
Типгибридизации
КЧ
Геометрическая
форма
Примеры
sp
2
линейная
BeCl2, [Ag(CN)2]-, [Cu(NH3)2]+
sp2
3
треугольная
BCl3, [HgI3]-
sp3, sd3
4
тетраэдрическая
CH4, [Be(OH)4]2-, [MnCl4]2-
sp2d
4
квадрат
[Ni(CN)4]2-, [PtCl4]2-
sp3dz2,dsp3
5
Тригональная
бипирамида
PF5, [Fe(CO)5]
sp3d(x2-y2),
d(x2-y2)sp3
5
квадратная
пирамида
[MnCl5]3-, [Ni(CN)5]3-
sp3d2, d2sp3
6
октаэдр
SF6, [Al(H2O)6]3+, [Fe(CN)6]3-
sp3d3
7
пентагональная
бипирамида
[V(CN)7]4-, [ZrF7]3-
66.
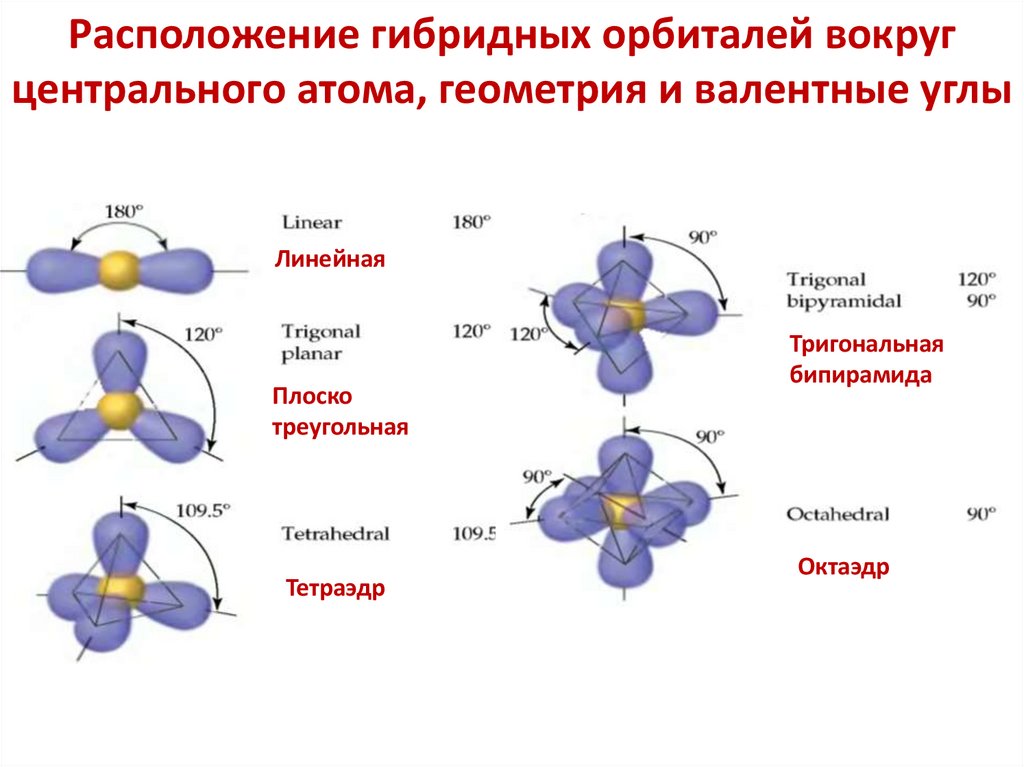
Расположение гибридных орбиталей вокругцентрального атома, геометрия и валентные углы
Линейная
Плоско
треугольная
Тетраэдр
Тригональная
бипирамида
Октаэдр
67.
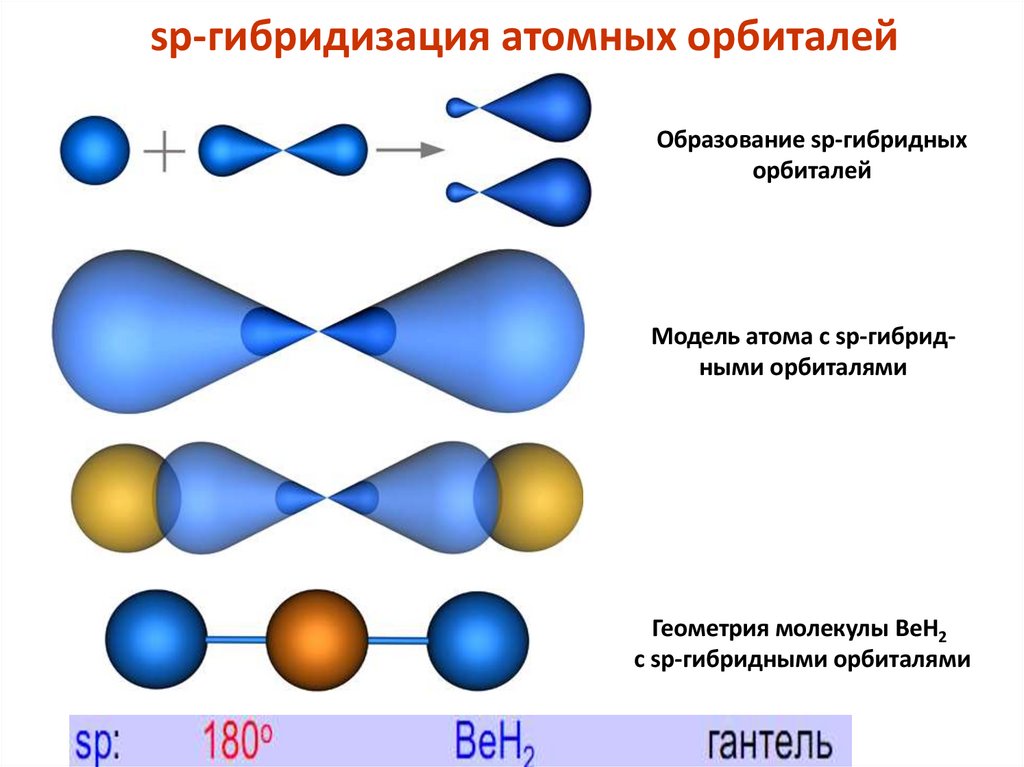
sp-гибридизация атомных орбиталейОбразование sp-гибридных
орбиталей
Модель атома с sp-гибридными орбиталями
Геометрия молекулы BeH2
с sp-гибридными орбиталями
68.
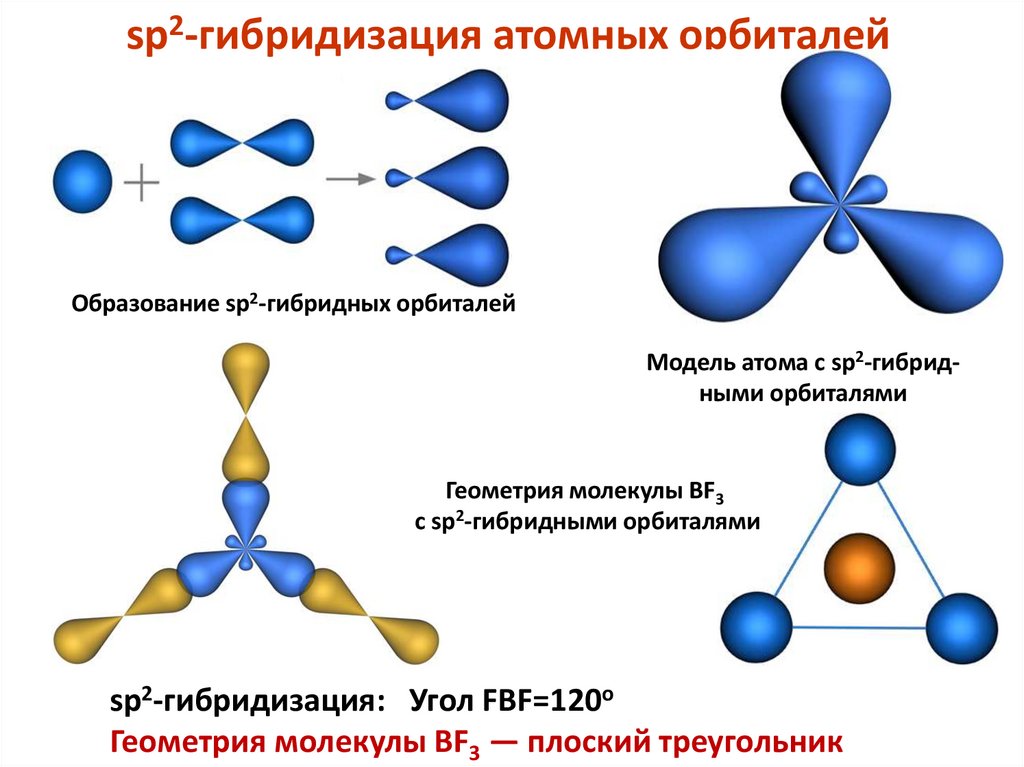
sp2-гибридизация атомных орбиталейОбразование sp2-гибридных орбиталей
Модель атома с sp2-гибридными орбиталями
Геометрия молекулы BF3
с sp2-гибридными орбиталями
sp2-гибридизация: Угол FBF=120o
Геометрия молекулы BF3 — плоский треугольник
69.
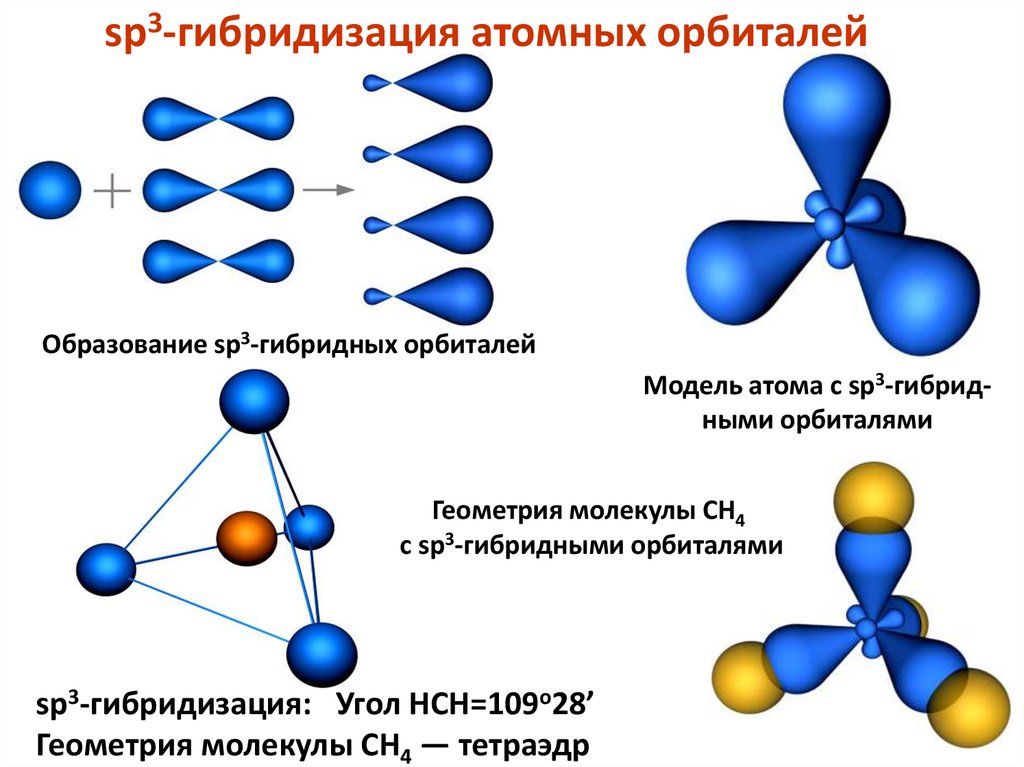
sp3-гибридизация атомных орбиталейОбразование sp3-гибридных орбиталей
Модель атома с sp3-гибридными орбиталями
Геометрия молекулы CH4
с sp3-гибридными орбиталями
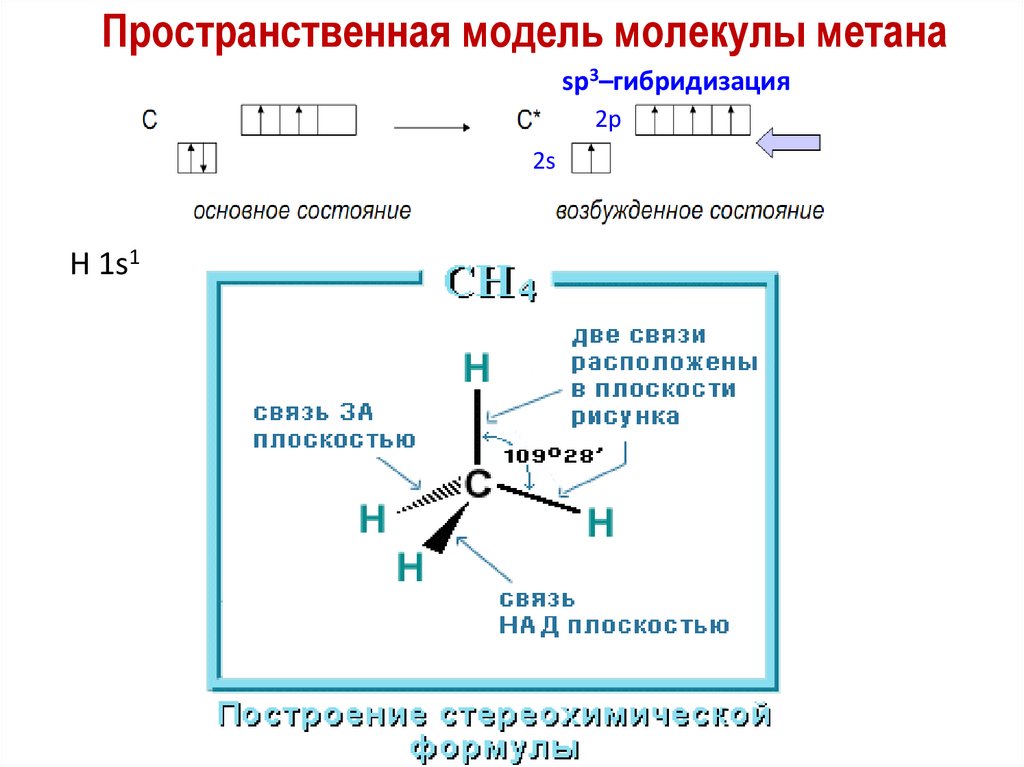
sp3-гибридизация: Угол HCH=109o28’
Геометрия молекулы CH4 — тетраэдр
69
70.
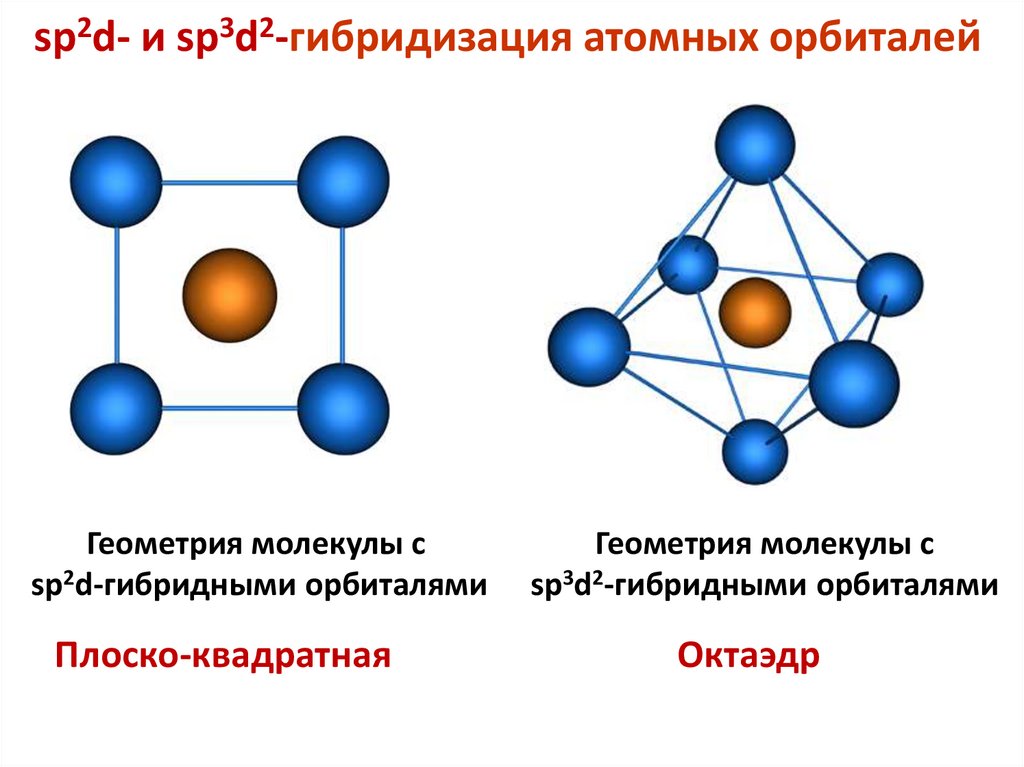
sp2d- и sp3d2-гибридизация атомных орбиталейГеометрия молекулы c
sp2d-гибридными орбиталями
Плоско-квадратная
Геометрия молекулы с
sp3d2-гибридными орбиталями
Октаэдр
71.
Теория гибридизацииВ гибридизации могут участвовать не только s- и pорбитали, но s-, p- и d орбитали и, например, s- и dорбитали без p-орбиталей или только p- и d-орбитали.
Теория гибридизации с участием f-орбиталей не
разработана.
Прочность связей увеличивается в ряду:
p < sp3 < sp2 < sp.
Возрастанию прочности связей способствует включение
в гибридизацию d-орбиталей.
72.
Некоторые иные типы гибридизации73.
Геометрия молекулыГеометрия молекулы определяется расстояниями
между связанными атомами, а также углами
между направлениями химических связей
Взаимное расположение атомов в молекуле может
быть определено экспериментально.
Можно предположить какую геометрию имеет
молекула (молекулярный ион), определив тип
гибридизации атомных орбиталей центрального
атома.
74.
Пространственная модель молекулы метанаsp3–гибридизация
2p
2s
H 1s1
75.
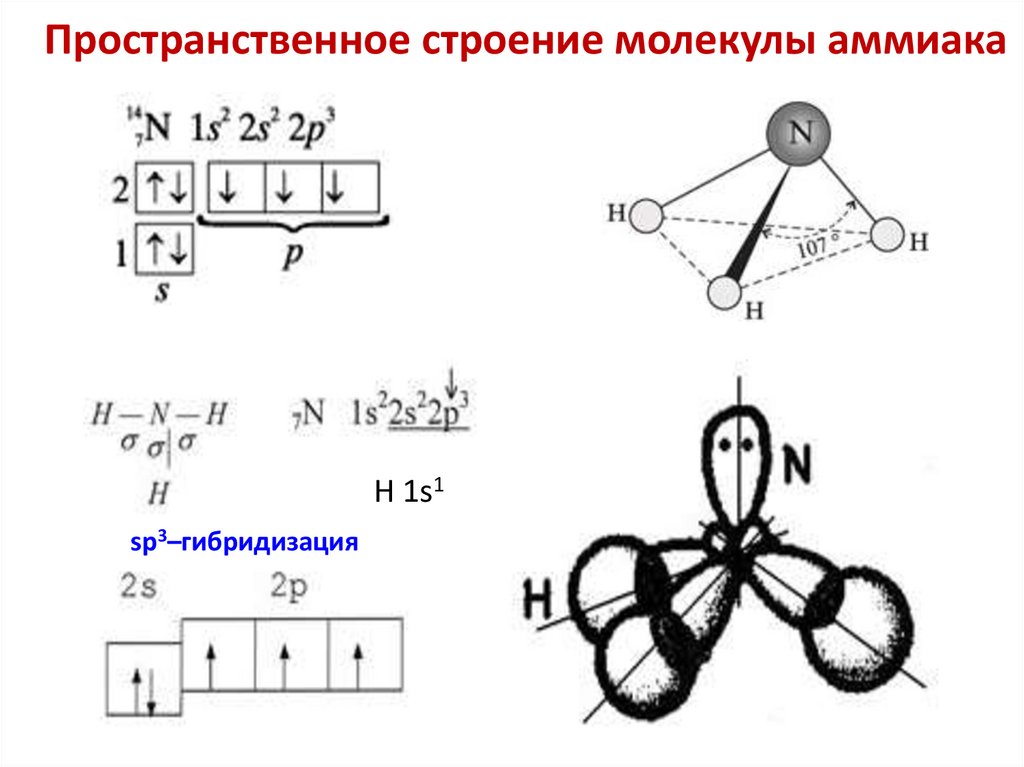
Пространственное строение молекулы аммиакаH 1s1
sp3–гибридизация
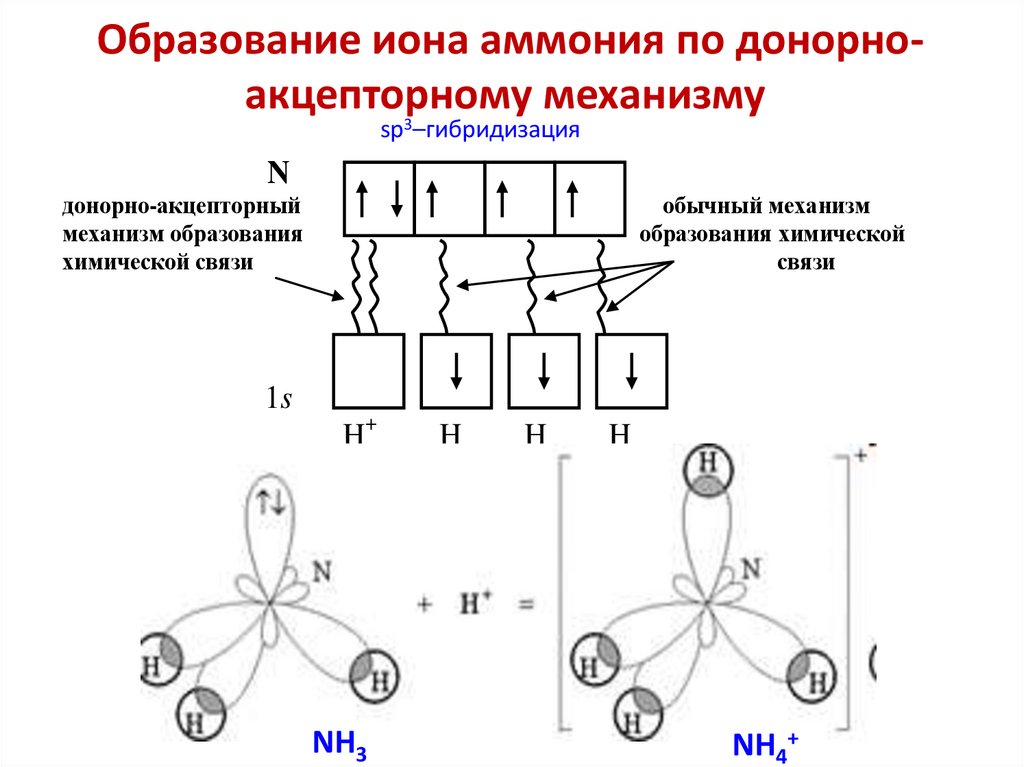
76. Образование иона аммония по донорно-акцепторному механизму
Образование иона аммония по донорноакцепторному механизмуsp3–гибридизация
N
донорно-акцепторный
механизм образования
химической связи
обычный механизм
образования химической
связи
1s
H+
NH3
H
H
H
NH4+
77.
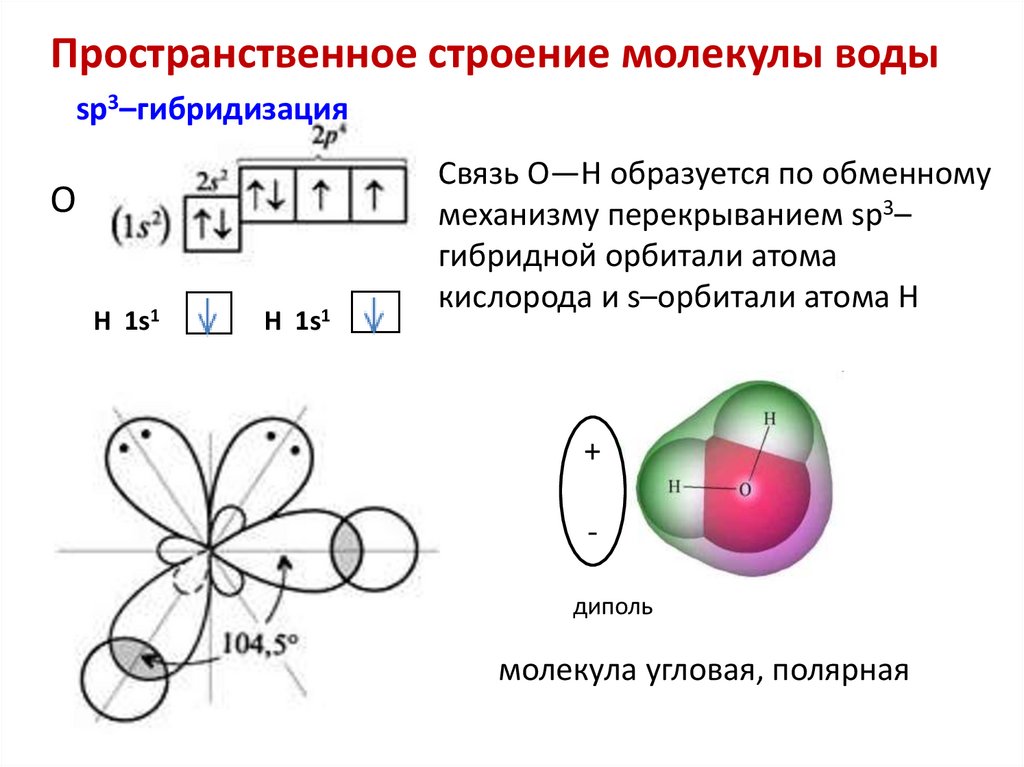
Пространственное строение молекулы водыsp3–гибридизация
O
H 1s1
H 1s1
Связь O—H образуется по обменному
механизму перекрыванием sp3–
гибридной орбитали атома
кислорода и s–орбитали атома H
+
диполь
молекула угловая, полярная
78.
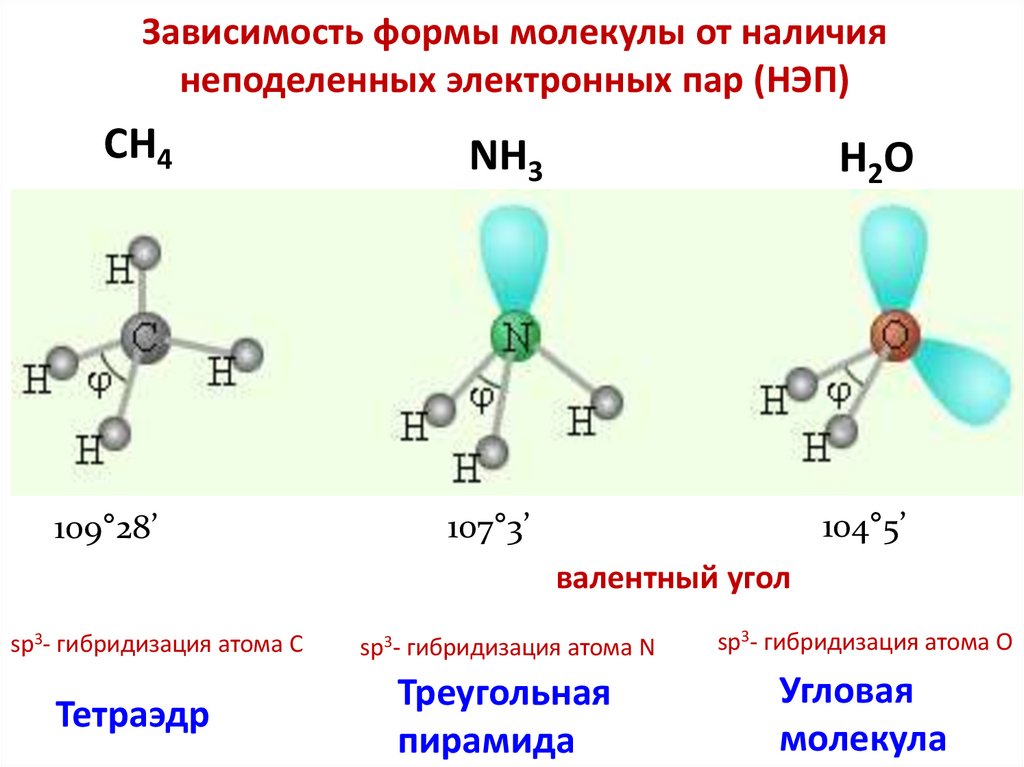
Зависимость формы молекулы от наличиянеподеленных электронных пар (НЭП)
CH4
NH3
H2O
109°28’
107°3’
104°5’
валентный угол
sp3- гибридизация атома C
Тетраэдр
sp3- гибридизация атома N
sp3- гибридизация атома O
Треугольная
пирамида
Угловая
молекула
79.
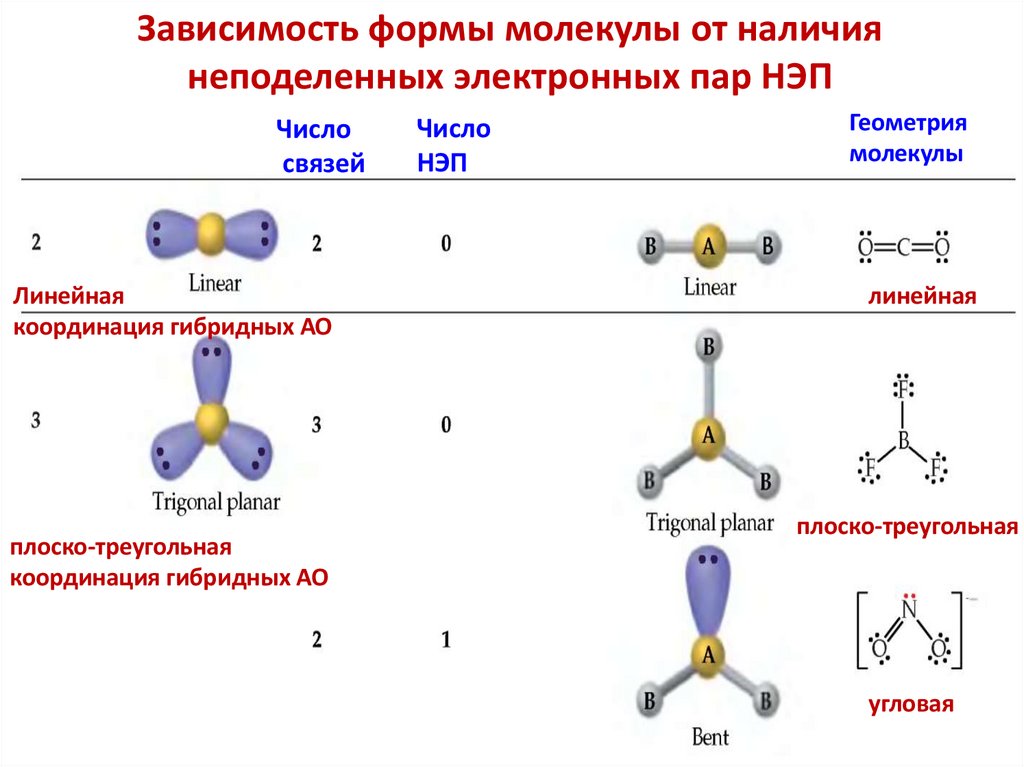
Зависимость формы молекулы от наличиянеподеленных электронных пар НЭП
Число
связей
Линейная
координация гибридных АО
плоско-треугольная
координация гибридных АО
Число
НЭП
Геометрия
молекулы
линейная
плоско-треугольная
угловая
80.
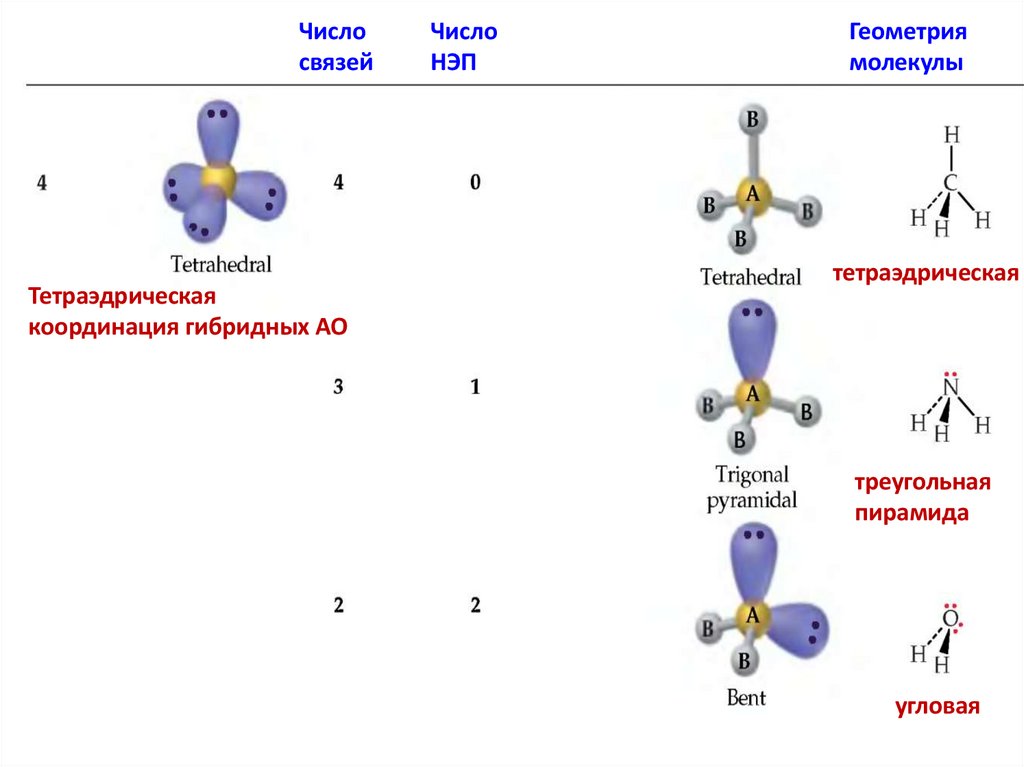
Числосвязей
Тетраэдрическая
координация гибридных АО
Число
НЭП
Геометрия
молекулы
тетраэдрическая
треугольная
пирамида
угловая
81.
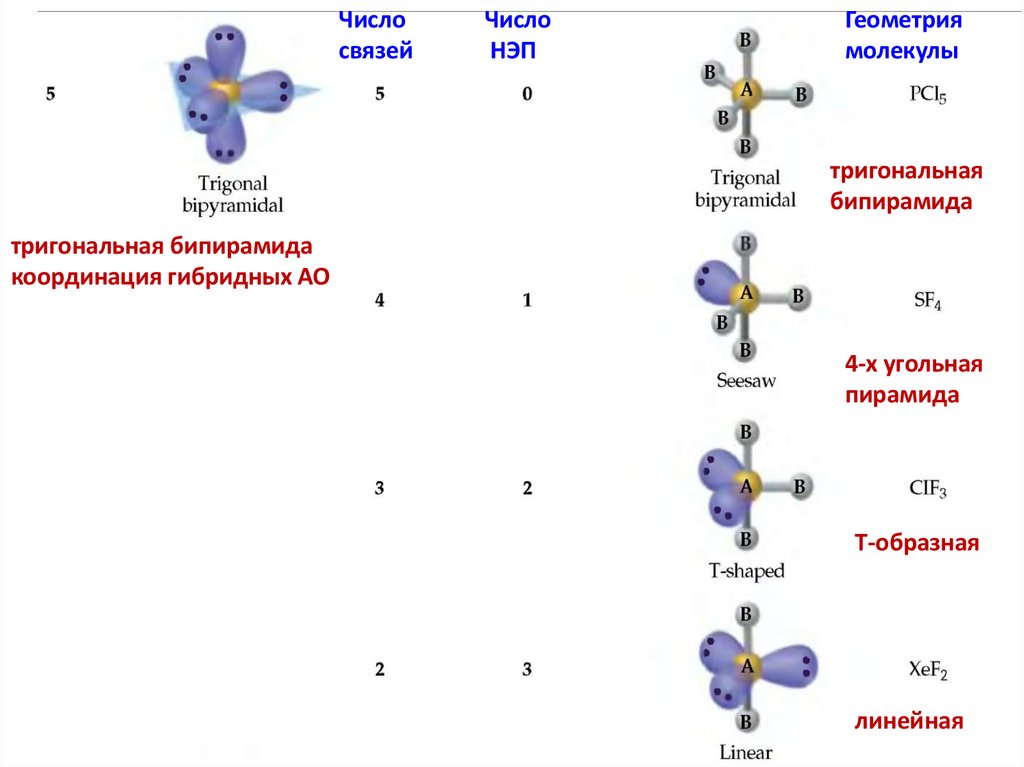
Числосвязей
Число
НЭП
Геометрия
молекулы
тригональная
бипирамида
тригональная бипирамида
координация гибридных АО
4-х угольная
пирамида
Т-образная
линейная
82.
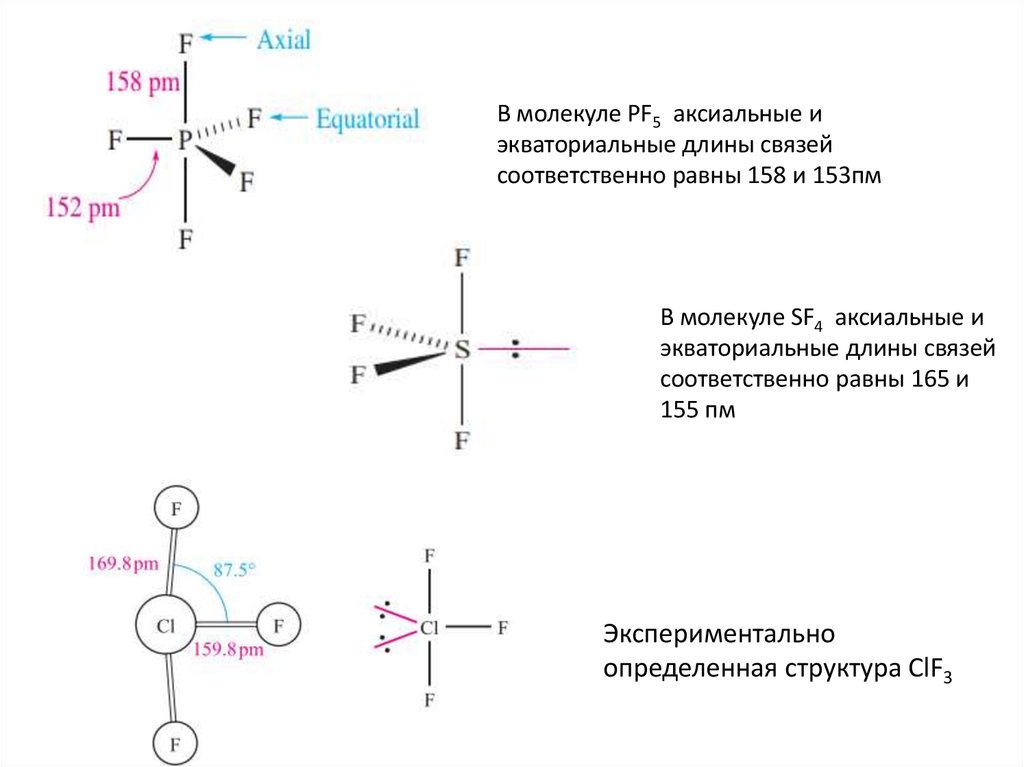
В молекуле PF5 аксиальные иэкваториальные длины связей
соответственно равны 158 и 153пм
В молекуле SF4 аксиальные и
экваториальные длины связей
соответственно равны 165 и
155 пм
Экспериментально
определенная структура ClF3
83.
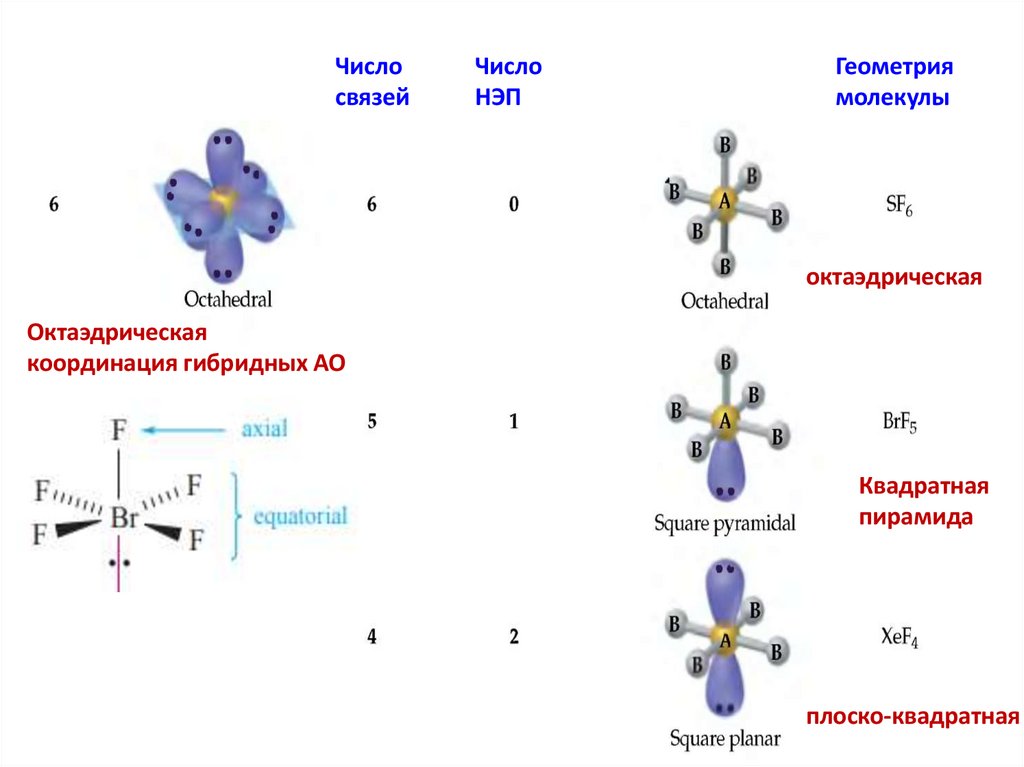
Числосвязей
Число
НЭП
Геометрия
молекулы
октаэдрическая
Октаэдрическая
координация гибридных АО
Квадратная
пирамида
плоско-квадратная
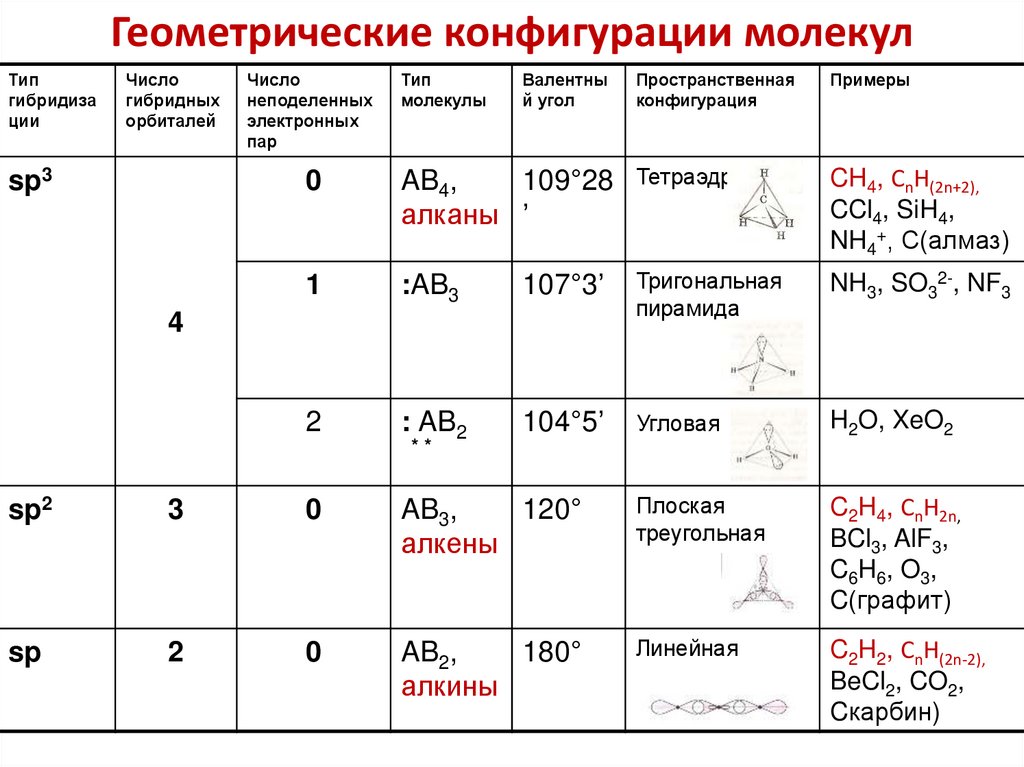
84. Геометрические конфигурации молекул
Типгибридиза
ции
Число
гибридных
орбиталей
sp3
Число
неподеленных
электронных
пар
Тип
молекулы
Валентны
й угол
Пространственная
конфигурация
Примеры
0
AB4,
109°28
алканы ’
Тетраэдр
CH4, CnH(2n+2),
CCl4, SiH4,
NH4+, С(алмаз)
1
:AB3
107°3’
Тригональная
пирамида
NH3, SO32-, NF3
2
: AB2
104°5’
Угловая
H2O, XeO2
4
**
sp2
3
0
AB3,
120°
алкены
Плоская
треугольная
C2H4, CnH2n,
BCl3, AlF3,
C6H6, O3,
C(графит)
sp
2
0
AB2,
180°
алкины
Линейная
C2H2, CnH(2n-2),
BeCl2, CO2,
Cкарбин)
85.
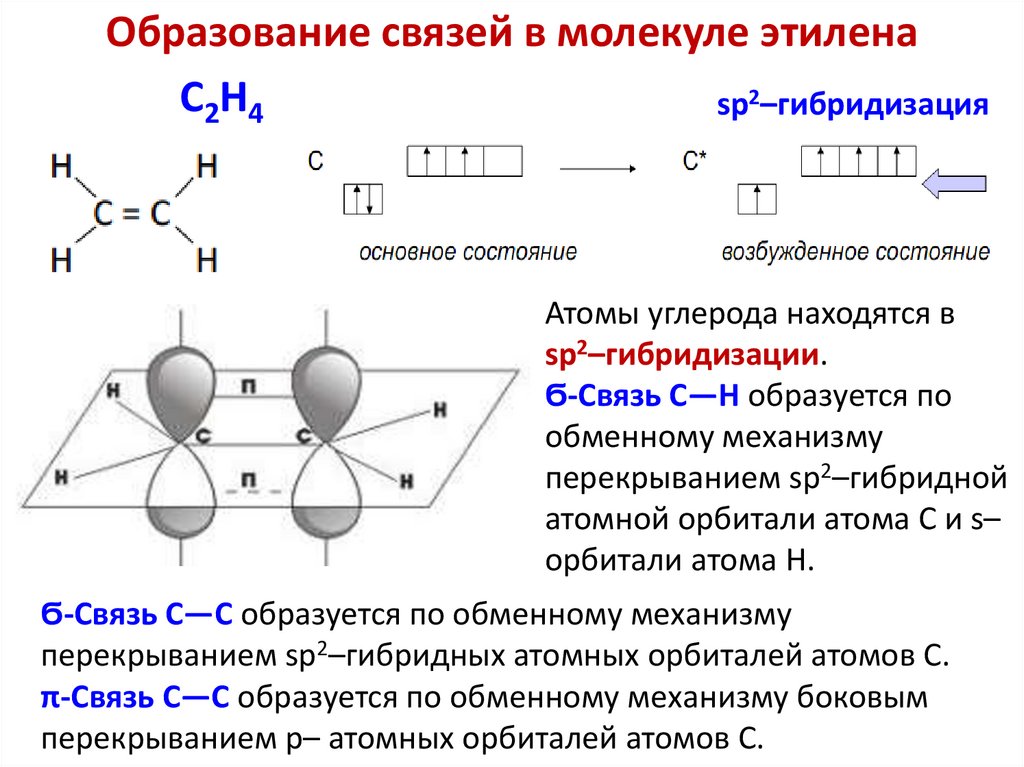
Образование связей в молекуле этиленаC2H4
sp2–гибридизация
Атомы углерода находятся в
sp2–гибридизации.
Ϭ-Связь C—H образуется по
обменному механизму
перекрыванием sp2–гибридной
атомной орбитали атома C и s–
орбитали атома H.
Ϭ-Связь C—C образуется по обменному механизму
перекрыванием sp2–гибридных атомных орбиталей атомов C.
π-Связь C—C образуется по обменному механизму боковым
перекрыванием p– атомных орбиталей атомов C.
86.
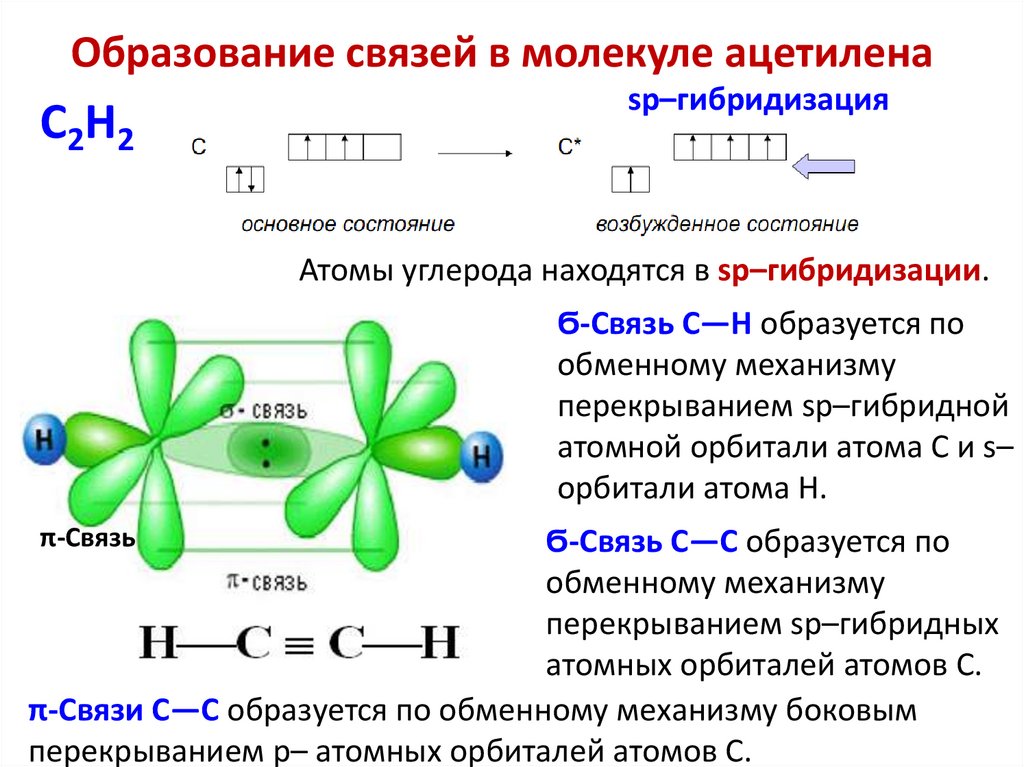
Образование связей в молекуле ацетиленаC2H2
sp–гибридизация
Атомы углерода находятся в sp–гибридизации.
Ϭ-Связь C—H образуется по
обменному механизму
перекрыванием sp–гибридной
атомной орбитали атома C и s–
орбитали атома H.
π-Связь
Ϭ-Связь C—C образуется по
обменному механизму
перекрыванием sp–гибридных
атомных орбиталей атомов C.
π-Связи C—C образуется по обменному механизму боковым
перекрыванием p– атомных орбиталей атомов C.
87. Делокализованные -связи (резонансные структуры)
Делокализованные -связи(резонансные структуры)
Ковалентная связь считается локализованной, если ее
электронная пара находится в поле двух ядер и связывает
только два атома (2е-2с): 2-х электронная – 2-х центровая
связь.
Делокализованная связь - связь, в которой электронная
пара принадлежит нескольким (более 2-х) ядрам атомов
Делокализация электронов (распределение электронов
между несколькими взаимодействующими ядрами)
характерна для сопряженных -связей, т.е. кратных
связей, чередующихся с одинарными.
Например: H2C=CH—CH=CH2—CH3 (пентадиен-1,3)
88.
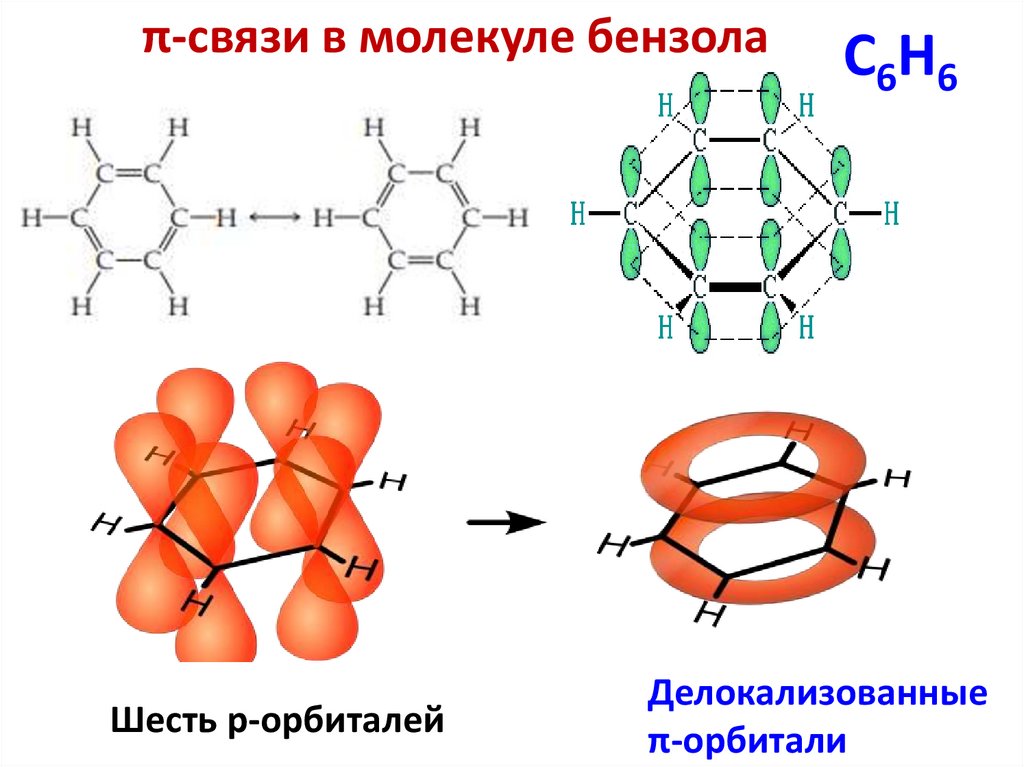
π-связи в молекуле бензолаШесть р-орбиталей
C6H6
Делокализованные
π-орбитали
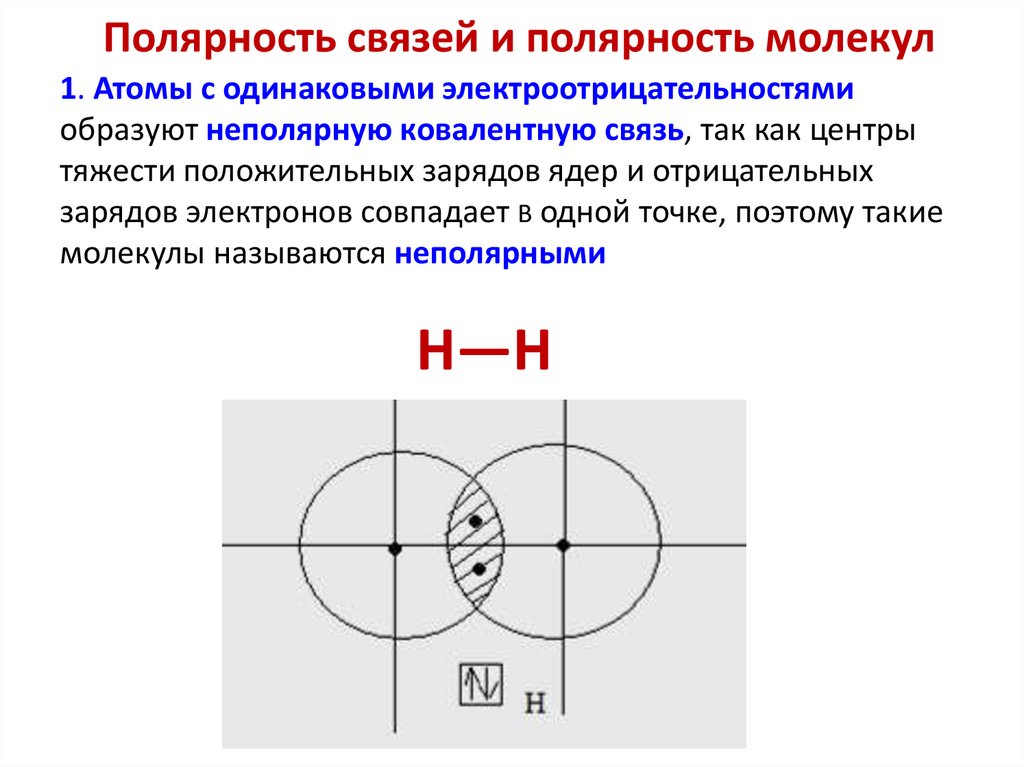
89.
Полярность связей и полярность молекул1. Атомы с одинаковыми электроотрицательностями
образуют неполярную ковалентную связь, так как центры
тяжести положительных зарядов ядер и отрицательных
зарядов электронов совпадает В одной точке, поэтому такие
молекулы называются неполярными
H—H
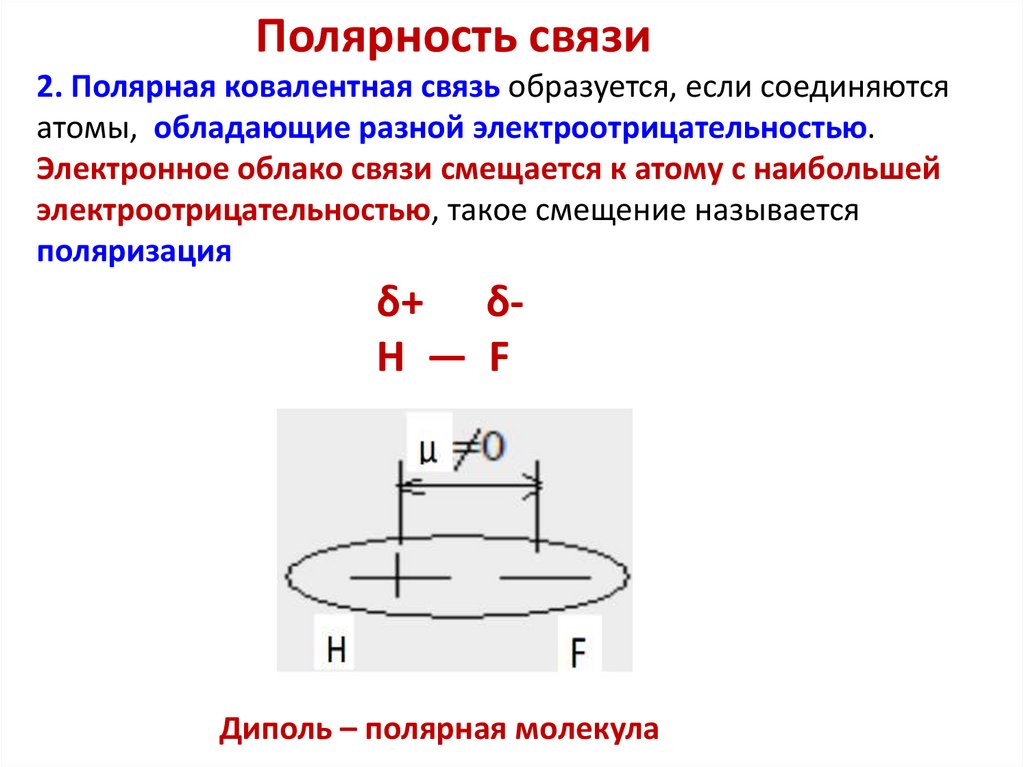
90.
Полярность связи2. Полярная ковалентная связь образуется, если соединяются
атомы, обладающие разной электроотрицательностью.
Электронное облако связи смещается к атому с наибольшей
электроотрицательностью, такое смещение называется
поляризация
δ+ δH — F
Диполь – полярная молекула
91.
Полярность связи• Количественная характеристика полярности связи • электрический дипольный момент μ (мю):
μ = q lдип, [Кл м или Дебай]
где q = 1,66∙10-33 [Кл] - абсолютное значение заряда
электрона;
lдип – длина диполя [м]- расстояние между центрами
«+» и «-» зарядов
1 Дебай (D) равен: 1D = 3,33.10-30 Кл м
Электрический дипольный момент – векторная
величина, направленная от (-) к (+)
Различают электрические дипольные моменты
химической связи и молекулы.
92.
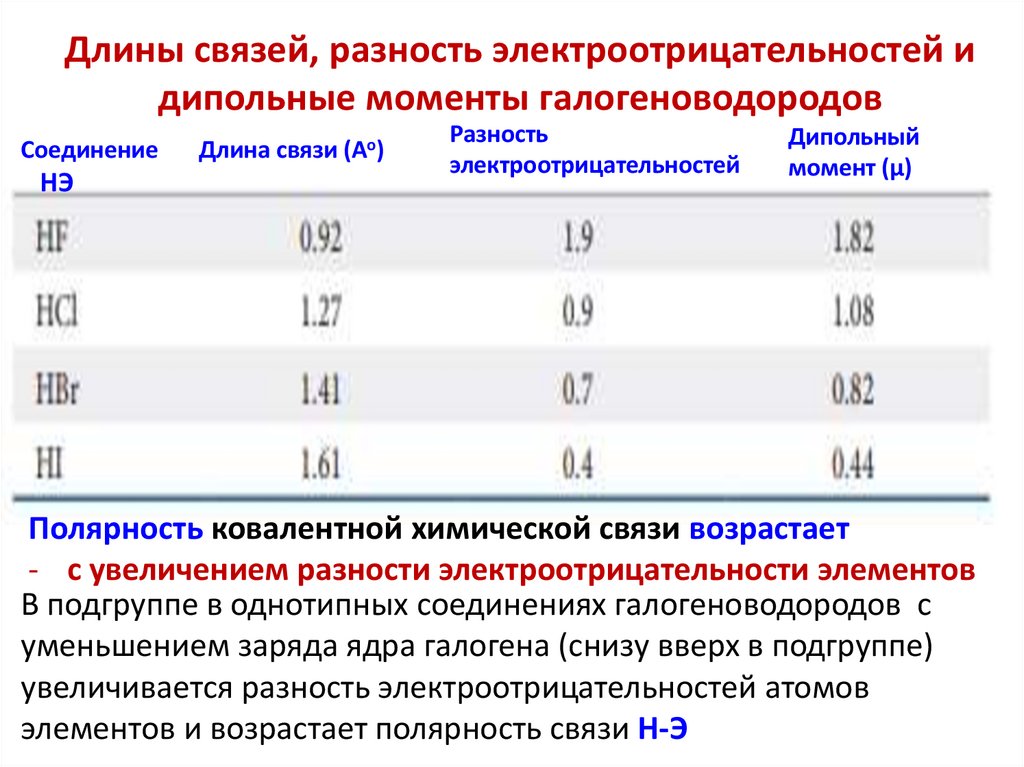
Длины связей, разность электроотрицательностей идипольные моменты галогеноводородов
Соединение
HЭ
Длина связи (Ао)
Разность
электроотрицательностей
Дипольный
момент (µ)
Полярность ковалентной химической связи возрастает
- с увеличением разности электроотрицательности элементов
В подгруппе в однотипных соединениях галогеноводородов с
уменьшением заряда ядра галогена (снизу вверх в подгруппе)
увеличивается разность электроотрицательностей атомов
элементов и возрастает полярность связи Н-Э
93.
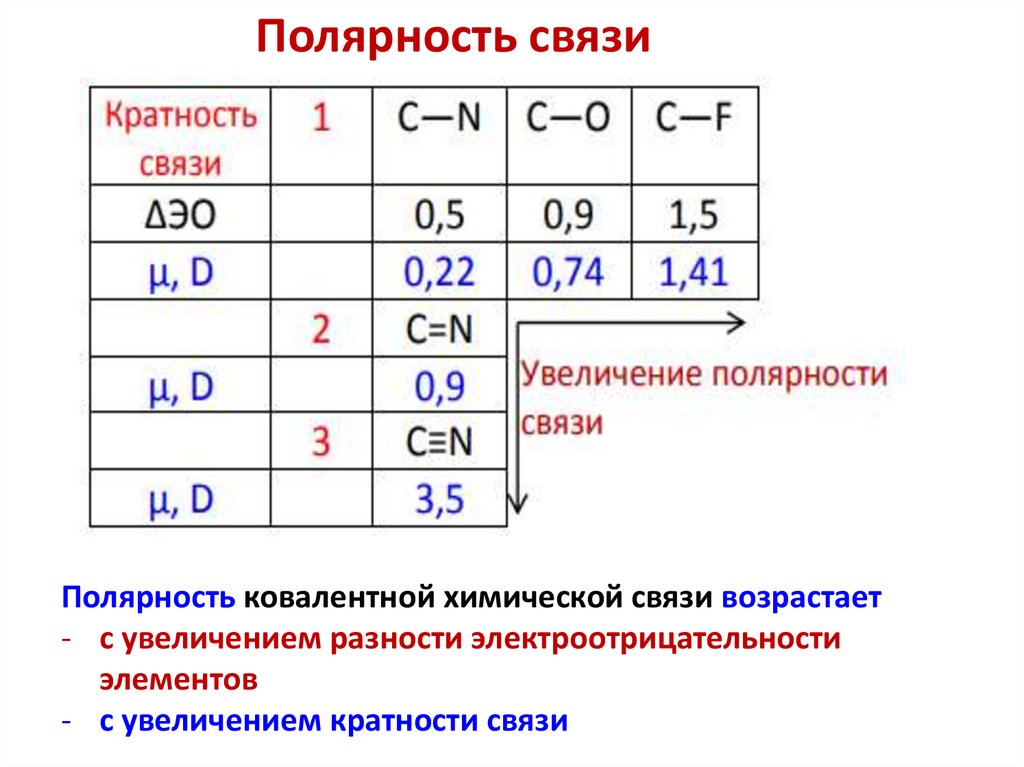
Полярность связиПолярность ковалентной химической связи возрастает
- с увеличением разности электроотрицательности
элементов
- с увеличением кратности связи
94.
Полярность молекулыЭлектрический дипольный момент многоатомной
молекулы — векторная сумма дипольных моментов
связей
μмол. = μсвязи
Полярность молекулы определяется двумя факторами:
1. Полярностями связей
2. Геометрией молекулы
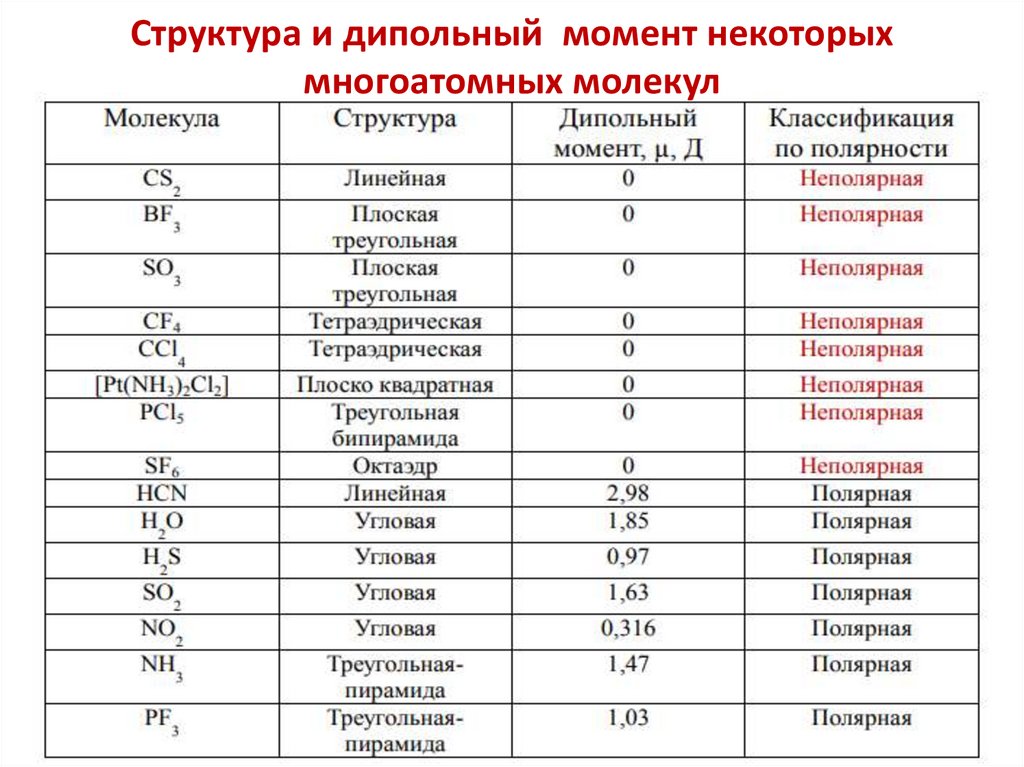
Молекула неполярна, если
а) все связи неполярны,
б) одинаковые атомы расположены вокруг центрального
симметрично, так что дипольные моменты связей взаимно
компенсированы , векторная сумма дипольных моментов
связей равна нулю: μмол. = μсвязи = 0.
Молекулы, имеющие форму линейную, плоско-треугольную,
тетраэдрическую, плоско-квадратную, тригональной
бипирамиды, октаэдра - неполярны.
95.
Полярность молекулыЭлектрический дипольный момент многоатомной
молекулы — векторная сумма дипольных моментов
связей
μмол. = μсвязи
Полярность молекулы определяется двумя факторами:
1. Полярностями связей
2. Геометрией молекулы
Молекула полярна, если в ней присутствуют полярные
связи и молекула имеет несимметричное строение,
векторная сумма дипольных моментов связей
больше нуля.
μмол. = μсвязи > 0
96. Геометрическая форма молекул. Полярность молекул
CH4NH3
H2O
Неполярная молекула
Полярная молекула
Полярная молекула
Полярная молекула
Неполярная молекула
97.
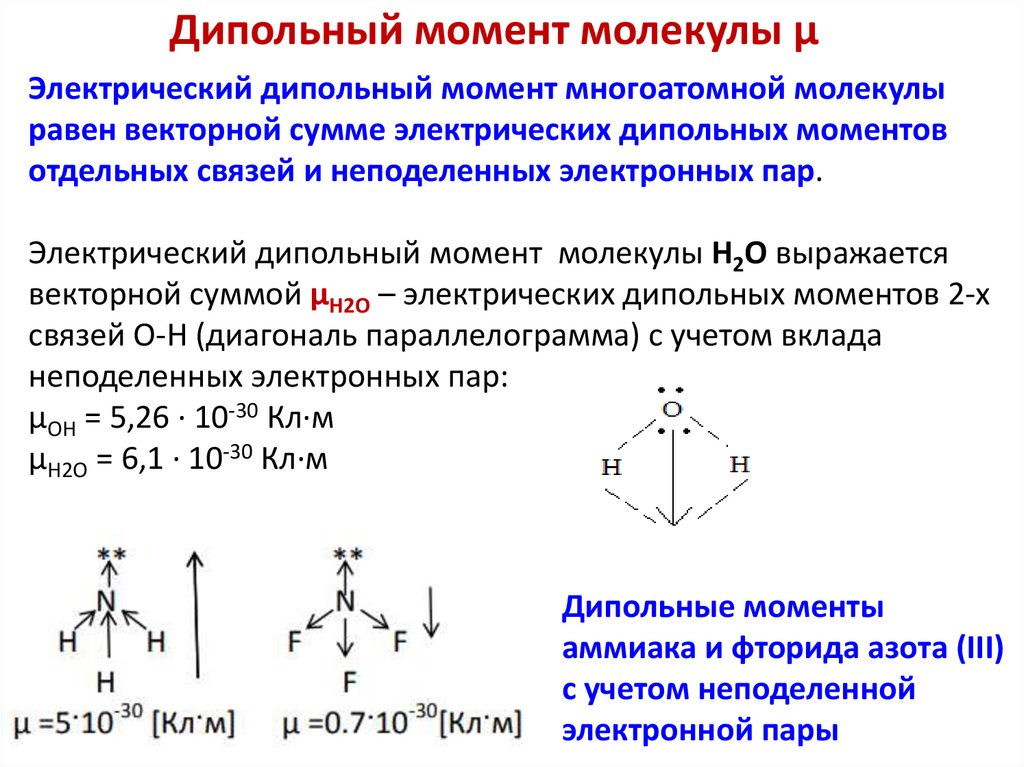
Дипольный момент молекулы μЭлектрический дипольный момент многоатомной молекулы
равен векторной сумме электрических дипольных моментов
отдельных связей и неподеленных электронных пар.
Электрический дипольный момент молекулы H2O выражается
векторной суммой μH2O – электрических дипольных моментов 2-х
связей О-Н (диагональ параллелограмма) с учетом вклада
неподеленных электронных пар:
μOH = 5,26 ∙ 10-30 Кл∙м
μH2O = 6,1 ∙ 10-30 Кл∙м
Дипольные моменты
аммиака и фторида азота (III)
с учетом неподеленной
электронной пары
98.
Дипольный момент молекулы μДипольный момент 2-х атомной молекулы
совпадает с дипольным моментом связи
молекулы, например, СО
CO – оксид углерода(II)
Структурная формула C≡O
ЭОо = 3,5; ЭОс = 2,5
С←О направление смещения общего электронного облака от
кислорода к углероду
μCO = 0,4∙10-30 Кл∙м
99.
Структура и дипольный момент некоторыхмногоатомных молекул
100.
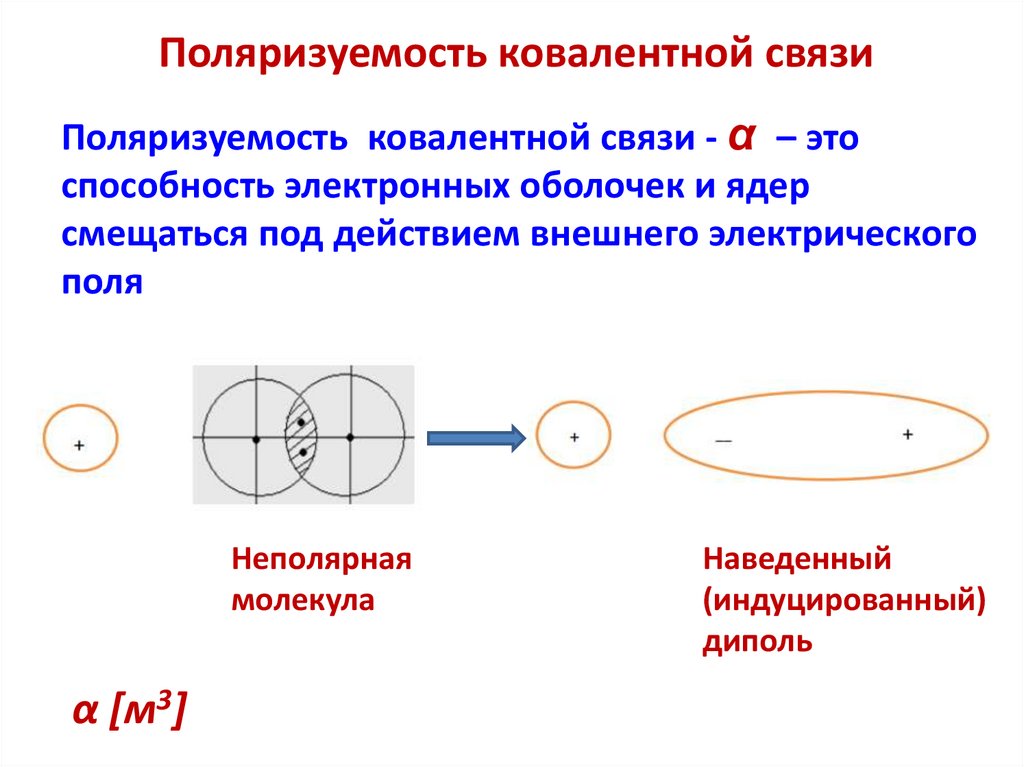
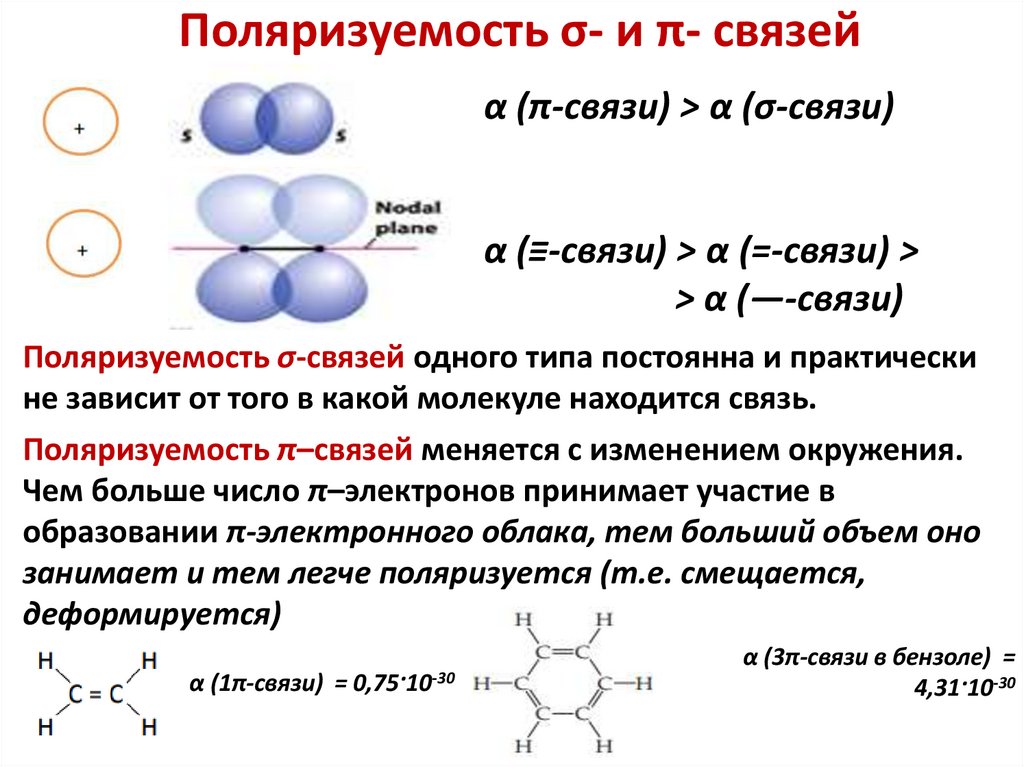
Поляризуемость ковалентной связиПоляризуемость ковалентной связи - α – это
способность электронных оболочек и ядер
смещаться под действием внешнего электрического
поля
Неполярная
молекула
α [м3]
Наведенный
(индуцированный)
диполь
101.
Поляризуемость σ- и π- связейα (π-связи) > α (σ-связи)
α (≡-связи) > α (=-связи) >
> α (—-связи)
Поляризуемость σ-связей одного типа постоянна и практически
не зависит от того в какой молекуле находится связь.
Поляризуемость π–связей меняется с изменением окружения.
Чем больше число π–электронов принимает участие в
образовании π-электронного облака, тем больший объем оно
занимает и тем легче поляризуется (т.е. смещается,
деформируется)
α (1π-связи) = 0,75·10-30
α (3π-связи в бензоле) =
4,31·10-30
102.
ПоляризуемостьПри действии внешнего электрического поля
неполярные молекулы деформируются, молекулы
становятся полярными и характеризуются наведенным
дипольным моментом (μнав.). Происходит
поляризация молекул.
Полярные молекулы характеризуются собственными
постоянными дипольными моментами (μпост).
Полярные молекулы во внешнем электрическом поле
определенным образом ориентируются и
дополнительно поляризуются: μ = μпост + μнав
103.
Индуцированный дипольный моментНаведенный или индуцированный
момент равен:
μi(нав) = q li
дипольный
Наведенный или индуцированный
дипольный
момент пропорционален напряженности внешнего
электрического поля и поляризуемости :
μi(нав) ~ U∙α,
где α- (альфа) – поляризуемость характеризует
способность электронных оболочек и ядер смещаться
(деформироваться) под действием внешнего
электрического поля , [м3]
U – напряженность электрического поля
104.
Индуцированный дипольный моментα - поляризуемость пропорциональна объему V
молекул или Мr молярной массе молекулы
α(He)= 0,2·10-30[м3];
α(H2)= 0,8·10-30[м3]
α(СH4)= 2,7·10-30[м3];
α(С-H)= 0,68·10-30[м3];
CH4
CF4
CCl4
CBr4
CI4
Увеличение радиусов атомов галогенов
Увеличение объема молекул
Увеличение поляризуемости молекул
105. Недостатки метода валентных связей
• 1. Не объясняет магнитные свойства молекул,например O2
• 2. Не рассматривается связь, образованная другим
числом электронов (меньше 2)
• 3. Нельзя предсказать и объяснить спектральные
свойства молекул
• 4. Не объясняет образование электронодефицитных
и электроноизбыточных молекул
• 5. Не объясняет, увеличение прочности связи при
отрыве электрона от нейтральной молекулы,
например, O , NO.








































 Химия
Химия








