Похожие презентации:
Презентация 12 ионно- обменные реакции
1.
Общая и неорганическая химияРаздел: Ионные равновесия
Тема: Ионно-обменные реакции
2.
Ионно-обменные реакции в растворах – реакции,протекающие между электролитами без изменения степеней
окисления элементов
В водных растворах электролитов химические реакции
протекают с участием ионов, реакции называются ионными,
а уравнения этих реакций –ионными уравнениями.
Составление уравнений ионно-обменных реакций
При химическом взаимодействии растворов электролитов
реакция протекает между ионами. В итоге устанавливается
равновесное состояние
3.
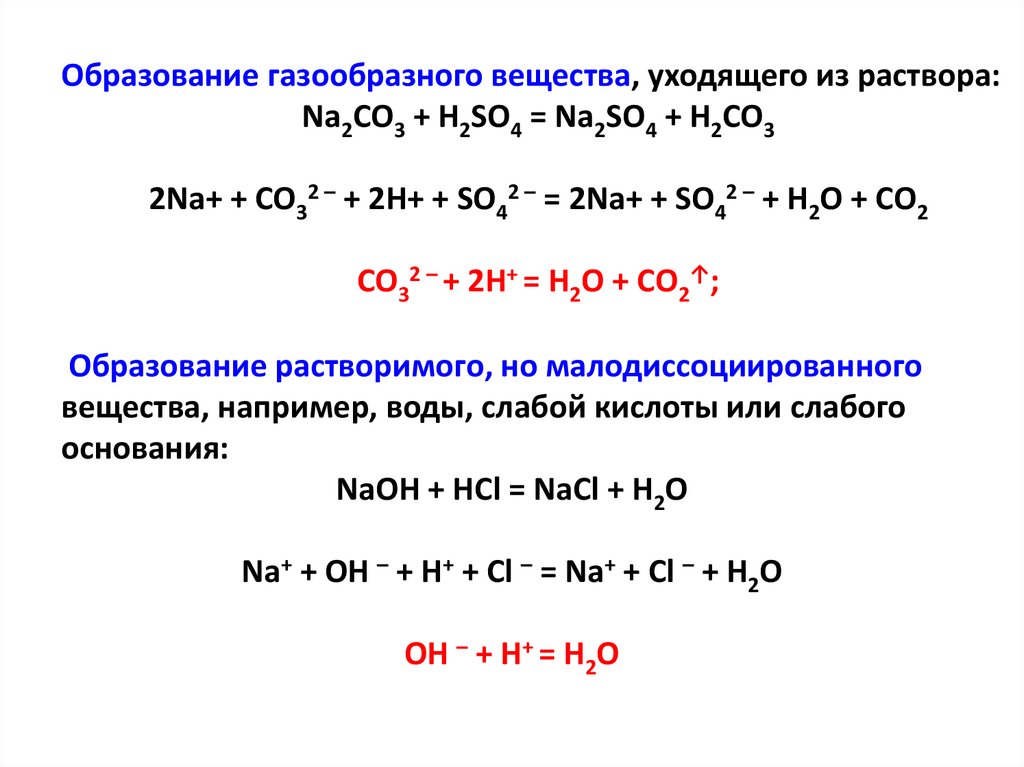
Образование газообразного вещества, уходящего из раствора:Na2CO3 + H2SO4 = Na2SO4 + H2CO3
2Na+ + CO32 – + 2H+ + SO42 – = 2Na+ + SO42 – + H2O + CO2
CO32 – + 2H+ = H2O + CO2↑;
Образование растворимого, но малодиссоциированного
вещества, например, воды, слабой кислоты или слабого
основания:
NaOH + HCl = NaCl + H2O
Na+ + OH – + H+ + Cl – = Na+ + Cl – + H2O
OH – + H+ = H2O
4.
Образование из нескольких простых ионов сложногокомплексного иона
HgI2 + 2KI = K2[HgI4]
Hg2+ + 2I – + 2K+ + 2I – = 2K+ + [HgI4]2 –
Hg2+ + 4I – = [HgI4]2-
Равновесие ионных реакций смещается в сторону образования
менее диссоциированных веществ либо при удалении какоголибо вещества из «сферы реакции» в виде осадка или газа.
Ионно-обменные реакции протекают в направлении
образования осадков, газов, слабых электролитов, комплексных
соединений
5.
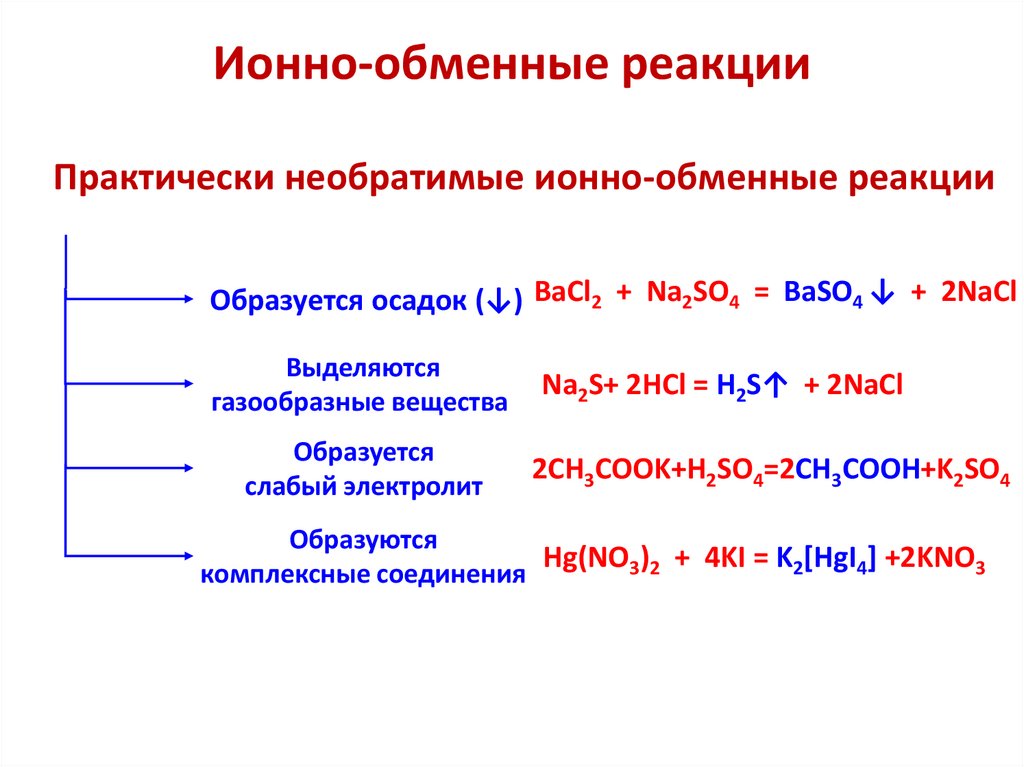
Ионно-обменные реакцииПрактически необратимые ионно-обменные реакции
Образуется осадок (↓) BaCl2 + Na2SO4 = BaSO4 ↓ + 2NaCl
Выделяются
газообразные вещества
Образуется
слабый электролит
Na2S+ 2HCl = H2S↑ + 2NaCl
2CH3COOK+H2SO4=2CH3COOH+K2SO4
Образуются
Hg(NO3)2 + 4KI = K2[HgI4] +2KNO3
комплексные соединения
6.
Направление ионно-обменных реакцийAgCl↓ + KI → AgI↓ + KCl
(молекулярное уравнение)
AgCl↓ + K+ + I- → AgI↓ + K+ + Cl- (полное ионное уравнение)
AgCl↓ +
I- → AgI↓ +
Cl-
(краткое ионное уравнение)
И в исходных и в продуктах присутствуют осадки.
Как определить направление?
Ионно-обменные реакции протекают в направлении наиболее
полного связывания ионов
Направление ионно-обменной реакции можно определить по
величине константы равновесия (Кравн)
7.
Константа равновесия ионно-обменной реакцииaA + bB
cC
+
dD
[











 Химия
Химия








