Похожие презентации:
Презентация 11 кислотно-основные
1.
Общая и неорганическая химияРаздел: Ионные равновесия
Тема: Кислотно-основные равновесия
2.
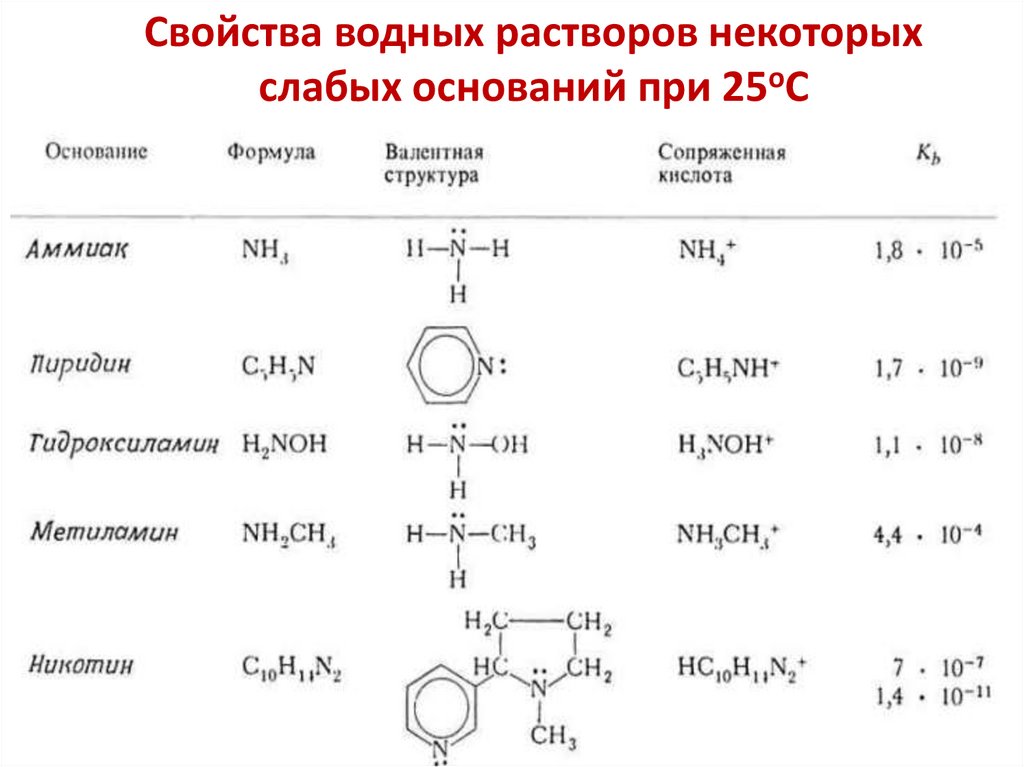
Понятия о кислотах и основаниях1. По Аррениусу
Кислота Аррениуса — вещество, которое в растворе
диссоциирует с образованием иона водорода и кислотного
остатка.
Основание Аррениуса — вещество, которое в растворе
диссоциирует с образованием иона гидроксида и катионов
металла или аммония.
2. По Бренстеду
Кислота Бренстеда — донор протона (отдает протон).
Основание Бренстеда — акцептор протона (принимает протон).
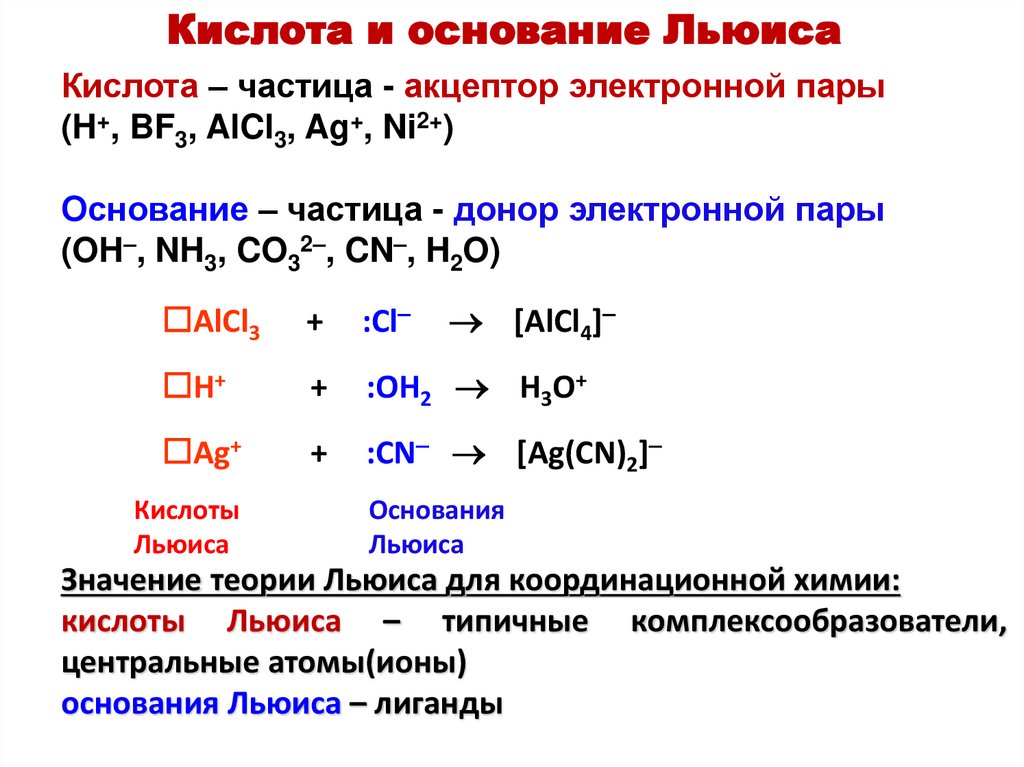
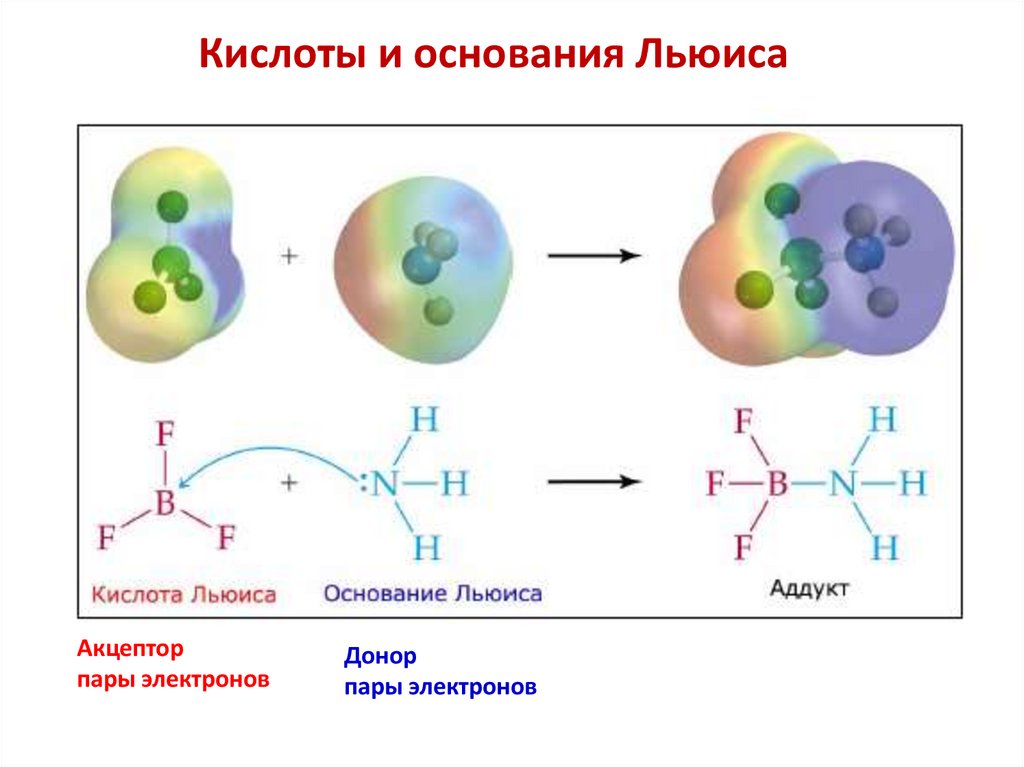
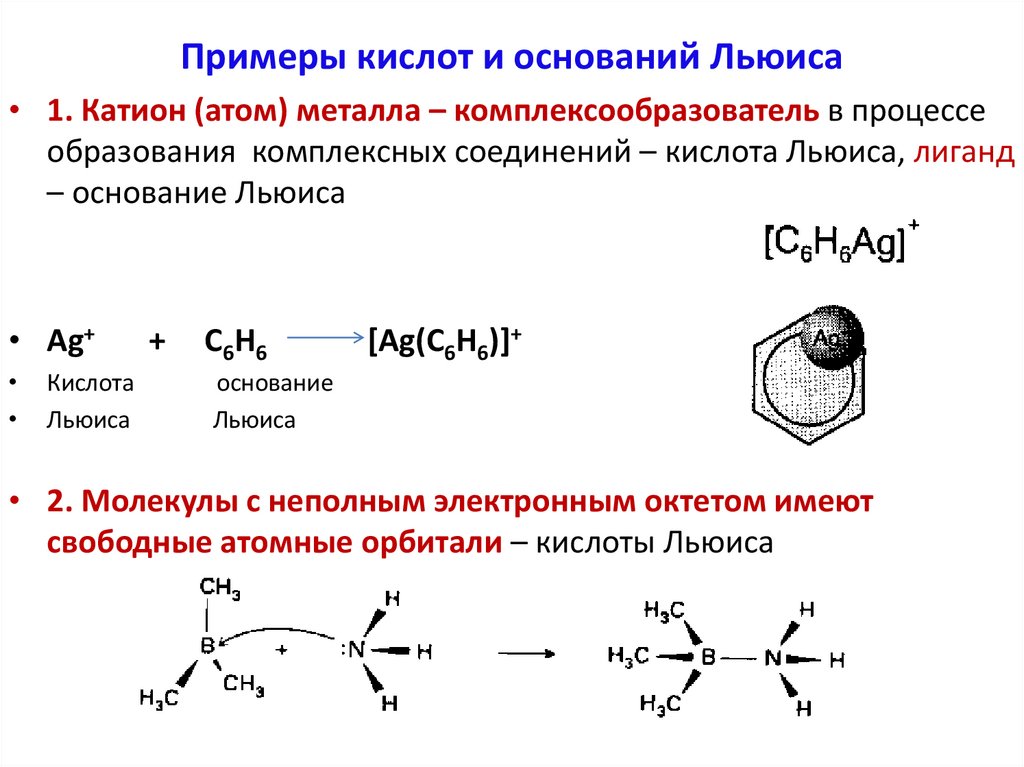
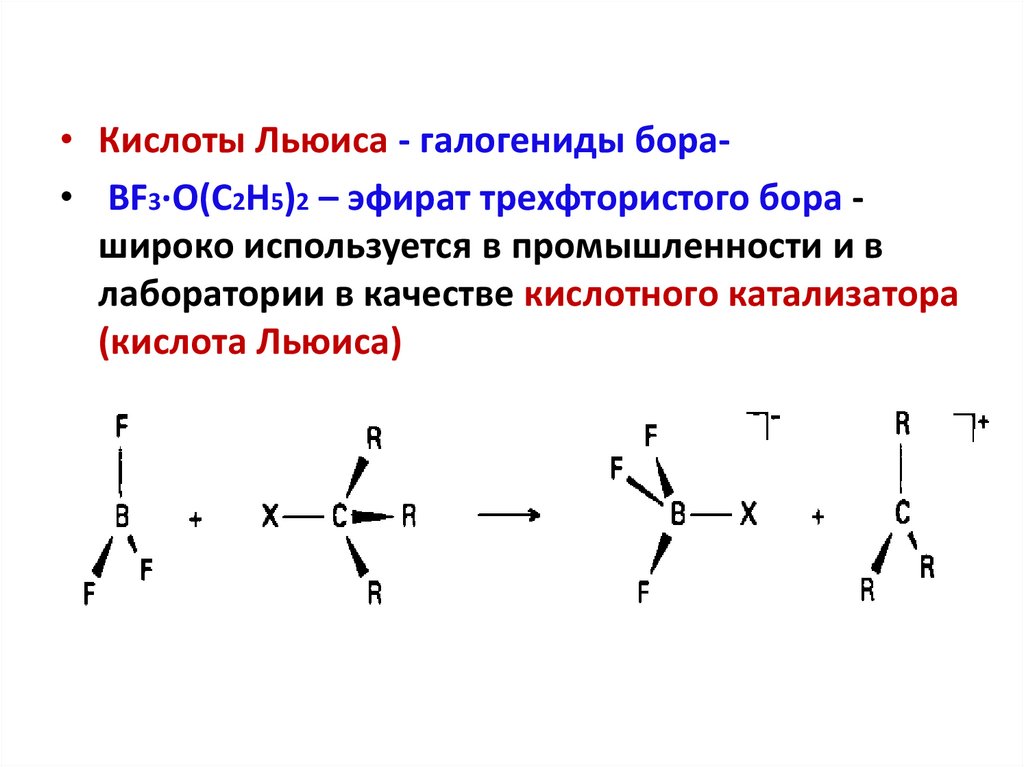
3. По Льюису
Кислота Льюиса — акцептор пары электронов.
Основание Льюиса — донор пары электронов.
3.
Теория АррениусаКислоты по Аррениусу – соединения, диссоциирующие с образованием
катионов H+ и кислотного остатка
НСl
H+ + Сl
Кислота Аррениуса
Основания по Аррениусу – соединения, диссоциирующие с образованием
OH -ионов и катионов.
NaOH Na+ + OH
Основание Аррениуса
Ионы H+ не могут существовать в растворе изолированно, поскольку их
диаметр настолько мал (10 15 м), а плотность заряда на поверхности иона
настолько велика, что они притягивают любые молекулы, содержащие
неподеленные электронные пары:
H+ + H2O ⇆ H3O+ - ион гидроксония
Частицы H3O+ могут гидратироваться дальше с образованием, например,
ионов H9O4+:
H3O+ + 3H2O ⇆ H9O4+
В неводных растворах протон также сольватирован:
в аммиаке образуется – NH4+, в этаноле – C2H5OH2+.
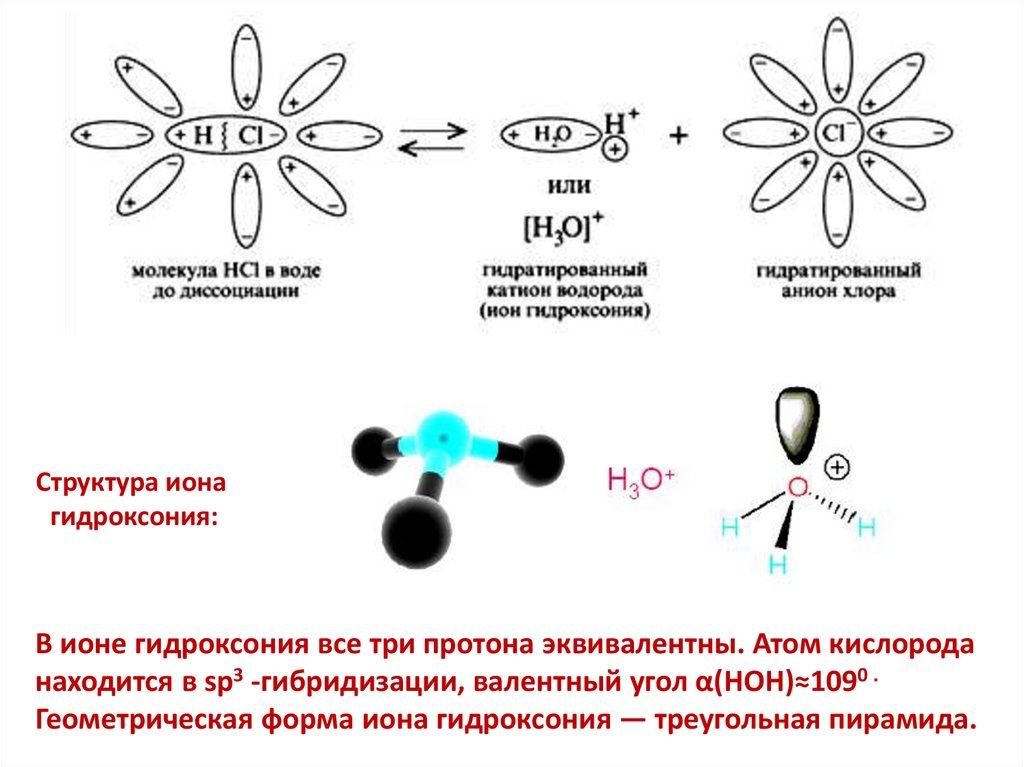
4.
Структура ионагидроксония:
В ионе гидроксония все три протона эквивалентны. Атом кислорода
находится в sp3 -гибридизации, валентный угол α(HOH)≈1090 .
Геометрическая форма иона гидроксония — треугольная пирамида.
5.
Теория Бренстеда-ЛоуриКислоты – это соединения, которые являются донорами
протонов, а основания – акцепторы протонов. Каждой кислоте
соответствует сопряженное ей основание:
AH
Кислота 1
+
:B
⇆
Основание 2
BH+
Кислота 2
+
A
Основание 1
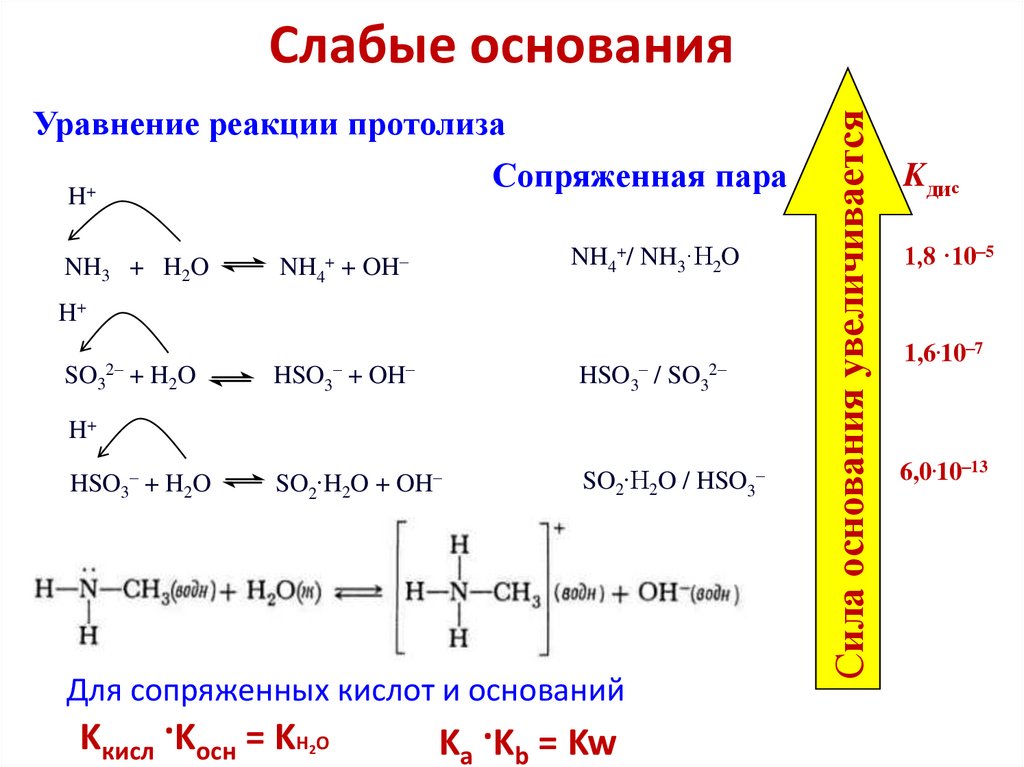
6. Протонная теория кислот и оснований Бренстеда
Кислоты и основания как вещества, теряющие иприобретающие протоны, называются протолитами, передача
протона от кислоты к основанию именуется протолизом, а
химическая реакция между ними – протолитической реакцией:
H+
H+
HA + B
A + HB+; KC
К-та 1 Осн 2
Осн 1 К-та 2
В протолитической реакции участвуют две сопряженные кислотноосновные пары: «кислота» / «основание»
HA /A и HB+/B
• Например, в реакции HNO3 + NH3 NO3 + NH4+
• сопряженные пары
HNO3 / NO3 и NH4+ / NH3.
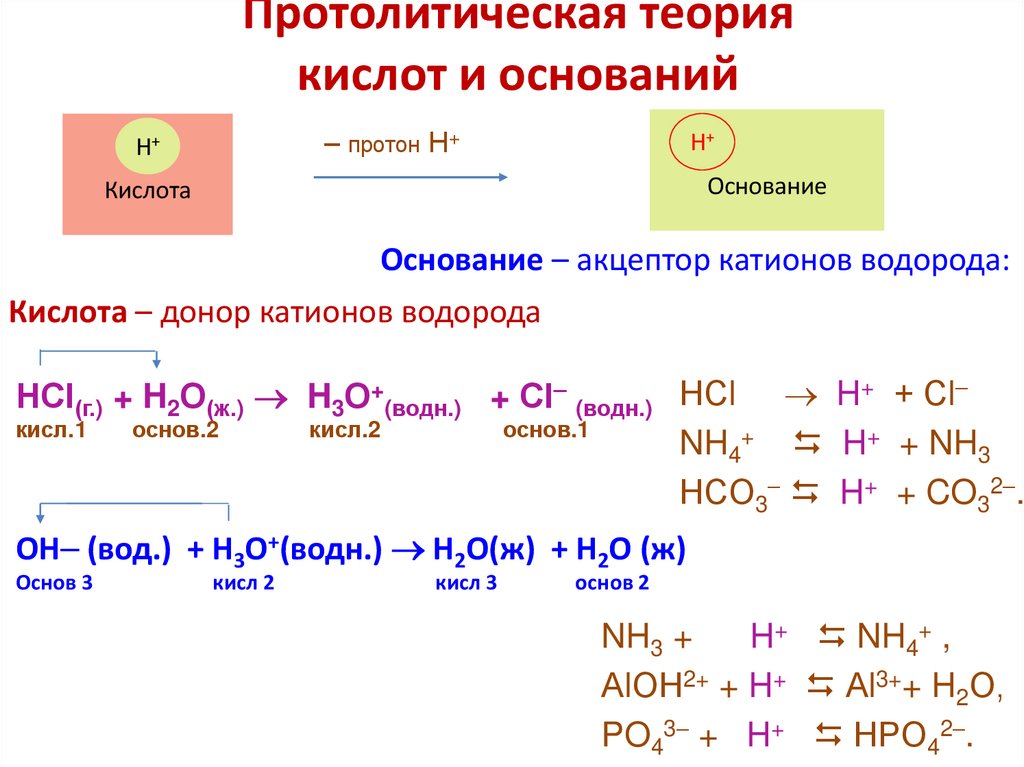
7.
Протолитическая теориякислот и оснований
– протон Н+
Н+
Н+
Основание
Кислота
Основание – акцептор катионов водорода:
Кислота – донор катионов водорода
НСI(г.) + H2О(ж.) H3О+(водн.) + СI (водн.) НСl H+ + Сl
кисл.1
основ.2
кисл.2
основ.1
NH4+ H+ + NH3
НCO3 H+ + CO32 .
OH (вод.) + H3O+(водн.) H2O(ж) + H2O (ж)
Основ 3
кисл 2
кисл 3
основ 2
NH3 +
H+ NH4+ ,
АlОН2+ + H+ Аl3++ H2О,
PO43 + H+ НPO42 .
8.
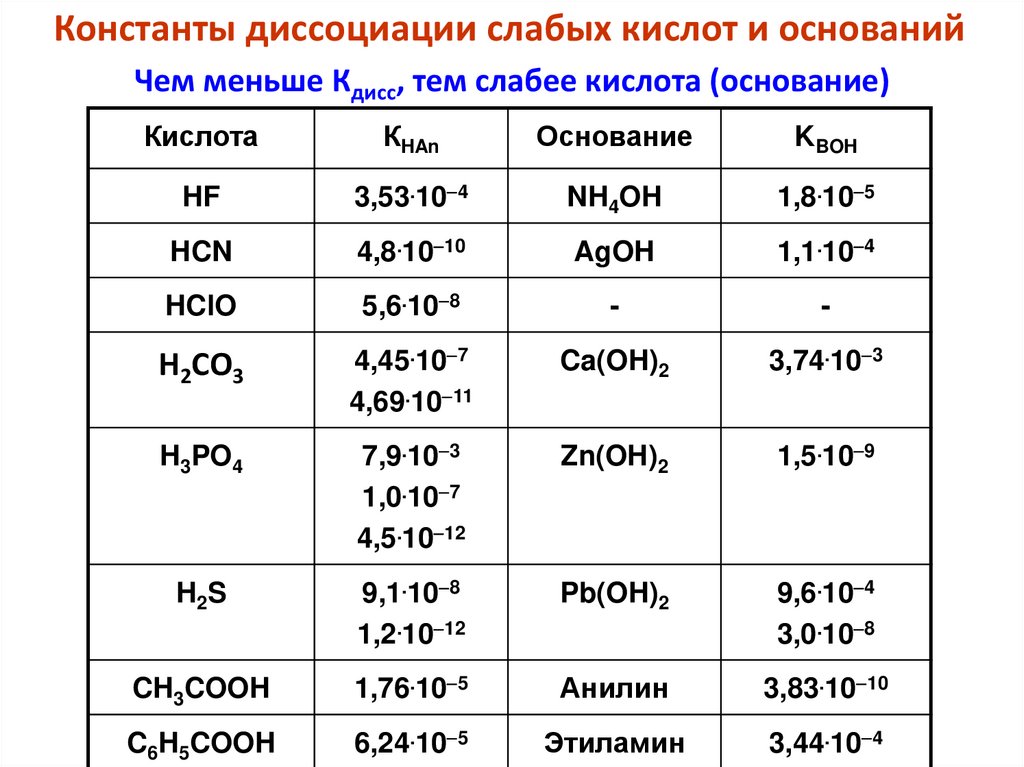
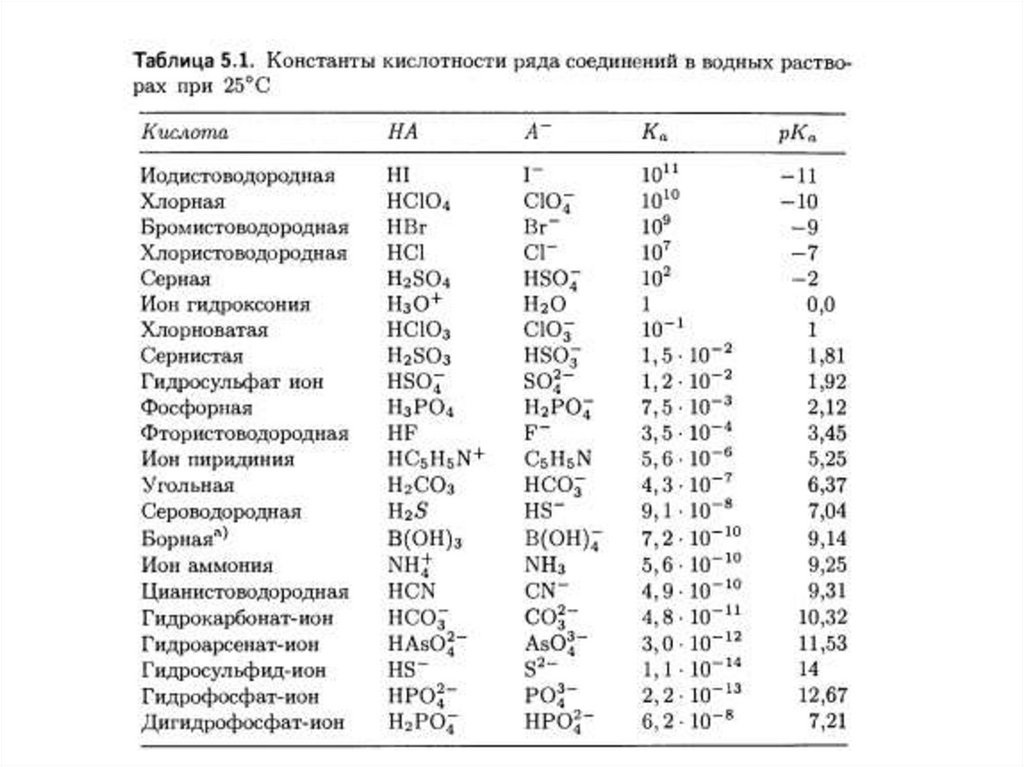
Примеры сопряженных кислот и основанийHCl и Cl-, NH4+ и NH3, H2O и OH , H3O+ и H2O, H2SO4 и HSO4 ,
HSO4 и SO4 2, [Al(H2O)6]3+ и [Al(H2O)5(OH)]2+
Кислоты могут быть
молекулярными,
HCI ⇆ H+ + Сl–
катионными,
NH4+ ⇆ NH3 + Н+
анионными
HCO3– ⇆ CO32- + Н+
Основания делятся на
⇆
молекулярные,
NH3 + Н+
NH4+
анионные,
ОН– + Н+ ⇆ Н2О
катионные,
AI(OH)2+ + Н+ ⇆ AI3+ + Н2О
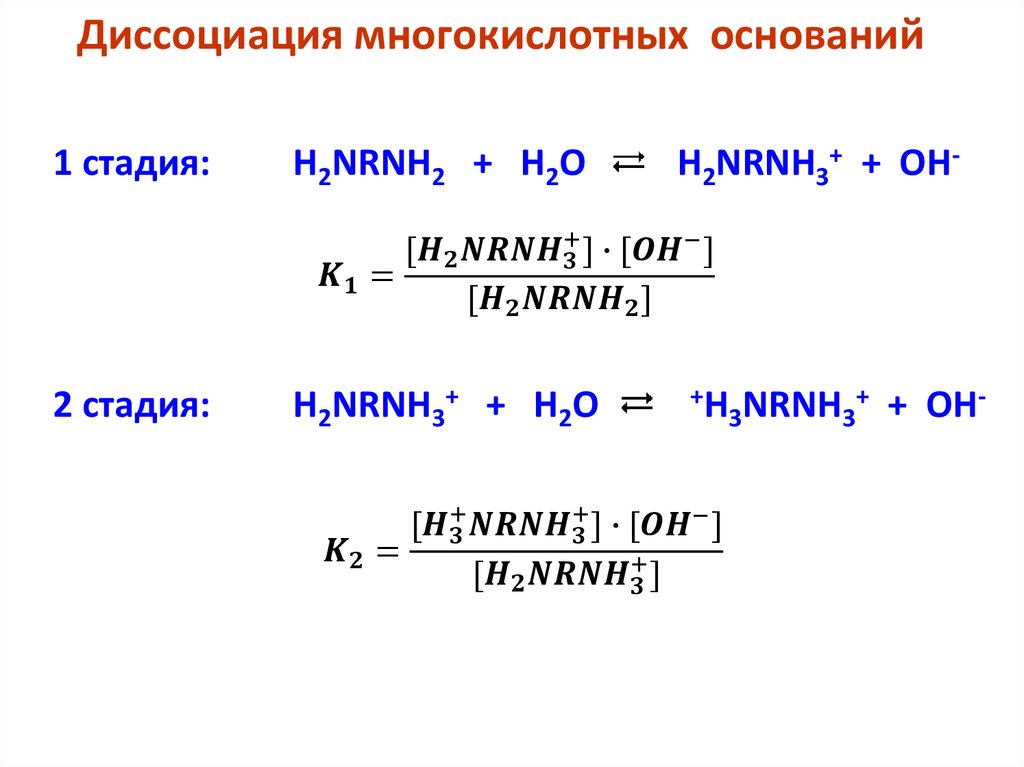
Амфотерные вещества (амфолиты) - это вещества, которые
являются как донорами, так и акцепторами протонов. Они
могут быть заряженными
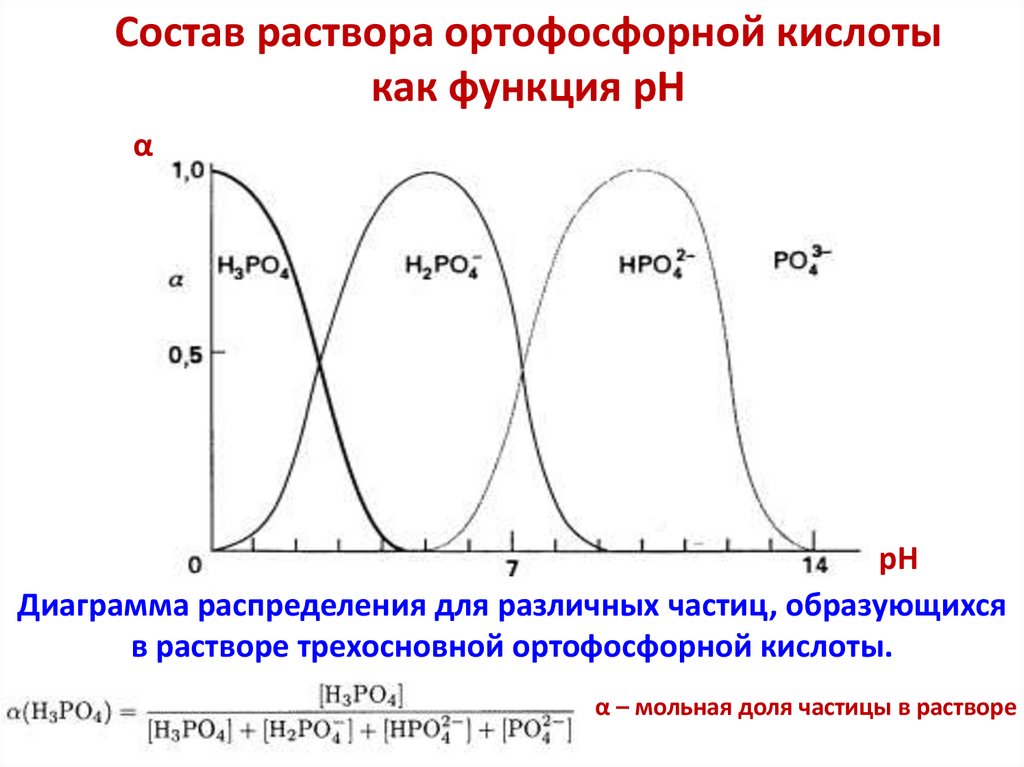
H2PO4– ⇆ Н+ + HPО42–,
H2PO4– + Н+ ⇆
и нейтральными Н2О + Н+ ⇆ Н3О+.
H3PO4
9.
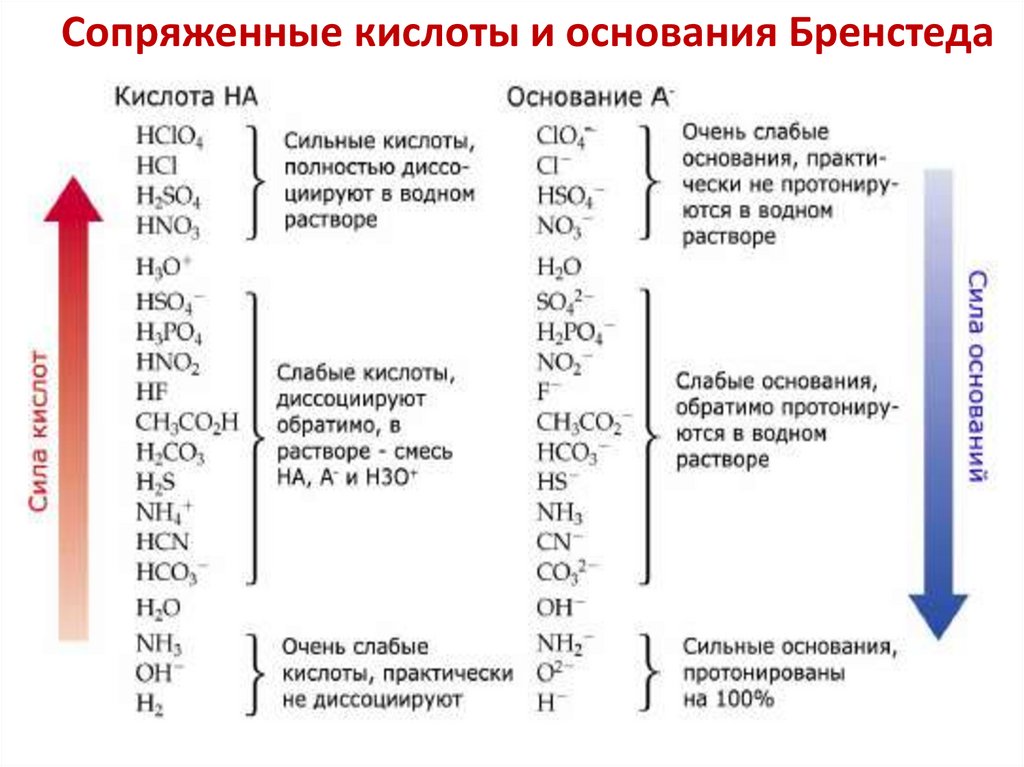
Сопряженные кислоты и основания Бренстеда10.
11.
Автопротолиз воды (диссоциация воды)Обладая амфотерными свойствами молекулы воды могут
вступать во взаимодействие друг с другом, образуя катион
гидроксония H3O+ и анион OH :
H2O + H2O ⇆ H3O+ + OH
основание 1
кислота 2
кислота 1
основание 2
Этот процесс называется автопротолизом.
Упрощенное уравнение диссоциации воды:
H2O ⇆ H+ + OH
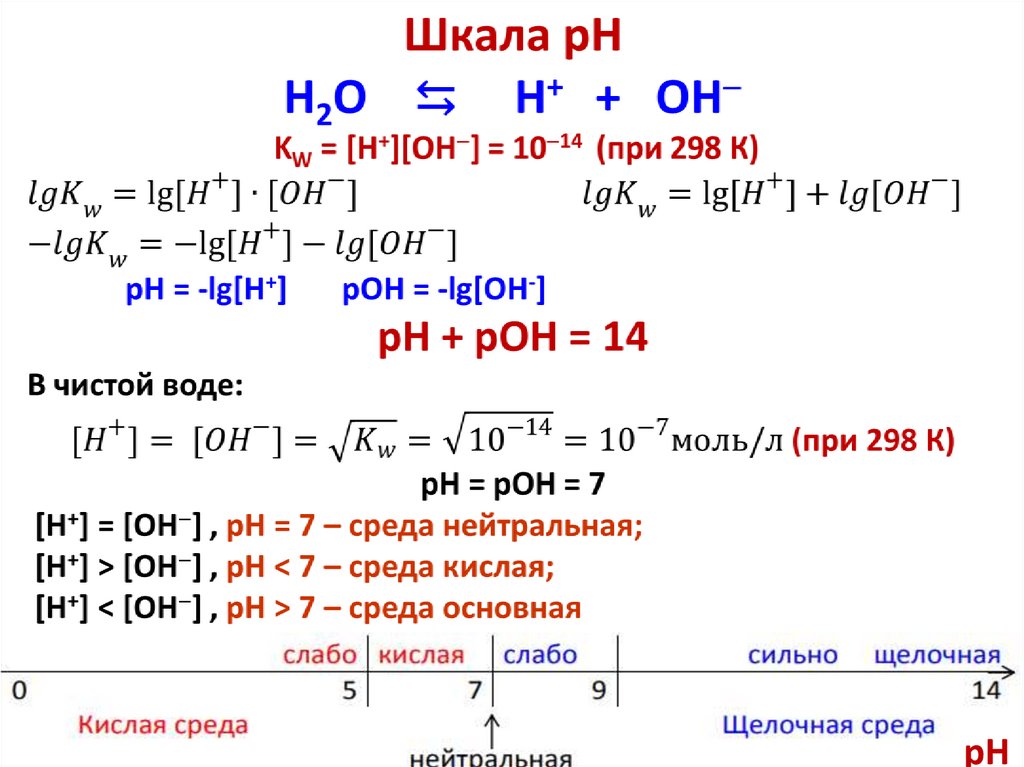
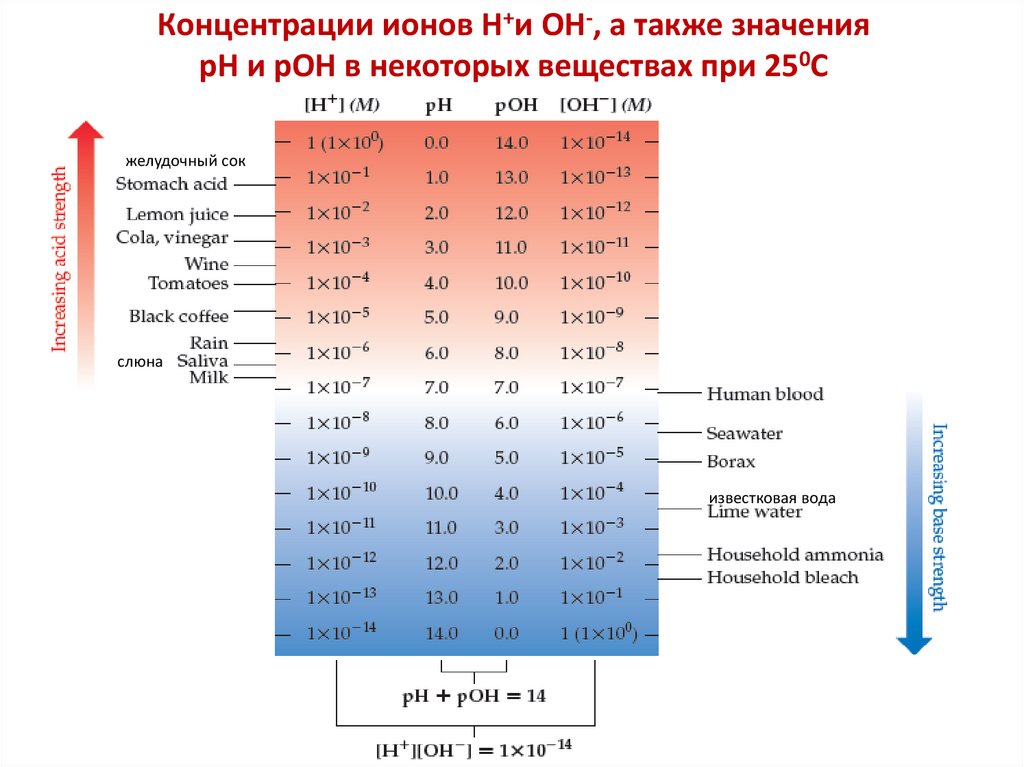
В чистой воде: [H2O] = 1000/18 = 55,85 моль/л, следовательно
Kдис·[H2O] = [H+][OH ] = const,
KH O = KW = [H+][OH ] = 10 14 (при 298 К)
2
KH O = KW – ионное произведение воды
2
12.
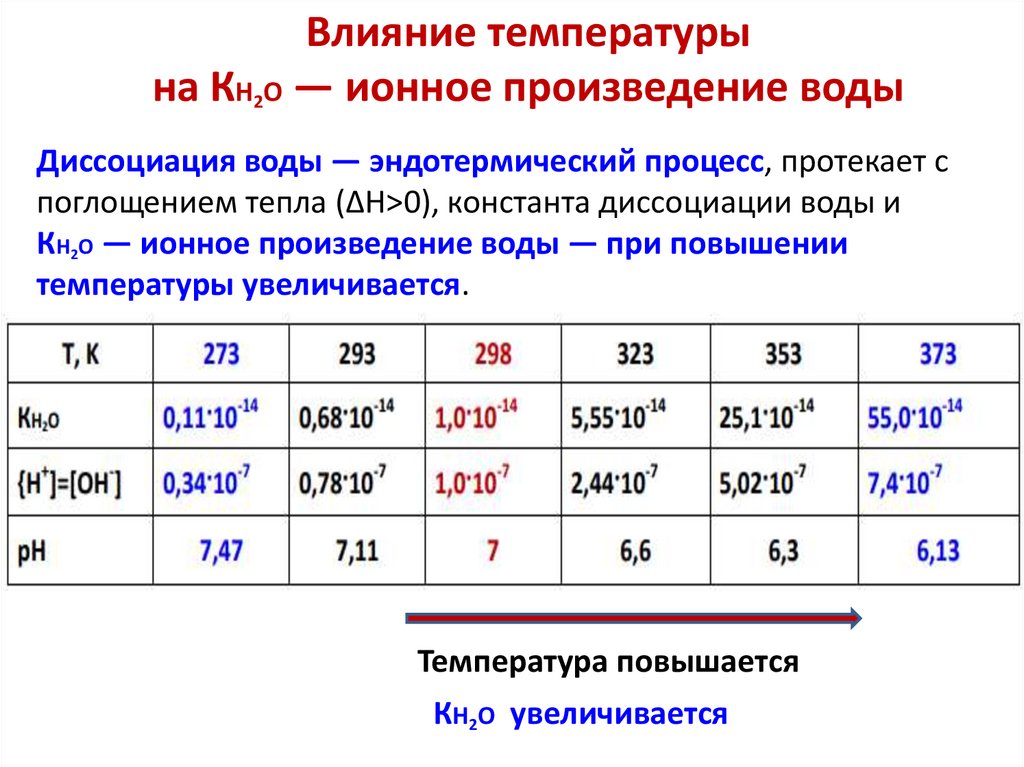
Влияние температурына КH2O — ионное произведение воды
Диссоциация воды — эндотермический процесс, протекает с
поглощением тепла (ΔН>0), константа диссоциации воды и
КH2O — ионное произведение воды — при повышении
температуры увеличивается.
Температура повышается
КH2O увеличивается
13.
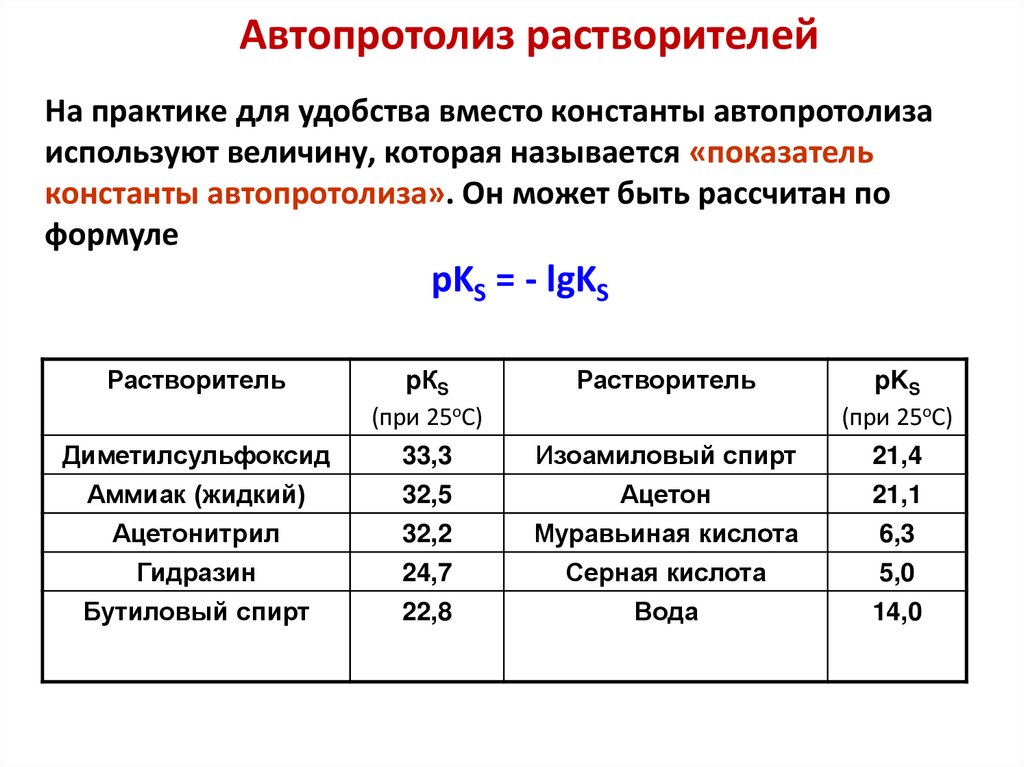
Автопротолиз растворителейДля любого протонодонорного растворителя:
HY + HY ⇆ H2Y+ + Y−
лионий
лиат
НY – протонодонорный растворитель (NH3, ROH, RNH2, RCOOH, RCONH2 и др.)
Константа равновесия процесса автопротолиза равна:
[





























 Химия
Химия








