Похожие презентации:
ОВР_2025
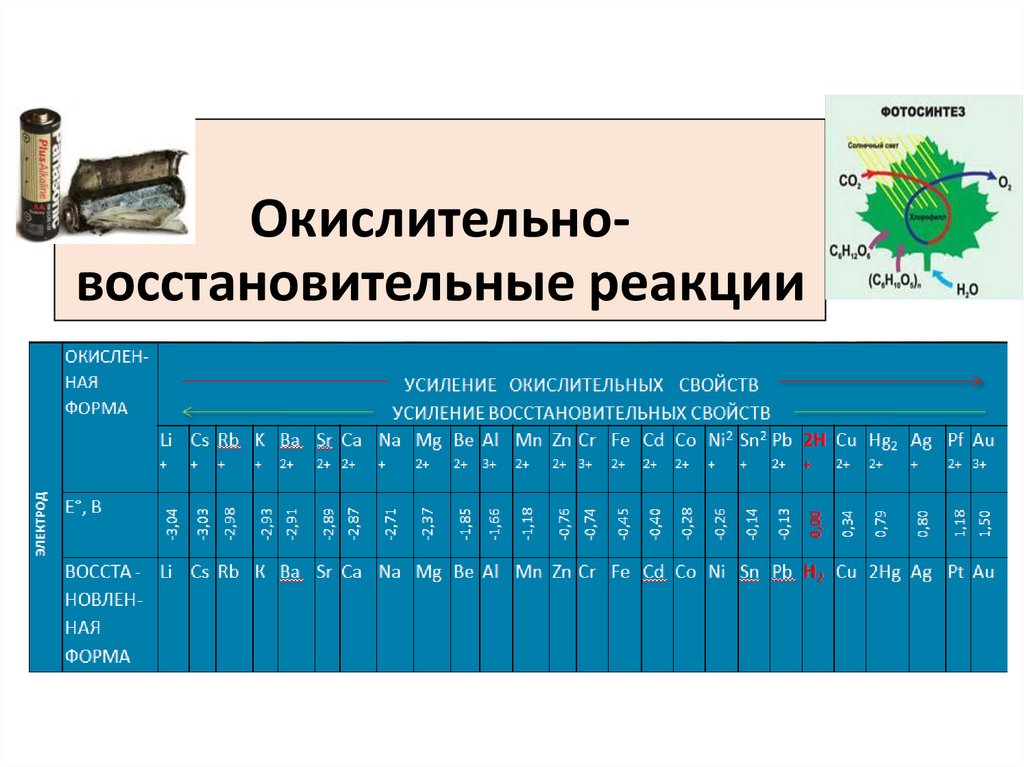
1. Окислительно-восстановительные реакции
Окислительновосстановительные реакцииОВР
2. Cтандартный электродный потенциал по водородной шкале -справочный материал.
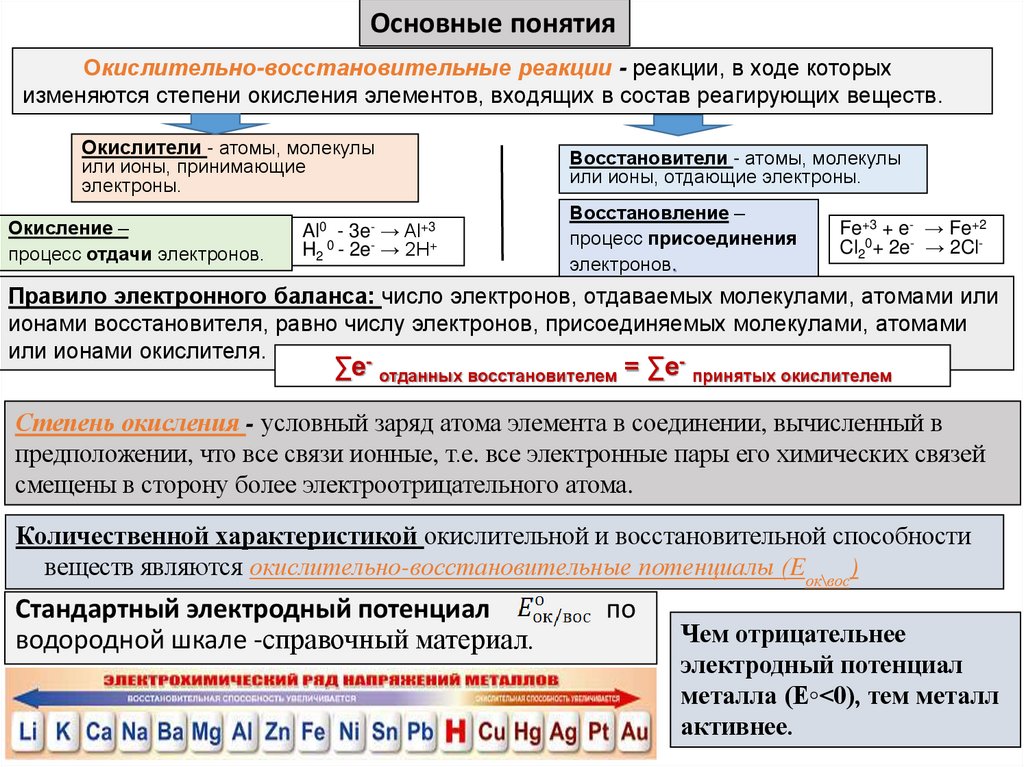
Основные понятияОкислительно-восстановительные реакции - реакции, в ходе которых
изменяются степени окисления элементов, входящих в состав реагирующих веществ .
Окислители - атомы, молекулы
или ионы, принимающие
электроны.
Окисление –
процесс отдачи электронов.
Al0 - 3e- → Al+3
H2 0 - 2e- → 2H+
Восстановители - атомы, молекулы
или ионы, отдающие электроны.
Восстановление –
процесс присоединения
электронов.
Fe+3 + e- → Fe+2
Cl20+ 2e- → 2Cl-
Правило электронного баланса: число электронов, отдаваемых молекулами, атомами или
ионами восстановителя, равно числу электронов, присоединяемых молекулами, атомами
или ионами окислителя.
-
∑e отданных восстановителем = ∑e принятых окислителем
Cтепень окисления - условный заряд атома элемента в соединении, вычисленный в
предположении, что все связи ионные, т.е. все электронные пары его химических связей
смещены в сторону более электроотрицательного атома.
Количественной характеристикой окислительной и восстановительной способности
веществ являются окислительно-восстановительные потенциалы (Eок\вос)
Cтандартный электродный потенциал
водородной шкале -справочный материал.
по
Чем отрицательнее
электродный потенциал
металла (E◦˂0), тем металл
активнее.
3.
Типичные окислители и восстановителиОкислители (+e-)
Восстановители (-e-)
1. Атомы неметаллов в простых веществах, 1. Нейтральные атомы металлов в простых
переходящие в отрицательные ионы. веществах, образующие катионы. К ним
Характеризуются
высоким
значением относятся щелочные и щелочно-земельные
электродного потенциала(>0) и большим металлы, а также Al, Fe и др.
сродством к электрону или большой Характеризуются
малым
значением
электроотрицательностью.
электродного потенциала (<0) и низкими
Например:
значениями электроотрицательности.
F2 +2e- = 2FE0F20/F- = 2.8В
Например:
Cl2 + 2e- =2Cl- E0Cl20/Cl- = 1.86В
Zn0 + 2e- = Zn 2+ E0Zn+2/Zn0 = -076В
Na0 - e- = Na +
E0Na+/Na0 = -1.7В
2.Положительно заряженный ионы
металлов.
Например:
Fe3+ E0Fe+3/Fe+ = 0.77В
Ce4+ E0Cr+6/Cr+3 = 1.6В
2. Атомы неметаллов с отрицательной
степенью
окисления
в
соединении.
Характеризуются
малым
значением
электродного потенциала (<0).
Например:
H2S-2 E0S0/S-2 = -0.46В
H2Se-2 E0Se0/Se-2 = 0.15 В
4.
3. Сложные ионы и молекулы, 3.Катионы металлов в низшей
содержащие атомы металла в состоянии степени окисления и с малыми
высшей
степени
окисления. значениями
электродного
Характеризуются высоким значением потенциала.
электродного потенциала(>0).
Например:
Cr2+ E0Cr2+/Cr0 = -0.47В
Например :
KMn+7O4 E0Mn+7/Mn+2 = 1.51В
Sn2+ E0Sn4+/Sn2+ = 0.15 В
K2Cr2+6O7 E0Cr+6/Cr+ = 1.46В
4. Сложные ионы и молекулы, 4. Сложные ионы и молекулы,
содержащие атомы неметалла
в содержащие атомы
в
состоянии
состоянии положительной степени промежуточной степени окисления.
окисления.
Например, сложные ионы SO32-, NO2-,
Например,
кислородосодержащие AsO33-, CrO2-, [Fe(CN)6]4- проявляют
кислоты, их ангидриды и соли : HN+5O3, восстановительные свойства, т.к. у них
конц. H2S+6O4, S+6O3, HCl+5O3 и др.
атомы серы, азота, мышьяка, хрома и
железа
находятся
в
состоянии
промежуточной степени окисления :
S+4, N+3, As+3, Cr+3 и Fe+2. А также
некоторые молекулы, например S+4O2,
5. Стандартные электродные потенциалы
6. Окислители и восстановители
7.
Величина окислительно-восстновительного потенциала зависит от:1. Природы вещества.
2. Вида электродной реакции.
3. Активности веществ, участвующих в электродной реакции.
4. Температуры.
По значениям окислительно-восстновительного потенциала можно:
1. Оценить окислительно-восстановительную способность
каждой сопряженной пары.
2. К данному окислителю подобрать восстановитель и наоборот.
3. Определить возможность и направление протекания реакции.
Типы ОВР
1) Межмолекулярные ОВР – атомы окислителя и восстановителя находятся в разных
молекулах:
2H2S2- + H2S+4O3 = 3S0 + 3H2O
2) Внутримолекулярные ОВР – атомы окислителя и восстановителя находятся в одной и
той же молекуле:
2KCl+5O3-2 = 2KCl- + 3O20
3) Диспропорционирование - один элемент одновременно повышает и понижает степень
окисления:
Cl20 + 2KOH = KCl+O + KCl- + H2O
4) Замещение 2РЗЭCl3+Mg0 t 2РЗЭ0 +3MgCl2
UF4+2Ca t U +2CaF2
8. Критерии самопроизвольного протекания ОВ реакций
Основные способы осуществления ОВРХимический способ –
непосредственная передача
электронов от восстановителя
к окислителю
Электрохимический способ –
хаотический перенос электронов
преобразуется в направленный процесс,
т.е. от восстановителя через внешнюю
цепь к окислителю.
Критерии самопроизвольного протекания ОВ реакций
G 0, EОВР 0
Связь между ЭДС окислительно-восстановительной реакции (EОВР) и
изменением энергии Гиббса (∆G) выражается уравнением:
∆G = -nFEовр, где n — число молей электронов, участвующих в реакции;
F — постоянная Фарадея, равная 96 500 Кл.
Возможность самопроизвольного протекания реакции можно определить
двумя способами:
1.По изменению энергии Гиббса (∆G): G реакции Gпрод. Gисх . в.
2.По ЭДС окислительно-восстановительной реакции
G 0
EОВР Eок ля Ев ля >0
9. Определение направления реакции:
1.10KBr - + 2KMn+7O4 + 8H2SO4 → 5Br20 +6K2SO4 + 2Mn2+SO4+ 8H2O
2 Br - – 2e- = Br20
• Mn+7 + 5e- = Mn2+
│5 , восстановитель, Eвос = 1.063 В
│2 , окислитель , Еок = 1.51 В
• В ионной форме :
10Br - + 2(MnO4)- + 16H+ = 5Br20 + 2Mn2+ + 8H2O
∆Gреакции = 5* 3.14 + 2*(-229.91) + 8*(-237.23) - 10*(-104.04) - 2*(- 440.28) =
421 кДж < 0
Еовр = 1.51 – 1.063 = 0.447 В > 0
Реакция идет в прямом направлении.
2. Действием какого из окислителей (а)K2Cr2O7 или б)KMnO4) можно выделить хлор
в свободном виде из раствора соляной кислоты?
С использованием стандартных электродных потенциалов рассчитайте ЭДС
реакции и составьте уравнение возможной окислительно-восстановительной
реакции, расставьте коэффициенты
2а. Mn+7+5e Mn+2
2Cl-1-2e Cl20
2 ок-ль Еок=1.51 В;
5 Eвос = 1.36
Еовр = 1.51 – 1.36 = 0.15 В > 0
уравнение возможной
ов реакции
2б. 2Cr+6+2e 2Cr+3
2Cl-1-2e Cl20
1
1
ок-ль Еок=1.33 В;
Eвос = 1.36
Еовр = 1.33 – 1.36 =- 0.03 В < 0
2KMn+7O4 + 16HCl → 5Cl20 +2KCl + 2Mn2+Cl2+ 8H2O
10. Влияние pH
Глубина протекания ОВ реакцийG 0 RT ln K х. р. , G 0 nF E
nF E nF ( E 0
E0
),
х. р.
ок ля
в ля
0
0
nF ( Eок
E
)
ля
в
ля
ln K
х. р.
RT
K х. р. оценивает глубину протекания ххимреакции
RT ln K
Влияние pH
1) 2KMnO4 + 3H2SO4 + 5Na2SO3 → 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O
2MnO4− + 6H+ + 5SO32− → 2Mn2+ + 5SO42− + 3H2O
MnO4− + 8H+ + 5e− → Mn2+ + 4H2O x2 E0ок = 1,51 В
SO32− + H2O − 2e− → SO42− + 2H+
x5 E0вос = 0,17 В
(pH<7)
K=10227.12
2) 2KMnO4 + H2О + 3Na2SO3 → 2MnО2(т) + 3Na2SO4 + 2КОН (pH = 7)
2MnO4− + H2О + 3SO32− → 2 MnО2(т) + 3SO42- + 2ОНMnO4− + 2 H2О + 3e− → MnО2(т) + 4 ОН− x2 E0ок = 0,6 В
SO32− + H2O − 2e− → SO42− + 2H+
x3 Е0вос = - 0,93 В
3) 2KMnO4 + Na2SO3 + 2KOH → Na2SO4 + 2K2MnO4 + H2O
K=10155.59
(pH >7)
SO32− + 2 OH− + 2MnO4− → SO42− + 2MnO42− + H2O
MnO4− + 1e− → MnO42−
x2 Е0ок = 0,56 В
SO32− + 2 OH− − 2e− → SO42− + H2О
x1 Е0вос = -0,93 В
K=1050.5
11.
Окислтельно-восстановительные свойства РЗЭИоны Ce4+ - сильные окислители
Ce3+ + окислитель Ce4+
(pН > 7)
в кислых средах
ЕСе+4 / Се+3= 1.61В
2Ce(SO4)2+H2O2 Ce2(SO4)3+O2 +H2SO4
3Ce(OH)3 + KMnO4 + 2H2O
3Ce(OH)4 + MnO2 + KOH
Ce+4+e Ce+3 2
2O-1-2e O20 1
Се+3-е Се+4
3
+7
+4
Mn +3е Mn
1
E = Eок-Eвос = 0,25В
2Ce(SO4)2+2KI I2+K2SO4+Ce2(SO4)3
(pН <7)
2Ce (NO3)3+NaBiO3 +6HNO3
2Ce(NO3)4+Bi(NO3)3+NaNO3+3H2O
Bi+5+2e Bi+3
Ce+3-e Ce+4
(pН <7)
Eок=1.86 В
2 Eвос=1.61В
1
Ce+4+e Ce+3 2
2I--2e I2
1
2Ce+4(OH)4+8HCl1 2Ce+3Cl3+Cl2 +8H2O
Ce+4+e Ce+3 2
2Cl-1-2e Cl20 1
ок-ль Еок=1.61 В;
в-ль Евост=1.36 В;
Ер=Еок-Евост= 0,25 В;
Ce+4I4
Ce+4Br4
Ce+4Cl4
Eu3+ + восстановитель Eu2+
pH 7
Eu2(SO4)3 + Zn
2EuSO4 + ZnSO4
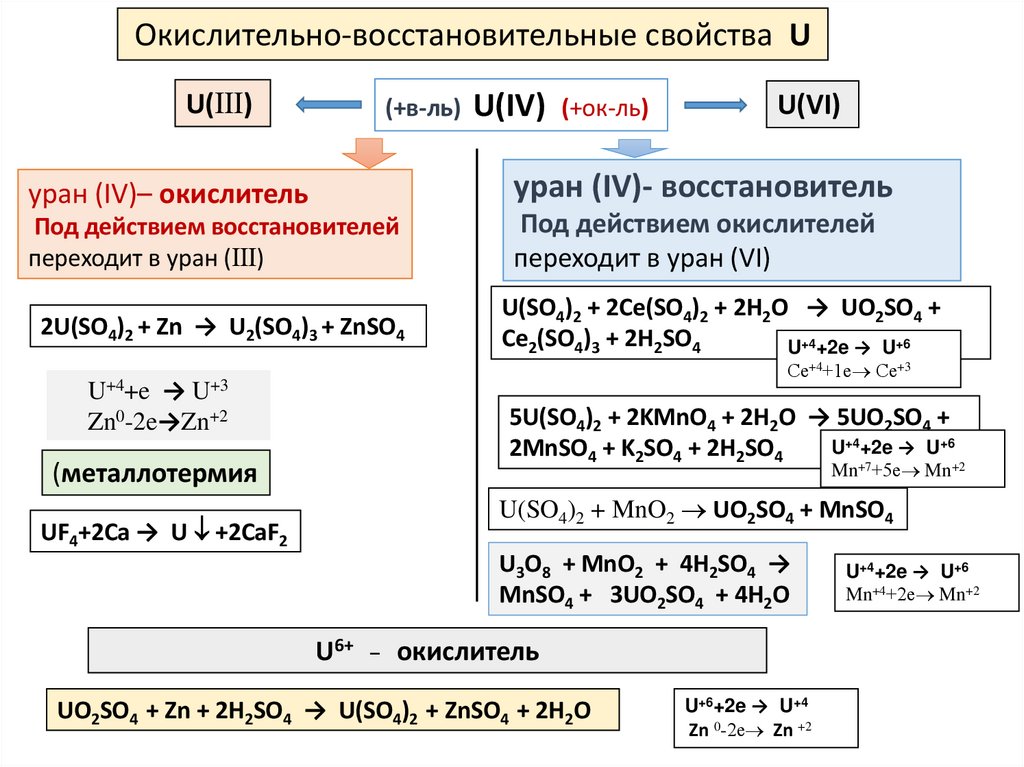
12.
Окислительно-восстановительные свойства UU(Ⅲ)
(+в-ль) U(IV) (+ок-ль)
U(VI)
уран (IV)– окислитель
уран (IV)- восстановитель
Под действием восстановителей
переходит в уран (Ⅲ)
Под действием окислителей
переходит в уран (VI)
2U(SO4)2 + Zn → U2(SO4)3 + ZnSO4
U(SO4)2 + 2Ce(SO4)2 + 2H2O → UO2SO4 +
Ce2(SO4)3 + 2H2SO4
U+4+2e → U+6
U+4+e
Се+4+1е Се+3
→ U+3
Zn0-2e→Zn+2
(металлотермия
UF4+2Ca → U +2CaF2
5U(SO4)2 + 2KMnO4 + 2H2O → 5UO2SO4 +
U+4+2e → U+6
2MnSO4 + K2SO4 + 2H2SO4
Mn+7+5е Mn+2
U(SO4)2 + MnO2 UO2SO4 + MnSO4
U3O8 + MnO2 + 4H2SO4 →
MnSO4 + 3UO2SO4 + 4H2O
U6+ _ окислитель
UO2SO4 + Zn + 2H2SO4 → U(SO4)2 + ZnSO4 + 2H2O
U+6+2e → U+4
Zn 0-2е Zn +2
U+4+2e → U+6
Mn+4+2е Mn+2
13. Роль ОВР в природе и технике:
1. Получение топлива2. Сжигание топлива в двигателях
3. Получение химических продуктов
4. Аккумуляторы
5.Превращение химической энергии в
электрическую.
6.Сгорание топлива, процессы
коррозии металлов и электролиз.
7.Методы объёмного анализа в
аналитической химии.









 Химия
Химия








