Похожие презентации:
15. Бериллий, магний и щёлочноземельные металлы
1.
БЕРИЛИЙ, МАГНИЙ ИЩЕЛОЧНОЗЕМЕЛЬНЫЕ
МЕТАЛЛЫ
2.
Бериллий, магний ищелочноземельные металлы
находятся в IIA-группе
Строение внешнего
энергетического уровня ns2
Максимальная
степень окисления
+2
Валентность - I I
12.11.2025
2
3.
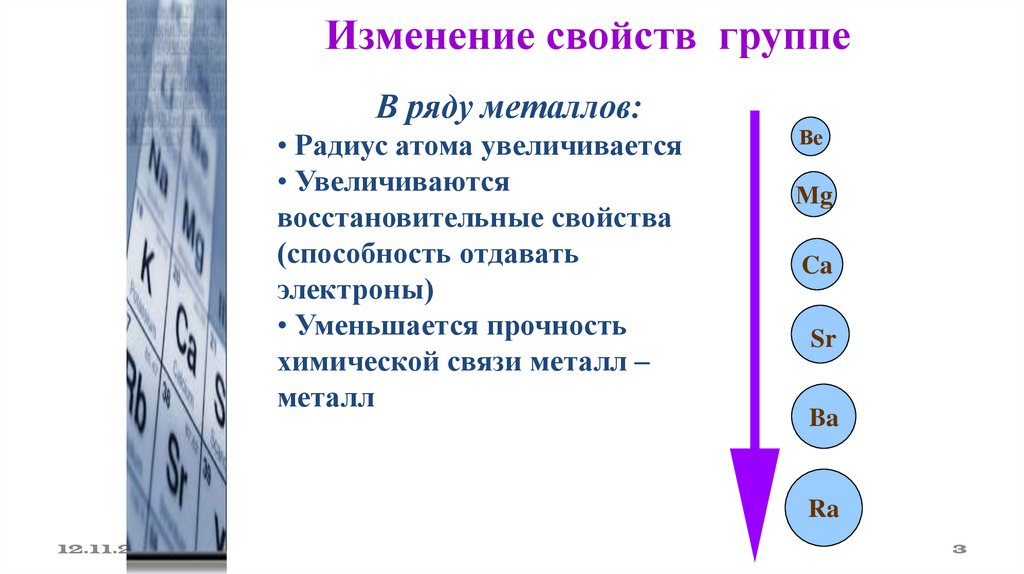
Изменение свойств группеВ ряду металлов:
• Радиус атома увеличивается
• Увеличиваются
восстановительные свойства
(способность отдавать
электроны)
• Уменьшается прочность
химической связи металл –
металл
Ве
Мg
Ca
Sr
Ba
Ra
12.11.2025
3
4.
«Если не знать имен умрет и познание вещей»Карл Линней
12.11.2025
4
5.
ОТКРЫТИЕ МЕТАЛЛОВ• Магний и кальций были
впервые получены
английским химиком и
физиком Г. Дэви в 1808 г.
• Магний из белой магнезии.
По названию минерала дали
название элементу.
• Название элемента кальций
происходит от лат. Слова
кальс, что означает «известь,
мягкий камень».
12.11.2025
Гемфри Дэви
(1778 – 1829)
5
6.
Нахождение в природеКак активные металлы, они встречаются
в природе только в виде соединений
Кальциевые горные породы –
известняк, мрамор, мел.
Магниевая горная порода –
магнезит.
6
7.
Физические свойстваКальций - твердый и
пластичный
Магний - относительно
мягкий, пластичный,
12.11.2025
ковкий
Щелочные металлы легкие,
мягкие и легкоплавкие,
серебристы, стронций имеет
золотистый оттенок.
Бериллий - светлосерый, твердый,
хрупкий
Стронций ковкий 7
8.
Химические свойства1. Металлы взаимодействуют почти со
всеми
неметаллами:
2Ме0 + О20 =2Ме+2О-2 (оксид)
Ме0 + Н20 = Ме+2Н2-1 (гидрид)
Ме0 + Cl20 = Mе+2Cl2-1 (хлорид)
Ме0 + S0 = Mе+2S-2 (сульфид)
3Ме0 + N20 = Mе3+2N2-3 (нитрид)
12.11.2025
8
9.
Химические свойства2. Бериллий с водой не реагирует, магний
реагирует медленно, остальные металлы
реагируют с водой, образуя щелочи и
восстанавливая воду до водорода:
Ме0 + 2Н2О = Ме+2 (ОН)2 + Н2
3. Магний реагирует с кислотами.
Ме0 + 2НCl = Ме+2 Cl2 + Н2
4. Магний и кальций реагирует с оксидами.
2Мg0 + TiО2 = 2Мg +2О + Ti
12.11.2025
9
10.
Проверь себя(работа с таблицей Д.И. Менделеева)
• Сравните атомы элементов, поставив знаки <, >
или = вместо *:
а) заряд ядра: Be* Ba; Мg * Al; Ca * К;
б) число электронных слоев: Be * Ba; Мg * Al;
Ca * К;
в) число электронов на внешнем уровне:
Be * Ba; Мg * Al; Ca * К;
г) радиус атома: Be * Ba; Мg * Al; Ca * K;
д) восстановительные свойства: Be* Ba; Мg *Al;
Ca * K.
12.11.2025
10
11.
Проверь себяДополните схемы взаимодействия щелочных металлов с неметаллами
общими формулами и названиями продуктов реакции. Запишите
конкретные уравнения реакций, расставив коэффициенты в них методом
электронного баланса.
а) М+ Н 2
Пример: ___________________
в) М+ С12
Пример:
б) М+ S
Пример: _______________________________
г) М+ N2
Пример: ___________________________
Допишите уравнения реакций. Как изменяется скорость реакций,
расположенных в указанной стрелкой последовательности?
а)
б)
в)
Ca + H2O→ ……………………….
Sr + H2O→……………………….
Ba + Н2О→………………………..
Объясните, от какого фактора зависит скорость реакции взаимодействия
щелочных металлов с водой ………………………..
Назовите продукты реакций. Опишите, как доказать их образование.
………………………............................................
12.11.2025
11










 Химия
Химия








