Похожие презентации:
Общая характеристика галогенов (2)
1.
Урок. Общаяхарактеристика
галогенов.
2.
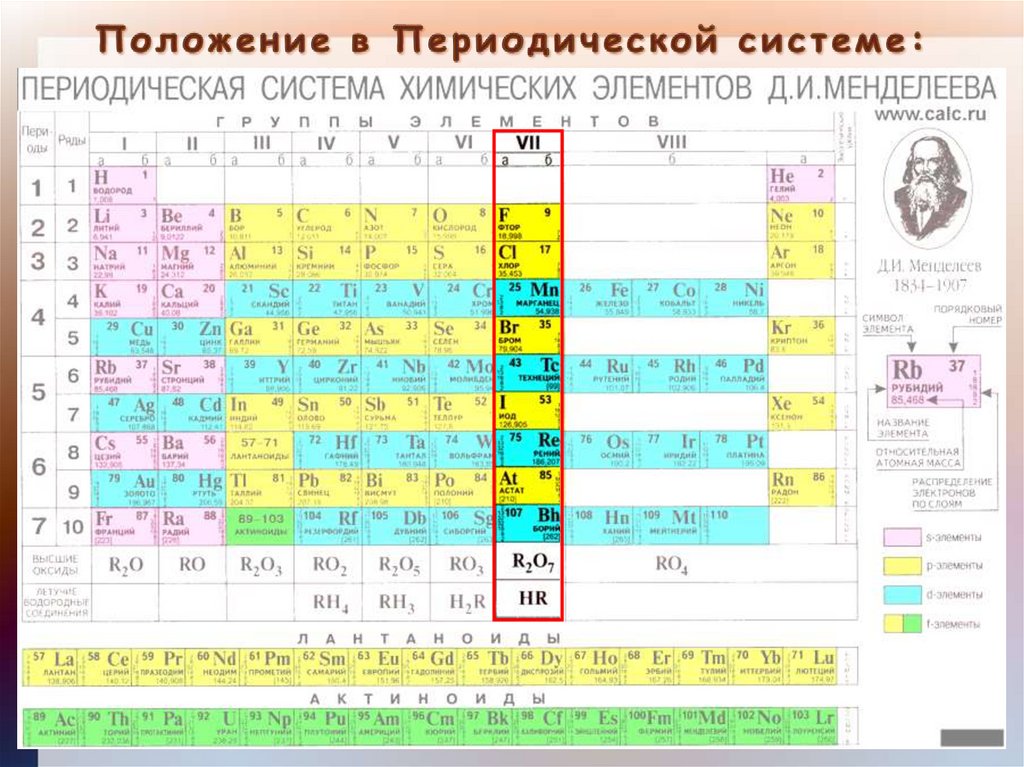
Цели:Охарактеризовать положение галогенов
в Периодической системе
Д.И.Менделеева.
Охарактеризовать особенности строения
атомов галогенов.
Охарактеризовать физические свойства.
Охарактеризовать химические свойства
галогенов.
Обобщить знания учащихся об
областях применения галогенов.
3.
4.
FФтор
Cl
Хлор
Br
Бром
I
Иод
At
Астат
ГАЛОГЕНЫ
(от греческого
halos - соль
genes-рождающий,
рождённый)
VII группа,
Главная подгруппа
5.
ЭлементAr
F
19
Cl
35,5
Br
Число
Число
Число
валентных
Окисл.
НеМетал
Окисл.
НеМетал
валентных
электронных
атома
электронов
R
R
атома
свойства
свойства
свойства
свойства
электронов
слоев
))
)))
))))
127
At
[210]
3s23p5
4s24p5
80
I
2s22p5
)))))
5s25p5
6s26p5
6.
Cl ClCl + Cl
Cl
Cl
Молекула двухатомная.
Тип связи – ковалентная неполярная.
Кристаллическая решетка – молекулярная.
Какие физические свойства можно предположить?
7.
8.
9.
10.
11.
12.
ГалогенF2
Cl2
Br2
Агрег.
сост.
Газ
Газ
Цвет
Запах
T
T
плавл.
кип.
°C
°C
Бледножелтый
Резкий
раздражающий запах
-219,7 -188,2
Желтозеленый
резкий
неприятный
запах
−100
−34
−7,2
58,8
Жид- Краснокость бурый
Резкий
удушающий,
пары
13.
ГалогенF2
Cl2
Br2
Агрег.
сост.
Газ
Газ
Цвет
Запах
T
T
плавл.
кип.
°C
°C
Бледножелтый
Резкий
раздражающий запах
-219,7 -188,2
Желтозеленый
резкий
неприятный
запах
−100
−34
−7,2
58,8
Жид- Краснокость бурый
Резкий
удушающий,
пары
14.
At215.
F216.
Cl217.
Cl218.
Br2Бром и иод добывают из
природных вод.
Источник иода – морские
водоросли –
ламинарии.
I2
19.
1. Взаимодействие с металлами.При взаимодействии галогенов с металлами
образуются соли – галогениды.
Zn + F2 = ZnF2
фторид цинка
2Fe + 3Cl2 − 2FeCl3
хлорид цинка
Fe + Cl2 − FeCl3
хлорид цинка
Al + Br2 − AlBr3
бромид цинка
2
Al + I2 − AlI3
бромид цинка
2Al + 3I2 − 2AlI3
бромид цинка
20.
2. Взаимодействие с водородом.При взаимодействии галогенов с водородом
образуются галогеноводороды (при растворении в
воде галогеноводороды образуют кислоты)
H2 + F2 − HF
H2 + Cl2 − HCl
H2 + Br2 − HBr
H2 + I2 − HI
фтороводород (со взрывом)
хлороводород (со взрывом при
ярком солнечном освещении)
бромоводород (при нагревании)
иодоводород (при нагревании,
медленно)
21.
3. Взаимодействие с водой.Cl2, Br2, I2 взаимодействуют по схеме:
Гal2 + H2O = HГalО + НГal
Cl2 + H2O = HClO + HCl (хлороводородная кислота)
(хлорноватистая кислота)
Вода горит во фторе:
2F2 + 2H2O = 4HF + O2
F2 + H2O − HF + O2
22.
4. Взаимодействие со сложными веществами.Более активный галоген вытесняет менее активный из
растворов солей.
F2 > Cl2 > Br2 > I2 активность уменьшается
КBr + Cl2 − KCl + Br2
2КBr + Cl2 − 2KCl + Br2
Почему для этой реакции не используют фтор?
23.
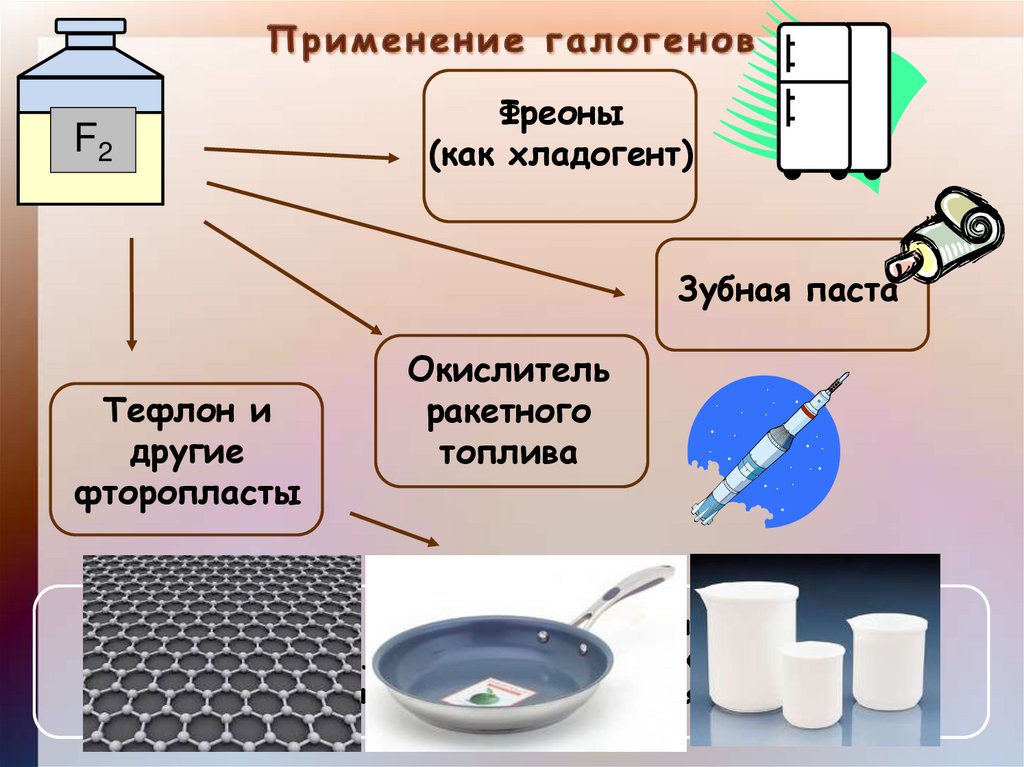
F2Фреоны
(как хладогент)
Зубная паста
Тефлон и
другие
фторопласты
Окислитель
ракетного
топлива
Тефлон называют «органической платиной». Перед ним
бессильны расплавленные щелочи, высокие температуры,
сильные кислоты, даже «Царская водка»
24.
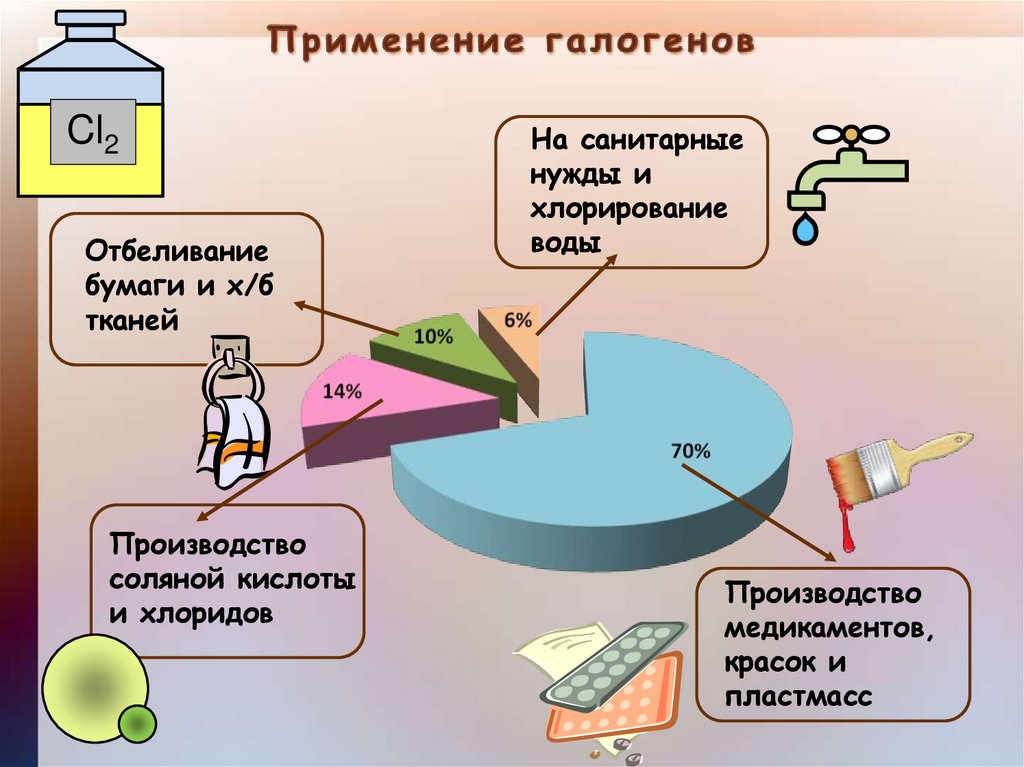
Cl2Отбеливание
бумаги и х/б
тканей
Производство
соляной кислоты
и хлоридов
На санитарные
нужды и
хлорирование
воды
Производство
медикаментов,
красок и
пластмасс
25.
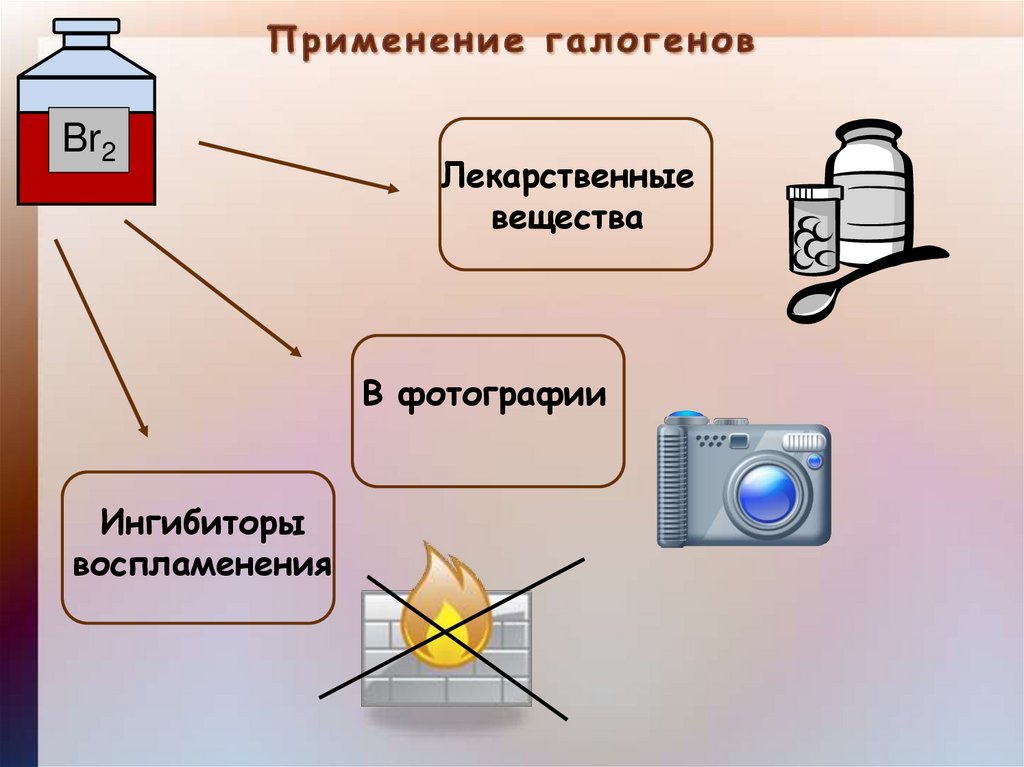
Br2Лекарственные
вещества
В фотографии
Ингибиторы
воспламенения
26.
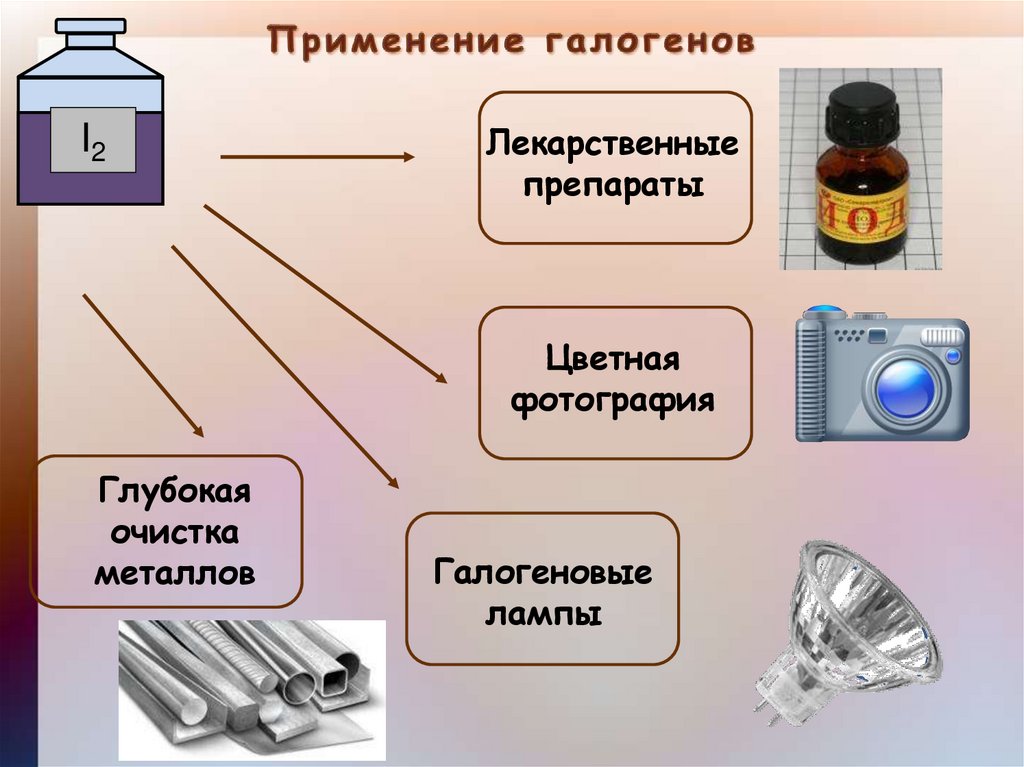
I2Лекарственные
препараты
Цветная
фотография
Глубокая
очистка
металлов
Галогеновые
лампы
27.
F2Фтор находится в организме во всех
органах и тканях.
Но наибольшее его количество содержится в
зубах, костях, волосах и ногтях.
Кости – своеобразное «депо» фтора.
Недостаток фтора –
один из факторов,
вызывающих
болезнь зубов –
кариес.
28.
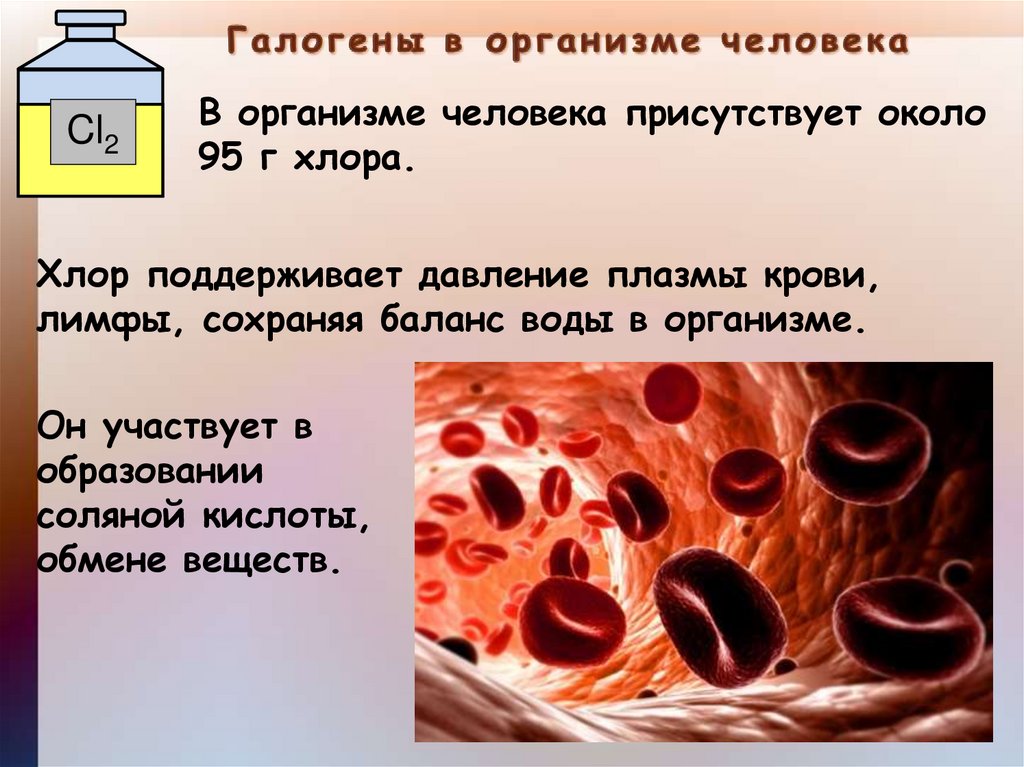
Cl2В организме человека присутствует около
95 г хлора.
Хлор поддерживает давление плазмы крови,
лимфы, сохраняя баланс воды в организме.
Он участвует в
образовании
соляной кислоты,
обмене веществ.
29.
Br2Содержание брома в организме человека
(масса тела 70 кг) составляет 260 мг.
Бром находится в крови, мозге, печени, почках.
Больше всего его в мозге человека.
Препараты брома
применяют при
заболеваниях нервной
системы: истерии,
неврастении и других
неврозах.
30.
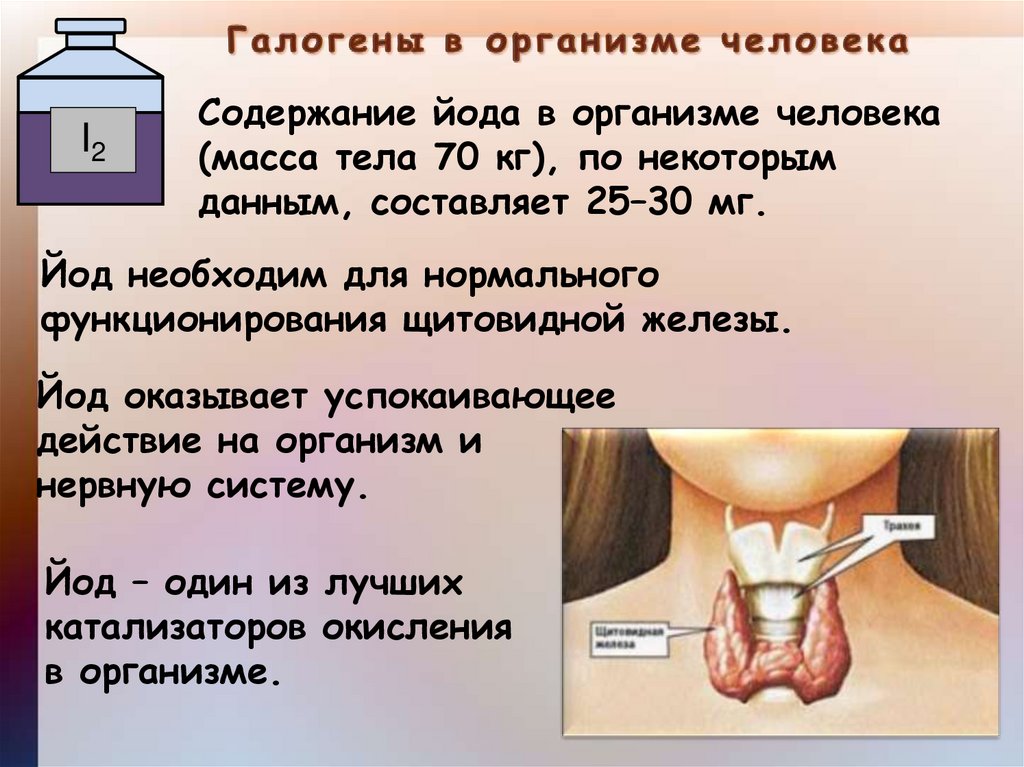
I2Содержание йода в организме человека
(масса тела 70 кг), по некоторым
данным, составляет 25–30 мг.
Йод необходим для нормального
функционирования щитовидной железы.
Йод оказывает успокаивающее
действие на организм и
нервную систему.
Йод – один из лучших
катализаторов окисления
в организме.























 Химия
Химия








