Похожие презентации:
АХ8 Расчет равновесий в растворах амфолитов
1. Важно!
Вывод упрощенных формул для расчета [H+] в растворах слабыхкислот и оснований был основан на допущении, что степень
диссоциации ≤ 5%.
По закону разбавления Оствальда: = √К/с
Следовательно К/с ≤ 0,052 ≤ 0,0025 или с/К ≥ 1/0,0025 ≥400
Т.е. если для растворов слабых протолитов выполняется
соотношение с/К ≥ 400, то [H+] и рН можно рассчитывать,
пользуясь приближенными формулами.
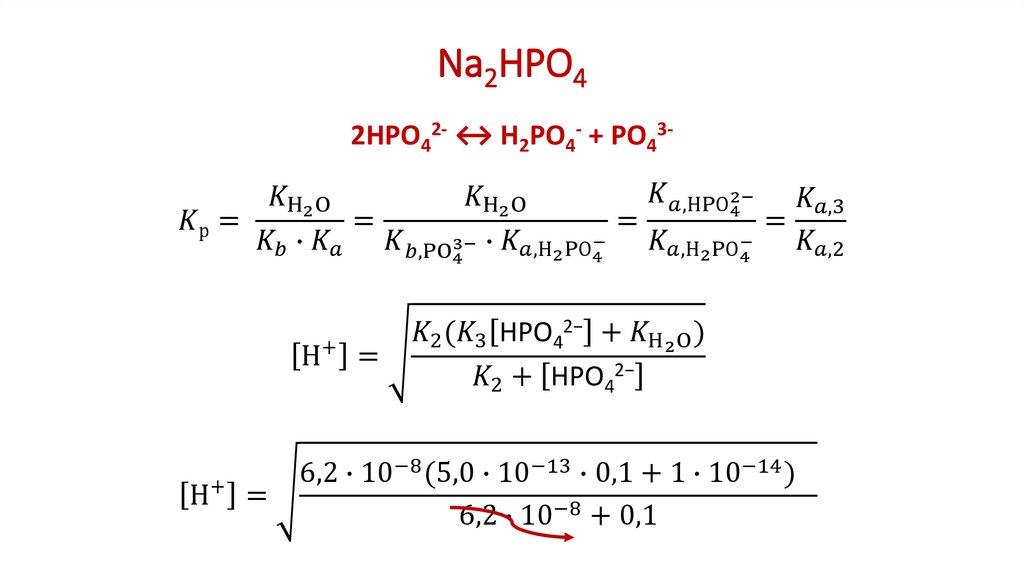
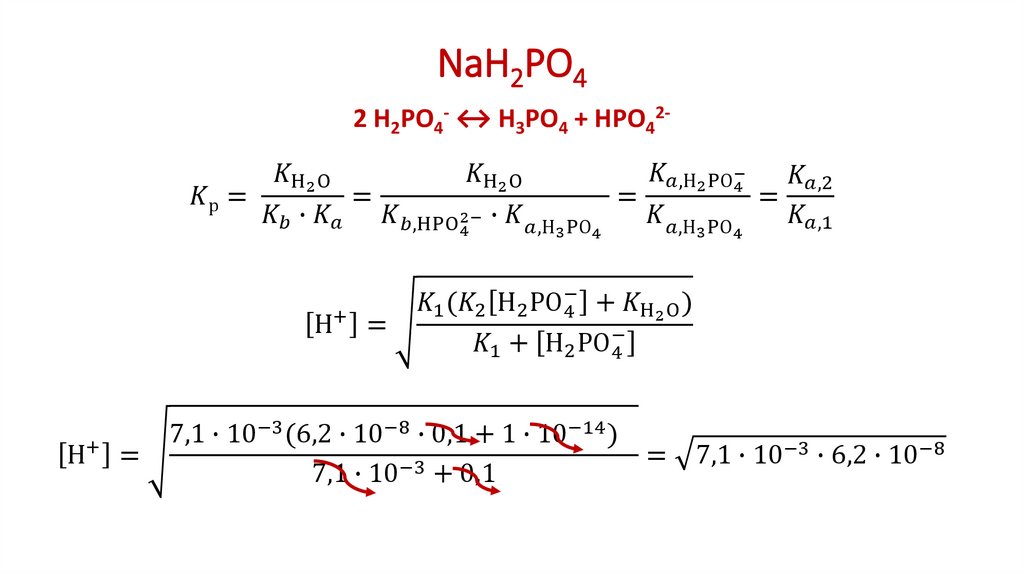
2. Расчет рН солей, образованных анионами слабых многопротонных кислот
В водных растворах таких солей, как например Na2CO3, Na3PO4, протолизаниона проходит ступенчато:
1-я ступень ─ Na3PO4 + H2O Na2HPO4 + NaOH
2-я ступень ─ Na2НPO4 + H2O NaH2PO4 + NaOH
3-я ступень ─ NaН2PO4 + H2O Н3PO4 + NaOH
Расчетные уравнения остаются прежними (как для солей
однопротонных кислот), но в них подставляют вместо КНА вторую (для
солей типа Na2CO3)
2
[H
][A
]
2К
2, Н2А
pН = 7 + ½ рКНСО3 + ½ lg c. А + Н2О НА + ОН
[HA ]
или третью (для солей типа Na3PO4)
[H ][A 3 ]
К3, Н3А
232[HA 2 ]
pН = 7 + ½ рКНРО4 + ½ lg c. А + Н2О НА + ОН
константу диссоциации кислоты, образующейся согласно уравнению 1-й
ступени протолиза соли:
3. Лекция 8
Расчет концентрации водородных ионов в растворах амфолитов:а) в растворах катионокислот и анионооснований
б) в растворах кислых солей
в) в растворах аминокислот
4. Реакции в растворах амфолитов
Амфолиты это соединения, в растворах которых сосуществуюткак протонодонорные, так и протоноакцепторные частицы.
К ним относятся:
1) «кислые» соли NaHCO3, NaH2PO4 и т.д.
2) соли катионокислот и анионооснований (NH4COOH, C6H5COONH4,
амфотерные гидроксиды или их основные соли ZnOHCl
3) аминокислоты, молекулы которых содержат как кислотную, так и
основную группы - глицин NH2CH2COOH.
При добавлении амфолита к воде он может действовать как
кислота или основание, а вода подвергаться самопроизвольной
ионизации.
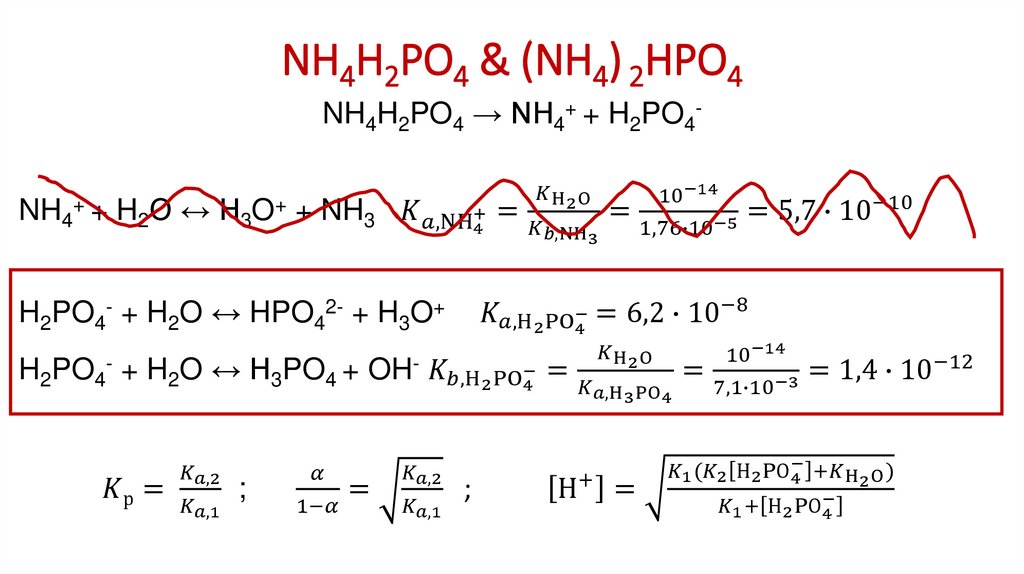
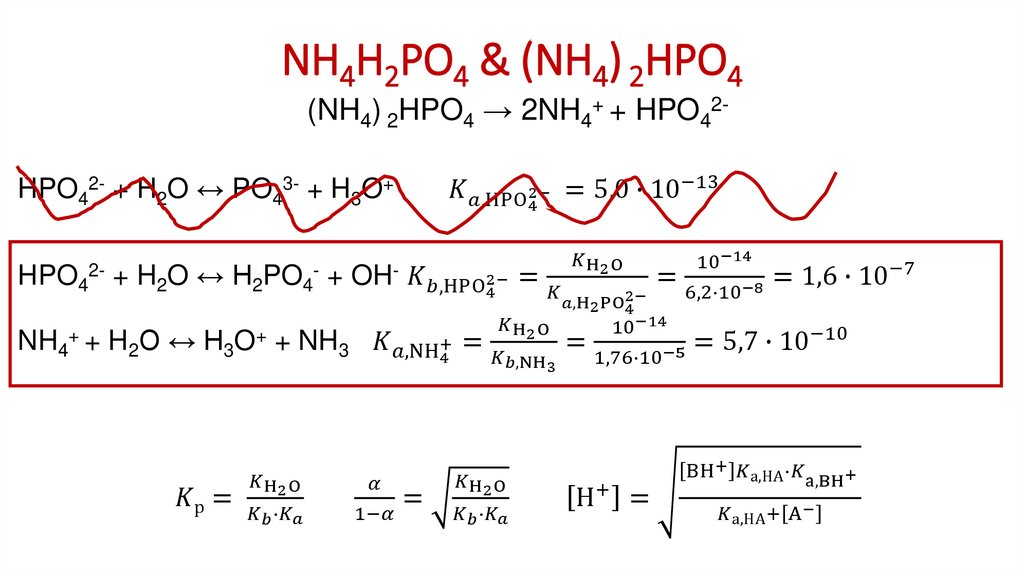
5. Соли катионокислот и анионооснований NH4COOH, C6H5COONH4, (NH4)2СО3 и т.д.
NH4COOH → NH4+ + НCOOНСОО- + Н2О ↔ НСООН + OHNH4+ + ОH- ↔ NH3 + H2O
_____________________
NH4+ + НСОО- ↔ НСООН + NH3
1. Как рассчитать константу такого равновесия?
2. Степень диссоциации катионокислот и анионооснований?
3. Какова кислотность среды в растворах таких солей?
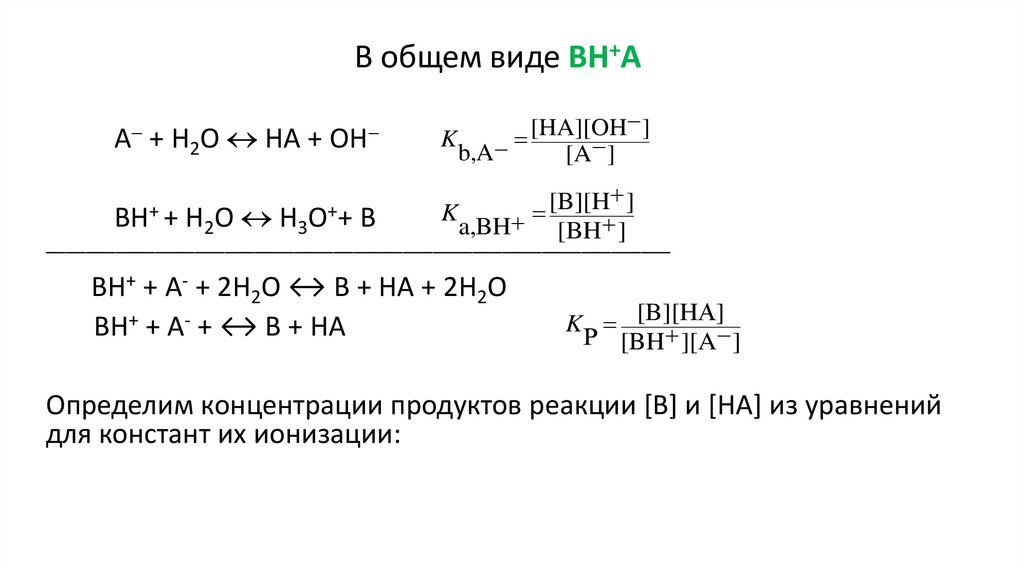
6.
В общем виде BH+AА + Н2О НА + ОН
]
[HA][OH
K
b,A
[A ]
]
[B][H
K
ВН+ + Н2О Н3О++ В
]
a,BH
[
BH
_______________________________________________________________
ВН+ + А- + 2Н2О ↔ В + НА + 2Н2О
ВН+ + А- + ↔ В + НА
]
K [B][HА
Р [BH ][A ]
Определим концентрации продуктов реакции [B] и [HA] из уравнений
для констант их ионизации:
7. - константа суммарного равновесия
]K [B][HА
Р [BH ][A ]
1.
- константа суммарного равновесия
В + Н2О ↔ ВН+ + ОН-
2. НА ↔ Н+ +А-
К [BH ][OH ]
b
[B]
][A-]
[H
Ка
[HA]
откуда
[B] [BH ][OH ]
K
b
][A- ]
[H
[HA]
Ка
откуда
Подставим найденные выражения для [B] и [HA] в уравнение для
константы равновесия:
BH+ OH− H+ [A−]









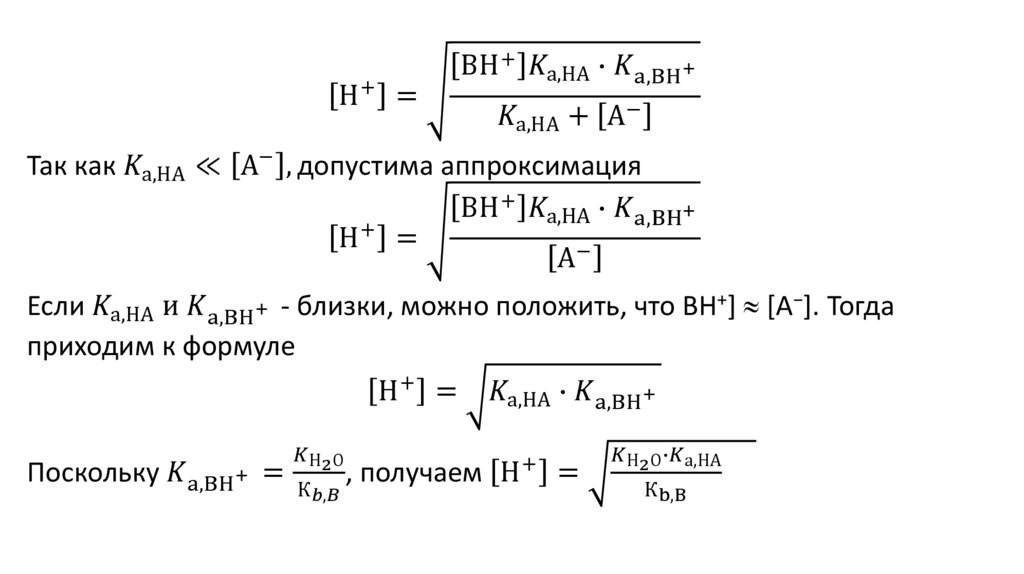
![[H^+ ]=√(〖(K_(Н_2 О) 〖∙K〗_(а,НА))/К_(b,B) 〗_ ) [H^+ ]=√(〖(K_(Н_2 О) 〖∙K〗_(а,НА))/К_(b,B) 〗_ )](https://cf5.ppt-online.org/files5/slide/j/jZnulwOsMcimqGH7fKvD4yNhatLTSB92xro5Y8/slide-11.jpg)



![[Н^+ ]^2 K_1=K_2 K_1 [〖НA〗^- ]-[Н^+ ]^2 [〖НA〗^- ]+K_(H_2 O) K_1 [Н^+ ]^2 K_1=K_2 K_1 [〖НA〗^- ]-[Н^+ ]^2 [〖НA〗^- ]+K_(H_2 O) K_1](https://cf5.ppt-online.org/files5/slide/j/jZnulwOsMcimqGH7fKvD4yNhatLTSB92xro5Y8/slide-15.jpg)

![〖[Н^+ ]=√(〖K_1 K〗_2 ) 〗_ 〖[Н^+ ]=√(〖K_1 K〗_2 ) 〗_](https://cf5.ppt-online.org/files5/slide/j/jZnulwOsMcimqGH7fKvD4yNhatLTSB92xro5Y8/slide-17.jpg)








 Химия
Химия








