Похожие презентации:
Л5 Моносахариды
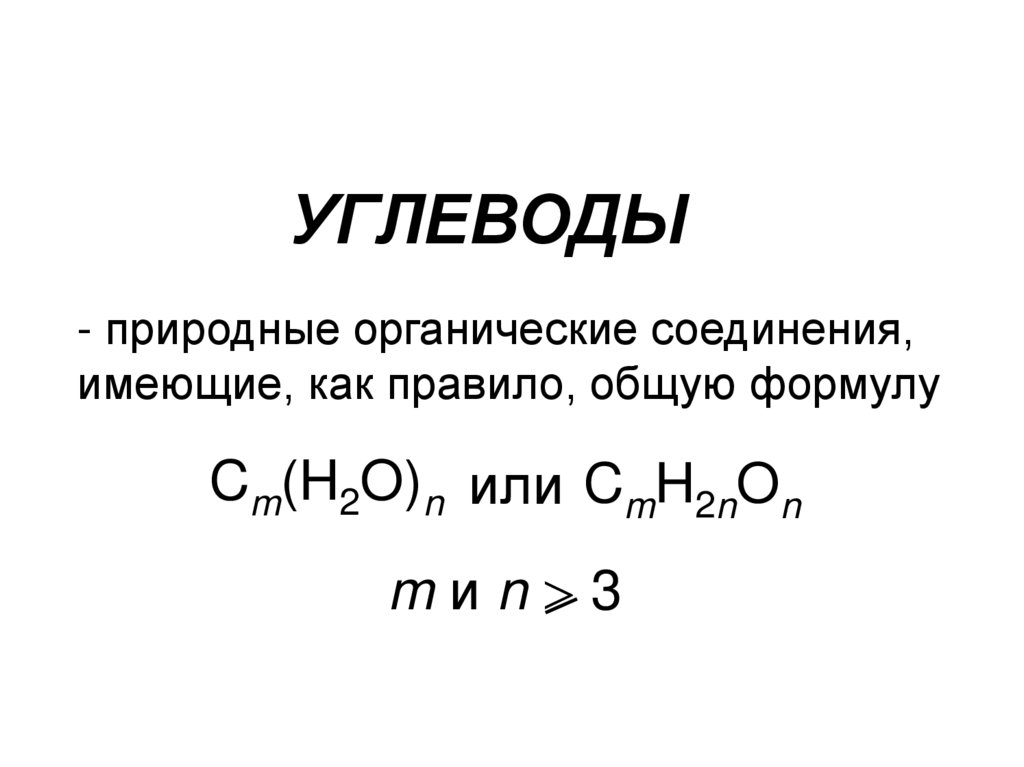
1. УГЛЕВОДЫ
- природные органические соединения,имеющие, как правило, общую формулу
Cm(H2O)n или CmH2nOn
mиn 3
2.
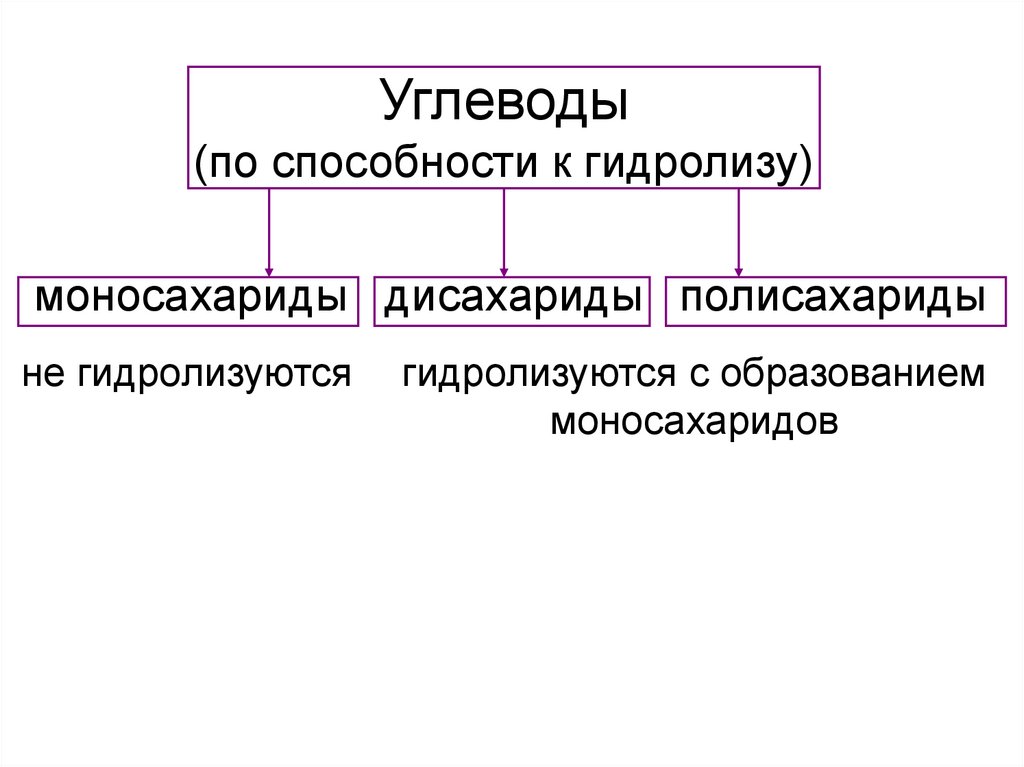
Углеводы(по способности к гидролизу)
моносахариды дисахариды полисахариды
не гидролизуются
гидролизуются с образованием
моносахаридов
3.
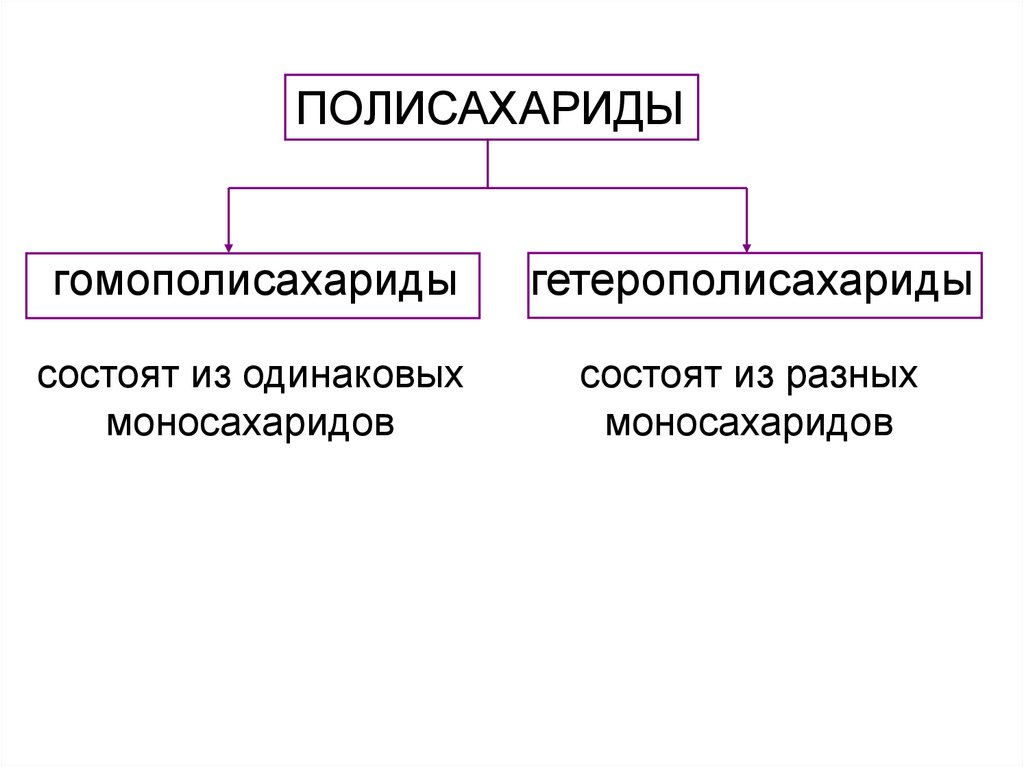
ПОЛИСАХАРИДЫгомополисахариды
гетерополисахариды
состоят из одинаковых
моносахаридов
состоят из разных
моносахаридов
4.
МОНОСАХАРИДЫ- гетерофункциональные соединения,
содержащие карбонильную и
гидроксильные группы
Общая формула: CnH2nOn
5.
Классификацияа) по числу углеродных атомов
С3Н6О3 – триозы
С4Н8О4 – тетрозы
С5Н10О5 – пентозы
С6Н12О6 – гексозы
…
С10Н20О10 – декозы
6.
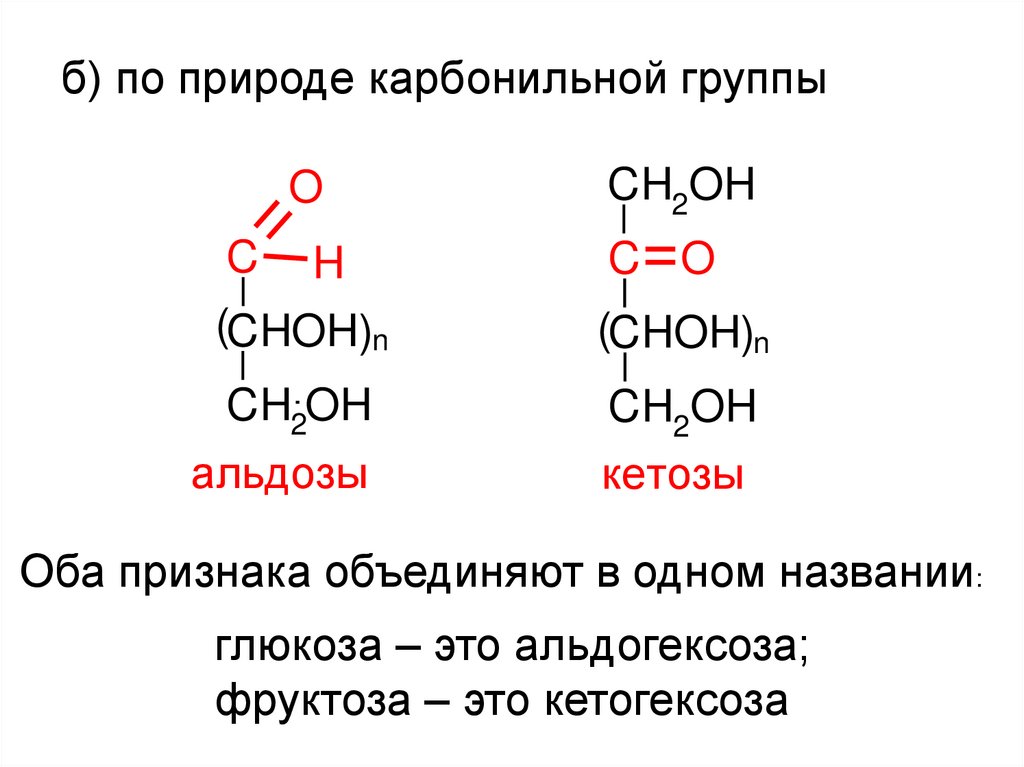
б) по природе карбонильной группыO
CH2OH
H
C O
(CHOH)n
(CHOH)n
CH2OH
CH2OH
альдозы
кетозы
C
Оба признака объединяют в одном названии:
глюкоза – это альдогексоза;
фруктоза – это кетогексоза
7.
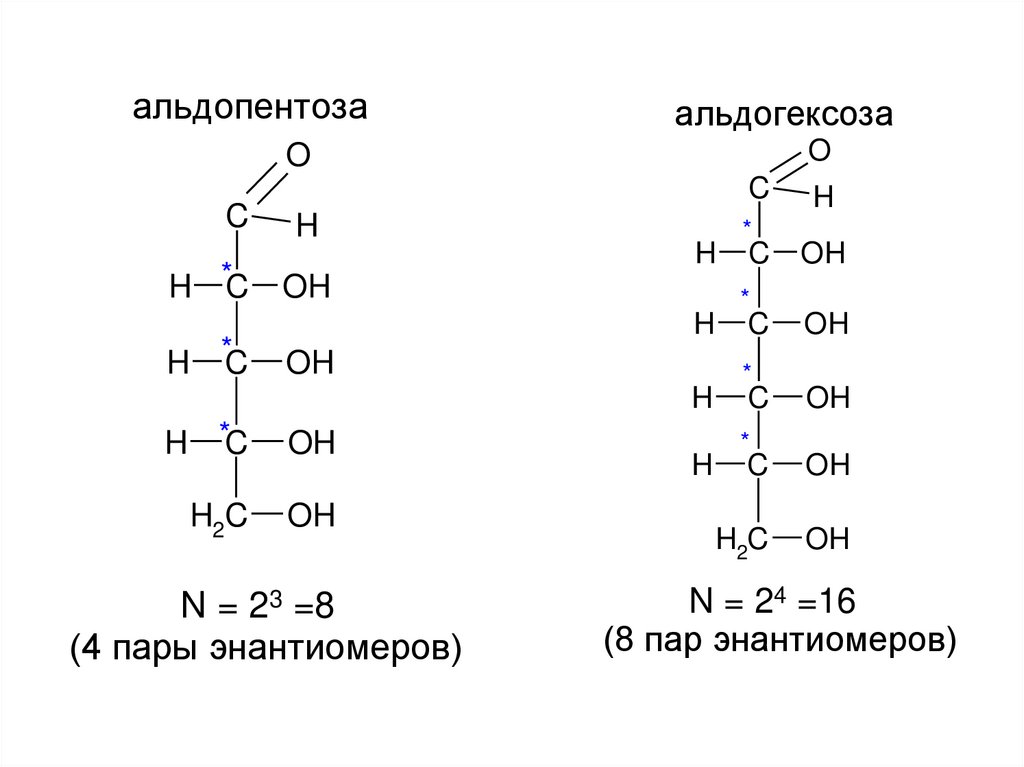
ИзомерияПространственная (стереоизомерия):
Оптическая (зеркальная) изомерия
связана с наличием у моносахаридов
асимметричных атомов углерода (С*).
Число пространственных изомеров
(стереоизомеров) определяется
по формуле: N = 2n ,где n– число С*
8.
альдопентозаальдогексоза
O
O
C
H *C
H *C
C
H
H
OH
OH
H
OH
H2C
OH
N = 23 =8
(4 пары энантиомеров)
C
OH
*
H
H *C
*
H
H
C
*
C
*
OH
OH
C
OH
H2C
OH
N = 24 =16
(8 пар энантиомеров)
9.
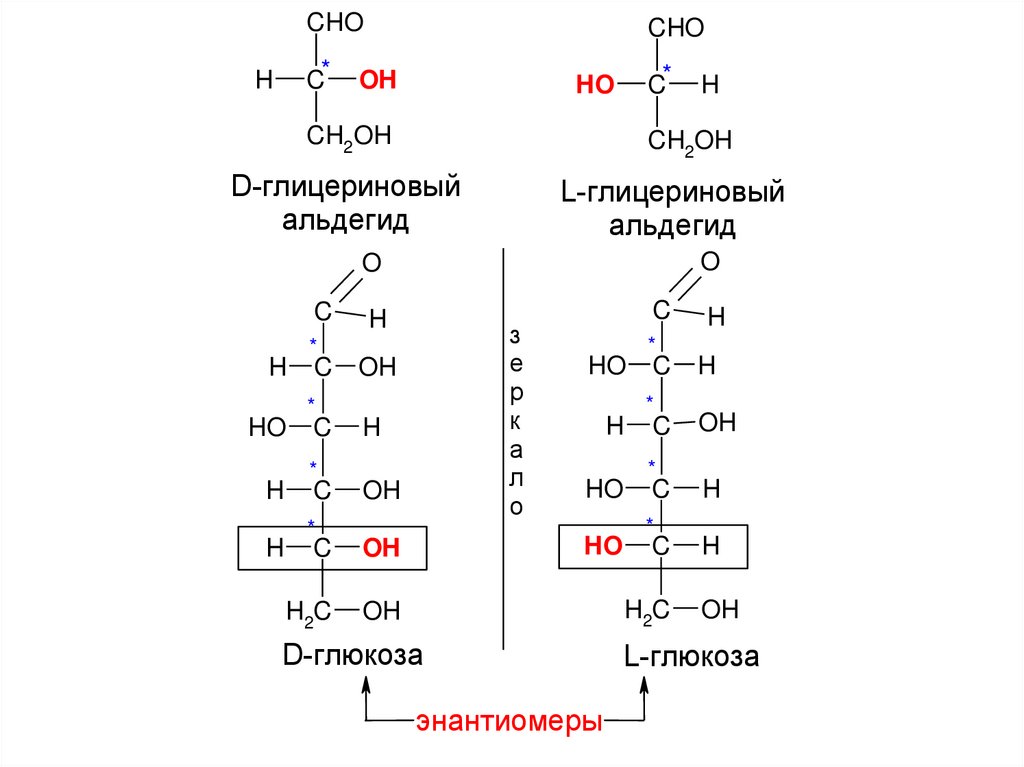
Пара энантиомеров имеет индивидуальноеназвание, с обозначением конфигурации
(D или L) для каждого вещества.
Конфигурация моносахаридов определяется
по конфигурационному стандарту Розанова
- глицериновому альдегиду.
При этом для сравнения берется последний
асимметричный атом углерода.
Большинство природных моносахаридов
относится к D-ряду (исключения: L-рамноза,
L-арабиноза).
10.
CHOC*
H
CHO
OH
C*
HO
H
CH2OH
CH2OH
D-глицериновый
альдегид
L-глицериновый
альдегид
O
O
C
H
*
C
H
з
е
р
к
а
л
о
OH
*
HO
H
H
C
*
C
*
H
OH
C
OH
H2C
OH
C
HO
*
C
*
H
HO
HO
D-глюкоза
энантиомеры
C
*
C
*
H
H
OH
H
C
H
H2C
OH
L-глюкоза
11.
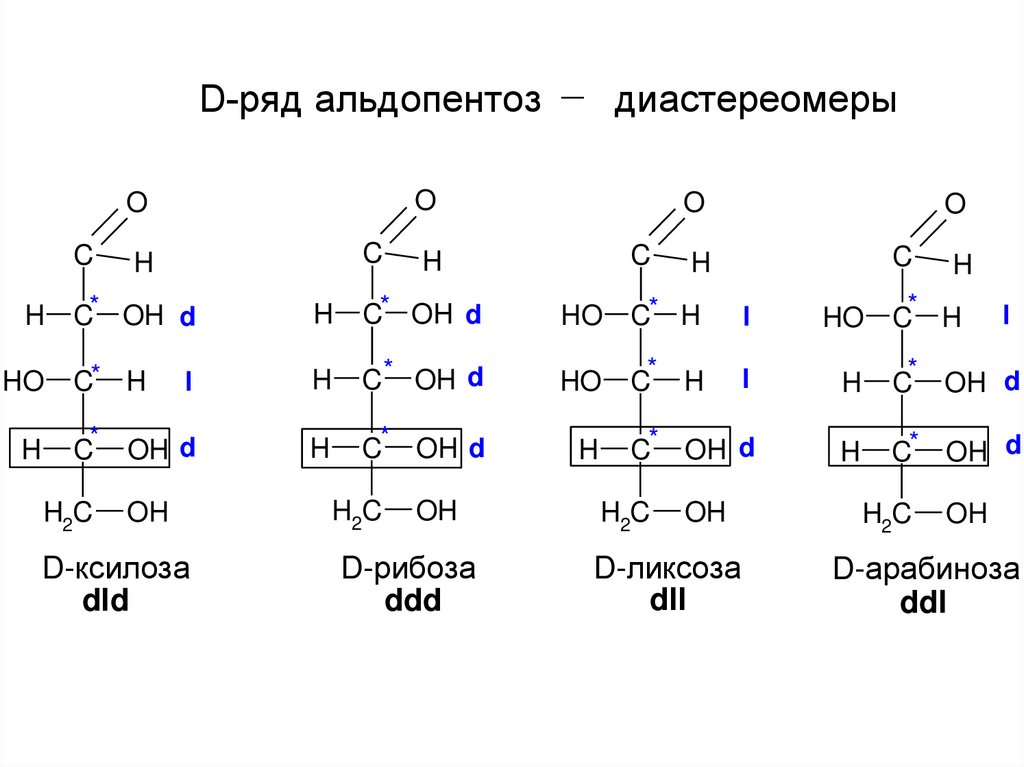
Стереоизомеры, относящиеся к одному ряду(D или L), но отличающиеся конфигурацией
одного или нескольких асимметричных
атомов углерода, называются диастереомерами.
Перечисление конфигураций асимметричных
атомов углерода производят снизу вверх.
12.
D-ряд альдопентозO
O
C
диастереомеры
C
H
O
H
C
O
C
H
H
HO C* H
C* OH d
H
C* OH d
HO C* H
l
HO
C* H
l
H
C* OH d
HO
C* H
l
H
*
C OH d
H
C* OH d
H
C* OH d
H
C* OH d
H
C* OH d
H
H2C
OH
D-ксилоза
dld
H2C
OH
D-рибоза
ddd
H2C
OH
D-ликсоза
dll
H2C
l
OH
D-арабиноза
ddl
13.
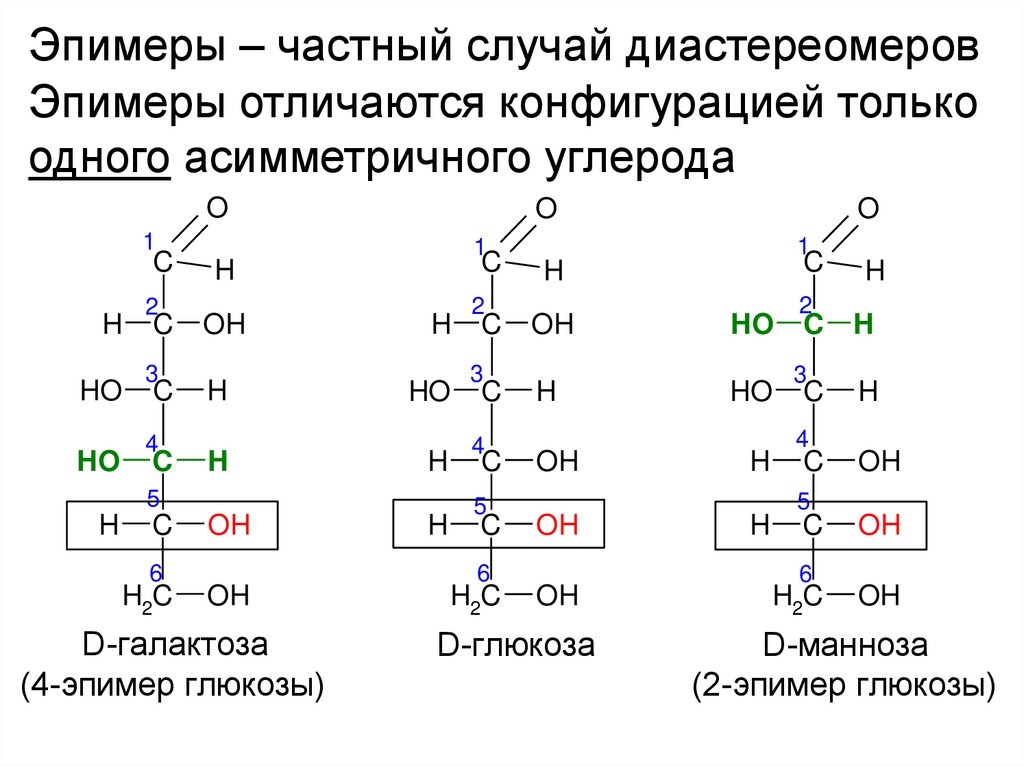
Эпимеры – частный случай диастереомеровЭпимеры отличаются конфигурацией только
одного асимметричного углерода
O
O
1
C
H
HO
HO
2
C
3
C
4
C
1
C
H
OH
H
H
HO
H
H
5
H
C
6
H2C
OH
OH
D-галактоза
(4-эпимер глюкозы)
H
2
C
3
C
4
C
5
C
6
H2C
O
1
C
H
OH
HO
H
HO
OH
H
2
C
3
C
4
C
H
H
H
OH
5
OH
OH
D-глюкоза
H
C
6
H2C
OH
OH
D-манноза
(2-эпимер глюкозы)
14.
Структурная изомерия:цикло-оксо (кольчато-цепная) таутомерия
В твердом состоянии моносахариды
существуют в циклической форме.
В растворе моносахариды находятся
в виде равновесной смеси таутомеров
- открытой и циклических форм.
Циклическая форма моносахаридов –
внутренний полуацеталь.
15.
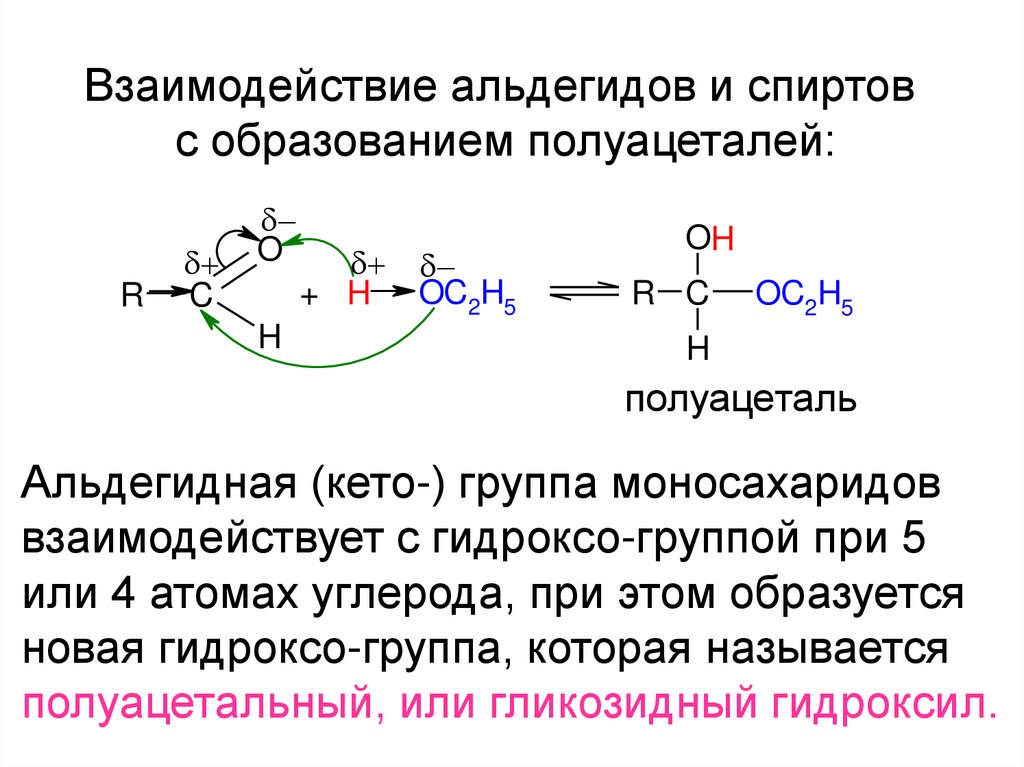
Взаимодействие альдегидов и спиртовс образованием полуацеталей:
R
C
O
H
+ H OC2H5
OH
R C
OC2H5
H
полуацеталь
Альдегидная (кето-) группа моносахаридов
взаимодействует с гидроксо-группой при 5
или 4 атомах углерода, при этом образуется
новая гидроксо-группа, которая называется
полуацетальный, или гликозидный гидроксил.
16.
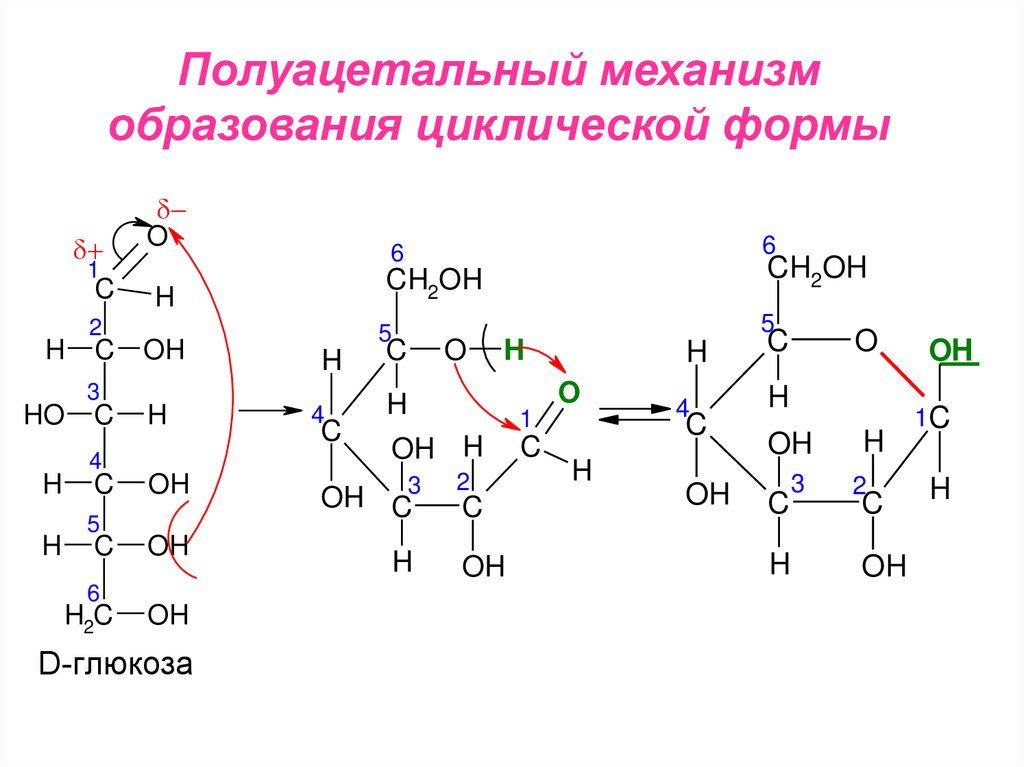
Полуацетальный механизмобразования циклической формы
1
C
H
2
C
O
H
OH
H
H
C
4
C
5
C
6
H2C
H
OH
OH
OH
D-глюкоза
CH2OH
CH2OH
5
5
H
C
4
H
1
OH H
C
3
HO
6
6
C
O
H
O
3
2
H
OH
OH C
C
H
C
4
H
C
H
OH
O
OH
H
3
2
C
H
C
OH
OH
1C
H
17.
В результате внутримолекулярноговзаимодействия карбонильной и гидроксогрупп образуются пятичленные циклы –
фуранозные и шестичленные – пиранозные.
В циклических формах моносахаридов возникает
дополнительный асимметричный атом углерода,
с которым связан гликозидный гидроксил.
Это обуславливает существование еще двух
стереоизомеров – α- и β-аномеров.
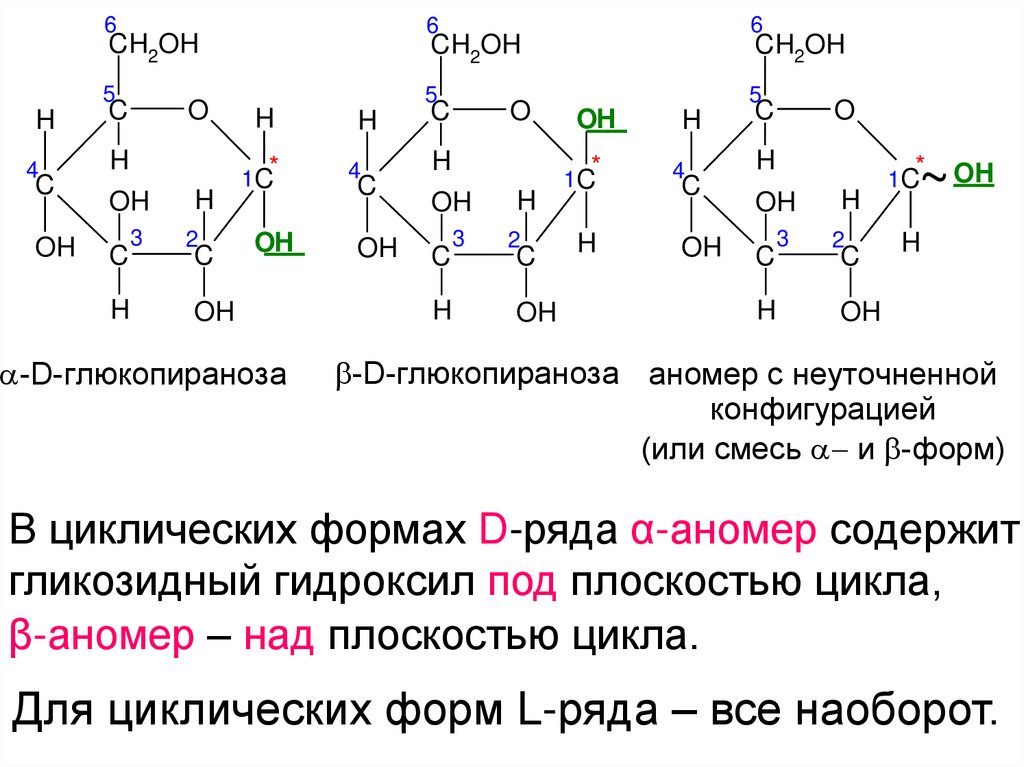
18.
65
H
C
4
H
C
OH
O
OH
H
3
2
C
H
C
6
6
CH2OH
CH2OH
CH2OH
5
H
H
C
1C*
4
H
OH
OH
OH
-D-глюкопираноза
C
O
OH
H
3
2
C
H
C
OH
5
OH
H
C
1C
*
4
H
H
OH
C
O
*
OH
H
3
2
C
H
C
~ OH
1C
H
OH
-D-глюкопираноза аномер с неуточненной
конфигурацией
(или смесь и -форм)
В циклических формах D-ряда α-аномер содержит
гликозидный гидроксил под плоскостью цикла,
β-аномер – над плоскостью цикла.
Для циклических форм L-ряда – все наоборот.
19.
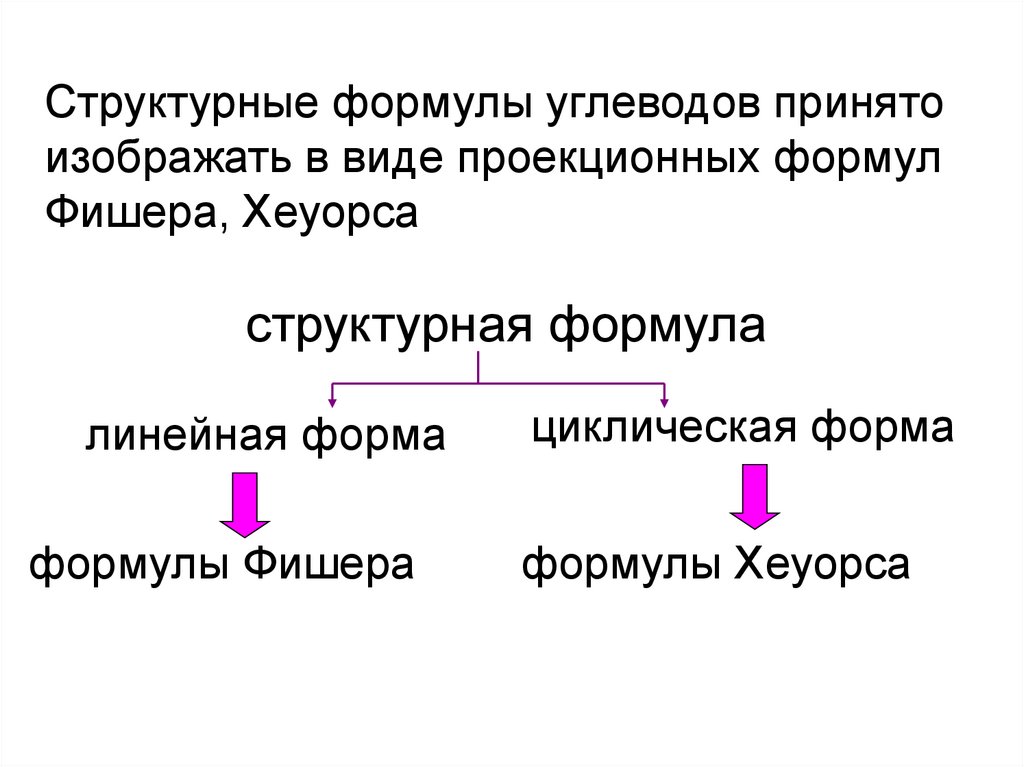
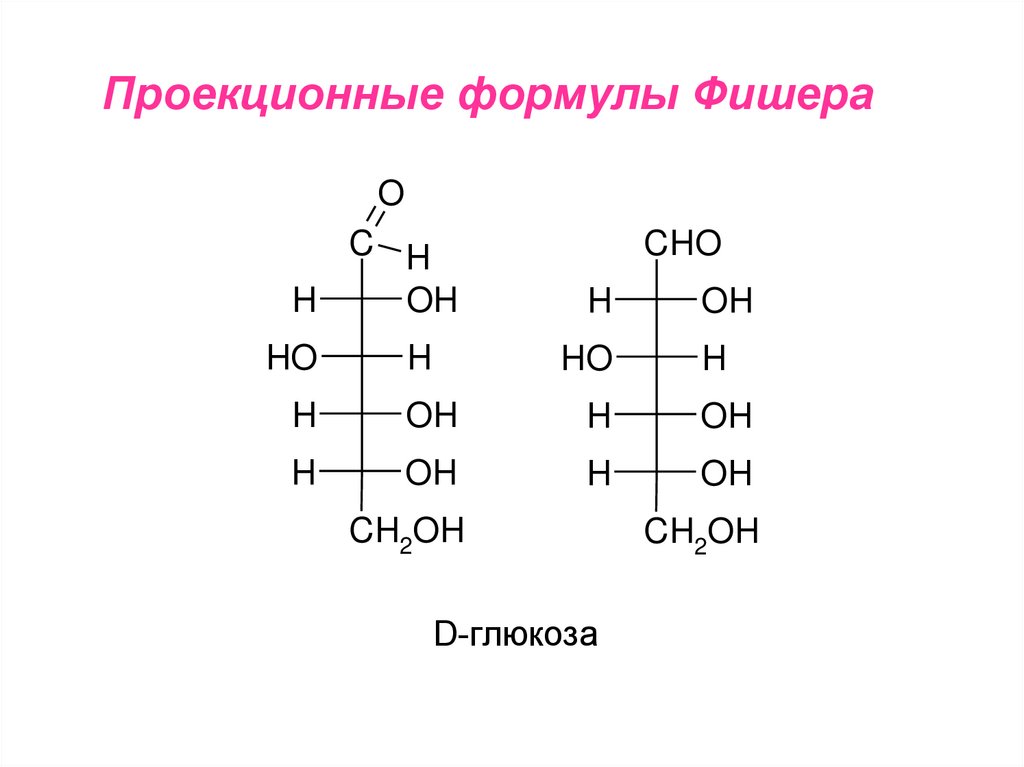
Структурные формулы углеводов принятоизображать в виде проекционных формул
Фишера, Хеуорса
структурная формула
линейная форма
формулы Фишера
циклическая форма
формулы Хеуорса
20.
Проекционные формулы ФишераO
C H
H
OH
CHO
H
OH
HO
H
HO
H
H
OH
H
OH
H
OH
H
OH
CH2OH
D-глюкоза
CH2OH
21.
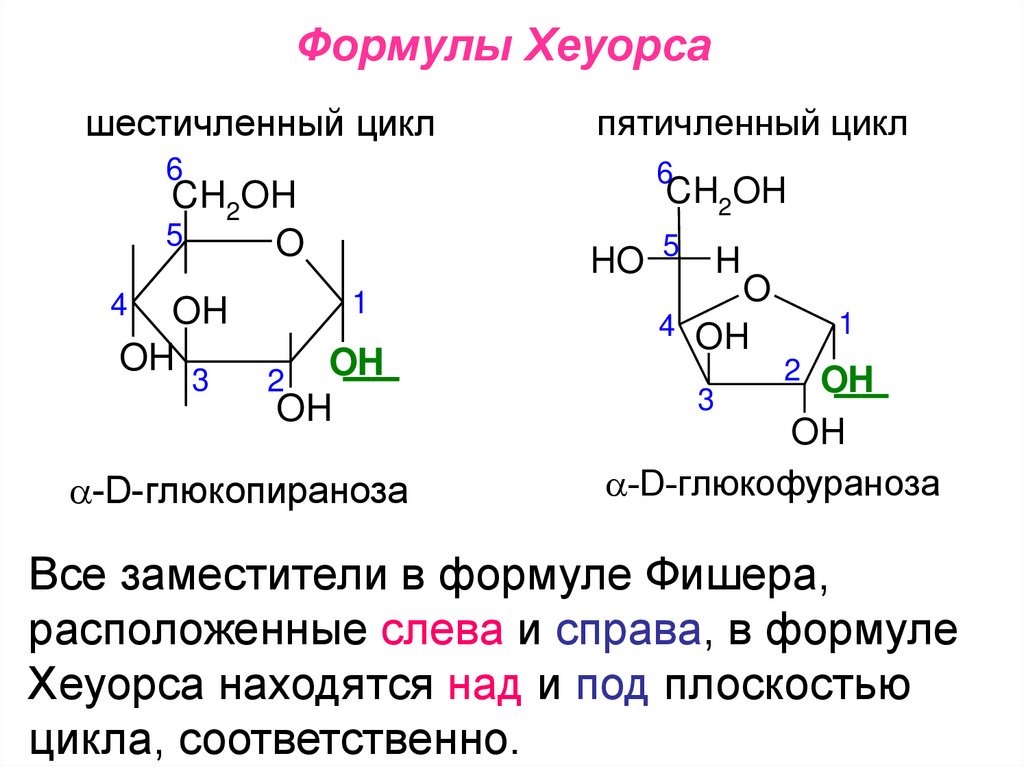
Формулы Хеуорсашестичленный цикл
6
6
CH2OH
CH2OH
5
O
OH
OH
3
HO 5 H
1
4
пятичленный цикл
OH
OH
2
-D-глюкопираноза
O
4 OH
3
1
2 OH
OH
-D-глюкофураноза
Все заместители в формуле Фишера,
расположенные слева и справа, в формуле
Хеуорса находятся над и под плоскостью
цикла, соответственно.
22.
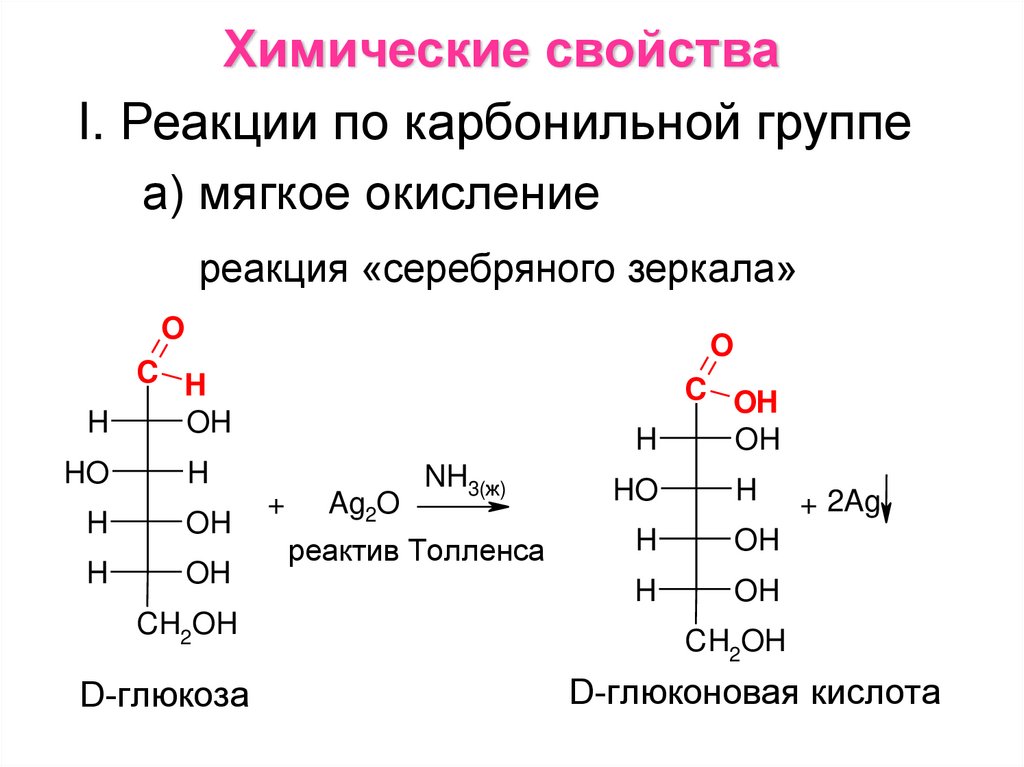
Химические свойстваI. Реакции по карбонильной группе
а) мягкое окисление
реакция «серебряного зеркала»
O
O
C H
H
OH
HO
C OH
H
OH
H
H
OH
H
OH
CH2OH
D-глюкоза
+
Ag2O
NH3(ж)
реактив Толленса
HO
H
H
OH
H
OH
+ 2Ag
CH2OH
D-глюконовая кислота
23.
OO
C H
H
OH
HO
C OH
H
OH
H
H
OH
H
OH
CH2OH
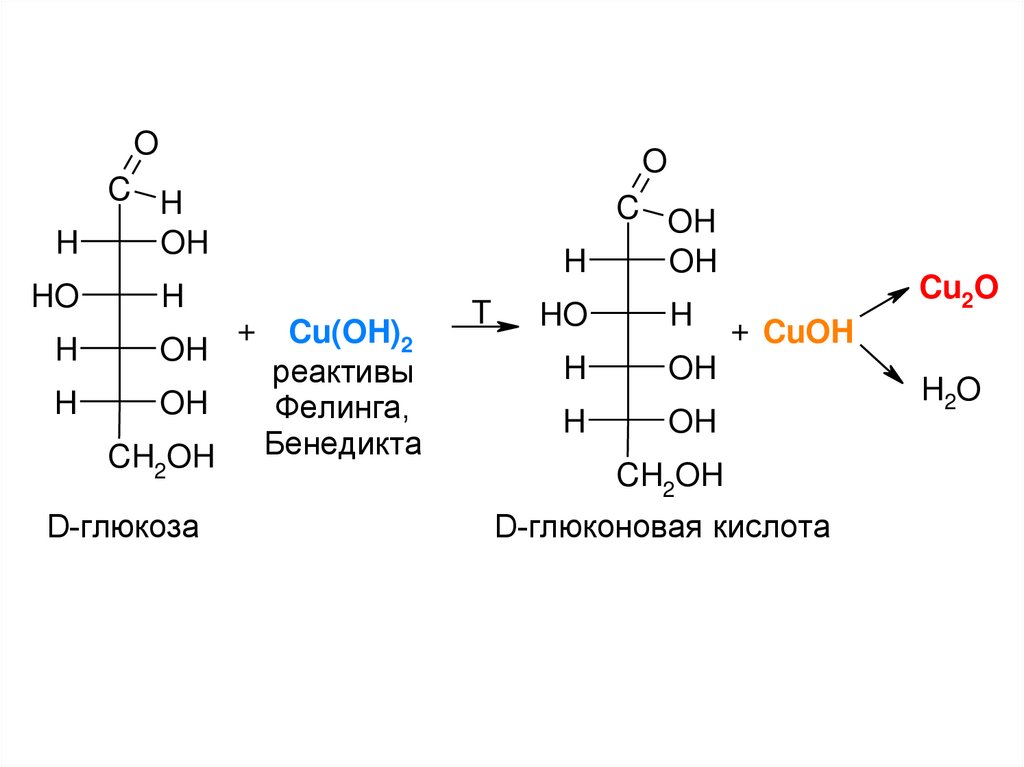
D-глюкоза
+
Cu(OH)2
реактивы
Фелинга,
Бенедикта
T
HO
H
H
OH
H
OH
Cu2O
+ CuOH
CH2OH
D-глюконовая кислота
H2O
24.
OO
C H
H
OH
HO
H
H
OH
H
OH
CH2OH
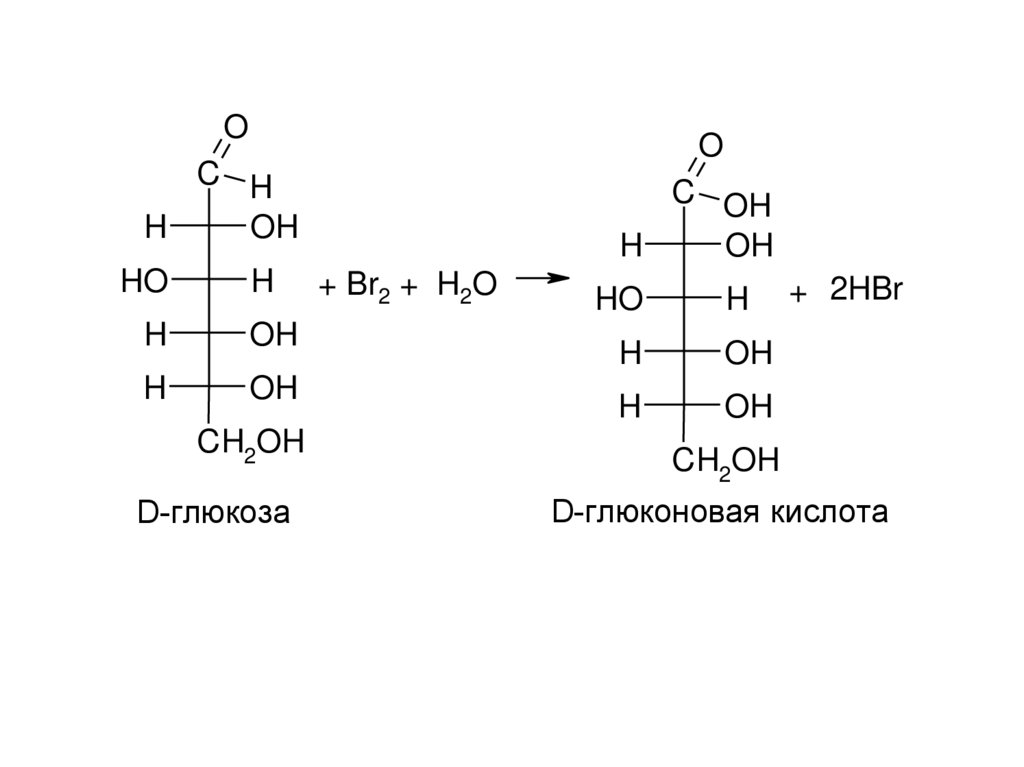
D-глюкоза
C OH
H
OH
+ Br2 + H2O
HO
H
H
OH
H
OH
+ 2HBr
CH2OH
D-глюконовая кислота
25.
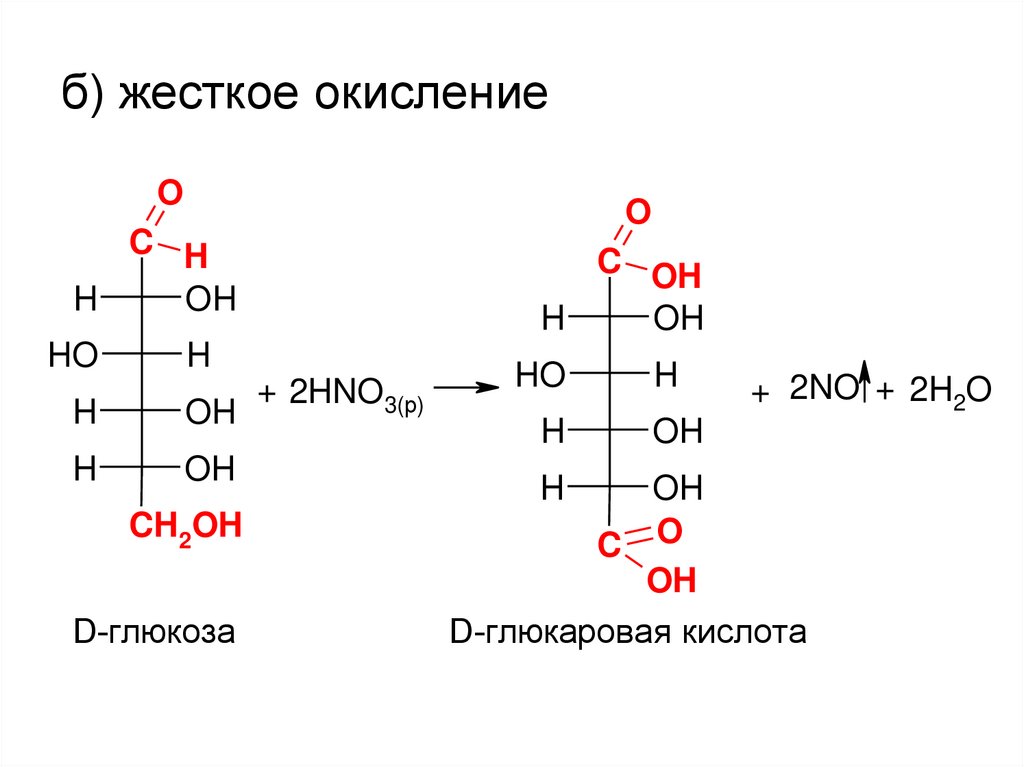
б) жесткое окислениеO
O
C H
H
OH
HO
C OH
H
OH
H
H
OH
H
OH
CH2OH
D-глюкоза
+ 2HNO3(р)
HO
H
H
OH
H
+ 2NO + 2H2O
OH
C O
OH
D-глюкаровая кислота
26.
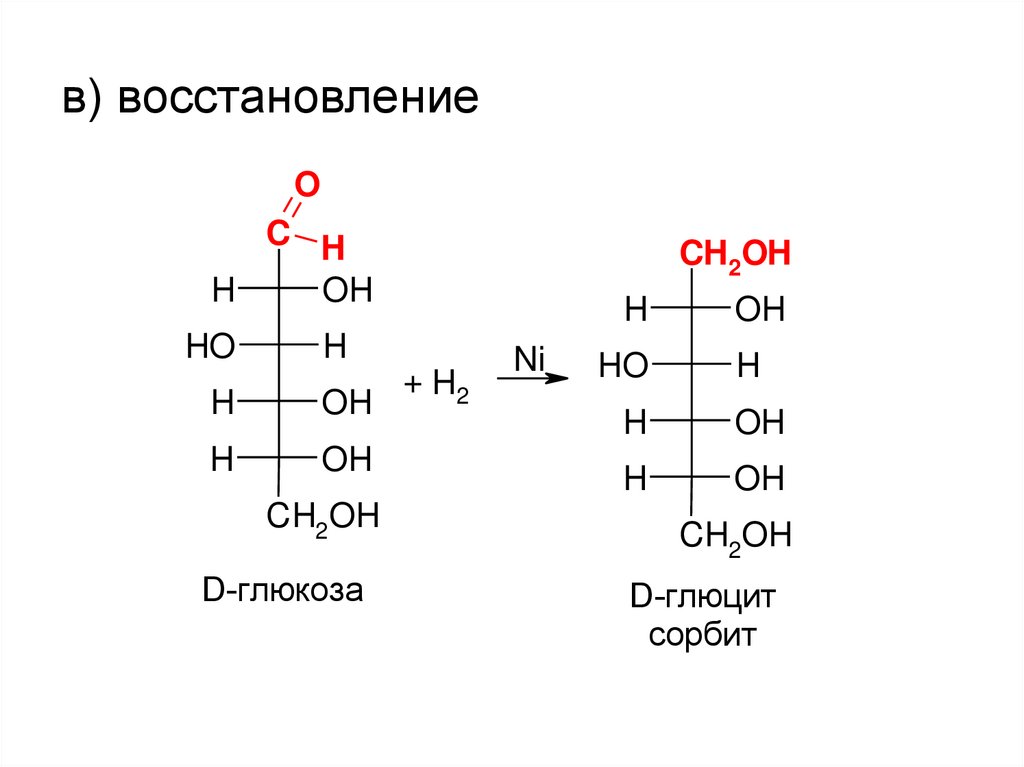
в) восстановлениеO
C H
H
OH
HO
CH2OH
H
H
OH
H
OH
CH2OH
D-глюкоза
+ H2
Ni
H
OH
HO
H
H
OH
H
OH
CH2OH
D-глюцит
сорбит
27.
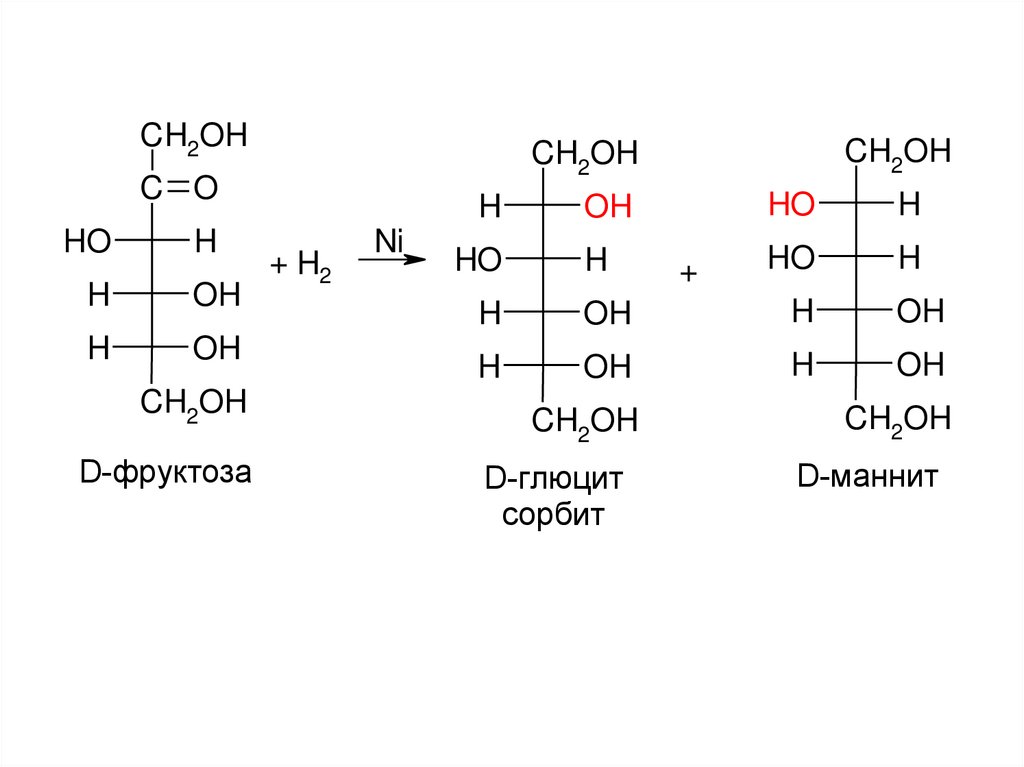
CH2OHC O
HO
H
H
OH
H
OH
CH2OH
D-фруктоза
CH2OH
CH2OH
+ H2
Ni
HO
H
HO
H
OH
H
OH
OH
H
OH
H
OH
HO
H
H
H
+
CH2OH
CH2OH
D-глюцит
сорбит
D-маннит
28.
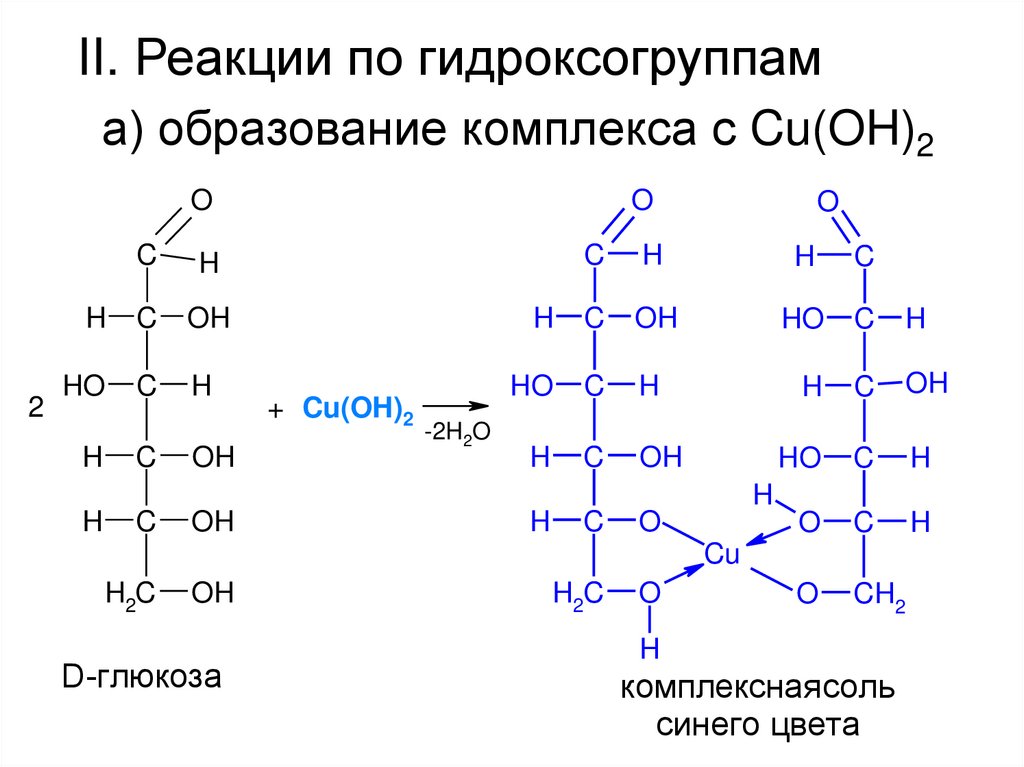
II. Реакции по гидроксогруппама) образование комплекса с Cu(OH)2
O
2
C
H
H
C
OH
HO
C
H
H
H
C
C
OH
OH
O
+ Cu(OH)2
-2H2O
O
C
H
H
C
H
C
OH
HO
C
H
HO
C
H
H
C
OH
H
C
OH
HO
C
H
O
C
H
O
CH2
H
C
H
O
Cu
H2C
OH
D-глюкоза
H2C
O
H
комплекснаясоль
синего цвета
29.
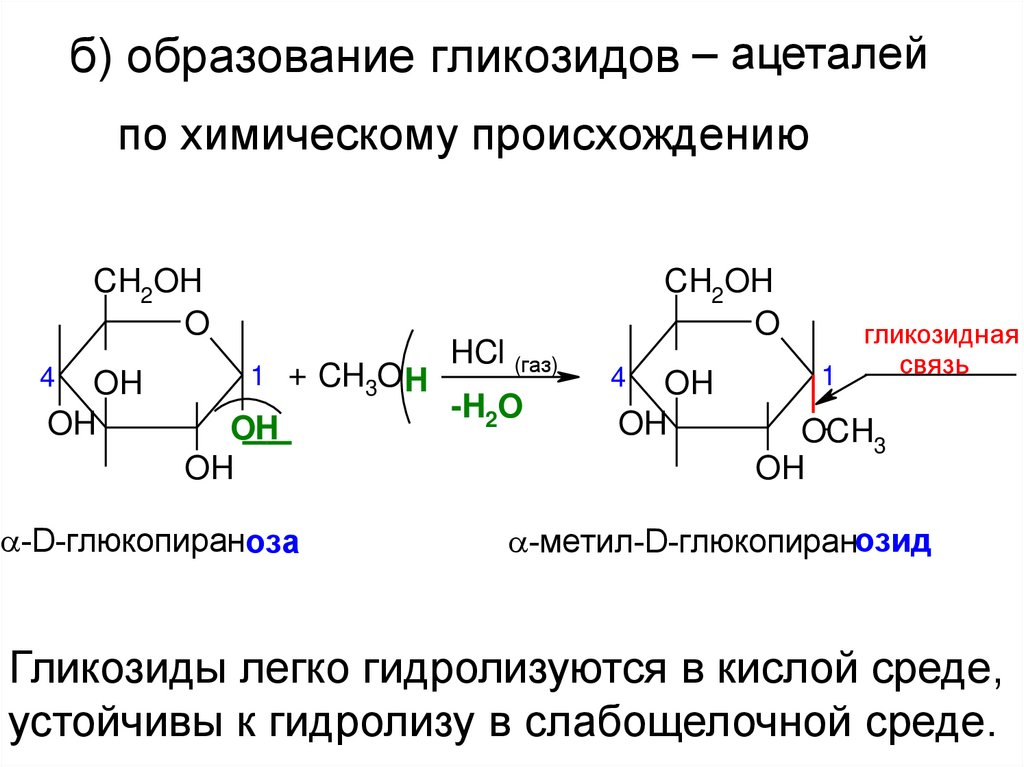
б) образование гликозидов – ацеталейпо химическому происхождению
CH2OH
O
4
OH
OH
1 + CH3O H
OH
OH
-D-глюкопираноза
HCl (газ)
-H2O
CH2OH
O
4
OH
OH
1
гликозидная
связь
OCH3
OH
-метил-D-глюкопиранозид
Гликозиды легко гидролизуются в кислой среде,
устойчивы к гидролизу в слабощелочной среде.
30.
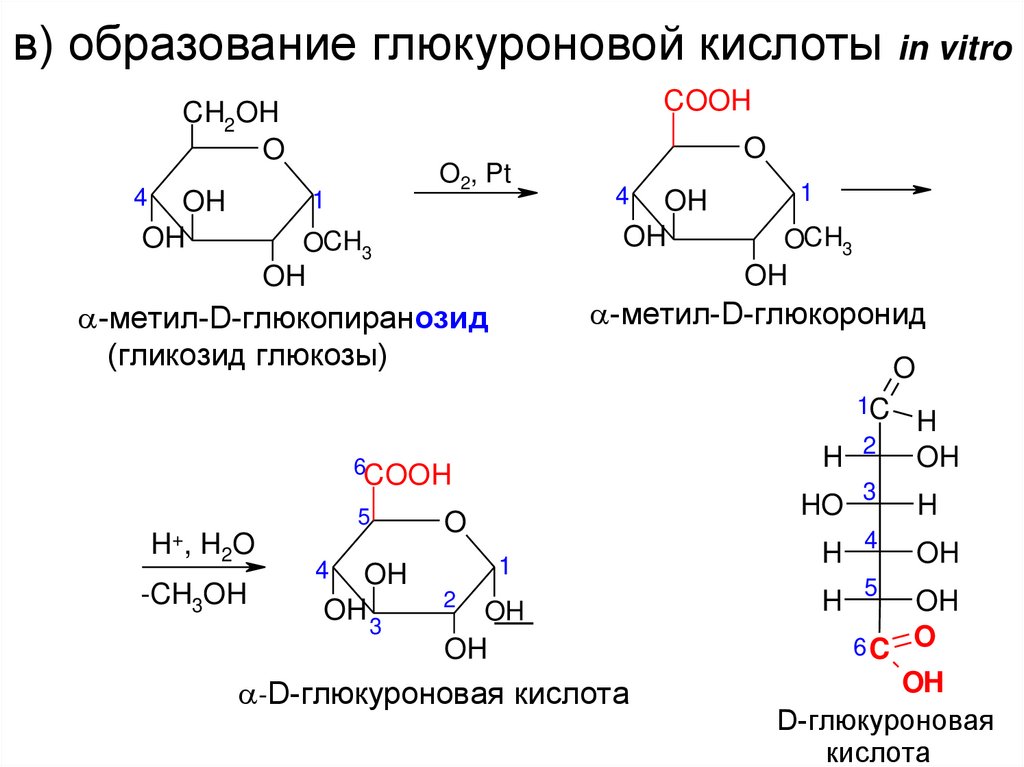
в) образование глюкуроновой кислоты in vitroCOOH
CH2 OH
O
4
O2, Pt
1
OH
OH
OCH3
O
1
4
OH
OH
OCH3
OH
OH
-метил-D-глюкопиранозид
(гликозид глюкозы)
-метил-D-глюкоронид
O
1C
H 2
6COOH
5
H+, H2O
-CH3OH
HO
O
1
H 4
OH
H
4
OH
OH 3
2
3
OH
-D-глюкуроновая кислота
5
H
OH
H
OH
OH
6C O
OH
D-глюкуроновая
кислота
31.
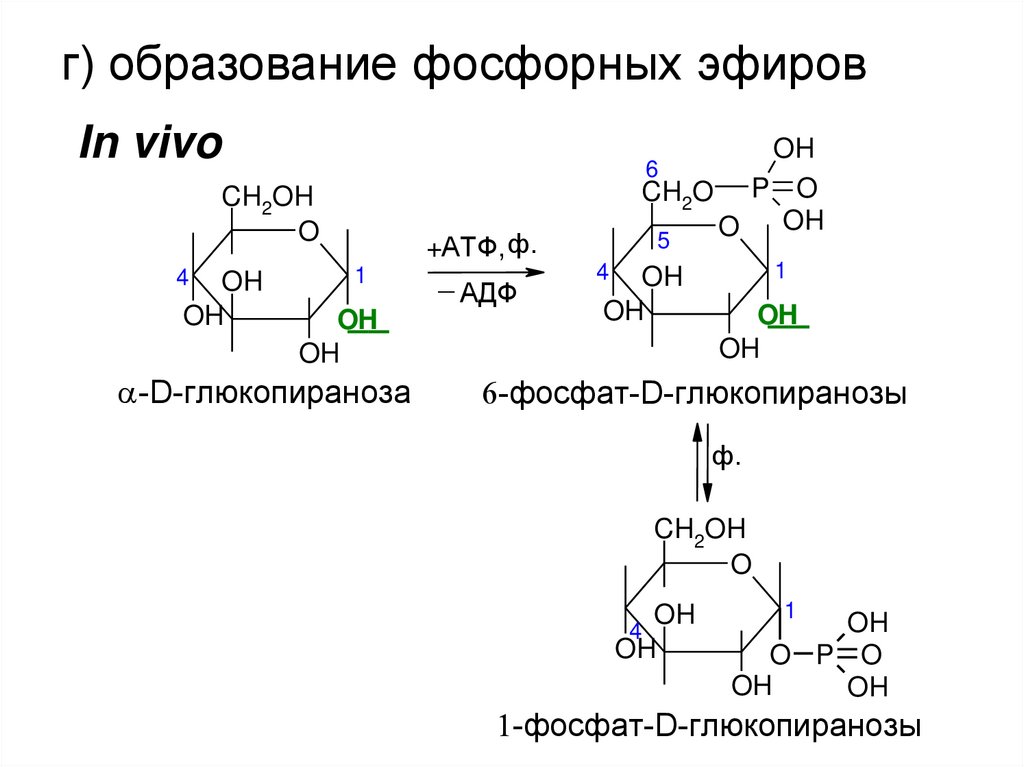
г) образование фосфорных эфировIn vivo
CH2OH
O
4
OH
OH
1
OH
OH
-D-глюкопираноза
+АТФ, ф.
_
АДФ
OH
6
CH2O P O
OH
O
5
1
4
OH
OH
OH
OH
-фосфат-D-глюкопиранозы
ф.
CH2OH
O
OH
4
OH
1
OH
O P O
OH
OH
-фосфат-D-глюкопиранозы
32.
Биологическое значение моносахаридов• Моносахариды (глюкоза, фруктоза, галактоза) –
важнейший источник энергии для организма
(около 500 г/сут). Широко распространены в
природе в форме разнообразных полисахаридов.
• Используются in vivo для синтеза гликогена,
структурных полисахаридов, жиров, холестерина,
и др.
• Рибоза и 2-дезоксирибоза необходимы для
биосинтеза нуклеотидов и нуклеиновых кислот.
• Глюкуроновая кислота необходима для
обезвреживания и выведения ксенобиотиков из
организма.
• Входят в состав лекарств: глюкоза, глюконат
кальция.
33.
Особая роль D-глюкозы• Универсальное питательное вещество для любых
клеток.
• Используется клетками как в энергетических, так и
в пластических целях.
• Единственный источник энергии для клеток
человека в анаэробных условиях, необходима для
эритроцитов, важна для нейронов.
• Используется
клетками
для
биосинтеза
практически всех метаболитов и запасающих
веществ, содержится в крови (3,3-5,5 ммоль/л), при
недостатке
биосинтезируется
из
молочной
кислоты,
глицерина,
аминокислот
(белков
организма).
• Широко распространена в природе, в основном в
виде биополимеров – полисахаридов.
34.
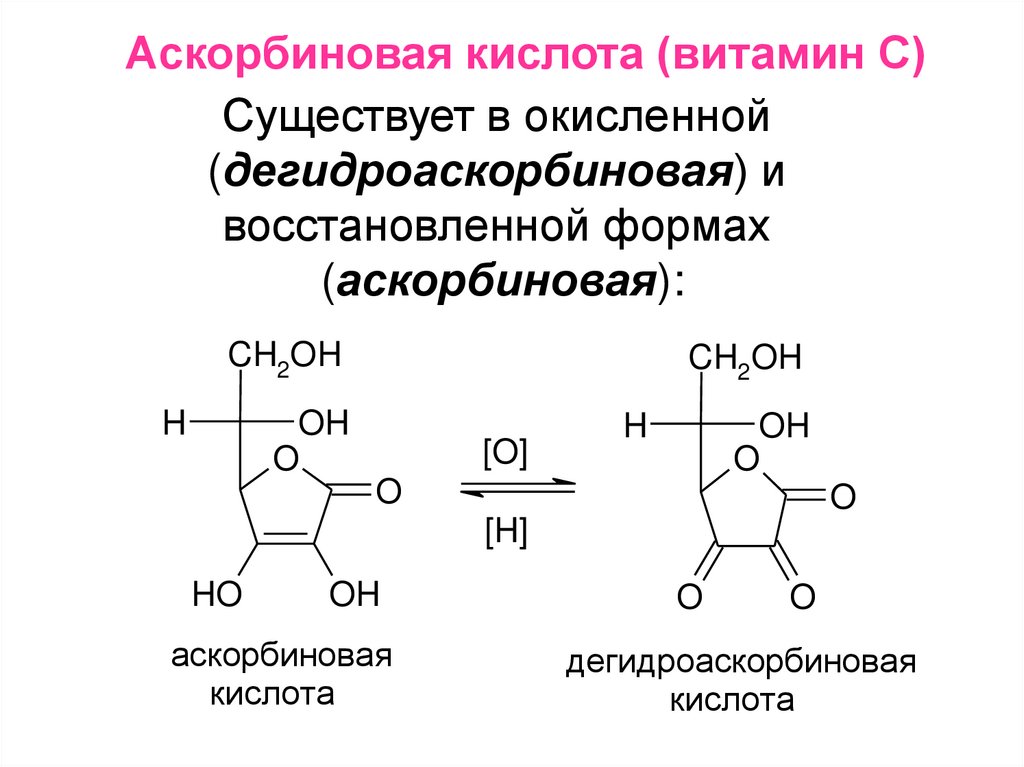
Аскорбиновая кислота (витамин С)Существует в окисленной
(дегидроаскорбиновая) и
восстановленной формах
(аскорбиновая):
CH2OH
H
CH2OH
OH
O
[O]
H
OH
O
O
O
[H]
HO
OH
аскорбиновая
кислота
O
O
дегидроаскорбиновая
кислота
35.
Кристаллическое вещество, хорошорастворимое в воде, плохо – в органических
растворителях, кислое на вкус,
незаменимое вещество, важнейший
антиоксидант.
Необходима для биосинтеза коллагена,
норадреналина, стероидных гормонов,
регенерации витамина Е в клеточных
мембранах. Потребность 50-125 мг/сут,
при недостатке развивается цинга.










 Химия
Химия








