Похожие презентации:
Углеводы. Моносахариды. (Лекция 13)
1. Лекция 13 Углеводы. Моносахариды
2. План
13.1 Введение . Биологическая роль13.2 Классификация. Стереоизомерия
13.3 Пентозы. Гексозы
13.4 Цикло-оксо таутомерия
13.5 Химические свойства моносахаридов
3.
13.1. Введение. Биологическая рольВажной составной частью всех живых
организмов являются углеводы. На долю
углеводов приходится 80-90%, считая на
сухой вес в растительных объектах и ≈
2%, считая на сухой вес– в тканях
животного происхождения. Термин
углеводы был предложен в 1844 году К.
Шмидтом, что обусловлено тем, что
первым соединением этого ряда
приписывали формулу Сn(Н2О)m (гидраты
4. общая формула моносахаридов Углеводы образуются в результате процесса фотосинтеза Схема фотосинтеза углеводов
Cn(H2O)mобщая формула моносахаридов
Углеводы образуются в результате
процесса фотосинтеза
Схема фотосинтеза углеводов
h
n CO2
+
m H2O
Cn(H2O)m
+
n O2
5. Биологическая роль углеводов
1. Энергетическая функция,1 г углеводов – 16,9 кДж
2. Углеводы – запасный питательный материал
3. Углеводы входят в состав опорных тканей
4. Структурная пластическая функция
5. Углеводы – участвуют в регуляции осмотических
процессов
6. Выполняют специфические функции
7. Необходимы для нормального окисления жиров и
белков
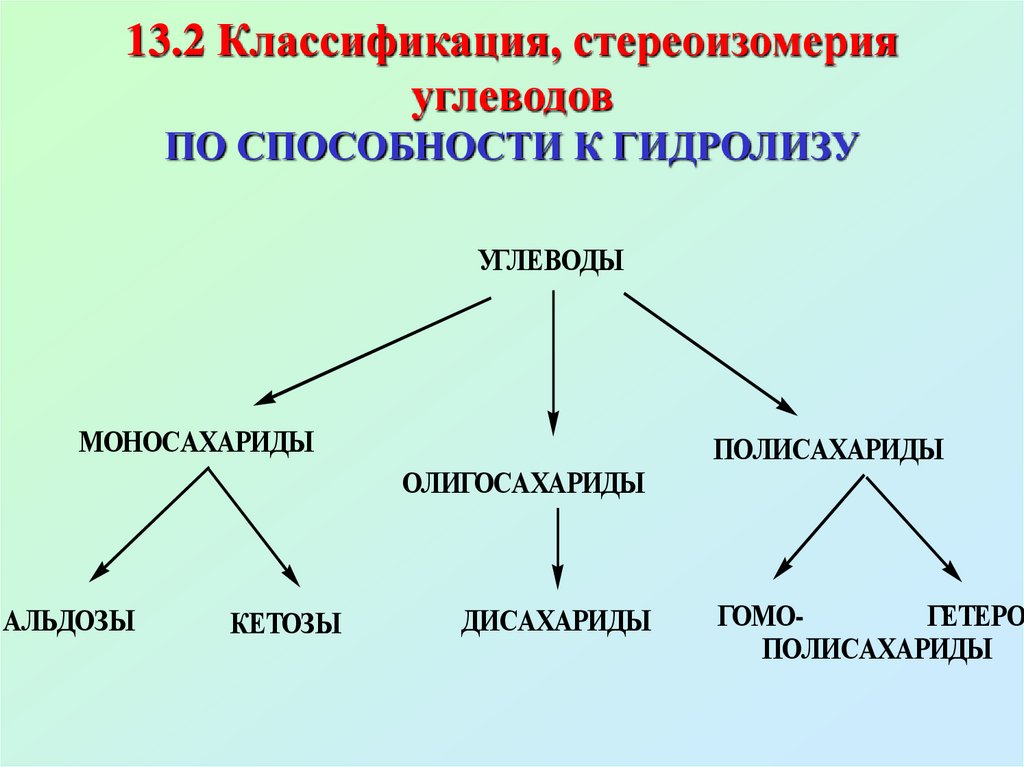
6. 13.2 Классификация, стереоизомерия углеводов ПО СПОСОБНОСТИ К ГИДРОЛИЗУ
УГЛЕВОДЫМОНОСАХАРИДЫ
ОЛИГОСАХАРИДЫ
АЛЬДОЗЫ
КЕТОЗЫ
ДИСАХАРИДЫ
ПОЛИСАХАРИДЫ
ГОМОГЕТЕРОПОЛИСАХАРИДЫ
7.
Классификация углеводовВ зависимости от
функциональной группы
различают альдозы
( содержат альдегидную группу
и кетозы (содержат оксогруппу)
8. Классификация углеводов ПО ЧИСЛУ АТОМОВ УГЛЕРОДА
3С4С
5С
6С
7С
триозы
тетрозы
пентозы
гексозы
гептозы
В природе наиболее распространены пентозы и
гексозы
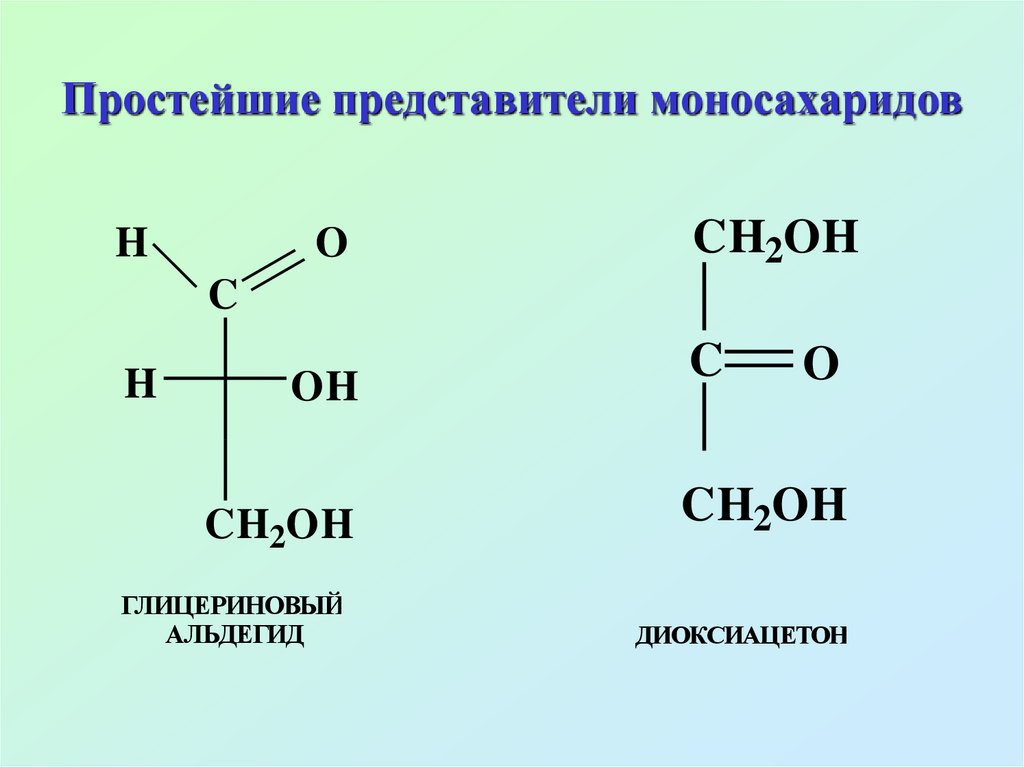
9. Простейшие представители моносахаридов
HO
CH2OH
C
H
OH
CH2OH
ГЛИЦЕРИНОВЫЙ
АЛЬДЕГИД
C
O
CH2OH
ДИОКСИАЦЕТОН
10.
Стереоизомерия моносахаридовВсе моносахариды, за исключением
диоксиацетона, содержат хиральные
центры, как правило их несколько. У
альдогексоз 4 хиральных центра,
следовательно возможно 16
стереоизомеров (8 пар энантиомеров).
Конкретное название моносахарида
определяется конфигурацией всех
асимметричных атомов углерода
11.
Многообразие форм молекулмоносахаридов предполагает
различные способы их изображения
Для изображения ациклических
форм моносахаридов приняты
проекционные формулы Фишера
Циклические формы изображают
формулами Колли-Толленса и
Хеуорса
12.
Британский химикW.N.Haworth
(лауреат
Нобелевской
премии в 1937)
предложил удобный
способ изображения
циклической формы
сахаров
13.
Пяти- и шестичленные цепи имеютклешневидную конфигурацию и
вследствие этого возможно
сближение в пространстве двух
функциональных групп –
альдегидной или кетогруппы с
гидроксильной и по типу реакции АN
образуется циклический
полуацеталь
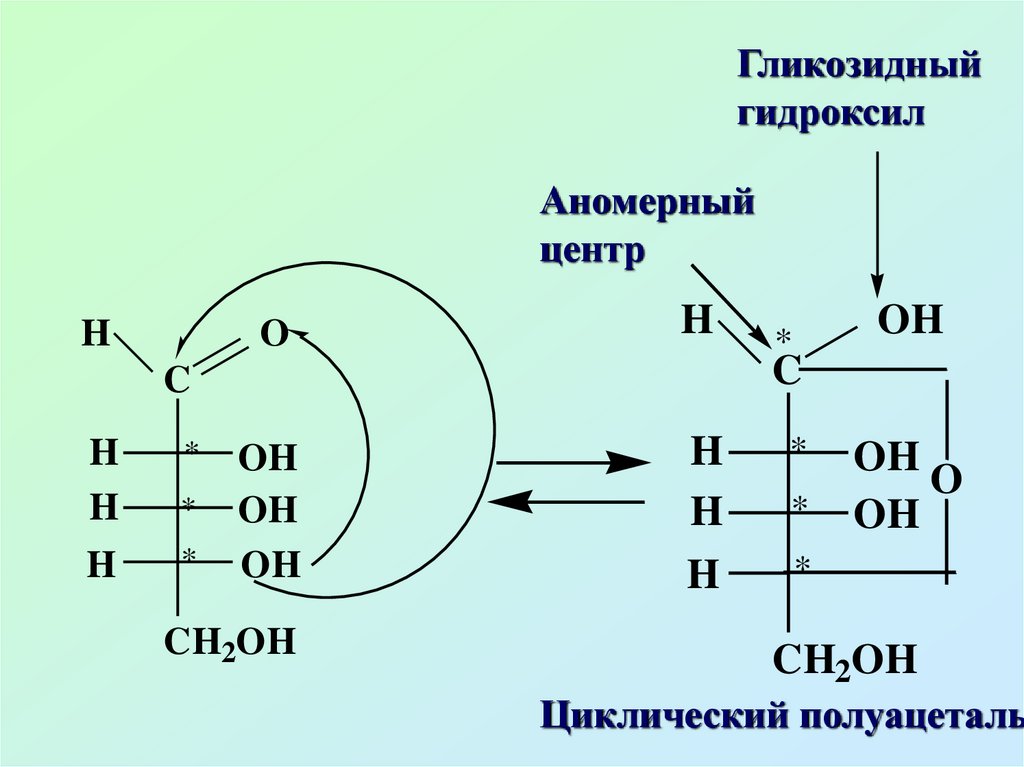
14.
В циклической форме возникаетдополнительный центр
хиральности, т.е.
асимметрическим становится
карбонильный атом углерода.
Этот новый хиральный центр
называют аномерным, а два
стереоизомера – α- и β-аномеры,
ОН – называют гликозидный
гидроксил
15.
Гликозидныйгидроксил
Аномерный
центр
H
O
H
*
H
*
*
*
C
C
H
H
OH
OH
OH
OH
CH2OH
H
H
*
H
*
*
OH
O
OH
CH2OH
Циклический полуацеталь
16.
У α-аномера конфигурацияаномерного центра совпадает с
конфигурацией концевого,
наиболее удаленного
асимметрического атома
углерода, а у β-аномера –
противоположного
17.
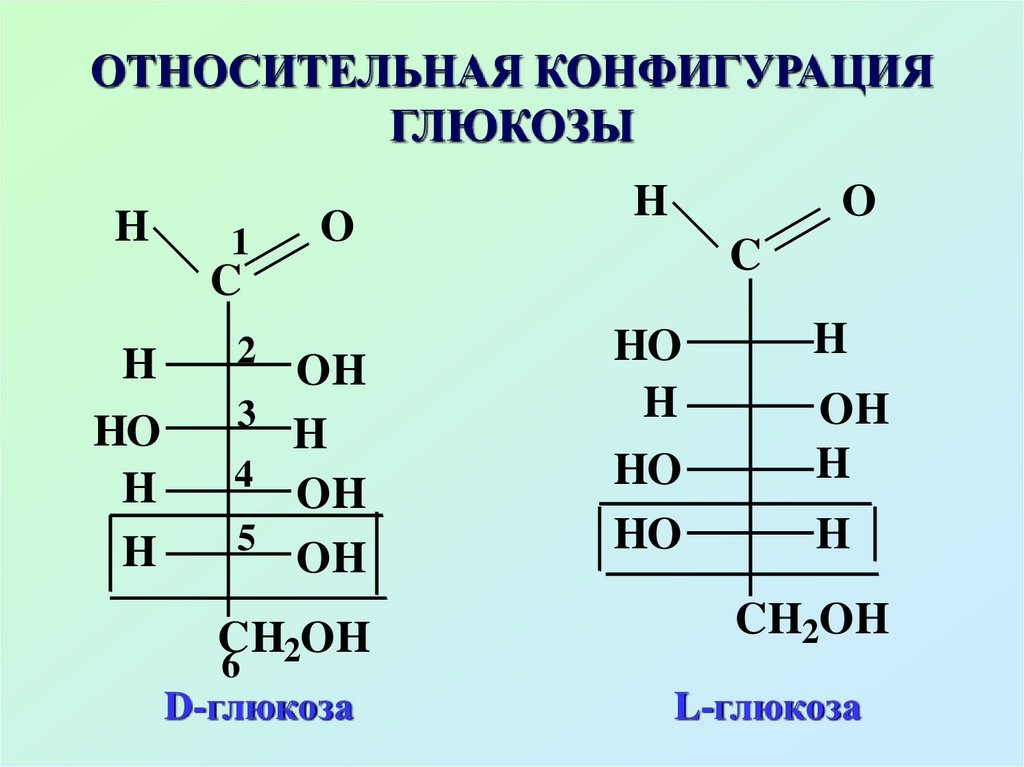
Относительная конфигурациямоносахаридов, т.е. принадлежность к
D-и L-стереохимическим рядам
определяется путем сравнения
конфигурации хирального атома
углерода, наиболее удаленного от
альдегидной или кетогруппы с
конфигурацией хирального атома
конфигурационного стандарта
18. ОТНОСИТЕЛЬНАЯ КОНФИГУРАЦИЯ ГЛЮКОЗЫ
H1
O
H
O
C
C
H
HO
H
H
2
OH
3
H
4
OH
5
OH
CH2OH
6
D-глюкоза
HO
H
HO
HO
H
OH
H
H
CH2OH
L-глюкоза
19.
Знак вращения (+) или (–)определяется экспериментально
Подавляющее большинство
природных моносахаридов
относится к D-ряду, но могут
быть и моносахариды L-ряда
(L-арабиноза)
20.
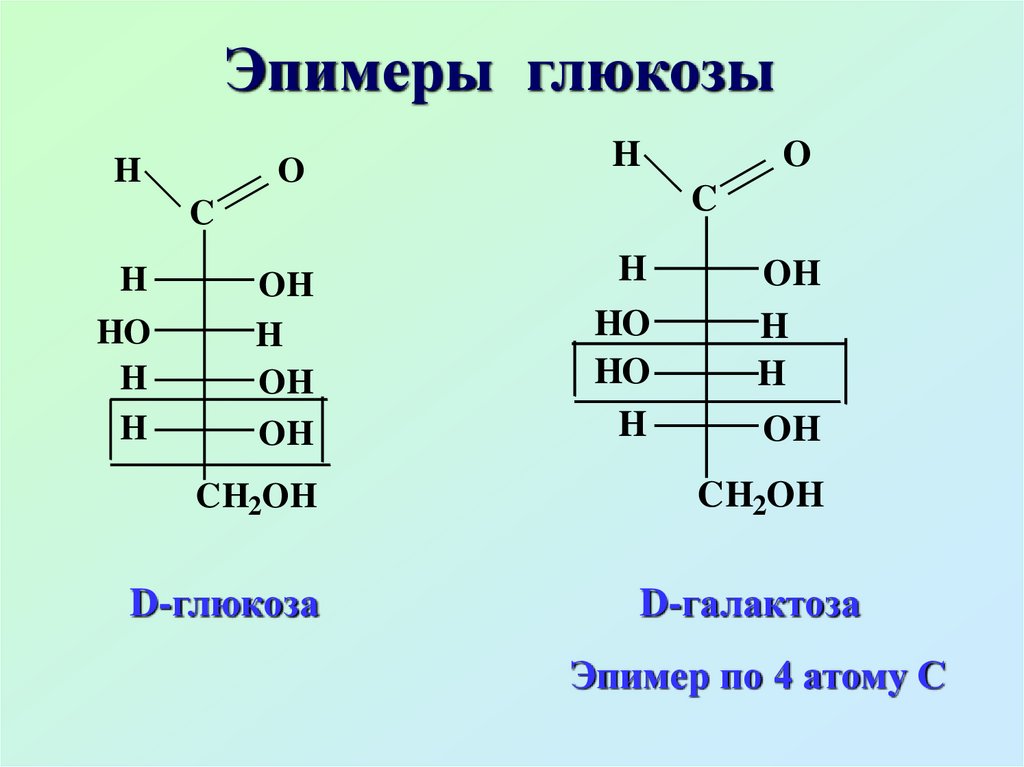
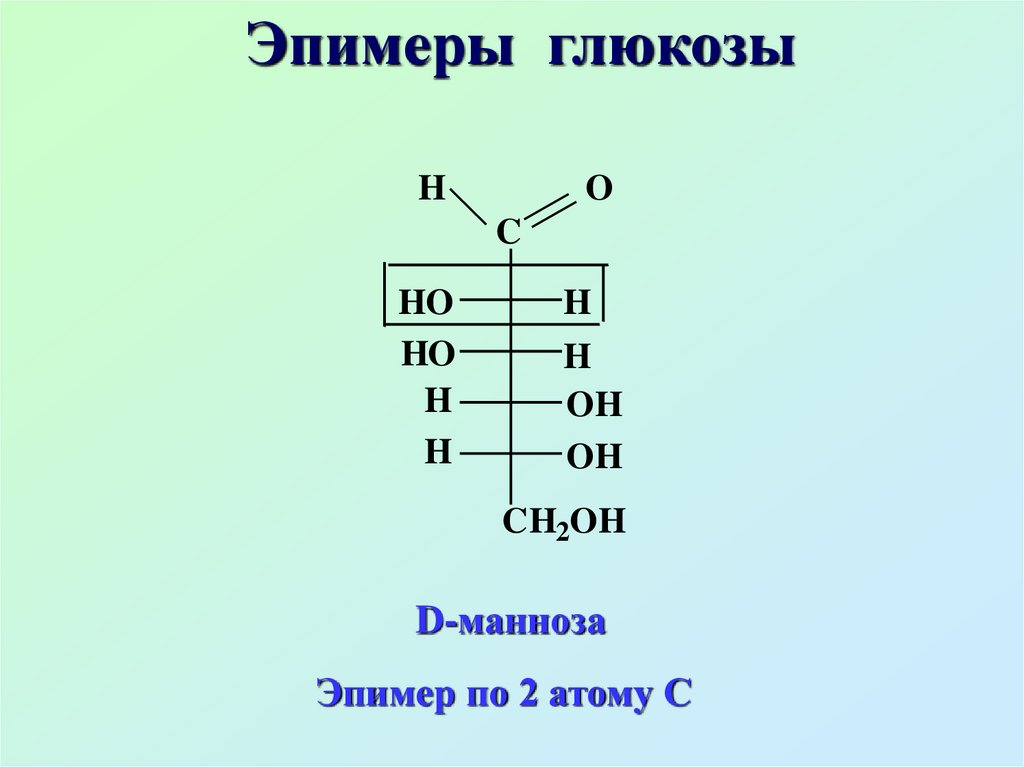
Эпимеры – диастереомеры,различающиеся
конфигурацией только одного
хирального атома
21.
Эпимеры глюкозыH
O
H
OH
H
OH
OH
H
HO
HO
H
C
C
H
HO
H
H
CH2OH
D-глюкоза
O
OH
H
H
OH
CH2OH
D-галактоза
Эпимер по 4 атому С
22.
Эпимеры глюкозыH
O
C
HO
HO
H
H
H
H
OH
OH
CH2OH
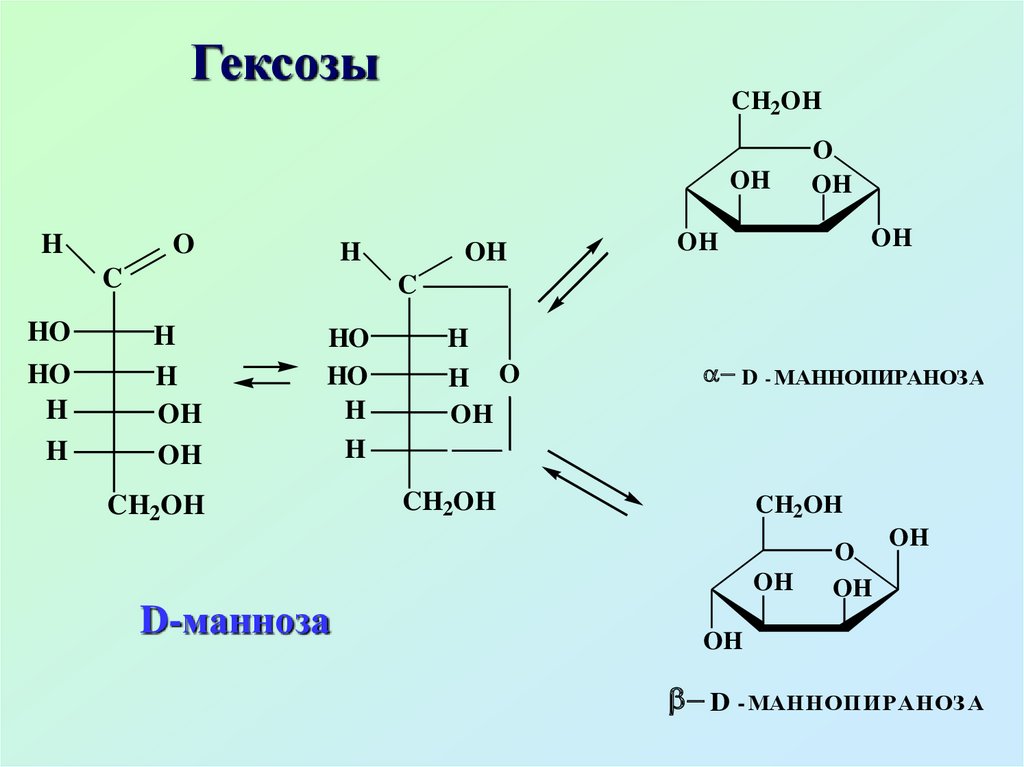
D-манноза
Эпимер по 2 атому С
23.
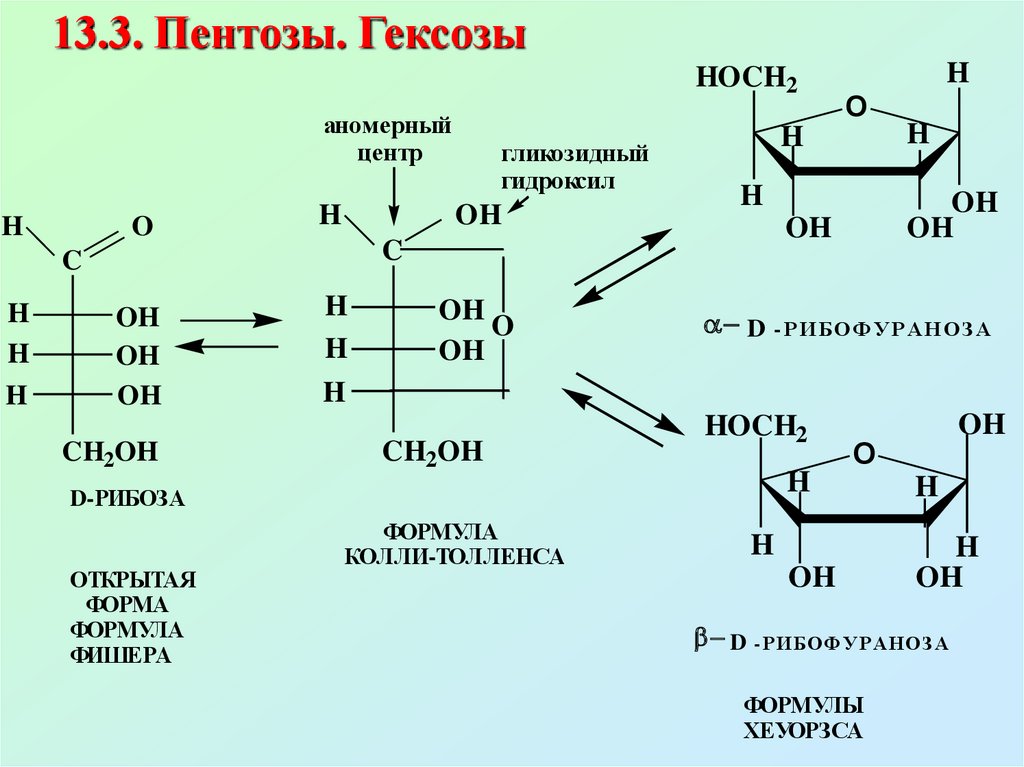
13.3. Пентозы. ГексозыHOCH2
аномерный
центр
H
O
H
OH
OH
OH
OH
H
H
H
CH2OH
OH
O
OH
H
H
OH
OH
OH
D - Р И БОФ У Р АН ОЗ А
H
CH2OH
HOCH2
D-РИБОЗА
ОТКРЫТАЯ
ФОРМА
ФОРМУЛА
ФИШЕРА
O
H
C
C
H
H
гликозидный
гидроксил
H
ФОРМУЛА
КОЛЛИ-ТОЛЛЕНСА
OH
O
H
H
OH
H
OH
H
D - Р И БОФ У Р АН ОЗ А
ФОРМУЛЫ
ХЕУОРЗСА
24.
Рибоза входит в составнуклеиновых кислот, а в виде
восстановленного спирта
входит в состав биологически
активных соединений
(витаминов и ферментов)
25.
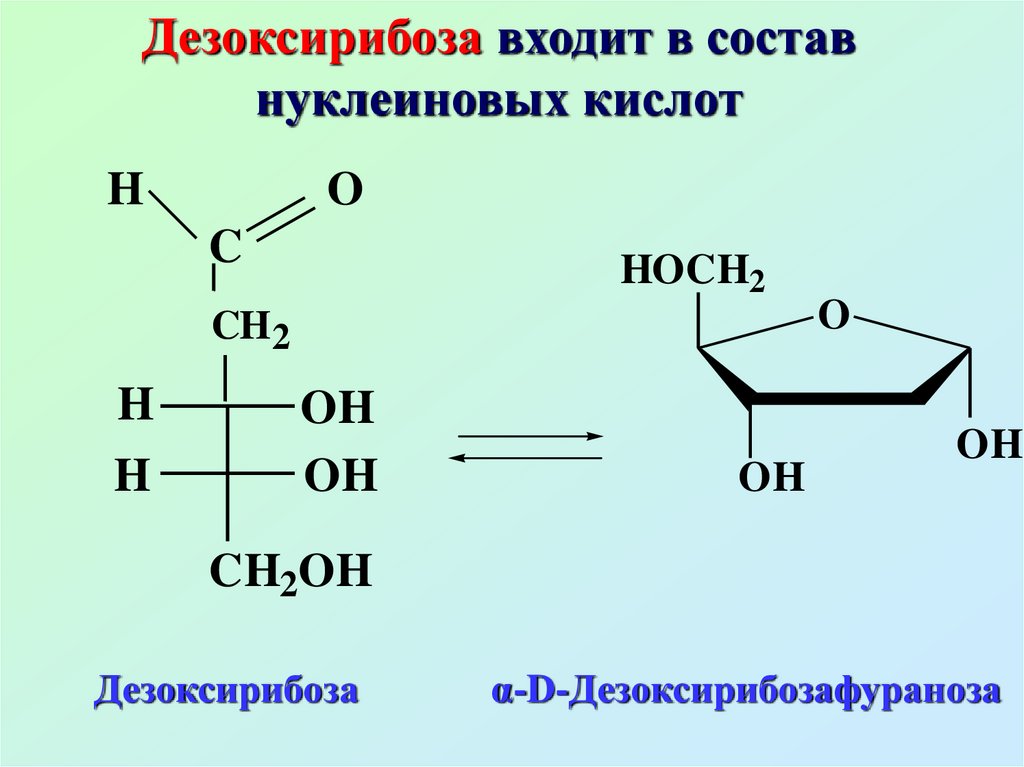
Дезоксирибоза входит в составнуклеиновых кислот
H
O
C
HOCH2
O
CH 2
H
H
OH
OH
OH
OH
CH2OH
Дезоксирибоза
α-D-Дезоксирибозафураноза
26.
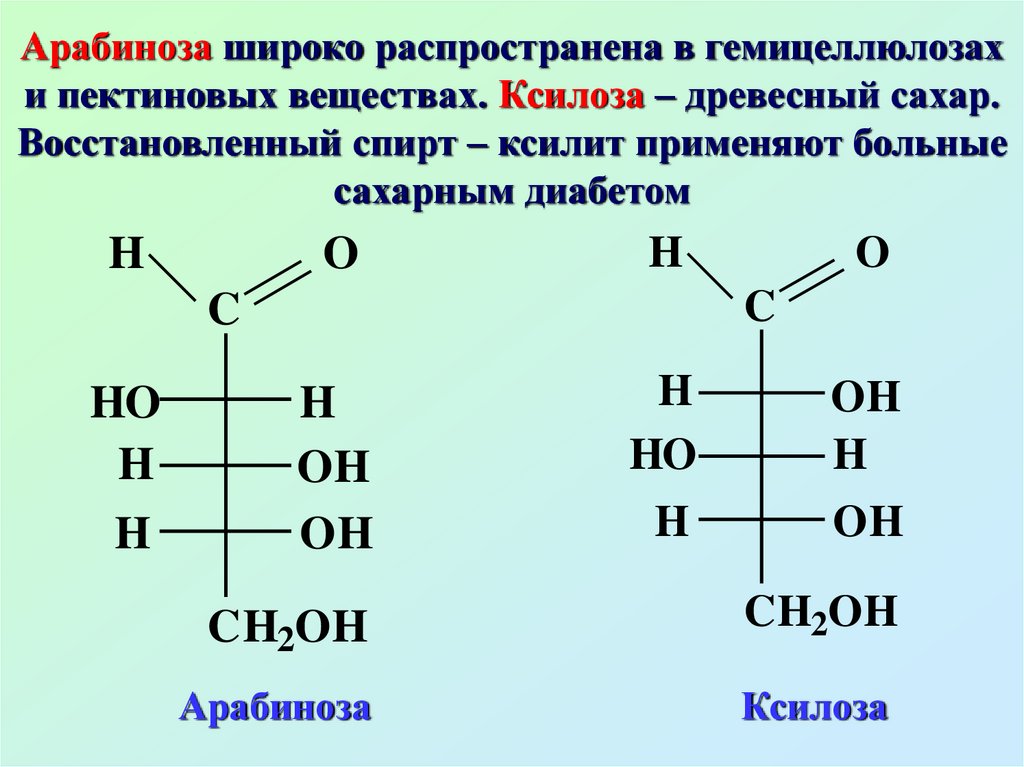
Арабиноза широко распространена в гемицеллюлозахи пектиновых веществах. Ксилоза – древесный сахар.
Восстановленный спирт – ксилит применяют больные
сахарным диабетом
H
O
H
C
C
HO
H
H
O
H
OH
OH
H
HO
OH
H
H
OH
CH2OH
CH2OH
Арабиноза
Ксилоза
27.
CH2OHГексозы
O
OH
H
O
H
C
H
HO
H
H
OH
OH
OH
C
OH
H
OH
OH
CH2OH
H
HO
H
H
OH
OH
H O
OH
CH2OH
O
CH2OH
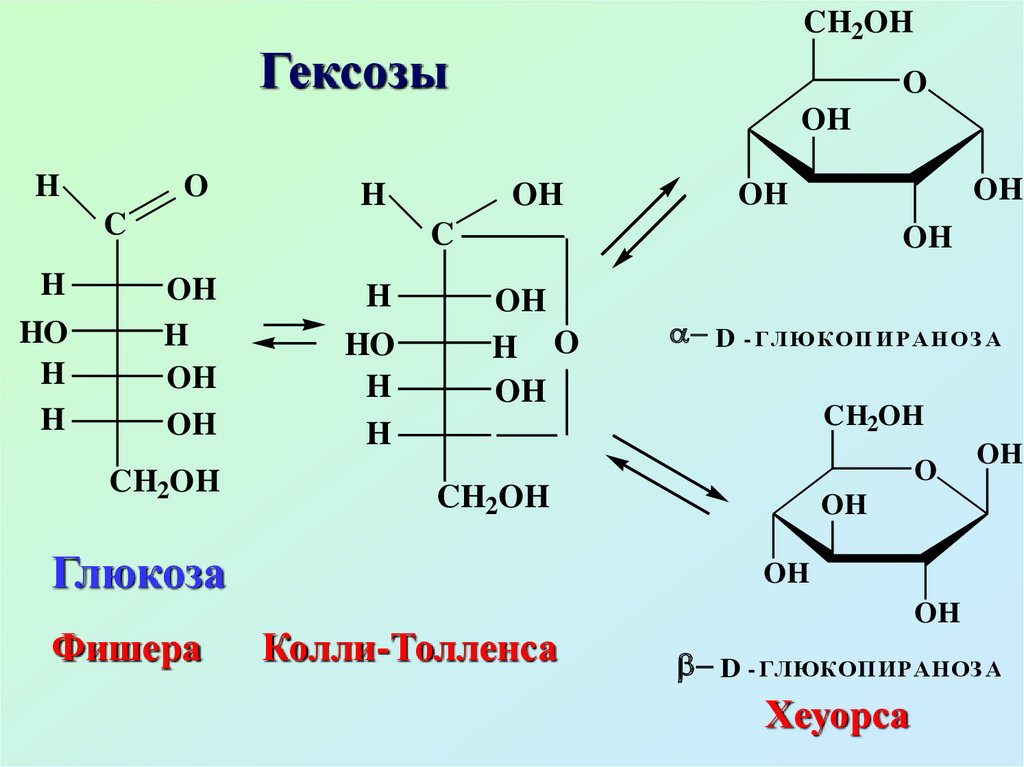
Глюкоза
Фишера
D - ГЛЮК ОП И Р АН ОЗ А
OH
OH
OH
Колли-Толленса
OH
D - ГЛЮКОПИРАНОЗ А
Хеуорса
28.
Глюкоза (виноградный сахар)содержится во всех фруктах,
ягодах, меде
В крови человека содержание
глюкозы составляет 0,08 – 0,12%.
Глюкоза входит в состав сахарозы,
крахмала, гликогена, целлюлозы
29.
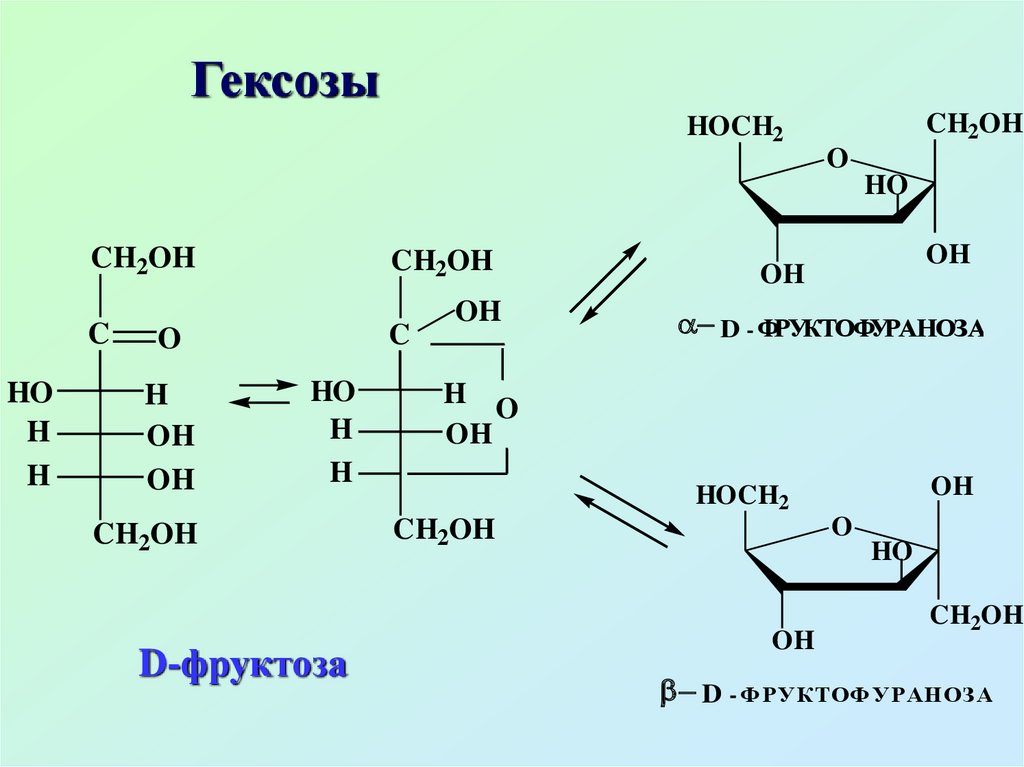
Фруктоза – плодовый сахар,встречается обычно вместе с
глюкозой. В свободном виде
находится в плодах, нектаре,
меде. В связанном виде входит в
состав сахарозы, полисахарида
– инулина (содержится в
растениях)
30.
ГексозыCH2OH
HOCH2
O
HO
CH2OH
C
HO
H
H
CH2OH
C
O
H
OH
OH
HO
H
H
CH2OH
D-фруктоза
OH
OH
OH
D - ФРУКТОФУРАНОЗА
H
O
OH
OH
HOCH2
O
CH2OH
HO
OH
CH2OH
D - ФРУКТОФУРАНОЗ А
31.
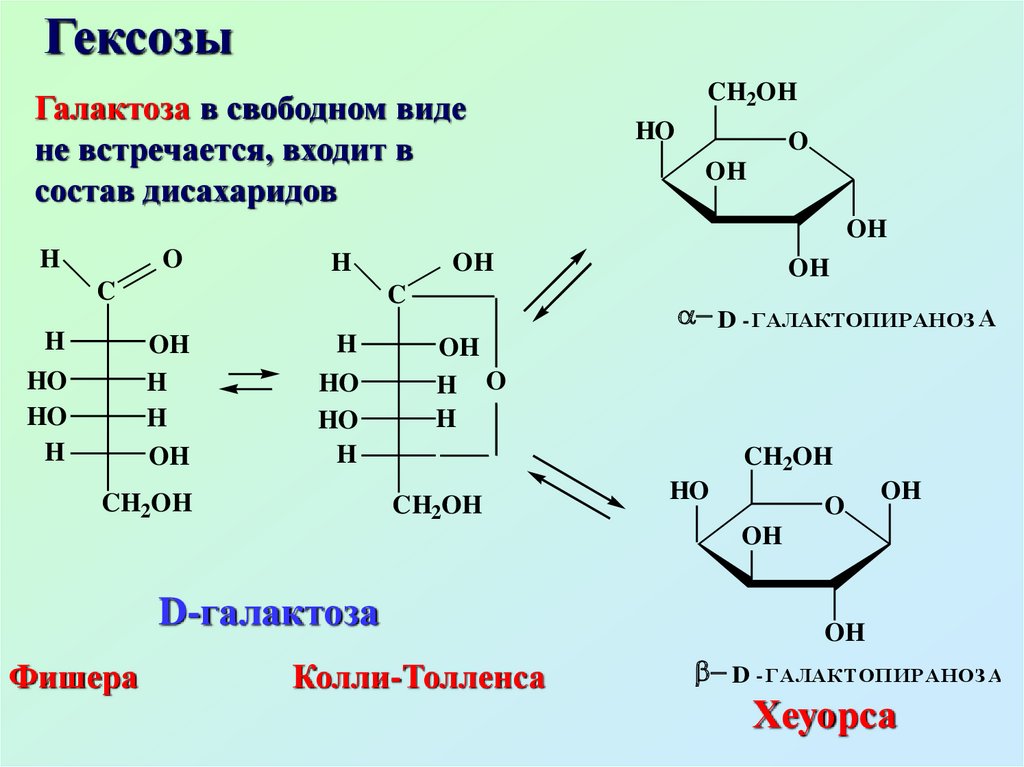
ГексозыГалактоза в свободном виде
не встречается, входит в
состав дисахаридов
CH2OH
HO
O
OH
OH
H
O
H
C
H
C
OH
H
H
OH
HO
HO
H
OH
H
HO
HO
H
CH2OH
OH
D - ГАЛАКТОПИРАНОЗ А
OH
H O
H
CH2OH
CH2OH
HO
O
OH
OH
D-галактоза
Фишера
Колли-Толленса
OH
D - ГАЛАКТОПИРАНОЗ А
Хеуорса
32.
ГексозыCH2OH
OH
H
O
H
C
HO
HO
H
H
OH
O
OH
OH
OH
C
H
H
OH
OH
HO
HO
H
H
CH2OH
H
H O
OH
D - МАННОПИРАНОЗА
CH2OH
CH2OH
OH
D-манноза
O
OH
OH
OH
D - МАННОПИРАНОЗ А
33.
Манноза образует сложныеприродные углеводы –
маннаны, входит в состав
гликопротеидов. Встречается в
растениях, в составе слизей,
гемицеллюлоз, содержится в
ячмене, корках апельсина
34.
13.4. Цикло-оксо таутомерияВ кристаллическом состоянии все
моносахариды находятся в циклической форме
в виде α- или β-аномеров. При растворении
моносахаридов в воде наблюдается так
называемая цикло-оксо таутомерия
(кольчато-цепная таутомерия), т.е.
устанавливается равновесие между
циклическими таутомерами моносахаридов,
различающихся по размеру цикла
(фуранозный, пиранозный), α- и β-формами и
открытой формой
35.
CH2OHHOCH2
HO
H
Таутомерные формы
O
OH
OH
OH
D - ГЛЮКОФУРАНОЗА
глюкозы
O
OH
OH
H
O
D - ГЛЮК ОП И Р АН ОЗ А
C
H
HO
H
H
HOCH2
HO
H
36%
OH
H
OH
OH
CH2OH
OH
O
OH
CH2OH
0,02%
O
D - ГЛЮКОФУРАНОЗА
OH
OH
64%
OH
OH
OH
OH
OH
D - ГЛЮКОП ИРАНОЗ А
36.
Процесс растворениямоносахаридов в воде
сопровождается своеобразным
оптическим эффектом, который
получил название мутаротация –
изменение удельного вращения до
некоторой определенной
величины при растворении
моносахарида в воде
37.
Явление мутаротации связано стаутомерными превращениями глюкозы
В смеси таутомеров глюкозы преобладают
пиранозные формы, однако, хотя открытая форма и составляет только ≈ 0,02 % в
смеси, тем не менее для глюкозы
характерны все реакции на альдегидную
группу, т.к. по мере расходования одной
формы, она вновь образуется, потому что
таутомеры легко переходят один в другой
38.
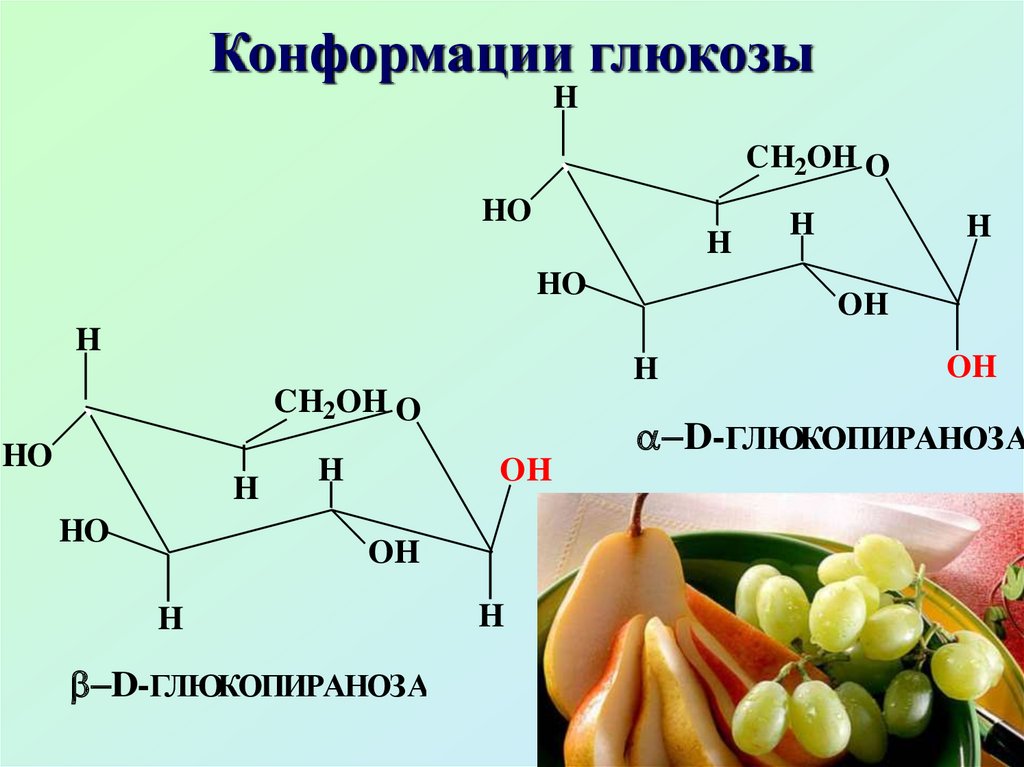
Для пиранозной формы наиболеепредпочтительна конформация
кресла. Конформационное
строение D-глюкопиранозы
проливает свет на уникальность βD-глюкопиранозы: единственный
моносахарид с полным
экваториальным расположением
заместителей
39. Конформации глюкозы
HCH2OH O
HO
H
HO
H
HO
H
HO
H
OH
D-ГЛЮКОПИРАНОЗА
OH
D-ГЛЮКОПИРАНОЗА
OH
H
H
OH
H
CH2OH O
H
H
40.
Благодаря строению(экваториальное расположение
всех заместителей) βглюкоза термодинамически
устойчива, именно это и
является причиной
распространенности β-глюкозы
в природе
41.
13.5. Химические свойствамоносахаридов
42.
Для моносахаридов характерны какреакции, свойственные спиртам, так и
альдегидам
I.Реакции, обусловленные
выми группами
спирто-
43. 1.Образование простых эфиров
CH2OHO
CH2OCH3
OH
O
+ 5 CH3I, KOH
OH
OCH3
OCH3
+
+ H2O, H
- 5 HI
OH
H3CO
OH
OCH3
CH2OCH3
O
OH
OCH3
H3CO
OCH3
2,3,4,6- ТЕТРА- О- МЕТИЛ-
D-ГЛЮКОП ИРАНОЗ А
О-метил-2,3,4,6 - тетра- О - метил D-глюкопиранозид
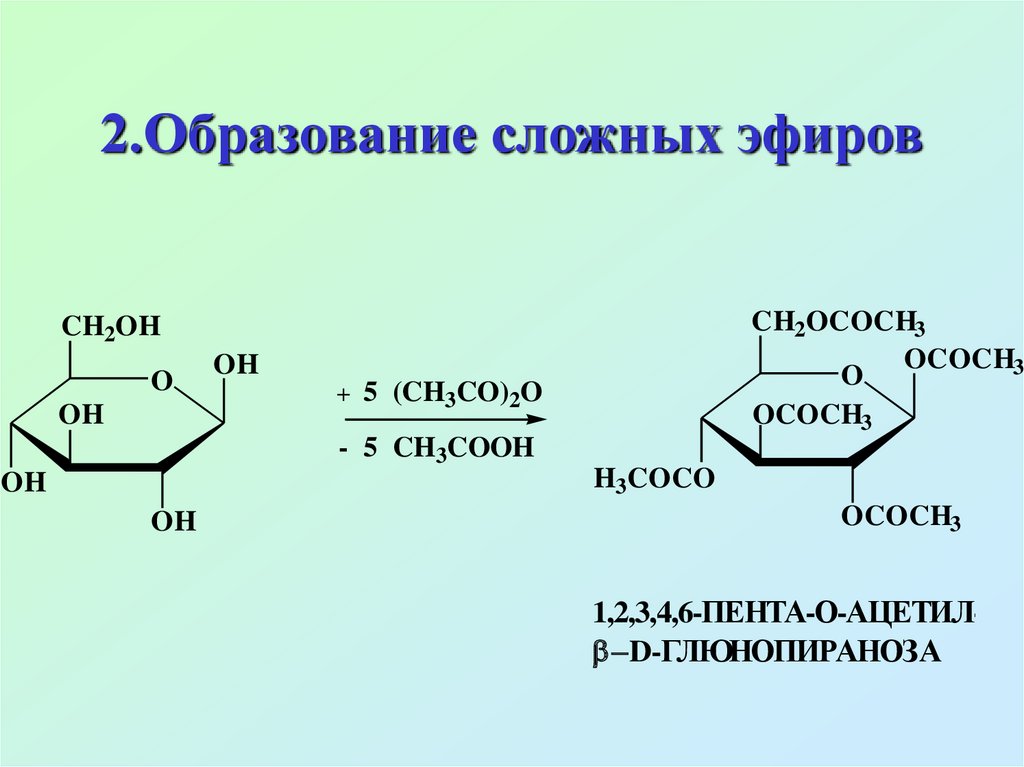
44. 2.Образование сложных эфиров
CH2OCOCH3OCOCH3
O
OCOCH3
CH2OH
O
OH
OH
+ 5 (CH3CO)2O
- 5 CH3COOH
H3COCO
OH
OH
OCOCH3
1,2,3,4,6-ПЕНТА-О-АЦЕТИЛ D-ГЛЮНОПИРАНОЗА
45.
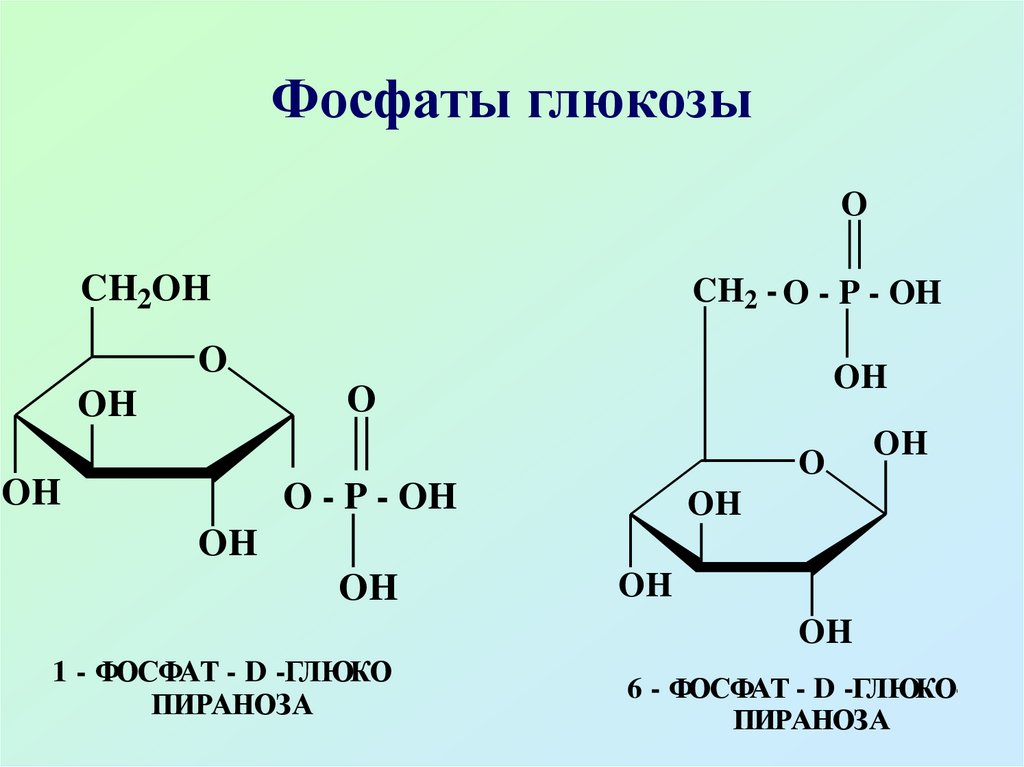
Из сложноэфирных производныхнаибольшее значение имеют
эфиры фосфорной кислоты
(фосфаты), они содержатся во
всех растительных и животных
организмах, наибольшее значение
имеют 6-фосфат, 1-фосфат
глюкозы и 1,6-дифосфат
фруктозы
46. Фосфаты глюкозы
OCH2OH
CH2 - O - P - OH
O
OH
O
OH
O
OH
O - P - OH
OH
OH
OH
OH
OH
OH
1 - ФОСФАТ - D -ГЛЮКОПИРАНОЗА
6 - ФОСФАТ - D -ГЛЮКОПИРАНОЗА
47.
OO
CH2O - P - OH
HO - P - O - CH2
O
HO
OH
OH
OH
OH
1,6 - ДИФОСФАТ - D - ФРУКТОФУРАНОЗА
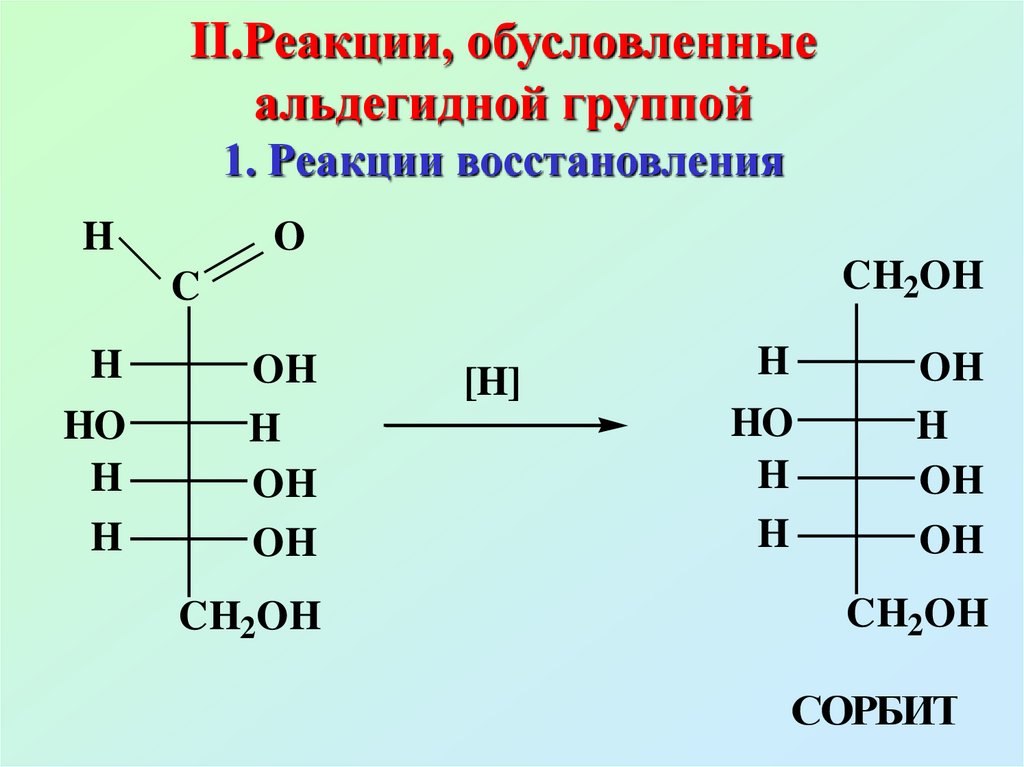
48. II.Реакции, обусловленные альдегидной группой 1. Реакции восстановления
HO
CH2OH
C
H
HO
H
H
OH
H
OH
OH
CH2OH
[H]
H
HO
H
H
OH
H
OH
OH
CH2OH
СОРБИТ
49.
При восстановлении ксилозыобразуется ксилит, галактозы
– дульцит, маннозы – маннит,
рибозы – рибит
50. 2. Реакции окисления а) Реакции окисления в щелочной среде реактивом Толленса
HO
C
+
R
[Ag(NH3)2]OH
Ag + ПРОДУКТЫ ОКИСЛЕНИЯ
51.
б) Реакции окисления в щелочнойсреде реактивом Фелинга (реактивом
Бенедикта)
H
O
C
+
R
Cu2+
КОМПЛЕКС
Cu2O
+ ПРОДУКТЫ ОКИСЛЕНИЯ
52.
Углеводы, дающиеположительные реакции
окисления в щелочной среде,
называются
восстанавливающими
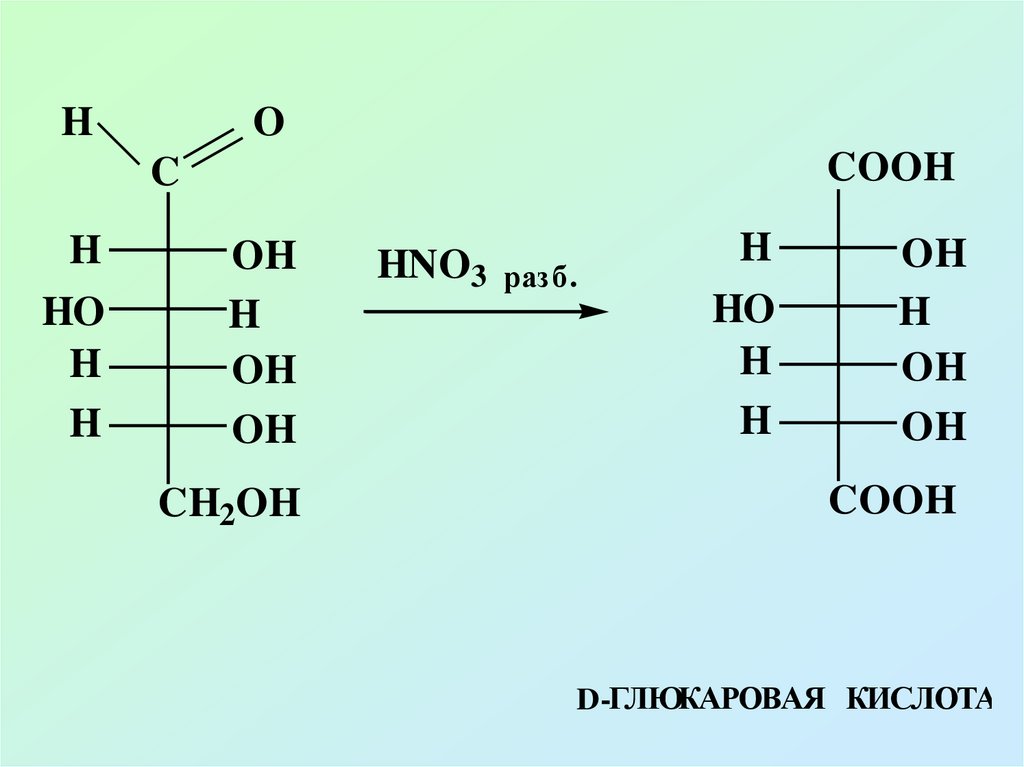
53. В) ОКИСЛЕНИЕ В КИСЛОЙ И НЕЙТРАЛЬНОЙ СРЕДЕ
Окисление в нейтральной и кислойсреде протекает без разрушения
молекул, при этом образуются
разнообразные кислоты
54.
HO
COOH
C
H
HO
H
H
OH
H
OH
OH
CH2OH
HNO3
разб.
H
HO
H
H
OH
H
OH
OH
COOH
D-ГЛЮКАРОВАЯ КИСЛОТА
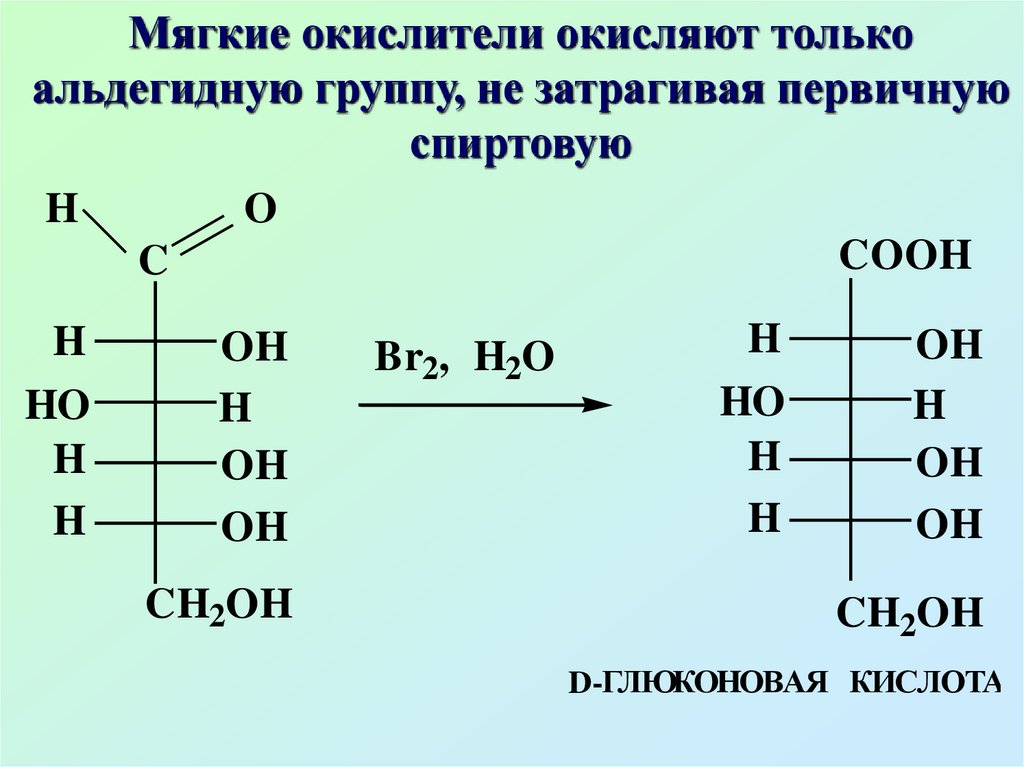
55.
Мягкие окислители окисляют толькоальдегидную группу, не затрагивая первичную
спиртовую
H
O
COOH
C
H
HO
H
H
OH
H
OH
OH
CH2OH
Br2, H2O
H
HO
H
H
OH
H
OH
OH
CH2OH
D-ГЛЮКOHОВАЯ КИСЛОТА
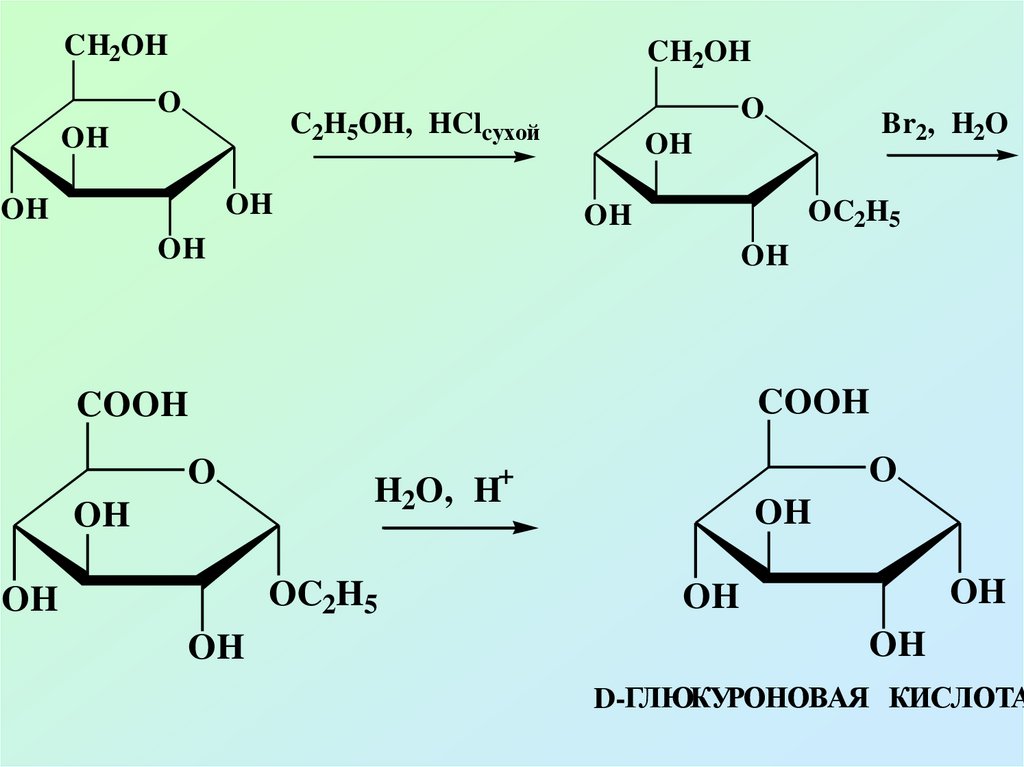
56.
CH2OHCH2OH
O
O
C2H5OH, HClcухой
OH
OH
OH
OH
OC2H5
OH
OH
OH
COOH
COOH
O
OH
OH
O
+
H2O, H
OC2H5
OH
Br2, H2O
OH
OH
OH
OH
D-ГЛЮКУРОНОВАЯ КИСЛОТА
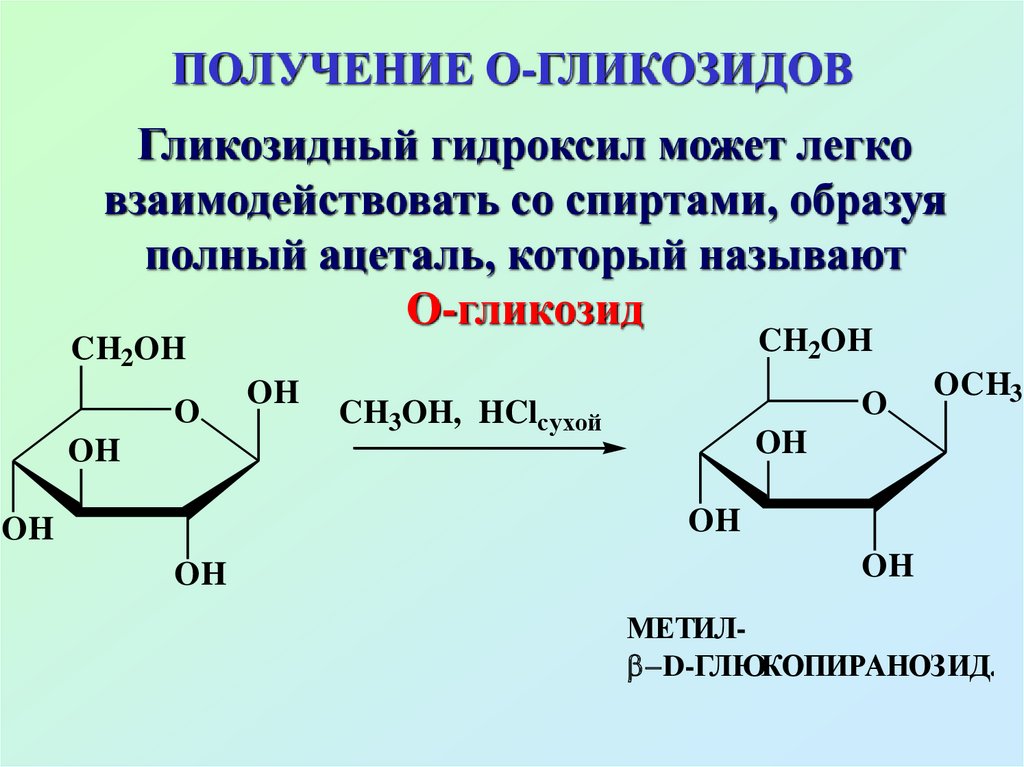
57. ПОЛУЧЕНИЕ О-ГЛИКОЗИДОВ
Гликозидный гидроксил может легковзаимодействовать со спиртами, образуя
полный ацеталь, который называют
О-гликозид
CH2OH
CH2OH
O
OH
O
CH3OH, HClсухой
OCH3
OH
OH
OH
OH
OH
OH
МЕТИЛ D-ГЛЮКОПИРАНОЗИД.
58.
О-гликозидылегко гидролизуются в кислой
среде с образованием
соответствующих
моносахаридов, но устойчивы
к гидролизу в щелочной среде
59.
Аминопроизводные углеводов,аминосахара, входят в состав
мукополисахаридов в
организме человека и
животных. Важнейшие из них
глюкозамин, галактозамин и
нейраминовая кислота
60.
Производные углеводов (аминосахара)H
O
C
H
HO
H
H
NH2
H
OH
OH
CH2OH
Глюкозамин
CH2OH
O
OH
OH
OH
NH2
61.
Производные углеводов (аминосахара)H
O
C
H
HO
HO
H
CH2OH
NH2
H
H
OH
CH2OH
Галактозамин
HO
O
OH
OH
NH2
62.
COOHC
O
CH2
H
OH
H2N
HO
H
H
H
H
OH
OH
CH2OH
Нейраминовая кислота
Производные – сиаловые кислоты
содержатся в спинно-мозговой
жидкости
63.
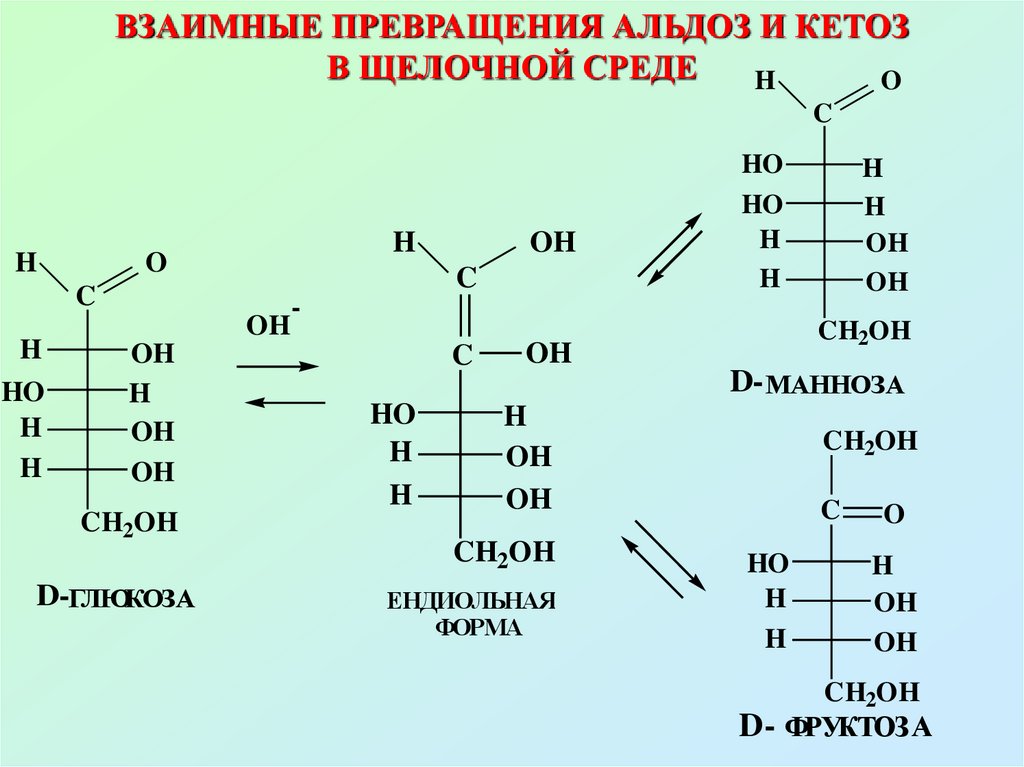
Взаимные превращения альдоз икетоз в щелочной среде
Вследствие наличия СНкислотного центра у α-углеродного
атома в щелочной среде возможны
взаимные превращения альдоз и
кетоз,что позволяет объяснить
положительные реакции с
реактивом Толленса и Фелинга
64. ВЗАИМНЫЕ ПРЕВРАЩЕНИЯ АЛЬДОЗ И КЕТОЗ В ЩЕЛОЧНОЙ СРЕДЕ
HO
C
HO
H
H
O
C
C
H
HO
H
H
OH
OH
H
OH
OH
CH2OH
D-ГЛЮКОЗА
OH
HO
H
H
-
C
HO
H
H
H
H
OH
OH
CH2OH
OH
D- МАННОЗА
H
OH
OH
CH2OH
ЕНДИОЛЬНАЯ
ФОРМА
CH2OH
C
HO
H
H
O
H
OH
OH
CH2OH
D- ФРУКТОЗА
65.
Благодаримза внимание !











































 Биология
Биология








