Похожие презентации:
4c44491c9fa54633a2d3c288013dc6d9
1.
Изучать мы начинаем неметаллы и ихсоединения.
В природе несомненно их велико значение.
Водород, азот и фосфор, кислород и углерод.
Круг в природе, в организмах.
Так идет за годом год.
Баланс природе не нарушишь , они вреда не
принесут
Во многом примененье они всегда себе найдут!
2.
тема урока«Общая характеристика
неметаллов»
3.
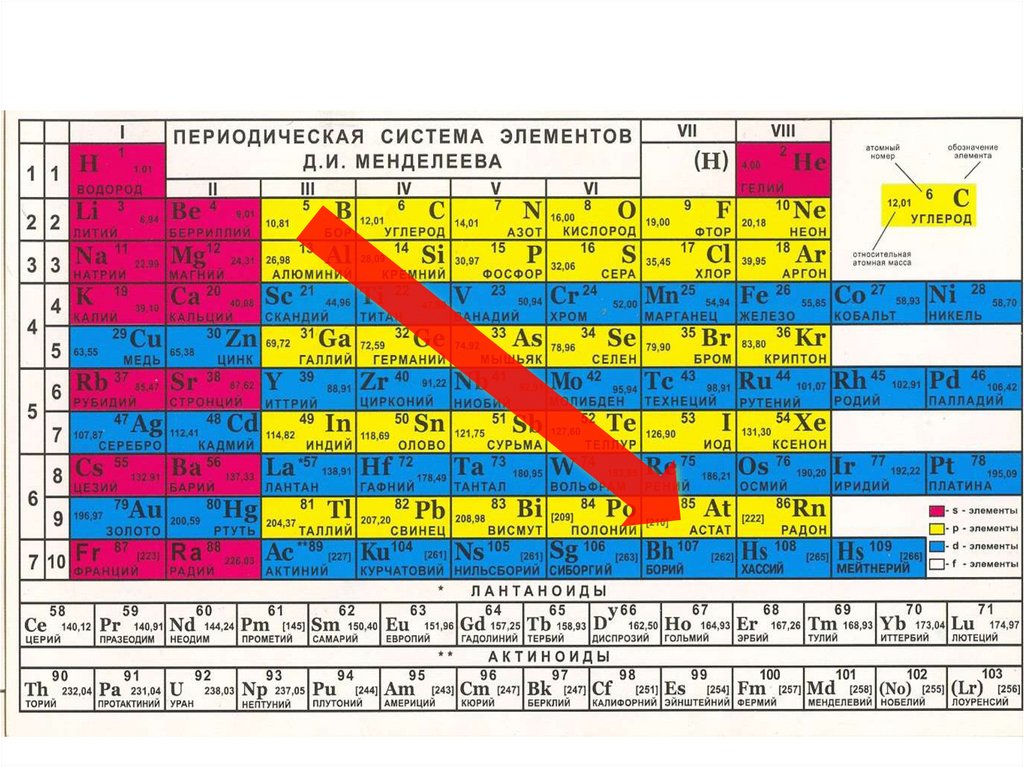
Что должны узнать на уроке?1. Положение элементов – неметаллов в
Периодической системе химических элементов
Д.И. Менделеева
2. Особенности строения атомов неметаллов
3. Характеристика простых веществ – неметаллов.
Физические свойства простых веществ –
неметаллов
4. Аллотропия неметаллов, причина
4.
5.
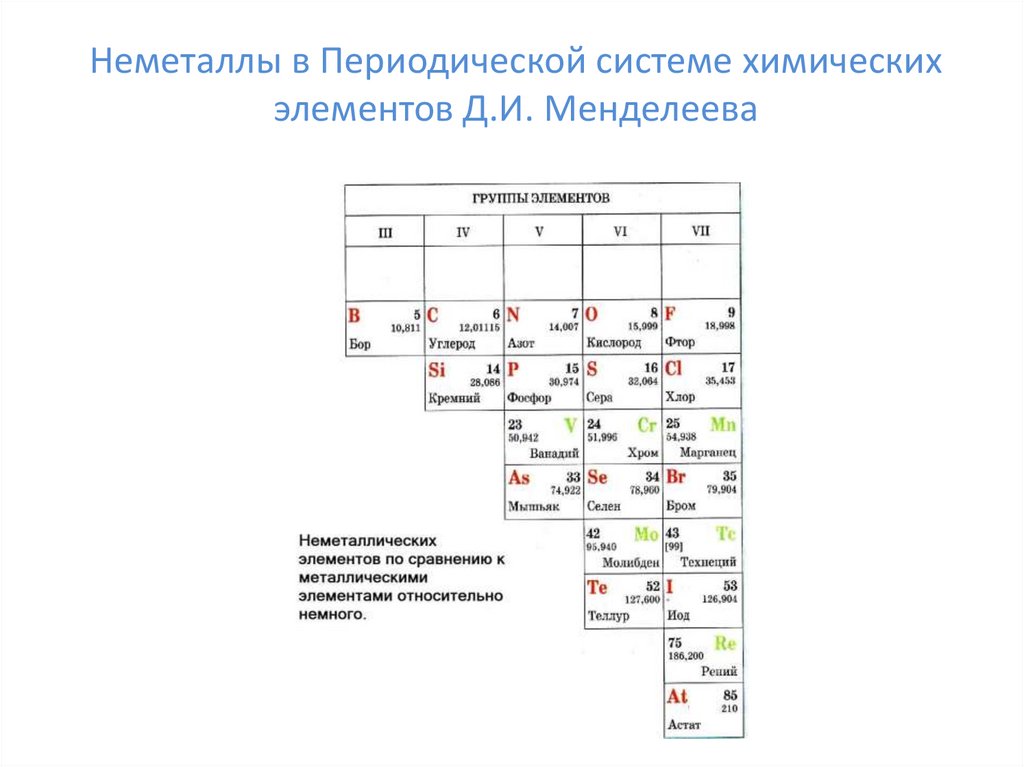
Неметаллы в Периодической системе химическихэлементов Д.И. Менделеева
6.
Особенности строения атомов – неметаллов:1. Небольшой радиус атомов (в сравнении с
радиусами атомов – металлов одного с ними
периода)
2. Число электронов на внешнем уровне от 4-х до 8 (у
бора – 3 электрона)
7.
Электроотрицательность (ЭО) – способность атомовхимического элемента смещать к себе общие
электронные пары
РЯД ЭЛЕКТРООТРИЦАТЕЛЬНОСТИ НЕМЕТАЛЛОВ
H , As , I , Si , P , Se , C , S , Br , Cl , N , O , F
8.
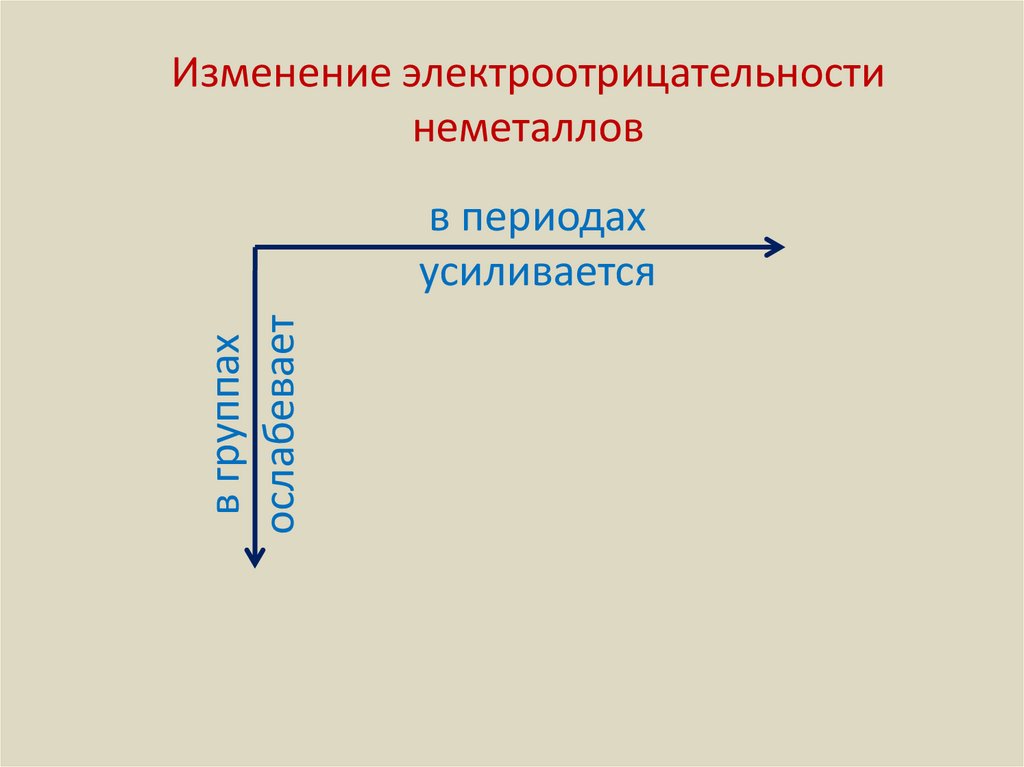
Изменение электроотрицательностинеметаллов
в группах
ослабевает
в периодах
усиливается
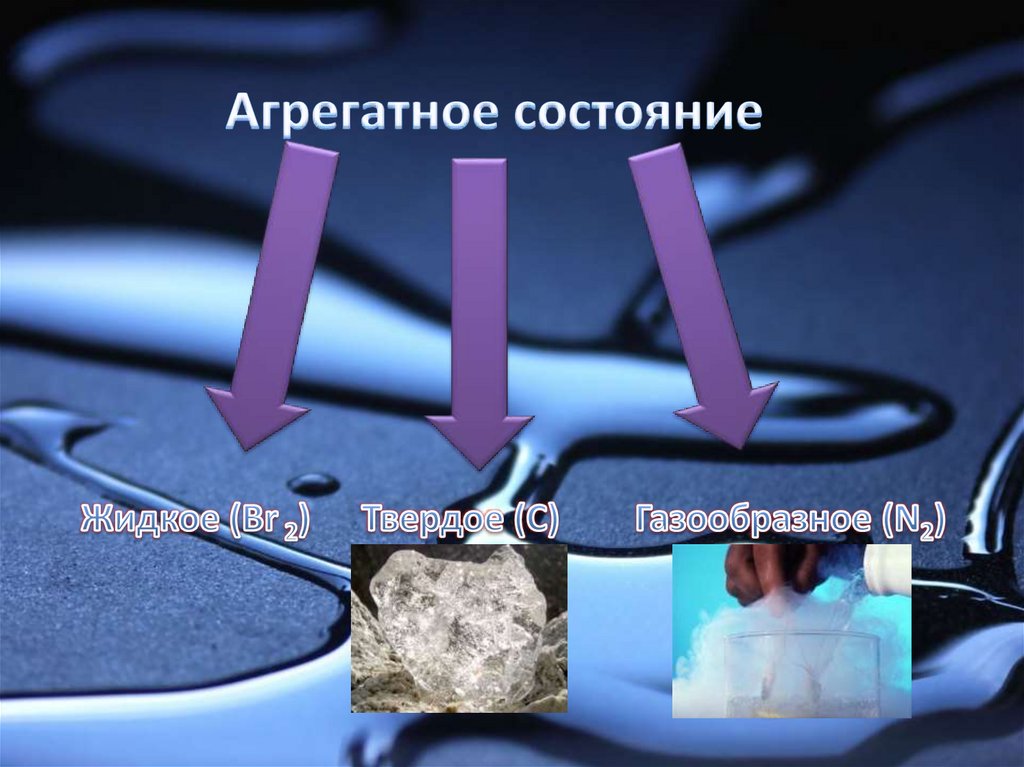
9. Простые вещества –неметаллы
1. Формулы молекул.2. Кристаллическая решетка.
3. Аллотропные модификации.
4. Физические свойства.
5. Химические свойства.
10.
11.
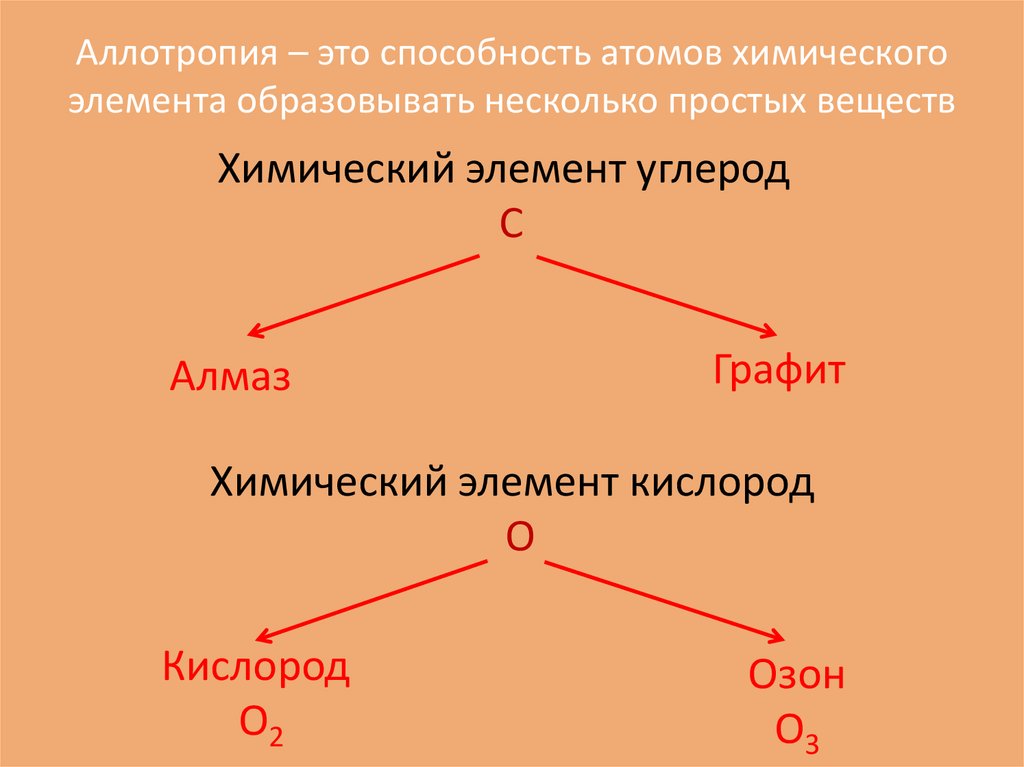
Аллотропия – это способность атомов химическогоэлемента образовывать несколько простых веществ
Химический элемент углерод
С
Алмаз
Графит
Химический элемент кислород
О
Кислород
О2
Озон
О3
12.
Причины аллотропии:1. Разное строение кристаллических решеток
(алмаз и графит)
2. Разное число атомов в молекулах простых
веществ (кислород и озон)











 Химия
Химия








