Похожие презентации:
Лекция 5-6 рН и гидролиз
1. Водородный показатель. Расчёт рН растворов сильных и слабых электролитов. Гидролиз солей.
Кафедра медицинской ифармацевтической химии
Водородный показатель. Расчёт рН
растворов сильных и слабых
электролитов. Гидролиз солей.
1
2.
Основные функцииводы в организме
Обеспечение процессов всасывания и механического
передвижения питательных веществ
Поддержание оптимального осмотического давления в
крови и тканях
Обеспечение функционирования
кислот, полисахаридов
Участие в процессах
катализа, гидролиза
белков,
биосинтеза,
Поддержание температуры тела
нуклеиновых
ферментативного
2
3.
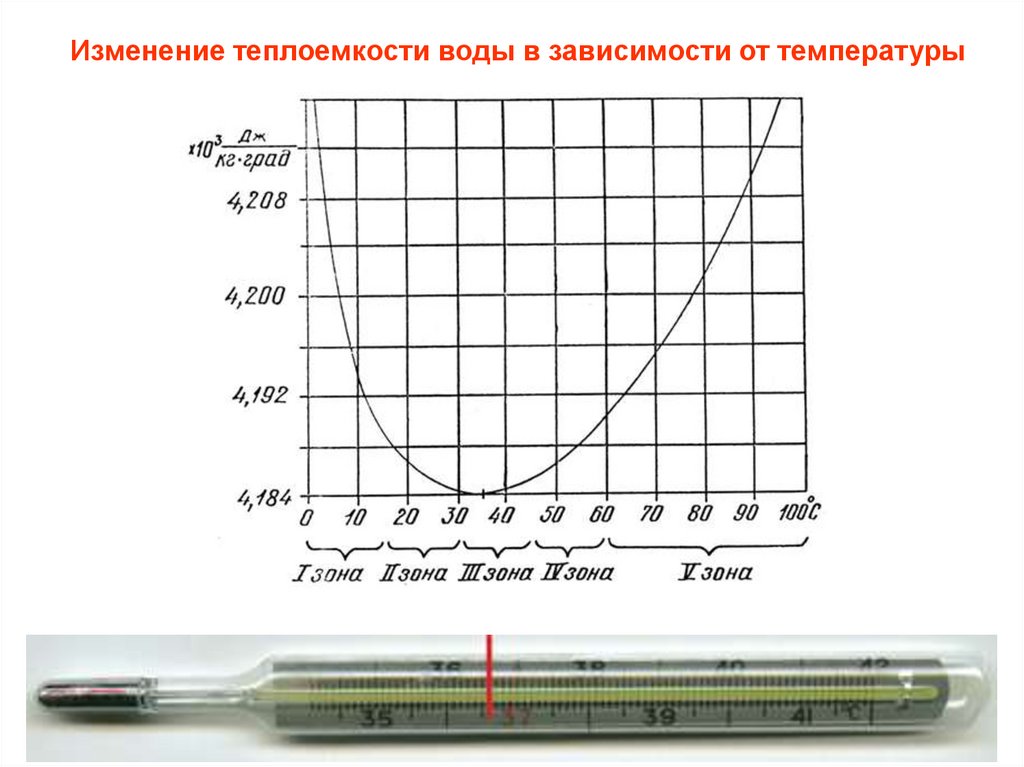
Изменение теплоемкости воды в зависимости от температуры3
4.
Значение растворовв жизнедеятельности организмов.
Важнейшие биологические жидкости - кровь, лимфа моча,
слюна, пот являются растворами солей, белков, углеводов,
липидов в воде.
Усвоение пищи связано с переходом питательных веществ в
растворенное состояние.
Биохимические реакции в живых организмах протекают в
растворах.
Биожидкости участвуют в транспорте:
- кислорода, питательных веществ (жиров, аминокислот),
- лекарственных препаратов к органам и тканям,
- выведении из организма метаболитов: мочевины, билирубина,
углекислого газа
Плазма крови является средой для клеток - лимфоцитов,
4
эритроцитов, тромбоцитов.
5.
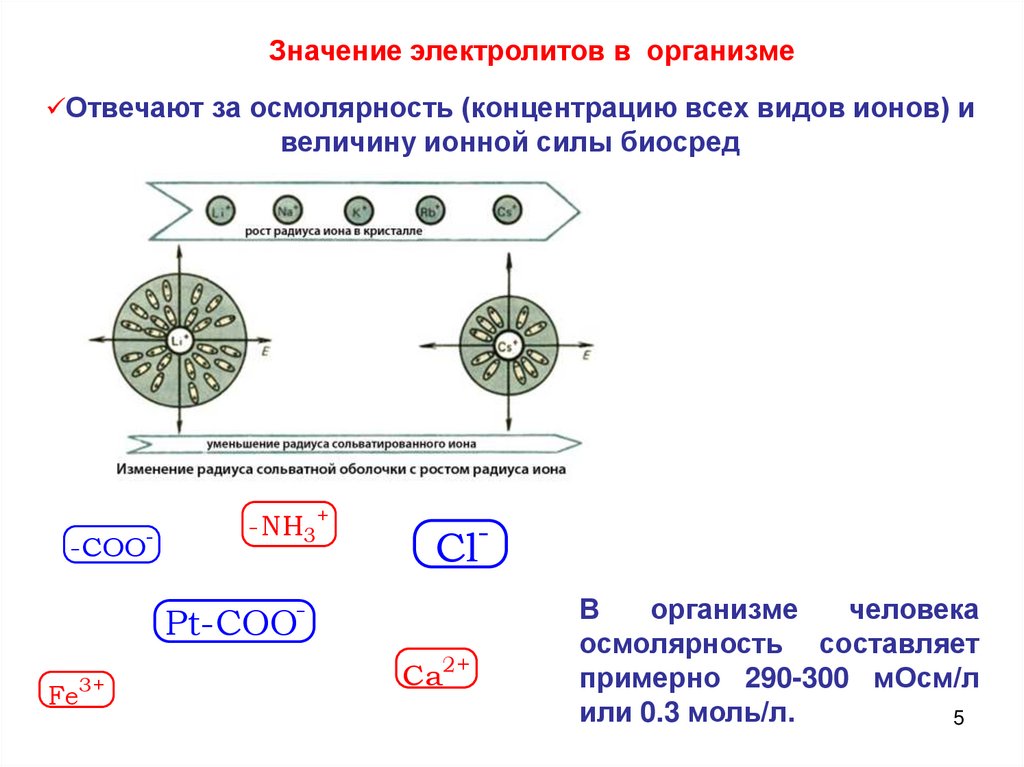
Значение электролитов в организмеОтвечают за осмолярность (концентрацию всех видов ионов) и
величину ионной силы биосред
-COO-
-NH3+
Cl-
Pt-COOFe3+
Ca2+
В
организме
человека
осмолярность составляет
примерно 290-300 мОсм/л
или 0.3 моль/л.
5
6.
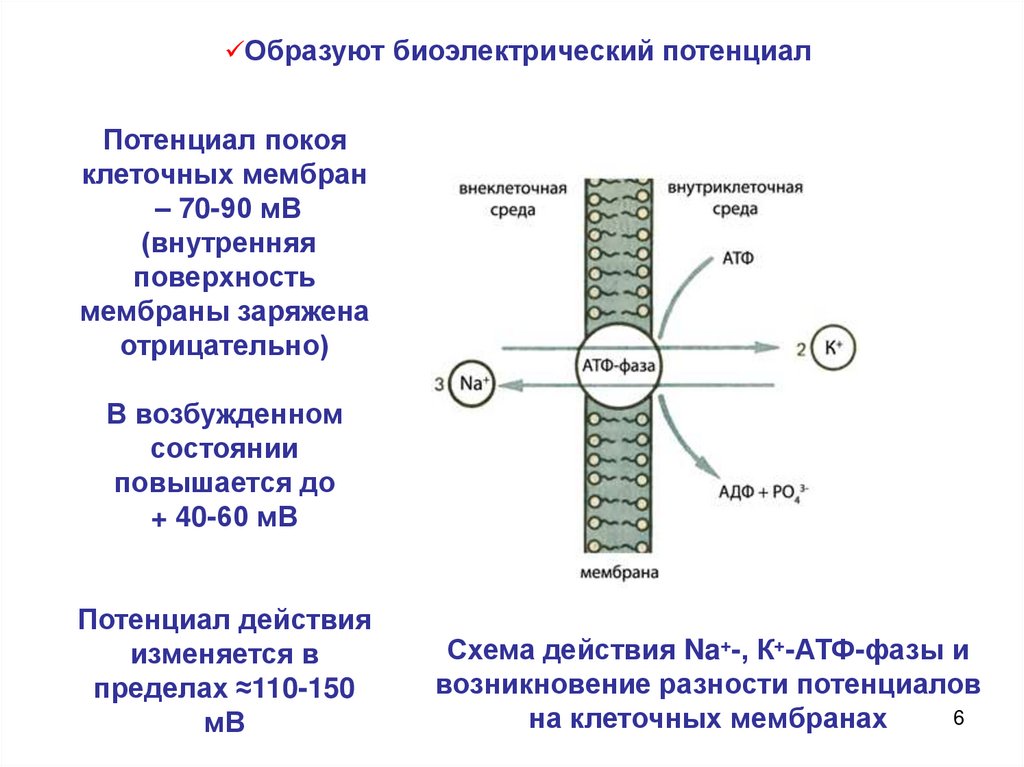
Образуют биоэлектрический потенциалПотенциал покоя
клеточных мембран
– 70-90 мВ
(внутренняя
поверхность
мембраны заряжена
отрицательно)
В возбужденном
состоянии
повышается до
+ 40-60 мВ
Потенциал действия
изменяется в
пределах ≈110-150
мВ
Схема действия Na+-, К+-АТФ-фазы и
возникновение разности потенциалов
6
на клеточных мембранах
7.
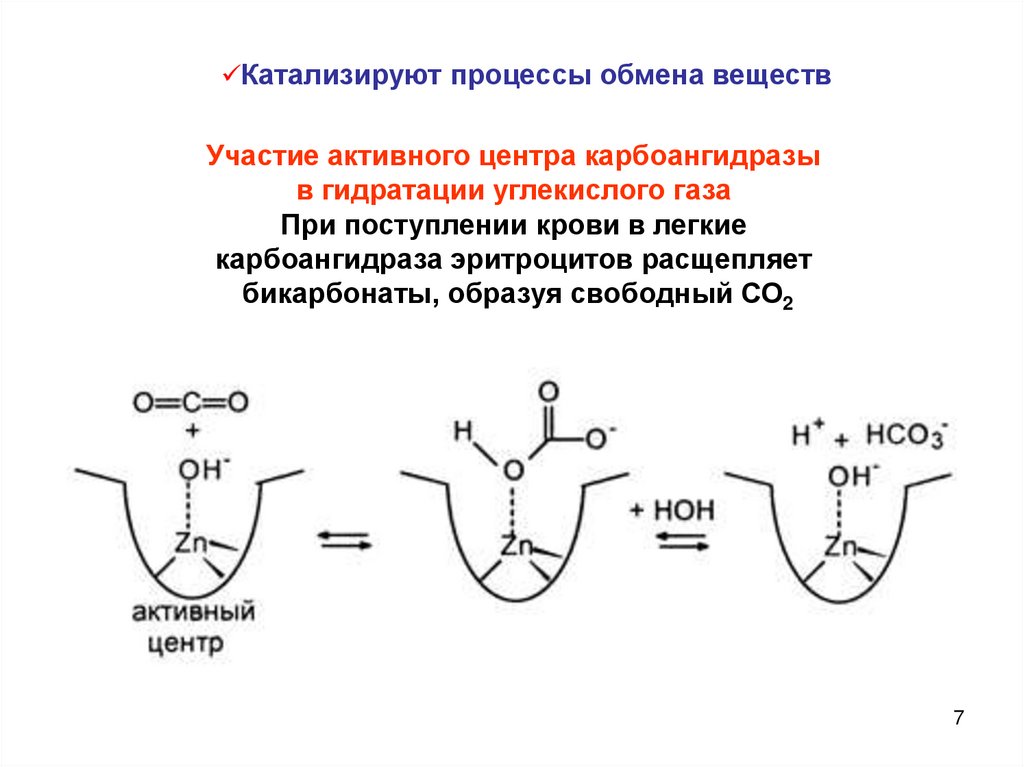
Катализируют процессы обмена веществУчастие активного центра карбоангидразы
в гидратации углекислого газа
При поступлении крови в легкие
карбоангидраза эритроцитов расщепляет
бикарбонаты, образуя свободный СО2
7
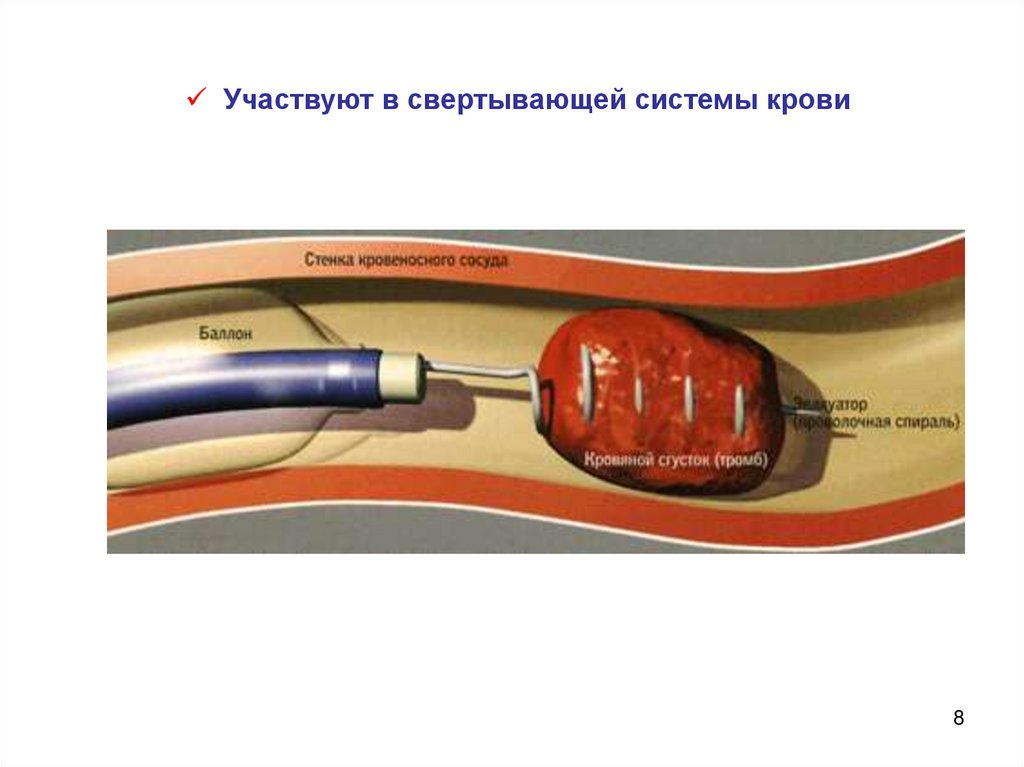
8.
Участвуют в свертывающей системы крови8
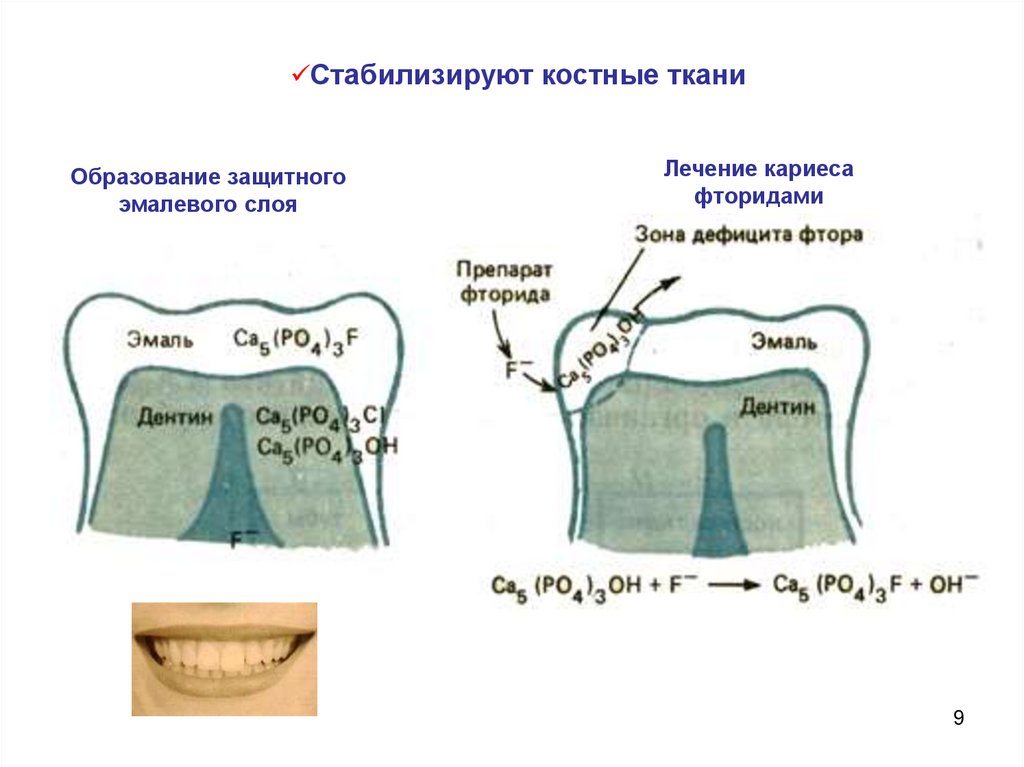
9.
Стабилизируют костные тканиОбразование защитного
эмалевого слоя
Лечение кариеса
фторидами
9
10.
КИСЛОТНО-ОСНОВНОЕ РАВНОВЕСИЕИмеющую огромное значение
для химии чистую воду... можно
рассматривать как слабую
кислоту или слабое основание.
С. Аррениус
Ионное произведение воды
Вода в малой степени ионизирована по уравнению:
H2O H+ + OH–.
Константа диссоциации Кдисс, в соответствии с законом
действующих масс, выразится уравнением:
[H ]·[OH ]
Кд
[H 2 O]
10
11.
При 25 °СКд =1.8·10 -16
Концентрацию молекул воды как в чистой воде, так и в
разбавленных водных растворах можно считать величиной
постоянной и равной:
[Н2О] =1000/18=55.56 моль/л
[Н+][ОН–] = Кд·[Н2О] = 1.8·10–16 ·55.56 = 10–14.
Кд·[Н2О] =Kw
Ионное произведение воды:
Kw=[Н+][ОН–] = 10–14
( 25° С )
В чистой воде при температуре 25 °С:
[H ] [OH ] K w 10 7
Моль/л.
11
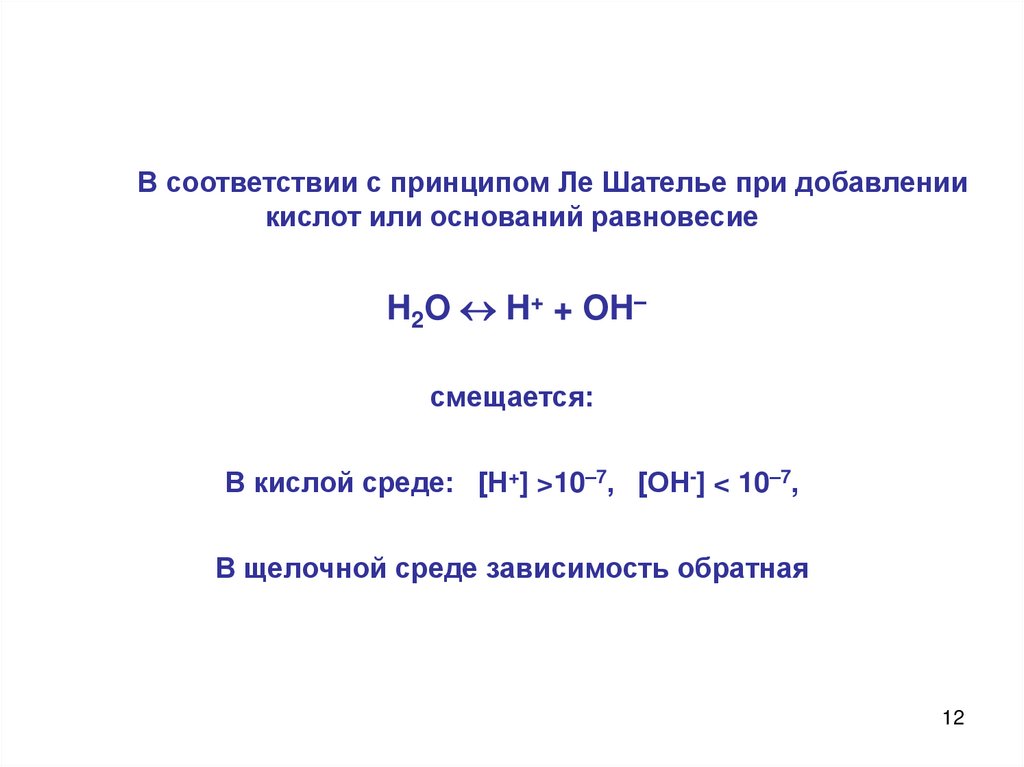
12.
В соответствии с принципом Ле Шателье при добавлениикислот или оснований равновесие
H2O H+ + OH–
смещается:
В кислой среде: [Н+] >10–7, [ОН-] < 10–7,
В щелочной среде зависимость обратная
12
13.
Диссоциация воды - эндотермический процесс, следовательно,Kw растет с повышением температуры:
Для наглядности удобно использовать величину
– lgKН2О = pKН2О.
Kw при различных температурах
t, °C
0
20
25
37
50
100
KН2О
1.2·10–15
6.9·10–15
1.0·10–14
2.5·10–14
5.5·10–14
5.1·10–13
pKН2О
14.93
14.96
14.00
13.60
13.27
13.29
13
14.
Для удобства в расчетах пользуются величинами водородногои гидроксильного показателей - рH и рОН,
pH - power Hydrogene!!!
р – отрицательный логарифм (-lg)
Шкала рН
рН = – lg[H+]
рН<7, рОН>7
рН + рОН = 14
рН = 7
рОН = – lg[OH–]
рН>7, рОН<7
14
15.
1516.
Для чистой воды рН=7Дождевая вода за счет растворенного СО2 имеет рН ~ 5.5 – 6.0
16
17.
Мрамор СаСО3 под действием слабокислой дождевой средыпереходит в растворимый гидрокарбонат Са(НСО3)2
Памятник Джорджу Вашингтону в Нью-Йорке
в момент открытия и через 60 лет
17
18.
Бронзовый памятник во влажном воздухе медленнопокрывается налетом основного карбоната меди
(СuOH)2CO3
18
19.
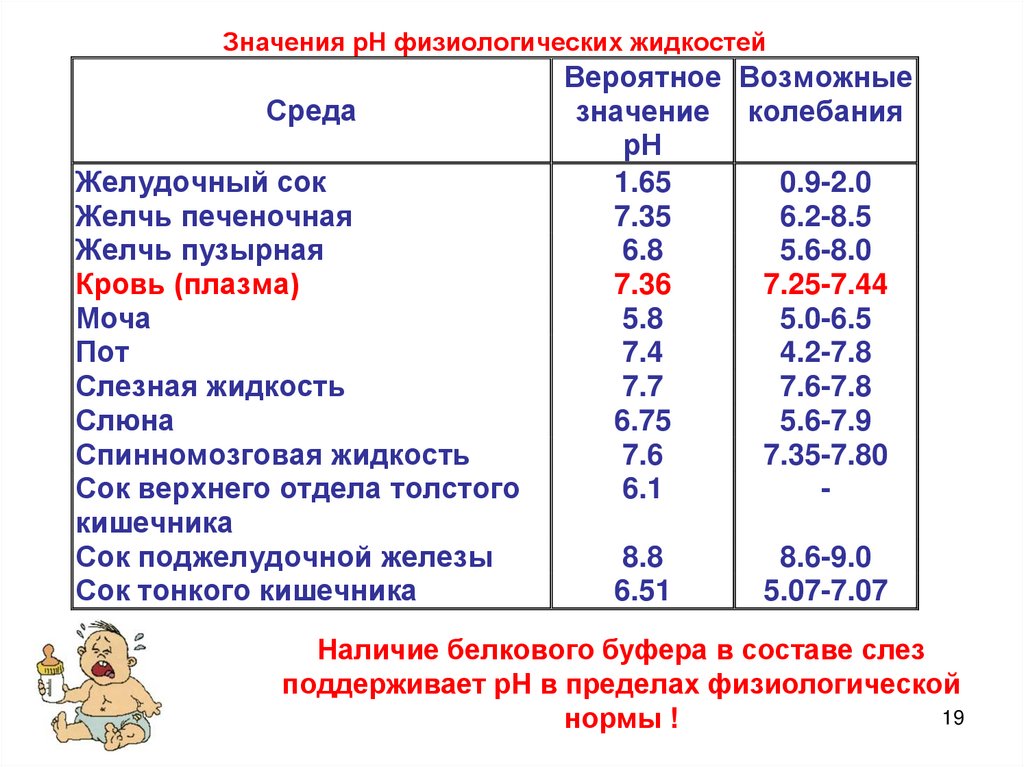
Значения рН физиологических жидкостейСреда
Желудочный сок
Желчь печеночная
Желчь пузырная
Кровь (плазма)
Моча
Пот
Слезная жидкость
Слюна
Спинномозговая жидкость
Сок верхнего отдела толстого
кишечника
Сок поджелудочной железы
Сок тонкого кишечника
Вероятное Возможные
значение колебания
рН
1.65
0.9-2.0
7.35
6.2-8.5
6.8
5.6-8.0
7.36
7.25-7.44
5.8
5.0-6.5
7.4
4.2-7.8
7.7
7.6-7.8
6.75
5.6-7.9
7.6
7.35-7.80
6.1
8.8
6.51
8.6-9.0
5.07-7.07
Наличие белкового буфера в составе слез
поддерживает рН в пределах физиологической
19
нормы !
20.
Расчет рН в растворах сильныхи слабых электролитах
Электролиты – вещества, растворы и расплавы
которых проводят электрический ток
вследствие
диссоциации на ионы.
20
21.
Сильные электролиты диссоциируют полностью, необратимо,в одну ступень.
HCl
H Cl ,
Al2 (SO4 )3
2Al
3
3SO4
2
a f ·c, 0 f 1
im f 1
(c 0)
a – активность
a c
иона
f – коэффициент активности,
учитывающий межионное
21
взаимодействие
22.
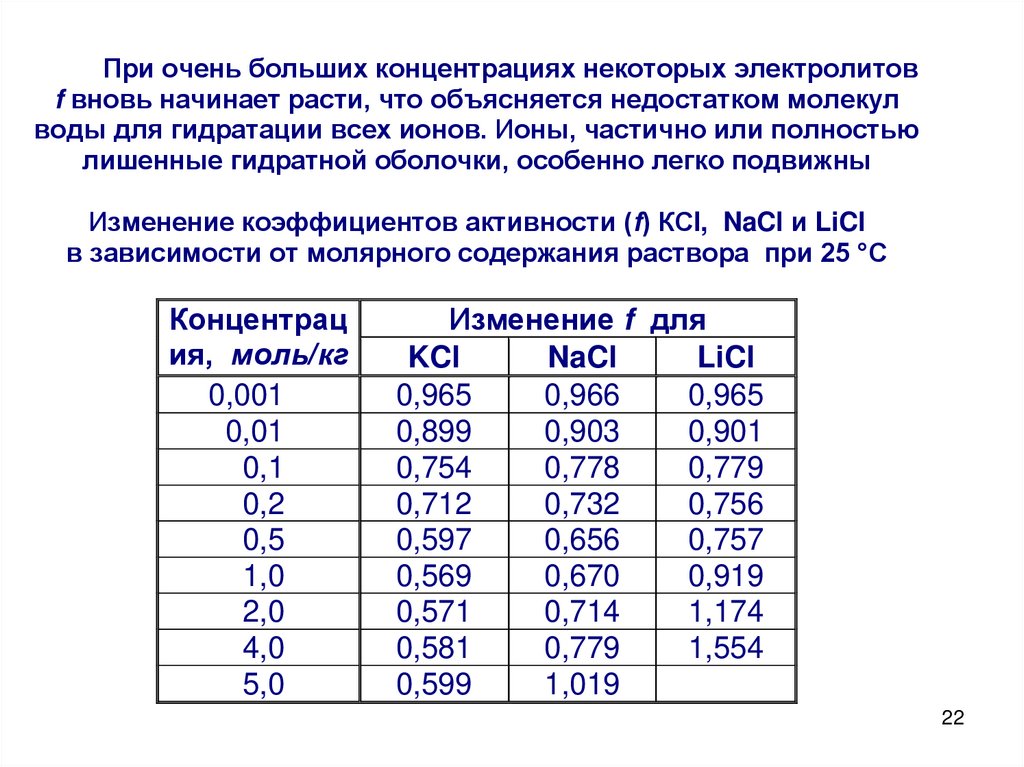
При очень больших концентрациях некоторых электролитовf вновь начинает расти, что объясняется недостатком молекул
воды для гидратации всех ионов. Ионы, частично или полностью
лишенные гидратной оболочки, особенно легко подвижны
Изменение коэффициентов активности (f) КСl, NaCl и LiCl
в зависимости от молярного содержания раствора при 25 °С
Концентрац
ия, моль/кг
0,001
0,01
0,1
0,2
0,5
1,0
2,0
4,0
5,0
Изменение f для
KCl
NaCl
LiCl
0,965
0,966
0,965
0,899
0,903
0,901
0,754
0,778
0,779
0,712
0,732
0,756
0,597
0,656
0,757
0,569
0,670
0,919
0,571
0,714
1,174
0,581
0,779
1,554
0,599
1,019
22
23.
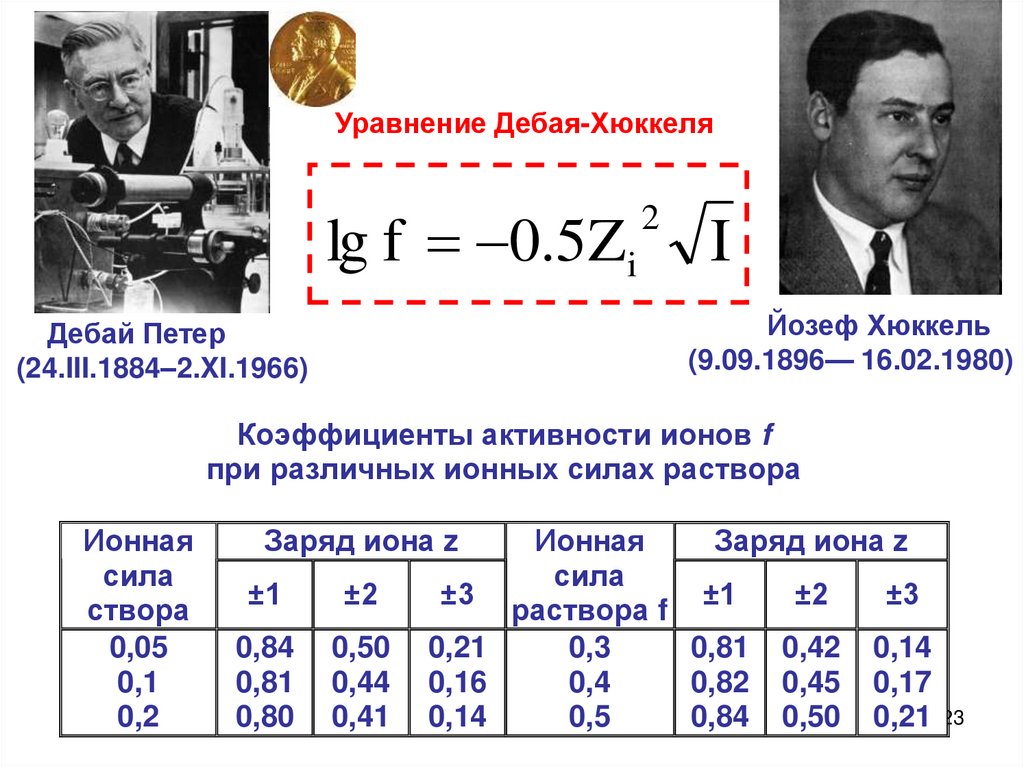
Уравнение Дебая-Хюккеляlg f 0.5Zi
2
I
Йозеф Хюккель
(9.09.1896— 16.02.1980)
Дебай Петер
(24.III.1884–2.XI.1966)
Коэффициенты активности ионов f
при различных ионных силах раствора
Ионная
сила
створа
0,05
0,1
0,2
Заряд иона z
±1
±2
0,84
0,81
0,80
0,50
0,44
0,41
Ионная
Заряд иона z
сила
±3
±1
±2
±3
раствора f
0,21
0,3
0,81 0,42 0,14
0,16
0,4
0,82 0,45 0,17
0,14
0,5
0,84 0,50 0,21 23
24.
Ионная сила растворовИонная сила растворов - величина, измеряемая полусуммой
произведений концентраций всех находящихся в растворе
ионов на квадрат их заряда (понятие введено Г. Льюисом )
1
I C z C z ... C z
2
2
1 1
2
2 2
2
n n
Ионная сила характеризует общее число ионных зарядов в
единице объема, независимо от их знаков.
Размерность - обратна размерности объема.
Ионная сила – удобная характеристика раствора, учитывающая
взаимодействие ионов, что важно для изучения биологических
систем и физиологических растворов, ионная сила которых, в том
числе и 0.9% (0.15м) NaCI равна, как правило, 0.15 .
24
25.
1) В водных растворах сильных кислот (HNO3, HCl, H2SO4 и др.):[H ] αк C( 1 к та);
z
где С( 1 к-та) молярная концентрация эквивалента
z кислоты (для одноосновных кислот она равна
молярной концентрации кислоты);
αк кажущаяся степень диссоциации (в долях от единицы).
25
26.
2) В водных растворах сильных оснований (NaOH, KОН, Са(ОН)2, Sr(OH)2и др.):
где
[OH ] αк С( 1 осн),
z
С( 1
осн) молярная концентрация эквивалента основания (для однокислотных
z
оснований она равна молярной концентрации основания);
26
27.
Расчет рН в растворах сильных электролитахРассчитать рН, рОН, [OH-] для 0,001 M НNO3
HNO 3
H NO3
pH lg 10 3 3
pOH 14 – 3 11
[OH ] 10
pOH
10
[H ] 10
pH
[OH ] 10
11
Н [OН ]
К Н 2О
рН = 14 - рОН
;
pOH
[OH ] 1014 pH
ОН [Н ]
К Н 2О
рОН = 14 - рН
27
28.
Задача 1. рН яблочного сока равен 4,57.Найти [Н+] и [OH-] (моль/л).
[H ] 10
pH
10
- 4.57
5
10 10
0.43
5
2.69 10 моль - экв/л
[OH ] 10
ОН
К Н 2О
pOH
14
10
10
3
.
72
10
моль - экв/л
5
[ Н ] 2.69 10
рОН = 14 - рН
28
29.
Для растворов сильных электролитов с высокой концентрациейпри расчетах рН и рОН следует использовать значения активности
ионов Н+ и ОН–:
pH lg a H lg f H c H
и
pOH lg a OH lg f OH c OH
29
30.
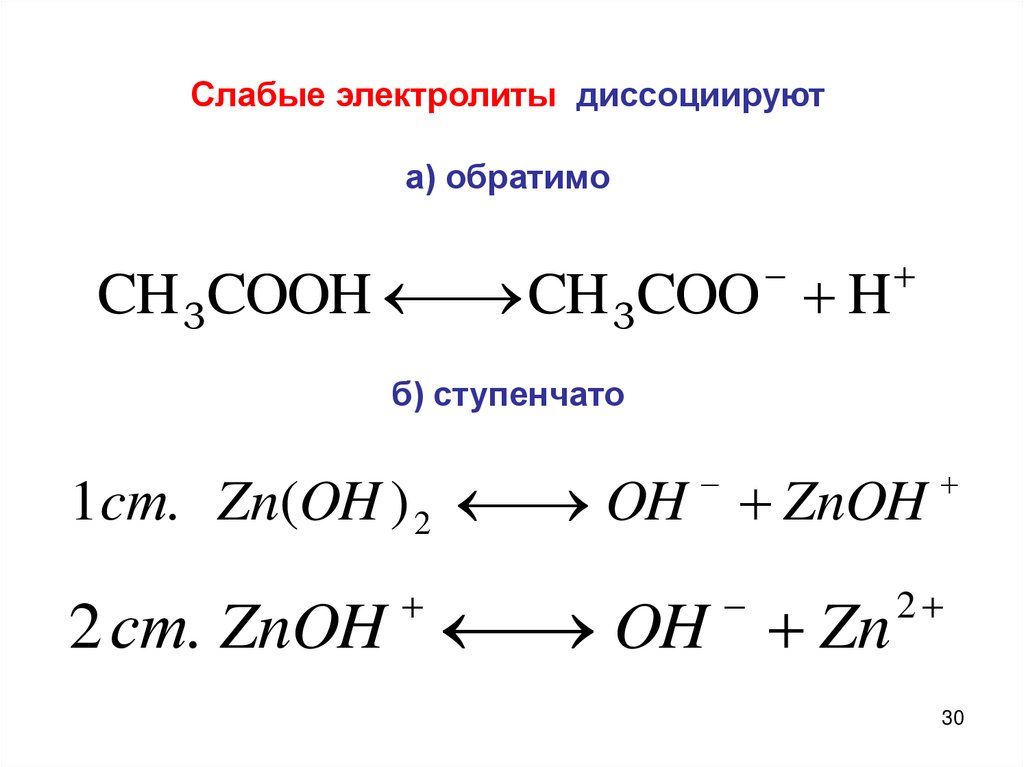
Слабые электролиты диссоциируюта) обратимо
CH 3COOH
CH 3COO H
б) ступенчато
1cт. Zn(OH ) 2
OH ZnOH
2 ст. ZnOH
OH Zn
2
30
31.
Степень диссоциации (ионизации) - отношениечисла молекул, распавшихся на ионы, к общему числу
молекул в растворе.
n диссоц.
, 0 1
n общ.
α зависит от:
Природы вещества и растворителя;
Концентрации;
Температуры;
Присутствия одноименного иона.
31
32.
Расчет [ Н+] и рН для растворов слабых электролитовКислоты
[H ] К д(к) ·C(к )
pH 12 pК д (к) 12 lg C(к )
Смесь кислот
[H ] С1К д1 ( к ) C 2 K д 2 ( к )
32
33.
Основания[OH ] К д (осн.)·C(осн.)
pOH 12 pК д(осн.) 12 lg C( осн.)
pH 14 12 pК д (осн.) 12 lg C( осн.)
Для смеси оснований
[OH ] C1К Д1 ( осн.) C 2 K Д 2 ( осн.)
-
33
34.
Задача 2. Найти рН, [Н+] и [OH-] 0,3 M растворамуравьиной кислоты (Ка=1.8∙10-4)
[H ] К д(к)·C(к ) 1.8 10 4 0.3 7.3 10 3 моль - экв/л
рН = – lg[H+] = – lg7.3∙10-3 = – lg7.3 – lg10-3 =
= 3 – lg7.3=3-0.86 = 2.14
34
35.
Для слабых многоосновных кислот/многокислотныхоснований учитывают диссоциацию только по первой
ступени!!!
35
36.
Общая, активная и потенциальная кислотностьАктивная кислотность – концентрация свободных катионов Н+,
имеющихся в растворе при данных условиях.
Мерой активной кислотности является значение рН раствора:
pH = -lg[H+]
Потенциальная кислотность – концентрация катионов Н+,
связанных в молекулы или ионы слабых кислот, имеющихся в
растворе.
Сильные кислоты:
HCl
H Cl
[H+]акт = [H+]общ,
Слабые кислоты:
[H+]пот=0.
CH 3COOH
CH 3COO- H
[H+]общ = [H+]пот + [H+]акт
[H+]пот > > [H+]акт
36
37.
ГИДРОЛИЗ СОЛЕЙ37
38.
Гидролиз солей - процесс взаимодействия ионов соли ссоставными частями воды (Н+ и ОН–).
Причина-образование малодиссоциированных соединений
(слабых электролитов)
Следствие – сдвиг равновесия диссоциации (ионизации)
воды, который сопровождается изменением кислотности
среды вследствие накопления Н+ или ОН– ионов.
38
39.
Гидролиз – процесс:обратимый ( ↔ )
ступенчатый
эндотермический (-Q), так как обратен реакции
нейтрализации.
Гидролиз идет по слабому компоненту соли!
Кислотность определяет сильный компонент!
Количественно гидролиз характеризуется
гидролиза Кг и степенью гидролиза h.
константой
39
40.
Варианты гидролиза:1.
Соль образована одноосновной слабой кислотой и
однокислотным сильным основанием (NaСN, CH3COONa,
NaNO2…) – среда щелочная
CH3COONa H 2O NaOH CH3COOH
CH3COO H 2O OH CH3COOH
Константа гидролиза Кг
[OH ][CH3COOH]
Кр
[H 2O][CH3COO ]
Так как [H2O] практически постоянна,
[OH ][CH3COOH]
К р [ H 2 O] К г
[CH3COO ]
40
41.
Связь Кг с ионным произведением воды и Кд[OH ][CH 3COOH]
Кг
[CH 3COO ]
Домножим числитель и знаменатель на [H+]:
[H ][OH ][CH 3COOH] K H 2O
Кг
[H ][CH 3COO ]
К д (к)
Кг
K H 2O
К Д CH 3COOH
10 14
10
Кг
5
,
7
·
10
1,75·10 5
Значение Кг показывает, что в момент равновесия произведение
концентраций исходных веществ примерно в миллиард раз
больше, чем продуктов реакции, что говорит об относительно
41
небольшой степени протекания гидролиза.
42.
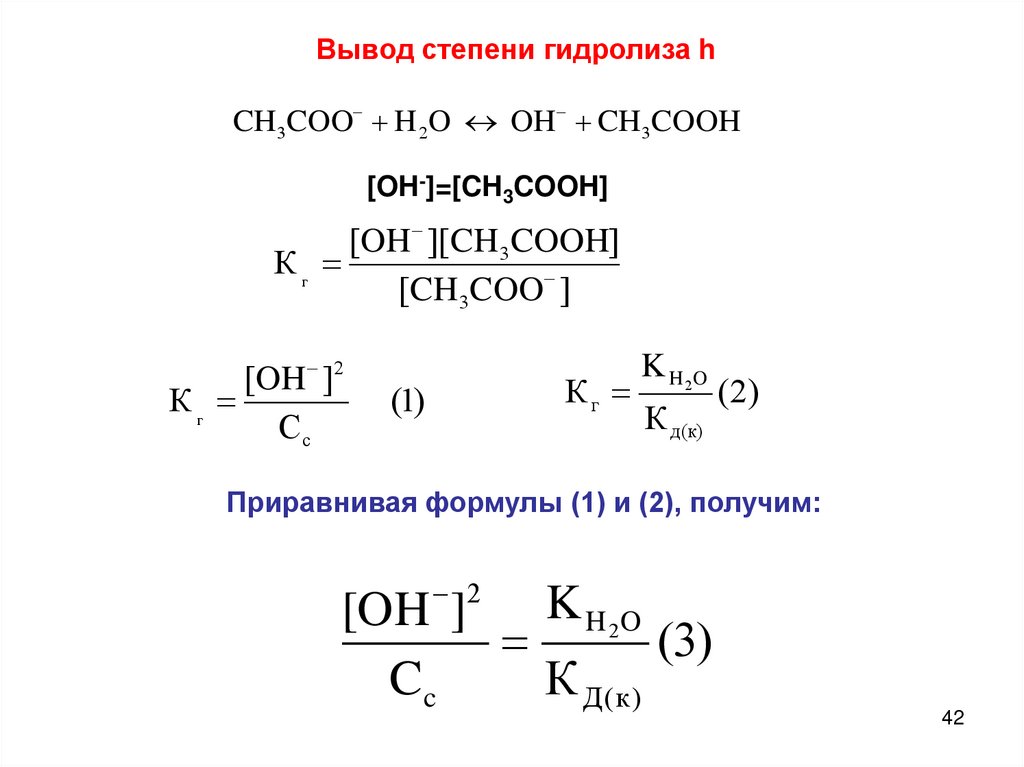
Вывод степени гидролиза hCH3COO H 2O OH CH3COOH
[OH-]=[CH3COOH]
[OH ][CH 3COOH]
Кг
[CH 3COO ]
[OH ]2
Кг
Сс
Кг
(1)
K H 2O
К д(к)
( 2)
Приравнивая формулы (1) и (2), получим:
2
K H 2O
[OH ]
(3)
Cc
К Д (к )
42
43.
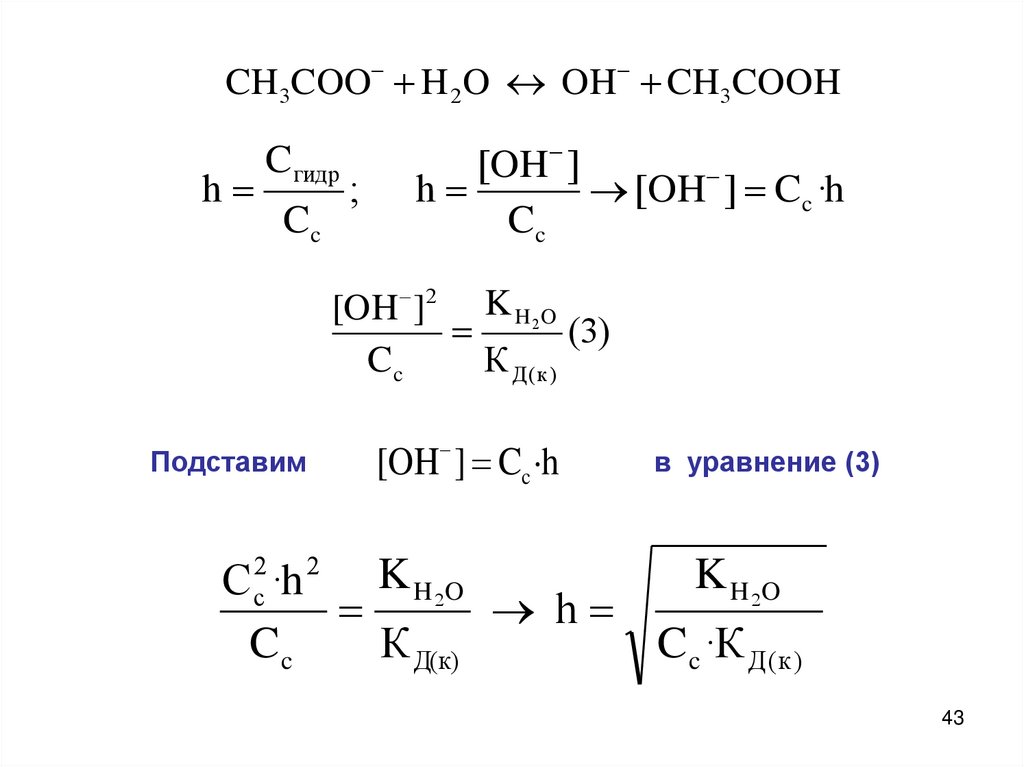
CH3COO H 2O OH CH3COOHh
Cгидр
Cc
;
[OH ]
h
[OH ] Cc ·h
Cc
[OH ]2 K H 2O
(3)
Cc
К Д (к )
[OH ] Cc ·h
Подставим
2
c
в уравнение (3)
2
K H 2O
K H 2O
C ·h
h
Cc
К Д(к)
C c ·К Д ( к )
43
44.
Вывод формулы для расчёта pH[OH ]2 K H 2O
(3)
Cc
К Д (к )
CH3COONa ( рН>7 )
[OH ]
K H 2O ·Cc
Kд к
1
1
1
pOH lg K H 2O lg Cc lg K д к
2
2
2
pH 14 pOH
1
1
pH 7 pКд к lg Cc
2
2
44
45.
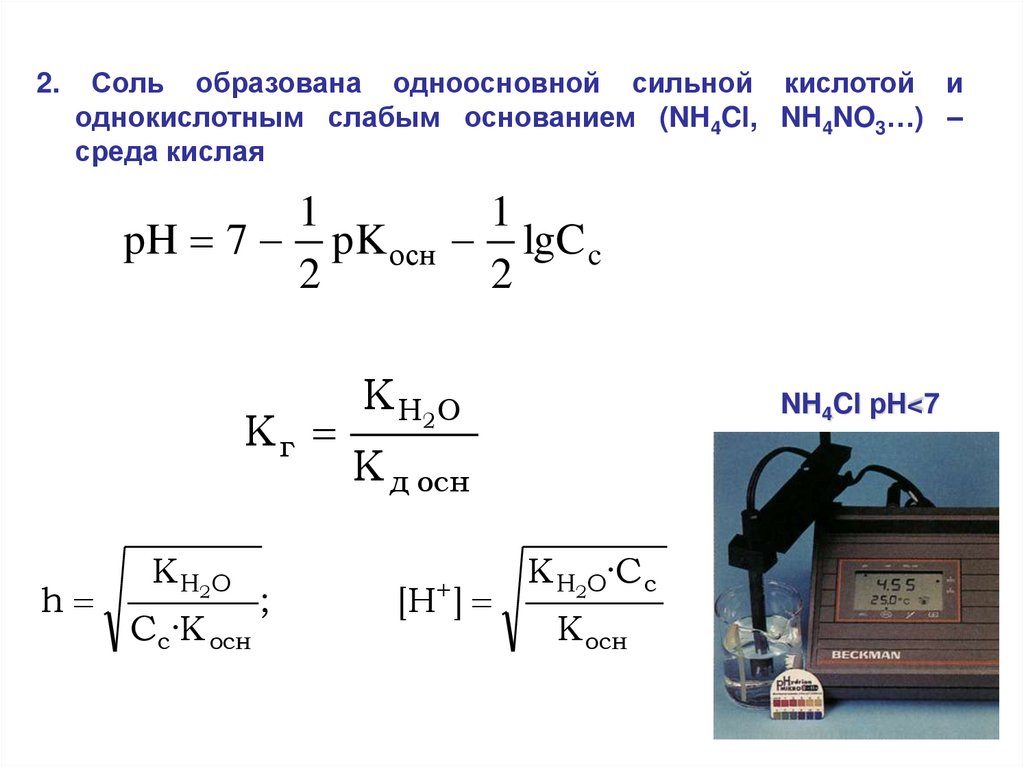
2.Соль образована одноосновной сильной кислотой и
однокислотным слабым основанием (NH4Cl, NH4NO3…) –
среда кислая
1
1
pH 7 pK осн lgC c
2
2
Кг
h
K H2O
Cc·K осн
;
K H2O
NH4Cl рН<7
K д осн
[H ]
K H2O·C c
K осн
45
46.
3. Соль образована слабым однокислотным основанием ислабой одноосновной кислотой (NH4CN, CH3COONH4…) –
среда ≈ нейтральная рН не зависит от концентрации соли,
гидролиз проходит достаточно глубоко
1
1
pH 7 pK к pК осн
2
2
h
K H 2O
К к·Kосн
;
[H ]
CH3COONН4+ ( рН ≈ 7 )
K H 2O·К к
K осн
10 14
Кг
0,9
10
5
K NH4OH ·K HCN 6,2·10 ·1,75·10
K H 2O
46
47.
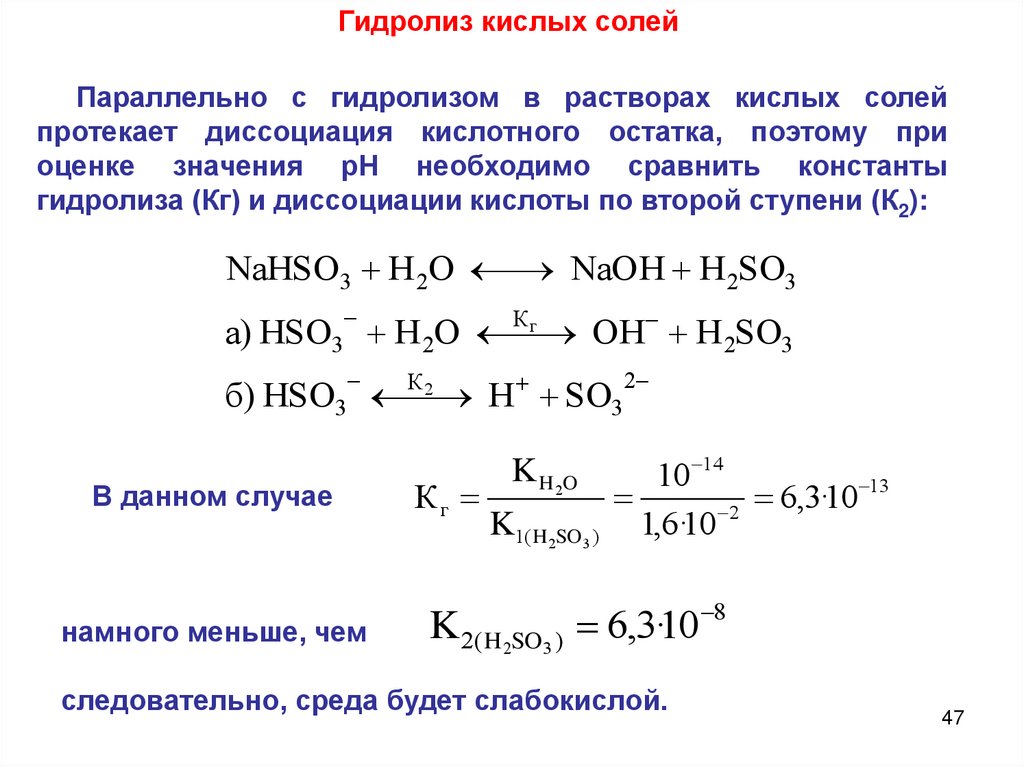
Гидролиз кислых солейПараллельно с гидролизом в растворах кислых солей
протекает диссоциация кислотного остатка, поэтому при
оценке значения рН необходимо сравнить константы
гидролиза (Кг) и диссоциации кислоты по второй ступени (К2):
NaHSO 3 H 2O
NaOH H 2SO3
Кг
а) HSO3 H 2O
OH H 2SO3
К2
б) HSO3
H SO3
В данном случае
намного меньше, чем
2
10 14
13
Кг
6
,
3
·
10
K1( H 2SO3 ) 1,6·10 2
K H 2O
K 2( H2SO3 ) 6,3·10
следовательно, среда будет слабокислой.
8
47
48.
Растворы кислых солей имеют различный характер среды:Na2HPO4 - щелочная
NaH2PO4 – кислая
Раствор питьевой соды NaHCO3 имеет слабощелочную среду
и используется в медицине для предотвращения ацидозов
Расчет степени гидролиза концентрации ионов водорода и
рН среды для кислых солей
1
1
pH pK 1 к pK 2 к
2
2
K2 к
h 2
;
К1 к
[H ] К1 к ·K 2 к
48
49.
Ступенчатый гидролизВ случае солей многоосновных кислот или
многокислотных оснований процесс гидролиза протекает
ступенчато
1- я ступень: Na 2СO3 H 2O NaOH NaHCO 3
2
CO3 H 2O OH HCO3
2-я ступень:
NaHСO 3 H 2O NaOH H 2CO3
HCO3 H 2O OH H 2CO3
K H 2O
K H 2O
4
Кг 1
2,1·10 ;
Кг 2
2,2·10 8
Kд 2
Kд1
1
1
pH 7 pKд2 к lg Cc
2
2
Сравнение величин Кг1 и Кг2 показывает, что практически гидролиз
протекает только по первой ступени.
Cмещением равновесия вправо ( нагреванием и разбавлением
раствора – согласно принципу Ле-Шателье) можно добиться в ряде
49
случаев реализации гидролиза по второй и даже по третьей ступени.
50.
Смещение равновесияобратимого гидролиза
50
51.
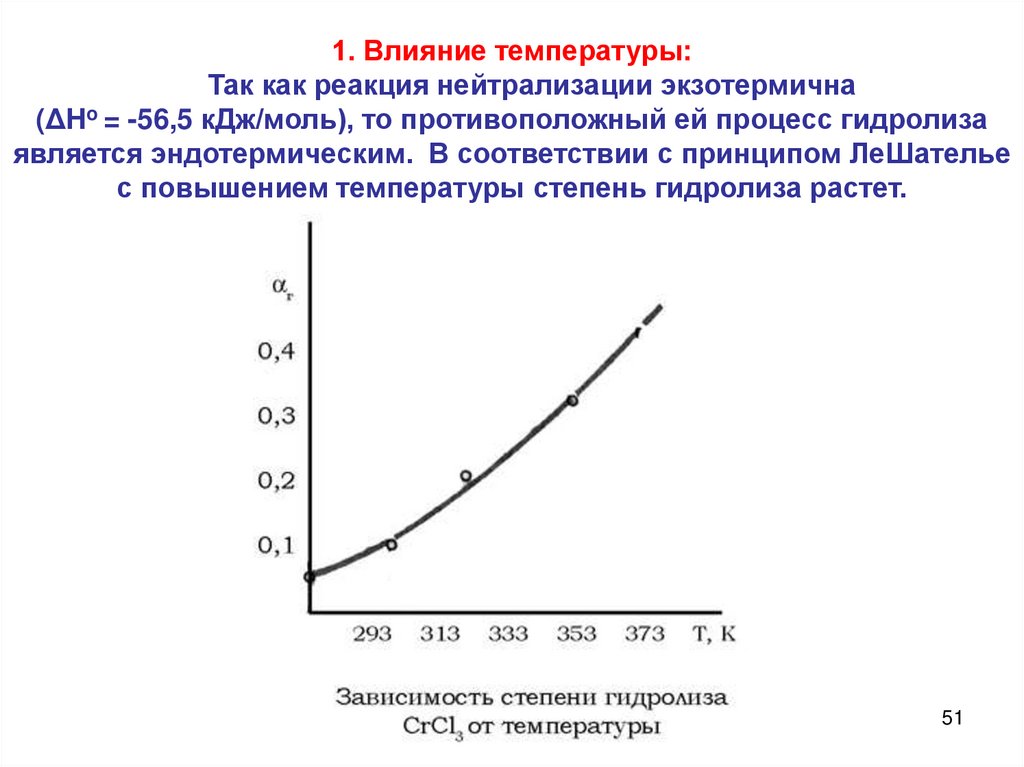
1. Влияние температуры:Так как реакция нейтрализации экзотермична
(ΔHo = -56,5 кДж/моль), то противоположный ей процесс гидролиза
является эндотермическим. В соответствии с принципом ЛеШателье
с повышением температуры степень гидролиза растет.
51
52.
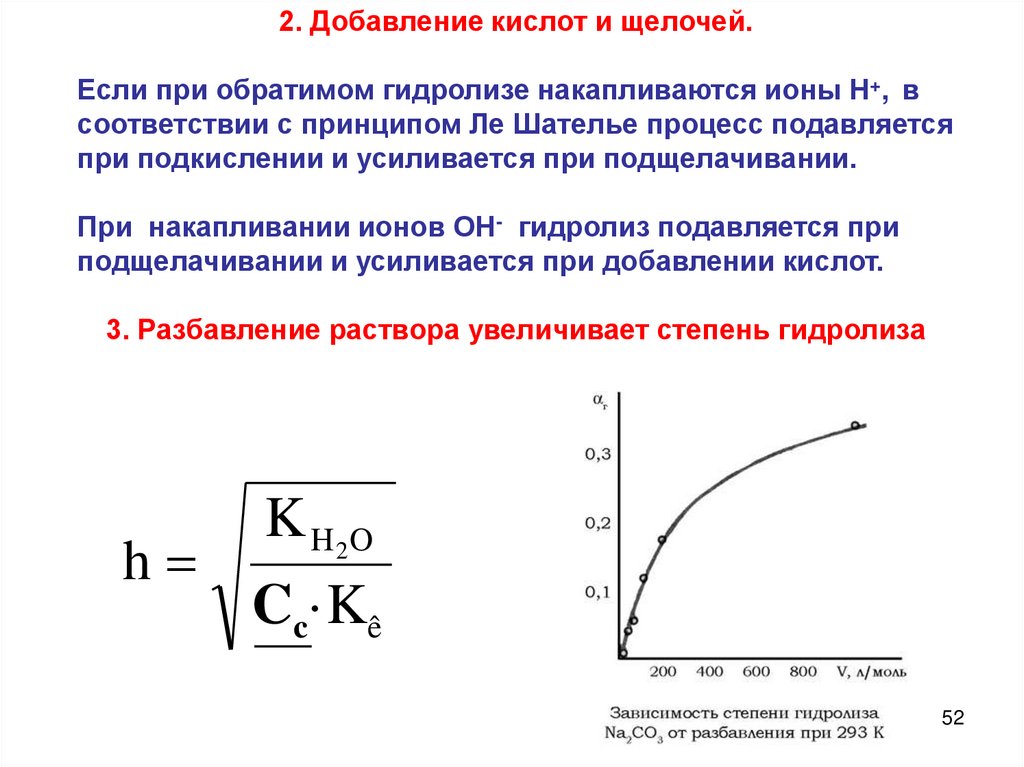
2. Добавление кислот и щелочей.Если при обратимом гидролизе накапливаются ионы Н+, в
соответствии с принципом Ле Шателье процесс подавляется
при подкислении и усиливается при подщелачивании.
При накапливании ионов ОН- гидролиз подавляется при
подщелачивании и усиливается при добавлении кислот.
3. Разбавление раствора увеличивает степень гидролиза
h
K H 2O
Cc·Kê
52
53.
Необратимый гидролизЕсли какое-либо из образующихся в процессе гидролиза
веществ накапливается в растворе в таких количествах, что
станет возможным выделение его в осадок или
улетучивание в виде газа, то гидролиз будет необратимым,
что приведет к полному разложению соли водой:
Al 2S3 6H 2O 2Al(OH) 3 3H 2S
2AlCl 3 3Na 2CO3 3H 2O 2Al(OH) 3 3CO2 6 NaCl
или
2Al3 3CO32- 3H 2O 2Al(OH) 3 3CO2
Соли, подвергающиеся необратимому гидролизу:
Cr2S3 , Al 2 (CO 3 )3 , Cr2 (CO 3 )3 , Fe 2 (CO 3 )3
53
54.
Роль гидролиза биоорганических соединенийв процессах жизнедеятельности
1. Каждый из ферментов активен при строго определенных
значениях рН:
пепсин желудочного сока активен при рН 1,5–2,0,
каталаза крови – при рН 7,0;
тканевые кетапсины при реакции среды, близкой
к нейтральной, катализируют синтез белка,
а при кислой реакции расщепляют его.
2. Ионы водорода катализируют гидролиз сложных
сахарозы.
жиров,
54
55.
3. Без ферментативного гидролиза невозможно усвоениепищевых продуктов (жиры, углеводы, белки) , так как
всасываться в кишечнике способны только относительно
небольшие молекулы.
Жиры в желудочно-кишечном тракте расщепляются водой на
более мелкие фрагменты.
R1—О—R2 + H2O → R1—ОН + R2—ОН
R1, R2 — фрагменты биоорганической молекулы
Усвоение полисахаридов и дисахаридов становится
возможным лишь после полного их гидролиза ферментами
до моносахаридов.
Белки гидролизуются до веществ, которые лишь потом могут
усваиваться.
55
56.
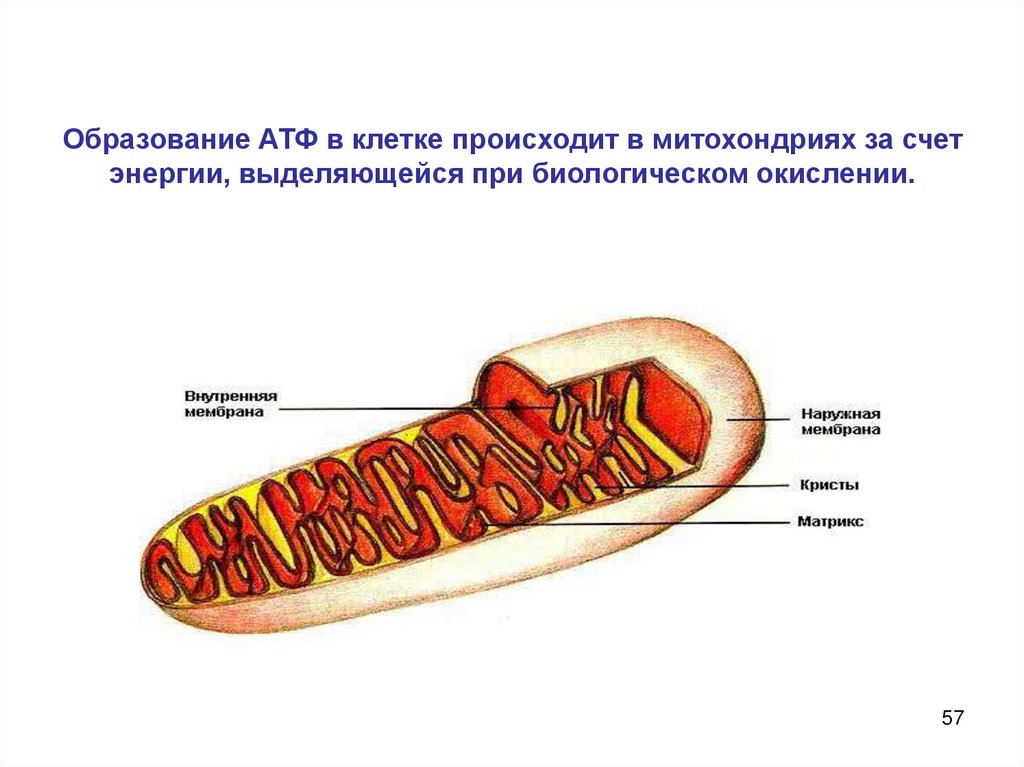
4. Гидролиз АТФ - источник энергии в организмеЧеловек получает энергию как за счет многостадийного процесса
окисления пищи — белков, жиров и углеводов, так и за счет
гидролиза некоторых сложных эфиров, амидов, пептидов и
гликозидов.
Космические ракеты высотой с
башню устремляются в небо за счет
громадной энергии, что выделяется
при сжигании водорода в чистом
кислороде.
Эта же энергия поддерживает
жизнь и в клетках нашего тела. В
них реакция окисления протекает
поэтапно. Кроме того, сначала
вместо тепловой и кинетической
энергии наши клетки создают
56
клеточное «топливо» — АТФ.
57. Образование АТФ в клетке происходит в митохондриях за счет энергии, выделяющейся при биологическом окислении.
5758.
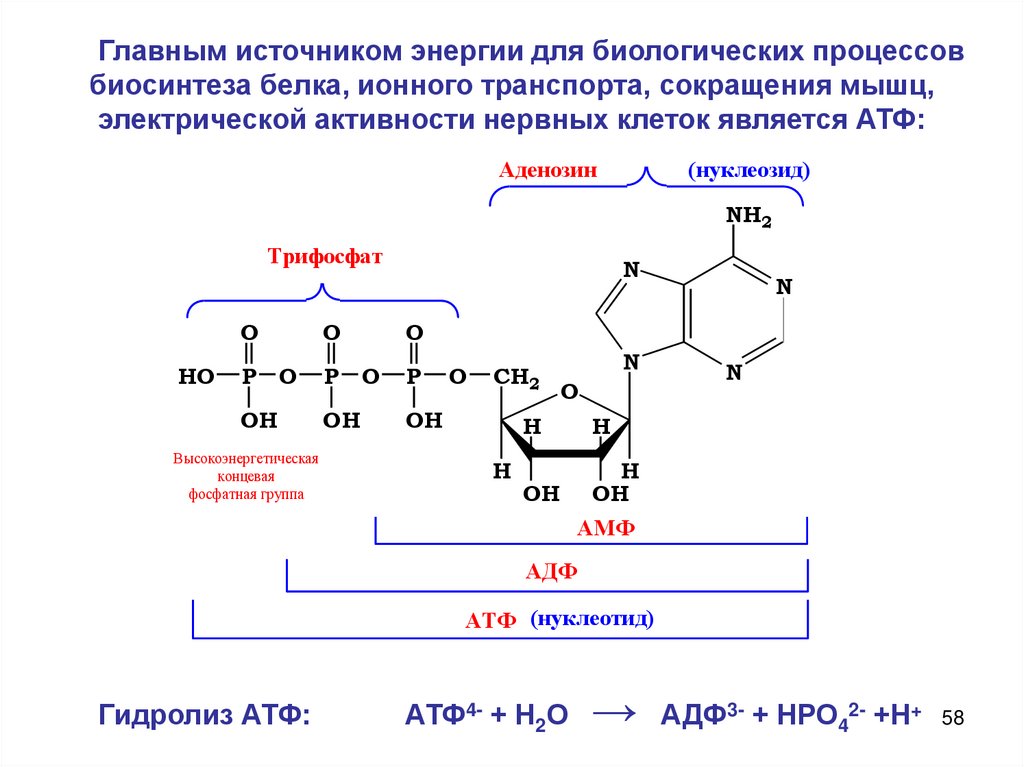
Главным источником энергии для биологических процессовбиосинтеза белка, ионного транспорта, сокращения мышц,
электрической активности нервных клеток является АТФ:
Аденозин
(нуклеозид)
NH2
Трифосфат
HO
N
O
O
O
P O
P O
P
OH
OH
OH
Высокоэнергетическая
концевая
фосфатная группа
O
CH2
H
N
O
H
H
OH
H
OH
N
N
АМФ
АДФ
АТФ (нуклеотид)
Гидролиз АТФ:
АТФ4- + Н2О
→ АДФ3- + НРО42- +Н+ 58
59.
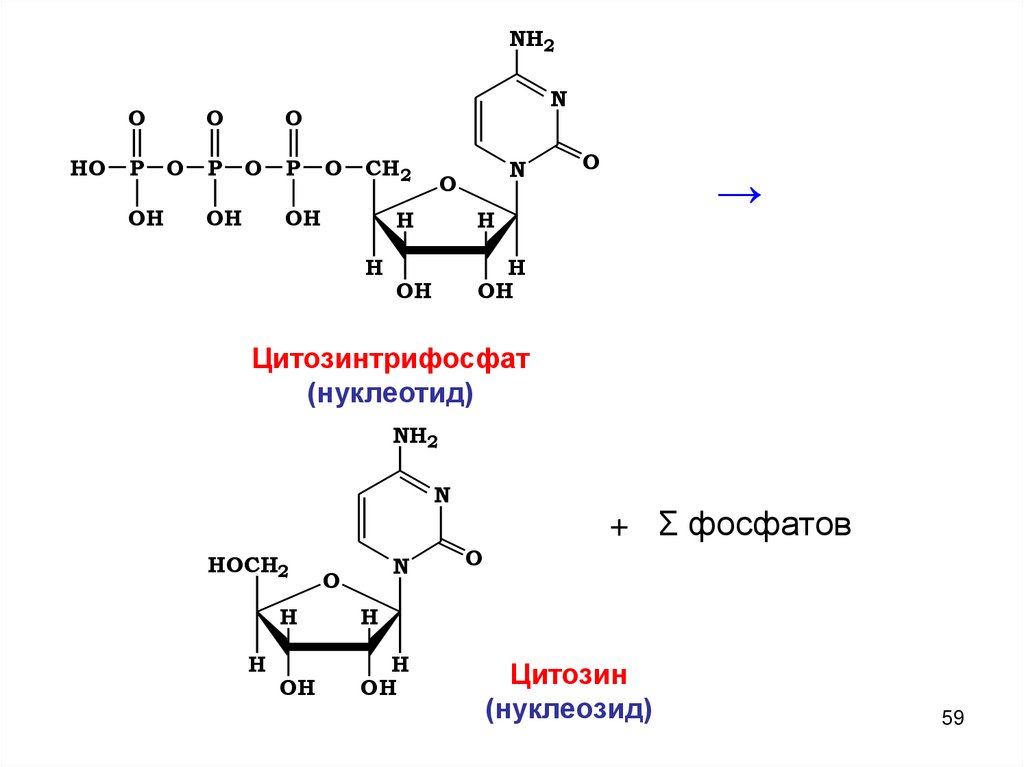
NH2O
HO
P
OH
O
O
P
N
O
O
OH
P
O
CH2
OH
H
N
O
H
H
OH
H
OH
O
→
Цитозинтрифосфат
(нуклеотид)
NH2
N
HOCH2
H
N
O
H
H
OH
H
OH
+ Σ фосфатов
O
Цитозин
(нуклеозид)
59
60.
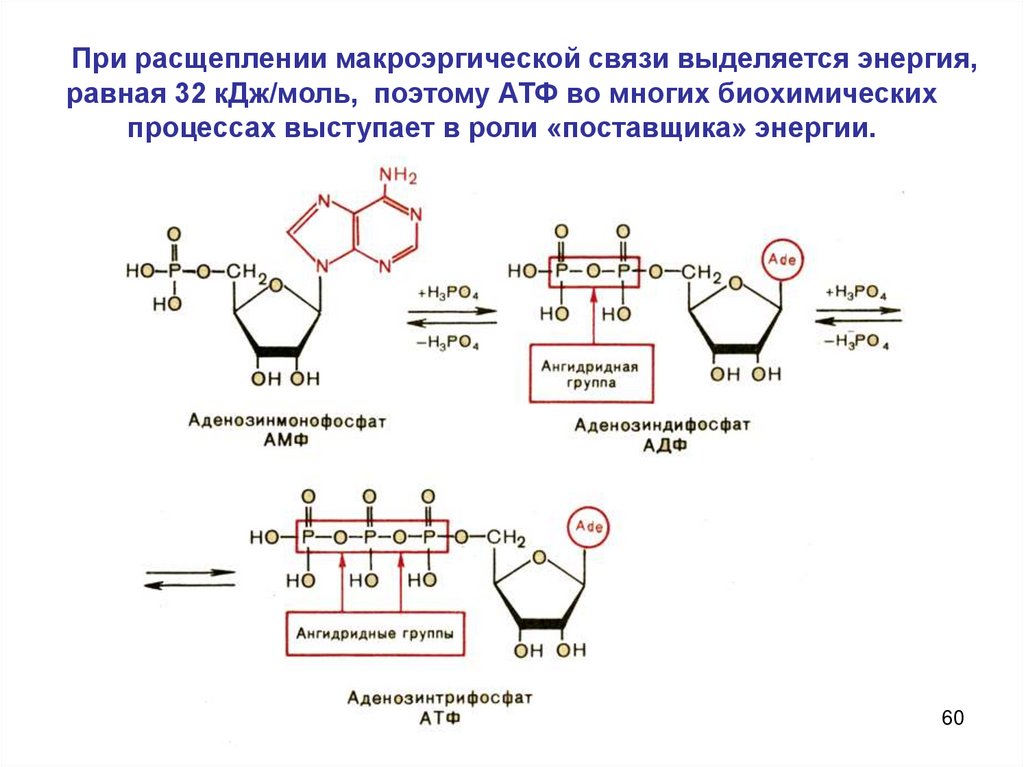
При расщеплении макроэргической связи выделяется энергия,равная 32 кДж/моль, поэтому АТФ во многих биохимических
процессах выступает в роли «поставщика» энергии.
60
61.
5. Гидролиз –один из важнейших путей метаболизмалекарственных препаратов и пищевых продуктов
Процесс гидролиза может
идти:
В плазме крови
На клеточных мембранах
В цитоплазме клеток
Во внутренних органеллах,
в частности в лизосомах
61
62.
Большинство лекарственных веществ метаболизируются впечени, располагающей для этого набором ферментных систем
весьма большой мощности.
Эти ферментные системы локализованы либо в митохондриях,
либо в микросомах, либо в гиалоплазме.
62
63.
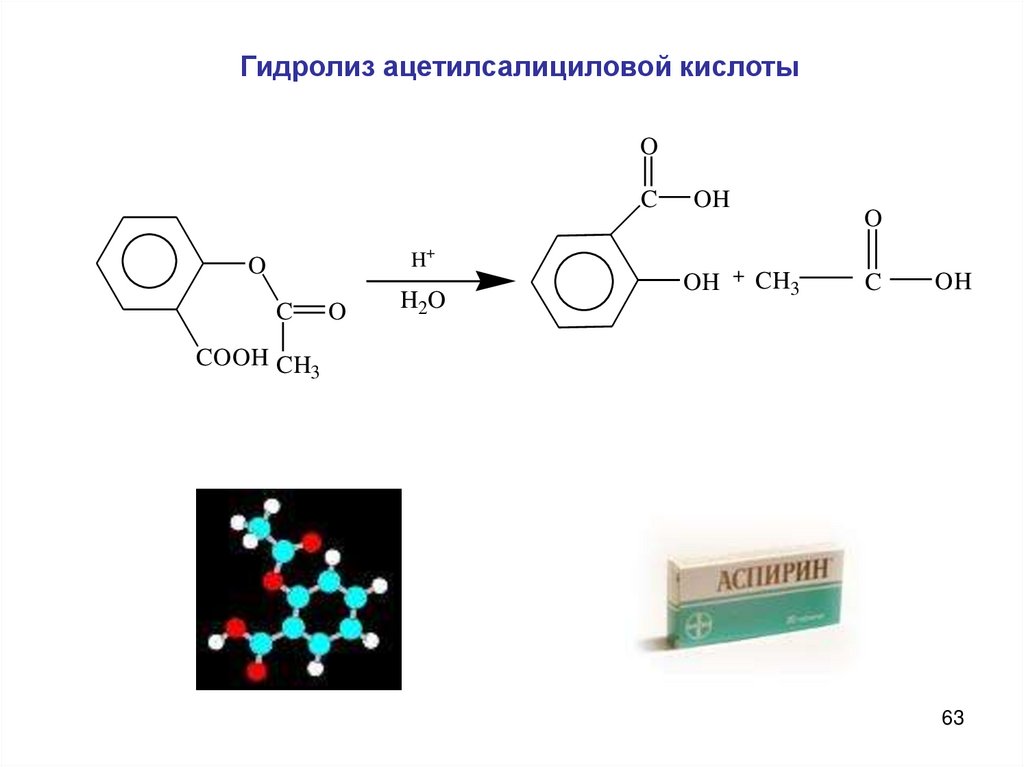
Гидролиз ацетилсалициловой кислотыO
C
H+
O
C
O
H 2O
OH
OH + CH3
O
C
OH
COOH CH
3
63
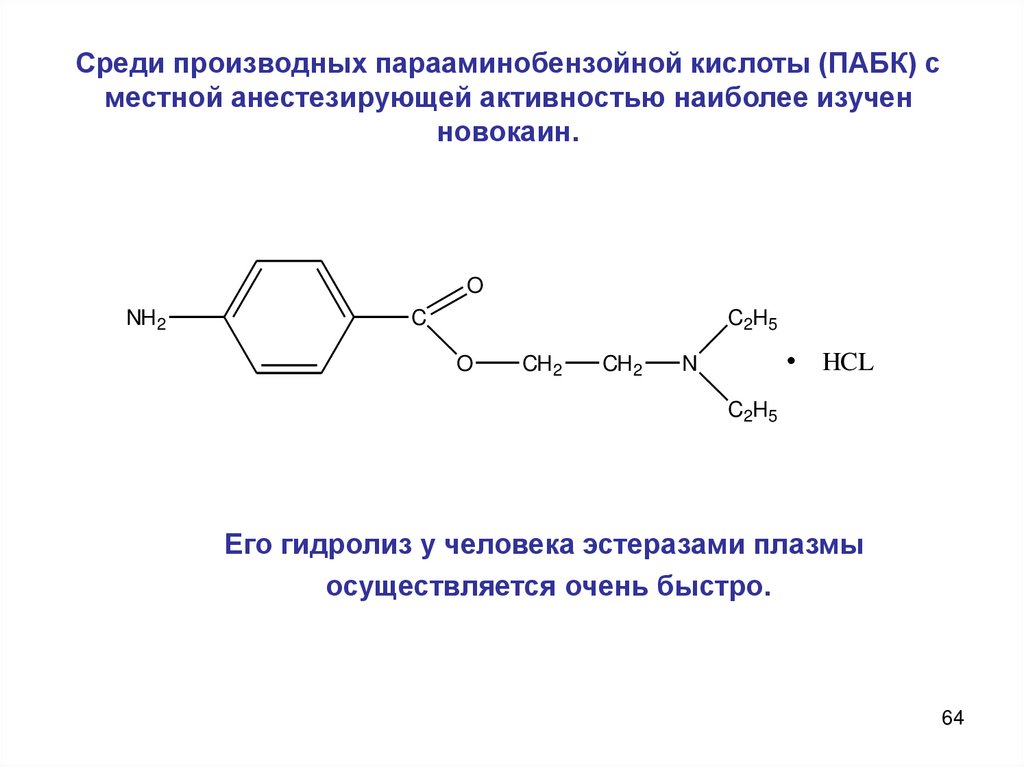
64. Среди производных парааминобензойной кислоты (ПАБК) с местной анестезирующей активностью наиболее изучен новокаин.
ONH 2
C
C2H5
O
CH 2
CH 2
HCL
N
C2H5
Его гидролиз у человека эстеразами плазмы
осуществляется очень быстро.
64
65.
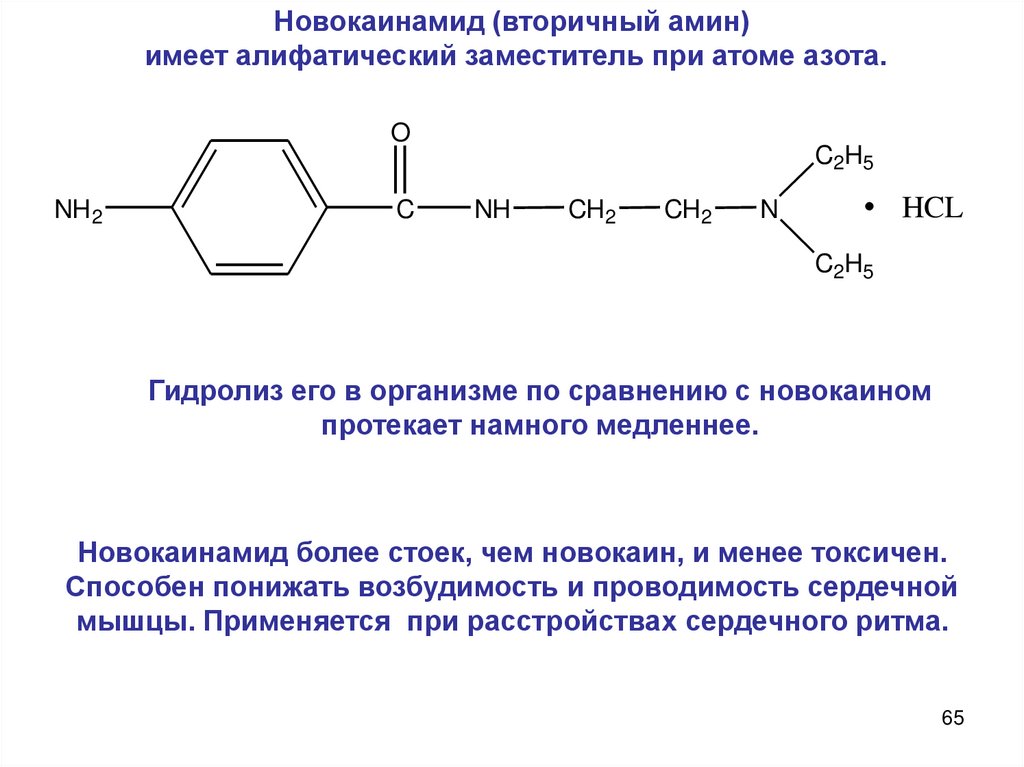
Новокаинамид (вторичный амин)имеет алифатический заместитель при атоме азота.
O
NH 2
C
C2H5
NH
CH 2
CH 2
HCL
N
C2H5
Гидролиз его в организме по сравнению с новокаином
протекает намного медленнее.
Новокаинамид более стоек, чем новокаин, и менее токсичен.
Способен понижать возбудимость и проводимость сердечной
мышцы. Применяется при расстройствах сердечного ритма.
65
66.
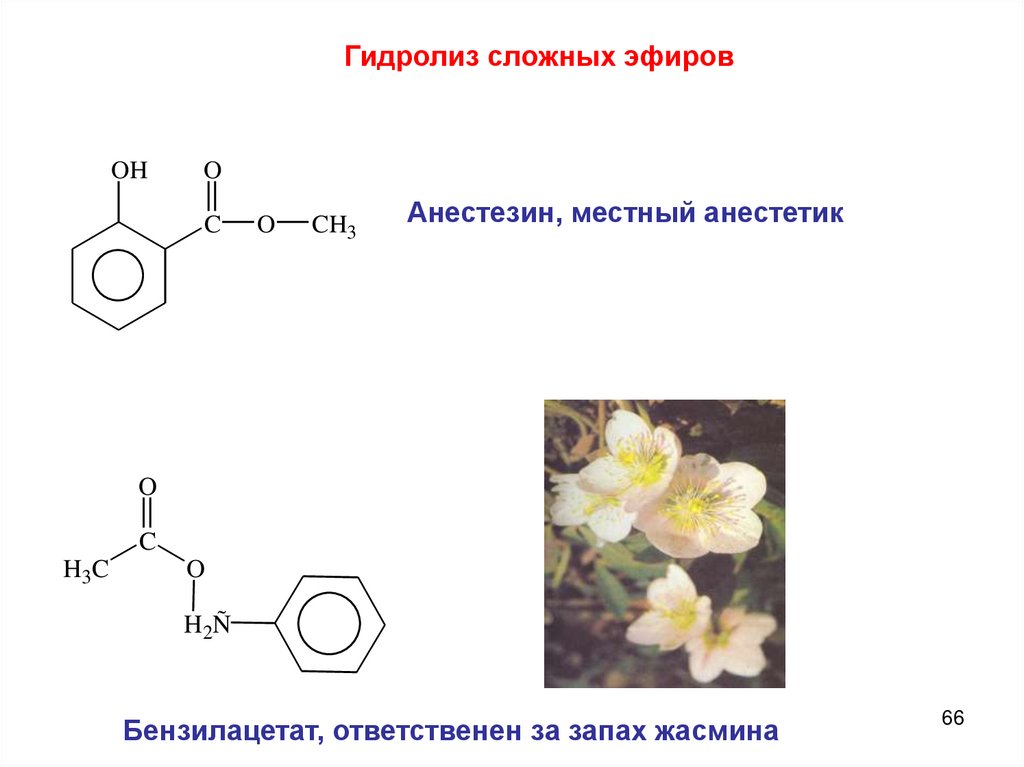
Гидролиз сложных эфировOH
O
C
O
CH3
Анестезин, местный анестетик
O
C
H3C
O
H 2Ñ
Бензилацетат, ответственен за запах жасмина
66
67.
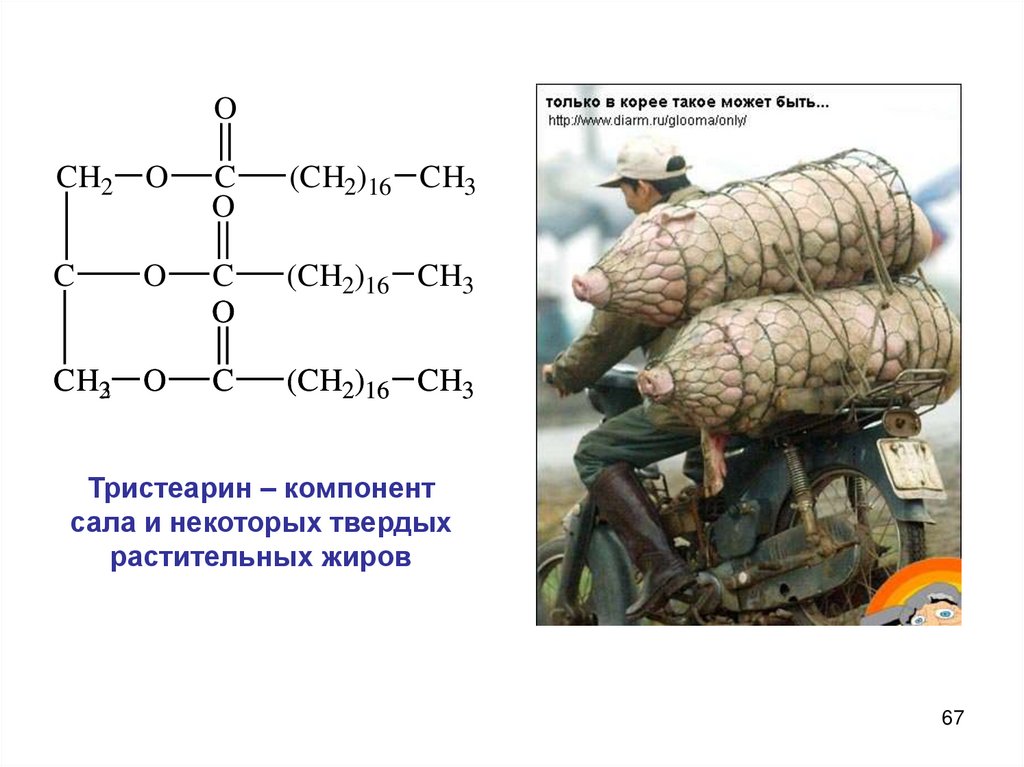
OCH2 O
C
O
(CH2)16 CH3
C
O
C
O
(CH2)16 CH3
CH23 O
C
(CH2)16 CH3
Тристеарин – компонент
сала и некоторых твердых
растительных жиров
67
68.
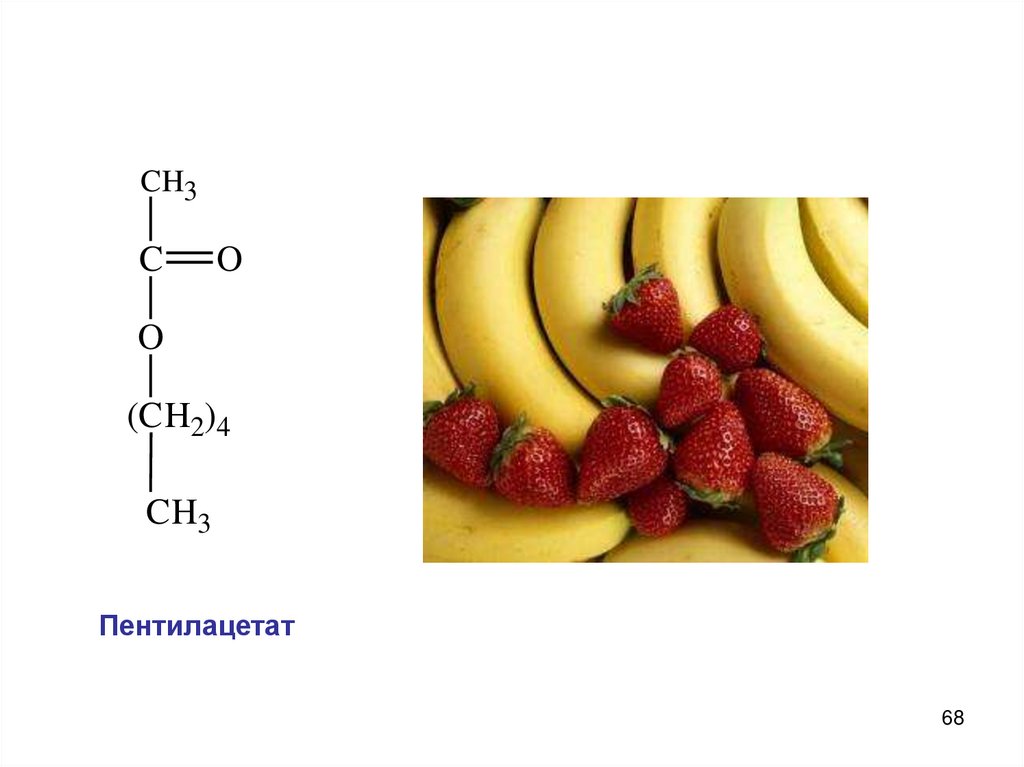
CH3C
O
O
(CH2)4
CH3
Пентилацетат
68
69.
CH3C
O
O
(CH2)7
CH3
Октилацетат
69
70.
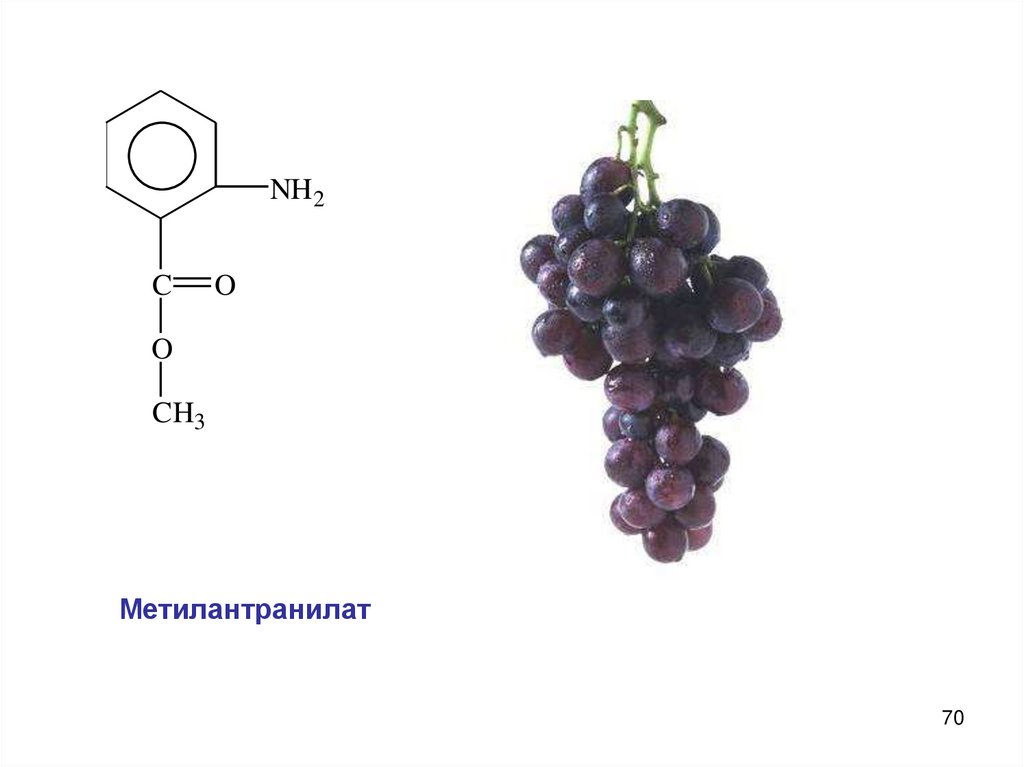
NH 2C
O
O
CH3
Метилантранилат
70
71.
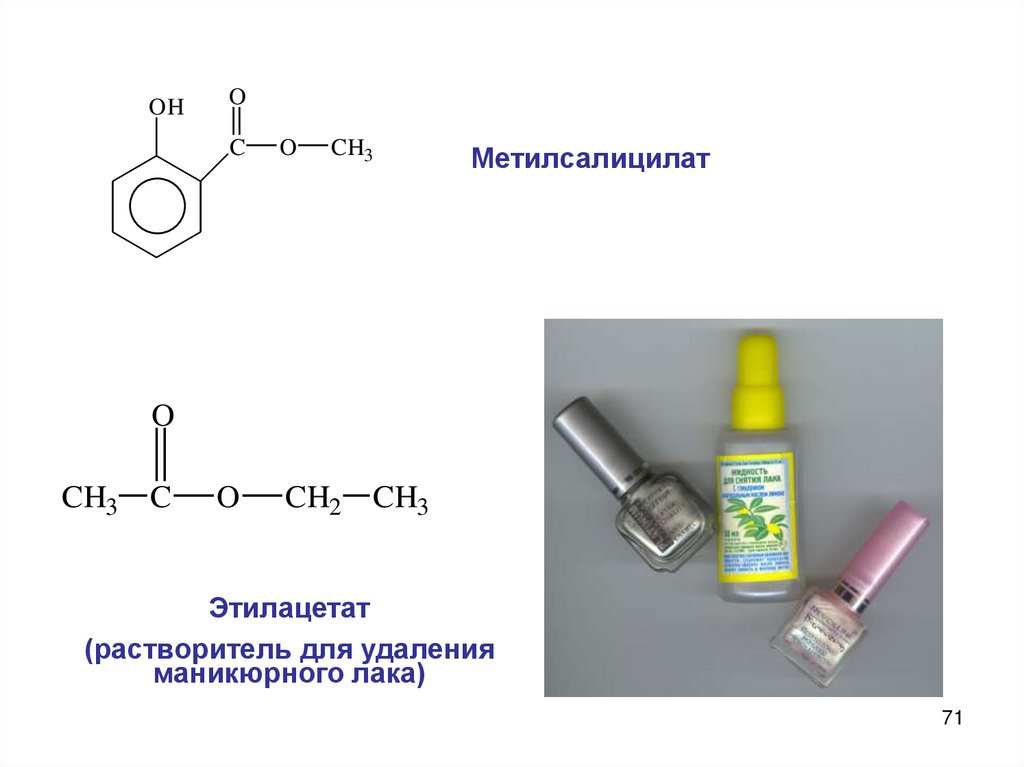
OHO
C
O
CH3
O
CH2 CH3
Метилсалицилат
O
CH3
C
Этилацетат
(растворитель для удаления
маникюрного лака)
71
72.
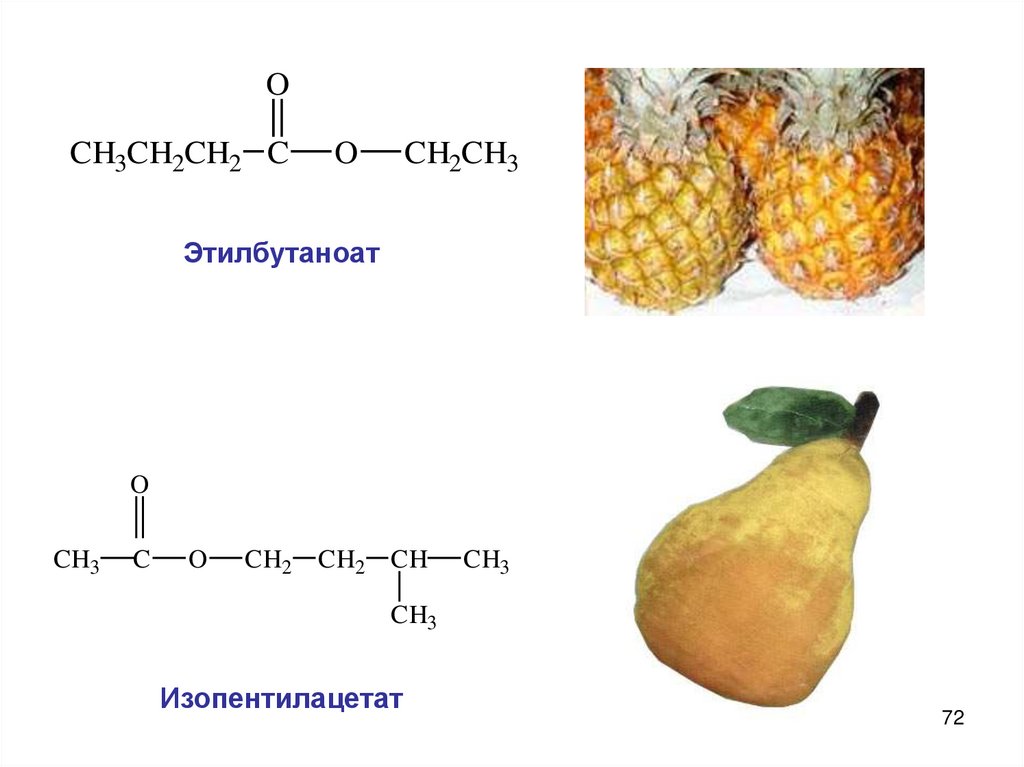
OCH3CH2CH2 C
O
CH2CH3
Этилбутаноат
O
CH3
C
O
CH2
CH2
CH
CH3
CH3
Изопентилацетат
72
73.
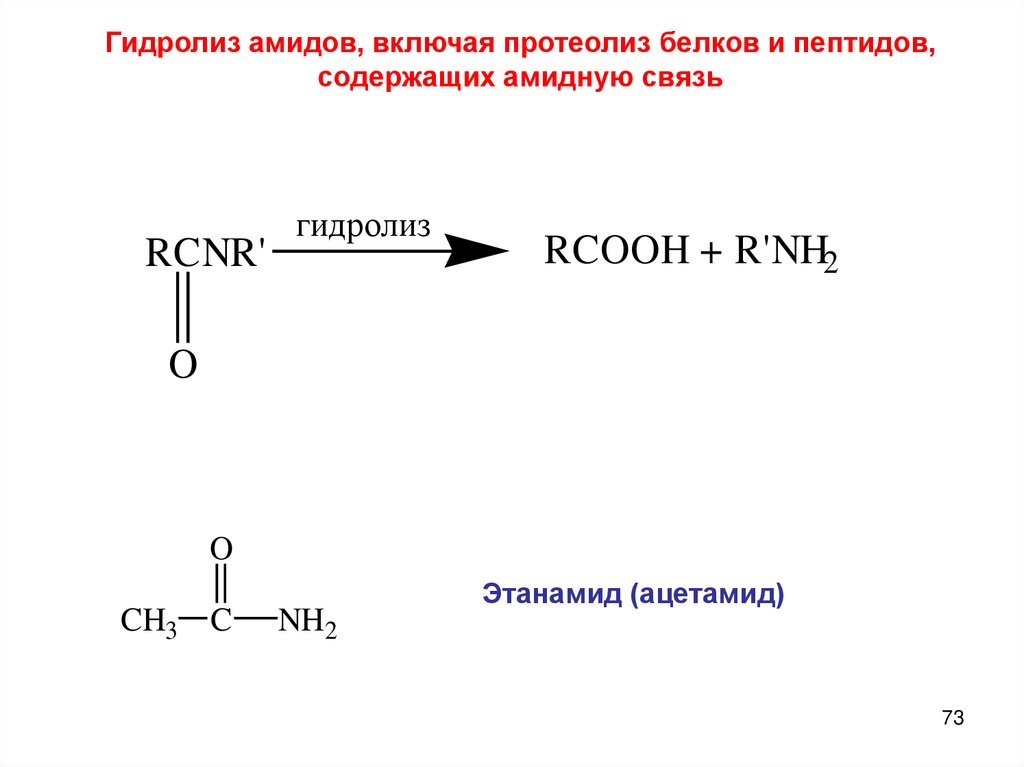
Гидролиз амидов, включая протеолиз белков и пептидов,содержащих амидную связь
RCNR'
гидролиз
RCOOH + R'NH2
O
O
CH3 C
NH2
Этанамид (ацетамид)
73
74.
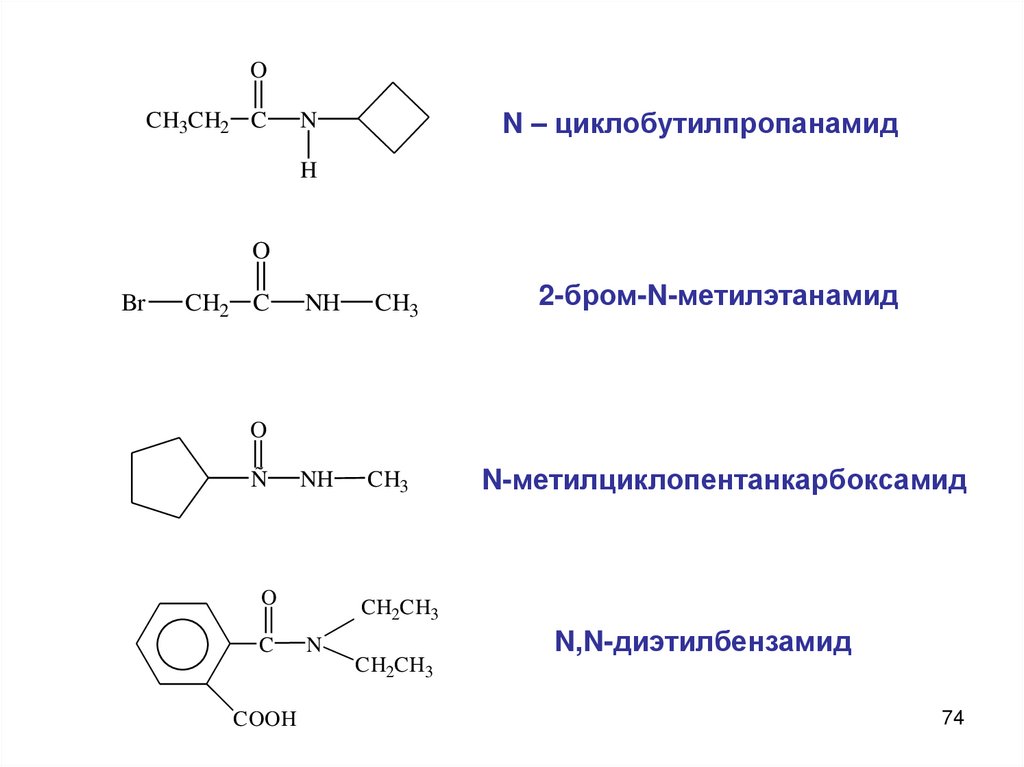
OCH3CH2 C
N – циклобутилпропанамид
N
H
O
Br
CH2 C
NH
CH3
2-бром-N-метилэтанамид
NH
CH3
N-метилциклопентанкарбоксамид
O
Ñ
O
C
CH2CH3
N
CH2CH3
COOH
N,N-диэтилбензамид
74
75.
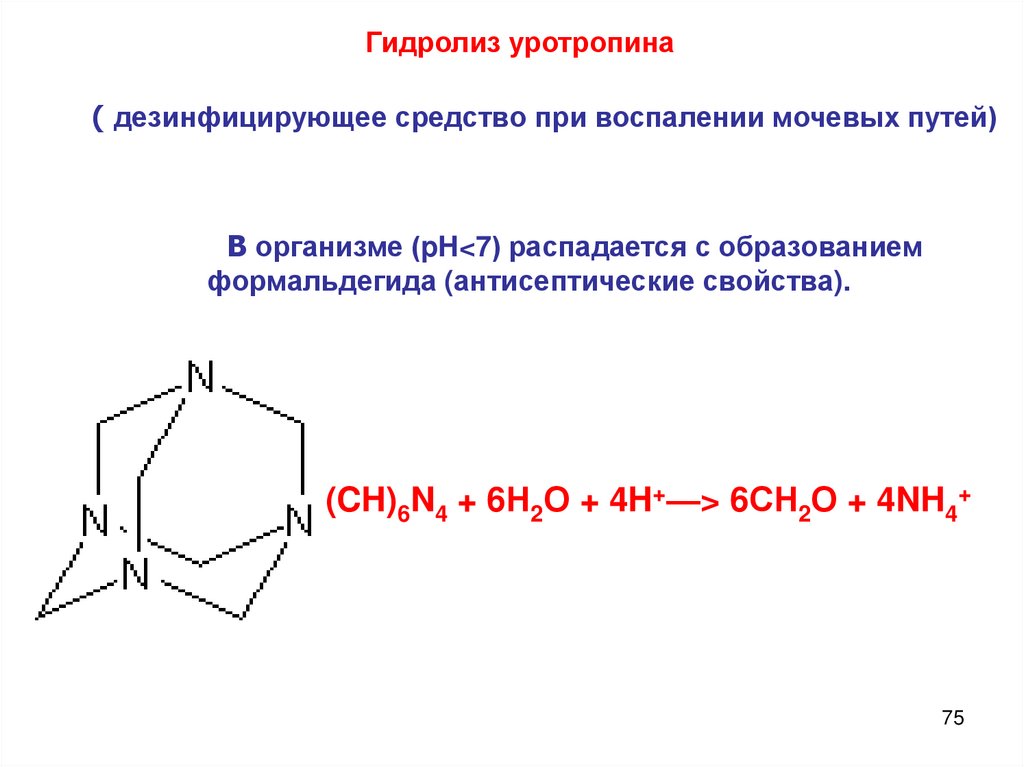
Гидролиз уротропина( дезинфицирующее средство при воспалении мочевых путей)
В организме (pH<7) распадается с образованием
формальдегида (антисептические свойства).
(CH)6N4 + 6Н2О + 4H+—> 6СН2О + 4NH4+
75
76.
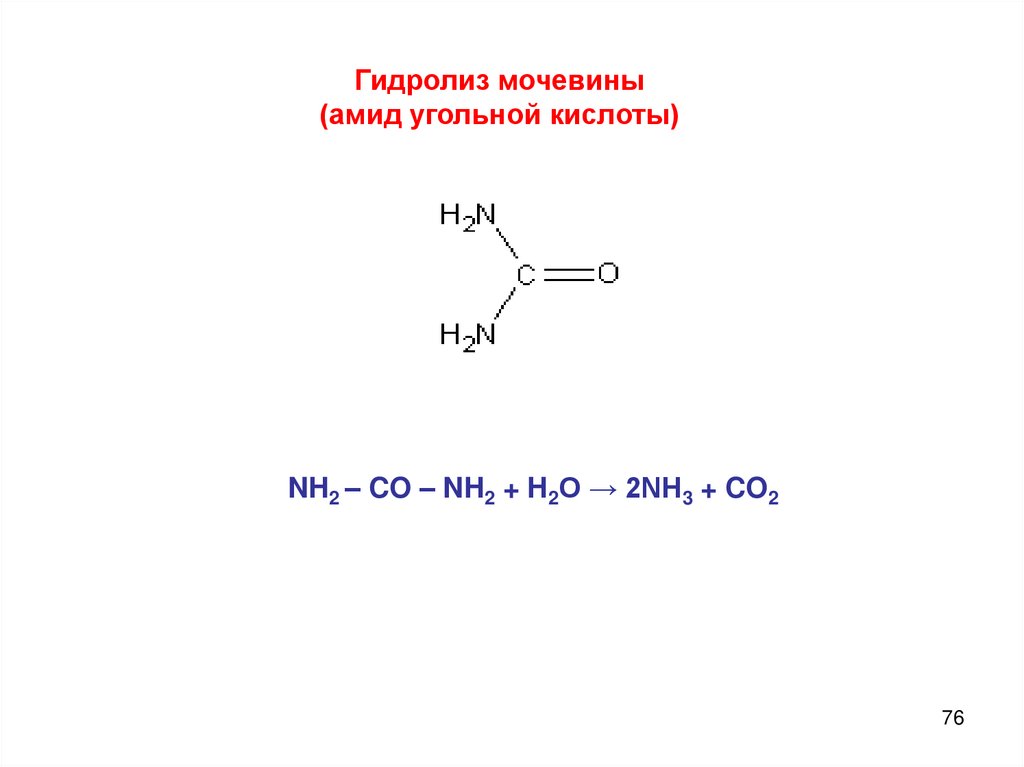
Гидролиз мочевины(амид угольной кислоты)
NH2 – CO – NH2 + H2O → 2NH3 + CO2
76
77.
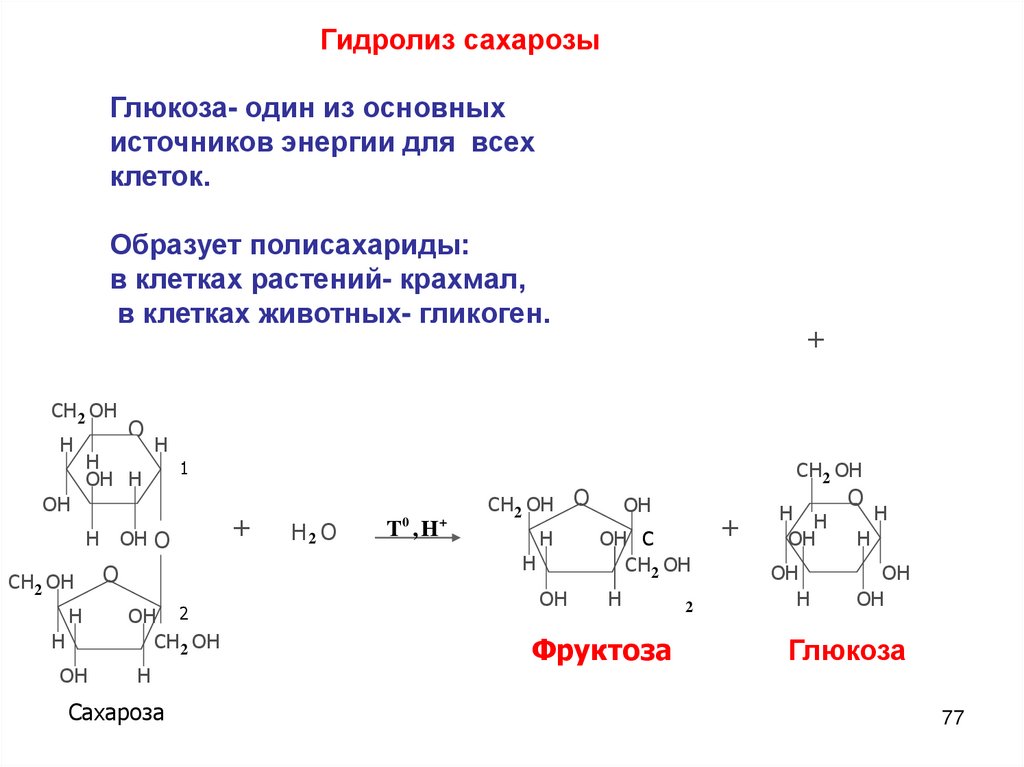
Гидролиз сахарозыГлюкоза- один из основных
источников энергии для всех
клеток.
Образует полисахариды:
в клетках растений- крахмал,
в клетках животных- гликоген.
CH 2 OH
H
О
H
OH H
H
1
OH
H
CH 2 OH
H
+
OH О
О
H
OH 2
CH 2 OH
OH
H
Сахароза
+
H2 O
T0 , H
CH 2 OH
CH 2 OH О
OH
H
OH С
CH 2 OH
H
OH
H
Фруктоза
2
+
H H
OH
OH
H
О
H
H
OH
OH
Глюкоза
77











































 Химия
Химия








