Похожие презентации:
9_Презентация_Галогены_Общая характеристика (1)
1.
Тема урока:«Общая характеристика галогенов.
Химические свойства на примере хлора»
9
F
фтор
35
17
Br
бром
Cl
хлор
53
Iйод
29.11.2025
85
At
астат
117
Ts
теннессин
2.
Сегодня на уроке вы…Узнаете
какие
элементы
относятся к
галогенам и
почему
29.11.2025
Научитесь
записывать
уравнения
химических
реакций
Узнаете
об областях
применения
галогенов и
их
соединений
3.
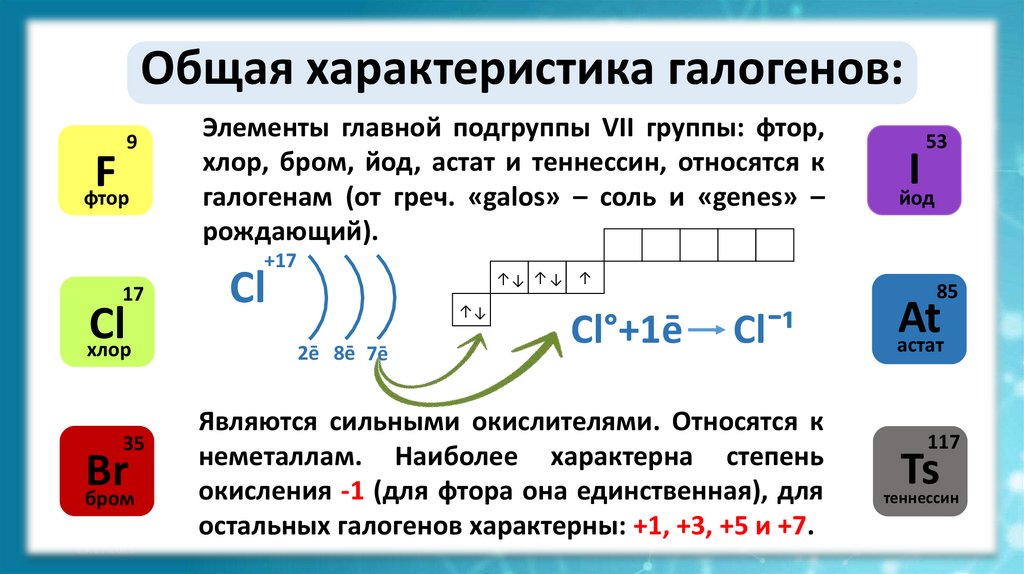
Общая характеристика галогенов:+17
Cl
хлор
35
Br
бром
29.11.2025
Cl
↑
2ē 8ē 7ē
↑
17
↑
↑
F
фтор
Элементы главной подгруппы VII группы: фтор,
хлор, бром, йод, астат и теннессин, относятся к
галогенам (от греч. «galos» – соль и «genes» –
рождающий).
↑
↑
9
↑
Cl°+1ē
53
Iйод
85
Cl¯¹
Являются сильными окислителями. Относятся к
неметаллам. Наиболее характерна степень
окисления -1 (для фтора она единственная), для
остальных галогенов характерны: +1, +3, +5 и +7.
At
астат
117
Ts
теннессин
4.
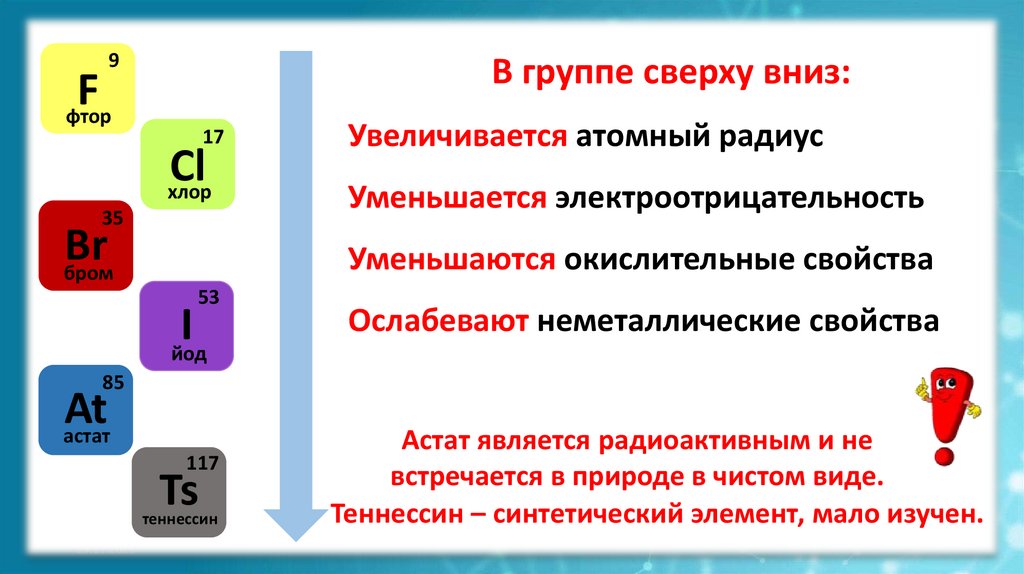
9В группе сверху вниз:
F
фтор
17
Cl
хлор
35
Br
бром
Увеличивается атомный радиус
Уменьшается электроотрицательность
Уменьшаются окислительные свойства
53
Iйод
Ослабевают неметаллические свойства
85
At
астат
117
Ts
теннессин
29.11.2025
Астат является радиоактивным и не
встречается в природе в чистом виде.
Теннессин – синтетический элемент, мало изучен.
5.
Нахождение галогенов в природе:Флюорит, CaF2
Криолит, K3AlF6
Сильвин, KCl
29.11.2025
Галит, NaCl
Сильвинит, KCl∙NaCl
6.
Нахождение галогенов в природе:Наибольшее количество
растворенного брома отмечается
в водах Мёртвого моря
Ламинария (морская капуста)
накапливает большое
количество йода
29.11.2025
7.
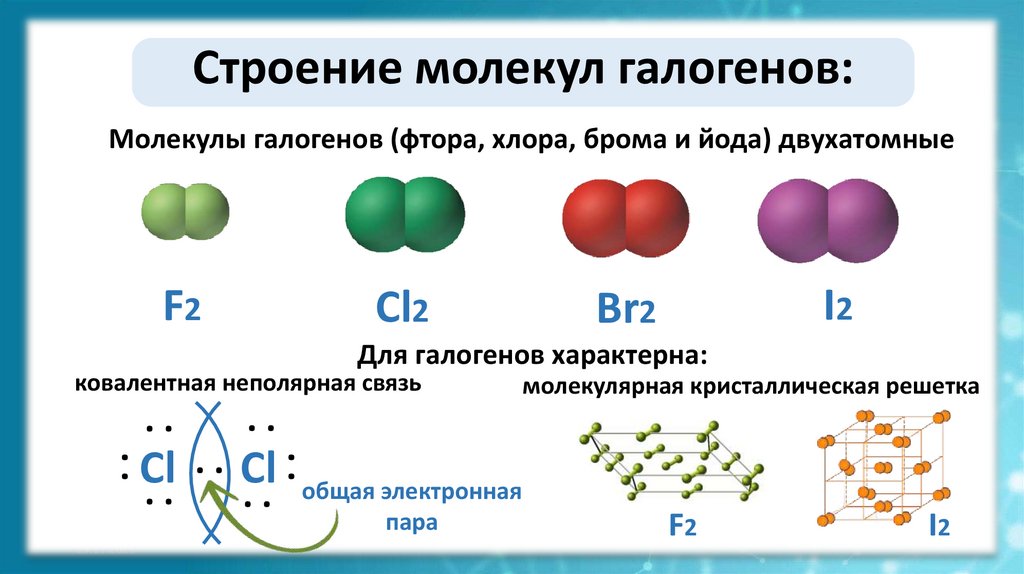
Строение молекул галогенов:Молекулы галогенов (фтора, хлора, брома и йода) двухатомные
F2
Cl2
I2
Br2
Для галогенов характерна:
ковалентная неполярная связь
∙∙
∙∙
∙∙
∙∙
молекулярная кристаллическая решетка
∙∙
∙∙
Cl ∙ ∙ Cl общая электронная
29.11.2025
пара
F2
I2
8.
Физические свойства галогенов:9
F
фтор
Светло–жёлтый газ с резким раздражающим запахом.
Активно реагирует с водой. Ядовит!
17
Cl
хлор
Жёлто–зелёный газ с удушливым запахом. В воде
растворяется ограниченно. Ядовит!
35
Br
бром
Красно–бурая зловонная жидкость. Лучше растворяется
в органических растворителях. Ядовит!
53
Серо–черные кристаллы со слабым металлическим
блеском и специфическим запахом. Ядовит!
Iйод
29.11.2025
9.
Получение галогенов:Лабораторный способ (хлор получают окислением соляной кислоты
подходящим сильным окислителем):
4HCl + MnO2
MnCl2 + Cl2 + 2H2O
16HCl + 2KMnO4
2MnCl2 + 5Cl2 + 2KCl + 8H2O
14HCl + K2Cr2O7
2CrCl3 + 3Cl2 + 2KCl + 7H2O
Промышленный способ (фтор и хлор получают электролизом
расплавов или растворов солей):
2NaCl + 2H2O
29.11.2025
H2 + Cl2 + 2NaOH
10.
Химические свойства хлора:+неМе
17
Cl
хлор
Cl2 + H2
2HCl
+Me
3Cl2 + 2Fe
2FeCl3
+H2O
Cl2 + H2O
HCl + HClO
+соли
Cl2 + 2KBr
2KCl + Br2
NaCl + NaClO + H2O
+NaOH Cl2 + 2NaOH
t°
3Cl2 + 6NaOH
5NaCl + NaClO3 + 3H2O
Реакции взаимодействия хлора с водой и щелочью
относят к реакциям диспропорционирования.
29.11.2025
11.
Биологическая роль галогенов:9
35
F
фтор
Br
бром
17
Cl
хлор
Iйод
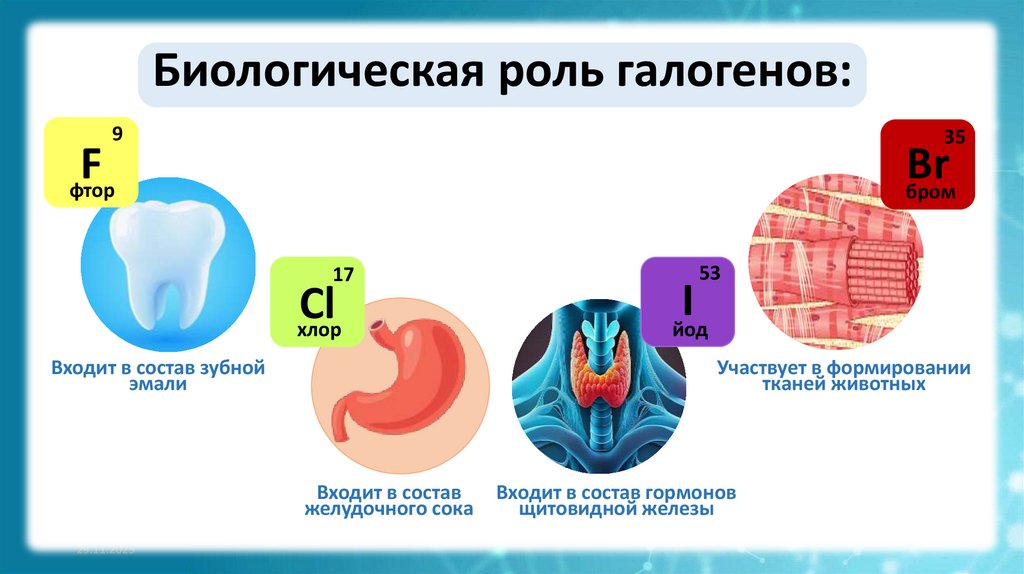
Участвует в формировании
тканей животных
Входит в состав зубной
эмали
Входит в состав
желудочного сока
29.11.2025
53
Входит в состав гормонов
щитовидной железы
12.
9F
фтор
Применение галогенов:
35
Br
бром
53
Iйод
Производство
фторсодержащих
зубных паст и
производство
тефлоновой посуды
Для противопожарной
пропитки деревянных
построек и при
нефтедобыче
Изготовление «йодной настойки» и производство аккумуляторов
29.11.2025
13.
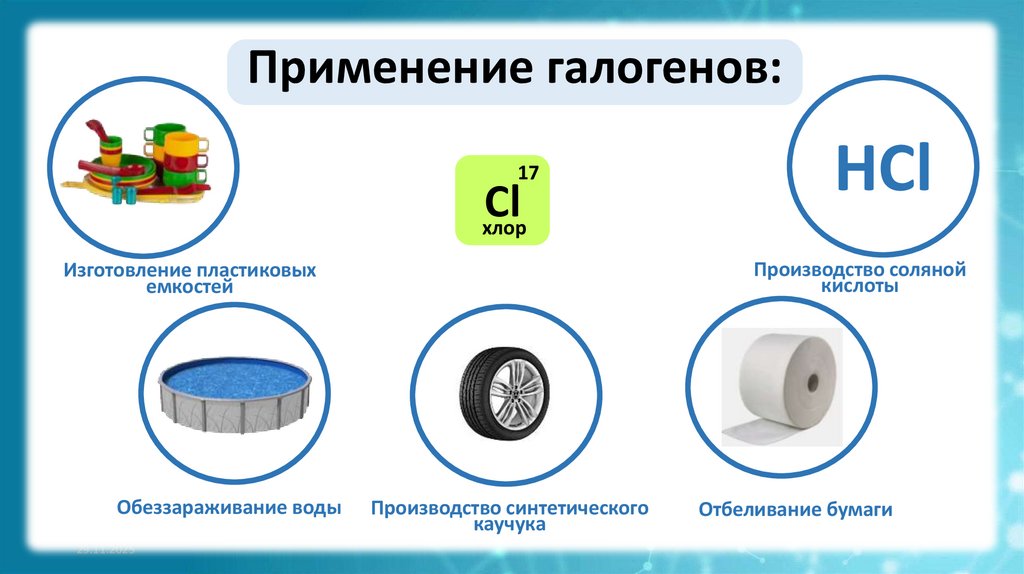
Применение галогенов:17
Cl
хлор
Производство соляной
кислоты
Изготовление пластиковых
емкостей
Обеззараживание воды
29.11.2025
HCl
Производство синтетического
каучука
Отбеливание бумаги
14.
Вывод:1. Галогены – типичные неметаллы, сильные окислители.
2. Их химическая активность и окислительные свойства
уменьшаются от фтора к йоду.
3. Хлор, как типичный представитель, проявляет высокую
химическую активность: реагирует с металлами,
неметаллами, водой и щелочами.
4. Реакции взаимодействия хлора с водой и щелочами
являются реакциями диспропорционирования.
5. Галогены и их соединения нашли широкое применение
в промышленности и быту.
29.11.2025









 Химия
Химия








