Похожие презентации:
Лекция 5.1
1. Лекция 5.1. Скорость химических реакций. Химическое равновесие.
2. Скорость реакции
Скорость химической реакции — это величина, показывающая, как изменяются концентрации реагентов илипродуктов реакции за единицу времени.
Существует два основных подхода:
Средняя скорость — это изменение концентрации за некоторый промежуток времени.
Для реагентов (которые убывают): v = - (ΔC / Δt)
Для продуктов (которые прибывают): v = + (ΔC / Δt)
Где ΔC — изменение концентрации (моль/л), Δt — изменение времени (с, мин и т.д.).
Мгновенная скорость — это скорость в данный конкретный момент времени. Определяется как
производная концентрации по времени.
3. Зависимость от природы реагирующих веществ
Природа реагирующих веществ — это совокупность их внутренних физико-химических характеристик,которые определяют их "реакционную способность".
Проще говоря, одни вещества "охотнее" и быстрее вступают в реакции, чем другие, из-за своей внутренней
структуры.
Ключевые причины, определяющие эту зависимость
Тип химической связи в реагентах. Прочность связи напрямую влияет на энергию, которую нужно
затратить для ее разрыва.
Ионные соединения (NaCl, KOH): реакции в растворах идут очень быстро, так как сводятся к встрече
ионов. Например, осаждение осадка AgCl при смешивании растворов AgNO₃ и NaCl происходит
практически мгновенно.
Ковалентные полярные соединения (HCl, H₂O): реакции идут с умеренной скоростью, требующей
некоторой активации.
Ковалентные неполярные соединения (O₂, N₂, алканы): связи очень прочные, реакции идут медленно,
требуют высоких температур или катализаторов. Например, реакция между H₂ и O₂ при комнатной
температуре не идет годами, но подожжется от искры.
4.
Прочность кристаллической решетки. Это особенно важно для твердых веществ в гетерогенных реакциях.Чтобы атом или ион внутри кристалла мог прореагировать, его нужно "вырвать" из решетки. Чем
прочнее решетка, тем медленнее реакция.
Пример: Алюминий — очень активный металл (сто левее водорода в ряду напряжений), но на
воздухе он устойчив из-за прочной оксидной пленки (Al₂O₃), защищающей его. Если же разрушить эту
пленку (например, амальгамированием), алюминий быстро окисляется.
Энергия активации (Eа). Это самый важный параметр, определяющий скорость реакции. Энергия
активации — это минимальный избыток энергии, которым должны обладать сталкивающиеся частицы
(атомы, молекулы, ионы), чтобы их столкновение привело к химической реакции.
Реакции с малой Eа идут быстро даже при низких температурах. Частицам не нужно много "лишней"
энергии для столкновения.
Пример: Реакция ионного обмена, нейтрализация кислоты щелочью.
Реакции с большой Eа идут медленно. Требуется сильный нагрев или катализатор, чтобы "подбросить"
энергию частицам или предоставить альтернативный путь с меньшим барьером.
Пример: Синтез аммиака из N₂ и H₂, горение дерева.
Таким образом, природа веществ определяет величину энергии активации реакции между ними.
Полярность молекул. Полярные молекулы (H₂O, HCl) легче взаимодействуют друг с другом и с ионами, так
как их взаимодействие часто имеет электростатическую природу. Неполярные молекулы (CH₄, C₆H₆) менее
склонны к таким взаимодействиям.
5.
6.
Пример 1: Взаимодействие металлов с кислотойРеакция: Металл + HCl → Соль + H₂↑
Цинк (Zn): Реагирует бурно с соляной кислотой, выделение водорода видно невооруженным глазом.
Железо (Fe): Реагирует значительно спокойнее, пузырьки водорода мелкие и их меньше.
Медь (Cu): Не реагирует вообще, так как стоит в ряду напряжений правее водорода. Ее природа такова,
что она не может вытеснить водород из кислоты.
Вывод: Разная химическая активность металлов, обусловленная их электрохимическими свойствами.
Пример 2: Взаимодействие щелочноземельных металлов с водой
Реакция: Металл + H₂O → Щелочь + H₂↑
Кальций (Ca): Реагирует достаточно активно, но без воспламенения водорода.
Натрий (Na): Реагирует очень бурно, плавает по поверхности, выделяется много тепла, может произойти
воспламенение.
Калий (K): Реагирует еще более бурно, с воспламенением и небольшим взрывом.
Вывод: При движении вниз по группе в периодической таблице металлические свойства усиливаются,
связь атома металла с электроном ослабевает, и он легче его отдает. Энергия активации реакции
снижается.
Пример 3: Горение углеводородов
Метан (CH₄): Горит спокойным пламенем.
Ацетилен (C₂H₂): Горит очень ярким пламенем с высокой температурой, может гореть во взрывном
режиме.
Вывод: Разная прочность тройной связи в ацетилене по сравнению с одинарными связями в метане и
разная энергия, выделяющаяся при их разрыве и образовании новых связей.
7. Зависимость от концентрации реагирующих веществ
Физический смысл. Объяснение лежит в теории столкновений:Химическая реакция происходит при столкновении частиц (молекул, атомов, ионов).
Чем выше концентрация реагентов, тем больше частиц содержится в единице объема.
Следовательно, чем больше частиц, тем чаще они сталкиваются друг с другом.
Чем чаще происходят столкновения, тем больше активных столкновений (тех, что приводят к реакции), и
тем выше скорость реакции.
Простая аналогия: Представьте толпу людей. Если людей в помещении мало (низкая "концентрация"), они
редко сталкиваются. Если людей много (высокая "концентрация"), столкновения происходят постоянно.
8.
Закон действующих масс (ЗДМ). Это количественная формулировка зависимости скорости от концентрации.Он был предложен в 1867 году К. Гульдбергом и П. Вааге.
Формулировка: Скорость элементарной гомогенной химической реакции при постоянной температуре прямо
пропорциональна произведению концентраций реагирующих веществ, возведенных в степени, равные их
стехиометрическим коэффициентам.
Математическая запись
Для общей реакции:
aA + bB → продукты
Скорость реакции описывается кинетическим уравнением:
v = k * [A]ᵃ * [B]ᵇ
где:
v — скорость химической реакции
k — константа скорости реакции. Она зависит от температуры и природы реагирующих веществ, но
НЕ зависит от их концентраций.
[A], [B] — молярные концентрации веществ A и B
a, b — стехиометрические коэффициенты в уравнении реакции, называемые порядками реакции по
веществам A и B соответственно.
9.
Важные нюансы и примерыПример 1: Простая реакция
Реакция: H₂ + I₂ → 2HI
Это элементарная реакция (идет в одну стадию).
Кинетическое уравнение: v = k * [H₂]¹ * [I₂]¹
Что это значит?
Если концентрацию [H₂] увеличить в 2 раза (а [I₂] оставить без изменений), то скорость реакции v
увеличится тоже в 2 раза.
Если концентрацию [I₂] увеличить в 3 раза, то скорость увеличится в 3 раза.
Если концентрации обоих реагентов увеличить в 2 раза, то скорость увеличится в 2 * 2 = 4 раза.
Пример 2: Реакция с разными порядками
Реакция: 2NO + O₂ → 2NO₂
Кинетическое уравнение: v = k * [NO]² * [O₂]¹
Что это значит?
Если концентрацию [NO] увеличить в 2 раза, то скорость увеличится в 2² = 4 раза.
Если концентрацию [O₂] увеличить в 2 раза, то скорость увеличится в 2 раза.
Порядок реакции по NO равен 2, а по O₂ равен 1. Общий порядок реакции равен сумме всех порядков:
2 + 1 = 3.
10.
Ограничения и важные предупрежденияЗДМ применим в основном к элементарным реакциям (реакциям, идущим в одну стадию). Для сложных
(многостадийных) реакций кинетическое уравнение может не совпадать со стехиометрическим
уравнением. Его определяют экспериментально.
Пример: Реакция H₂ + Br₂ → 2HBr
Стехиометрические коэффициенты: 1 и 1.
Реальное кинетическое уравнение сложное: v = k * [H₂] * [Br₂]^(1/2)
Порядок по Br₂ равен 0.5, что не совпадает со стехиометрическим коэффициентом.
Для гетерогенных реакций (где реагенты в разных фазах, например, твердое вещество + газ) в уравнение
Закона Действующих Масс концентрации твердых веществ не включаются, так как их концентрация
постоянна.
Пример: Горение угля: C(тв) + O₂(г) → CO₂(г)
Скорость реакции: v = k * [O₂] (концентрация угля [C] не пишется, она постоянна и включена в
константу k).
Концентрации чистых жидкостей и твердых веществ также не включаются в ЗДМ по той же причине.
11. Зависимость от температуры
Физический смысл. Объяснение снова дает теория столкновений, но с ключевым дополнением.При повышении температуры:
Увеличивается средняя кинетическая энергия молекул. Частицы начинают двигаться быстрее.
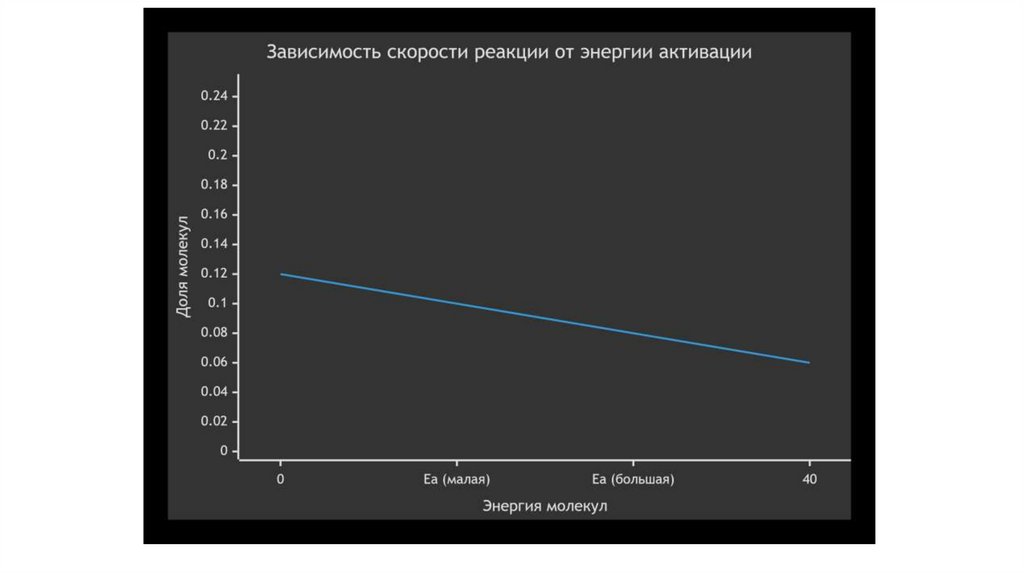
НО это не главное. Главное — повышение температуры приводит к резкому увеличению доли активных
молекул — тех, энергия которых равна или превышает энергию активации (Eа).
На графике видно, что при повышении температуры (T₂ > T₁) доля
молекул с энергией, большей Eа (площадь под кривой справа от Eа),
значительно возрастает. Именно эти "энергичные" молекулы и
обеспечивают протекание реакции.
Простая аналогия: Чтобы перевалить через горный перевал (Eа), нужна
определенная энергия. При низкой "температуре" лишь у немногих
путников хватит сил. Если всех "нагреть" (дать энергию), то через
перевал сможет перейти гораздо больше людей.
12.
Количественные правила. Существует два основных правила, описывающих эту зависимость.Правило Вант-Гоффа (приближенное). Это эмпирическое правило, удобное для быстрых оценок. При
повышении температуры на каждые 10°C скорость большинства химических реакций увеличивается в 2–4
раза.
Математическая запись:
v₂ / v₁ = γ^((T₂ - T₁)/10)
где:
v₂ и v₁ — скорости реакции при температурах T₂ и T₁
γ — температурный коэффициент Вант-Гоффа (то самое число 2, 3 или 4).
(T₂ - T₁)/10 — на сколько "декад" по 10°C изменилась температура.
Пример:
Температурный коэффициент γ = 2. Во сколько раз увеличится скорость реакции при повышении температуры
от 20°C до 50°C?
ΔT = 50 - 20 = 30°C → ΔT/10 = 3
v₂ / v₁ = 2³ = 8
Ответ: Скорость реакции увеличится в 8 раз.
Недостаток правила: Оно приблизительное и работает в ограниченном температурном интервале. Более
точное описание дает уравнение Аррениуса.
13.
Уравнение Аррениуса (точное). Это фундаментальное уравнение, устанавливающее связь между константойскорости k и температурой T.
где:
k — константа скорости реакции (именно она входит в закон действующих масс v = k * [A]ᵃ * [B]ᵇ)
A — предэкспоненциальный множитель (константа, примерно равная общему числу столкновений)
e — основание натурального логарифма (~2.718)
Eа — энергия активации (Дж/моль) — главный параметр, определяющий чувствительность реакции к
температуре.
R — универсальная газовая постоянная (~8.314 Дж/(моль·K))
T — абсолютная температура (в Кельвинах).
Что показывает это уравнение?
Чем выше температура T, тем меньше отрицательная степень -Eа/(R*T), и тем БОЛЬШЕ константа
скорости k, а значит, и скорость реакции v.
Чем больше энергия активации Eа, тем сильнее реакция зависит от температуры. Реакции с высокой Eа
(например, разложение веществ) очень чувствительны к нагреву, а реакции с низкой Eа (ионный обмен)
почти не зависят от температуры.
14.
Графическое представлениеЗависимость константы скорости от температуры по Аррениусу — экспоненциальная. Если построить график в
координатах ln(k) от 1/T, получится прямая линия, по наклону которой можно определить энергию активации.
Практическое значение и примеры
Холодильник: Низкая температура замедляет биохимические реакции, приводящие к порче продуктов
(действия бактерий и ферментов).
Скороварка: Высокое давление поднимает температуру кипения воды (до ~120°C), что в разы ускоряет
процесс приготовления пищи (гидролиз белков, крахмала).
Катализаторы в автомобилях: Дожигают выхлопные газы. Без катализатора для этих реакций
потребовался бы сильный нагрев. Катализатор снижает Eа, позволяя реакциям идти быстро уже при
температуре выхлопа.
Промышленный синтез (аммиак, серная кислота): Проведение процессов при высоких температурах для
достижения приемлемой скорости, даже если равновесие смещается в невыгодную сторону (компромисс
между кинетикой и термодинамикой).
15. Зависимость от площади реакционной поверхности
Гетерогенная реакция — это реакция, в которой реагенты находятся в разных фазах (агрегатных состояниях) имежду ними существует граница раздела.
Примеры:
Твердое вещество + газ (горение угля: C(тв) + O₂(г) → CO₂(г))
Твердое вещество + жидкость (растворение цинка в кислоте: Zn(тв) + 2HCl(ж) → ZnCl₂(р-р) + H₂(г))
Невозможная жидкость + газ (поглощение CO₂ раствором щелочи)
Два несмешивающихся жидкости
Физический смысл. Химическая реакция может протекать только на границе раздела фаз, где частицы реагентов могут
столкнуться.
Чем больше площадь этой границы, тем больше частиц твердого вещества (или жидкости) одновременно
доступны для столкновения с частицами другого реагента (газа или жидкости).
Увеличение площади поверхности приводит к увеличению числа активных центров — мест на поверхности, где
наиболее вероятно протекание реакции.
Простая аналогия: Представьте, что вам нужно покрасить лист металла.
Если это цельный куб, вы красите только его внешние грани.
Если этот куб распилить на множество мелких пластинок, общая площадь всех поверхностей, которые нужно
красить, возрастет в десятки раз.
Так же и в химии: чем мельче вещество, тем больше его частиц "на виду" и готовы к реакции.
16.
Как изменяют площадь поверхности?Для увеличения площади поверхности твердое вещество подвергают:
Измельчению (размалывают в порошок)
Распылению
Созданию пористой структуры (например, активированный уголь)
Примеры из жизни:
Сахар. Кусковой сахар растворяется в чае медленно, а тот же сахар, растертый в пудру, — очень быстро.
Древесина. Целое бревно горит медленно, а мелкие щепки и опилки вспыхивают мгновенно.
Мел. Кусковой мел в кислоте "шипит" медленно, а порошковый — очень интенсивно.
Кинетическое описание. Для гетерогенных реакций Закон Действующих Масс применяется с поправкой:
Скорость гетерогенной реакции пропорциональна площади поверхности твердой фазы (S) и концентрации реагента
в жидкости или газе.
Рассмотрим реакцию: Zn(тв) + 2HCl(р-р) → ZnCl₂(р-р) + H₂(г)
Скорость можно выразить как:
v = k * S * [HCl]²
Концентрация твердого вещества [Zn] в уравнение НЕ ВХОДИТ! Она постоянна для данного вещества и уже учтена в
константе скорости k и площади S.
Что это значит на практике?
Если мы увеличим площадь цинка (S) в 2 раза (например, возьмем не одну пластинку, а две такой же площади, или
измельчим одну), то скорость реакции увеличится в 2 раза.
Если мы увеличим концентрацию кислоты [HCl] в 2 раза, то скорость увеличится в 4 раза (т.к. порядок реакции по
кислоте равен 2).
17.
Практическое значение. Понимание этой зависимости крайне важно в промышленности и быту:Металлургия: Руду перед восстановлением дробят и обогащают, чтобы увеличить площадь контакта с
восстановителем (коксом) и ускорить процесс.
Химическая промышленность: Катализаторы часто используют в виде мелкодисперсных порошков или
наносят на пористые носители (керамика, оксид алюминия) для максимального увеличения активной
поверхности.
Пищеварение: Жевательная и ферментативная обработка пищи в организме как раз направлена на
увеличение площади поверхности пищевых частиц для ускорения биохимических реакций digestion.
Тушение пожара: При тушении горючих жидкостей пеной или порошком создается слой, изолирующий
поверхность горения от кислорода воздуха (уменьшается доступная площадь для реакции горения).
18. Тепловые эффекты химических реакций
Тепловой эффект химической реакции — это количество теплоты, которое выделяется или поглощается вовремя химической реакции при постоянной температуре.
Проще говоря, это ответ на вопрос: Нагреется ли смесь или охладится в результате реакции?
Если теплота выделяется — реакция называется ЭКЗОТЕРМИЧЕСКОЙ.
Если теплота поглощается — реакция называется ЭНДОТЕРМИЧЕСКОЙ.
Почему реакции сопровождаются тепловыми эффектами? Вся суть в энергии химических связей.
На разрыв химических связей в реагентах требуется затратить энергию.
При образовании новых связей в продуктах энергия выделяется.
Тепловой эффект (Q) — это и есть разница между этими двумя величинами.
Q = E(связей продуктов) - E(связей реагентов)
Если энергия выделившаяся > энергии поглощенной, то разность отрицательная (-Q), и происходит нагрев
(экзотермическая реакция).
Если энергия выделившаяся < энергии поглощенной, то разность положительная (+Q), и происходит
охлаждение (эндотермическая реакция).
19.
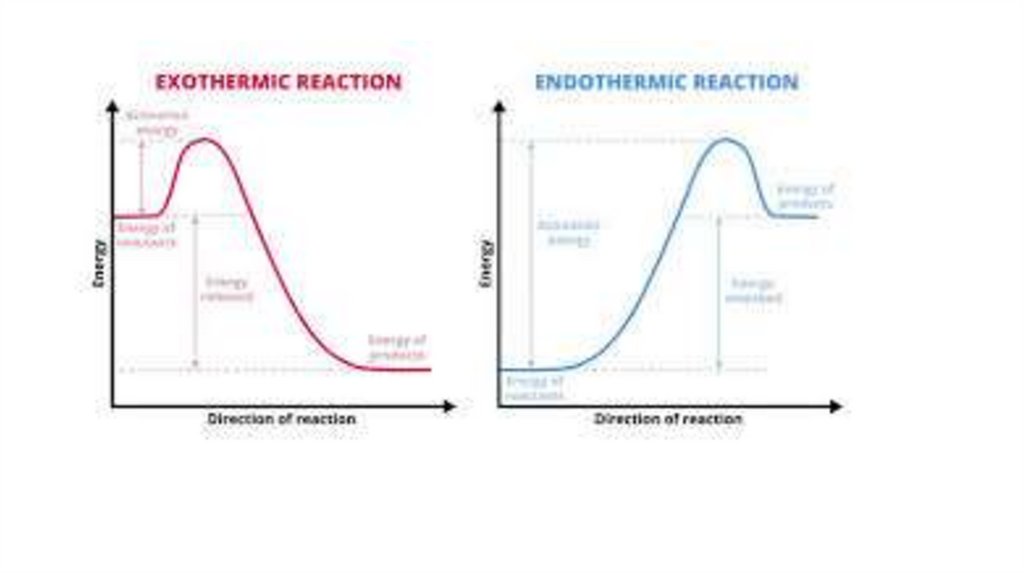
Типы реакций по тепловому эффектуЭкзотермические реакции (Q < 0)
Теплота выделяется в окружающую среду.
Продукты реакции более устойчивы (имеют меньшую энергию), чем реагенты.
Примеры:
Горение: C + O₂ → CO₂ + Q
Нейтрализация: NaOH + HCl → NaCl + H₂O + Q
Дыхание, гниение — все процессы окисления.
На графике видно, что энергия продуктов ниже, чем энергия реагентов. Разница выделяется в виде
тепла.
Эндотермические реакции (Q > 0)
Теплота поглощается из окружающей среды.
Продукты реакции менее устойчивы (имеют большую энергию), чем реагенты.
Примеры:
Разложение: 2HgO → 2Hg + O₂ - Q (для разложения нужно постоянно нагревать)
Фотосинтез: 6CO₂ + 6H₂O → C₆H₁₂O₆ + 6O₂ - Q (энергия поглощается из солнечного света)
Гашение извести: CaO + H₂O → Ca(OH)₂ + Q — это экзотермическая реакция, а вот обратный процесс
— разложение гидроксида — будет эндотермическим.
На графике видно, что энергия продуктов выше, чем энергия реагентов. Для этого требуется
приток энергии извне.
20.
21.
Термохимические уравнения. Это химические уравнения, в которых обязательно указан тепловой эффект иагрегатные состояния веществ.
Правила составления:
Тепловой эффект записывается в конце уравнения как +Q (для экзо) или -Q (для эндо).
Указываются агрегатные состояния: (т), (ж), (г), (р-р). Это важно, так как при изменении агрегатного
состояния тоже выделяется или поглощается энергия.
Коэффициенты в уравнении показывают количество молей веществ. Поэтому тепловой эффект всегда
соответствует количеству веществ, указанных в уравнении.
Примеры:
C(т) + O₂(г) → CO₂(г) + 394 кДж (Выделяется 394 кДж при сгорании 1 моля углерода)
N₂(г) + O₂(г) → 2NO(г) - 180 кДж (Поглощается 180 кДж для образования 2 молей NO)
Более распространенная форма записи — с использованием изменения энтальпии (ΔH).
22.
Энтальпия (ΔH). В современной химии тепловой эффект принято выражать через изменение энтальпиисистемы (ΔH).
Энтальпия (H) — это запас внутренней энергии системы, который может быть выделен в виде тепла.
ΔH = H(продуктов) - H(реагентов)
Связь с тепловым эффектом (Q):
Q = -ΔH
Экзотермическая реакция: ΔH < 0 (энтальпия продуктов меньше, система теряет энергию).
Эндотермическая реакция: ΔH > 0 (энтальпия продуктов больше, система запасает энергию).
Те же примеры, записанные через энтальпию:
C(т) + O₂(г) → CO₂(г), ΔH = -394 кДж/моль
N₂(г) + O₂(г) → 2NO(г), ΔH = +180 кДж/моль
23.
Закон Гесса (Фундаментальный закон термохимии). Тепловой эффект химической реакции зависит толькоот начального и конечного состояния веществ и не зависит от пути процесса (промежуточных стадий).
Следствия и применение:
Позволяет рассчитывать тепловые эффекты реакций, которые невозможно измерить на опыте.
Термохимические уравнения можно складывать, вычитать и умножать, как алгебраические уравнения.
Пример расчета по закону Гесса:
Дано:
(1) C(т) + O₂(г) → CO₂(г), ΔH₁ = -394 кДж
(2) CO(г) + ½O₂(г) → CO₂(г), ΔH₂ = -283 кДж
Найти тепловой эффект реакции:
(3) C(т) + ½O₂(г) → CO(г), ΔH₃ = ?
Решение:
Мы видим, что реакцию (3) можно получить, если из реакции (1) вычесть реакцию (2):
(3) = (1) - (2)
Следовательно:
ΔH₃ = ΔH₁ - ΔH₂ = (-394) - (-283) = -111 кДж/моль
24.
Практическое значениеЭнергетика: Сжигание топлива (угля, газа, нефти) — это использование экзотермических реакций для
получения тепла и электричества.
Металлургия: Расчет затрат энергии на восстановление металлов из руд (часто эндотермические
процессы).
Пищевая промышленность: Расчет калорийности пищи основан на тепловом эффекте ее окисления в
организме.
Химический синтез: Подбор условий для управления реакциями (например, поддержание температуры
для эндотермических процессов).
25. Обратимость реакций
Необратимая реакция — реакция, которая протекает до конца, т.е. до полного израсходования хотя быодного из реагентов. Продукты такой реакции не могут взаимодействовать друг с другом с образованием
исходных веществ.
Признаки:
Образование осадка: AgNO₃ + NaCl → AgCl↓ + NaNO₃
Выделение газа: Zn + 2HCl → ZnCl₂ + H₂↑
Образование малодиссоциирующего вещества (чаще всего воды): HCl + NaOH → NaCl + H₂O
Обратимая реакция — реакция, которая при одних и тех же условиях может протекать как в прямом, так и в
обратном направлении.
Обозначение: Знаком обратимости ⇄ или ⇌.
Пример: Синтез аммиака: N₂ + 3H₂ ⇄ 2NH₃
Суть: Реакция не идет до конца. В системе одновременно присутствуют и реагенты, и продукты.
26.
Константа химического равновесия (K). Это величина, показывающая соотношение между продуктами иреагентами в состоянии равновесия.
Для обратимой реакции:
aA + bB ⇄ cC + dD
Константа равновесия вычисляется по формуле:
K = ([C]ᶜ * [D]ᵈ) / ([A]ᵃ * [B]ᵇ)
где [A], [B], [C], [D] — равновесные концентрации веществ, а, b, c, d — стехиометрические коэффициенты.
Что показывает значение K?
K >> 1: В равновесной смеси преобладают продукты. Прямая реакция сильно смещена вправо.
K << 1: В равновесной смеси преобладают реагенты. Прямая реакция сильно смещена влево.
K ≈ 1: В смеси присутствуют заметные количества и реагентов, и продуктов.
27. Химическое равновесие и его смещение под действием различных факторов для создания оптимальных условий протекания химических
процессовХимическое равновесие — это состояние обратимой реакции, при котором:
Скорость прямой реакции равна скорости обратной реакции (vпр = vобр).
Концентрации всех веществ остаются постоянными во времени.
Ключевая особенность: Равновесие динамическое. Реакции не прекращаются, но чистых изменений не
наблюдается.
Цель управления: Сместить равновесие в нужную сторону (чаще всего в сторону образования целевого
продукта), чтобы увеличить его выход и скорость получения.
28.
Факторы управления и их практическое применениеФактор 1: Концентрация реагентов и продуктов
Правило:
↑ Концентрации реагентов → смещение равновесия в сторону продуктов.
↑ Концентрации продуктов → смещение равновесия в сторону реагентов.
Удаление продукта из зоны реакции → равновесие в сторону его восполнения.
Практическая стратегия:
Подача избытка более дешевых реагентов. Чтобы дорогое вещество прореагировало полностью, его
смешивают с избытком другого реагента.
Непрерывный отвод продукта. Это один из самых эффективных методов. Если целевой продукт
удалять (например, испарением, осаждением или откачкой, если это газ), равновесие постоянно
смещается вправо, и реакция идет практически до конца.
Пример (Промышленный синтез эфира):
C₂H₅OH + CH₃COOH ⇄ CH₃COOC₂H₅ + H₂O
Задача: Увеличить выход эфира.
Решение: Одним из продуктов является вода. Ее удаляют из реакционной смеси (например, с
помощью водоотнимающих средств), что смещает равновесие вправо.
29.
Фактор 2: Давление (Только для реакций с участием газов!)Правило:
↑ Давления → равновесие смещается в сторону меньшего общего количества моль газа.
↓ Давления → равновесие смещается в сторону большего общего количества моль газа.
Практическая стратегия:
Рассчитать изменение числа молей газа (Δn газов).
Если Δn < 0 (в продуктах меньше моль газа), повышение давления увеличит выход продукта.
Если Δn > 0, выход продукта увеличится при понижении давления.
Если Δn = 0, давление не влияет на положение равновесия.
Пример (Синтез аммиака по Габеру):
N₂(г) + 3H₂(г) ⇄ 2NH₃(г)
Слева: 1 моль + 3 моля = 4 моля газа
Справа: 2 моля газа
Δn = 2 - 4 = -2 (уменьшение числа моль).
Решение: Проведение процесса под высоким давлением (150-300 атм). Это значительно увеличивает
выход аммиака.
30.
Фактор 3: ТемператураПравило:
↑ Температуры → равновесие смещается в сторону эндотермической реакции (поглощает избыток
тепла).
↓ Температуры → равновесие смещается в сторону экзотермической реакции (компенсирует отвод
тепла).
Практическая стратегия (Поиск компромисса):
Здесь возникает главное противоречие между термодинамикой (выход продукта) и кинетикой (скорость
процесса).
С точки зрения равновесия: Для экзотермической реакции выгодна низкая температура (выход
продукта максимален).
С точки зрения скорости: Для любой реакции выгодна высокая температура (скорость растет по
правилу Вант-Гоффа).
Решение: Выбирают температуру, которая дает приемлемый выход за приемлемое время.
Пример (Синтез аммиака):
N₂ + 3H₂ ⇄ 2NH₃, ΔH = -92 кДж (экзотермическая)
Термодинамика: Максимальный выход аммиака — при низких температурах (~100°C).
Кинетика: При 100°C скорость реакции ничтожно мала.
Компромисс: Процесс ведут при 450-500°C. При этой температуре выход аммиака уже не максимален,
но скорость с использованием катализатора достаточна для промышленных целей.
31.
Фактор 4: КатализаторПравило: Катализатор не смещает химическое равновесие.
Практическая стратегия:
Катализатор ускоряет достижение равновесия, но не меняет его положения.
Это позволяет быстрее выйти на максимально возможный для данных T и P выход продукта, экономя
время и ресурсы.
Пример (Тот же синтез аммиака):
Без катализатора равновесие устанавливается крайне медленно. Катализатор (губчатое железо с
добавками) позволяет реакции выйти на рабочую скорость при 450-500°C.
32. Принцип Ле Шателье
Формулировка принципаЕсли на систему, находящуюся в состоянии равновесия, оказать внешнее воздействие, то равновесие
сместится в таком направлении, чтобы ослабить это воздействие.
Это универсальный принцип, применимый не только к химическим, но и к физическим равновесиям
(например, фазовым).
Как применять принцип на практике? Рассмотрим три основных фактора воздействия.
Влияние изменения концентрации
Правило: Увеличение концентрации одного из веществ смещает равновесие в сторону расхода этого
вещества.
Пример:
N₂ + 3H₂ ⇄ 2NH₃
Если увеличить концентрацию N₂ или H₂, равновесие сместится вправо (в сторону образования
аммиака, чтобы "израсходовать" добавленный реагент).
Если увеличить концентрацию NH₃, равновесие сместится влево (в сторону разложения
аммиака, чтобы "уменьшить" его добавленное количество).
Если удалять аммиак из зоны реакции, равновесие постоянно смещается вправо (система
стремится восполнить убыль продукта).
33.
Влияние изменения давления (для газов!)Правило: Повышение давления смещает равновесие в сторону уменьшения общего количества
молей газа.
Как анализировать?
Посчитать сумму молей газообразных веществ слева и справа.
Сравнить их.
Пример:
N₂(г) + 3H₂(г) ⇄ 2NH₃(г)
Слева: 1 моль + 3 моля = 4 моля газа
Справа: 2 моля газа
Вывод: При повышении давления равновесие сместится вправо, так как это приводит к
уменьшению общего числа частиц и, следовательно, к снижению давления (система
"противодействует" росту давления).
Важно! Если количество молей газа одинаково с обеих сторон, давление не влияет на положение
равновесия.
Пример: H₂(г) + I₂(г) ⇄ 2HI(г) (1+1 = 2 слева и 2 справа).
34.
Влияние изменения температурыПравило: Повышение температуры смещает равновесие в сторону эндотермической реакции
(поглощающей тепло).
Как анализировать?
Определить, какая из реакций (прямая или обратная) является эндотермической.
Записать тепловой эффект в уравнении.
Пример:
N₂ + 3H₂ ⇄ 2NH₃ + Q (ΔH < 0)
Прямая реакция (→) — экзотермическая (выделяет тепло, +Q).
Обратная реакция (←) — эндотермическая (поглощает тепло, -Q).
Вывод:
При повышении температуры равновесие сместится влево (в сторону эндотермической
реакции разложения аммиака, чтобы "поглотить" избыток тепла).
При понижении температуры равновесие сместится вправо (в сторону экзотермической
реакции синтеза аммиака, чтобы "скомпенсировать" охлаждение).
































 Химия
Химия