Похожие презентации:
Презентация по химии на тему _Кислоты_
1.
КИСЛОТЫВыполнила: Якунина О. В.- учитель
химии
2.
images.yandex.ru3.
КислотыЛакмус будет в них краснеть,
Растворяться – цинк и медь.
А мелок в них, посмотри,
В миг пускает пузыри!
И опасны для работы
Эти жгучие …… кислоты.
4.
Цель урока: познакомиться склассификациями и общими
физическими и химическими
свойствами кислот.
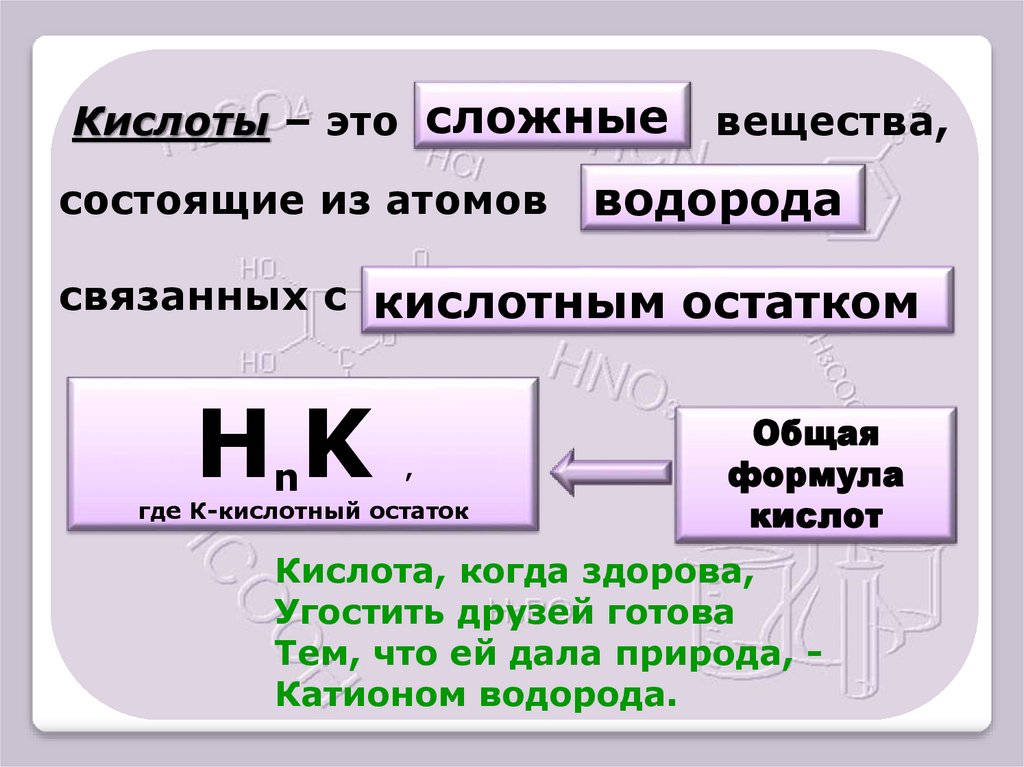
5.
Кислоты – это сложныесостоящие из атомов
вещества,
водорода
связанных с кислотным остатком
НnK
,
где К-кислотный остаток
Общая
формула
кислот
Кислота, когда здорова,
Угостить друзей готова
Тем, что ей дала природа, Катионом водорода.
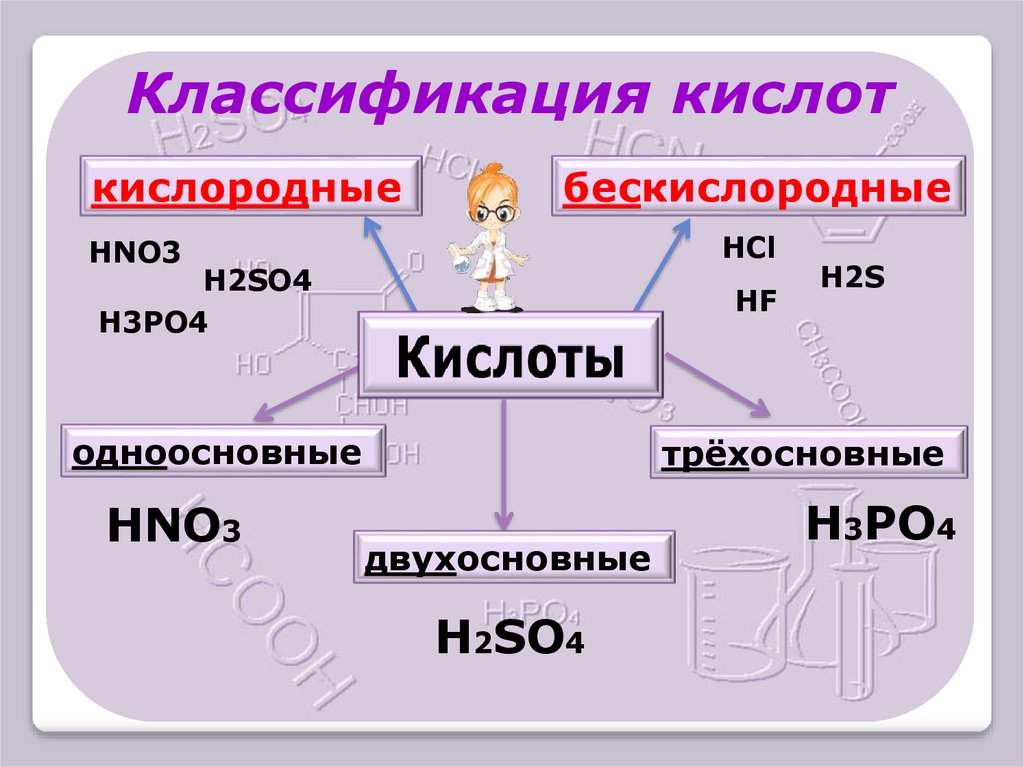
6.
Классификация кислоткислородные
бескислородные
HCl
HNO3
H2SO4
H3PO4
HF
одноосновные
HNO3
H2S
трёхосновные
двухосновные
H2SO4
H3PO4
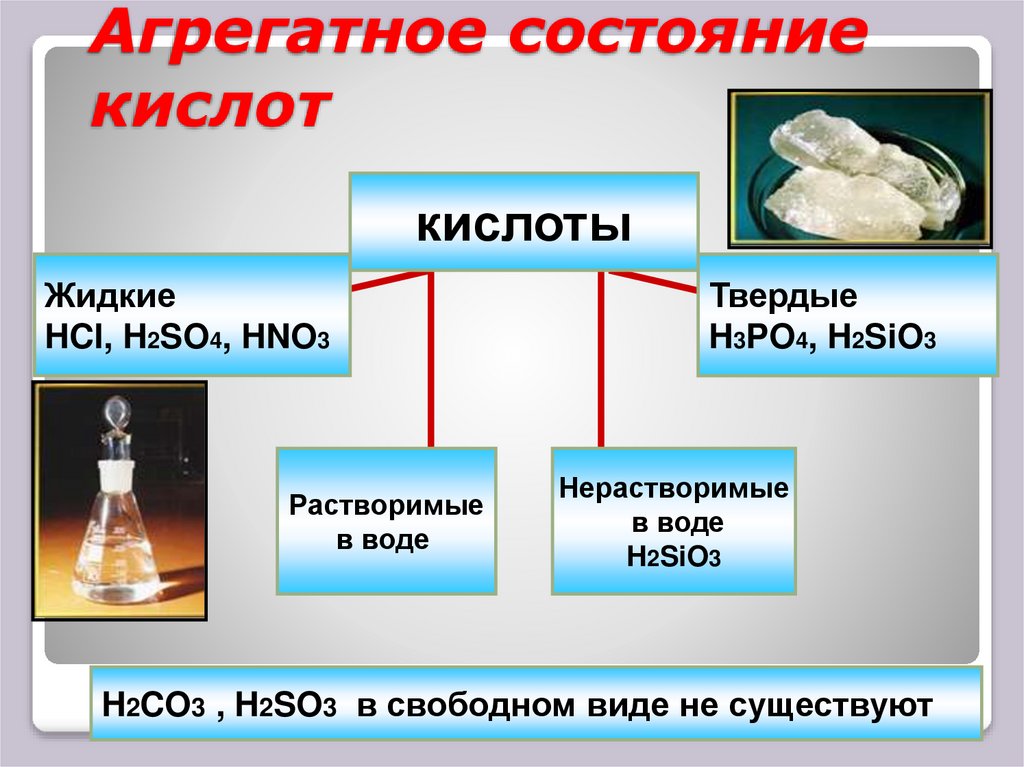
7. Агрегатное состояние кислот
кислотыЖидкие
HCI, H2SO4, HNO3
Растворимые
в воде
Твердые
H3PO4, H2SiO3
Нерастворимые
в воде
H2SiO3
H2CO3 , H2SO3 в свободном виде не существуют
8.
Физические свойства:Большинство кислот – жидкие вещества.
Разъедают (разрушают):
• кожу,
• ткани,
• бумагу,
• древесину.
Техника безопасности
При попадании кислоты на кожу необходимо это
место промыть большим количеством воды
и обработать раствором соды.
При разбавлении серной кислоты
приливают кислоту к воде, а не наоборот.
Нельзя приливать воду к кислоте, потому что происходит
сильное разогревание раствора и его разбрызгивание.
Это очень опасно!
9. Разбавление серной кислоты водой
Относительносмешивания серной
кислоты с водой с
давних пор
существует строгое
правило:
«Сначала вода, потом
кислота, иначе
произойдет
ужасное».
10. Представители кислот
HNO3 – азотнаякислота. Бесцветная
летучая жидкость с
резким запахом, дымит
на воздухе, сильный
окислитель.
HNO3 применяется
для производства
взрывчатых веществ,
красителей, лаков,
лекарств, полимеров,
удобрений.
Её называют
«царицей всех кислот»
11. Представители кислот
H2SO4 - сернаякислота тяжелая
маслянистая
жидкость, сильный
окислитель,
электролит.
Издавна её
называют «матерью
всех кислот»,
«Купоросное масло»
12.
Химические свойства1. Взаимодействуют с индикаторами
Название индикатора
Цвет индикатора в среде
кислой
щелочной
нейтральной
Лакмус
Красный
Синий
Фиолетовый
Фенолфталеин
Бесцветный
Малиновый
Бесцветный
Метиловый оранжевый
Розовый
Желтый
Оранжевый
2. Взаимодействует с металлами
3. Взаимодействуют с основными оксидами
4.Взаимодействуют с основаниями
5. Взаимодействуют с солями
13. Это интересно
Однажды английскийхимик Роберт Бойль,
изучая свойства
соляной кислоты,
случайно пролил ее.
Кислота попала на
сине-фиолетовые
лепестки фиалок.
Спустя некоторое
время лепестки стали
ярко-красными. Так
были открыты
индикаторы.
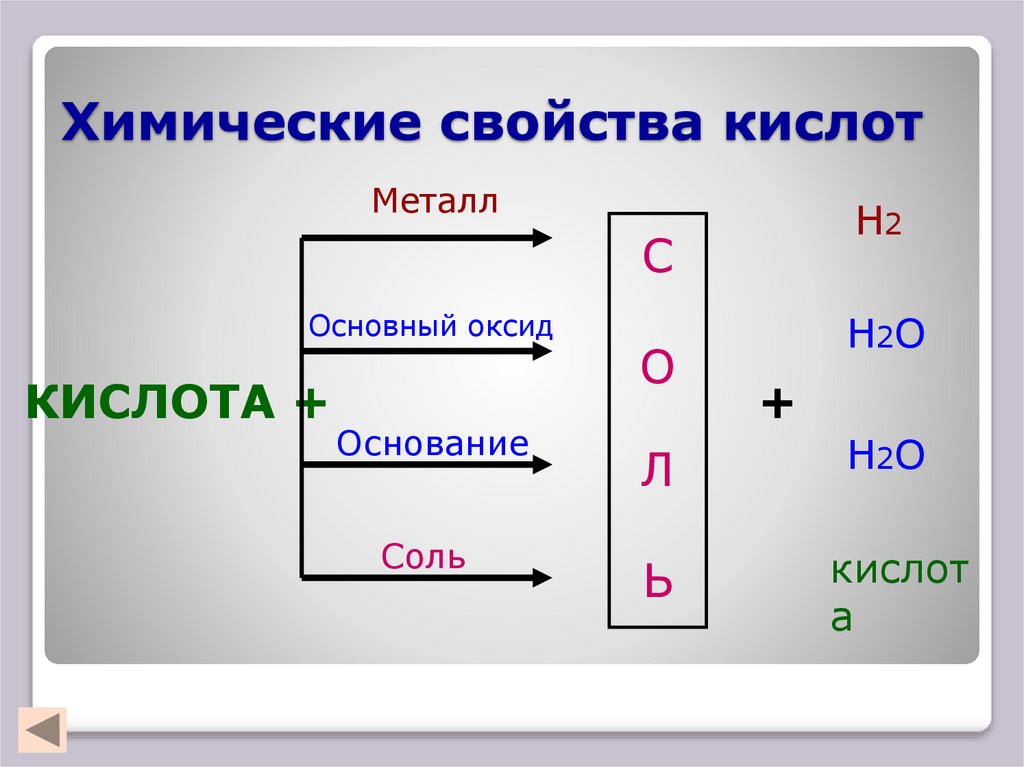
14. Химические свойства кислот
МеталлН2
С
Основный оксид
КИСЛОТА +
Основание
Соль
О
Н2О
+
Л
Н2О
Ь
кислот
а
15. Химические свойства кислот
Кислота + металл = соль + водородРяд активности металлов:
Li K Ba Ca Na Mg Al Zn Fe Sn Pb H Cu Hg
Ag Pt Au
Активность металлов уменьшается
Опыт 1. Взаимодействие цинка с соляной
кислотой
Опыт 2. Взаимодействие металлов с
кислотами
16.
Химические свойствакислот
• Кислота + основный оксид = соль
+ вода
Опыт. Взаимодействие оксида меди
(II) с серной кислотой
СuO + H2SO4 = CuSO4 +H2O
17.
Химические свойствакислот
• Кислота + основание = соль
+ вода
HCl + NaOH NaCl +
=
H2O
H2SO4 + Cu(OH)2 CuSO4 + 2H2O
=
Опыт.
18.
Химические свойствакислот
• Кислота 1 + соль 1 = соль 2 +
Кислота 2
Условия реакции:
1. Если образуется осадок
↓:
H2SO4 + BaCl2 BaSO4↓ + 2HCl
=
2. Если выделяется газ:
2 HNO3 + CaCO3
=
Ca(NO3)2 + H2O +
CO2
19.
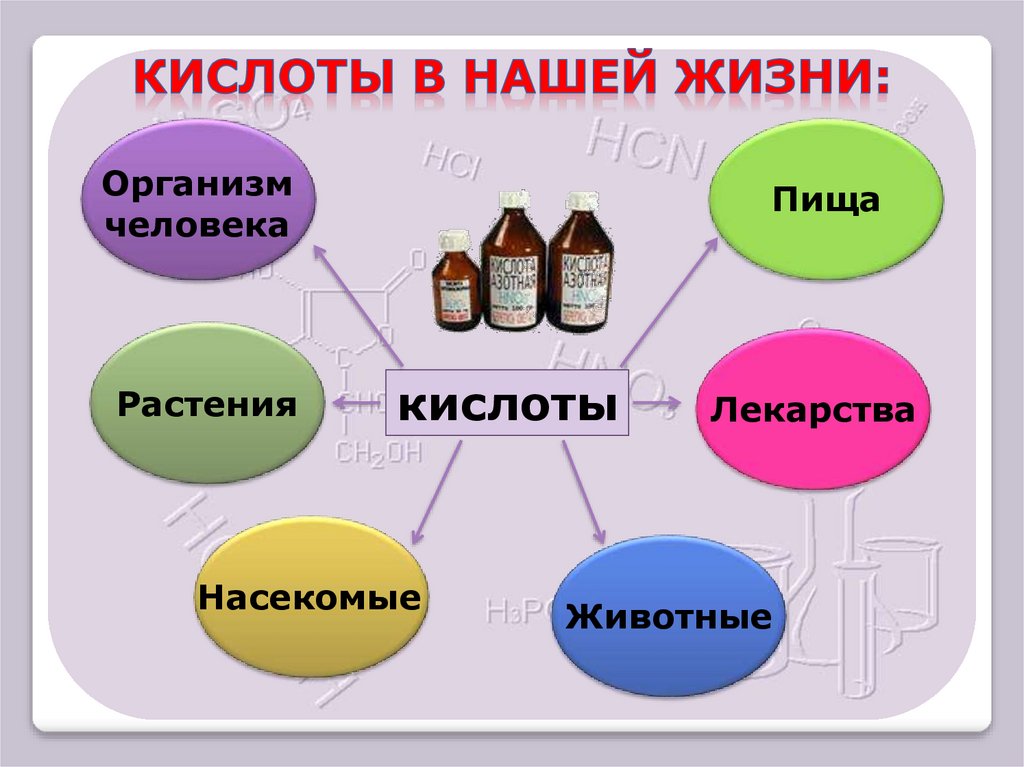
Организмчеловека
Растения
Пища
кислоты
Насекомые
Лекарства
Животные
20.
• Лимонная кислота• Яблочная кислота
• Винная кислота
• Щавелевая кислота
• Муравьиная кислота
21.
• Уксусная кислота• Молочная кислота
• Лимонная кислота
22.
Аскорбиновая, фолиевая, оротовая,пангамовая, никотиновая и другие
кислоты являются витаминами.
Соляная кислота находится в желудке.
Бактерии, попавшие в желудок с пищей,
погибают под ее действием.
Молочная кислота образуется в
мышцах при физической нагрузке.
23.
Нуклеиновые кислоты:ДНК является носителем генетической информации.
С молекулами ДНК связаны два основополагающих
свойства живых организмов –наследственность и
изменчивость.
24.
КИСЛОТНЫЕ ДОЖДИ В ПРИРОДЕ.SO2+H2O=H2SO3
Если кислый дождь из тучи,
То природная среда
Вся в опасности тогда.
25.
Минеральные кислотыНазвание кислоты
Формула кислоты
Азотная
Серная
Угольная
Кремниевая
Метафосфорная
Ортофосфорная
Соляная
С
Р
HNO3
H2SO4
H2CO3
H2SiO3
HPO3
H3PO4
HCl
26.
Азотная кислоташироко используется для производства удобрений, красителей,
лаков, пластмасс, лекарственных и взрывчатых веществ, а
также химических волокон.
Серная кислота
расходуется для производства минеральных удобрений,
красителей, химических волокон, пластмасс, лекарственных
веществ, используется для извлечения металлов из руд;
заполнения кислотных аккумуляторов, находит применение в
нефтяной промышленности для очистки нефтепродуктов.
Фосфорная кислота
используется в составах для обезжиривания металлических поверхностей
перед нанесением защитных покрытий, входит в состав композиций для
преобразования ржавчины перед покраской, применяется для защиты от
коррозии трубопроводов, прокачивающих морскую воду.
Соляная кислота
широко применяется в нефтяной промышленности, используется в составах
травильных растворов для удаления ржавчины и отложений в трубопроводах и
скважинах, а также как отвердитель фенолформальдегидных смол.
27.
Полезные советыУксусная эссенция, подогретая на водяной
бане, способна обесцвечивать чернильные
пятна на паркете
Если вы подпалили утюгом изделие из
светлой хлопчатобумажной ткани, замочите
изделие на ночь в небольшом количестве воды
с равной долей кислого молока – подпалина
исчезнет.
Чтобы устранить специфический запах
несвежего хлеба в хлебнице, протрите ее
стенки уксусом.
Краски ковра снова станут яркими и
насыщенными, если протереть его тряпкой,
смоченной в уксусе.
28.
Кислоты разные нужны,Кислоты всякие важны!
Они и в пище и в траве,
В белке, и в дождевой воде.
И чтобы грамотными быть,
Кислоты нужно изучить!
29.
Кислоты – помощницыКакую кислоту добавляют в напитки
для придания кислого вкуса?
Какая кислота содержится в
минеральной воде?
Какая кислота содержится в
желудочном соке?
С помощью какой кислоты делают
рисунки на стекле?
30.
Проверь себя1.Формула кислоты это:
а) КOH б) CаCl2 в) HCL
г)
SO2
2. С раствором серной кислоты
взаимодействует:
а) оксид калия
в) оксид
фосфора
б) оксид углерода г) медь
3. Соляная кислота не
взаимодействует с металлом:
а) алюминием
б) серебром
в) железом
г) цинком
31.
Я познакомился с кислотами и понял:что это сложные вещества состоящие из атомов
водорода и кислотного остатка;
узнал, о многообразии кислот;
что кислоты имеют кислую среду;
что они очень полезны для человека и
используются им в быту и в производстве.
32. Информационные источники:
1.3CD-ROM «Химия.8 класс» (Электронный ресурс) – М.
«Просвещение»,2004.
2.
Габриелян О.С. Настольная книга учителя. Химия. 8 класс. М.:
Дрофа, 2003
3.
Маркина И.В. Современный урок химии. Ярославль. Академия
развития. 2008
4.
Правила техники безопасности при работе с кислотами.
Анимация. http://files.school-collection.edu.ru/dlrstore/0ab6f5aa4185-11db-b0de-0800200c9a66/ch08_20_05.swf
5. http://www.logosib.ru/him/HCl.jpg
6. http://forexaw.com/TERMs/Metal121313/img73211_41_Himicheskie_svoystva_zolota-rastvoryi.jpg
Информационные источники:


























 Химия
Химия








