Похожие презентации:
Химические свойства водорода
1. Химические свойства водорода
2.
Водород в промышленности получаютдействием соляной кислоты на цинк
конверсией природного газа
действием раствора щелочи на алюминий
разложением воды электрическим током
3. 1. Какова относительная атомная масса водорода
1) 42) 3
3) 1
4) 2
2. Состав молекулы воды
1) Н2
2) Н
3) Н2О2
4) Н2О
4. 3. Состав молекулы водорода
1) Н22) Н
3) Н2О2
4) Н2О
4. Во сколько раз водород легче газа
кислорода?
1) 4
2) 12
3) 16
4) 14,5
5. 5. Каким способом можно получить водород в промышленности?
1) взаимодействие кислот с металлами2) взаимодействие активных металлов с
водой
3) из природного газа
4) разложением воды
6. 6. Какова относительная молекулярная масса водорода?
1) 42) 3
3) 1
4) 2
7. Укажите валентность водорода в
соединениях
1) I
2) II
3) III
4)IV
7. В результате реакции, термохимическое уравнение которой 2Н2 + О2 → 2Н2О + 484 кДж выделилось 121 кДж теплоты.
В результате реакции, термохимическое уравнение которой 2Н2 + О2 → 2Н2О + 484 кДжвыделилось 121 кДж теплоты.
Вычислите объём (н. у.) кислорода, который
израсходован на сжигание водорода.
Задание
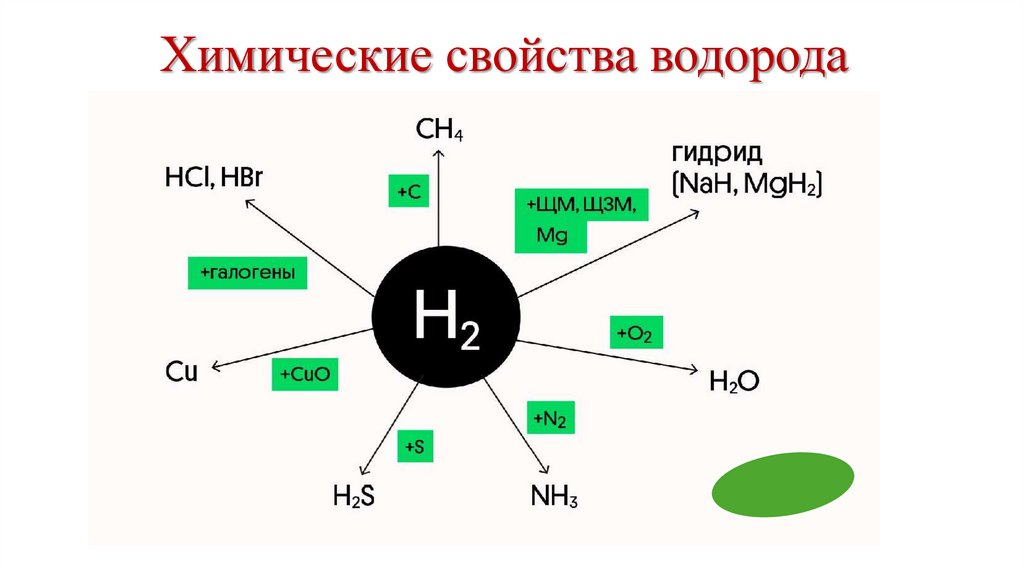
8. Химические свойства водорода
9. Реагирует с
1⃣ + металлы (только ЩМ, ЩЗМ и Mg)Na + H₂ → 2NaH
Mg + H₂ → MgH₂
10.
2 ⃣ + неметаллыCl₂ + H₂ → 2HCl
O₂ + 2H₂ → 2H₂O
S + H₂ → H₂S
N₂ + 3H₂ → 2NH₃
С + 2H₂ → CH₄
• С кремнием и фосфором водород не реагирует
11.
3 ⃣ + оксиды некоторых металлов средней ималой активности
CuO + H₂ → Cu + H₂O (t°C)
4⃣ в смеси с СО образует синтез-газ, который
является сырьем для производства многих
органических соединений
12. В результате реакции, термохимическое уравнение которой 2Н2 + О2 → 2Н2О + 484 кДж выделилось 121 кДж теплоты.
В результате реакции, термохимическое уравнениекоторой 2Н2 + О2 → 2Н2О + 484 кДж
выделилось 121 кДж теплоты. Вычислите объём
(н. у.) кислорода, который израсходован на сжигание водорода.
Задание











 Химия
Химия








