Похожие презентации:
Презентация v2_Терапия мКРРПЖ в первой линии_Ужевко Т.Н (1)
1. Терапия мКРРПЖ в первой линии: современные возможности и взгляд в будущее Ужевко тамара Николаевна - врач-химиотерапевт, зав.
дневнымстационаром ЦАОП г. Люберцы
Доклад подготовлен при поддержке компании Пфайзер
Breakthroughs that change patients’ lives
EM-RUS-tla-0129
2. Эпидемиология рака предстательной железы в РФ
В мире:1,2В России:
2020 год
• 17 % от всех ЗНО у мужчин (1-е место)
• РПЖ IV стадии в 2022 году установлен у
21,6 % пациентов
14.1% от всех случаев ЗНО у мужчин (2-е
место)
5-е место в структуре смертности (6.8%
всех смертей от ЗНО)
В разных странах в 15-30% диагноз
устанавливается на IV стадии
2040 прогноз:
~820,000 новых случаев
~345,000 дополнительных смертей
• стандартизованный показатель 42,12 на 100
тыс. населения
• прирост заболеваемости с 2012 по 2022 гг. 13,66 %.
• В структуре смертности от онкологических
заболеваний у мужчин РПЖ занимает 3-е
место после опухолей трахеи, бронхов,
легкого и рака желудка
Злокачественные новообразования в России в 2022 году (заболеваемость и смертность). Под ред. А.Д. Каприна,
В.В. Старинского, А.О. Шахзадовой, И.В. Лисичниковой. Москва, 2023
2
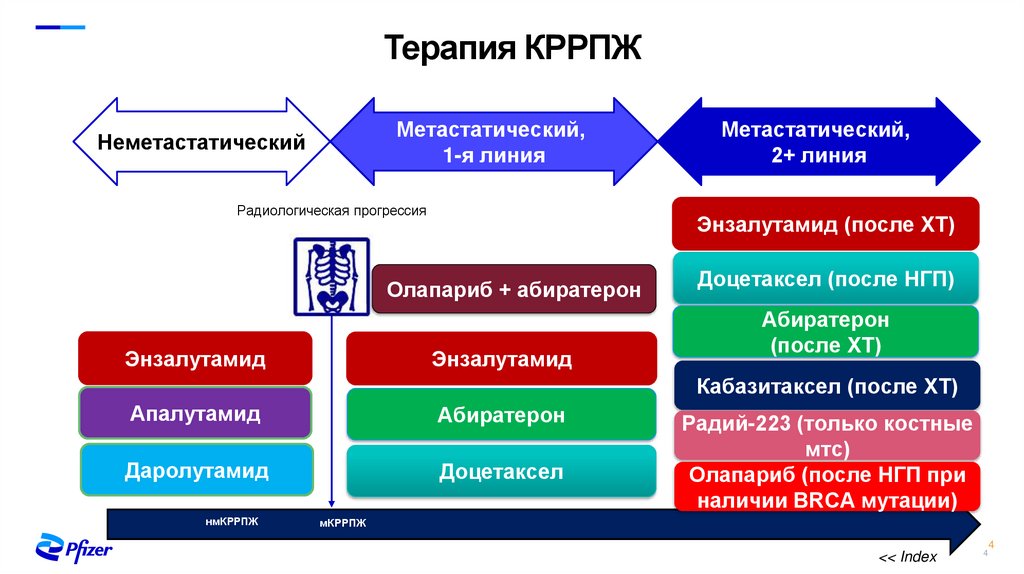
3. Принципы терапии РПЖ
Терапия КРРПЖМетастатический,
1-я линия
Неметастатический
Радиологическая прогрессия
Энзалутамид (после ХТ)
Олапариб + абиратерон
Энзалутамид
Метастатический,
2+ линия
Энзалутамид
Доцетаксел (после НГП)
Абиратерон
(после ХТ)
Кабазитаксел (после ХТ)
Апалутамид
Абиратерон
Даролутамид
Доцетаксел
нмКРРПЖ
Радий-223 (только костные
мтс)
Олапариб (после НГП при
наличии BRCA мутации)
мКРРПЖ
<< Index
4
4
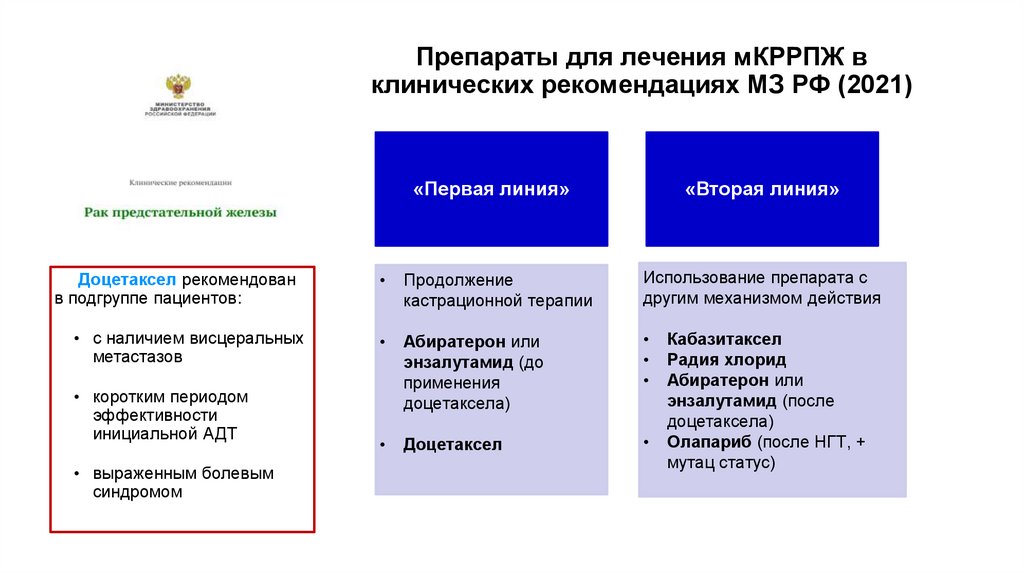
4. Терапия КРРПЖ
Препараты для лечения мКРРПЖ вклинических рекомендациях МЗ РФ (2021)
«Первая линия»
«Вторая линия»
Доцетаксел рекомендован
в подгруппе пациентов:
Продолжение
кастрационной терапии
Использование препарата с
другим механизмом действия
• с наличием висцеральных
метастазов
Абиратерон или
энзалутамид (до
применения
доцетаксела)
Доцетаксел
• коротким периодом
эффективности
инициальной АДТ
• выраженным болевым
синдромом
Кабазитаксел
Радия хлорид
Абиратерон или
энзалутамид (после
доцетаксела)
Олапариб (после НГТ, +
мутац статус)
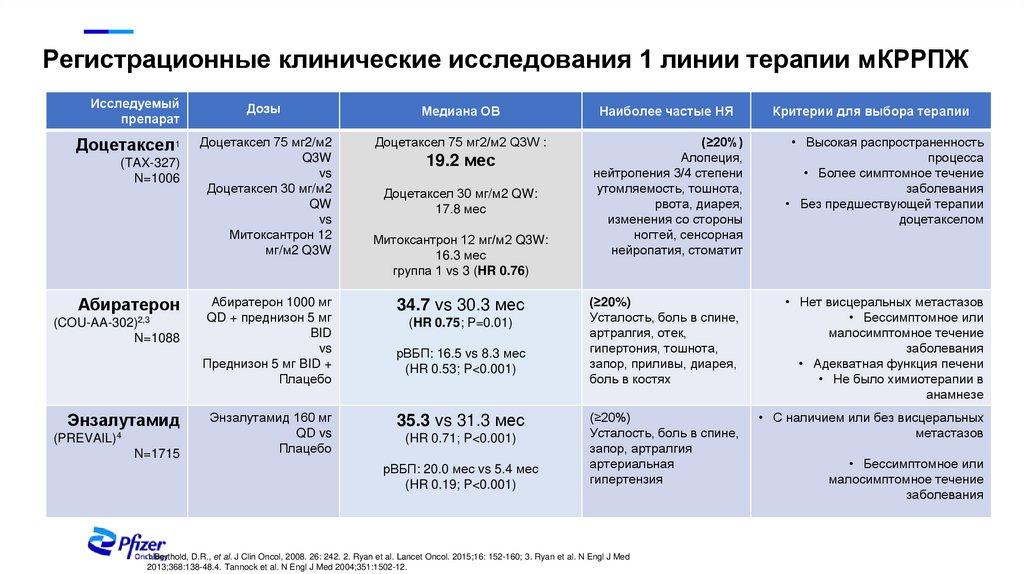
5.
Регистрационные клинические исследования 1 линии терапии мКРРПЖИсследуемый
препарат
Дозы
Медиана ОВ
Наиболее частые НЯ
Доцетаксел1
Доцетаксел 75 мг2/м2
Q3W
vs
Доцетаксел 30 мг/м2
QW
vs
Митоксантрон 12
мг/м2 Q3W
Доцетаксел 75 мг2/м2 Q3W :
(≥20%)
Алопеция,
нейтропения 3/4 степени
утомляемость, тошнота,
рвота, диарея,
изменения со стороны
ногтей, сенсорная
нейропатия, стоматит
• Высокая распространенность
процесса
• Более симптомное течение
заболевания
• Без предшествующей терапии
доцетакселом
(≥20%)
Усталость, боль в спине,
артралгия, отек,
гипертония, тошнота,
запор, приливы, диарея,
боль в костях
• Нет висцеральных метастазов
• Бессимптомное или
малосимптомное течение
заболевания
• Адекватная функция печени
• Не было химиотерапии в
анамнезе
(≥20%)
Усталость, боль в спине,
запор, артралгия
артериальная
гипертензия
• С наличием или без висцеральных
метастазов
(TAX-327)
N=1006
Абиратерон
(COU-AA-302)2,3
N=1088
Энзалутамид
(PREVAIL)4
N=1715
Абиратерон 1000 мг
QD + преднизон 5 мг
BID
vs
Преднизон 5 мг BID +
Плацебо
Энзалутамид 160 мг
QD vs
Плацебо
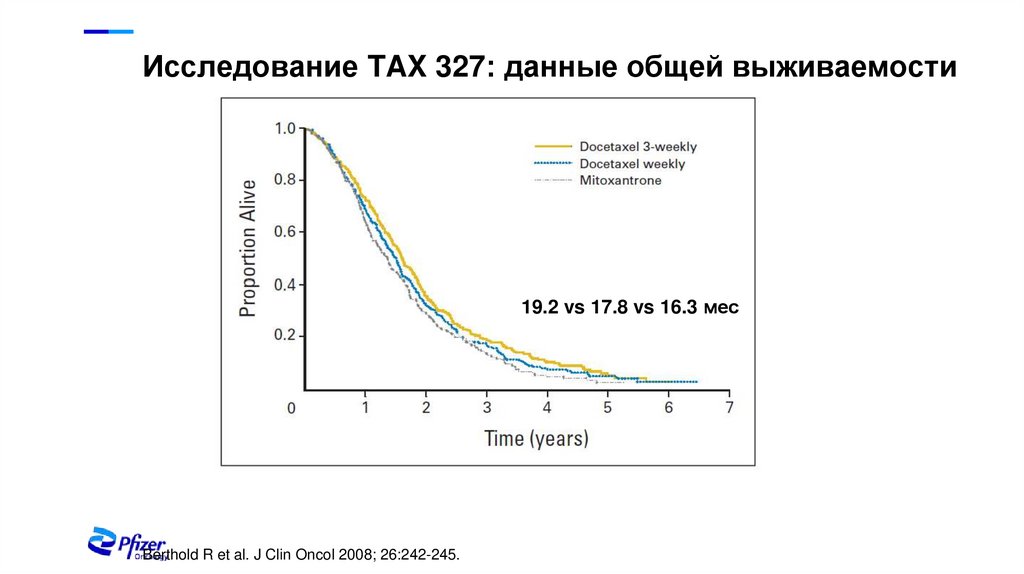
19.2 мес
Доцетаксел 30 мг/м2 QW:
17.8 мес
Митоксантрон 12 мг/м2 Q3W:
16.3 мес
группа 1 vs 3 (HR 0.76)
34.7 vs 30.3 мес
(HR 0.75; P=0.01)
рВБП: 16.5 vs 8.3 мес
(HR 0.53; P<0.001)
35.3 vs 31.3 мес
(HR 0.71; P<0.001)
рВБП: 20.0 мес vs 5.4 мес
(HR 0.19; P<0.001)
1.Berthold, D.R., et al. J Clin Oncol, 2008. 26: 242. 2. Ryan et al. Lancet Oncol. 2015;16: 152-160; 3. Ryan et al. N Engl J Med
2013;368:138-48.4. Tannock et al. N Engl J Med 2004;351:1502-12.
Критерии для выбора терапии
• Бессимптомное или
малосимптомное течение
заболевания
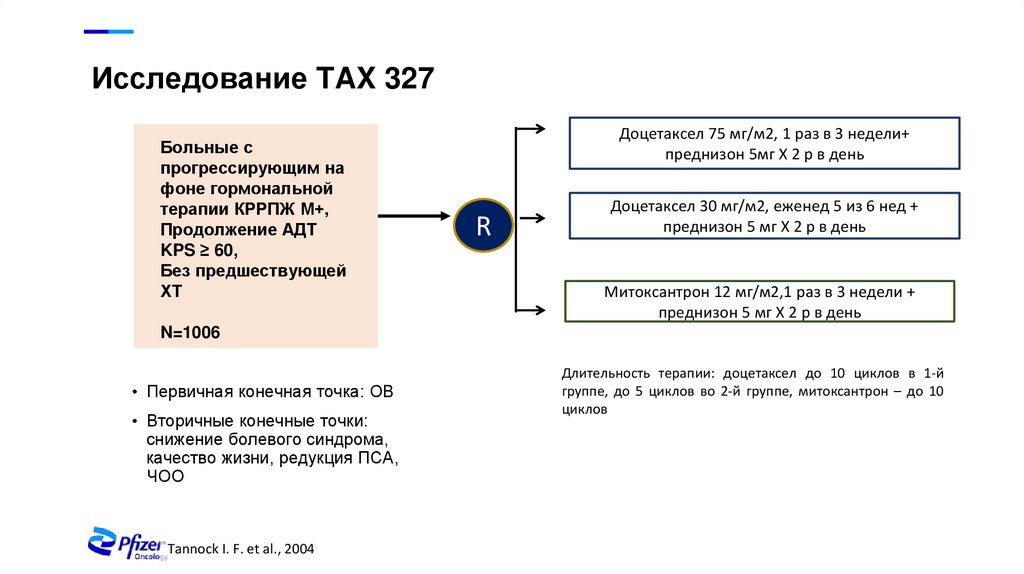
6. Алгоритмы в терапии мКРРПЖ
Исследование TAX 327Больные с
прогрессирующим на
фоне гормональной
терапии КРРПЖ М+,
Продолжение АДТ
KPS ≥ 60,
Без предшествующей
ХТ
Доцетаксел 75 мг/м2, 1 раз в 3 недели+
преднизон 5мг Х 2 р в день
R
Доцетаксел 30 мг/м2, еженед 5 из 6 нед +
преднизон 5 мг Х 2 р в день
Митоксантрон 12 мг/м2,1 раз в 3 недели +
преднизон 5 мг Х 2 р в день
N=1006
• Первичная конечная точка: ОВ
• Вторичные конечные точки:
снижение болевого синдрома,
качество жизни, редукция ПСА,
ЧОО
Tannock I. F. et al., 2004
Длительность терапии: доцетаксел до 10 циклов в 1-й
группе, до 5 циклов во 2-й группе, митоксантрон – до 10
циклов
7. Регистрационные клинические исследования 1 линии терапии мКРРПЖ
Исследование TAX 327: данные общей выживаемости19.2 vs 17.8 vs 16.3 мес
Berthold R et al. J Clin Oncol 2008; 26:242-245.
8. Исследование TAX 327
Выбор между доцетакселом и НГТ в 1-й линии терапиимКРРПЖ
Энзалутамид
Абиратерон
Docetaxel
Доцетаксел
• Хороший ответ на ГТ (>12 месяцев)
• Минимальные симптомы (?)
• Малый или умеренный объем метастазов
• Нет висцеральных метастазов (только для абиратерона)
• Невозможность ХТ (пожилой, плохой ФС, выбор
пациента)
• Противопоказания к стероидам (в т.ч. для абираторона)
• Предшествующее назначение доцетаксела (при мГЧРПЖ)
• Малая длительность ответа на ГТ (<12
месяцев)
• Выраженные симптомы
• Распространенные метастазы
• Быстро прогрессирующее заболевание
• Висцеральные метастазы
• Подходит для ХТ / хороший ФС
14
9. Исследование TAX 327: данные общей выживаемости
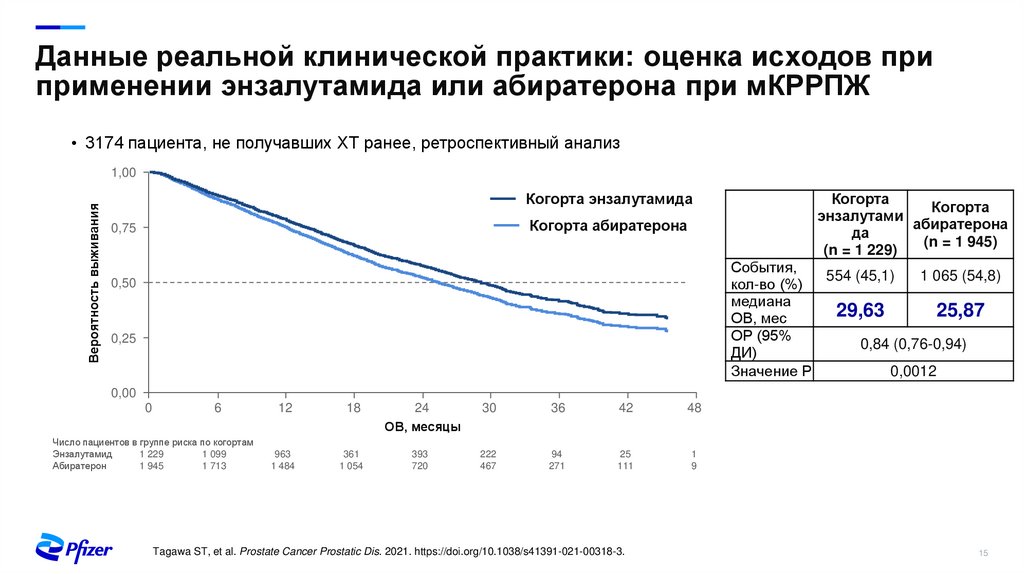
Данные реальной клинической практики: оценка исходов приприменении энзалутамида или абиратерона при мКРРПЖ
• 3174 пациента, не получавших ХТ ранее, ретроспективный анализ
Вероятность выживания
1,00
Когорта энзалутамида
Когорта абиратерона
0,75
Когорта
Когорта
энзалутами
абиратерона
да
(n = 1 945)
(n = 1 229)
События,
554 (45,1)
1 065 (54,8)
кол-во (%)
медиана
29,63
25,87
ОВ, мес
ОР (95%
0,84 (0,76-0,94)
ДИ)
Значение Р
0,0012
0,50
0,25
0,00
0
6
Число пациентов в группе риска по когортам
Энзалутамид
1 229
1 099
Абиратерон
1 945
1 713
12
18
24
ОВ, месяцы
30
36
42
48
963
1 484
361
1 054
393
720
222
467
94
271
25
111
1
9
Tagawa ST, et al. Prostate Cancer Prostatic Dis. 2021. https://doi.org/10.1038/s41391-021-00318-3.
15
10. Исследование III фазы COU-AA-302: абиратерон при КРРПЖ у больных, не получавших химиотерапию
Фармакокинетические особенностиингибиторов PARP
Основными ферментами, участвующими в метаболизме олапариба, являются
изоферменты цитохрома Р450 CYP3A4/5
Талазопариб не метаболизируется ферментами печени:
после приема внутрь одной дозы 1 мг талазопариба в плазме крови человека не
выявлялось основных циркулирующих метаболитов, а талазопариб был
единственным обнаруженным циркулирующим производным лекарственного
вещества
талазопариб не является ингибитором цитохромов или же индуктором в
клинически значимых концентрациях
16
11.
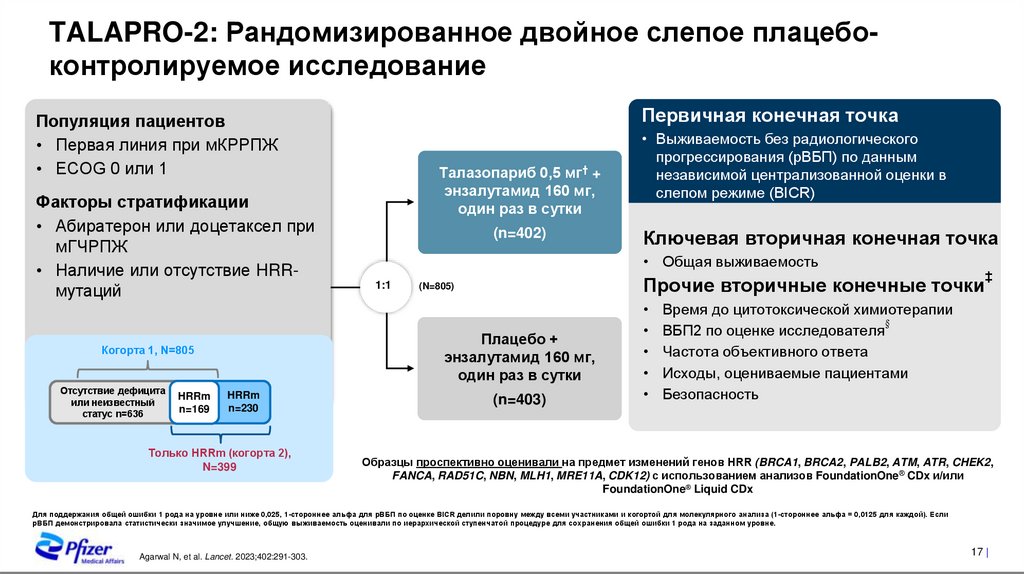
TALAPRO-2: Рандомизированное двойное слепое плацебоконтролируемое исследованиеПервичная конечная точка
Популяция пациентов
• Первая линия при мКРРПЖ
• ECOG 0 или 1
Факторы стратификации
• Абиратерон или доцетаксел при
мГЧРПЖ
• Наличие или отсутствие HRRмутаций
HRRm
n=169
(n=402)
HRRm
n=230
Только HRRm (когорта 2),
N=399
Ключевая вторичная конечная точка
• Общая выживаемость
1:1
Прочие вторичные конечные точки
(N=805)
Плацебо +
энзалутамид 160 мг,
один раз в сутки
Когорта 1, N=805
Отсутствие дефицита
или неизвестный
статус n=636
Талазопариб 0,5 мг† +
энзалутамид 160 мг,
один раз в сутки
• Выживаемость без радиологического
прогрессирования (рВБП) по данным
независимой централизованной оценки в
слепом режиме (BICR)
(n=403)
‡
Время до цитотоксической химиотерапии
§
ВБП2 по оценке исследователя
Частота объективного ответа
Исходы, оцениваемые пациентами
Безопасность
Образцы проспективно оценивали на предмет изменений генов HRR (BRCA1, BRCA2, PALB2, ATM, ATR, CHEK2,
FANCA, RAD51C, NBN, MLH1, MRE11A, CDK12) с использованием анализов FoundationOne® CDx и/или
FoundationOne® Liquid CDx
Для поддержания общей ошибки 1 рода на уровне или ниже 0,025, 1-стороннее альфа для рВБП по оценке BICR делили поровну между всеми участниками и когортой для молекулярного анализа (1-стороннее альфа = 0,0125 для каждой). Если
рВБП демонстрировала статистически значимое улучшение, общую выживаемость оценивали по иерархической ступенчатой процедуре для сохранения общей ошибки 1 рода на заданном уровне.
Agarwal N, et al. Lancet. 2023;402:291-303.
17 |
12. Исследование PREVAIL: эффективность энзалутамида у пациентов с мКРРПЖ в первой линии
Слайд содержит информацию для:Все пациенты (Когорта 1)
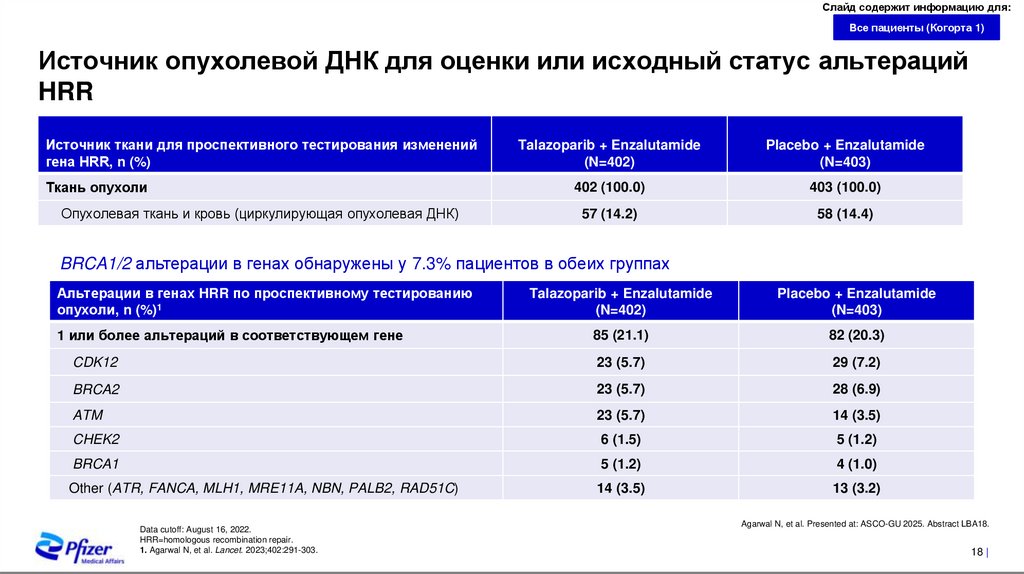
Источник опухолевой ДНК для оценки или исходный статус альтераций
HRR
Источник ткани для проспективного тестирования изменений
гена HRR, n (%)
Ткань опухоли
Опухолевая ткань и кровь (циркулирующая опухолевая ДНК)
Talazoparib + Enzalutamide
(N=402)
Placebo + Enzalutamide
(N=403)
402 (100.0)
403 (100.0)
57 (14.2)
58 (14.4)
BRCA1/2 альтерации в генах обнаружены у 7.3% пациентов в обеих группах
Альтерации в генах HRR по проспективному тестированию
опухоли, n (%)1
Talazoparib + Enzalutamide
(N=402)
Placebo + Enzalutamide
(N=403)
85 (21.1)
82 (20.3)
CDK12
23 (5.7)
29 (7.2)
BRCA2
23 (5.7)
28 (6.9)
ATM
23 (5.7)
14 (3.5)
CHEK2
6 (1.5)
5 (1.2)
BRCA1
5 (1.2)
4 (1.0)
Other (ATR, FANCA, MLH1, MRE11A, NBN, PALB2, RAD51C)
14 (3.5)
13 (3.2)
1 или более альтераций в соответствующем гене
Data cutoff: August 16, 2022.
HRR=homologous recombination repair.
1. Agarwal N, et al. Lancet. 2023;402:291-303.
Agarwal N, et al. Presented at: ASCO-GU 2025. Abstract LBA18.
18 |
13.
Слайд содержит информацию для:Все пациенты (Когорта 1)
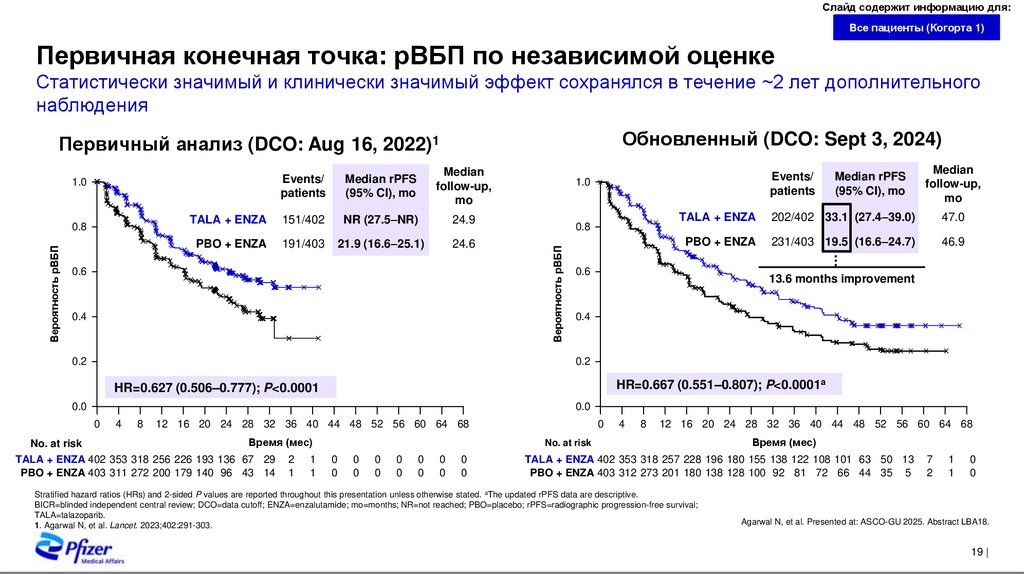
Первичная конечная точка: рВБП по независимой оценке
Статистически значимый и клинически значимый эффект сохранялся в течение ~2 лет дополнительного
наблюдения
Обновленный (DCO: Sept 3, 2024)
Первичный анализ (DCO: Aug 16, 2022)1
Median rPFS
(95% CI), mo
Median
follow-up,
mo
Вероятность рВБП
0.8
TALA + ENZA
151/402
NR (27.5–NR)
24.9
PBO + ENZA
191/403
21.9 (16.6–25.1)
24.6
0.6
0.4
0.2
Events/
patients
1.0
0.8
Вероятность рВБП
Events/
patients
1.0
Median rPFS
(95% CI), mo
Median
follow-up,
mo
TALA + ENZA
202/402 33.1 (27.4–39.0)
47.0
PBO + ENZA
231/403 19.5 (16.6–24.7)
46.9
0.6
13.6 months improvement
0.4
0.2
HR=0.667 (0.551–0.807); P<0.0001a
HR=0.627 (0.506–0.777); P<0.0001
0.0
0.0
0
4
8
12 16 20 24 28 32 36 40 44 48 52 56 60 64 68
Время (мес)
No. at risk
TALA + ENZA 402 353 318 256 226 193 136 67 29 2 1
PBO + ENZA 403 311 272 200 179 140 96 43 14 1 1
0
4
8
12 16 20 24 28 32 36 40 44 48 52 56 60 64 68
No. at risk
0
0
0
0
0
0
0
0
0
0
0
0
0
0
Время (мес)
TALA + ENZA 402 353 318 257 228 196 180 155 138 122 108 101 63 50 13
PBO + ENZA 403 312 273 201 180 138 128 100 92 81 72 66 44 35 5
Stratified hazard ratios (HRs) and 2-sided P values are reported throughout this presentation unless otherwise stated. aThe updated rPFS data are descriptive.
BICR=blinded independent central review; DCO=data cutoff; ENZA=enzalutamide; mo=months; NR=not reached; PBO=placebo; rPFS=radiographic progression-free survival;
TALA=talazoparib.
1. Agarwal N, et al. Lancet. 2023;402:291-303.
7
2
1
1
0
0
Agarwal N, et al. Presented at: ASCO-GU 2025. Abstract LBA18.
19 |
14. Выбор между доцетакселом и НГТ в 1-й линии терапии мКРРПЖ
Слайд содержит информацию для:Все пациенты (Когорта 1)
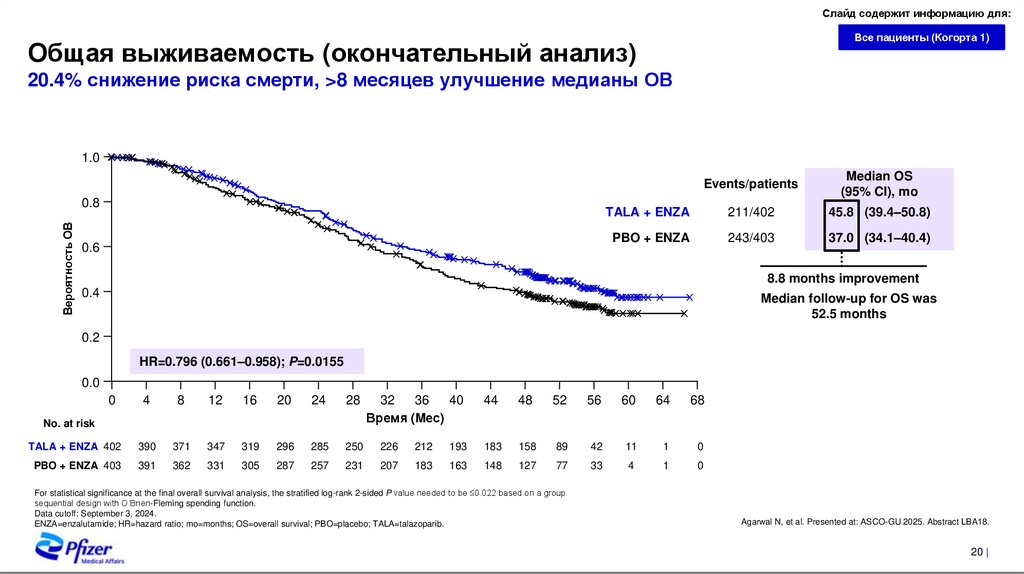
Общая выживаемость (окончательный анализ)
20.4% снижение риска смерти, >8 месяцев улучшение медианы ОВ
1.0
Вероятность ОВ
0.8
0.6
Events/patients
Median OS
(95% CI), mo
TALA + ENZA
211/402
45.8 (39.4–50.8)
PBO + ENZA
243/403
37.0 (34.1–40.4)
8.8 months improvement
0.4
Median follow-up for OS was
52.5 months
0.2
HR=0.796 (0.661–0.958); P=0.0155
0.0
0
4
8
12
16
20
24
28
TALA + ENZA 402
390
371
347
319
296
285
250
226
212
PBO + ENZA 403
391
362
331
305
287
257
231
207
183
No. at risk
32
36
40
Время (Mес)
44
48
52
56
60
64
68
193
183
158
89
42
11
1
0
163
148
127
77
33
4
1
0
For statistical significance at the final overall survival analysis, the stratified log-rank 2-sided P value needed to be ≤0.022 based on a group
sequential design with O’Brien-Fleming spending function.
Data cutoff: September 3, 2024.
ENZA=enzalutamide; HR=hazard ratio; mo=months; OS=overall survival; PBO=placebo; TALA=talazoparib.
Agarwal N, et al. Presented at: ASCO-GU 2025. Abstract LBA18.
20 |
15. Данные реальной клинической практики: оценка исходов при применении энзалутамида или абиратерона при мКРРПЖ
Слайд содержит информацию для:Все пациенты (Когорта 1)
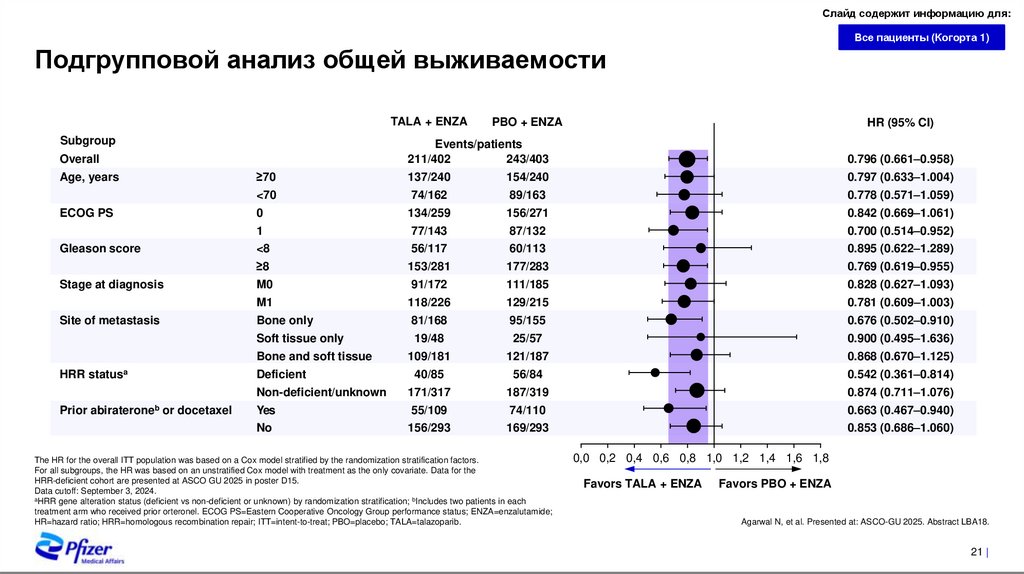
Подгрупповой анализ общей выживаемости
TALA + ENZA
Subgroup
ECOG PS
Gleason score
Stage at diagnosis
Site of metastasis
HRR statusa
Prior abirateroneb or docetaxel
HR (95% CI)
Events/patients
211/402
243/403
0.796 (0.661–0.958)
≥70
137/240
154/240
0.797 (0.633–1.004)
<70
74/162
89/163
0.778 (0.571–1.059)
0
134/259
156/271
0.842 (0.669–1.061)
1
77/143
87/132
0.700 (0.514–0.952)
<8
56/117
60/113
0.895 (0.622–1.289)
≥8
153/281
177/283
0.769 (0.619–0.955)
M0
91/172
111/185
0.828 (0.627–1.093)
M1
118/226
129/215
0.781 (0.609–1.003)
Bone only
81/168
95/155
0.676 (0.502–0.910)
Soft tissue only
19/48
25/57
0.900 (0.495–1.636)
Bone and soft tissue
109/181
121/187
0.868 (0.670–1.125)
Deficient
40/85
56/84
0.542 (0.361–0.814)
Non-deficient/unknown
171/317
187/319
0.874 (0.711–1.076)
Yes
55/109
74/110
0.663 (0.467–0.940)
No
156/293
169/293
0.853 (0.686–1.060)
Overall
Age, years
PBO + ENZA
The HR for the overall ITT population was based on a Cox model stratified by the randomization stratification factors.
For all subgroups, the HR was based on an unstratified Cox model with treatment as the only covariate. Data for the
HRR-deficient cohort are presented at ASCO GU 2025 in poster D15.
Data cutoff: September 3, 2024.
aHRR gene alteration status (deficient vs non-deficient or unknown) by randomization stratification; bIncludes two patients in each
treatment arm who received prior orteronel. ECOG PS=Eastern Cooperative Oncology Group performance status; ENZA=enzalutamide;
HR=hazard ratio; HRR=homologous recombination repair; ITT=intent-to-treat; PBO=placebo; TALA=talazoparib.
0,0 0,2 0,4 0,6 0,8 1,0 1,2 1,4 1,6 1,8
Favors TALA + ENZA
Favors PBO + ENZA
Agarwal N, et al. Presented at: ASCO-GU 2025. Abstract LBA18.
21 |
16. Фармакокинетические особенности ингибиторов PARP
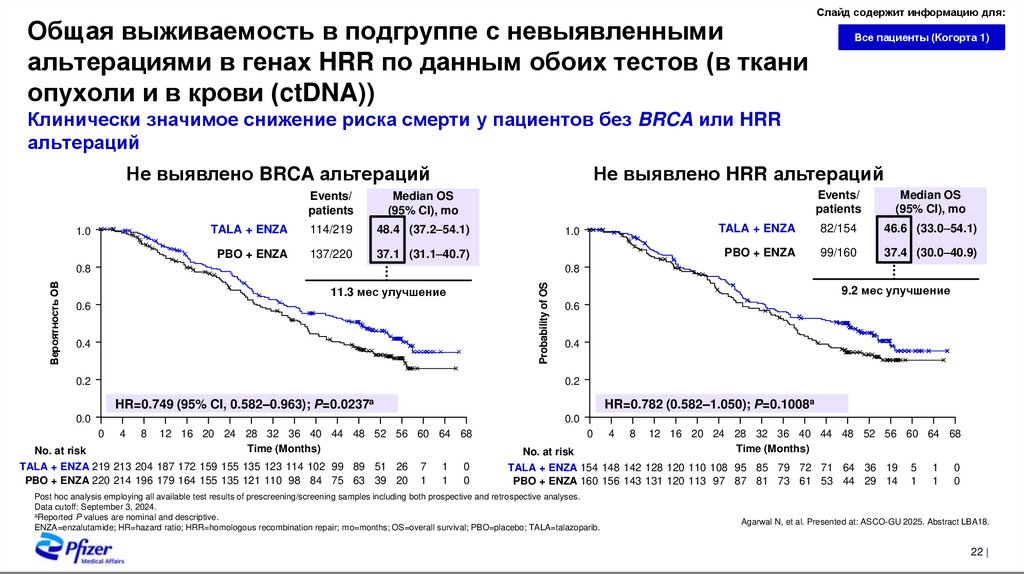
Общая выживаемость в подгруппе с невыявленнымиальтерациями в генах HRR по данным обоих тестов (в ткани
опухоли и в крови (ctDNA))
Слайд содержит информацию для:
Все пациенты (Когорта 1)
Клинически значимое снижение риска смерти у пациентов без BRCA или HRR
альтераций
Не выявлено BRCA альтераций
1.0
Не выявлено HRR альтераций
Events/
patients
Median OS
(95% CI), mo
TALA + ENZA
114/219
48.4 (37.2–54.1)
PBO + ENZA
137/220
37.1 (31.1–40.7)
1.0
Median OS
(95% CI), mo
TALA + ENZA
82/154
46.6 (33.0–54.1)
PBO + ENZA
99/160
37.4 (30.0–40.9)
0.8
Probability of OS
Вероятность ОВ
0.8
Events/
patients
11.3 мес улучшение
0.6
0.4
0.2
9.2 мес улучшение
0.6
0.4
0.2
HR=0.749 (95% CI, 0.582–0.963); P=0.0237a
HR=0.782 (0.582–1.050); P=0.1008a
0.0
0.0
0
4
8
12 16 20 24 28 32 36 40 44 48 52 56 60 64 68
Time (Months)
No. at risk
TALA + ENZA 219 213 204 187 172 159 155 135 123 114 102 99 89 51 26
PBO + ENZA 220 214 196 179 164 155 135 121 110 98 84 75 63 39 20
7
1
1
1
0
0
0
4
8
12 16 20 24 28 32 36 40 44 48 52 56 60 64 68
Time (Months)
No. at risk
TALA + ENZA 154 148 142 128 120 110 108 95 85 79 72 71 64 36 19
PBO + ENZA 160 156 143 131 120 113 97 87 81 73 61 53 44 29 14
Post hoc analysis employing all available test results of prescreening/screening samples including both prospective and retrospective analyses.
Data cutoff: September 3, 2024.
aReported P values are nominal and descriptive.
ENZA=enzalutamide; HR=hazard ratio; HRR=homologous recombination repair; mo=months; OS=overall survival; PBO=placebo; TALA=talazoparib.
5
1
1
1
0
0
Agarwal N, et al. Presented at: ASCO-GU 2025. Abstract LBA18.
22 |
17. TALAPRO-2: Рандомизированное двойное слепое плацебо-контролируемое исследование
Слайд содержит информацию для:Все пациенты (Когорта 1)
Probability of Cytotoxic Chemotherapy
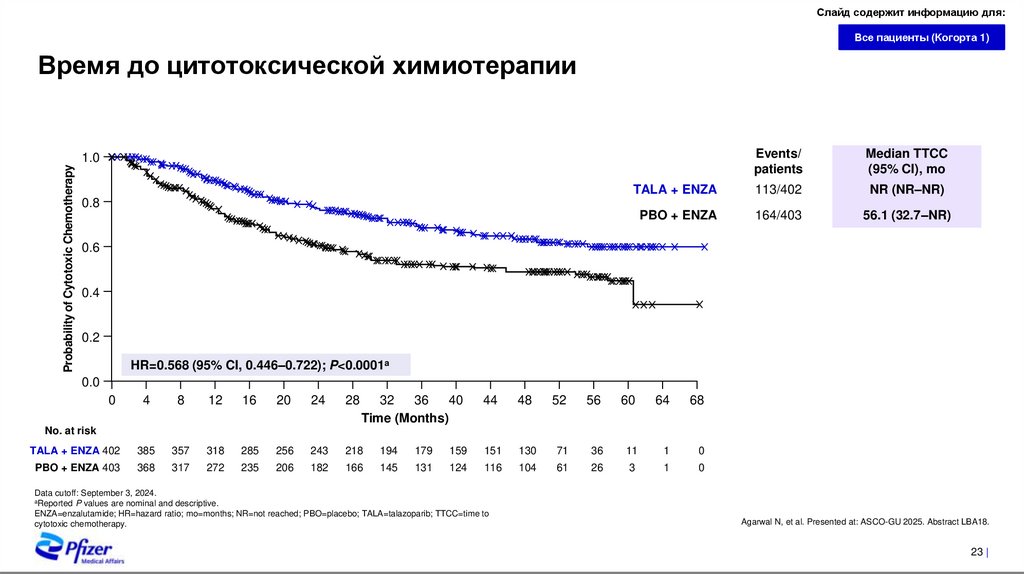
Время до цитотоксической химиотерапии
Events/
patients
Median TTCC
(95% CI), mo
TALA + ENZA
113/402
NR (NR–NR)
PBO + ENZA
164/403
56.1 (32.7–NR)
1.0
0.8
0.6
0.4
0.2
HR=0.568 (95% CI, 0.446–0.722); P<0.0001a
0.0
0
4
8
12
16
20
24
28
32
36
40
Time (Months)
TALA + ENZA 402
385
357
318
285
256
243
218
194
179
PBO + ENZA 403
368
317
272
235
206
182
166
145
131
44
48
52
56
60
64
68
159
151
130
71
36
11
1
0
124
116
104
61
26
3
1
0
No. at risk
Data cutoff: September 3, 2024.
aReported P values are nominal and descriptive.
ENZA=enzalutamide; HR=hazard ratio; mo=months; NR=not reached; PBO=placebo; TALA=talazoparib; TTCC=time to
cytotoxic chemotherapy.
Agarwal N, et al. Presented at: ASCO-GU 2025. Abstract LBA18.
23 |
18. Источник опухолевой ДНК для оценки или исходный статус альтераций HRR
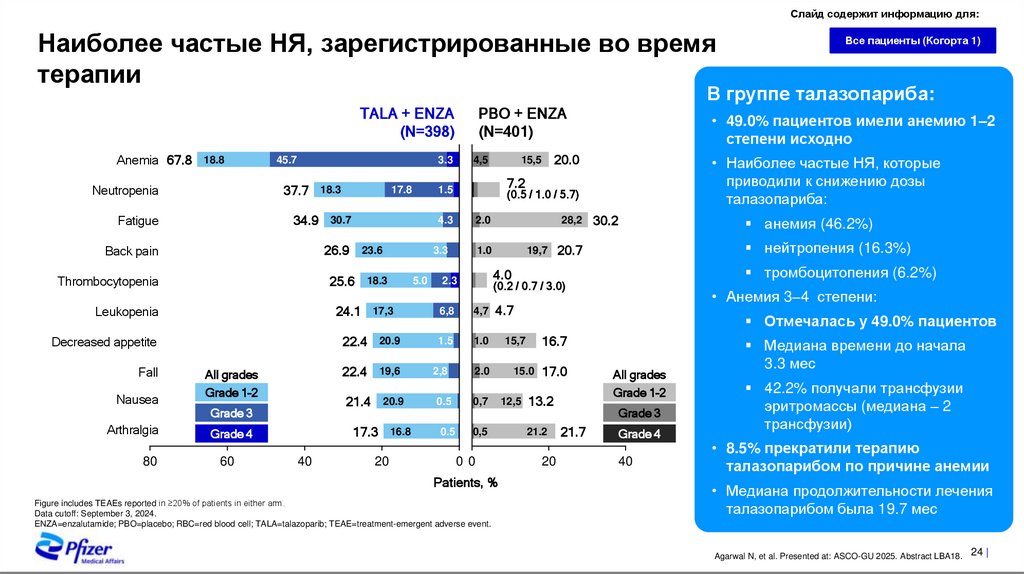
Слайд содержит информацию для:Наиболее частые НЯ, зарегистрированные во время
терапии
Все пациенты (Когорта 1)
В группе талазопариба:
TALA + ENZA
(N=398)
Anemia 67.8 18.8
Neutropenia
45.7
3.3
37.7 18.3
17.8
Back pain
26.9 23.6
Thrombocytopenia
25.6 18.3
Decreased appetite
Fall
Nausea
Arthralgia
80
All grades
Grade 1–2
Grade 3
Grade 4
60
40
(0.5 / 1.0 / 5.7)
4.3
2.0
3.3
1.0
28,2
19,7
17,3
6,8
4,7 4.7
22.4 20.9
1.5
1.0
22.4 19,6
2,8
2.0
15.0
21.4 20.9
0.5
0,7
12,5 13.2
17.3 16.8
0.5
0,5
21.2
20
• Наиболее частые НЯ, которые
приводили к снижению дозы
талазопариба:
7.2
4.0
5.0
• 49.0% пациентов имели анемию 1–2
степени исходно
20.0
15,5
2.3
24.1
Leukopenia
4,5
1.5
34.9 30.7
Fatigue
PBO + ENZA
(N=401)
30.2
анемия (46.2%)
нейтропения (16.3%)
20.7
тромбоцитопения (6.2%)
(0.2 / 0.7 / 3.0)
0 0
Patients, %
Figure includes TEAEs reported in ≥20% of patients in either arm.
Data cutoff: September 3, 2024.
ENZA=enzalutamide; PBO=placebo; RBC=red blood cell; TALA=talazoparib; TEAE=treatment-emergent adverse event.
• Анемия 3–4 степени:
Отмечалась у 49.0% пациентов
16.7
15,7
17.0
20
All grades
Grade 1–2
Grade 3
21.7
Grade 4
40
Медиана времени до начала
3.3 мес
42.2% получали трансфузии
эритромассы (медиана – 2
трансфузии)
• 8.5% прекратили терапию
талазопарибом по причине анемии
• Медиана продолжительности лечения
талазопарибом была 19.7 мес
Agarwal N, et al. Presented at: ASCO-GU 2025. Abstract LBA18.
24 |
19. Первичная конечная точка: рВБП по независимой оценке Статистически значимый и клинически значимый эффект сохранялся в течение
Слайд содержит данные для:Дефицит HRR (когорта 2)
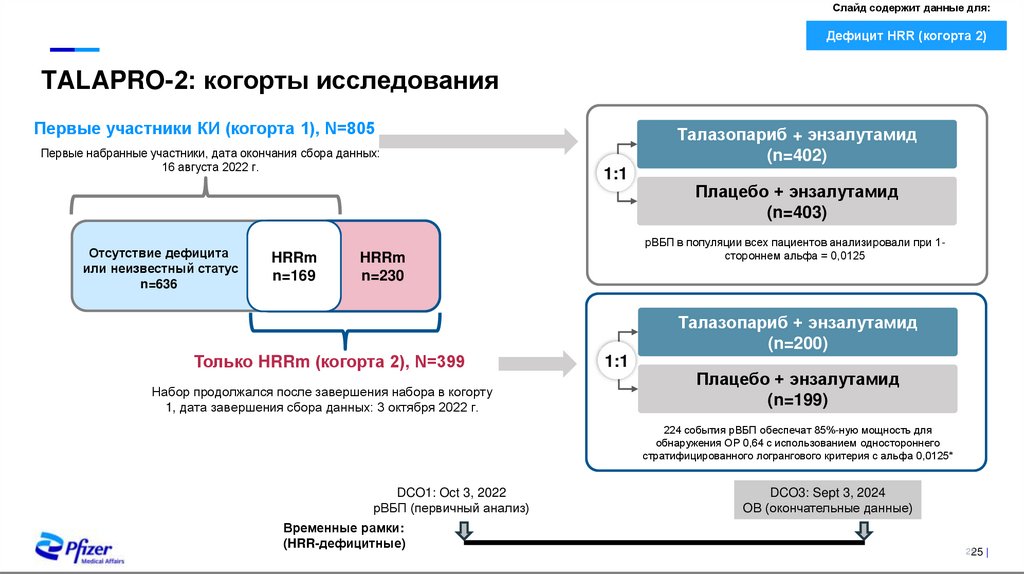
TALAPRO-2: когорты исследования
Первые участники КИ (когорта 1), N=805
Первые набранные участники, дата окончания сбора данных:
16 августа 2022 г.
Отсутствие дефицита
или неизвестный статус
n=636
HRRm
n=169
Талазопариб + энзалутамид
(n=402)
1:1
рВБП в популяции всех пациентов анализировали при 1стороннем альфа = 0,0125
HRRm
n=230
Только HRRm (когорта 2), N=399
Набор продолжался после завершения набора в когорту
1, дата завершения сбора данных: 3 октября 2022 г.
Плацебо + энзалутамид
(n=403)
Талазопариб + энзалутамид
(n=200)
1:1
Плацебо + энзалутамид
(n=199)
224 события рВБП обеспечат 85%-ную мощность для
обнаружения ОР 0,64 с использованием одностороннего
стратифицированного логрангового критерия с альфа 0,0125*
DCO1: Oct 3, 2022
рВБП (первичный анализ)
Временные рамки:
(HRR-дефицитные)
DCO3: Sept 3, 2024
OВ (окончательные данные)
25
25 |
20. Общая выживаемость (окончательный анализ) 20.4% снижение риска смерти, >8 месяцев улучшение медианы ОВ
Table ofContents
Когорта 2
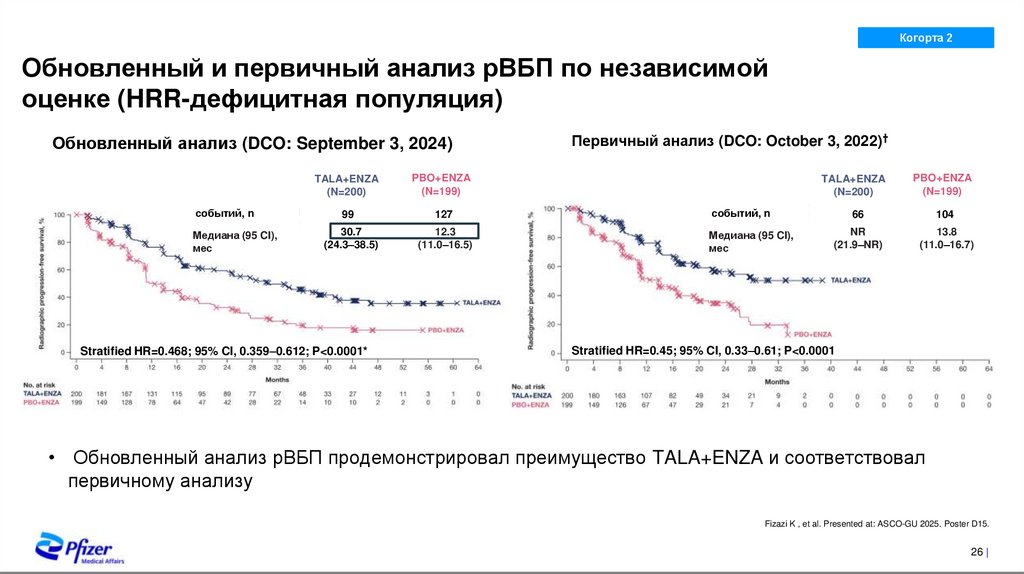
Обновленный и первичный анализ рВБП по независимой
оценке (HRR-дефицитная популяция)
Обновленный анализ (DCO: September 3, 2024)
событий, n
Медиана (95 CI),
мес
TALA+ENZA
(N=200)
PBO+ENZA
(N=199)
99
127
30.7
(24.3–38.5)
12.3
(11.0–16.5)
Stratified HR=0.468; 95% CI, 0.359–0.612; P<0.0001*
Первичный анализ (DCO: October 3, 2022)†
TALA+ENZA
(N=200)
PBO+ENZA
(N=199)
66
104
NR
(21.9–NR)
13.8
(11.0–16.7)
событий, n
Медиана (95 CI),
мес
Stratified HR=0.45; 95% CI, 0.33–0.61; P<0.0001
• Обновленный анализ рВБП продемонстрировал преимущество TALA+ENZA и соответствовал
первичному анализу
Fizazi K , et al. Presented at: ASCO-GU 2025. Poster D15.
26 |
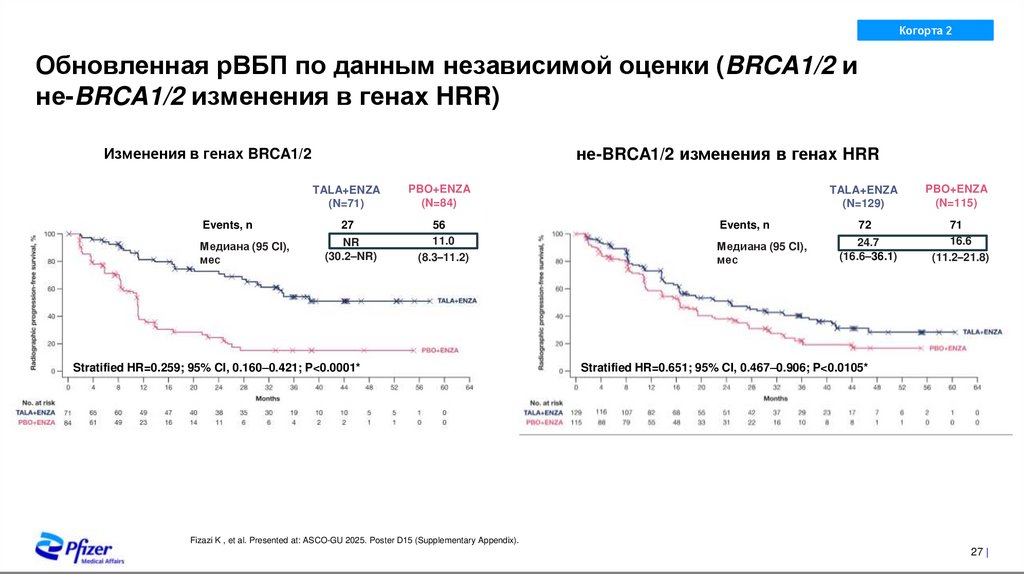
21. Подгрупповой анализ общей выживаемости
Table ofContents
Когорта 2
Обновленная рВБП по данным независимой оценки (BRCA1/2 и
не-BRCA1/2 изменения в генах HRR)
не-BRCA1/2 изменения в генах HRR
Изменения в генах BRCA1/2
Events, n
Медиана (95 CI),
мес
TALA+ENZA
(N=71)
PBO+ENZA
(N=84)
27
56
11.0
(8.3–11.2)
NR
(30.2–NR)
Stratified HR=0.259; 95% CI, 0.160–0.421; P<0.0001*
Events, n
Медиана (95 CI),
мес
TALA+ENZA
(N=129)
PBO+ENZA
(N=115)
72
71
16.6
(11.2–21.8)
24.7
(16.6–36.1)
Stratified HR=0.651; 95% CI, 0.467–0.906; P<0.0105*
Fizazi K , et al. Presented at: ASCO-GU 2025. Poster D15 (Supplementary Appendix).
27 |
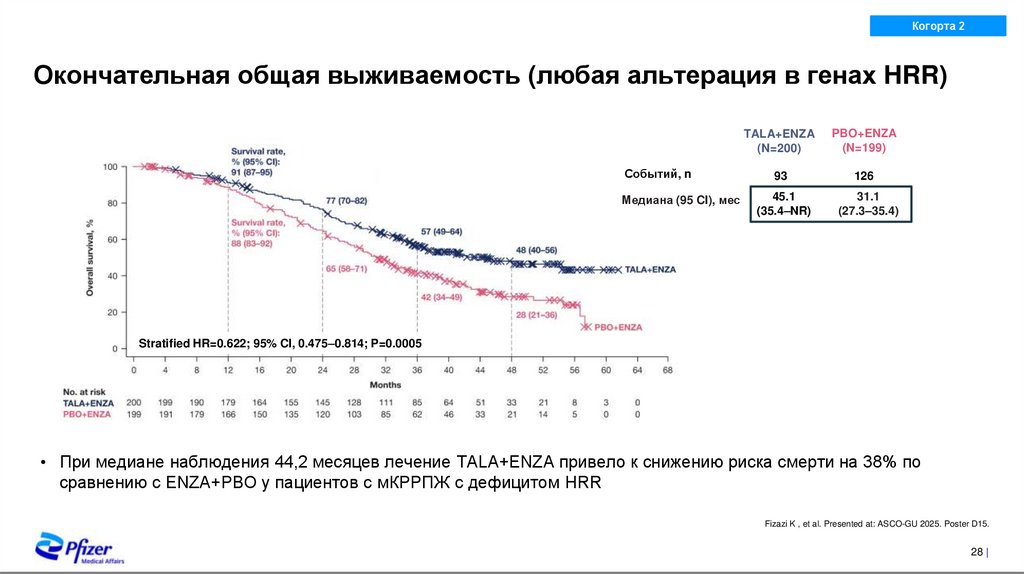
22. Общая выживаемость в подгруппе с невыявленными альтерациями в генах HRR по данным обоих тестов (в ткани опухоли и в крови
Table ofContents
Когорта 2
Окончательная общая выживаемость (любая альтерация в генах HRR)
Событий, n
Медиана (95 CI), мес
TALA+ENZA
(N=200)
PBO+ENZA
(N=199)
93
126
45.1
(35.4–NR)
31.1
(27.3–35.4)
Stratified HR=0.622; 95% CI, 0.475–0.814; P=0.0005
• При медиане наблюдения 44,2 месяцев лечение TALA+ENZA привело к снижению риска смерти на 38% по
сравнению с ENZA+PBO у пациентов с мКРРПЖ с дефицитом HRR
Fizazi K , et al. Presented at: ASCO-GU 2025. Poster D15.
28 |
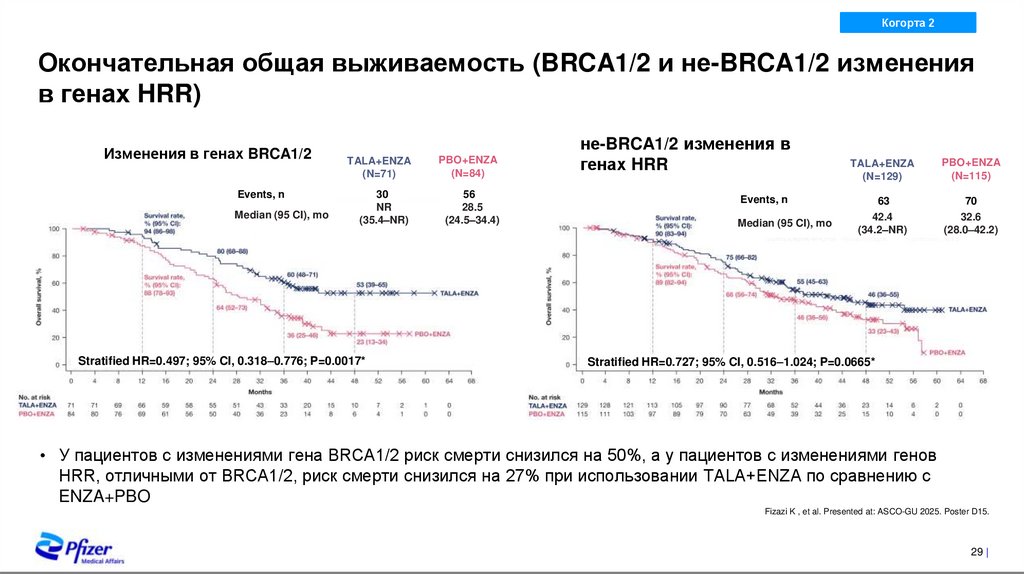
23. Время до цитотоксической химиотерапии
Table ofContents
Когорта 2
Окончательная общая выживаемость (BRCA1/2 и не-BRCA1/2 изменения
в генах HRR)
Изменения в генах BRCA1/2
Events, n
Median (95 CI), mo
TALA+ENZA
(N=71)
PBO+ENZA
(N=84)
30
NR
(35.4–NR)
56
28.5
(24.5–34.4)
Stratified HR=0.497; 95% CI, 0.318–0.776; P=0.0017*
не-BRCA1/2 изменения в
генах HRR
TALA+ENZA
(N=129)
Events, n
Median (95 CI), mo
PBO+ENZA
(N=115)
63
70
42.4
(34.2–NR)
32.6
(28.0–42.2)
Stratified HR=0.727; 95% CI, 0.516–1.024; P=0.0665*
• У пациентов с изменениями гена BRCA1/2 риск смерти снизился на 50%, а у пациентов с изменениями генов
HRR, отличными от BRCA1/2, риск смерти снизился на 27% при использовании TALA+ENZA по сравнению с
ENZA+PBO
Fizazi K , et al. Presented at: ASCO-GU 2025. Poster D15.
29 |
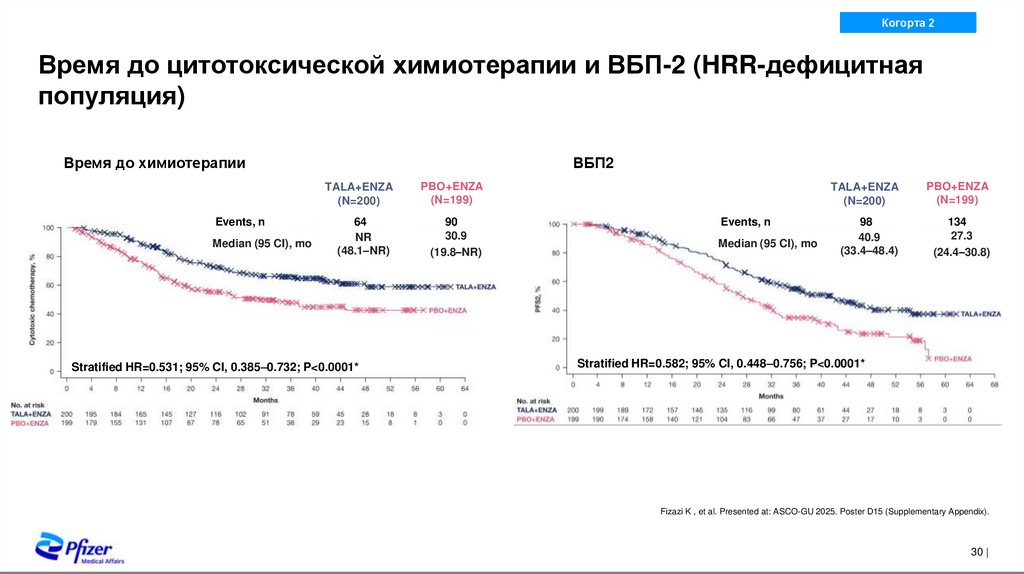
24. Наиболее частые НЯ, зарегистрированные во время терапии
Table ofContents
Когорта 2
Время до цитотоксической химиотерапии и ВБП-2 (HRR-дефицитная
популяция)
Время до химиотерапии
Events, n
Median (95 CI), mo
ВБП2
TALA+ENZA
(N=200)
PBO+ENZA
(N=199)
64
NR
(48.1–NR)
90
30.9
(19.8–NR)
Stratified HR=0.531; 95% CI, 0.385–0.732; P<0.0001*
Events, n
Median (95 CI), mo
TALA+ENZA
(N=200)
PBO+ENZA
(N=199)
98
40.9
(33.4–48.4)
134
27.3
(24.4–30.8)
Stratified HR=0.582; 95% CI, 0.448–0.756; P<0.0001*
Fizazi K , et al. Presented at: ASCO-GU 2025. Poster D15 (Supplementary Appendix).
30 |
25. TALAPRO-2: когорты исследования
Table ofContents
Когорта 2
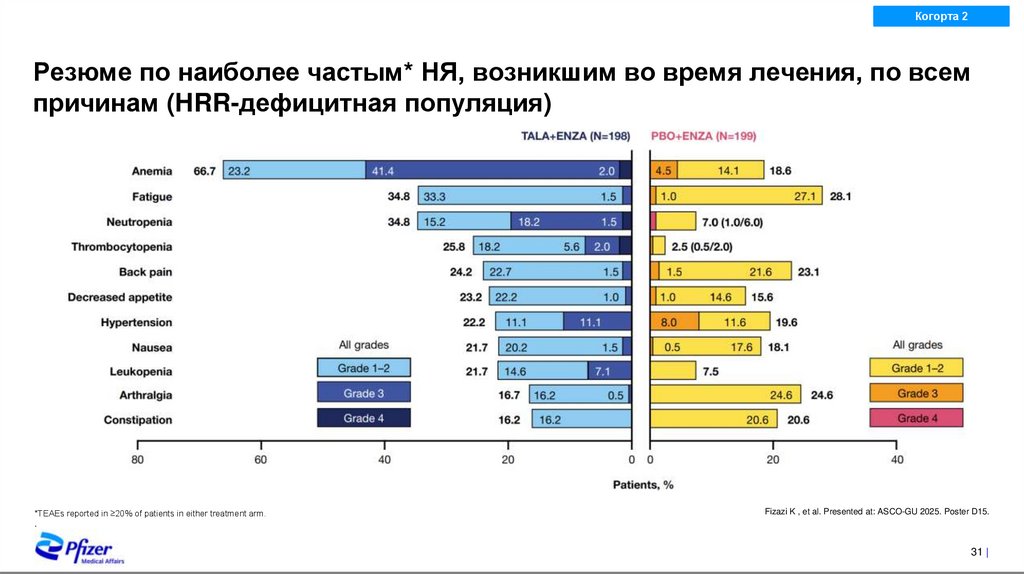
Резюме по наиболее частым* НЯ, возникшим во время лечения, по всем
причинам (HRR-дефицитная популяция)
*TEAEs reported in ≥20% of patients in either treatment arm.
.
Fizazi K , et al. Presented at: ASCO-GU 2025. Poster D15.
31 |
26. Обновленный и первичный анализ рВБП по независимой оценке (HRR-дефицитная популяция)
Table ofContents
Когорта 2
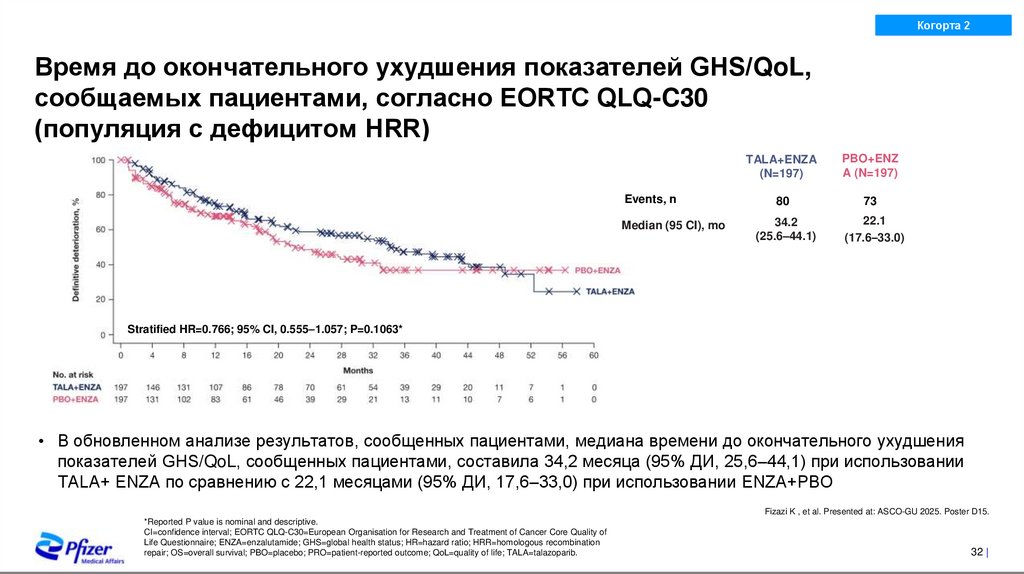
Время до окончательного ухудшения показателей GHS/QoL,
сообщаемых пациентами, согласно EORTC QLQ-C30
(популяция с дефицитом HRR)
Events, n
Median (95 CI), mo
TALA+ENZA
(N=197)
PBO+ENZ
A (N=197)
80
73
34.2
(25.6–44.1)
22.1
(17.6–33.0)
Stratified HR=0.766; 95% CI, 0.555–1.057; P=0.1063*
• В обновленном анализе результатов, сообщенных пациентами, медиана времени до окончательного ухудшения
показателей GHS/QoL, сообщенных пациентами, составила 34,2 месяца (95% ДИ, 25,6–44,1) при использовании
TALA+ ENZA по сравнению с 22,1 месяцами (95% ДИ, 17,6–33,0) при использовании ENZA+PBO
Fizazi K , et al. Presented at: ASCO-GU 2025. Poster D15.
*Reported P value is nominal and descriptive.
CI=confidence interval; EORTC QLQ-C30=European Organisation for Research and Treatment of Cancer Core Quality of
Life Questionnaire; ENZA=enzalutamide; GHS=global health status; HR=hazard ratio; HRR=homologous recombination
repair; OS=overall survival; PBO=placebo; PRO=patient-reported outcome; QoL=quality of life; TALA=talazoparib.
32 |
27. Обновленная рВБП по данным независимой оценки (BRCA1/2 и не-BRCA1/2 изменения в генах HRR)
Table ofContents
Слайд содержит информацию для:
Все пациенты (Когорта 1)
Выводы
• TALAPRO-2 — это первое исследование комбинации PARPi и НГП, которое показало
существенное клинически и статистически значимое улучшение ОВ по сравнению со
стандартным лечением (энзалутамид) при мКРРПЖ у пациентов с и без HRR-мутаций
• Медиана ОВ в группе в группе талазопариб+энзалутамид составила 45,8 месяцев — на
8,8 месяцев дольше, чем в группе активного контроля
• Медиана OВ с TALA + ENZA была схожей в ITT популяции, а также в подгруппах с
дефицитом HRR и без дефицита HRR (в диапазоне от 46 до 47 месяцев)
• Эти результаты убедительно подтверждают, что TALA+ ENZA является стандартом
лечения мКРРПЖ вне зависимости от HRR-мутаций
33 |
28. Окончательная общая выживаемость (любая альтерация в генах HRR)
Table ofContents
Спасибо за внимание!
Пройдите, пожалуйста короткий опрос!
34 |






 Медицина
Медицина








