Похожие презентации:
prezentacija_pervyj_zakon_termodinamiki_i_ego_prme
1.
«Первый закон термодинамикии его применение к
изопроцессам. Адиабатный
процесс.»
/Урок физики в 10 классе/
Забродина Любовь Михайловна,
учитель физики МОУ СОШ №10 г.
Сердобска высшей квалификационной категории.
2. Эпиграф урока:
«За основу тут мы берём положениетакое:
Из ничего не творится ничего»
Лукреций Кар, «О природе вещей»
3. Цель урока
• Формирование научного мировоззрения ипознавательного интереса школьников в
процессе «открытия» нового знания по
теме урока.
4. Задачи урока
Обучающие:• 1.Обобщить и систематизировать знания учащихся о первом законе термодинамики
(формулировка, математическая запись, физический смысл).
• 2.Исследовать особенности использования первого закона термодинамики для
описания газовых процессов.
• 3. Обобщить и систематизировать знания учащихся об адиабатном процессе.
Рассмотреть примеры адиабатного процесса в технике и природе.
• 4. Ввести понятие «вечный двигатель первого рода» и доказать невозможность его
создания.
• 5. Сформировать умения применять знания на практике, в том числе при решении
задач.
5.
Развивающие:Развивать умения учащихся видеть целостность
окружаюшего мира, анализировать применение первого
закона термодинамики для изопроцессов и адиабатного
процесса; умения объяснять проявление и применение
адиабатного процесса в природе и технике.
Воспитывающие:
Продолжить формирование научного мировоззрения,
культуры общения.
6. Планируемые результаты
Планируемые результаты:Планируемые результаты
Личностные:
осознавать свои возможности в учебной деятельности;
формирование устойчивой мотивации к приобретению новых знаний
и практических умений;
формирование навыков самоанализа и самоконтроля.
Метапредметные:
Регулятивные:
формирование умений выполнять задания в соответствии с поставленной целью;
умение формулировать и анализировать учебную проблему
адекватно воспринимать оценку своей работы учителем, товарищами.
7.
Познавательные:научиться: устанавливать причинно-следственные связи в изучаемом
круге явлений; искать и отбирать источники необходимой информации,
умение анализировать, сопоставлять, находить ответ на проблемный
вопрос, систематизировать информацию;
самостоятельно проводить делать вывод, анализировать полученные
результаты;
самостоятельно оценивать собственный результат.
Коммуникативные:
уметь: организовать продуктивное взаимодействие со сверстниками,
сравнивать разные точки зрения,
сформулировать собственное мнение,
осуществлять взаимный контроль и взаимопомощь.
8.
Предметные:Научиться:
обобщить и систематизировать знания о первом законе
термодинамики
(формулировка, математическая запись, физический смысл),
применять первый закон термодинамики для описания
газовых процессов,
понимать физический смысл адиабатного процесса,
распознавать адиабатный процесс в технике и природе,
доказывать невозможность создания вечного двигателя,
применять знания на практике, в том числе при решении
задач,
научиться представлять результаты в виде графиков, таблиц,
схем.
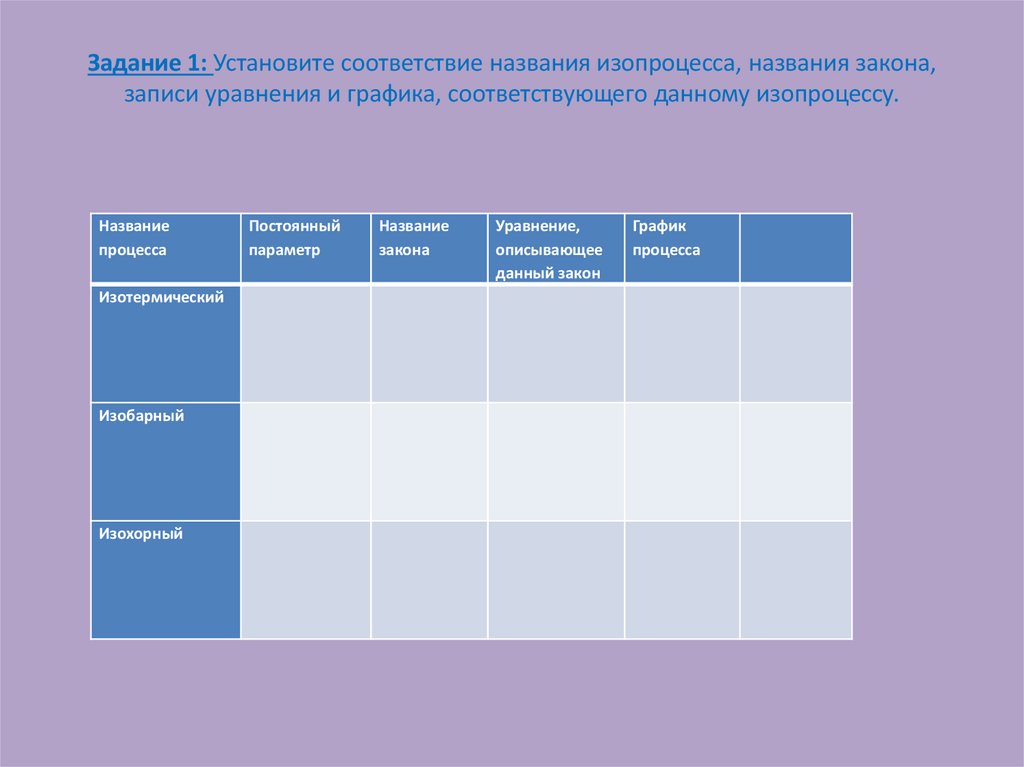
9. Задание 1: Установите соответствие названия изопроцесса, названия закона, записи уравнения и графика, соответствующего данному
изопроцессу.Название
процесса
Изотермический
Изобарный
Изохорный
Постоянный
параметр
Название
закона
Уравнение,
описывающее
данный закон
График
процесса
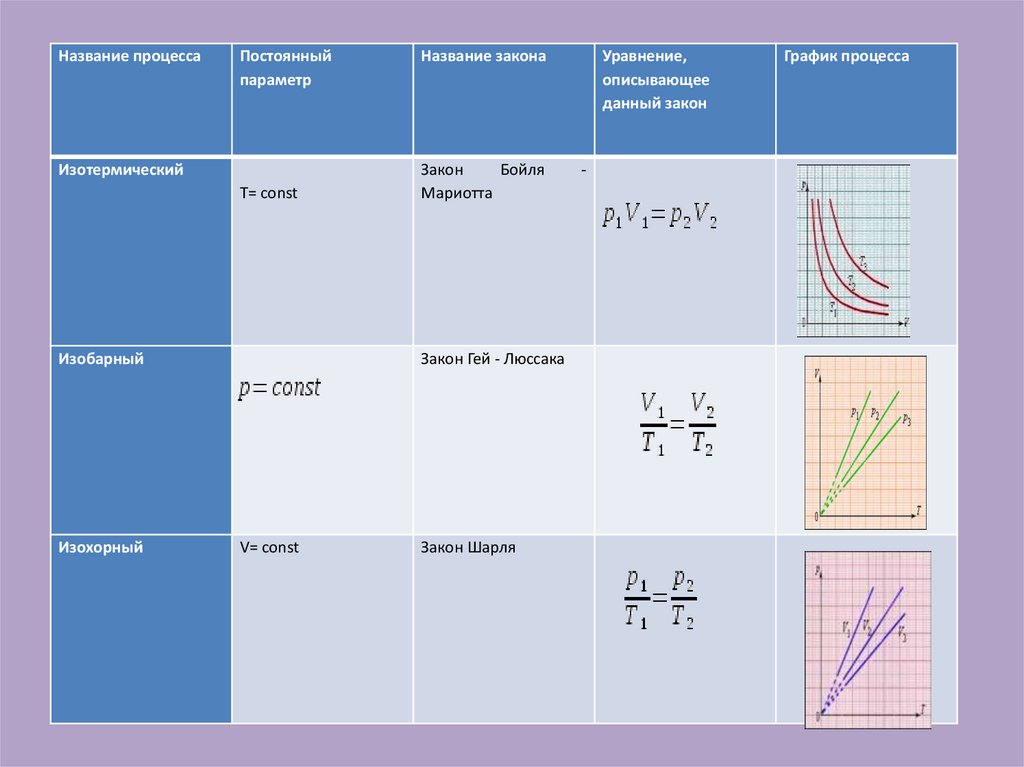
10.
Название процессаПостоянный
параметр
Изотермический
T= const
Изобарный
Изохорный
Название закона
Закон
Бойля
Мариотта
Закон Гей - Люссака
V= const
Закон Шарля
Уравнение,
описывающее
данный закон
-
График процесса
11. Задание 2: Вспомнить материал о внутренней энергии, способах изменения внутренней энергии и формулы расчета количества
теплоты. Систематизировать материал в тетрадях ввиде схемы, ответив на вопросы:
12.
13.
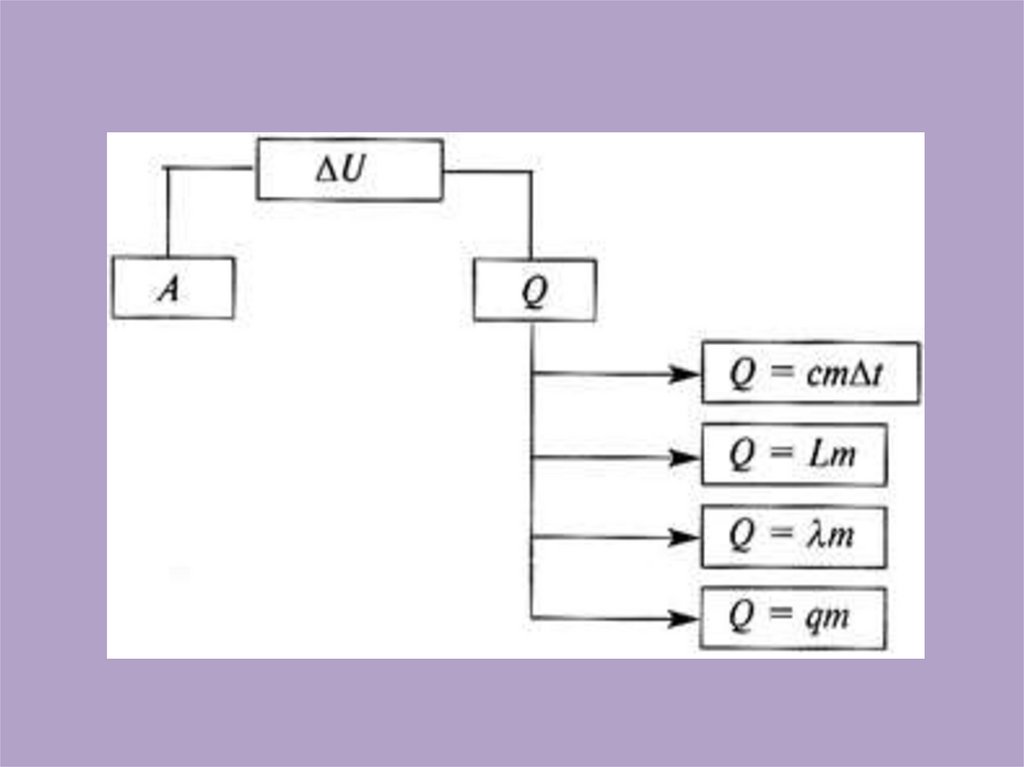
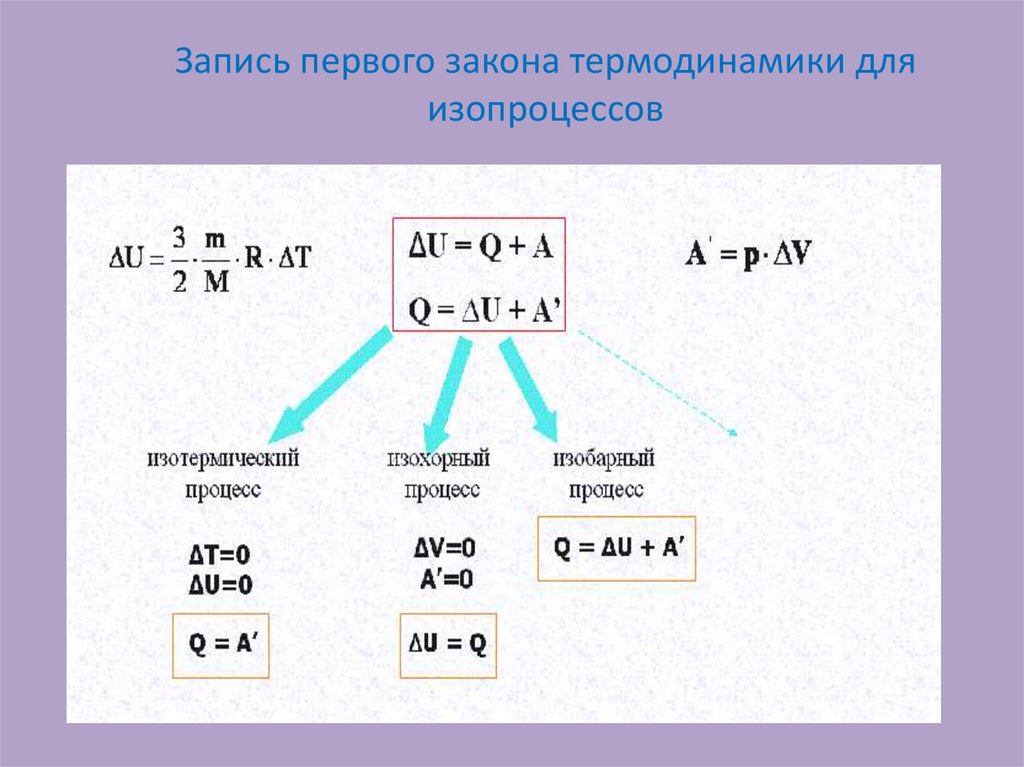
14. Формулировка и математическая запись закона:
• Изменение внутреннейэнергии
термодинамической
системы при переходе из
одного состояния в
другое равно сумме
работы внешних сил и
количества теплоты,
переданного системе
• ΔU = Q + A'
• В термодинамической
системе количество
теплоты, сообщенное
системе, идет на
изменение внутренней
энергии и на работу
системы над внешними
телами.
• Q=A + ∆ U
15.
Вопросы тестирования1. Как называется процесс изменения состояния газа при постоянной температуре?
А) изотермический;
Б) Изохорный;
В) Изобарный;
2. Какому процессу соответствует график, изображенный на рисунке?
А) Изобарному;
Б) Изохорному;
В) Изотермическому.
16.
17.
5. Какую работу совершил газ при давлении 300 Па, если первоначальныйобъем был 1 м3, а конечный 3 м3?
А) 0
Б) 300 Дж
В) 600 Дж
Г) 900 Дж
Д) 500 Дж
18. Запись первого закона термодинамики для изопроцессов
19. Адиабатный процесс
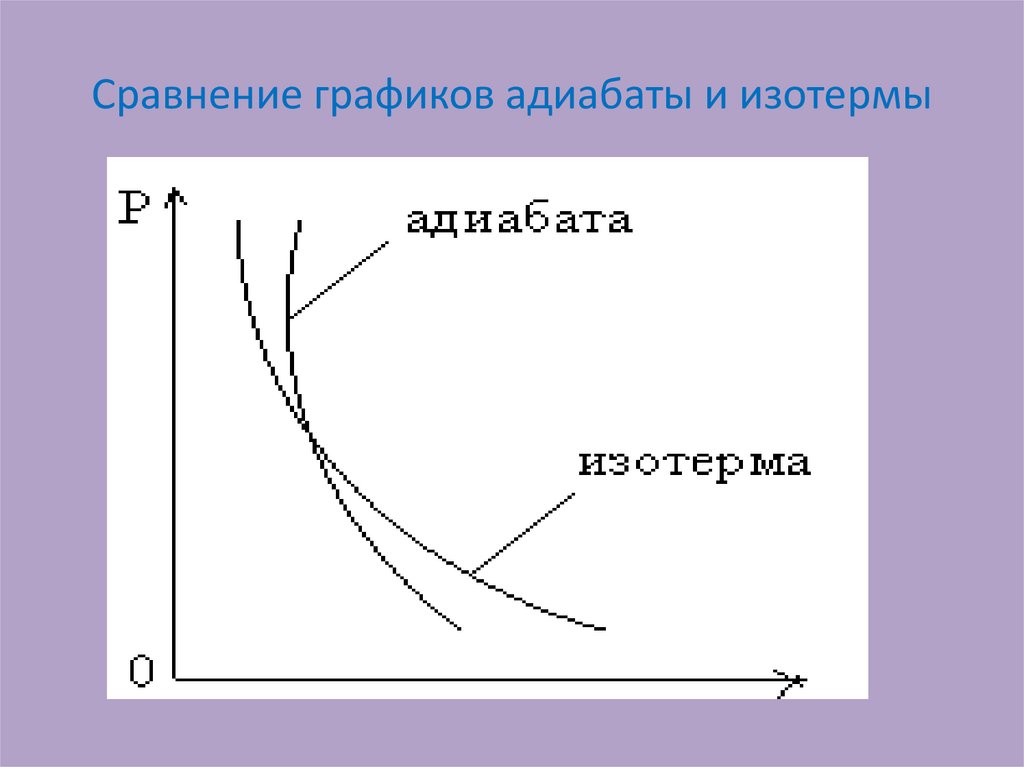
20. Сравнение графиков адиабаты и изотермы
21.
• График адиабаты идет круче графика изотермы.• С помощью формулы p = nkT (n - числа молекул в единице
объема - концентрации частиц) нетрудно объяснить, почему
адиабата идет круче изотермы.
• При изотермическом сжатии газа давление p растет вследствие
увеличения n, а при адиабатном сжатии увеличивается и n, и T,
поэтому давление растет быстрее.
• Работа, которую совершает газ при адиабатическом
расширении, на участке 1—2 меньше, чем при
изотермическом. При адиабатическом расширении
осуществляется охлаждение газа, тогда как при
изотермическом — температура поддерживается постоянной
за счет притока извне такого же количества теплоты.
22. Применение и проявление адиабатного процесса
• процесс происходит вдвигателях
внутреннего сгорания
• Серебристые облака
23. Применение первого закона термодинамики к газовым процессам.
24. Решение задач
Деятельность педагогаДеятельность учащихся
Задачи для решения:
1. При изотермическом расширении идеальным газом совершена работа 15 Q=15 кДж
кДж. Какое количество теплоты сообщено газу?
2. В закрытом баллоне находится газ. При охлаждении его внутренняя энергия
уменьшилась на 500 Дж. Какое количество теплоты отдал газ? Совершил ли он Q=500 Дж, А=0
работу?
3. Быстрый подъем воздушных масс определенной влажности приводит к
образованию облака. Как при этом изменяется внутренняя энергия?
При адиабатном расширении газа его
внутренняя энергия уменьшается, газ
охлаждается
4. Вычислите изменение внутренней энергии кислорода массой 0,5 кг при
изохорном повышении его температуры на 15 0С.
56*103Дж.
5. Качественная задача.
Человека можно считать термодинамической системой. Тогда объясните, с точки зрения физики,
почему, когда много работаешь, то хочется много есть, а если ничего не делаешь, то и аппетита
нет.
Высказывают предположения.
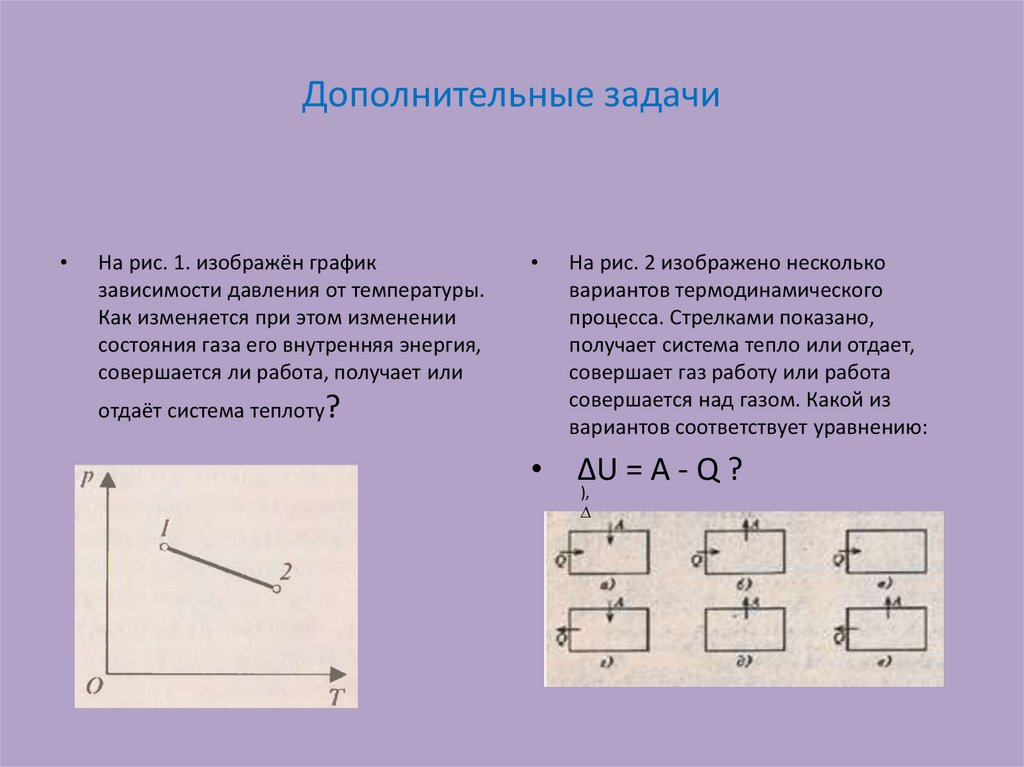
25. Дополнительные задачи
На рис. 1. изображён график
зависимости давления от температуры.
Как изменяется при этом изменении
состояния газа его внутренняя энергия,
совершается ли работа, получает или
На рис. 2 изображено несколько
вариантов термодинамического
процесса. Стрелками показано,
получает система тепло или отдает,
совершает газ работу или работа
совершается над газом. Какой из
вариантов соответствует уравнению:
∆U = А - Q ?
отдаёт система теплоту?
),
∆



















 Физика
Физика








