Похожие презентации:
Презентация - спирти
1.
Спирти – похідні вуглеводнів, молекули яких містять одну або кілька гідроксильних групОН, пов'язаних з насиченими атомами карбону в sp3-гібридизованому стані. Їх загальна
формула R-ОН, де R – алкіл Alk.
Кількість гідроксильних груп визначає атомність спиртів. Одноатомні спирти містять у
молекулі одну ОН-групу (CH3СН2ОН), двоатомні – дві ОН-групи (СН2ОН–СН2ОН),
триатомні – три ОН-групи (СН2ОН–СНОН–СН2ОН).
Залежно від того, з яким атомом карбону (первинним, вторинним чи третинним) зв’язана
гідроксильна група, розрізняють первинні R–CH2–OH, вторинні R2CH–OH і третинні
R3C–OH спирти:
За будовою вуглеводневих радикалів, пов'язаних з атомом оксигену, спирти поділяють на:
насичені – гідроксильні похідні алканів та циклоалканів: алканоли (СH3CH2-OH) і
циклоалканоли (циклогексанол С6Н11-ОН та ін.);
ненасичені – гідроксипохідні ненасичених вуглеводнів, в яких гідроксильна група не
знаходиться при кратному зв’язку: алкеноли (CH2=CH-CH2-OH), алкіноли (CH≡C-CH2-OH),
циклоалкеноли і т.п.;
ароматичні – гідроксильні похідні ароматичних вуглеводнів з групою -ОН у бічному
ланцюзі: арилалканоли (C6H5-CH2-OH).
2.
Спирти з двома ОН-групами при одному і тому ж атомі карбонуR-CH(OH)2 і R2C(OH)2 нестійкі. Подібно вугільній кислоті (O=C(OH)2 → CO2 +
H2O) вони легко відщеплюють воду і перетворюються, відповідно, в альдегіди
R-CH=O або кетони R2C=O.
Спирти з трьома ОН-групами при одному і тому ж атомі карбону
R-C(OH)3 не існують.
Ненасичені спирти з ОН-групою при sp2- або sp-атомі карбону (тобто
атомі, з'єднаному з іншим атомом подвійним або потрійним зв'язком) дуже
нестійкі. Наприклад, вініловий спирт CH2=CH-OH відразу ж ізомеризуєтся в
оцтовий альдегід CH3-CH=O.
3.
Одноатомними насиченими спиртами називають гідроксильні похідні насиченихвуглеводнів, що містять одну гідроксильну группу, зв’язану з атомом карбону в sp3гібридизації.
Одноатомні насичені спирти утворюють гомологічний ряд, загальна формула якого
СnН2n+1ОН.
Номенклатура
За замісниковою номенклатурою назву спирту утворюють з назви вуглеводню, що
відповідає головному вуглецевому ланцюгу, до якої додають суфікс -ол з указанням
положення гідроксильної групи в ланцюзі атомів Карбону. Нумерацію головного
вуглецевого ланцюга починають з того кінця, до якого ближче розташована гідроксильна
група:
За радикало-функціональною номенклатурою назви спиртів утворюють з відповідної
назви вуглеводневого радикала, зв’язаного з гідроксильною групою, до якого додають
овий і спирт:
4.
Назви одноатомних насичених спиртів5.
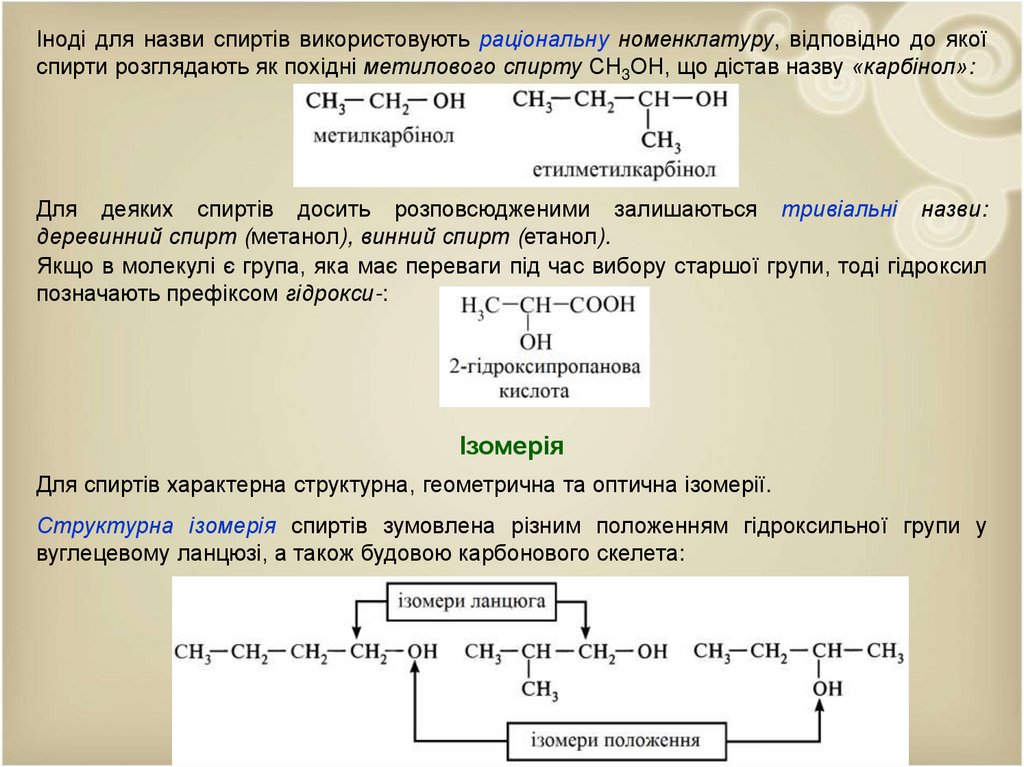
Іноді для назви спиртів використовують раціональну номенклатуру, відповідно до якоїспирти розглядають як похідні метилового спирту СН3ОН, що дістав назву «карбінол»:
Для деяких спиртів досить розповсюдженими залишаються тривіальні назви:
деревинний спирт (метанол), винний спирт (етанол).
Якщо в молекулі є група, яка має переваги під час вибору старшої групи, тоді гідроксил
позначають префіксом гідрокси-:
Ізомерія
Для спиртів характерна структурна, геометрична та оптична ізомерії.
Структурна ізомерія спиртів зумовлена різним положенням гідроксильної групи у
вуглецевому ланцюзі, а також будовою карбонового скелета:
6.
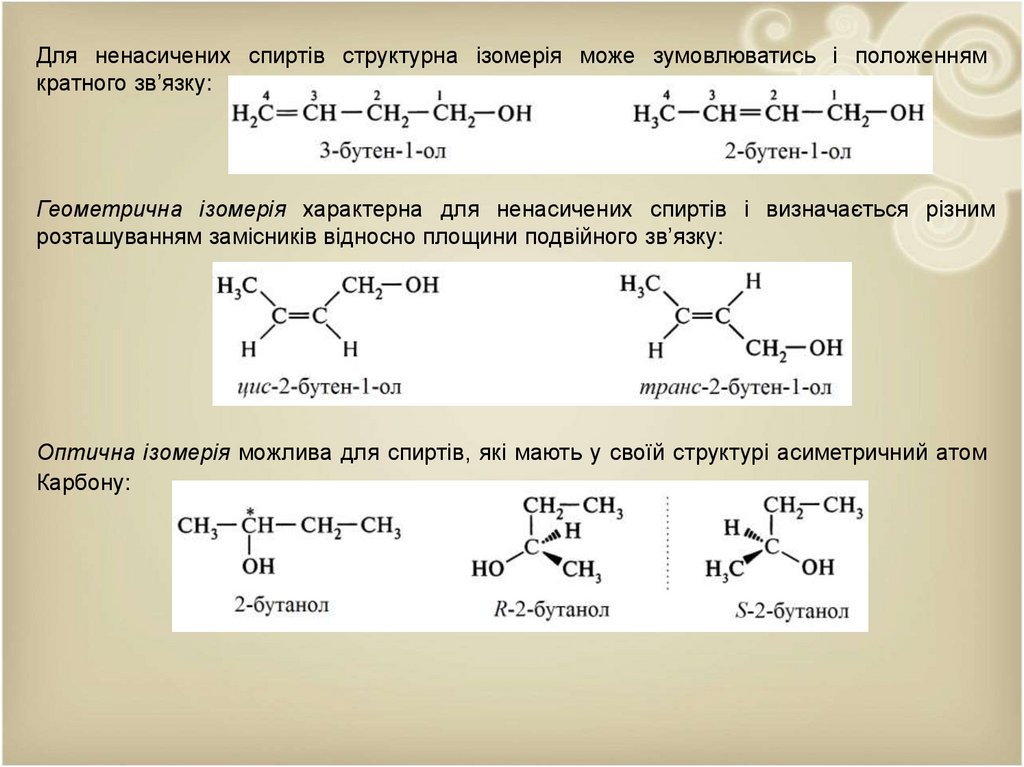
Для ненасичених спиртів структурна ізомерія може зумовлюватись і положеннямкратного зв’язку:
Геометрична ізомерія характерна для ненасичених спиртів і визначається різним
розташуванням замісників відносно площини подвійного зв’язку:
Оптична ізомерія можлива для спиртів, які мають у своїй структурі асиметричний атом
Карбону:
7.
Способи одержання1. Гідроліз галогенопохідних вуглеводнів
Галогенопохідні вуглеводнів, атом галогену яких зв’язаний з атомом Карбону в sp3гібридизації, у присутності водних розчинів лугів при нагріванні піддаються гідролізу з
утворенням спиртів:
Галогеналкани є електрофільними реагентами, їх електрофільні властивості зумовлені
полярністю зв’язку С–Hal. Оскільки атом галогену виявляє більшу електронегативність,
ніж атом Карбону, електронна густина зв’язку С–Hal зміщена до атома галогену. Тому
атом галогену набуває часткового негативного (δ–), а атом карбону – часткового
позитивного (δ+) заряду (Сδ+—Halδ–).
Електронодефіцитний атом Карбону стає електрофільним центром молекули
галогеналкану і може бути атакований нуклеофільним реагентом. У процесі атаки
нуклеофіл надає пару електронів для утворення хімічного зв’язку з електронодефіцитним
атомом Карбону, а атом галогену відщеплюється від молекули галогеналкану з
електронною парою зв’язку С–Hal:
Таку реакцію називають реакцією нуклеофільного заміщення і позначають символом
SN. Нуклеофільним реагентом у реакції гідролізу виступає молекула води, тому що
містить атом з неподіленими електронними парами:
8.
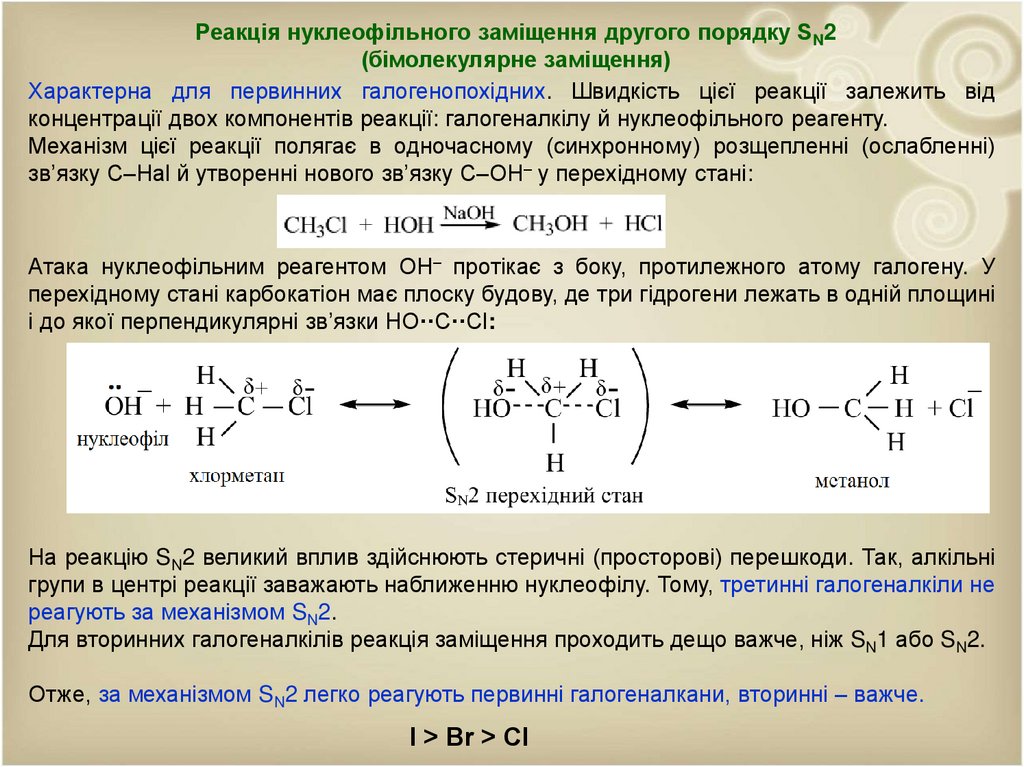
Реакція нуклеофільного заміщення другого порядку SN2(бімолекулярне заміщення)
Характерна для первинних галогенопохідних. Швидкість цієї реакції залежить від
концентрації двох компонентів реакції: галогеналкілу й нуклеофільного реагенту.
Механізм цієї реакції полягає в одночасному (синхронному) розщепленні (ослабленні)
зв’язку С–Наl й утворенні нового зв’язку С–ОН– у перехідному стані:
Атака нуклеофільним реагентом ОН– протікає з боку, протилежного атому галогену. У
перехідному стані карбокатіон має плоску будову, де три гідрогени лежать в одній площині
і до якої перпендикулярні зв’язки НО··С··Сl:
На реакцію SN2 великий вплив здійснюють стеричні (просторові) перешкоди. Так, алкільні
групи в центрі реакції заважають наближенню нуклеофілу. Тому, третинні галогеналкіли не
реагують за механізмом SN2.
Для вторинних галогеналкілів реакція заміщення проходить дещо важче, ніж SN1 або SN2.
Отже, за механізмом SN2 легко реагують первинні галогеналкани, вторинні – важче.
І > Br > Cl
9.
Реакція нуклеофільного заміщення першого порядку SN1(мономолекулярне заміщення).
Цей механізм називається мономолекулярним, оскільки на стадії, що визначає швидкість
усього процесу (стадія 1), бере участь молекула тільки одного реагенту (галогеналкану),
тобто, швидкість реакції пропорційна концентрації тільки одного з реагентів
(галогеналкану), а від концентрації нуклеофілу не залежить.
Механізм SN1 можливий у випадку сполук, які утворюють досить стійкі карбокатіони
(третинні карбокатіони), тому за механізмом SN1 реагують третинні галогеналкани.
На відміну від механізму SN2, де розрив зв’язку С–Hal та утворення зв’язку С–Nu
відбуваються синхронно, у механізмі SN1 розрив зв’язку С–Hal передує утворенню зв’язку
С–Nu, тобто реакція проходить у дві стадії:
Перша стадія – іонізація (дисоціація зв’язку С–Hal) під дією молекул розчинника протікає
з малою швидкістю і є лімітуючою стадією всього процесу:
10.
Друга стадія – взаємодія карбокатіону з нуклеофільним реагентом, проходить швидко:Під час іонізації галогеналкілу утворюється третинний карбокатіон плоскої будови, який
піддається атаці нуклеофільним реагентом (ОН− або Н2О) як спереду, так і ззаду.
2. Гідратація алкенів.
Приєднання води до алкенів приводить до утворення насичених спиртів. Відбувається в
присутності мінеральних кислот, найчастіше сульфатної:
Оскільки приєднання води до алкенів відбувається за правилом Марковникова, то в
умовах цієї реакції залежно від будови вуглеводню утворюються вторинні і третинні
спирти
11.
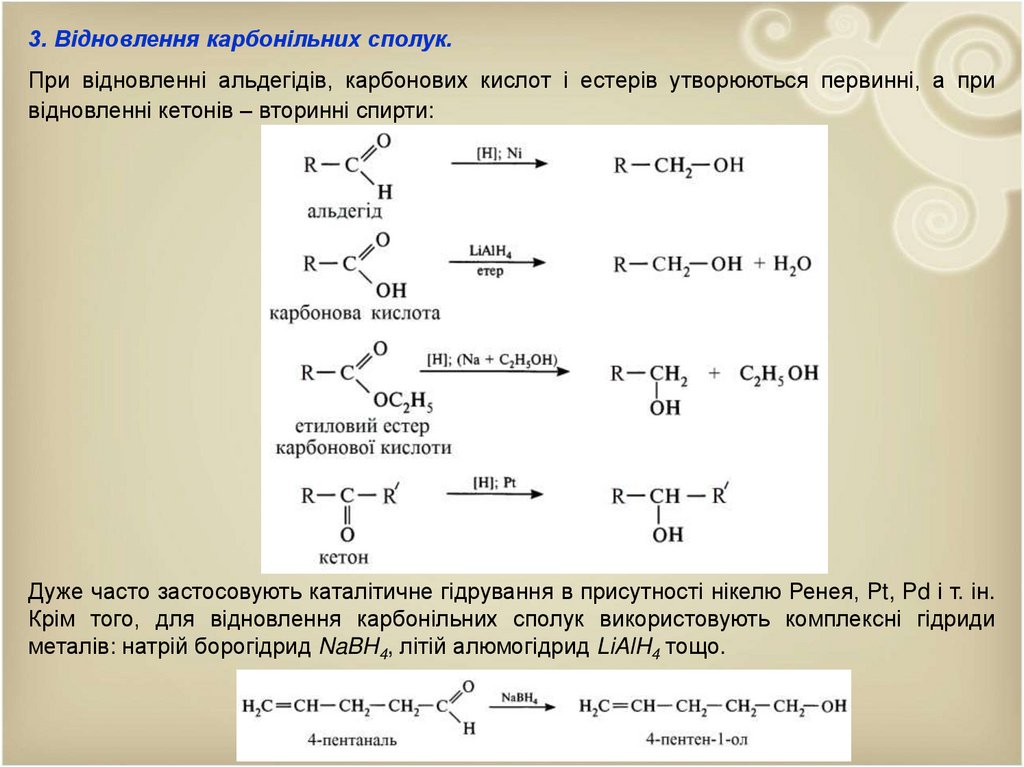
3. Відновлення карбонільних сполук.При відновленні альдегідів, карбонових кислот і естерів утворюються первинні, а при
відновленні кетонів – вторинні спирти:
Дуже часто застосовують каталітичне гідрування в присутності нікелю Ренея, Pt, Pd і т. ін.
Крім того, для відновлення карбонільних сполук використовують комплексні гідриди
металів: натрій борогідрид NaBH4, літій алюмогідрид LiAlH4 тощо.
12.
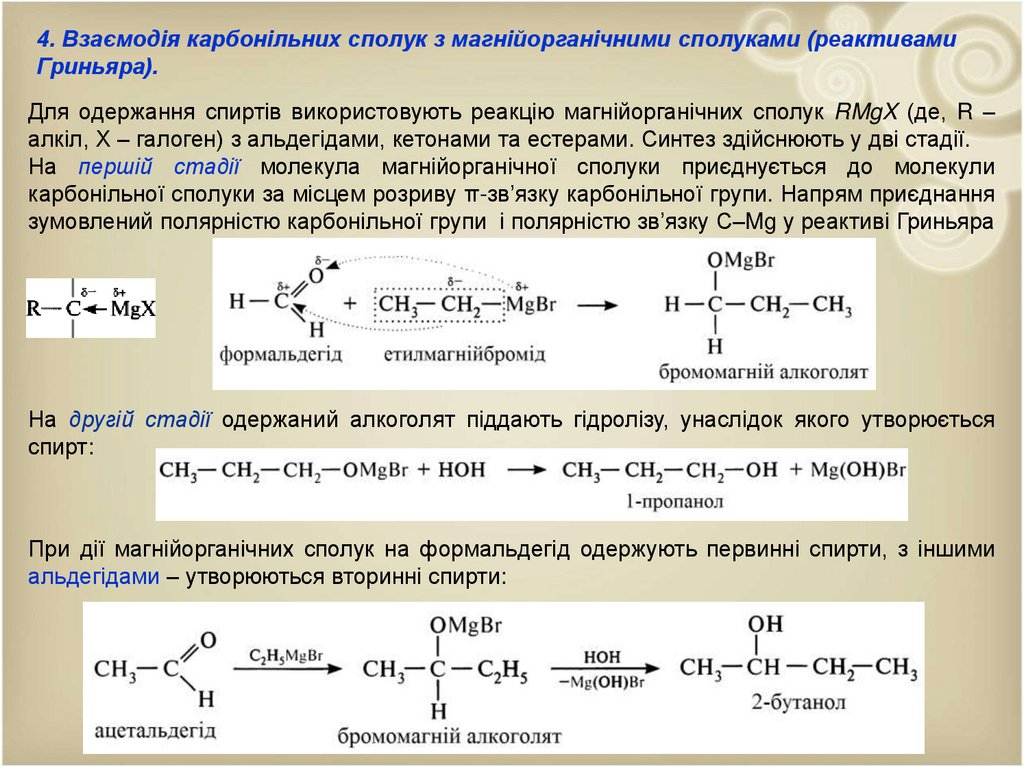
4. Взаємодія карбонільних сполук з магнійорганічними сполуками (реактивамиГриньяра).
Для одержання спиртів використовують реакцію магнійорганічних сполук RMgX (де, R –
алкіл, Х – галоген) з альдегідами, кетонами та естерами. Синтез здійснюють у дві стадії.
На першій стадії молекула магнійорганічної сполуки приєднується до молекули
карбонільної сполуки за місцем розриву π-зв’язку карбонільної групи. Напрям приєднання
зумовлений полярністю карбонільної групи і полярністю зв’язку С–Mg у реактиві Гриньяра
На другій стадії одержаний алкоголят піддають гідролізу, унаслідок якого утворюється
спирт:
При дії магнійорганічних сполук на формальдегід одержують первинні спирти, з іншими
альдегідами – утворюються вторинні спирти:
13.
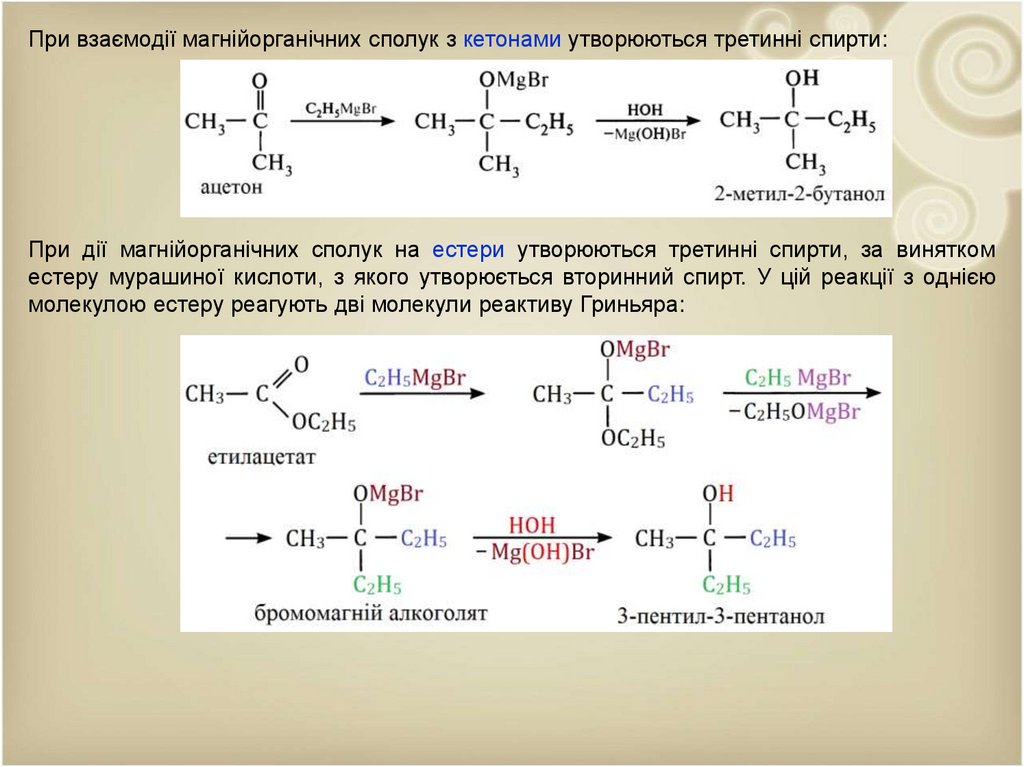
При взаємодії магнійорганічних сполук з кетонами утворюються третинні спирти:При дії магнійорганічних сполук на естери утворюються третинні спирти, за винятком
естеру мурашиної кислоти, з якого утворюється вторинний спирт. У цій реакції з однією
молекулою естеру реагують дві молекули реактиву Гриньяра:
14.
Фізичні властивості.Насичені одноатомні спирти – безбарвні рідини або кристалічні речовини зі специфічним
запахом. Нижчі члени гомологічного ряду мають характерний «спиртовий» запах;
бутанолам і пентанолам притаманний неприємний «сивушний» запах; вищі алканоли
мають приємний фруктовий запах. Циклоалканоли, ненасичені та ароматичні спирти
здебільшого рідкі або тверді речовини з приємним ароматним запахом. Так,
циклогексанол має запах камфори, пропаргіловий спирт НС≡С–СН2–ОН має запах герані,
а 2-фенілетанол С6Н5–СН2–СН2–ОН – запах троянд.
Спирти мають вищі температури плавлення і кипіння, більшу розчинність у воді, ніж
відповідні вуглеводні. Така різка відмінність між фізичними властивостями спиртів і
алканів зумовлена насамперед тим, що спирти є полярними сполуками. Вони мають два
полярні зв’язки С–О і О–Н. Існування на атомах гідроксильної групи часткових зарядів
протилежного знака приводить до міжмолекулярної взаємодії гідроксильних груп і
утворення водневих зв’язків:
Внаслідок такої взаємодії відбувається асоціація молекул спирту. Водневі зв’язки значно
слабші за ковалентні, проте їх утворення суттєво зменшує леткість, підвищує
температуру кипіння, тому що асоціати, які утворюються, мають більшу молекулярну
масу.
Залежно від будови, первинні спирти мають вищу температуру кипіння, ніж вторинні, які,
у свою чергу, характеризуються більшою температурою кипіння порівняно з третинними.
15.
Спирти з невеликою молекулярною масою добре розчинні у воді. Метанол, етанол,пропанол, аліловий і пропаргіловий спирти змішуються з водою в усіх співвідношеннях. У
водних розчинах спиртів утворюються водневі зв’язки між молекулами води і спирту:
У цілому здатність спиртів розчинятися у воді зменшується зі збільшенням
гідрокарбонового радикалу та при переході від багатоатомних спиртів до одноатомних.
Водневі зв’язки, які утворюються між молекулами води і спирту, міцніші, ніж зв’язки між
молекулами спирту, що приводить до зменшення сумарного об’єму води і спирту при
змішуванні (явище контракції спирту).
16.
Хімічні властивості.Хімічні властивості спиртів визначаються наявністю полярних зв’язків О–Н та С–О, а
також неподілених електронних пар атома оксигену, причому полярність О–Н-зв’язку
значно вища, ніж полярність зв'язку С–О.
Реакції, характерні для спиртів можна поділити на дві групи, залежно від того, який
зв’язок О–Н чи С–О розривається в процесі реакції.
Перша група – реакції, що відбуваються з розривом О–Н-зв’язку і до яких відносяться
кислотно-основні, естерифікації, окиснення і дегідрування.
Друга група – реакції, що відбуваються з розривом С–О-зв’язку і до яких відноситься
нуклеофільне заміщення ОН-групи, утворення етерів, дегідратація, перегрупування.
Присутність у молекулі спирту кратних зв’язків або ароматичного радикала не змінює
принципово хімічні властивості гідроксильної групи, а надає спиртам властивостей,
характерних для ненасичених або ароматичних сполук.
17.
1. Реакції розщеплення О–Н-зв’язку.1. Кислотно-основні реакції.
Кислотні властивості спиртів зумовлені рухливістю атома гідрогену гідроксильної
групи.
Атом оксигену як більш електронегативний елемент зміщує електронну густину зв’язку
→Oδ+←Hδ– на себе, утворюючи при цьому на атомі гідрогену частковий позитивний заряд.
Під дією сильних основ спирти відщеплюють від гідроксильної групи протон, тобто
виявляють властивості ОН-кислот.
Додаткове збільшення електронної густини на атомі оксигену за рахунок +І-ефекту
вуглеводневого радикала приводить до зменшення полярності зв’язку О–Н і відповідно
рухливості атома гідрогену. Тому при переході від первинних спиртів до третинних
кислотні властивості знижуються:
18.
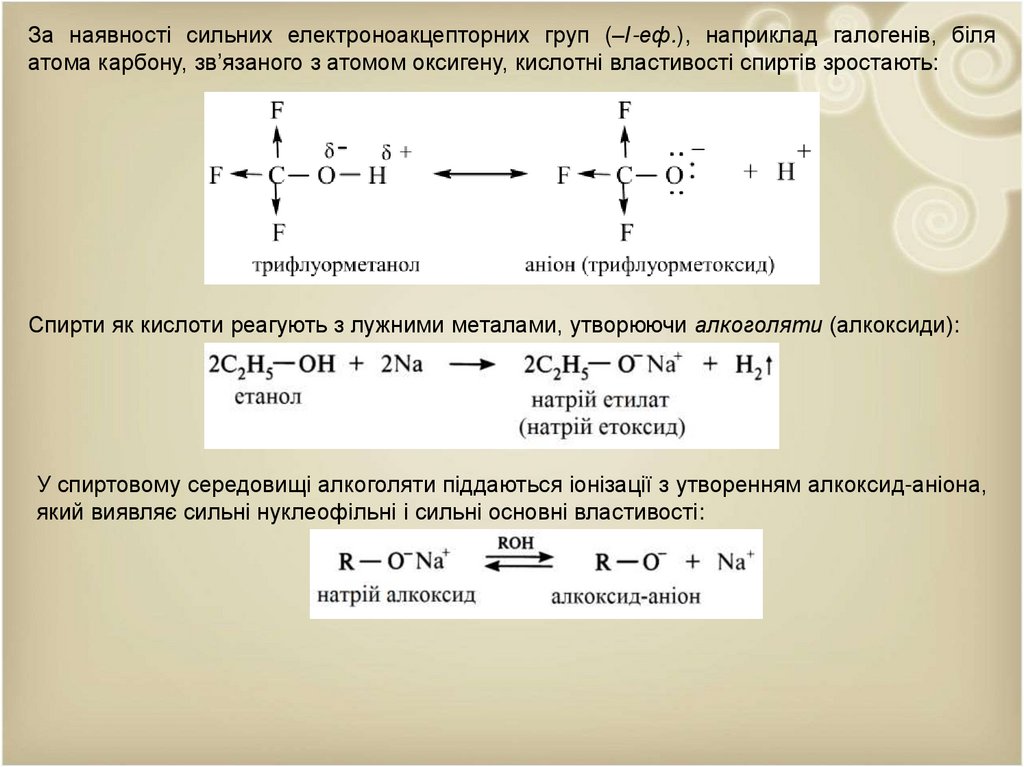
За наявності сильних електроноакцепторних груп (–І-еф.), наприклад галогенів, біляатома карбону, зв’язаного з атомом оксигену, кислотні властивості спиртів зростають:
Спирти як кислоти реагують з лужними металами, утворюючи алкоголяти (алкоксиди):
У спиртовому середовищі алкоголяти піддаються іонізації з утворенням алкоксид-аніона,
який виявляє сильні нуклеофільні і сильні основні властивості:
19.
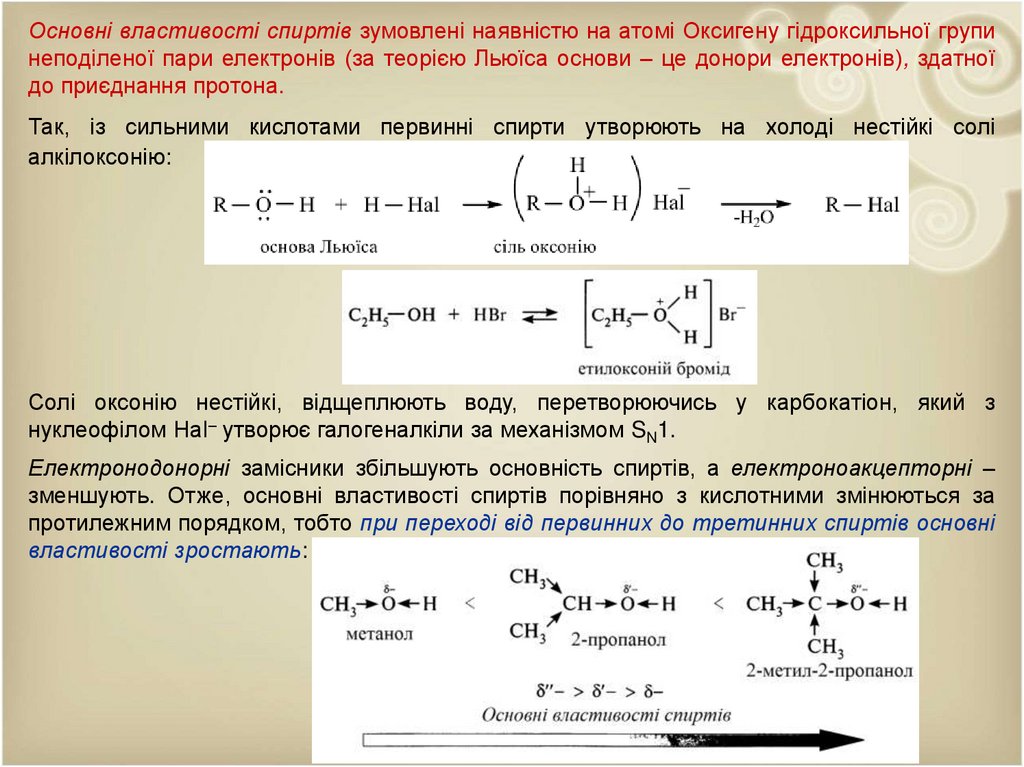
Основні властивості спиртів зумовлені наявністю на атомі Оксигену гідроксильної групинеподіленої пари електронів (за теорією Льюїса основи – це донори електронів), здатної
до приєднання протона.
Так, із сильними кислотами первинні спирти утворюють на холоді нестійкі солі
алкілоксонію:
Солі оксонію нестійкі, відщеплюють воду, перетворюючись у карбокатіон, який з
нуклеофілом Наl– утворює галогеналкіли за механізмом SN1.
Електронодонорні замісники збільшують основність спиртів, а електроноакцепторні –
зменшують. Отже, основні властивості спиртів порівняно з кислотними змінюються за
протилежним порядком, тобто при переході від первинних до третинних спиртів основні
властивості зростають:
20.
2. Реакція естерифікації.При взаємодії спиртів з органічними або оксигенвмісними мінеральними кислотами
утворюються естери (складні ефіри), які можна розглядати як похідні спиртів R-ОН, що
отримують при заміні в них атома гідрогену ОН-групи ацильним залишком карбонової
кислоти або неорганічним залишком мінеральної.
Реакція естерифікації проходить у присутності каталізаторів – сильних кислот
(концентрованої сульфатної H2SО4, фосфатної Н3РО4, BF3 тощо) в рідкій фазі або Аl2O3 –
у газовій.
Реакції спиртів з карбоновими кислотами відбуваються за механізмом нуклеофільного
заміщення.
Первинні спирти легко реагують з карбоновими кислотами, вторинні – вже з меншою
швидкістю, а третинні – ще важче через стеричні перешкоди, внаслідок яких
ускладнюється доступ до реакційного центра при взаємодії з реагентом (правило М.
Меншуткіна).
Встановлено, що в реакції естерифікації молекула води завжди утворюється при
відщепленні ОН-групи кислоти та атома Н від спирту.
21.
22.
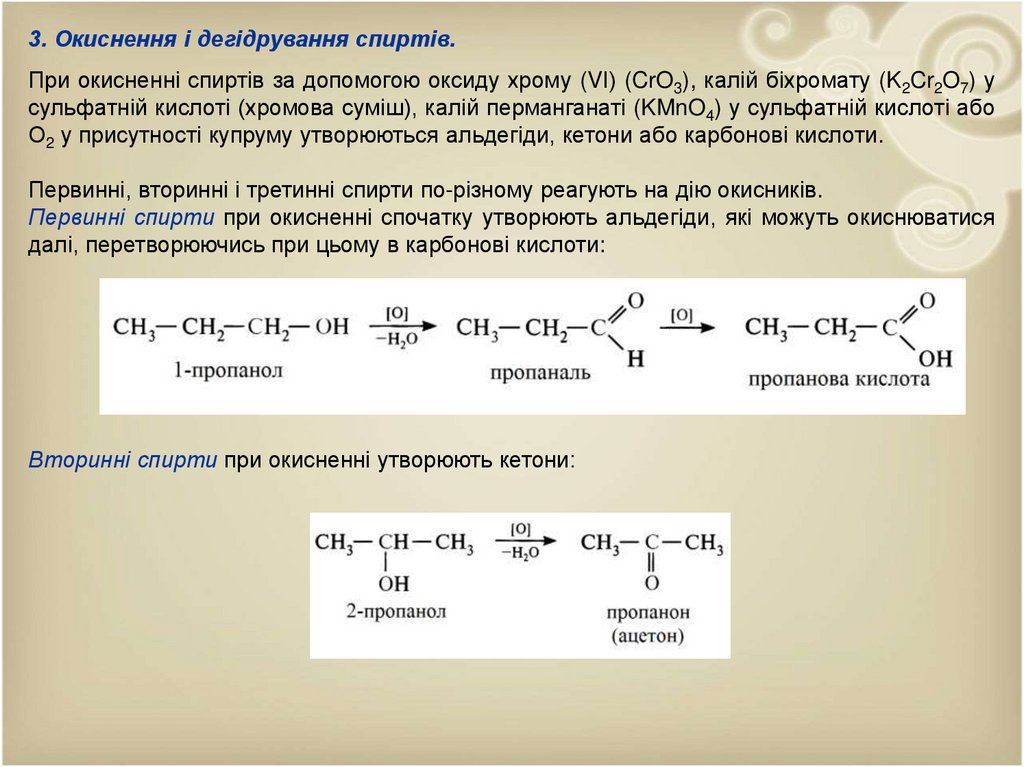
3. Окиснення і дегідрування спиртів.При окисненні спиртів за допомогою оксиду хрому (VІ) (CrO3), калій біхромату (K2Cr2O7) у
сульфатній кислоті (хромова суміш), калій перманганаті (KMnO4) у сульфатній кислоті або
О2 у присутності купруму утворюються альдегіди, кетони або карбонові кислоти.
Первинні, вторинні і третинні спирти по-різному реагують на дію окисників.
Первинні спирти при окисненні спочатку утворюють альдегіди, які можуть окиснюватися
далі, перетворюючись при цьому в карбонові кислоти:
Вторинні спирти при окисненні утворюють кетони:
23.
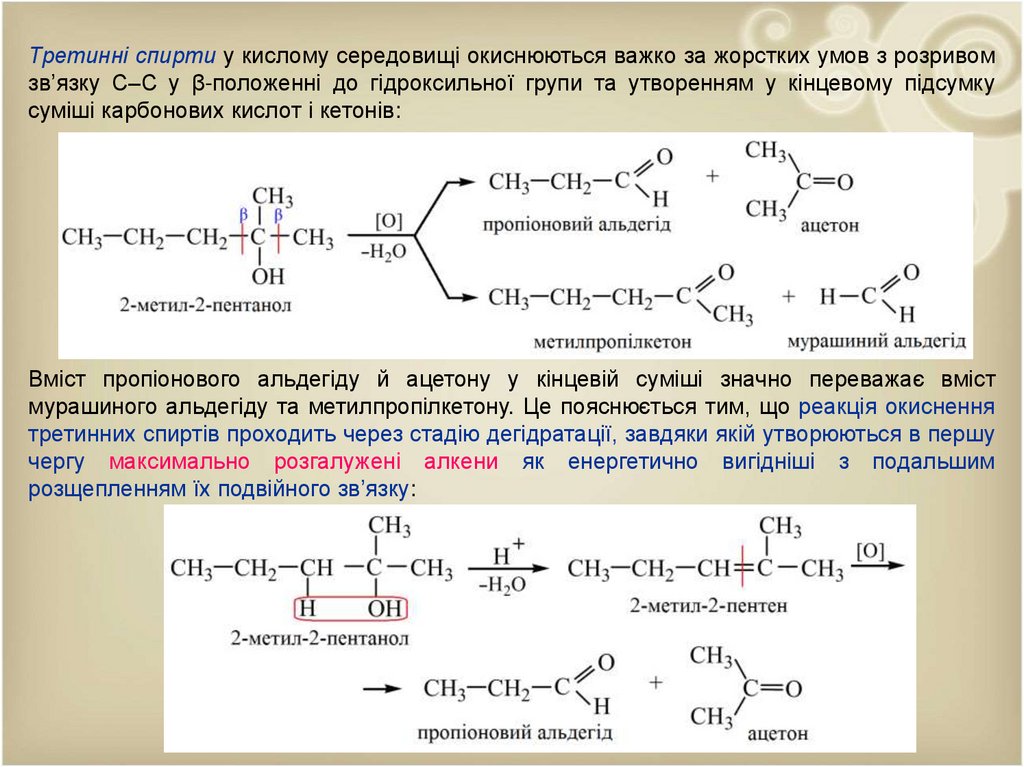
Третинні спирти у кислому середовищі окиснюються важко за жорстких умов з розривомзв’язку С–С у β-положенні до гідроксильної групи та утворенням у кінцевому підсумку
суміші карбонових кислот і кетонів:
Вміст пропіонового альдегіду й ацетону у кінцевій суміші значно переважає вміст
мурашиного альдегіду та метилпропілкетону. Це пояснюється тим, що реакція окиснення
третинних спиртів проходить через стадію дегідратації, завдяки якій утворюються в першу
чергу максимально розгалужені алкени як енергетично вигідніші з подальшим
розщепленням їх подвійного зв’язку:
24.
25.
Процес дегідрування спиртів відбувається в присутності Сu, Рt або Рd як за відсутності,так і в присутності оксигену.
З первинних спиртів при цьому утворюються альдегіди, а з вторинних – кетони:
26.
2. Реакції розщеплення С–О-зв’язку.1. Дегідратація спиртів.
При нагріванні спиртів у присутності концентрованої сульфатної кислоти, безводної
фосфатної кислоти або при пропусканні парів спирту над каталізатором алюміній оксидом
Аl2O3 спирти відщеплюють воду, тобто піддаються дегідратації. Залежно від природи
спирту та умов проведення реакції дегідратація може проходити міжмолекулярно і
внутрішньомолекулярно.
При міжмолекулярній дегідратації спиртів утворюються етери:
Внаслідок внутрішньомолекулярної дегідратації утворюються алкени:
Внутрішньомолекулярна дегідратація в ряду вторинних і третинних спиртів здійснюється
за правилом Зайцева: протон відщеплюється від сусіднього з ОН-групою, менш
гідрогенізованого атома Карбону.
27.
Відщеплення води від двох молекул спирту з утворенням етерів – міжмолекулярнадегідратація – стає переважаючим процесом при нагріванні спиртів у присутності
каталітичних кількостей мінеральної кислоти (спирт у надлишку) при температурі
140–160 °С.
Внутрішньомолекулярна дегідратація, тобто перетворення спирту в алкен, стає
домінуючою при нагріванні спиртів з надлишком мінеральної кислоти при температурі
вище 170°С. Особливо легко вона перебігає в ряду третинних спиртів.
У випадку пропускання парів спирту над Аl2O3 при температурі 200–250 °С відбувається
міжмолекулярна дегідратація з утворенням етерів, а при вищій температурі (300–
400°С) проходить внутрішньомолекулярна дегідратація, тобто утворюються алкени.
Міжмолекулярна дегідратація спиртів відбувається за механізмом SN2 або SN1. При
цьому спочатку молекула спирту під дією мінеральної кислоти протонується з утворенням
оксонієвого катіона, а потім проходить заміщення групи –ОН:
28.
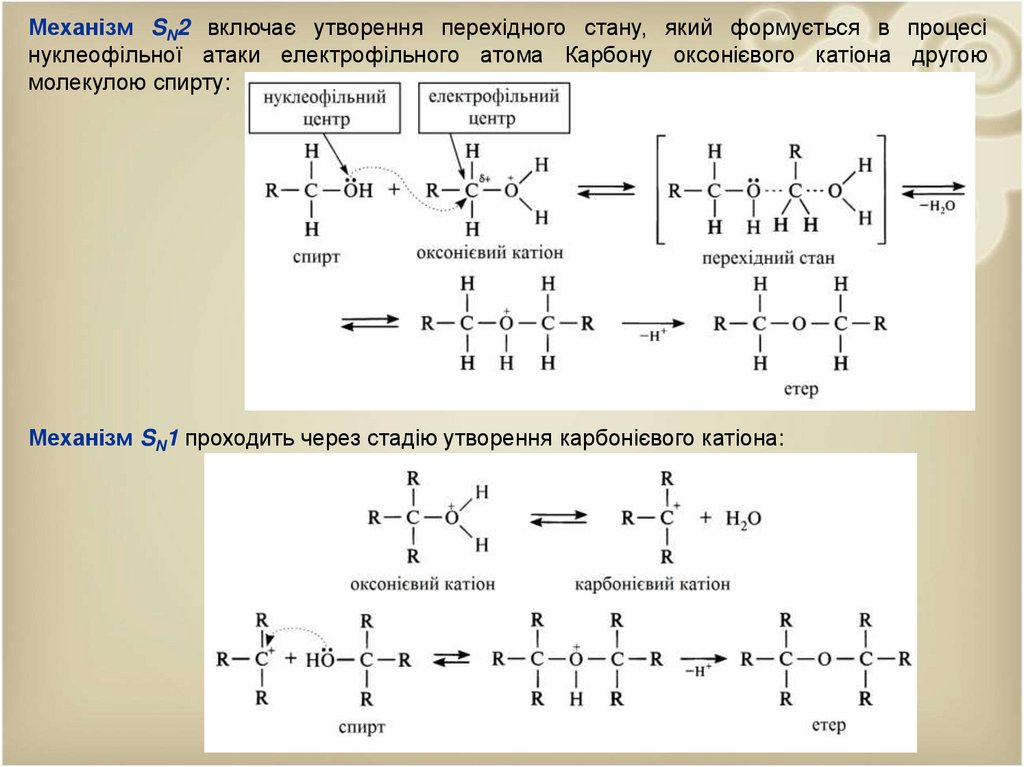
Механізм SN2 включає утворення перехідного стану, який формується в процесінуклеофільної атаки електрофільного атома Карбону оксонієвого катіона другою
молекулою спирту:
Механізм SN1 проходить через стадію утворення карбонієвого катіона:
29.
Внутрішньомолекулярна дегідратація спиртів належить до реакцій елімінування(відщеплення) (E). Легше дегідратуються третинні спирти, потім вторинні і далі первинні,
за механізмом Е1 або Е2, аналогічно реакції дегідрогалогенування. Однак, для спиртів
реакції відщеплення характерніші за механізмом Е1, ніж Е2.
Процес дегідратації спиртів підпорядковується правилу О. Зайцева з утворенням
найбільш розгалужених алкенів.
Як і у випадку нуклеофільного заміщення, елімінування спиртів відбувається з утворенням
оксонієвого катіона. Лімітуючою стадією процесу є розщеплення цього катіона на
молекулу води і карбокатіон. Елімінування завершується швидким відщепленням βпротона від карбокатіона під дією слабкої основи (молекули води, спирту тощо) з
утворенням алкену.
Так, дегідратація третинного спирту проходить за механізмом Е1 і часто супроводжується
реакцією нуклеофільного заміщення за SN1-механізмом:
30.
Одержання того чи іншого алкену при дегідратації визначається стабільністю проміжнихкарбокатіонів і термодинамічною стабільністю розгалужених алкенів.
Наприклад, для ізоамілового спирту згідно з правилом Зайцева повинен утворюватися
тільки 3-метил-1-бутен, а реально виникають три алкени C5H10:
Утворений первинний карбокатіон найменш стабільний і крім відщеплення протона
схильний також унаслідок 1,2-гідридного зміщення ізомеризуватись у стабільніший
вторинний, з якого одержують алкени:
31.
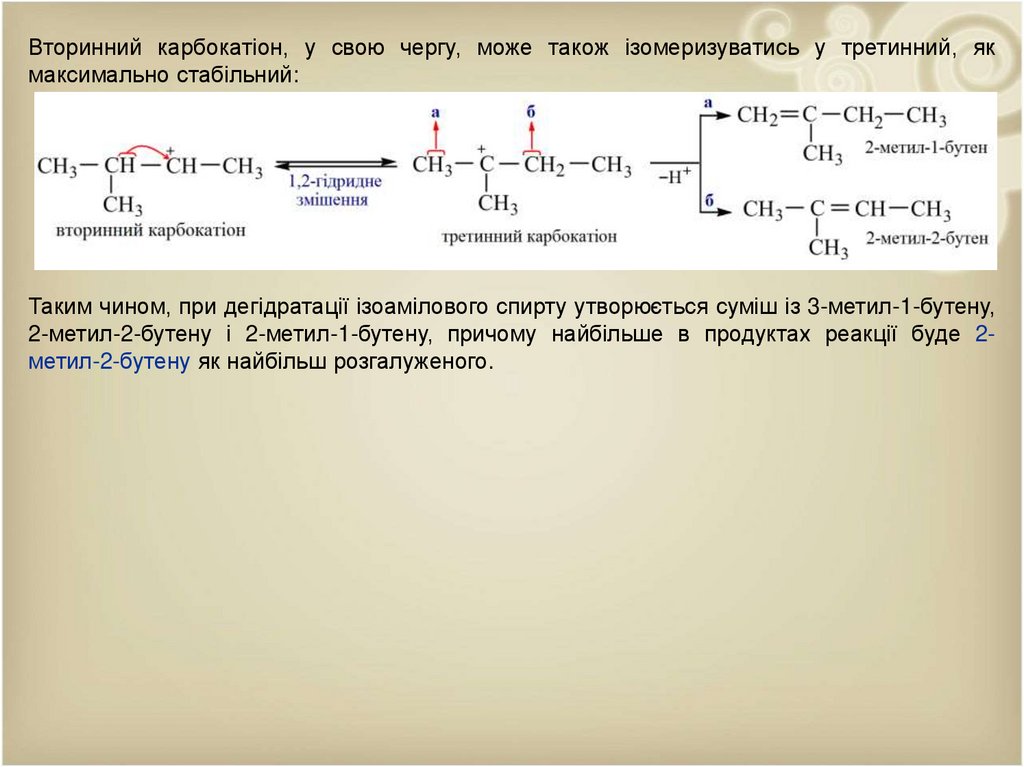
Вторинний карбокатіон, у свою чергу, може також ізомеризуватись у третинний, якмаксимально стабільний:
Таким чином, при дегідратації ізоамілового спирту утворюється суміш із 3-метил-1-бутену,
2-метил-2-бутену і 2-метил-1-бутену, причому найбільше в продуктах реакції буде 2метил-2-бутену як найбільш розгалуженого.
32.
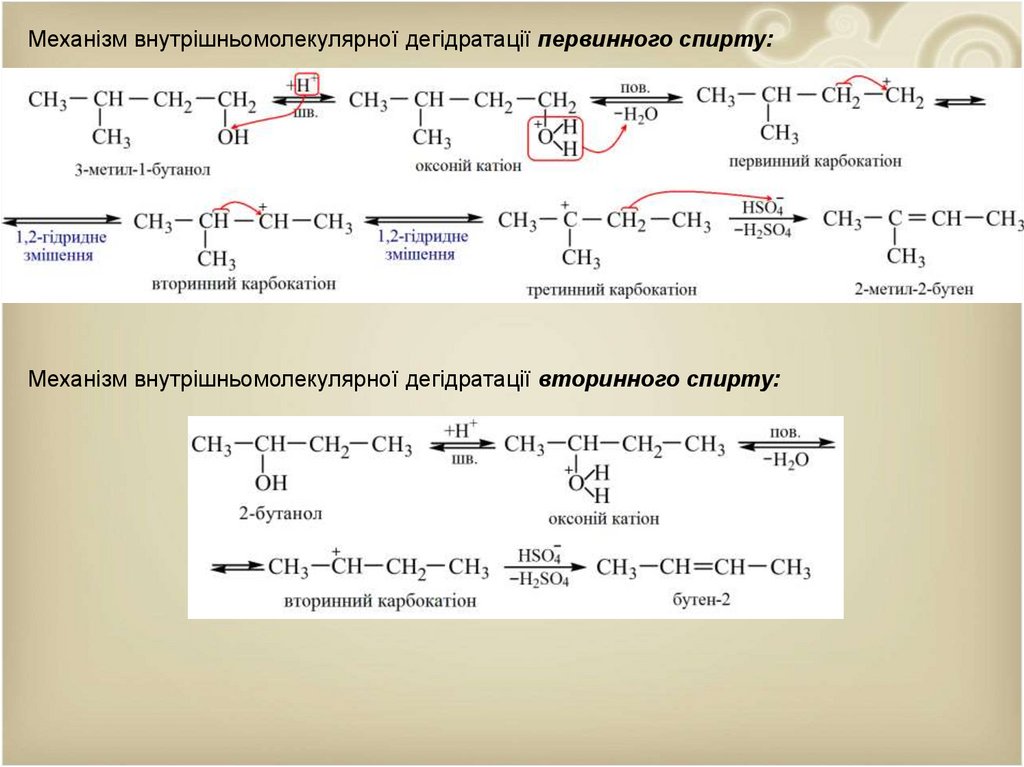
Механізм внутрішньомолекулярної дегідратації первинного спирту:Механізм внутрішньомолекулярної дегідратації вторинного спирту:
33.
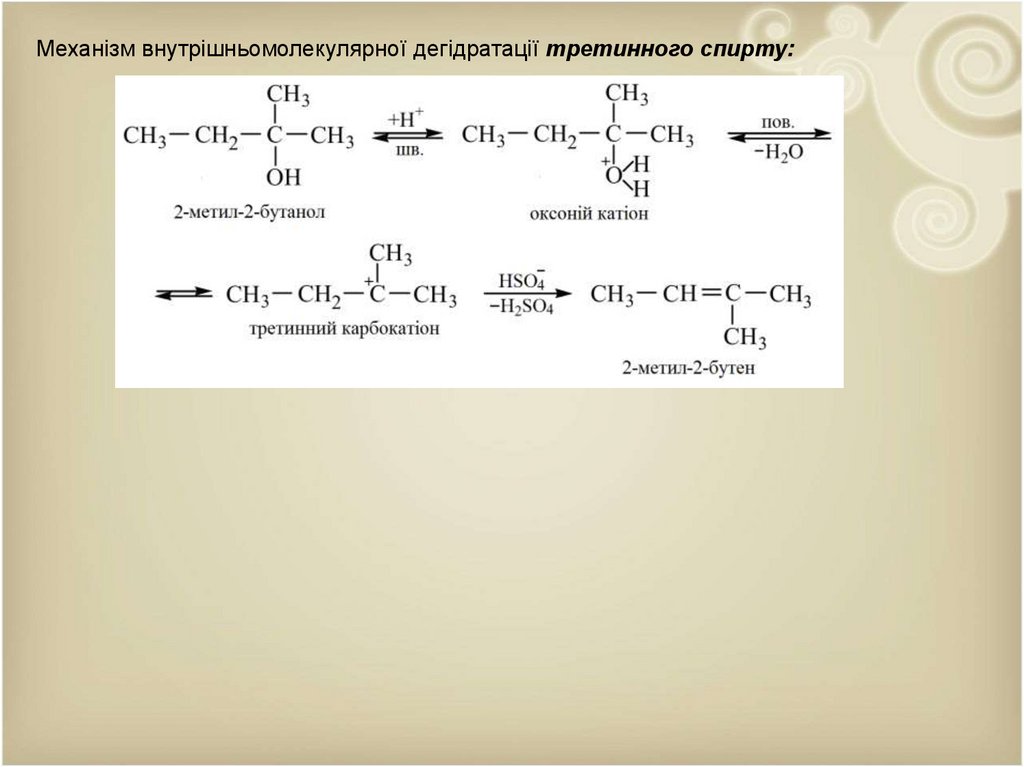
Механізм внутрішньомолекулярної дегідратації третинного спирту:34.
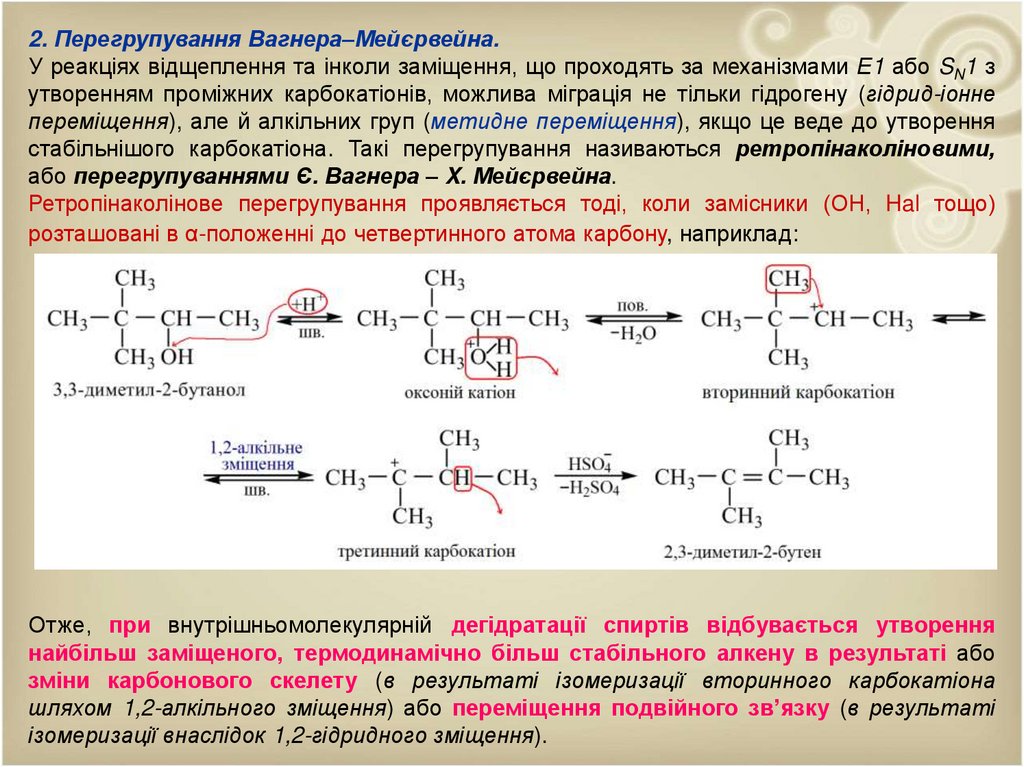
2. Перегрупування Вагнера–Мейєрвейна.У реакціях відщеплення та інколи заміщення, що проходять за механізмами Е1 або SN1 з
утворенням проміжних карбокатіонів, можлива міграція не тільки гідрогену (гідрид-іонне
переміщення), але й алкільних груп (метидне переміщення), якщо це веде до утворення
стабільнішого карбокатіона. Такі перегрупування називаються ретропінаколіновими,
або перегрупуваннями Є. Вагнера – X. Мейєрвейна.
Ретропінаколінове перегрупування проявляється тоді, коли замісники (ОН, Hal тощо)
розташовані в α-положенні до четвертинного атома карбону, наприклад:
Отже, при внутрішньомолекулярній дегідратації спиртів відбувається утворення
найбільш заміщеного, термодинамічно більш стабільного алкену в результаті або
зміни карбонового скелету (в результаті ізомеризації вторинного карбокатіона
шляхом 1,2-алкільного зміщення) або переміщення подвійного зв’язку (в результаті
ізомеризації внаслідок 1,2-гідридного зміщення).
35.
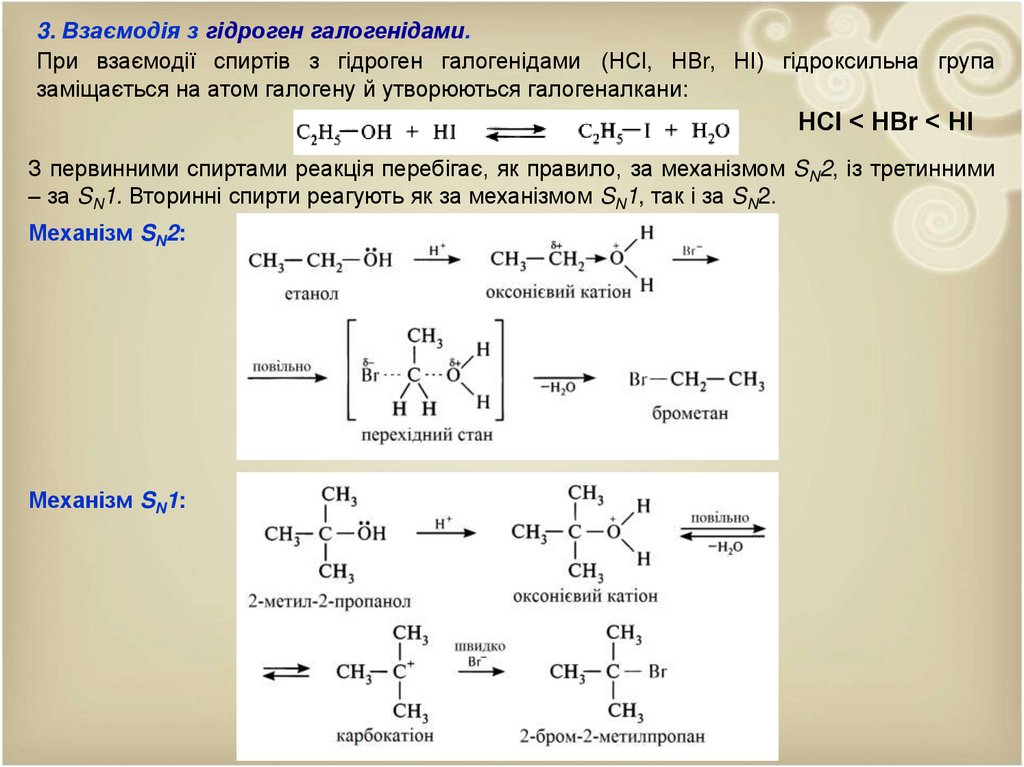
3. Взаємодія з гідроген галогенідами.При взаємодії спиртів з гідроген галогенідами (НСl, НВr, НІ) гідроксильна група
заміщається на атом галогену й утворюються галогеналкани:
НСl < НВr < НІ
З первинними спиртами реакція перебігає, як правило, за механізмом SN2, із третинними
– за SN1. Вторинні спирти реагують як за механізмом SN1, так і за SN2.
Механізм SN2:
Механізм SN1:
36.
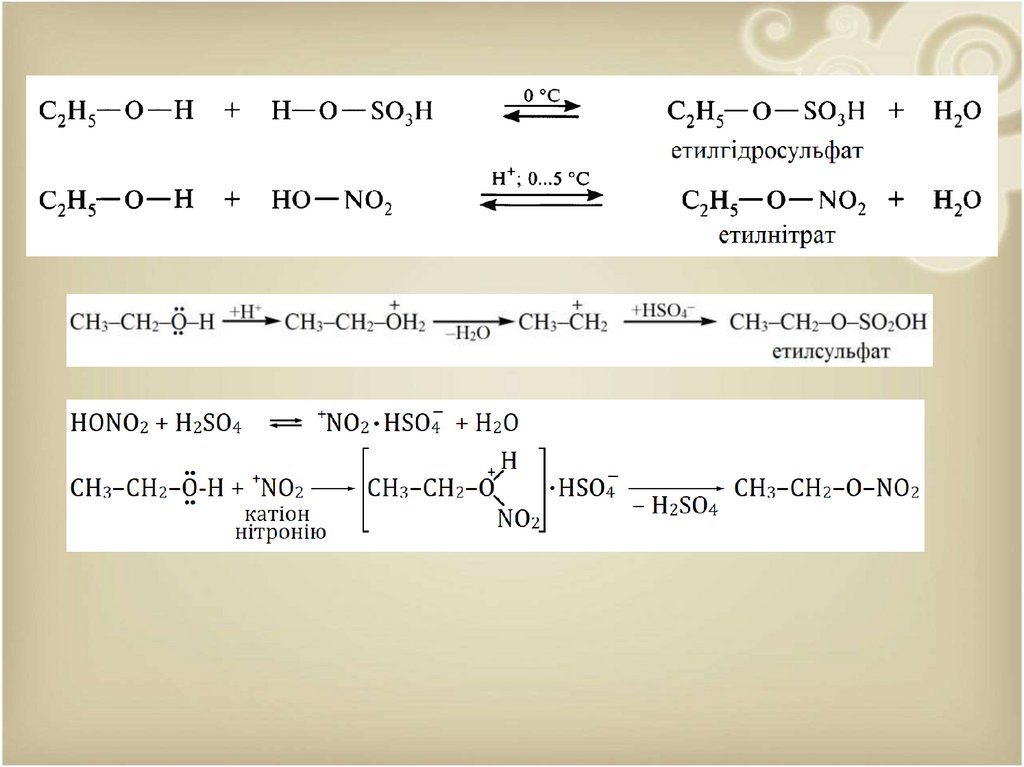
4. Взаємодія з сульфатною кислотою.При взаємодії спиртів, особливо первинних, з сульфатною кислотою утворюються
відповідні естери вже на холоді. При цьому, на відміну від одержання естерів за участю
нітратної кислоти, спостерігається розщеплення С–О-зв’язку в молекулі спирту:
5. Утворення етерів.
Одержання етерів відбувається в присутності кислотних каталізаторів при відносно
невеликих температурах. Перебіг реакції етерифікації включає стадію утворення
протонованого спирту, карбокатіона та алкілювання ними наступної молекули спирту:
Найлегше етери синтезуються з первинних спиртів, важче реакція відбувається з
вторинними і третинними спиртами, оскільки вони здатні в умовах процесу
дегідратуватися до алкенів.
Як алкілюючі речовини застосовують також галогеналкіли. Однак взаємодія спиртів з
галогеналкілами відбувається повільно:
37.
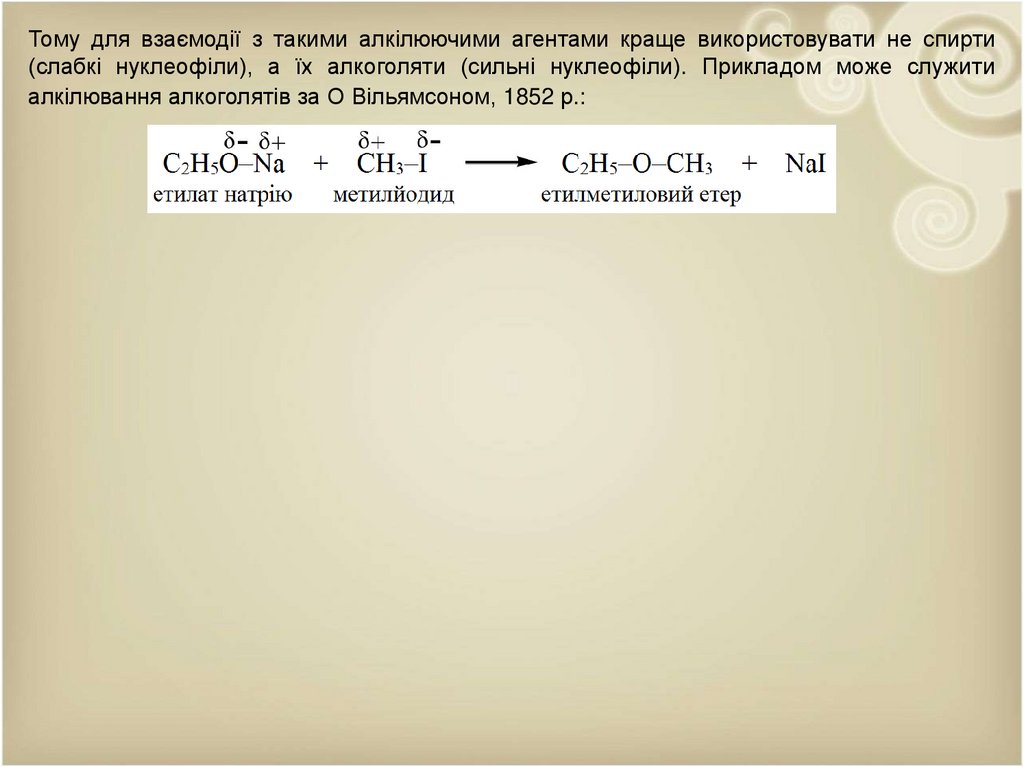
Тому для взаємодії з такими алкілюючими агентами краще використовувати не спирти(слабкі нуклеофіли), а їх алкоголяти (сильні нуклеофіли). Прикладом може служити
алкілювання алкоголятів за О Вільямсоном, 1852 р.:



















 Химия
Химия








