Похожие презентации:
Лекция 1. Часть 2 Поток 2
1.
Лекция 1 (Часть 2)Теория кислот и оснований
Водородный показатель
Расчёт рН сильных и слабых электролитов
Минеральные буферные системы
2. Равновесия в водных растворах
• окислительно-восстановительные равновесия;• лигандообменные равновесия;
• гетерогенные равновесия;
• конкурентные равновесия;
• кислотно-основные равновесия.
2
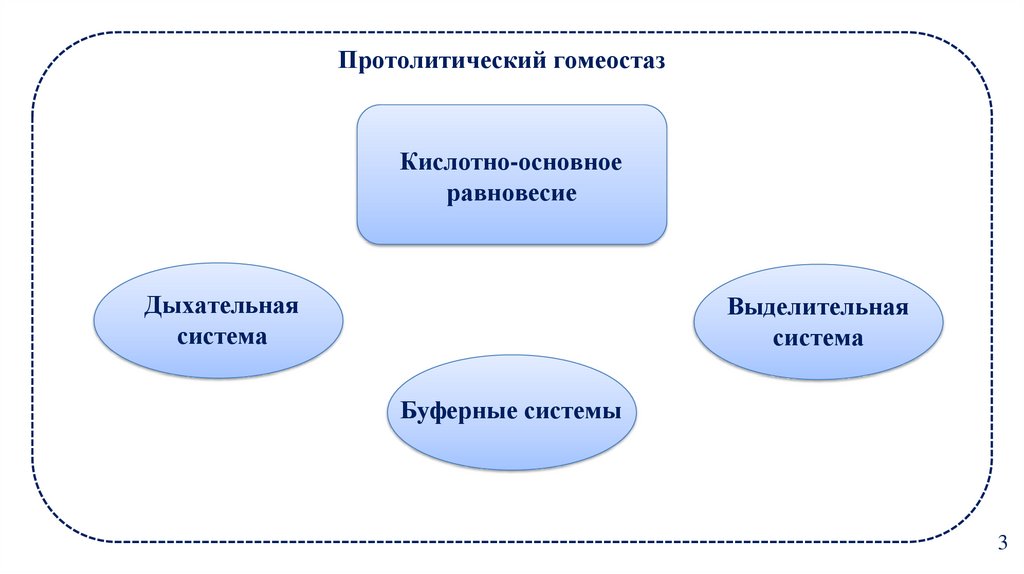
3. Протолитический гомеостаз
Кислотно-основноеравновесие
Дыхательная
система
Выделительная
система
Буферные системы
3
4.
Теории кислот и оснований-электролитическая теория Аррениуса;
-протолитическая теория Брёнстеда — Лаури;
-теория Льюиса.
4
5. Протолитическая теория (1923 г.)
• кислота – донор протона, основание – акцепторпротона;
• у каждой кислоты есть сопряжённое ей основание
– кислота минус протон:
HF→F−
Йоханнес Николаус Брёнстед (1879-1947)
датский физикохимик, член Датского • у каждого основания есть сопряжённая ей кислота
королевского общества наук
– основание плюс протон:
NH3→NH4+
H2O→H3O+; H2O→OH–
Томас Мартин Лаури (1874-1936)
британский химик
чем больше доля переданных (принятых) протонов,
тем сильнее кислота (основание);
• равновесие смещено в сторону более слабых кислот
и оснований
5
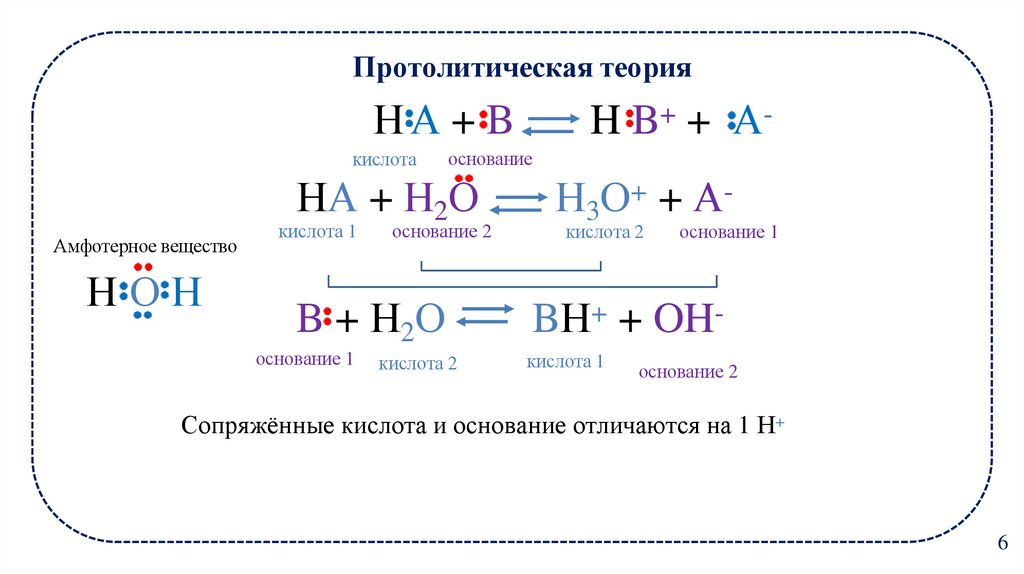
6. Протолитическая теория Н А + B H B+ + А-
Протолитическая теорияНА + B
кислота
Амфотерное вещество
НОН
H B+ + А-
основание
НА + Н2О
Н3О+ + А-
B + Н2О
BН+ + OH-
кислота 1
основание 1
основание 2
кислота 2
кислота 2
кислота 1
основание 1
основание 2
Сопряжённые кислота и основание отличаются на 1 Н+
6
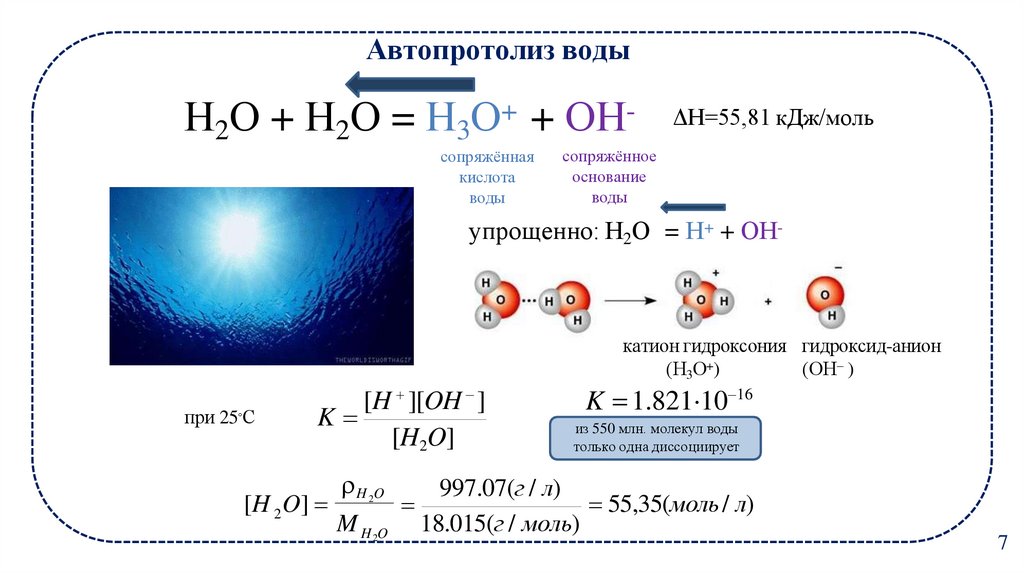
7. Автопротолиз воды
Н2О + Н2О = Н3О+ + ОНсопряжённаякислота
воды
ΔH=55,81 кДж/моль
сопряжённое
основание
воды
упрощенно: Н2О = Н+ + ОН-
катион гидроксония гидроксид-анион
(Н3О+)
(ОН– )
при 25◦С
[H ][OH ]
K
[H2O]
K 1.821 10 16
из 550 млн. молекул воды
только одна диссоциирует
H O
997.07(г / л)
[H 2 O]
55,35(моль / л)
M H O 18.015(г / моль)
2
2
7
8. Kдисс. [H2O] Kw [H ][OH ]
Kдисс. [H2O] Kw [H ][OH ]при 25◦С
Kw 55.35 1.821 10
16
10
14
ионное произведение воды
-Kw постоянно для воды и разбавленных растворов при заданной
температуре;
-изменение концентрации одного из ионов приводит к изменению
концентрации другого
Пример: +HCl (0.001 M)
+NaOH (0.02 M)
10 14
Kw
[OH ]
10 11 (моль / л)
[H ] 0.001
10 14
Kw
13
[H ]
5
10
(моль / л)
[OH ] 0.02
[H+]>[OH-] ([H+]>10-7 моль/л, [OH-]<10-7 моль/л) – кислая реакция среды;
[H+]<[OH-] ([H+]<10-7 моль/л, [OH-]>10-7 моль/л) – щелочная реакция среды;
[H+]=[OH-]= 10-7 моль/л – нейтральная реакция среды
pX=-lgX
pH=-lg[H+] pOH=-lg[OH-]
[H ][OH ] 10 14
pH + pOH=14
8
9. pH + pOH≈13.6
при 37◦СK w 2.36 10
14
pH + pOH≈13.6
pH<6.8 - кислая реакция среды;
pH>6.8 - щелочная реакция среды
Логарифмом числа b по основанию a называют показатель степени, в
который надо возвести основание a, чтобы получить число b
loga b x , если ax b , где
Действия с десятичными логарифмами
Логарифм произведения
Логарифм частного
Логарифм степени
a 0,a 1,b 0
log10 а lg а
lg(а в) lg а lg в
а
lg lg а lg в
в
lg аk k lg а
9
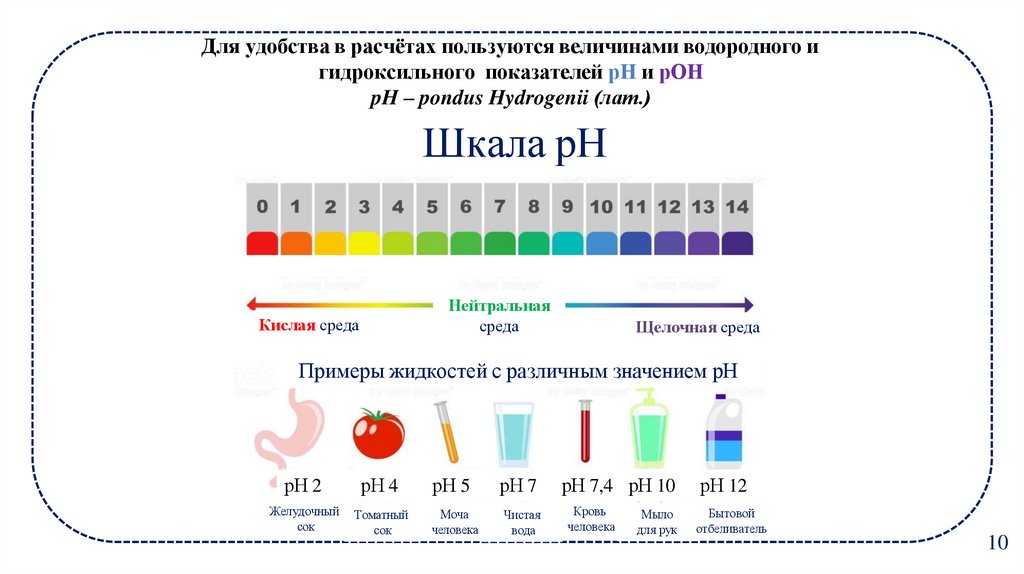
10. pH – pondus Hydrogenii (лат.)
Для удобства в расчётах пользуются величинами водородного игидроксильного показателей рH и рОН
pH – pondus Hydrogenii (лат.)
Шкала рН
Нейтральная
среда
Кислая среда
Щелочная среда
Примеры жидкостей с различным значением рН
рН 2
рН 4
рН 5
рН 7
рН 7,4 рН 10
рН 12
Желудочный
сок
Томатный
сок
Моча
человека
Чистая
вода
Кровь
человека
Бытовой
отбеливатель
Мыло
для рук
10
11.
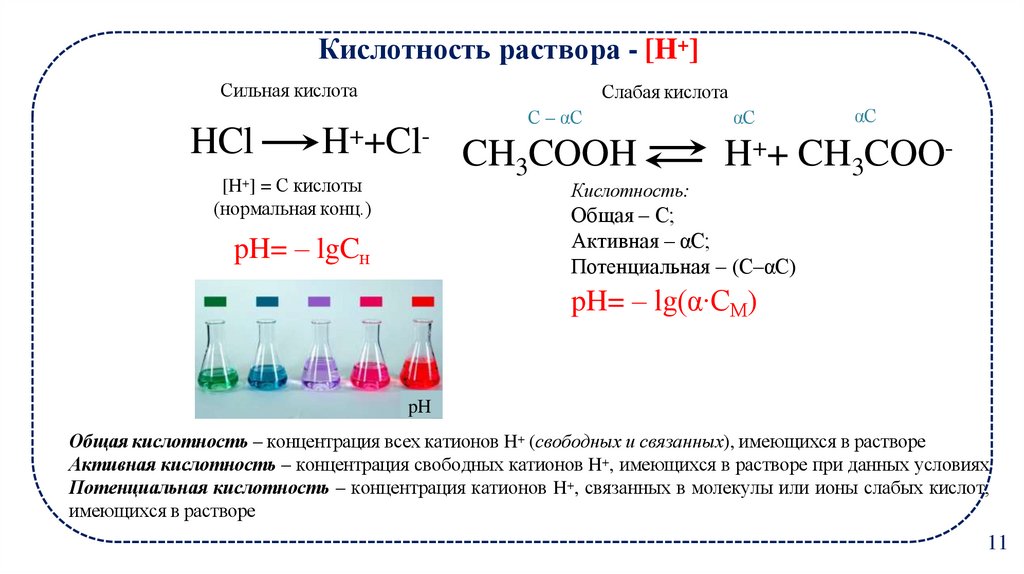
Кислотность раствора - [H+]Сильная кислота
HCl
Слабая кислота
С – αС
H++Cl- CH COOH
3
[H+] = С кислоты
(нормальная конц.)
Кислотность:
αС
αС
H++ CH3COO-
Общая – С;
Активная – αС;
Потенциальная – (С–αС)
pH= – lgCн
pH= – lg(α∙CМ)
pH
Общая кислотность – концентрация всех катионов H+ (свободных и связанных), имеющихся в растворе
Активная кислотность – концентрация свободных катионов H+, имеющихся в растворе при данных условиях
Потенциальная кислотность – концентрация катионов H+, связанных в молекулы или ионы слабых кислот,
имеющихся в растворе
11
12. pH растворов сильных и слабых электролитов
Сильные кислотыpH lg CN lg(z CМ ), где z – основность кислоты
Сильные основания (щёлочи)
Ме(ОН)z → Меz+ + z ОН-
[OH ] C N z C M
pOH lg CN lg(z CM ), где z кислотность основания
Слабые кислоты
pH 14 pOH 14 lg C N
pH lg C M
1
2
Ka
1
pKa lg CM
pH lg C M lg CM
lg(C M K a )
2
2
CM
Слабые основания
pOH lg C M
pKb lg CM
pOH
2
pKb lg CM
pH 14
2
12
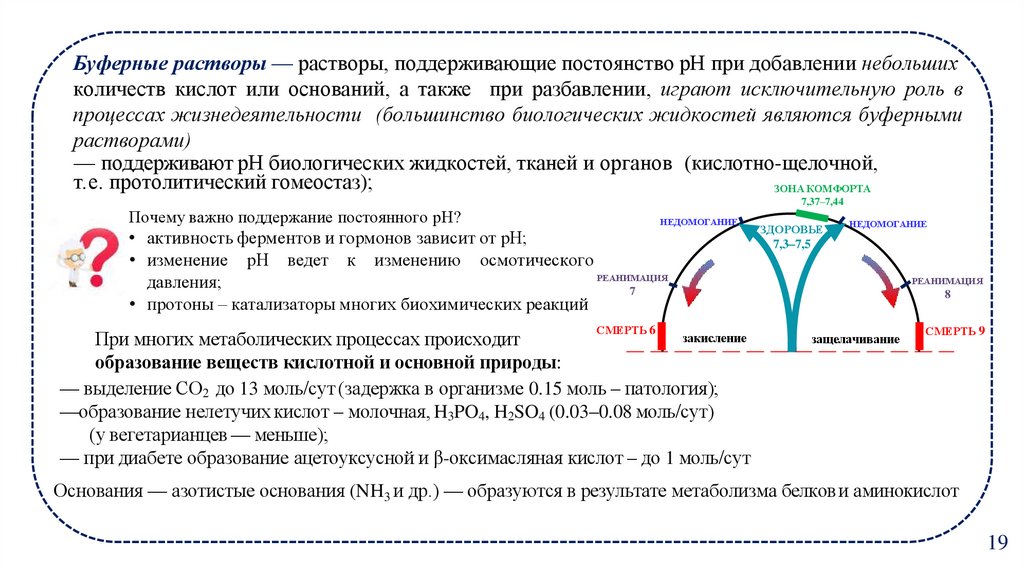
13. Буферные растворы — растворы, поддерживающие постоянство рН при добавлении небольших
количеств кислот или оснований, а также при разбавлении, играют исключительную роль впроцессах жизнедеятельности (большинство биологических жидкостей являются буферными
растворами)
— поддерживают рН биологических жидкостей, тканей и органов (кислотно-щелочной,
т.е. протолитический гомеостаз);
ЗОНА КОМФОРТА
7,37–7,44
Почему важно поддержание постоянного рН?
НЕДОМОГАНИЕ
• активность ферментов и гормонов зависит от рН;
• изменение рН ведет к изменению осмотического
РЕАНИМАЦИЯ
давления;
7
• протоны – катализаторы многих биохимических реакций
СМЕРТЬ 6
закисление
При многих метаболических процессах происходит
образование веществ кислотной и основной природы:
— выделение СО2 до 13 моль/сут (задержка в организме 0.15 моль – патология);
—образование нелетучих кислот – молочная, H3PO4, H2SO4 (0.03–0.08 моль/сут)
(у вегетарианцев — меньше);
— при диабете образование ацетоуксусной и β-оксимасляная кислот – до 1 моль/сут
ЗДОРОВЬЕ
НЕДОМОГАНИЕ
7,3–7,5
РЕАНИМАЦИЯ
8
защелачивание
СМЕРТЬ 9
Основания — азотистые основания (NH3 и др.) — образуются в результате метаболизма белков и аминокислот
19
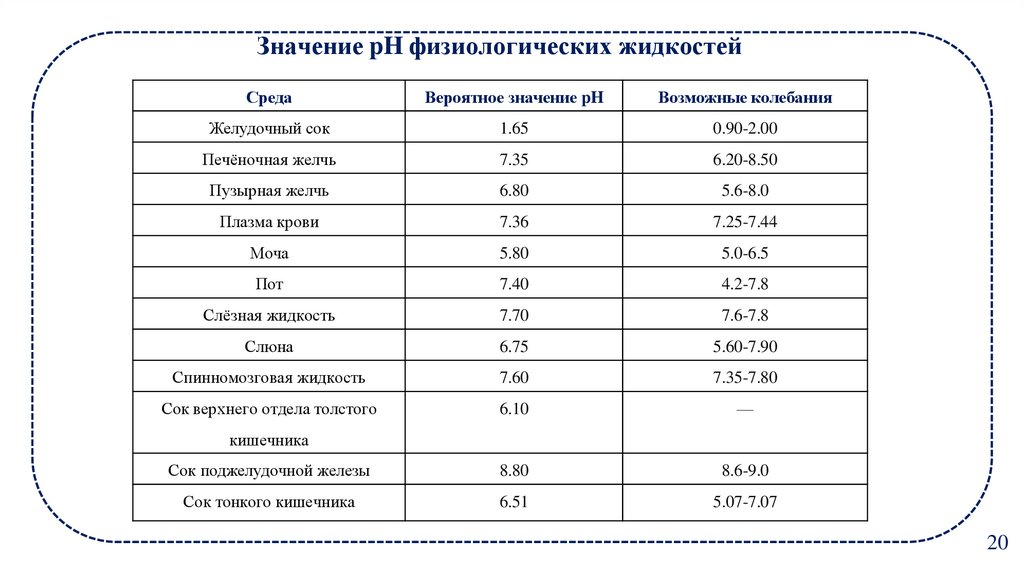
14. Значение pH физиологических жидкостей
СредаВероятное значение pH
Возможные колебания
Желудочный сок
1.65
0.90-2.00
Печёночная желчь
7.35
6.20-8.50
Пузырная желчь
6.80
5.6-8.0
Плазма крови
7.36
7.25-7.44
Моча
5.80
5.0-6.5
Пот
7.40
4.2-7.8
Слёзная жидкость
7.70
7.6-7.8
Слюна
6.75
5.60-7.90
Спинномозговая жидкость
7.60
7.35-7.80
Сок верхнего отдела толстого
6.10
—
Сок поджелудочной железы
8.80
8.6-9.0
Сок тонкого кишечника
6.51
5.07-7.07
кишечника
20
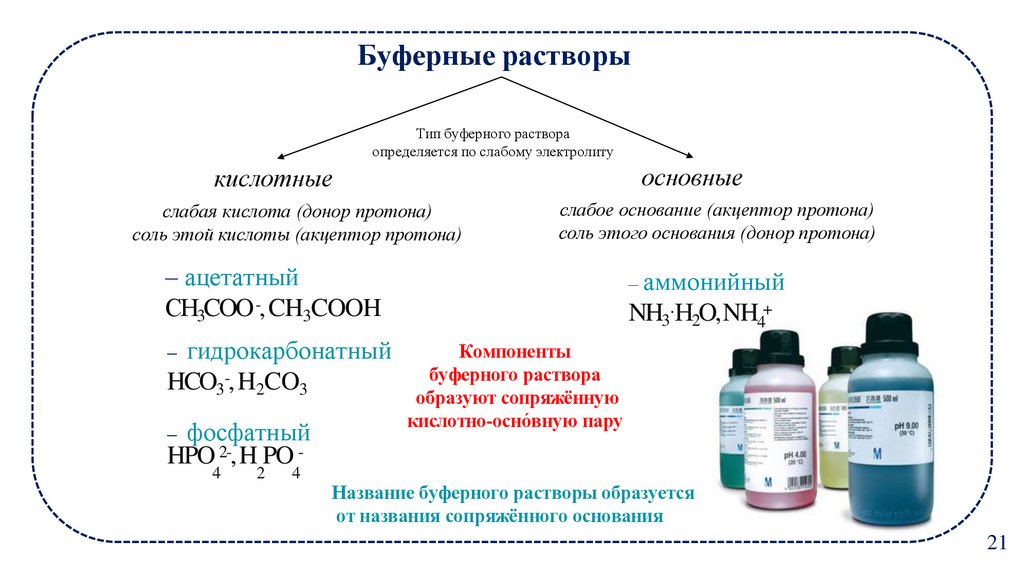
15. Буферные растворы
Тип буферного раствораопределяется по слабому электролиту
основные
кислотные
слабая кислота (донор протона)
соль этой кислоты (акцептор протона)
слабое основание (акцептор протона)
соль этого основания (донор протона)
– ацетатный
СH3COO -, CH3COOH
– гидрокарбонатный
HCO3-, H2CO3
– фосфатный
– аммонийный
NH3·H2O,NH4+
Компоненты
буферного раствора
образуют сопряжённую
кислотно-осно́вную пару
HPO 2-,H PO 4
2
4
Название буферного растворы образуется
от названия сопряжённого основания
21
16. Схема (механизм) буферного действия
(на примере ацетатной буферной системы)СН3СООН/СН3СООNa
+
СН СООН
H
+
СН
СОО
3
3
+
СН3СООNa Na + СН3СОО
[CH3COOH]=С кислоты; [CH3COO -]=С соли (сопряжённого основания)
1) Добавление сильной кислоты:
CH COOH
+
H
CH 3COOH
3
CH 3COO сильная
слабый электролит
кислота
(слабая кислота)
pH const
2) Добавление сильного основания:
CH COOH
3
+
OH
H2O + CH3COO
CH
COO
3
слабый
сильное
pH const основание электролит
22
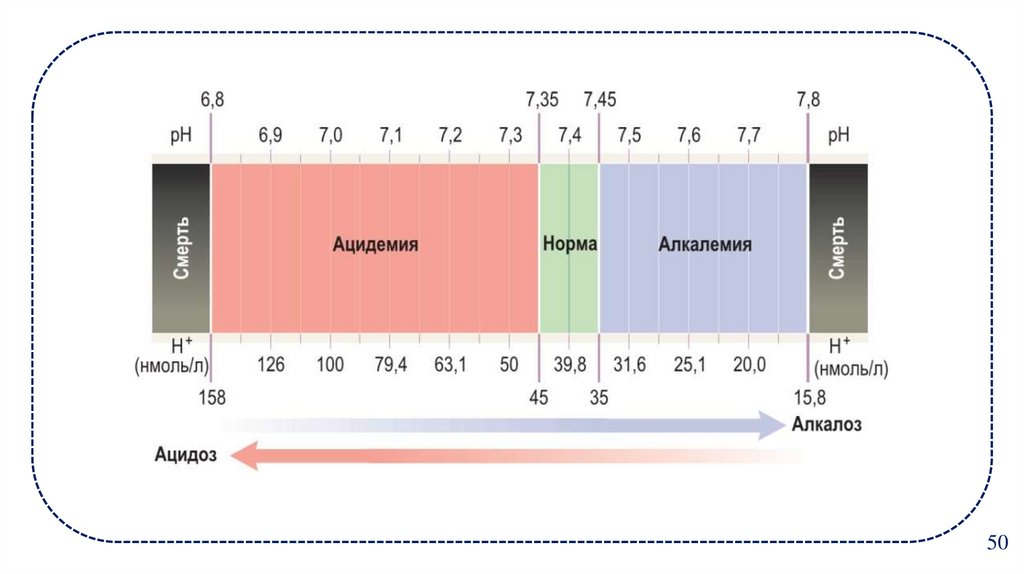
17.
5018. Алкалиемия (аномально высокая щёлочность крови)
Ацидемия(аномально высокая
кислотность крови)
Алкалиемия
(аномально высокая
щёлочность крови)
при сердечно-сосудистых заболеваниях,
ишемической болезни, инфаркте
миокарда;
при потере организмом остатков кислот;
при тяжелых формах сахарного диабета;
при кишечной непроходимости;
при приеме пищи кислотного характера;
при нарушении выведения натрия почками;
при начальных изменениях пародонта.
при приеме пищи осно́вного характера;
при задержке основ́ ных катионов;
при приеме лекарственных препаратов;
при отравлениях.
51




![Kдисс. [H2O] Kw [H ][OH ] Kдисс. [H2O] Kw [H ][OH ]](https://cf5.ppt-online.org/files5/slide/1/1a9YivI75pDRkPdJ0AbSutWmhVZj38MnLGlqQc/slide-7.jpg)




 Химия
Химия








