Похожие презентации:
ОВР 11 класс
1. Окислительно-восстановительные реакции
Окислительновосстановительныереакции
Преподаватель: Марина Ивановна
2.
По степени окисления реакции делят на1. Реакции без изменения степени окисления;
2. Реакции с изменением степени окисления.
Окислительно-восстановительные
реакции
–
это
химические реакции, протекающие с изменением степеней
окисления элементов, образующих реагирующие вещества.
Степень окисления – это условный заряд атомов химического
элемента в соединении, вычисленный из предложения, что
соединение состоит из простых ионов
Степень окисления атома обозначают знаком заряда и цифрой над
символом химического элемента в формуле вещества, например:
Следует различать понятия «степень окисления» и «валентность»
Валентность – это свойство атомов присоединять или замещать
определённое число атомов другого элемента.
Количественно валентность определяется
связей, образованных атомом.
числом
химических
3.
Правила, которые необходимо знать приопределении степени окисления
1. Степень окисления свободных атомов и атомов в простых
веществах равна нулю.
Например:
2. Сумма степеней окисления всех атомов в молекуле (или
формульной единице) вещества равна нулю:
Задание: Самостоятельно рассмотреть пример расстановки степеней
окисления атомов в перманганат калия KMnO4
4.
Любая ОВР (окислительно-восстановительная реакция) состоит изпроцессов окисления и восстановления
Рассмотрим реакцию
Видим, что степени окисления в данной реакции изменили атомы
железа и меди. Следовательно, эта реакция является окислительновосстановительной. Атомы железа в степени окисления 0 отдали два
электрона, превратившись при этом в ион с зарядом +2:
Окисление – это процесс отдачи электронов атомом или
ионом
Ионы меди в исходном веществе имели степень окисления +2, а в
продукте реакции — степень окисления 0, т. е. каждый из них
принял по два электрона
Восстановление – это процесс принятия электронов атомом
или ионом
5.
6.
Окислительно-восстановительные реакции играют важную роль ворганической химии. Рассмотрим, например, реакцию горения
метана и повторим, как рассчитываются коэффициенты и
составляются уравнения окислительно-восстановительных реакций
с использованием метода электронного баланса, т. е. равенства числа
отданных и принятых электронов.
Убедиться, что атомы углерода в этой реакции теряют именно 8
электронов, поможет схема, где на числовом луче показаны степени
окисления атомов, а так же изменение этой величины в процессах
окисления и восстановления
1
2
3
4
5
6
7
8
7.
Одно вещество в реакциях может выступать и вроли окислителя, и в роли восстановителя.
Во-первых, в состав вещества могут входить атомы элементов, один
из которых проявляет свойства окислителя, а другой —
восстановителя. Например, хлороводород (и его водный раствор —
соляная кислота) проявляет окислительные свойства при
взаимодействии с металлами за счёт катиона водорода
и
восстановительные благодаря наличию галогена в минимальной
степени окисления
Во-вторых, вещество может содержать атомы элемента в
промежуточной степени окисления и выступать в качестве
окислителя, принимая чужие электроны, или в качестве
восстановителя, отдавая электроны другим атомам. Так, оксид серы
(IV) в реакции с кислородом выступает в роли восстановителя, а в
реакции с углеродом — окислителя:
8.
Постарайтесьчто-то
запомнить:)
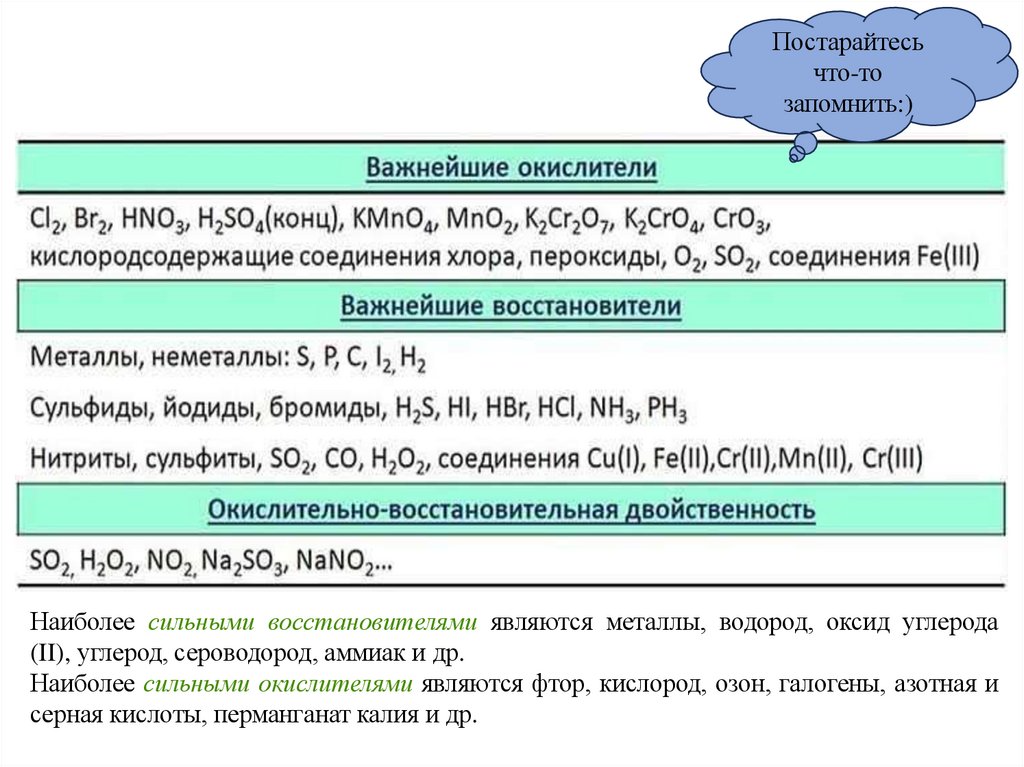
Наиболее сильными восстановителями являются металлы, водород, оксид углерода
(II), углерод, сероводород, аммиак и др.
Наиболее сильными окислителями являются фтор, кислород, озон, галогены, азотная и
серная кислоты, перманганат калия и др.
9.
ЗАКЛЮЧЕНИЕОкислительно-восстановительные
реакции
используются
на
производстве (все металлургические процессы, синтез аммиака,
производство кислот) и играют важную роль в процессах
жизнедеятельности (процессы дыхания, горения и фотосинтеза).
Подчеркнём, единство окислительно-восстановительных процессов.
Ведь если какой-то элемент или вещество окисляется (отдаёт
электроны), то другое вещество обязательно восстанавливается
(принимает эти электроны) с со блюдением электронного баланса.
Эти процессы неразрывно связаны между собой.
Без изменения степеней окисления элементов протекают, например,
реакции ионного обмена.
10.
ДОМАШНЕЕ ЗАДАНИЕЗадание № 1
Задание № 2 Дана схема окислительно-восстановительной реакции:
1. Составьте электронный баланс этой реакции.
2. Укажите окислитель и восстановитель.
3. Расставьте коэффициенты в уравнении реакции.
Задание № 3 Дана схема окислительно-восстановительной реакции:
1. Составьте электронный баланс этой реакции.
2. Укажите окислитель и восстановитель.
3. Расставьте коэффициенты в уравнении реакции.
11.
ДОМАШНЕЕ ЗАДАНИЕ1) Изучить презентацию «Окислительно-восстановительные реакции»;
2) Сделать конспект занятия (написать определения, уравнения реакций). Конспект
можно сделать кратко, главное, чтоб вы понимали о чём идёт речь;
3) Для закрепления знаний – сделать небольшое задание в тетради (Тетради
проверю!)
На следующем уроке (очном), обязательно все повторим:)
12. Понятие об электролизе растворов и расплавов солей
Преподаватель: Марина Ивановна13.
Самым сильным из известных окислителей и восстановителейявляется электрический ток. Он восстанавливает даже щелочные и
щёлочноземельные металлы и алюминий из их соединений и
окисляет даже ионы галогенов и кислорода из их соединений до
простых веществ.
ЭЛЕКТРОЛИЗ – это окислительно – восстановительные реакции,
протекающие на электродах при прохождении электрического тока
через расплав или раствор электролита
При плавлении электролиты распадаются на ионы, только в
отличие от ионов в водных растворах такие ионы не гидратированы.
При пропускании электрического тока через расплав ионы
направляются к противоположно заряженным электродам и
разряжаются на них.
Негидратированные ионы* в химии — это ионы, которые не
связаны с молекулами воды.
14.
Рассмотрим электролиз расплава хлорида натрия. В расплаве эта сольдиссоциирует:
Катионы натрия направляются к катоду (отрицательному полюсу
источника тока) и разряжаются на нём, т. е. восстанавливаются:
Итоговое уравнение электролиза расплава хлорида натрия:
Катод (-)
Анод (+)
Под действием электрического тока
положительные ионы движутся к
катоду, а отрицательные ионы – к
аноду.
15.
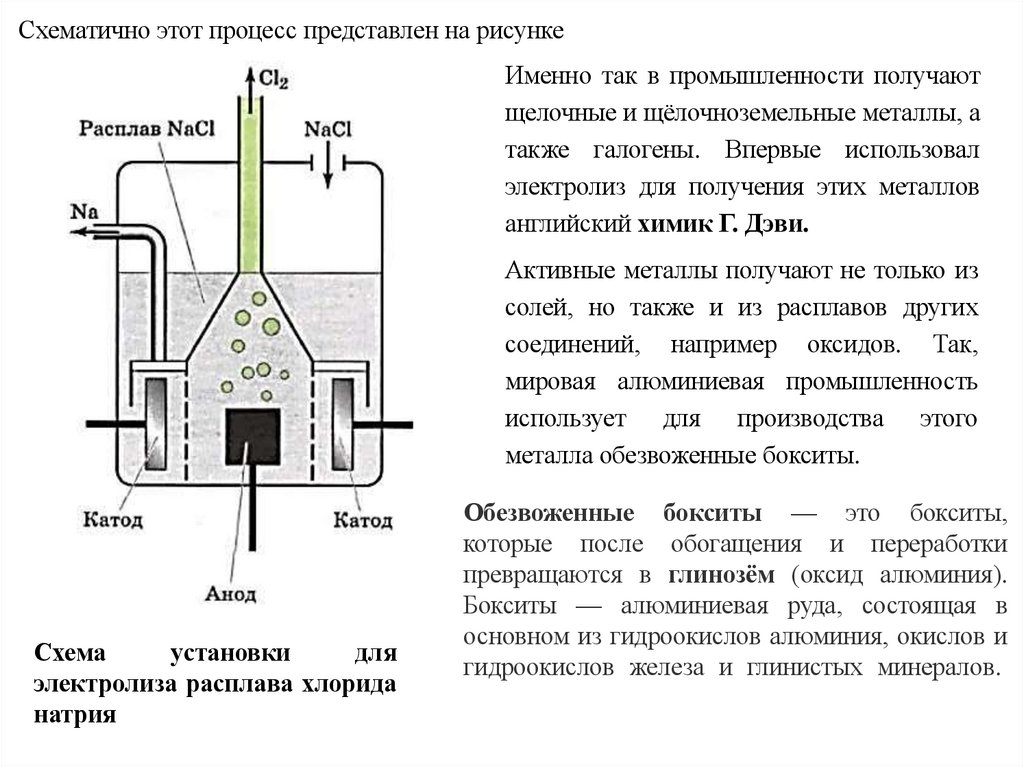
Схематично этот процесс представлен на рисункеИменно так в промышленности получают
щелочные и щёлочноземельные металлы, а
также галогены. Впервые использовал
электролиз для получения этих металлов
английский химик Г. Дэви.
Активные металлы получают не только из
солей, но также и из расплавов других
соединений, например оксидов. Так,
мировая алюминиевая промышленность
использует для производства этого
металла обезвоженные бокситы.
Схема
установки
для
электролиза расплава хлорида
натрия
Обезвоженные бокситы — это бокситы,
которые после обогащения и переработки
превращаются в глинозём (оксид алюминия).
Бокситы — алюминиевая руда, состоящая в
основном из гидроокислов алюминия, окислов и
гидроокислов железа и глинистых минералов.
16.
17.
Второй тип электролиза, используемого в промышленности, — этоэлектролиз растворов.
В этом процессе приходится учитывать не только те ионы, на
которые диссоциирует электролит, но также и ионы, образующиеся
при очень незначительной диссоциации молекул воды:
18.
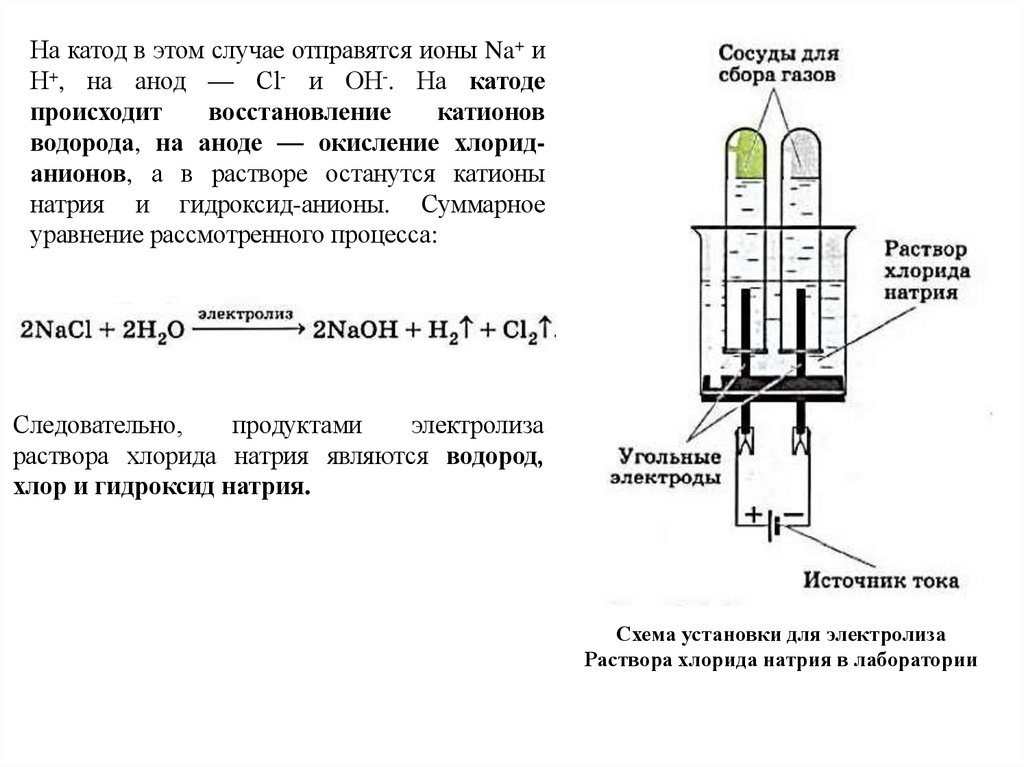
На катод в этом случае отправятся ионы Na+ иН+, на анод — Сl- и ОН-. На катоде
происходит
восстановление
катионов
водорода, на аноде — окисление хлориданионов, а в растворе останутся катионы
натрия и гидроксид-анионы. Суммарное
уравнение рассмотренного процесса:
Следовательно,
продуктами
электролиза
раствора хлорида натрия являются водород,
хлор и гидроксид натрия.
Схема установки для электролиза
Раствора хлорида натрия в лаборатории
19.
Для определения продуктов электролизаэлектролитов существуют следующие правила.
водных
растворов
1. Процесс на катоде зависит не от материала катода, из которого он
сделан, а от положения металла (катиона электролита) в
электрохимическом ряду напряжений, при этом если:
1.1. Катион электролита расположен в начале ряда
напряжений (по алюминий включительно), на катоде идёт
процесс восстановления воды (выделяется водород Н2↑).
Катионы металла не восстанавливаются, они остаются в растворе.
1.2. Катион электролита находится в ряду напряжений между
алюминием и водородом, то на катоде восстанавливаются
одновременно и ионы металла, и молекулы воды.
1.3. Катион электролита находится в ряду напряжений после
водорода, то на катоде восстанавливаются катионы металла.
1.4. В растворе содержатся катионы разных металлов, то сначала
восстанавливается катион металла, стоящего в ряду
напряжений правее.
20.
2. Процесс на аноде зависит от материала анода и от природы аниона2.1. Если анод растворяется (железо, цинк, медь, серебро и все
металлы, которые окисляются в процессе электролиза), то
окисляется металл анода, несмотря на природу аниона.
2.2. Если анод не растворяется (его называют инертным — графит,
золото, платина), то:
а) при электролизе растворов солей бескислородных кислот (кроме
фторидов) на аноде идёт процесс окисления аниона;
б) при электролизе растворов солей кислородсодержащих кислот и
фторидов на аноде идёт процесс окисления воды.
Анионы не окисляются, они остаются в растворе;
в) анионы по их способности окисляться располагаются в
следующем порядке:
21.
В промышленности электролиз находит широкое применение:для
получения
щелочных,
щёлочноземельных металлов и алюминия;
• для получения галогенов, водорода и
кислорода (рисунок);
• для нанесения металлических покрытий на
поверхность изделий — никелирование,
хромирование, золочение (общее название
таких процессов — гальваностегия);
для
изготовления
рельефных
металлических копий (гальванопластика);
для
очистки
цветных
примесей {рафинирование).
металлов
от



















 Химия
Химия








