Похожие презентации:
Химическиие св-ва галогенов
1.
2. название «галоген» происходит от слов рождать соль
ФторХлор
Бром
Йод
Астат
3.
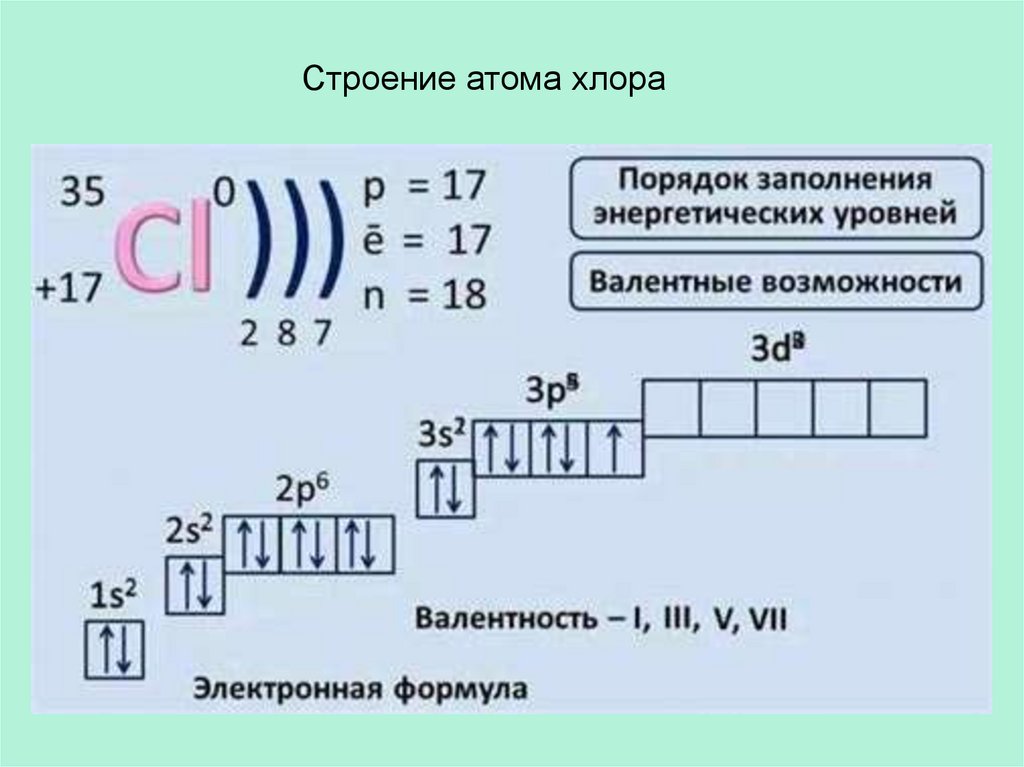
Строение атома хлора4.
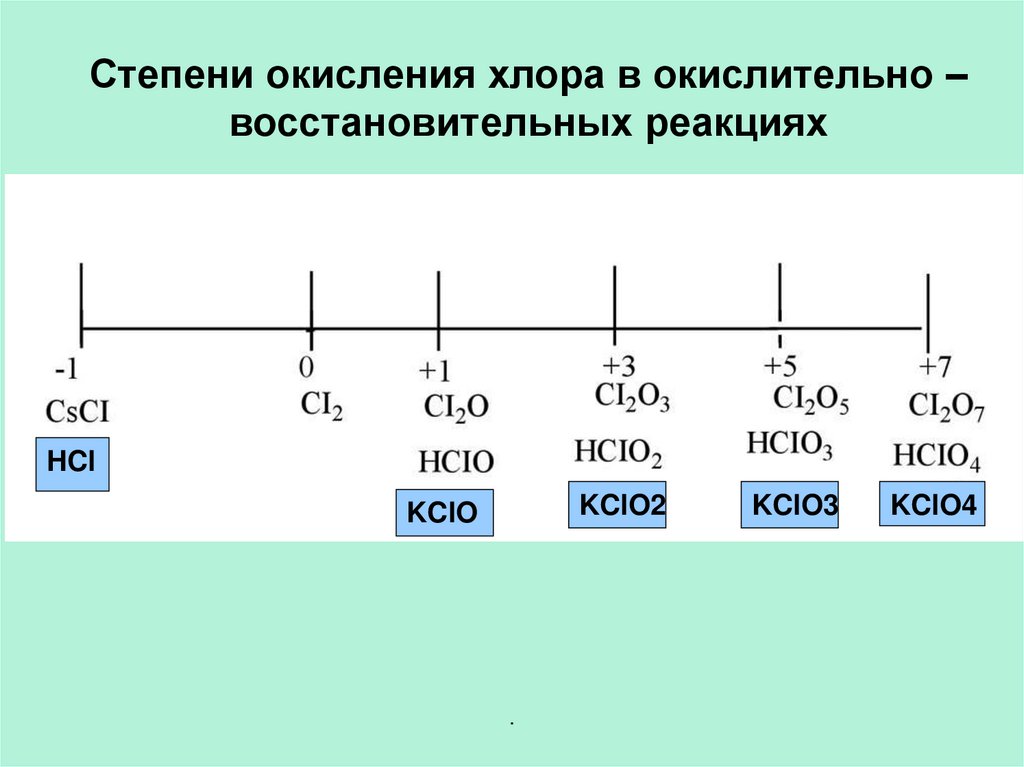
Степени окисления хлора в окислительно –восстановительных реакциях
HCl
KClO2
KClO
.
KClO3
KClO4
5. Химические свойства 45 F2 -наиболее реакционноспособен , реакции идут на холоду, при нагревании – даже с участием Au, Pt.
С простыми веществами:С металлами(в том числе золотом и
платиной.)
2Na + F2 → 2NaF
Mo + 3F2 → MoF6
Со сложными веществами:
2H2O + F2 → 4HF + O2
2KCl + F2 → Cl2 + 2NaF
2KBr + F2 → Br2 + 2КF
2KI + F2 → I2 + 2КF
С неметаллами
H2 + F2 → 2HF
Xe + 2F2 → XeF4
6.
Фтор не может быть растворим в воде, так как энергично разлагаетеѐ.
SiO2 +2 F2 = SiF4 + O2 + 157 ккал
2H2 O + 2F2 = 4 HF + O 2+ 143 ккал
Фтор является самым сильным окислителем.
Непосредственно фтор не реагирует
только с кислородом, азотом и
углеродом (в виде алмаза).
.
7. Химические свойства Cl2 - сильно реакционноспособен (искл. C, O2, N2 и некот. др.)
С простыми веществами:С металлами
С неметаллами
2Fe + 3Cl2 → 2FeCl3
H2 + Cl2 → 2HCl (tº, hυ)
Cu + Cl2 → Cu Cl2
2P + 5Cl2 → 2PCl5 ( tº, в изб. Сl2)
Со сложными веществами:
H2O + Cl2 → HCl+HClO хлорная вода
2NaOH + Cl2 → NaOCl + NaCl + H2O жавелевая вода
2KBr + Cl2 → Br2 + 2КCl
2KI + Cl2 → I2 + 2КCl
8.
Хлор непосредственно взаимодействует со всемипростыми веществами за исключением кислорода, азота и
благородных газов.
Такие неметаллы как фосфор, мышьяк, сурьма и кремний при
высокой температуре реагируют с хлором с выделением
большого количества тепла.
.
9. Химические свойства Br2 - реакционноспособен
С простыми веществами:С металлами
С неметаллами
2Al + 3Br2 → 2AlBr3
H2 + Br2 → 2HCl
Cu + Br2 → Cu Br2
2P + 5Br2 → 2PBr5
Со сложными веществами:
Br2 + H2O → HBr + HBrO бромная вода
2KI + Br2 → I2 + 2КCl
10. Химические свойства I2 - химически наименее активен
С простыми веществами:С металлами
С неметаллами
Hg + I2 → HgI2
H2 + I2 → 2HCl (tº)
2Al + 3I2 → 2AlI3
2P + 3Br2 → 2PI3
Со сложными веществами:
I2 + H2O → HI + HIO
I2 + р-р крахмала → темно-синее окрашивание
11.
Йод с водородом реагируеттолько при достаточно сильном
нагревании, и не полностью, т.к.
начинает идти обратная реакцияразложение жидкого водорода:
H2 + J2 ↔2HJ -12, 7 ккал.
.
12.
Сравнение химических свойствгалогенов показывает, что их
относительная активность
последовательно уменьшается от
фтора к астату.
Этот эффект проявляется в
способности более легких
галогенов в виде
простых веществ окислять галоген
- ионы более тяжелых галогенов:
F2+CI2 2F+CI2
CI2+Br2 2CI+Br2
• все галогены активно взаимодействуют
со всеми простыми веществами.
Особенно быстро и с выделением
большого количества теплоты
• протекает реакция соединения галогенов
с металлами.
• Так, расплавленный металлический
натрий в атмосфере хлора сгорает
ослепительной вспышкой, а на стѐклах
сосуда появляется белый налѐт хлорида
натрия:
2Nа + C12=2Na C1
Br2+2J 2Br+J2
J2+2CIO3 2JO3+CI2
.
13. Физические свойства галогенов
Фтор газ светло–желтого цвета,
обладающий резким
запахом. Ядовит
.
14.
. Хлор – газсветло-зеленого цвета,
также как и фтор имеет
резкий запах. Сильно
ядовит. При повышенном
давлении и комнатной
температуре легко
переходит в жидкое
состояние
15.
.Бром – тяжелая
жидкость красно-бурого
цвета с характерным
неприятным резким
запахом. Жидкий бром, а
также его пары сильно
ядовиты. Бром плохо
растворяется в воде и
хорошо в неполярных
растворителях
16.
. Йод – твердоевещество темно-серого
цвета с металлическим
блеском. Пары йода
имеют фиолетовый цвет.
Йод легко возгоняется,
т.е. переходит в
газообразное состояние
из твердого, при этом
минуя жидкое состояние.
.
17.
• Астат — твёрдоевещество сине-чёрного цвета,
по внешнему виду похожее
на иод. Для него характерно
сочетание свойств неметаллов
(галогенов) и металлов
(полоний, свинец и другие). Как
и иод, астат хорошо
растворяется в органических
растворителях и легко ими
экстрагируется. По летучести
немного уступает иоду, но
также может легко возгоняться.
.
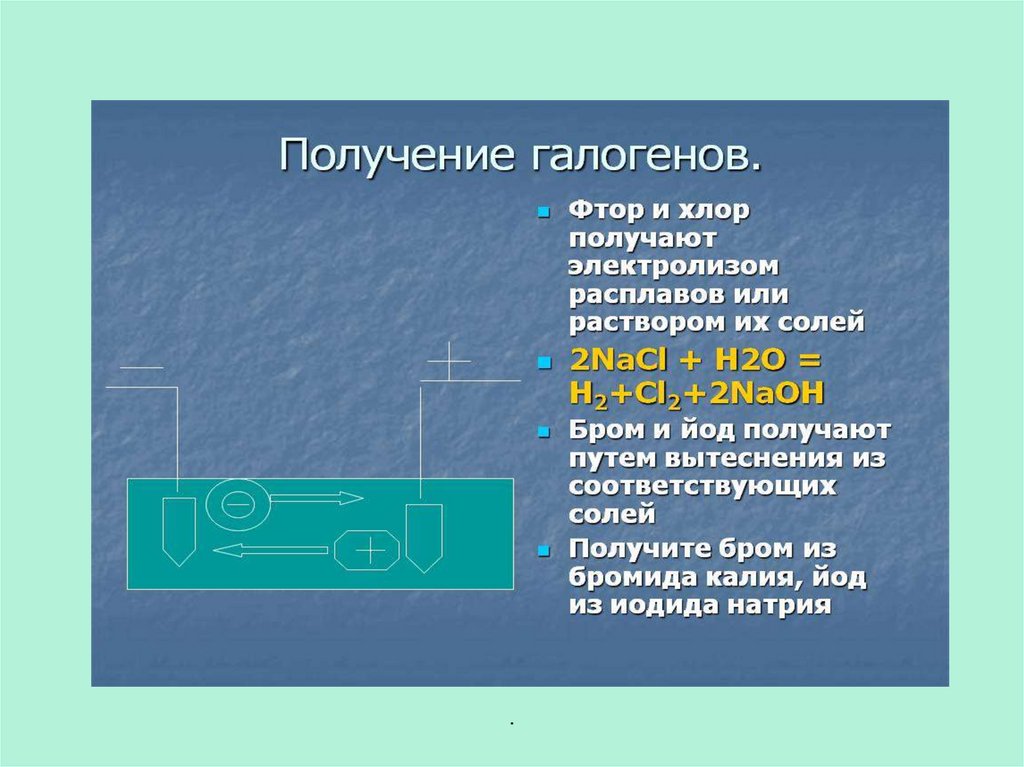
18. Получение галогенов
Галогены можно получить при
электролизе растворов или расплавов
галогенидов:
MgCl2 = Mg + Cl2 (расплав).
Наиболее часто галогены получают по
реакции окисления галогенводородных
кислот:
MnO2 + 4HCl = MnCl2 + Cl2↑ +2H2O;
K2Cr2O7 + 14HCl = 3Cl2↑ + 2KCl
+2CrCl3 +7H2O;
2KMnO4 +16HCl = 2MnCl2 +5Cl2↑
+8H2O +2KCl.
.
19.
20.
.21.
.22.
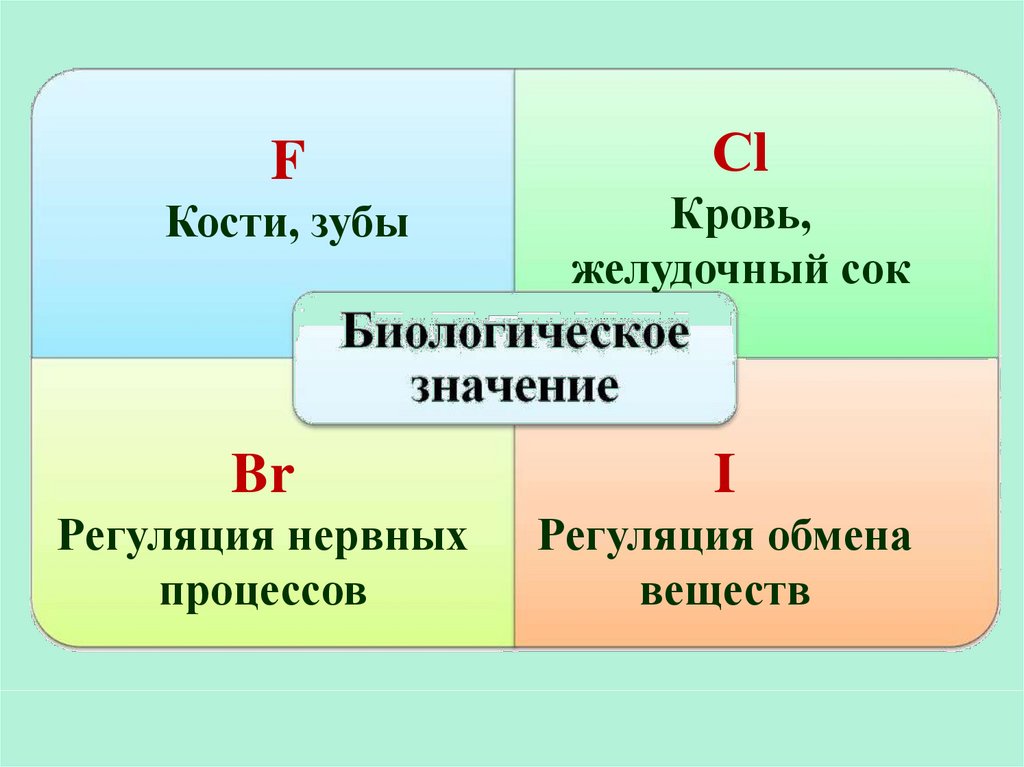
FСl
Кости, зубы
Кровь,
желудочный сок
Br
I
Регуляция нервных
процессов
Регуляция обмена
веществ
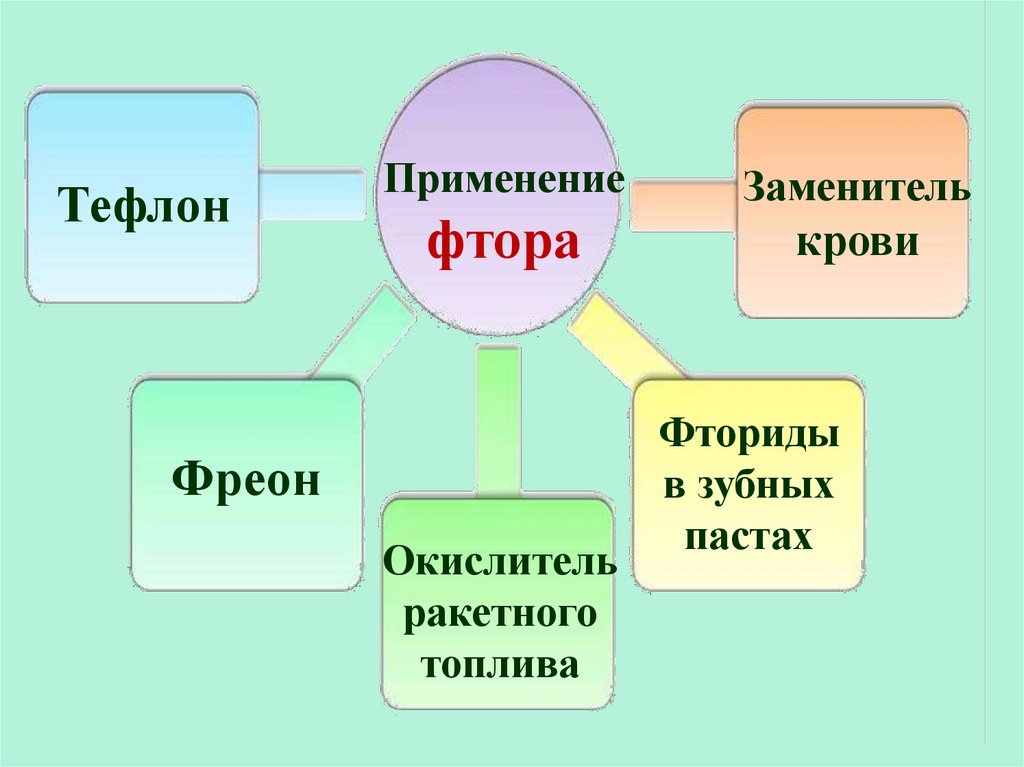
23.
ТефлонПрименение
фтора
Фреон
Окислитель
ракетного
топлива
Заменитель
крови
Фториды
в зубных
пастах
24.
Содержание фтора в организме человекаоколо 10-5% – в костной
ткани, ногтях и зубах. В зубах в виде
фторапатита Ca5(PO4)3F содержится
0,01% фтора.
При избытке фтора повышается хрупкость
костей (флюороз).
У рабочих электролизных цехов
алюминиевых заводов со стажем работы
более 10 лет заболеваемость флюорозом
превышает 10%
Фтор - сильное ядовитое вещество,
вызывает воспаление слизистых
оболочек и сильные, долго незаживающие
ожоги кожи.
Соединения фтора приводят к сильным
отравлениям. Например, при отравлении
фтористым натрием наблюдаются
следующие признаки: рвота, иногда кровью,
понос, сильное возбуждение, порезы мышц,
судороги, паралич дыхательного
центра.
Оказание первой помощи: промывание
желудка, солевое слабительное,
известковая вода, и обратится к врачу!
.
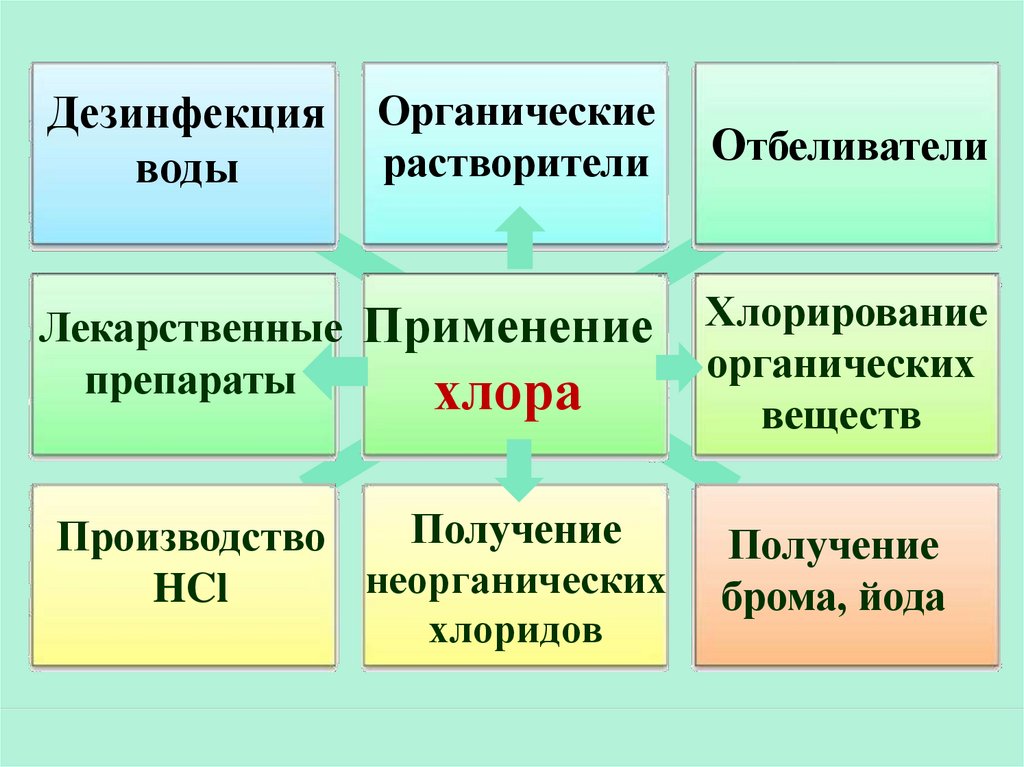
25.
Органическиерастворители
Отбеливатели
Лекарственные Применение
препараты
хлора
Хлорирование
органических
веществ
Получение
Производство
неорганических
HCl
хлоридов
Получение
брома, йода
Дезинфекция
воды
26.
Содержание хлора в организме человекаоколо 0,15%.
Массовая доля соляной кислоты в
желудочном соке (рН 1÷3) около 0,3%. Она
необходима для перехода фермента пепсина
в активную форму.
Хлорид-анион участвует вместе с катионами
калия и натрия в солевом обмене между
клетками и межклеточными тканями.
Суточная потребность в хлориде натрия – 510 г.
Это сильное ядовитое вещество. При
вдыхании паров вызывает ожог
слизистых дыхательных путей, кашель,
удушье, боли в груди и в глазах,
слезотечение, отѐк легких, ослабление
сердца. При приеме внутрь – рвота, боли в
желудке, мокрота, спазм голосовой
щели..
Первая помощь: вдыхание кислорода,
вдыхать тѐплые водяные пары с
нашатырьным спиртом. Полный покой,
постельный режим. При попадании в
глаз – промывание 2% раствором соды и
обратится к врачу.
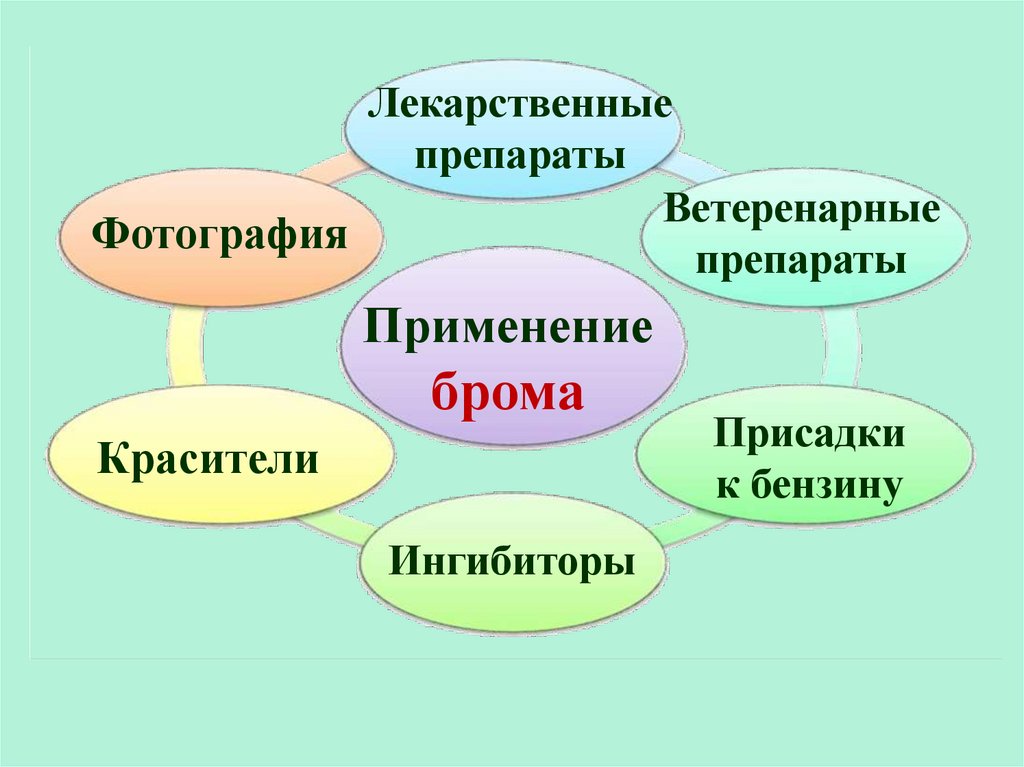
27.
Лекарственныепрепараты
Ветеренарные
Фотография
препараты
Применение
брома
Красители
Ингибиторы
Присадки
к бензину
28.
23.12.2025Содержание брома в организме человека
10-5% – преимущественно в
гипофизе. Бромид-анионы накапливаются в
мозге и действуют
успокаивающе. В 1910 г. один из учеников
И.П.Павлова, П.М.Никифоровский,
установил в опытах на собаках, что
бромиды не снижают возбудимость, а
усиливают торможение.
Бром - ядовитое вещество. При вдыхании
паров брома: насморк, кашель,
удушье, явление бронхита и
бронхопневмонии, слезотечение,
конъюктивит.
Слизистая рта и языка имеет коричневый
цвет. При внутреннем приеме: боли
в животе, рвота и понос.
Первая помощь: вдыхать водяные пары с
небольшой примесью нашатырного спирта,
ингаляции с содовым раствором. При
отравлении через рот – промывание желудка
0,5% раствором тиосульфата
натрия.
Сафиканов А.Ф.
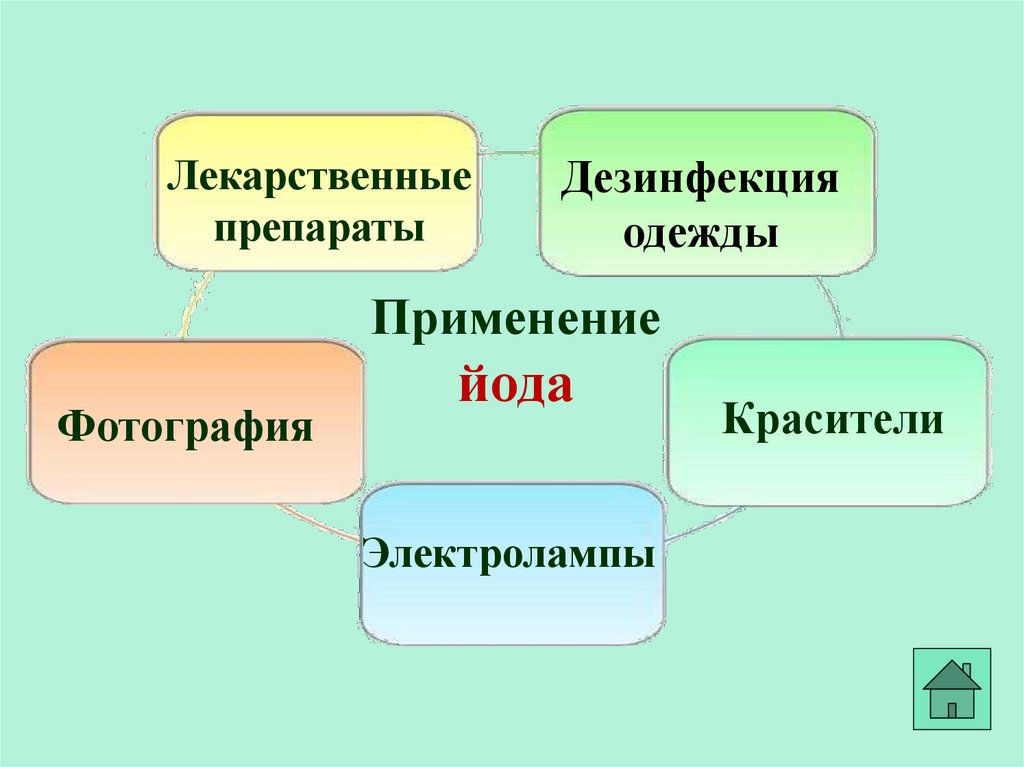
29.
Лекарственныепрепараты
Дезинфекция
одежды
Применение
Фотография
йода
Электролампы
Красители
30.
Йод - ядовитое вещество. Симптомыострого отравления: бурое окрашивание
языка и слизистой оболочки рта, рвота
бурыми и синими
массами, понос, головная боль, насморк,
кожная сыпь. В тяжелых случаях - судороги,
коматозное состояние.
Помощь при отравлениях: промывание
желудка 0,5% раствором тиосульфата
натрия, внутрь 20-30г активированного угля
в водной взвеси. Промывать, прополоскать,
нос, рот, глотку 2% раствором
двууглекислого натрия.
Больше половины содержащегося в
человеке иода (всего 4*10-5%) находится в
щитовидной железе – в составе гормонов
тироксина и
трииодтиронина. В небольших дозах
регулирует работу щитовидной железы. При
недостатке йода возникает базедова болезнь.
Йод применяют для йодной настойки(5%
раствора йода в спирте,) йодид калия
используют в медицине, аналитической
химии, а йодид серебра – при изготовлении






















 Химия
Химия








