Похожие презентации:
Tsikloalkany_-areny_1hAMkQ
1.
Циклические углеводороды: циклоалканы, ареныЦиклические углеводороды. Физические свойства, нахождение в природе,
состав, строение, теория напряжения Байера. Конформации циклогексана.
Аксиальные и экваториальные заместители.
Сравнение химических свойств с алканами и алкенами. Реакции
присоединения и замещения для циклоалканов. Влияние строения и
условий протекания реакций.
Арены. Физические свойства, нахождение в природе, состав, строение,
номенклатура. Энергия резонанса при образовании ароматической системы.
Правило ароматичности (правило Хюккеля). Реакции электрофильного
замещения в ароматическом ядре. Роль кислот Льюиса в реакциях
электрофильного замещения. Ориентанты первого и второго рода. Влияние
заместителей и условий протекания на продукты реакции. Механизм
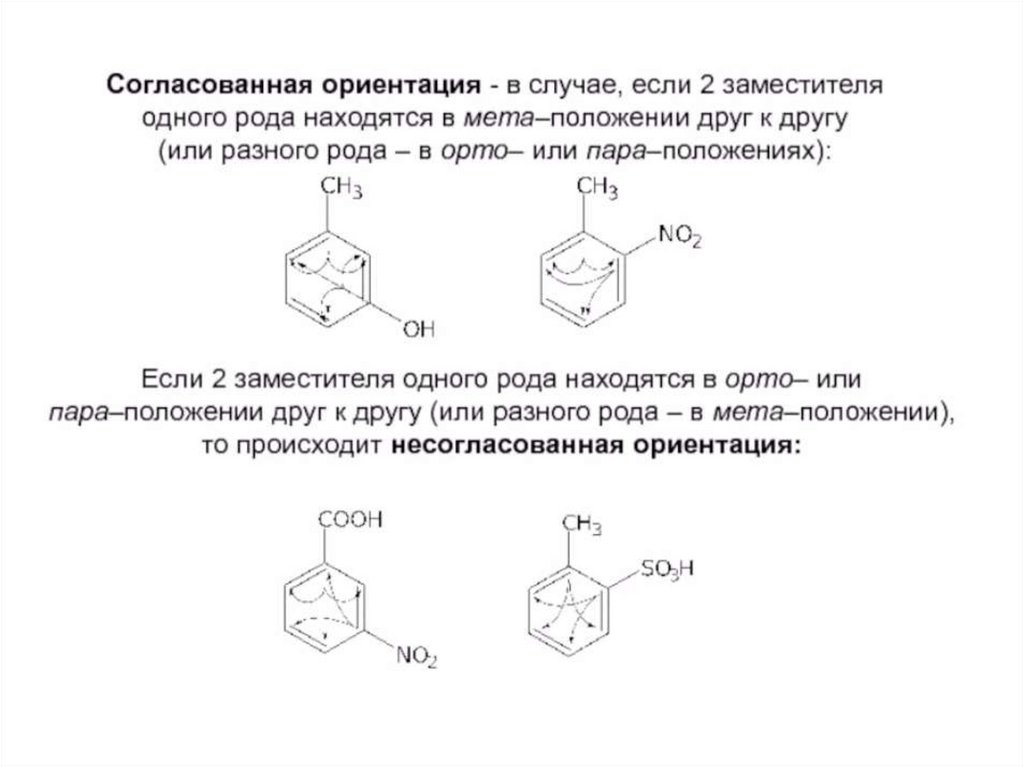
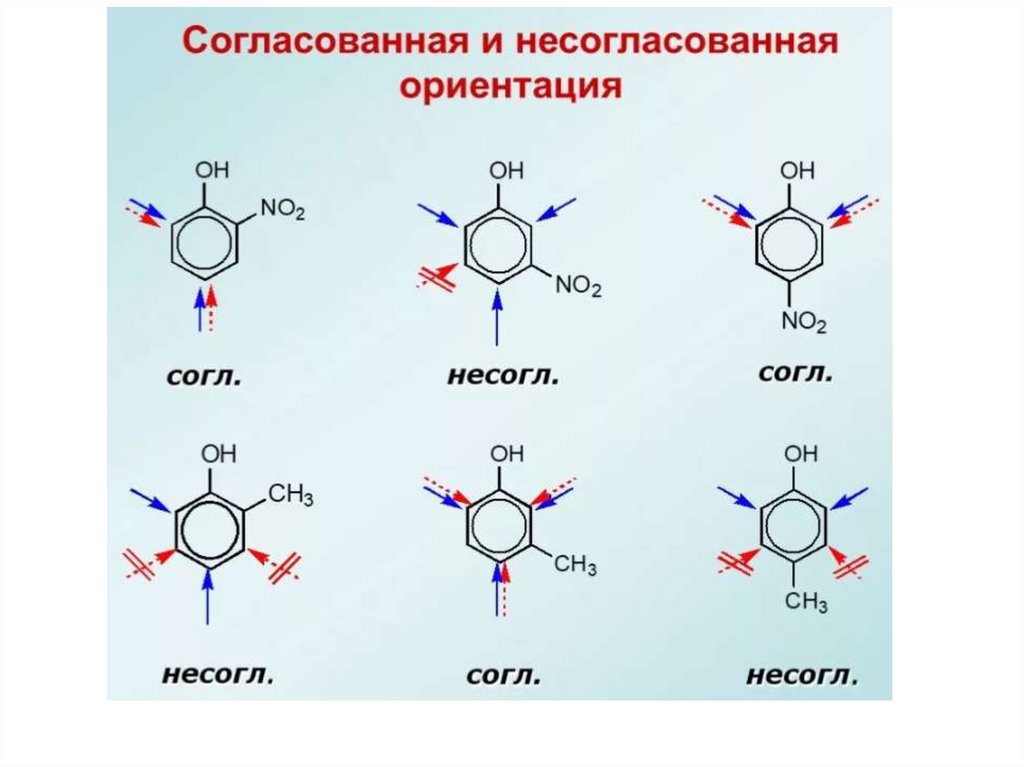
ориентирующего действия. Согласованная и несогласованная ориентация.
Реакции гомологов бензола. Замещение в боковой цепи, условия, механизм.
Реакция хлорирования бензола.
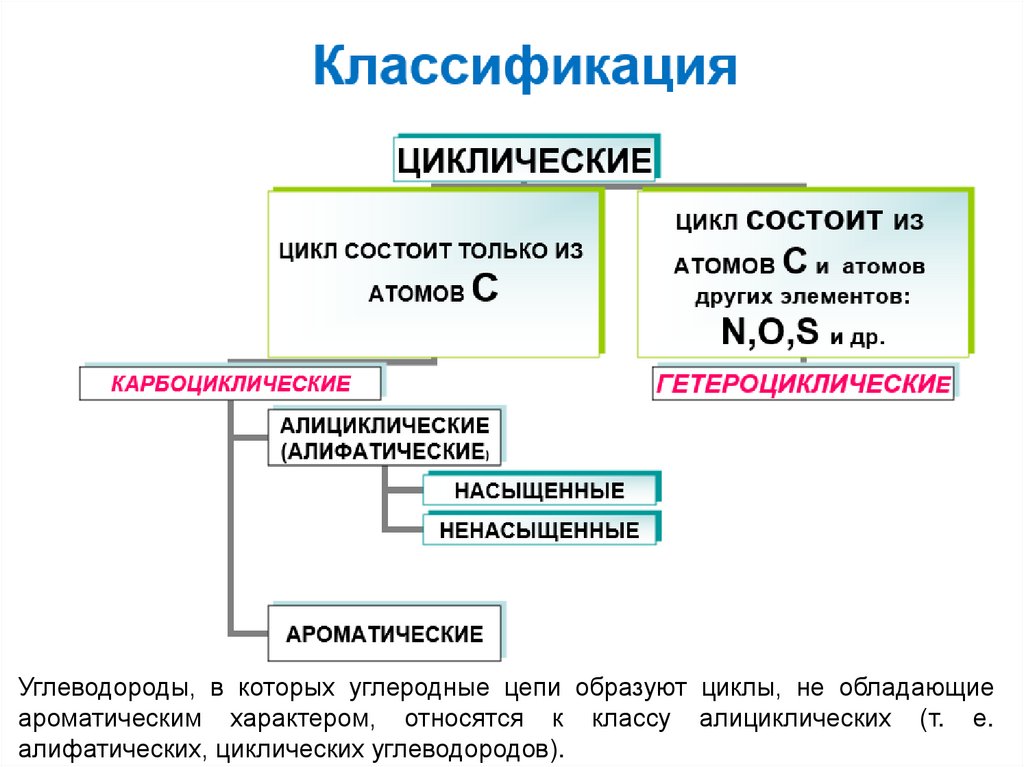
2. Классификация
Углеводороды, в которых углеродные цепи образуют циклы, не обладающиеароматическим характером, относятся к классу алициклических (т. е.
алифатических, циклических углеводородов).
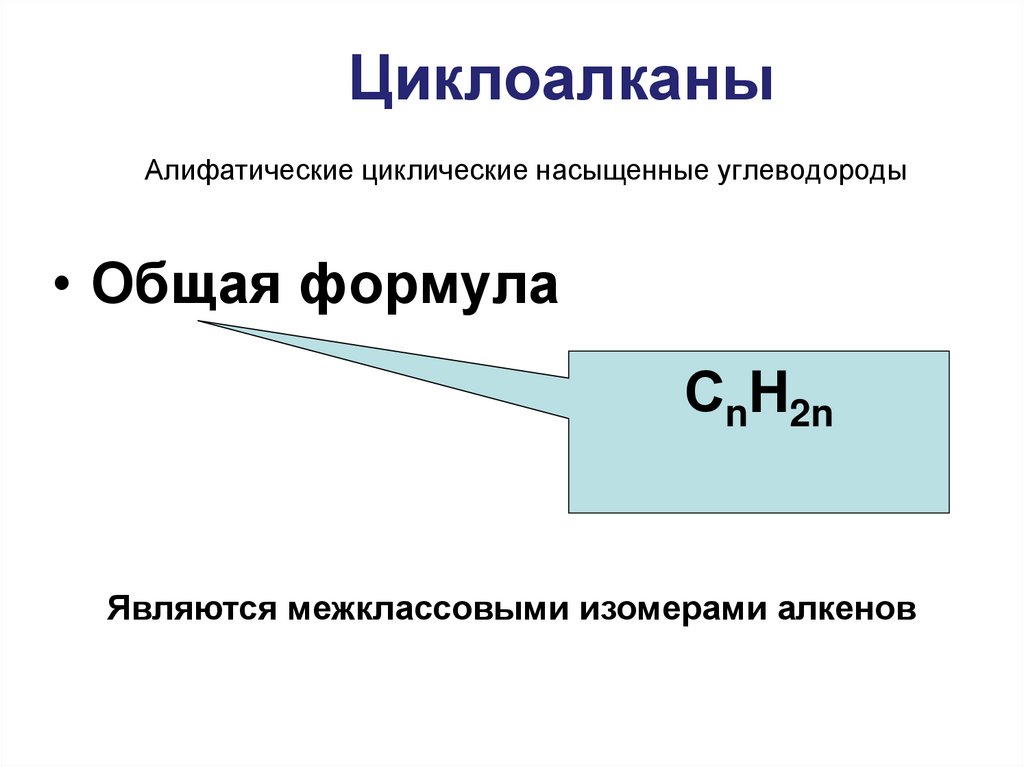
3. Алифатические циклические насыщенные углеводороды
ЦиклоалканыАлифатические циклические насыщенные углеводороды
• Общая формула
СnH2n
Являются межклассовыми изомерами алкенов
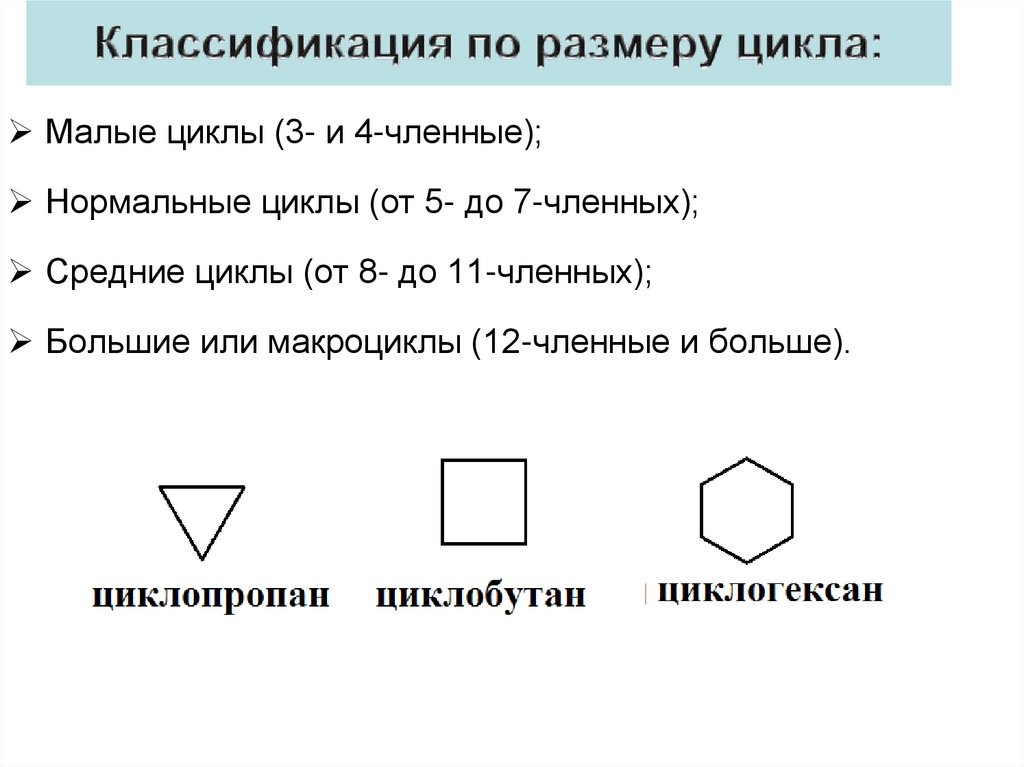
4.
Малые циклы (3- и 4-членные);Нормальные циклы (от 5- до 7-членных);
Средние циклы (от 8- до 11-членных);
Большие или макроциклы (12-членные и больше).
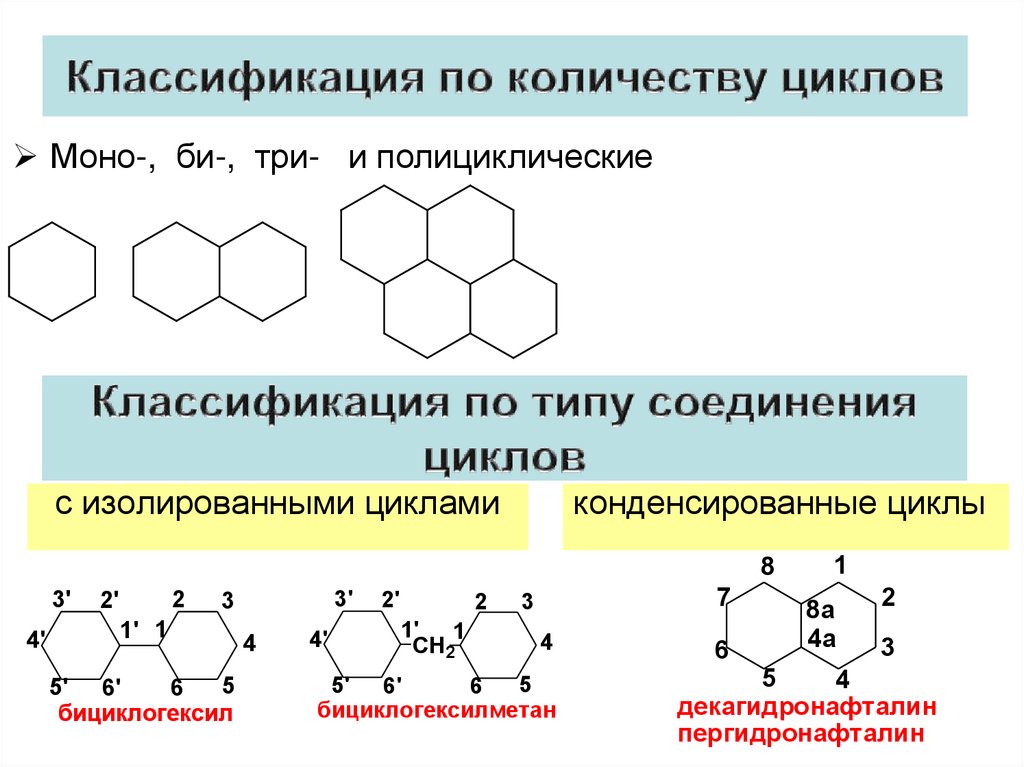
5.
Моно-, би-, три- и полициклическиес изолированными циклами
конденсированные циклы
8
3'
4'
2
2'
3'
3
1' 1
5
5' 6'
6
бициклогексил
4
4'
2'
2
1' 1
CH2
7
3
4
5
5' 6'
6
бициклогексилметан
6
1
8a
4a
2
3
5
4
декагидронафталин
пергидронафталин
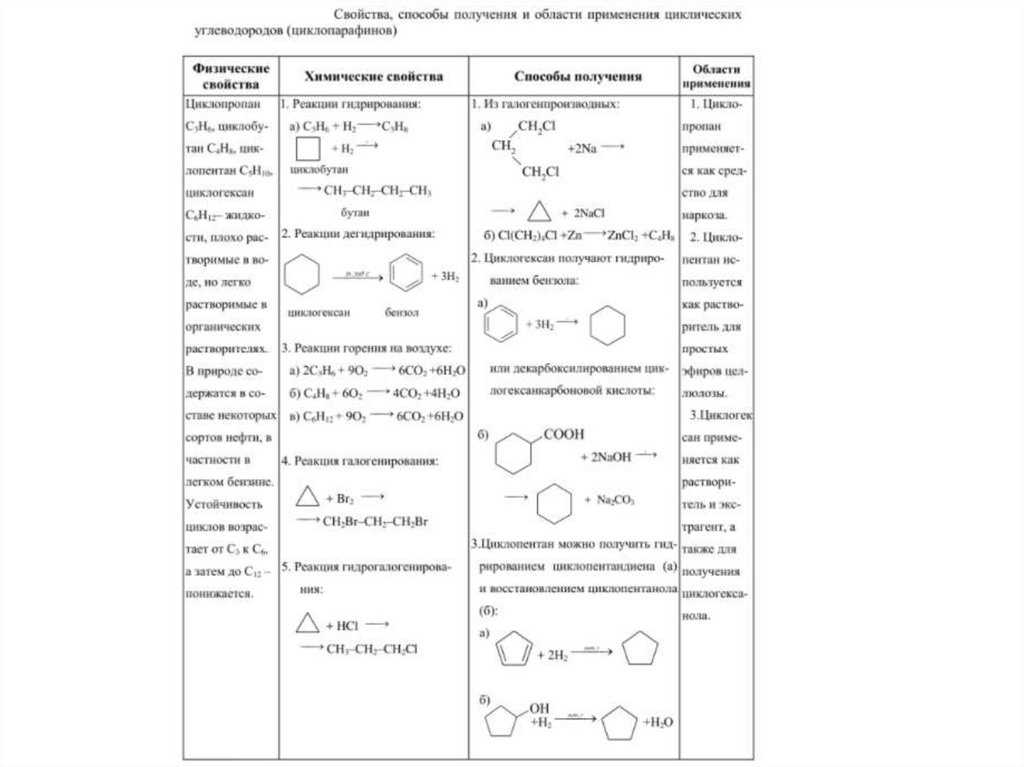
6. Физические свойства
При обычных условиях:• С3, С4 – газы;
• С5-С16 – жидкости;
• С17 и выше – твердые вещества.
• Температуры плавления и кипения
выше, чем у алканов.
7. Получение
1) циклизация дигалогенопроизводных углеводородов:а) при действии цинка в среде этанола, на соответствующее
дигалогенопроизводное,
цепь
углеродных
атомов
замыкается, приводя к циклоалкану (Гавриил Гавриилович
Густавсон (1843-1908))
б) при действии амальгамы лития на 1,4-дибромбутан
8.
2) гидрогенизация ароматических соединенийФизические свойства
Циклоалканы
имеют
более
высокие
температуры плавления, кипения и большую
плотность, чем соответствующие алканы. При
одинаковом составе температура кипения
циклопарафина тем выше, чем больше размер
цикла. Циклоалканы в воде практически не
растворимы, однако растворимы в органических
растворителях.
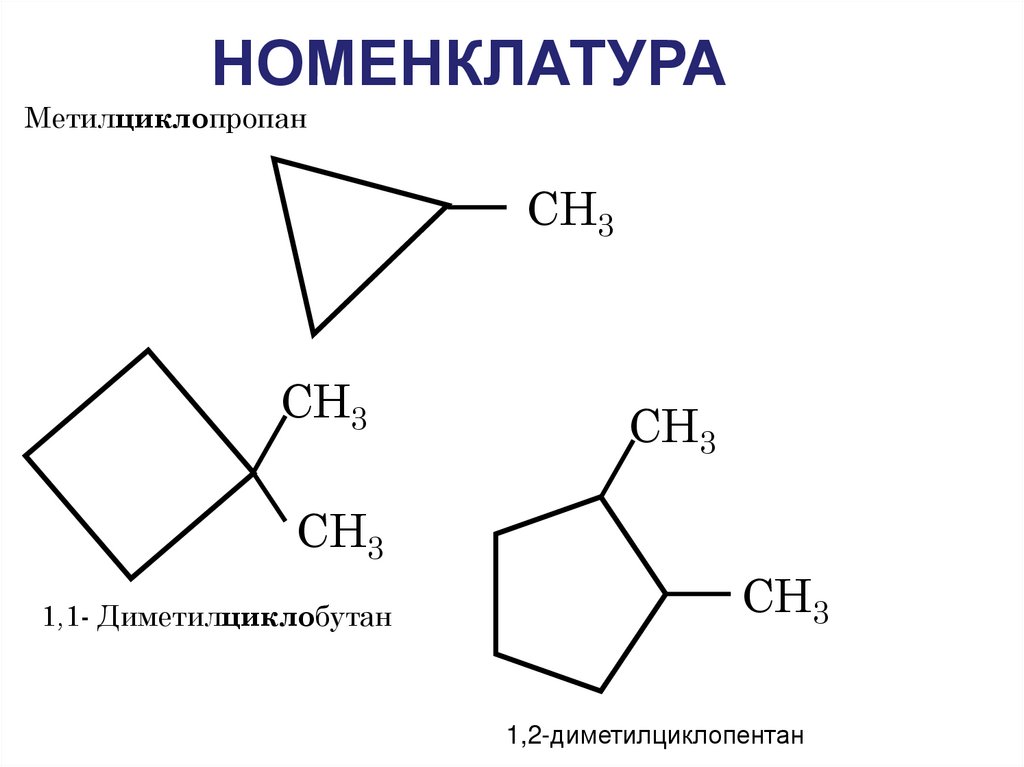
9. НОМЕНКЛАТУРА
МетилциклопропанСН3
СН3
СН3
СН3
1,1- Диметилциклобутан
СН3
1,2-диметилциклопентан
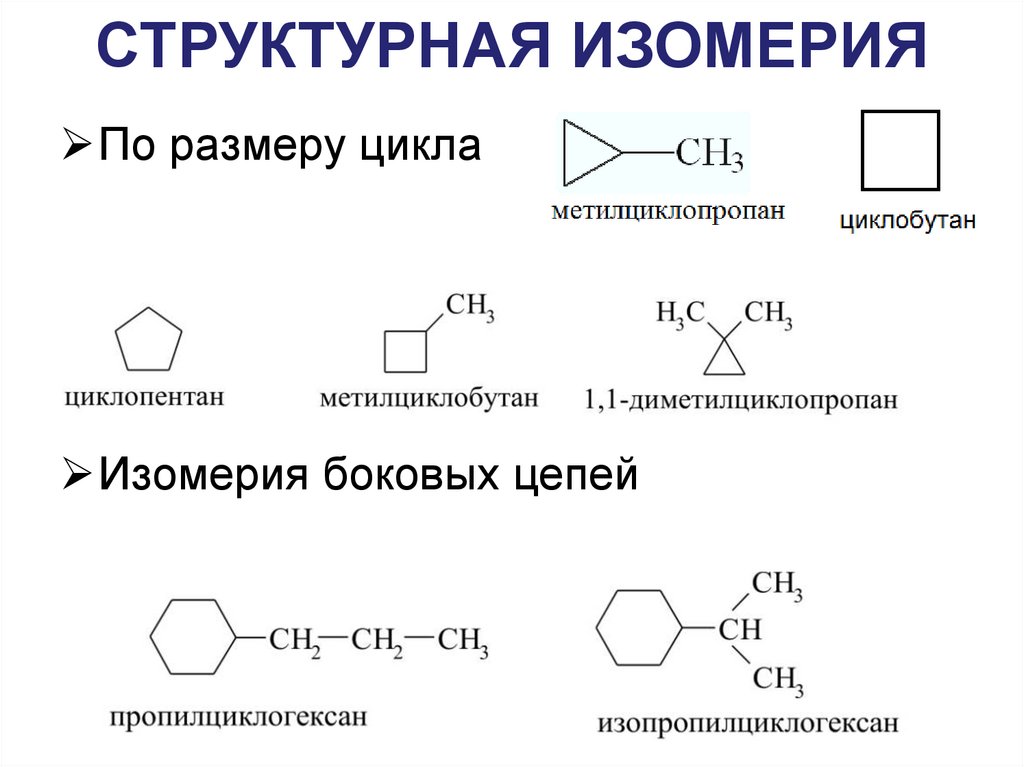
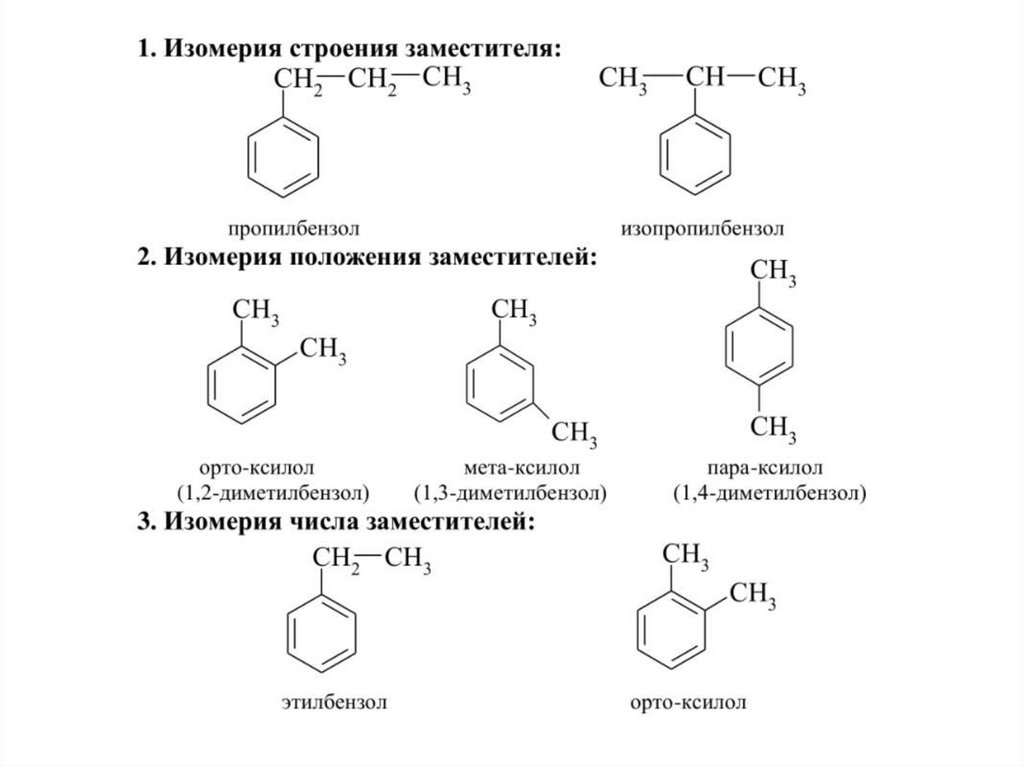
10. СТРУКТУРНАЯ ИЗОМЕРИЯ
По размеру циклаИзомерия боковых цепей
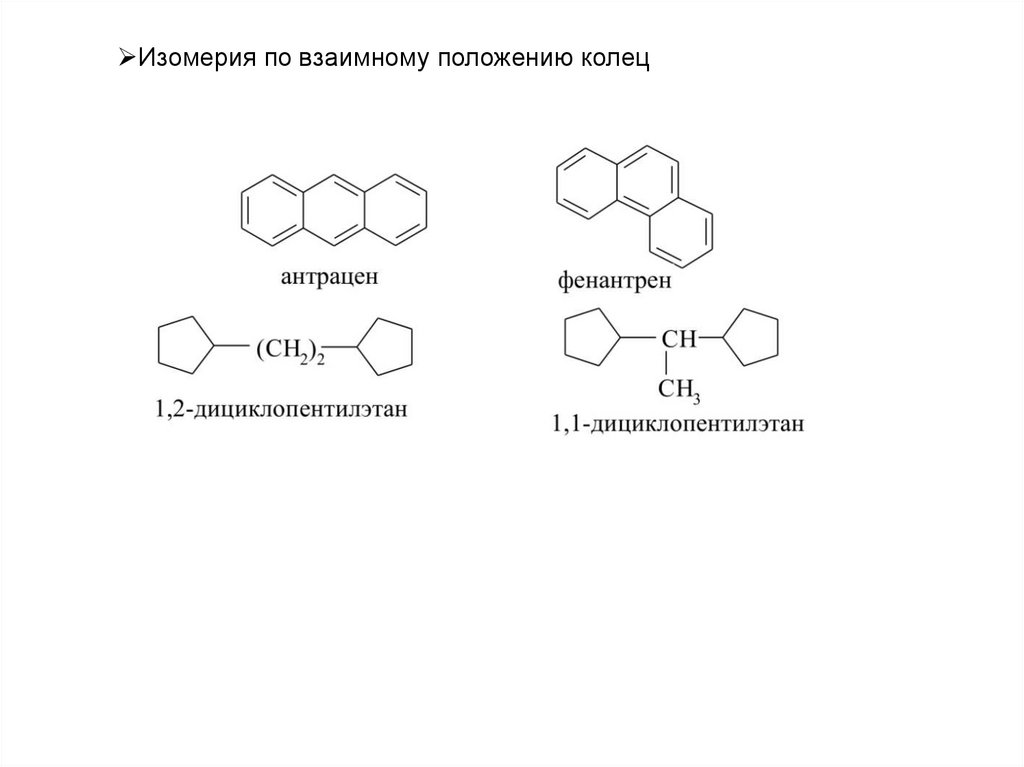
11.
Изомерия по взаимному положению колец12.
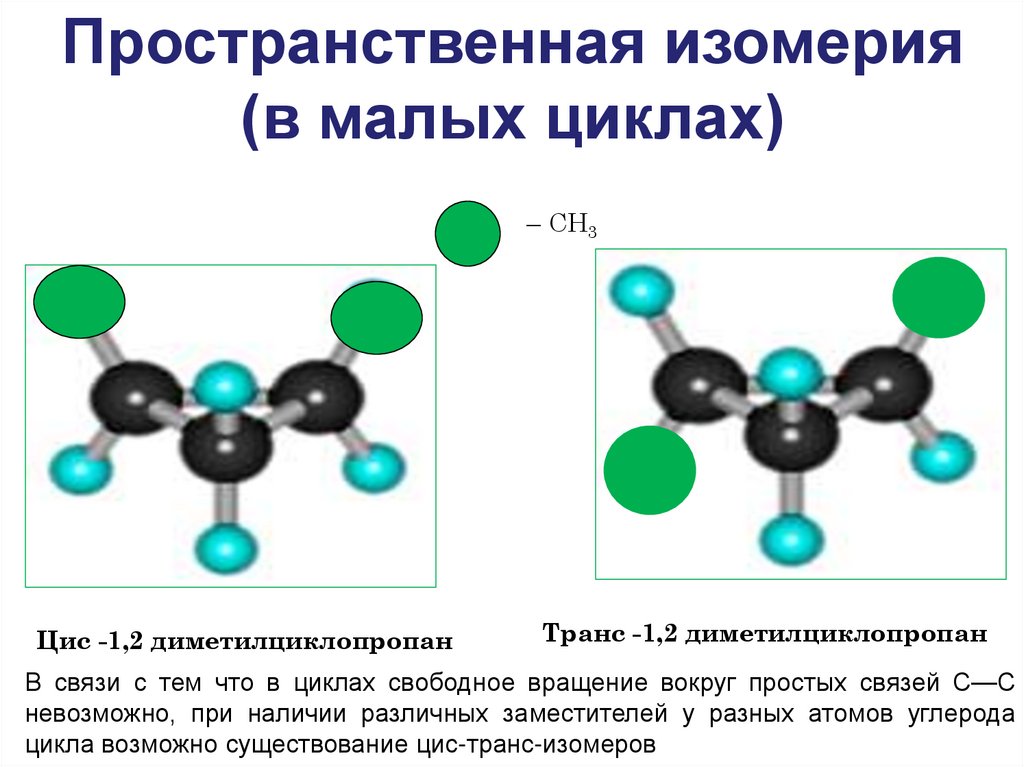
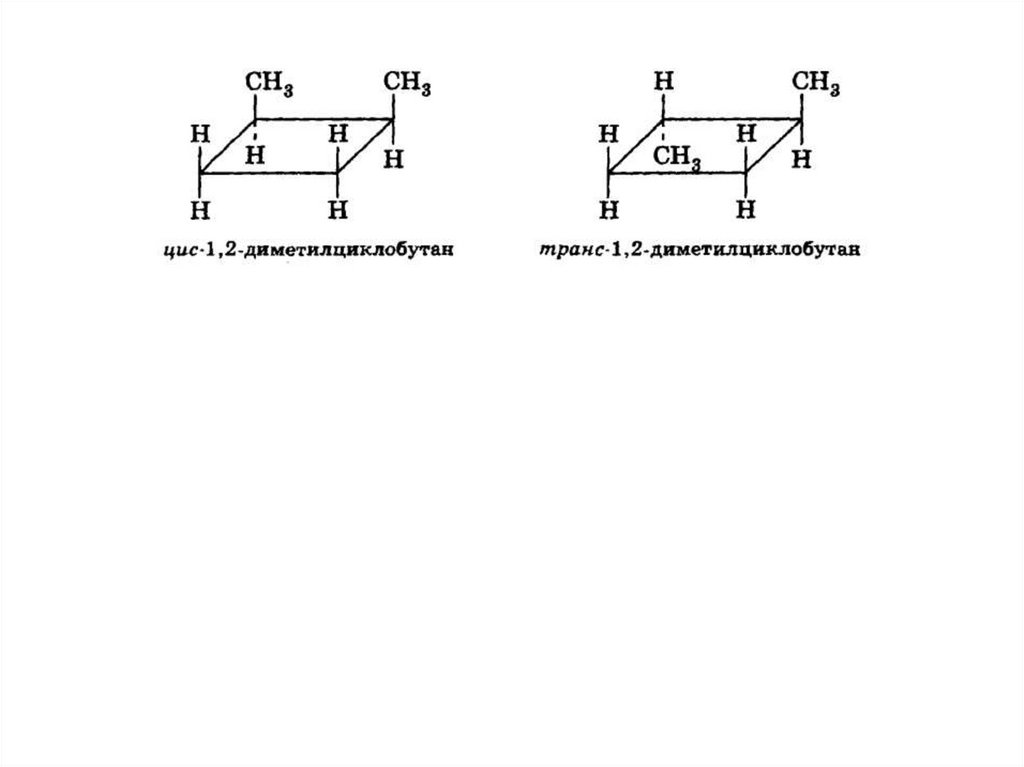
Пространственная изомерия(в малых циклах)
– СН3
Цис -1,2 диметилциклопропан
Транс -1,2 диметилциклопропан
В связи с тем что в циклах свободное вращение вокруг простых связей С—С
невозможно, при наличии различных заместителей у разных атомов углерода
цикла возможно существование цис-транс-изомеров
13.
14.
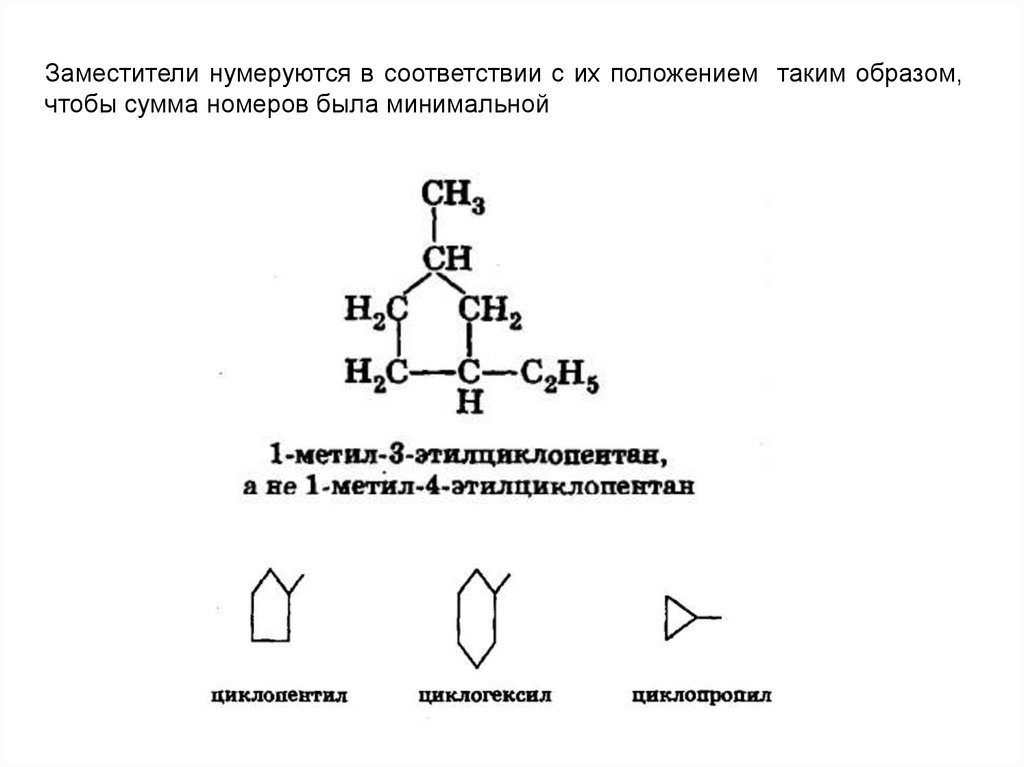
Заместители нумеруются в соответствии с их положением таким образом,чтобы сумма номеров была минимальной
15.
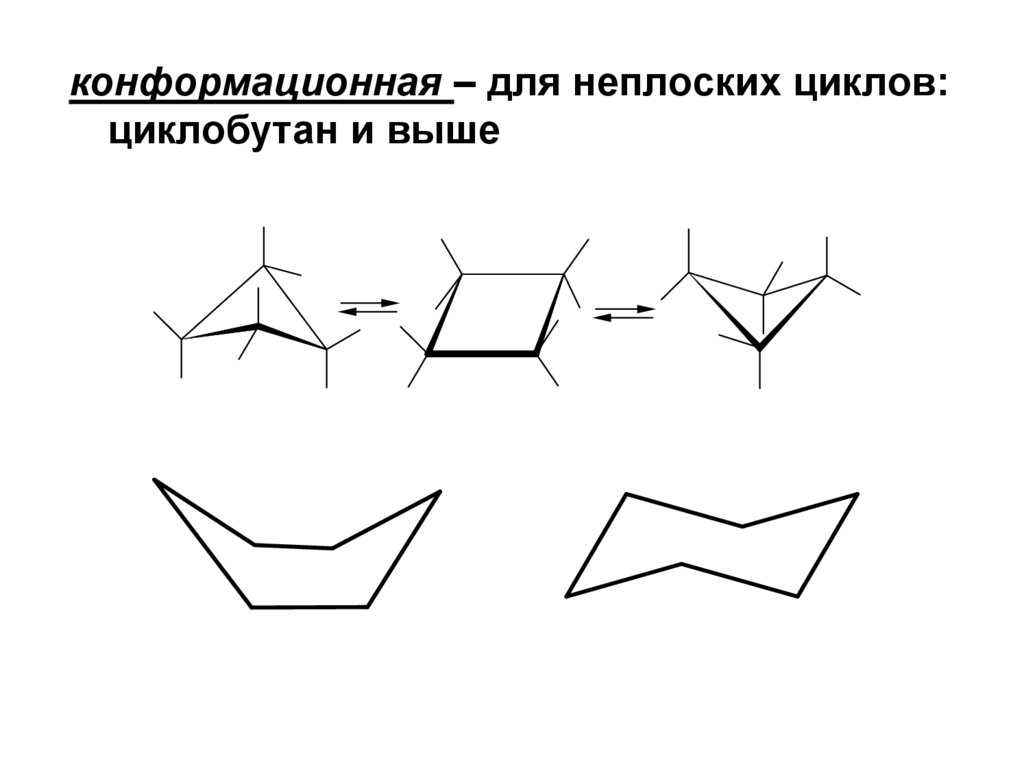
конформационная – для неплоских циклов:циклобутан и выше
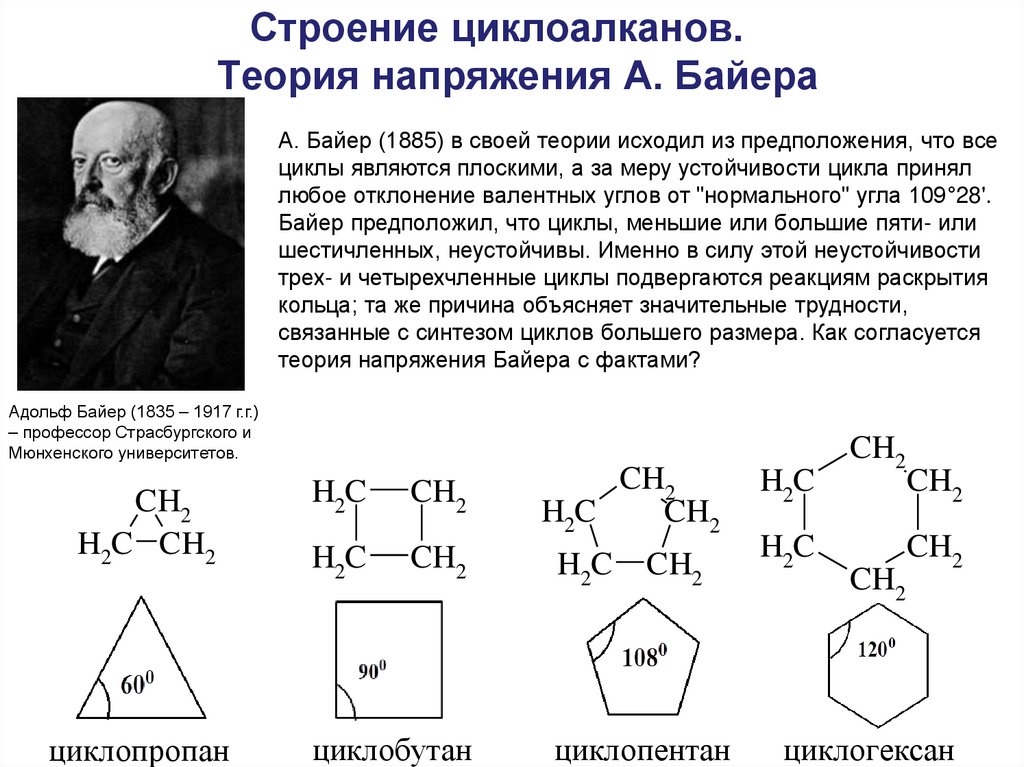
16. Строение циклоалканов. Теория напряжения А. Байера
А. Байер (1885) в своей теории исходил из предположения, что всециклы являются плоскими, а за меру устойчивости цикла принял
любое отклонение валентных углов от "нормального" угла 109°28'.
Байер предположил, что циклы, меньшие или большие пяти- или
шестичленных, неустойчивы. Именно в силу этой неустойчивости
трех- и четырехчленные циклы подвергаются реакциям раскрытия
кольца; та же причина объясняет значительные трудности,
связанные с синтезом циклов большего размера. Как согласуется
теория напряжения Байера с фактами?
Адольф Байер (1835 – 1917 г.г.)
– профессор Страсбургского и
Мюнхенского университетов.
CH2
H2C CH2
циклопропан
H2C
CH2
CH2
H2C
CH2
H2C
CH2
H2C
циклобутан
CH2
циклопентан
H2C
H2C
CH2
CH2
CH2
CH2
циклогексан
17.
Прочность (напряженность) циклов зависит от числа атомов,участвовавших в кольце и эта закономерность объяснена
теорией напряжения Адольфа Байера.
Прочность цикла определяется его степенью напряженности, обусловленной
изменением валентных углов образующих его атомов и отклонением связей
этих атомов от нормального направления. В кольце циклопропана все
образующие его атомы лежат в одной плоскости и углы между направлениями
валентных связей равны 60о (как в правильном треугольнике).
В циклобутане эти углы равны 90о (как в правильном четырехугольнике), а в
циклопентане 108о (как в правильном пятиугольнике).
Так как нормальный валентный угол атома углерода равен 109о28’ , можно
вычислить величину уменьшения валентных углов атомов углерода,
образующих циклы.
Так как при уменьшении валентного угла от нормального направления
отклоняются обе образующие его валентности, можно, разделив на 2
полученные выше разности, рассчитать величину угла отклонения каждой
валентной связи.
18.
Так как при уменьшении валентного угла от нормального направленияотклоняются обе образующие его валентности, можно, разделив на 2
полученные выше разности, рассчитать величину угла отклонения каждой
валентной связи.
Наибольшее отклонение валентных связей претерпевают
атомы углерода в трехчленном кольце циклопропана; меньшее,
но все же значительное – в четырехчленном кольце
циклобутана. В пятичленном кольце циклопентана отклонение
каждой валентной связи очень невелико. Поэтому кольца
циклопропана и циклобутана сильно напряжены и непрочны.
В реакции они сравнительно легко разрываются, образуя
соединения с открытой цепью. Кольцо циклопентана
напряжено незначительно и поэтому прочно.
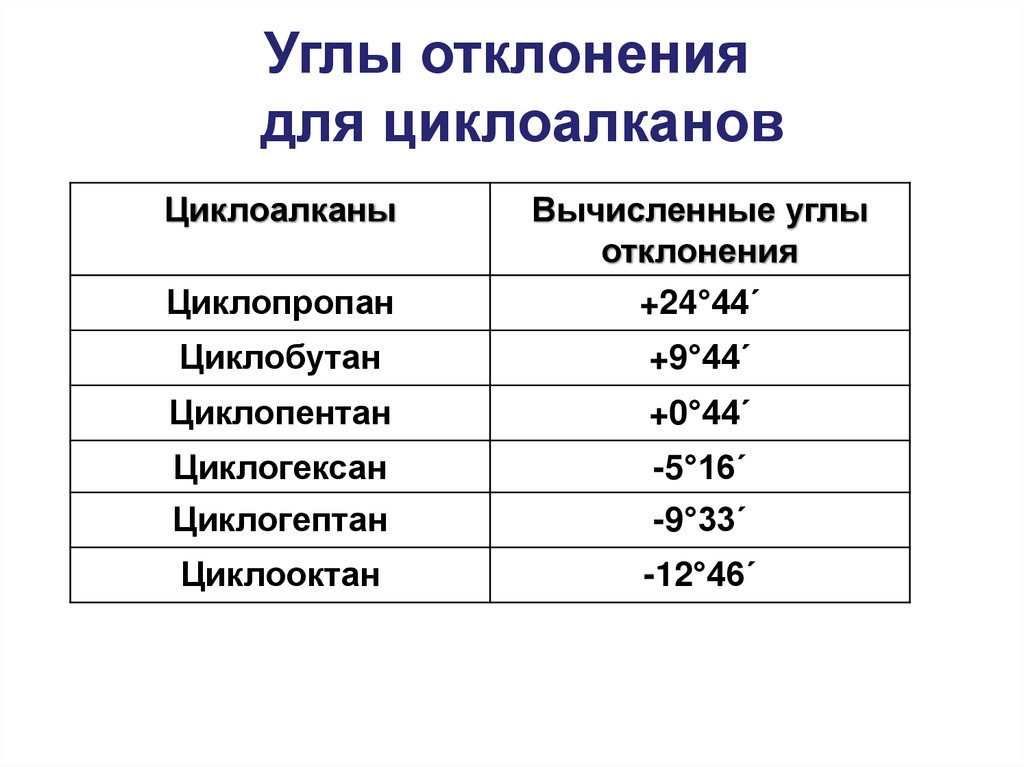
19. Углы отклонения для циклоалканов
ЦиклоалканыВычисленные углы
отклонения
Циклопропан
+24°44΄
Циклобутан
+9°44΄
Циклопентан
+0°44΄
Циклогексан
-5°16΄
Циклогептан
-9°33΄
Циклооктан
-12°46΄
20.
Теплоты сгорания и относительная стабильность циклоалкановТеплота сгорания — это количество тепла, выделяющееся при сгорании 1 моля
соединения до двуокиси углерода и воды. Как и теплоты гидрирования, теплоты
сгорания часто могут дать полезную информацию об относительной
устойчивости органических соединений. Соответствуют ли данные по теплотам
сгорания различных циклоалканов предположению Байера о малой
устойчивости циклов меньшего или большего размера, чем циклопентан или
циклогексан?
Рассмотрение данных для большого числа соединений показывает, что теплоты
сгорания алифатических углеводородов довольно неплохо согласуются с
величинами, рассчитанными на основании характеристических вкладов каждой
из структурных единиц молекулы. Для ациклических алканов вклад каждого
метиленового звена (—СН2—) в суммарную теплоту сгорания составляет
примерно 157,4 ккал/моль (659,0 103 Дж/моль).
CmHn + (m + n/4) O2 = mCO2 + (n/2) Н2O + Q
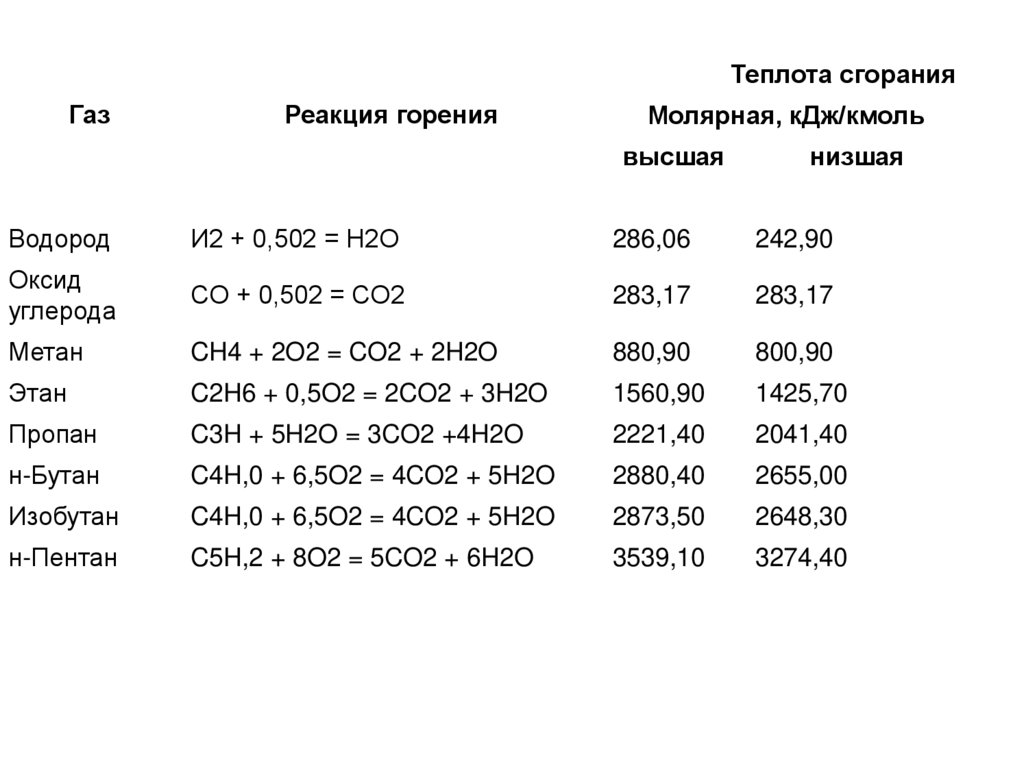
21.
Теплота сгоранияГаз
Реакция горения
Молярная, кДж/кмоль
высшая
низшая
Водород
И2 + 0,502 = H2O
286,06
242,90
Оксид
углерода
CО + 0,502 = CO2
283,17
283,17
Метан
CH4 + 2O2 = CO2 + 2H2O
880,90
800,90
Этан
C2H6 + 0,5O2 = 2CO2 + 3H2O
1560,90
1425,70
Пропан
C3H + 5H2O = 3CO2 +4H2O
2221,40
2041,40
н-Бутан
C4H,0 + 6,5O2 = 4CO2 + 5H2O
2880,40
2655,00
Изобутан
C4H,0 + 6,5O2 = 4CO2 + 5H2O
2873,50
2648,30
н-Пентан
C5H,2 + 8O2 = 5CO2 + 6H2O
3539,10
3274,40
22.
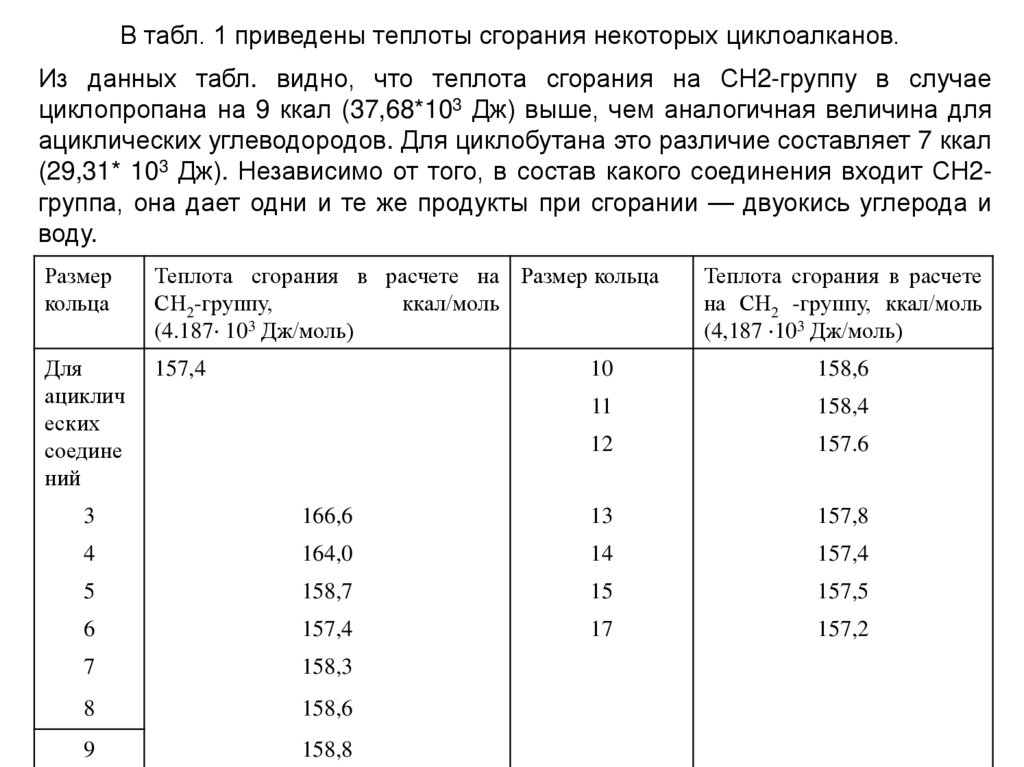
В табл. 1 приведены теплоты сгорания некоторых циклоалканов.Из данных табл. видно, что теплота сгорания на СН2-группу в случае
циклопропана на 9 ккал (37,68*103 Дж) выше, чем аналогичная величина для
ациклических углеводородов. Для циклобутана это различие составляет 7 ккал
(29,31* 103 Дж). Независимо от того, в состав какого соединения входит СН2группа, она дает одни и те же продукты при сгорании — двуокись углерода и
воду.
Размер
кольца
Теплота сгорания в расчете на Размер кольца
СН2-группу,
ккал/моль
(4.187 103 Дж/моль)
Для
ациклич
еских
соедине
ний
157,4
Теплота сгорания в расчете
на СН2 -группу, ккал/моль
(4,187 103 Дж/моль)
10
158,6
11
158,4
12
157.6
3
166,6
13
157,8
4
164,0
14
157,4
5
158,7
15
157,5
6
157,4
17
157,2
7
158,3
8
158,6
9
158,8
23.
Мера напряженности цикла обусловливает легкость или трудность образованияцикла и его относительную устойчивость. По Байеру, наиболее устойчивым
должен быть пятичленный цикл, а следующим по устойчивости —
шестичленный. Четырехчленный и семичленный циклы должны обладать
меньшей и почти одинаковой степенью устойчивости. Высшие же циклы
должны быть все менее и менее устойчивыми. В дальнейшем оказалось, что
этот вывод неверен.
!!! Шестичленный цикл прочнее пятичленного, не наблюдается
увеличения напряжения и в макроциклах, что связано с
НЕПЛОСКИМ СТРОЕНИЕМ циклов.
Если кольца большого размера устойчивы, почему же их трудно синтезировать?
Здесь мы подошли ко второму неверному допущению Байера. Тот факт, что
соединение трудно синтезировать, совсем не означает, что оно неустойчиво.
Замыкание кольца требует, чтобы два конца цепи были достаточно сближены
друг с другом для того, чтобы образовалась связь. Чем больше размер кольца,
которое нужно синтезировать, тем более длинной будет цепь, из которой его
получают, и тем меньше вероятность сближения двух концов этой цепи. В этих
условиях более вероятно сближение концов двух различных цепей, что дает
совершенно другие продукты.
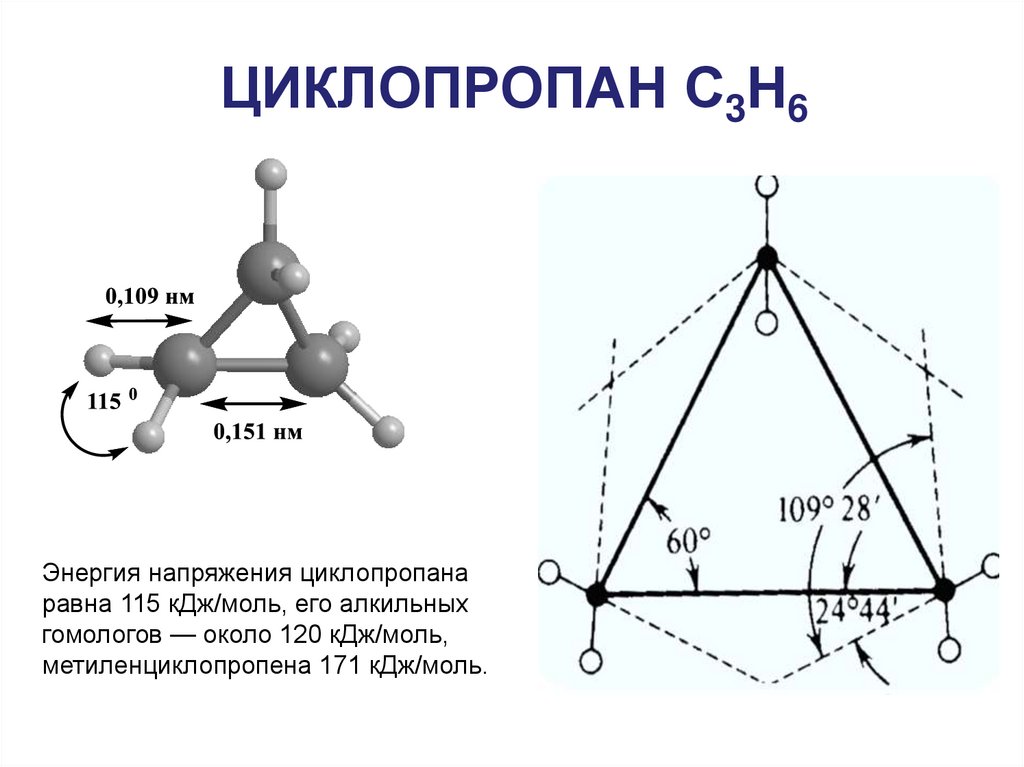
24. ЦИКЛОПРОПАН С3Н6
Энергия напряжения циклопропанаравна 115 кДж/моль, его алкильных
гомологов — около 120 кДж/моль,
метиленциклопропена 171 кДж/моль.
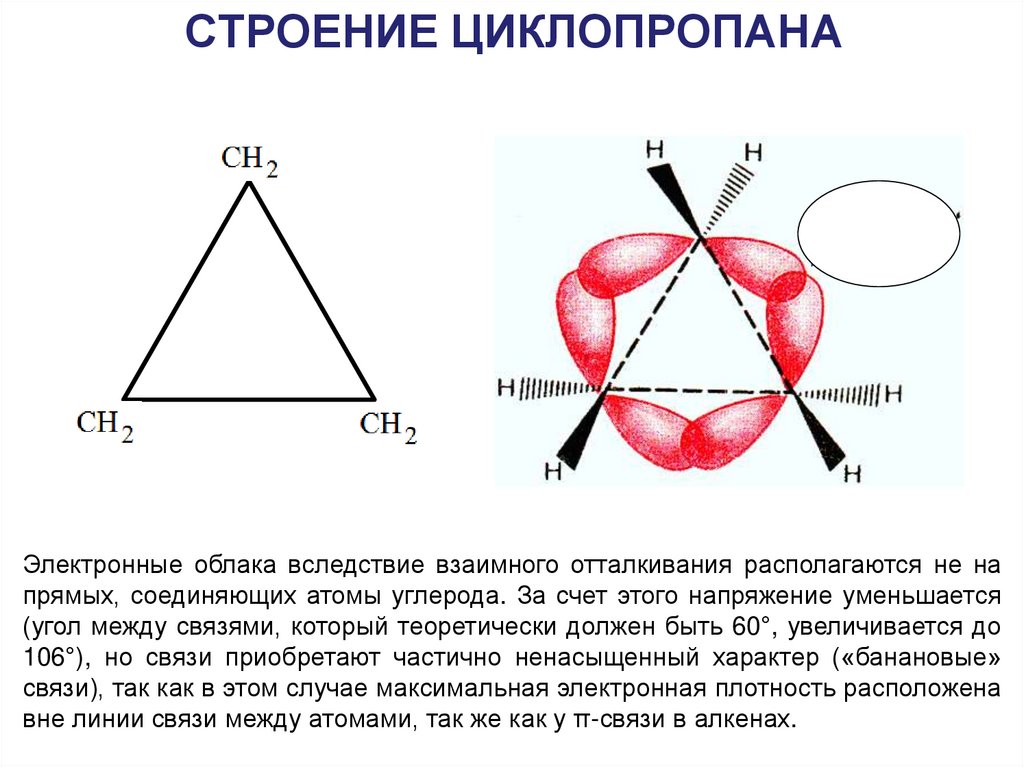
25. СТРОЕНИЕ ЦИКЛОПРОПАНА
Электронные облака вследствие взаимного отталкивания располагаются не напрямых, соединяющих атомы углерода. За счет этого напряжение уменьшается
(угол между связями, который теоретически должен быть 60°, увеличивается до
106°), но связи приобретают частично ненасыщенный характер («банановые»
связи), так как в этом случае максимальная электронная плотность расположена
вне линии связи между атомами, так же как у π-связи в алкенах.
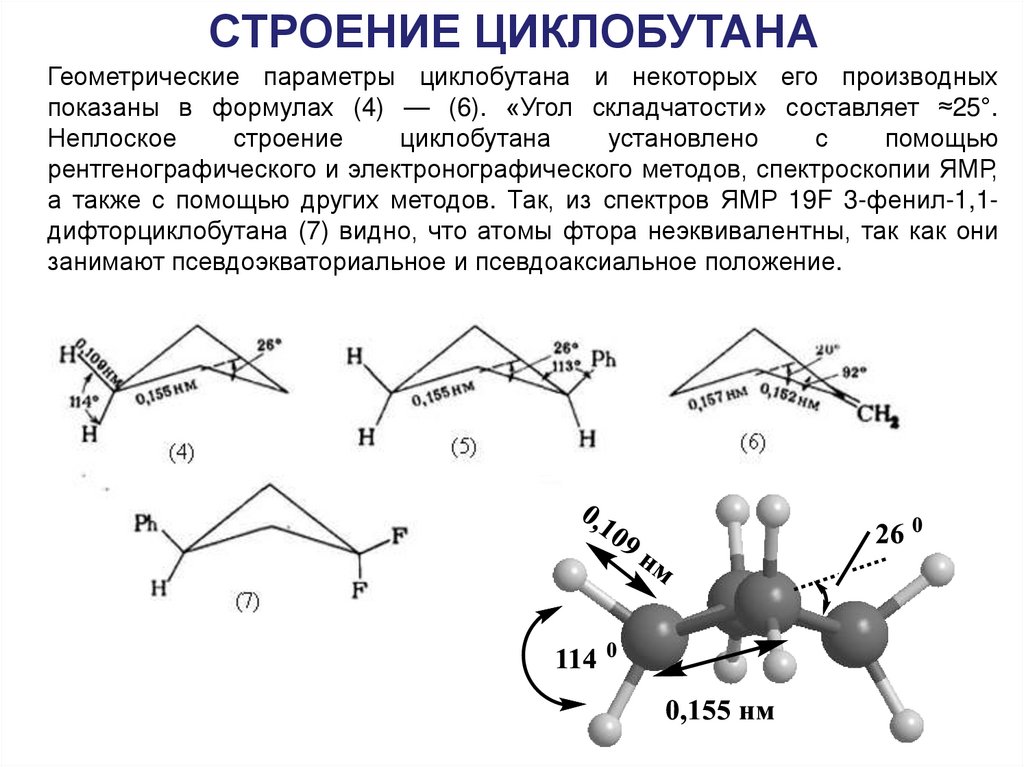
26.
СТРОЕНИЕ ЦИКЛОБУТАНАГеометрические параметры циклобутана и некоторых его производных
показаны в формулах (4) — (6). «Угол складчатости» составляет ≈25°.
Неплоское
строение
циклобутана
установлено
с
помощью
рентгенографического и электронографического методов, спектроскопии ЯМР,
а также с помощью других методов. Так, из спектров ЯМР 19F 3-фенил-1,1дифторциклобутана (7) видно, что атомы фтора неэквивалентны, так как они
занимают псевдоэкваториальное и псевдоаксиальное положение.
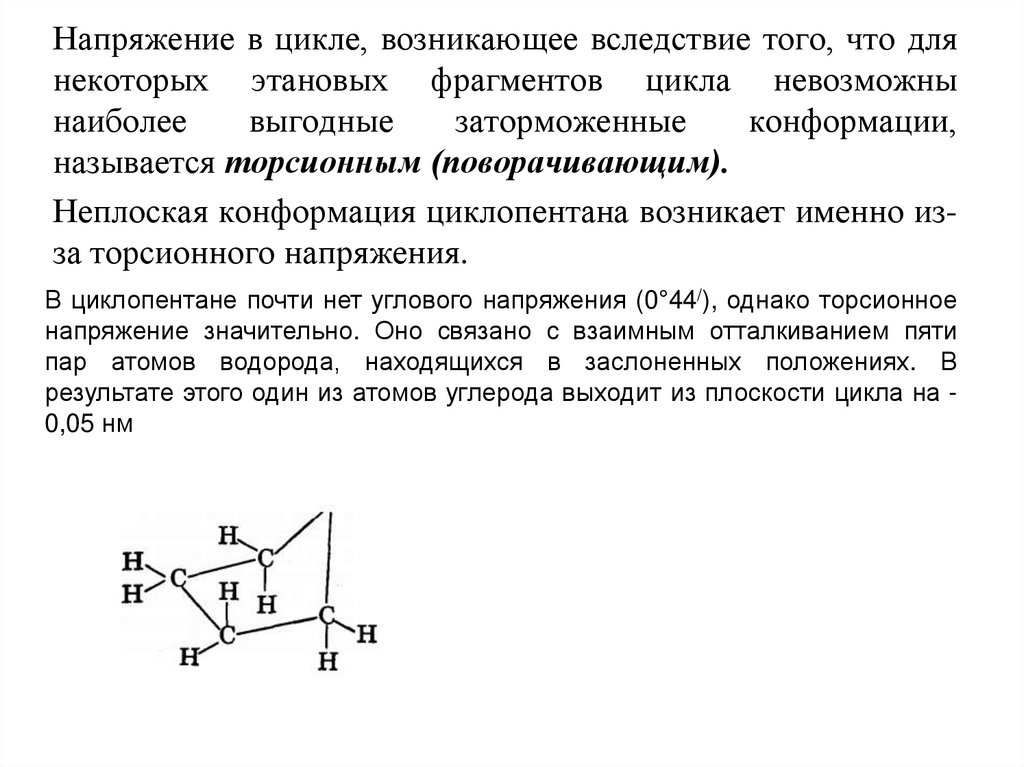
27.
Напряжение в цикле, возникающее вследствие того, что длянекоторых этановых фрагментов цикла невозможны
наиболее
выгодные
заторможенные
конформации,
называется торсионным (поворачивающим).
Неплоская конформация циклопентана возникает именно изза торсионного напряжения.
В циклопентане почти нет углового напряжения (0°44/), однако торсионное
напряжение значительно. Оно связано с взаимным отталкиванием пяти
пар атомов водорода, находящихся в заслоненных положениях. В
результате этого один из атомов углерода выходит из плоскости цикла на 0,05 нм
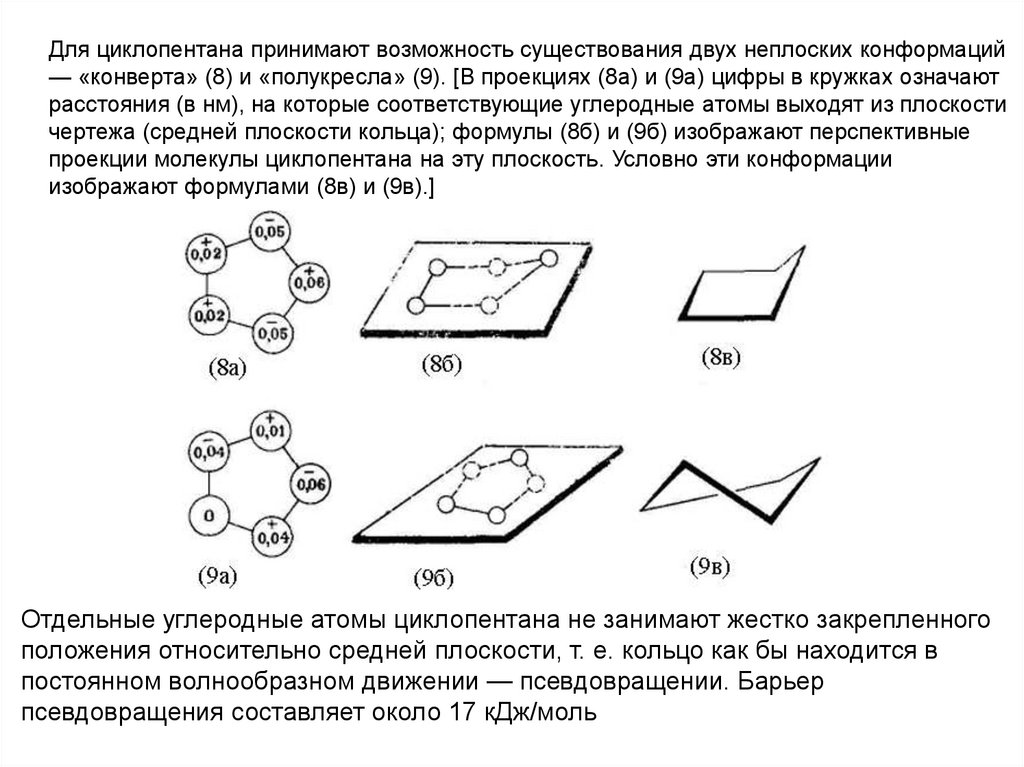
28.
Для циклопентана принимают возможность существования двух неплоских конформаций— «конверта» (8) и «полукресла» (9). [В проекциях (8а) и (9а) цифры в кружках означают
расстояния (в нм), на которые соответствующие углеродные атомы выходят из плоскости
чертежа (средней плоскости кольца); формулы (8б) и (9б) изображают перспективные
проекции молекулы циклопентана на эту плоскость. Условно эти конформации
изображают формулами (8в) и (9в).]
Отдельные углеродные атомы циклопентана не занимают жестко закрепленного
положения относительно средней плоскости, т. е. кольцо как бы находится в
постоянном волнообразном движении — псевдовращении. Барьер
псевдовращения составляет около 17 кДж/моль
29.
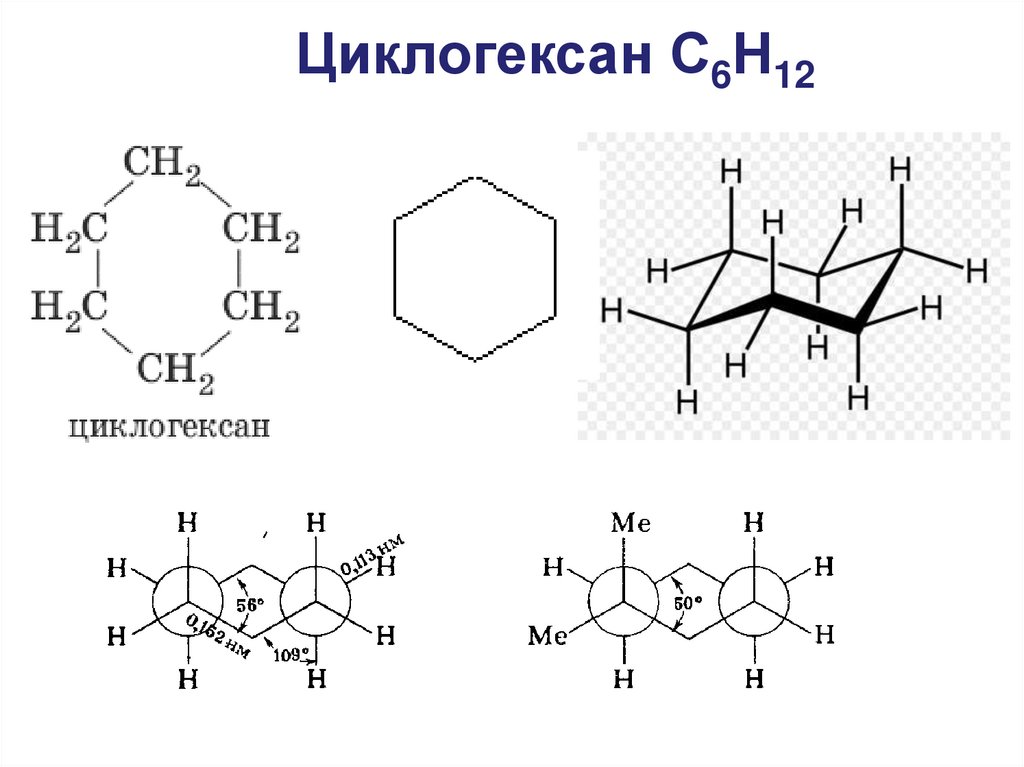
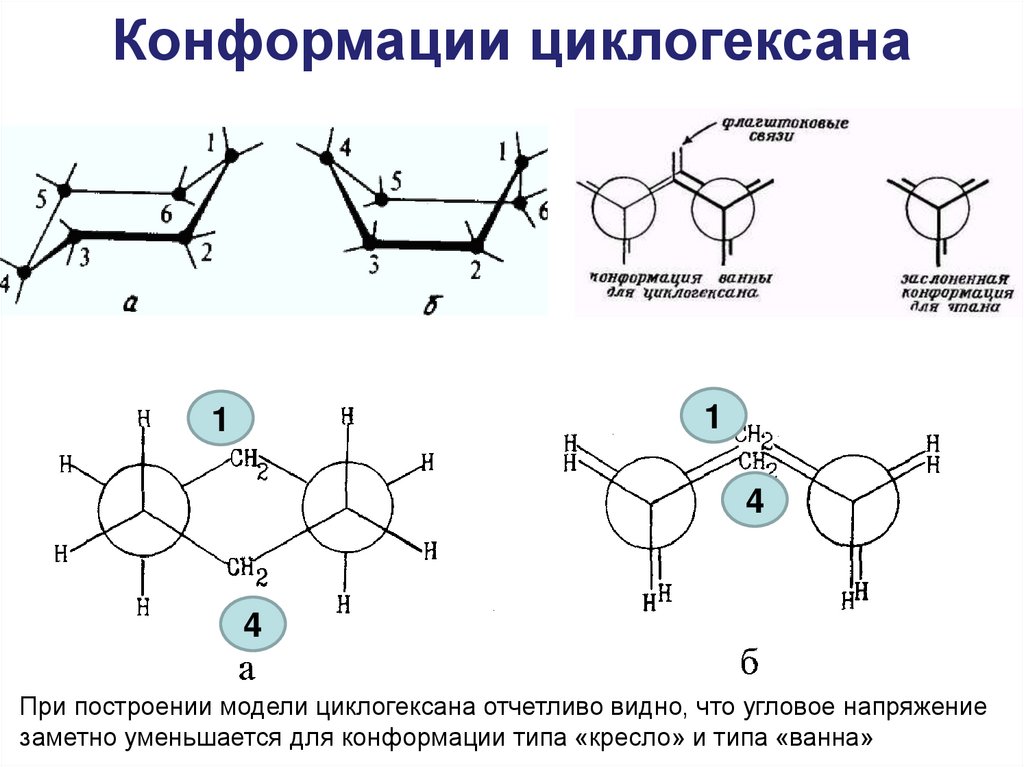
Циклогексан С6Н1230. Конформации циклогексана
11
4
4
При построении модели циклогексана отчетливо видно, что угловое напряжение
заметно уменьшается для конформации типа «кресло» и типа «ванна»
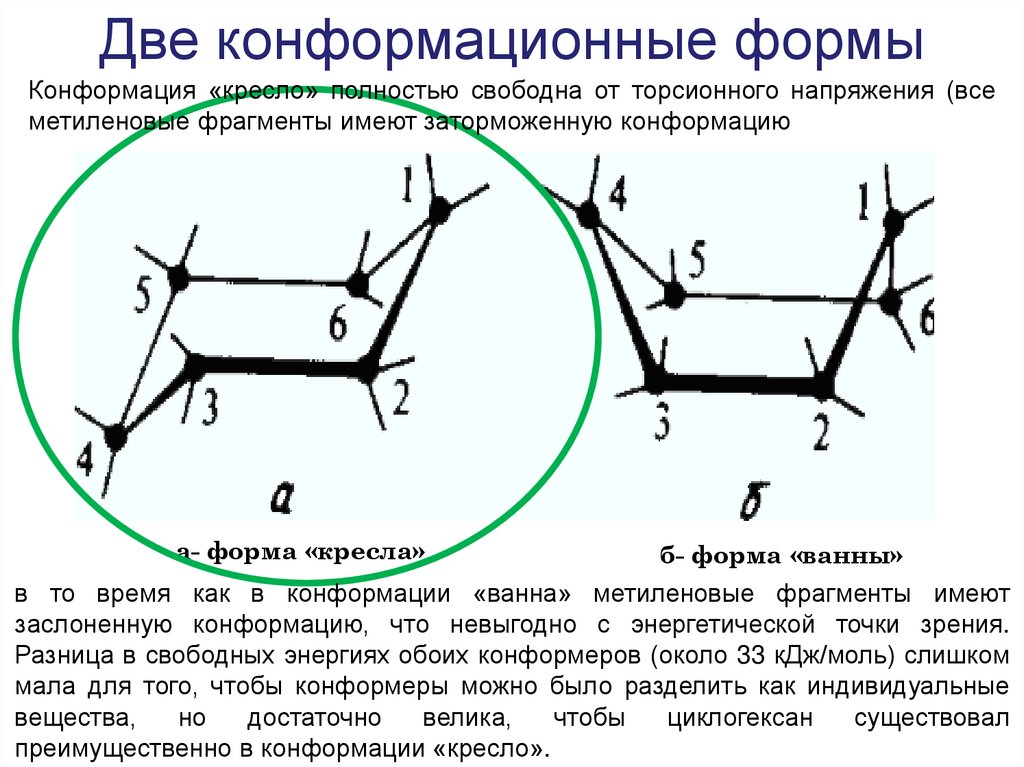
31. Две конформационные формы
Конформация «кресло» полностью свободна от торсионного напряжения (всеметиленовые фрагменты имеют заторможенную конформацию
а- форма «кресла»
б- форма «ванны»
в то время как в конформации «ванна» метиленовые фрагменты имеют
заслоненную конформацию, что невыгодно с энергетической точки зрения.
Разница в свободных энергиях обоих конформеров (около 33 кДж/моль) слишком
мала для того, чтобы конформеры можно было разделить как индивидуальные
вещества,
но
достаточно
велика,
чтобы
циклогексан
существовал
преимущественно в конформации «кресло».
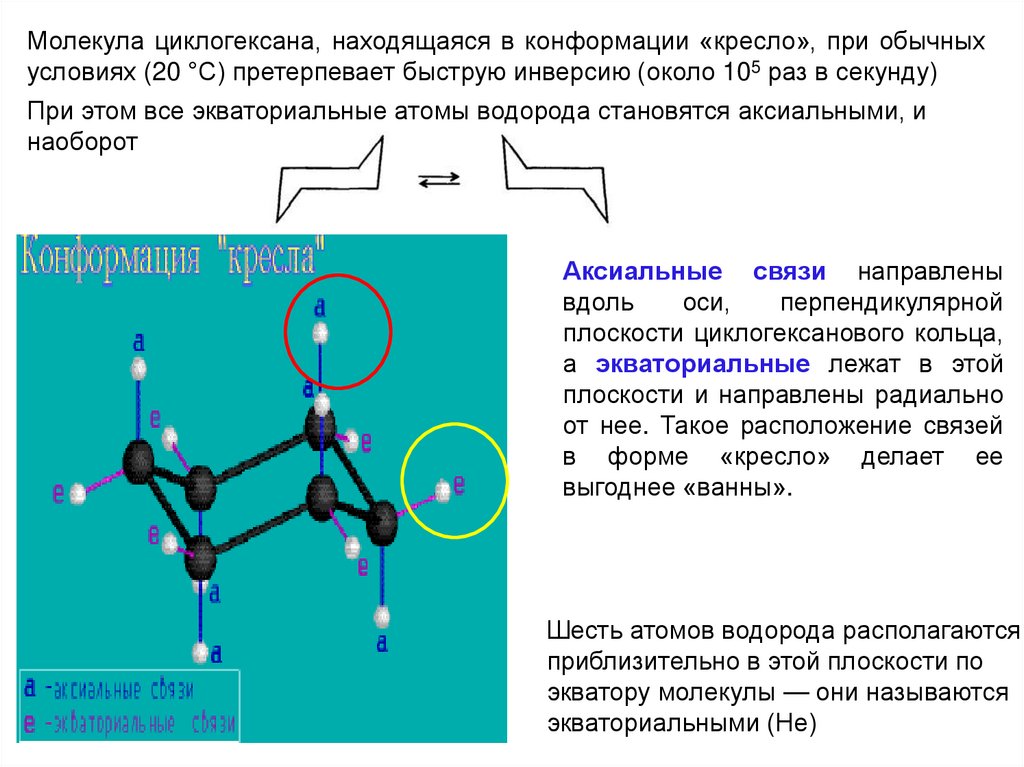
32.
Молекула циклогексана, находящаяся в конформации «кресло», при обычныхусловиях (20 °С) претерпевает быструю инверсию (около 105 раз в секунду)
При этом все экваториальные атомы водорода становятся аксиальными, и
наоборот
Аксиальные связи направлены
вдоль
оси,
перпендикулярной
плоскости циклогексанового кольца,
а экваториальные лежат в этой
плоскости и направлены радиально
от нее. Такое расположение связей
в форме «кресло» делает ее
выгоднее «ванны».
Шесть атомов водорода располагаются
приблизительно в этой плоскости по
экватору молекулы — они называются
экваториальными (Не)
33.
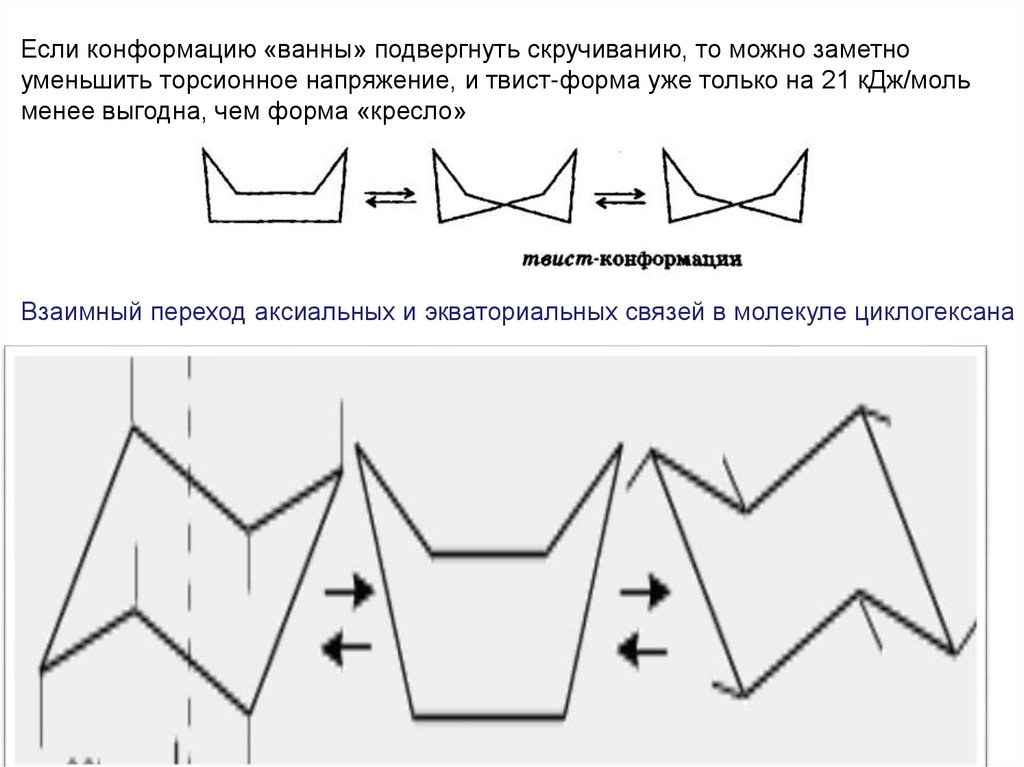
Если конформацию «ванны» подвергнуть скручиванию, то можно заметноуменьшить торсионное напряжение, и твист-форма уже только на 21 кДж/моль
менее выгодна, чем форма «кресло»
Взаимный переход аксиальных и экваториальных связей в молекуле циклогексана
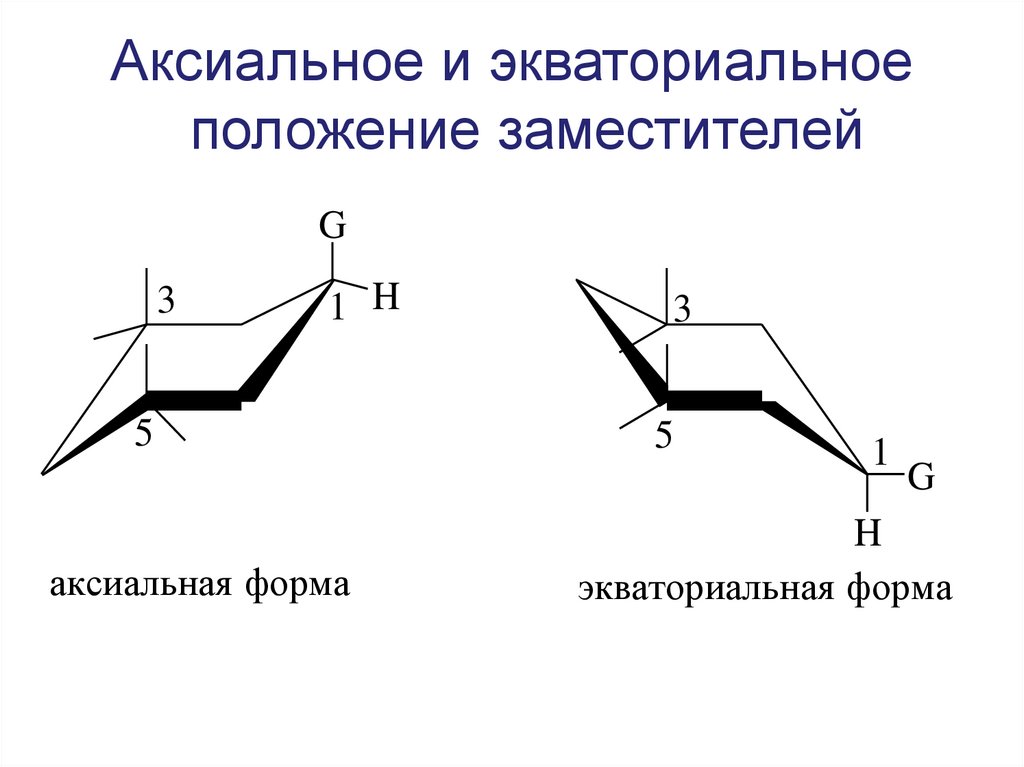
34. Аксиальное и экваториальное положение заместителей
G3
1 H
5
аксиальная форма
3
5
1
G
H
экваториальная форма
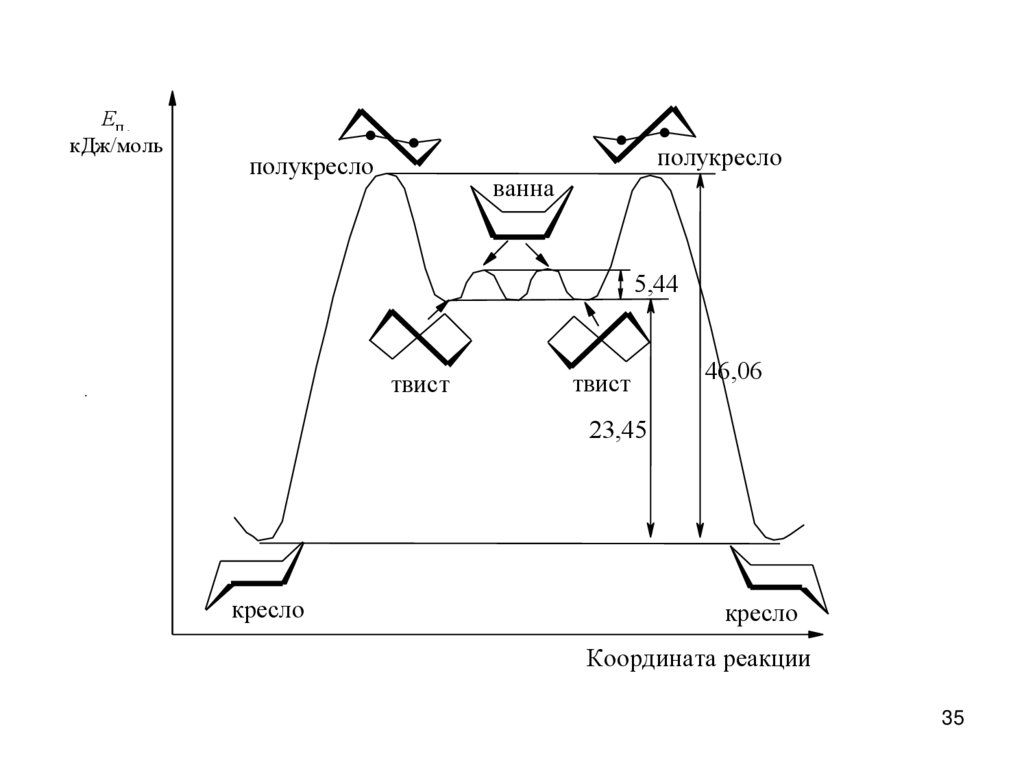
35.
Eп ,кДж/моль
..
..
полукресло
полукресло
ванна
5,44
твист
твист
46,06
23,45
кресло
кресло
Координата реакции
35
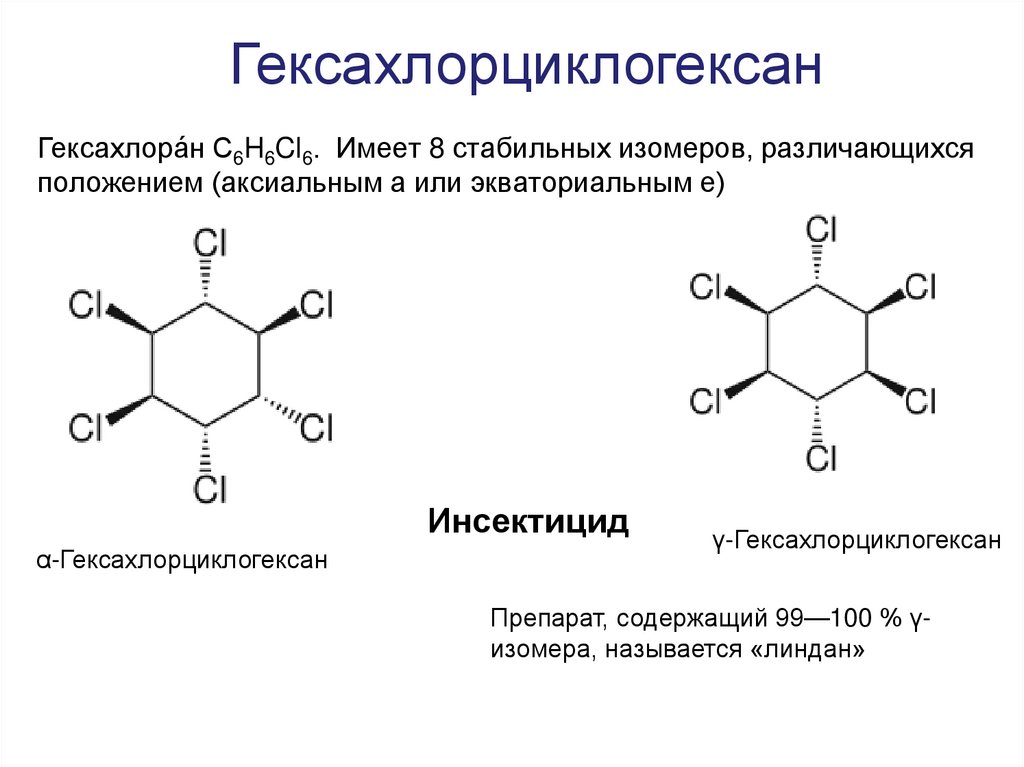
36. Гексахлорциклогексан
Гексахлора́н C6H6Cl6. Имеет 8 стабильных изомеров, различающихсяположением (аксиальным а или экваториальным е)
Инсектицид
α-Гексахлорциклогексан
γ-Гексахлорциклогексан
Препарат, содержащий 99—100 % γизомера, называется «линдан»
37.
Низшие циклоалканы (циклопропан и циклобутан) ведут себякак ненасыщенные углеводороды, они способны вступать в
реакции присоединения. Циклоалканы с большим количеством
углеродных атомов в цикле ведут себя как алканы, для них
характерны реакции замещения.
38. Химические свойства
Реакции галогенирования;Действие галогеноводородов;
Действие водорода;
Окисление.
Малые циклы
Характерны реакции
присоединения
(с разрывом цикла)
Средние и макроциклы
Характерны реакции
замещения
Кроме этого:
Дегидрирование
(ароматизация)
За исключением циклопропана и в меньшей степени циклобутана, все
остальные циклоалканы по реакционной способности не отличаются от
инертных алканов.
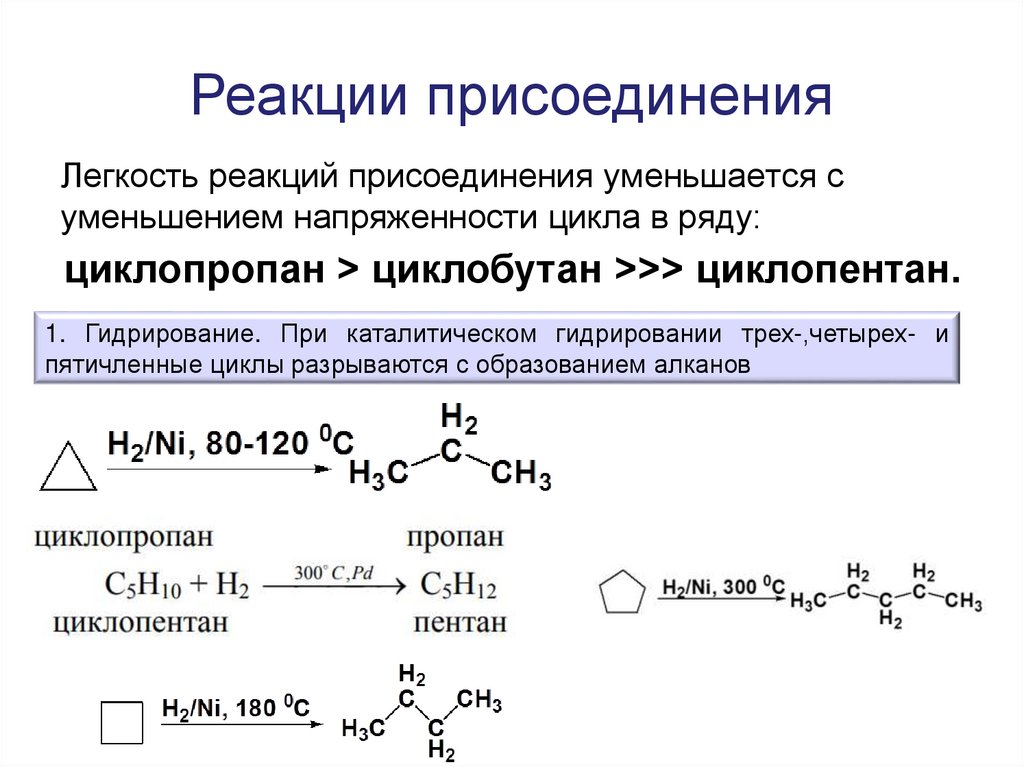
39. Реакции присоединения
Легкость реакций присоединения уменьшается суменьшением напряженности цикла в ряду:
циклопропан > циклобутан >>> циклопентан.
1. Гидрирование. При каталитическом гидрировании трех-,четырех- и
пятичленные циклы разрываются с образованием алканов
40.
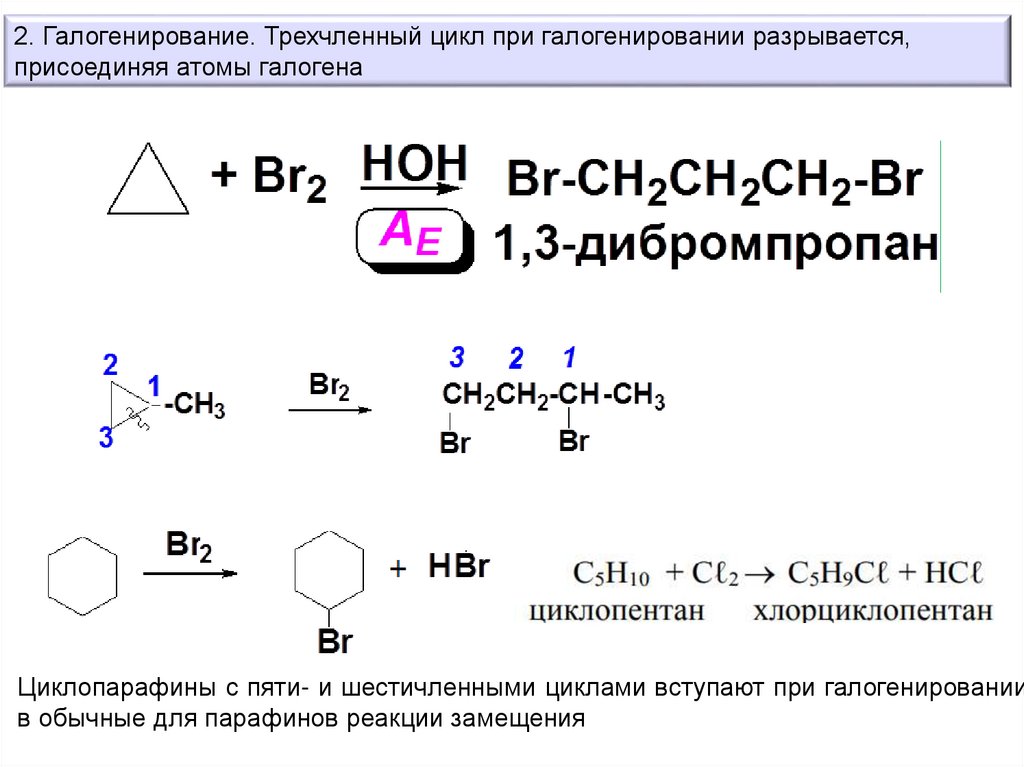
2. Галогенирование. Трехчленный цикл при галогенировании разрывается,присоединяя атомы галогена
Циклопарафины с пяти- и шестичленными циклами вступают при галогенировании
в обычные для парафинов реакции замещения
41.
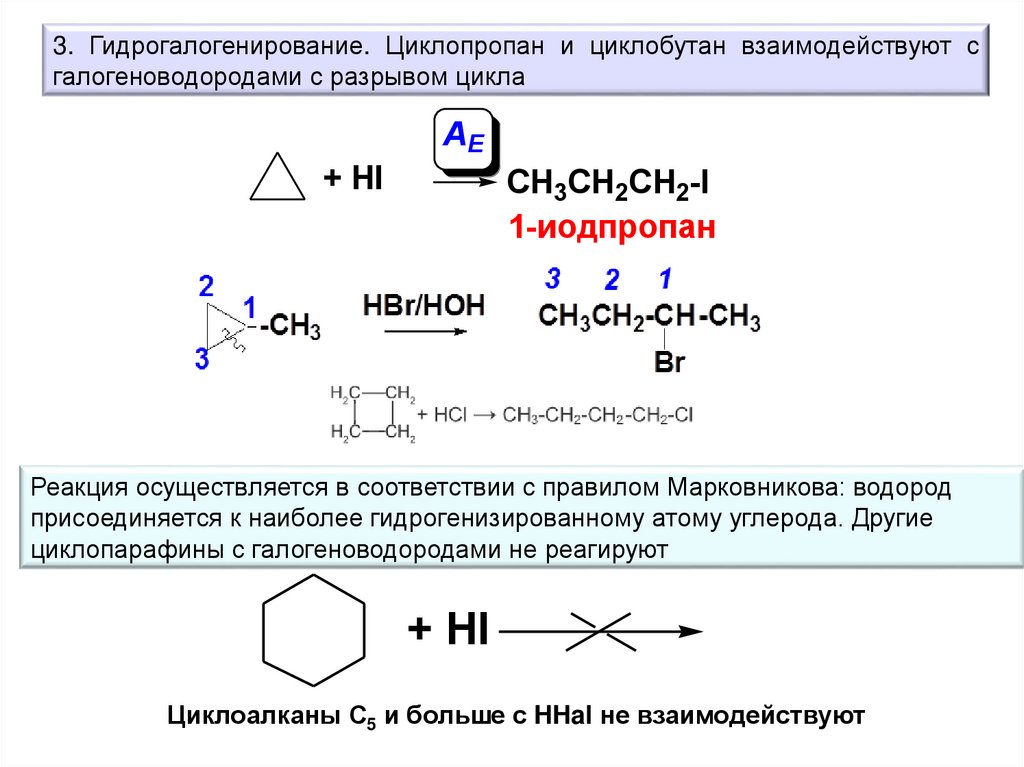
3. Гидрогалогенирование. Циклопропан и циклобутан взаимодействуют сгалогеноводородами с разрывом цикла
AE
+ HI
CH3CH2CH2-I
1-иодпропан
Реакция осуществляется в соответствии с правилом Марковникова: водород
присоединяется к наиболее гидрогенизированному атому углерода. Другие
циклопарафины с галогеноводородами не реагируют
+ HI
Циклоалканы С5 и больше с HHal не взаимодействуют
42.
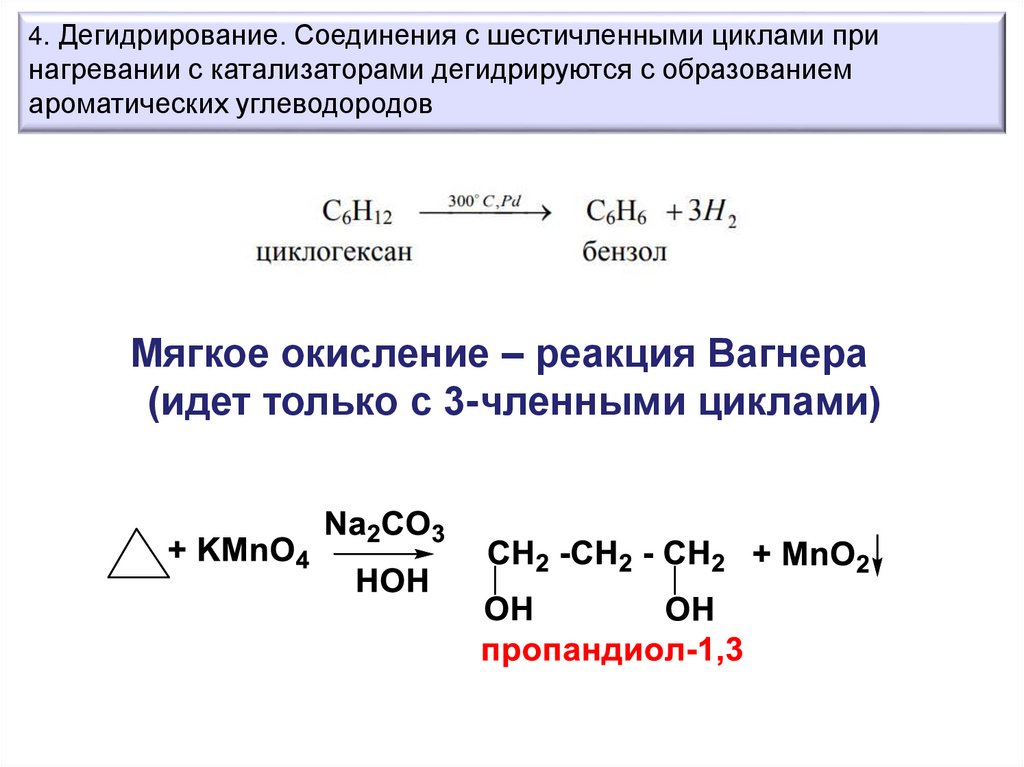
4. Дегидрирование. Соединения с шестичленными циклами принагревании с катализаторами дегидрируются с образованием
ароматических углеводородов
Мягкое окисление – реакция Вагнера
(идет только с 3-членными циклами)
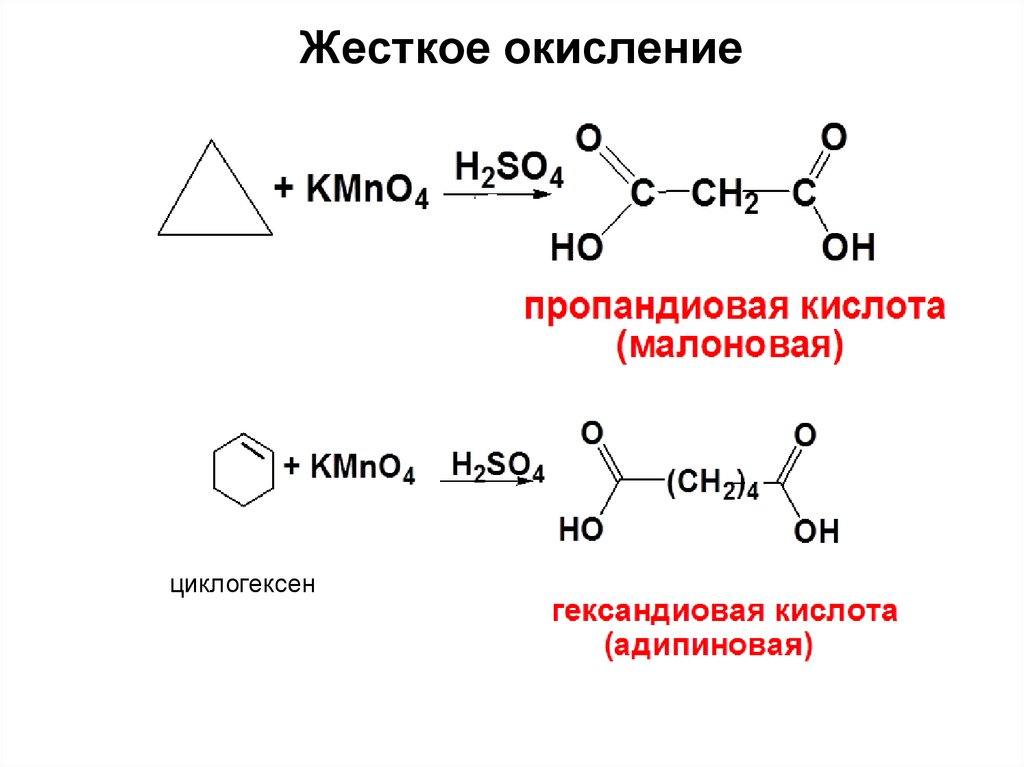
43. Жесткое окисление
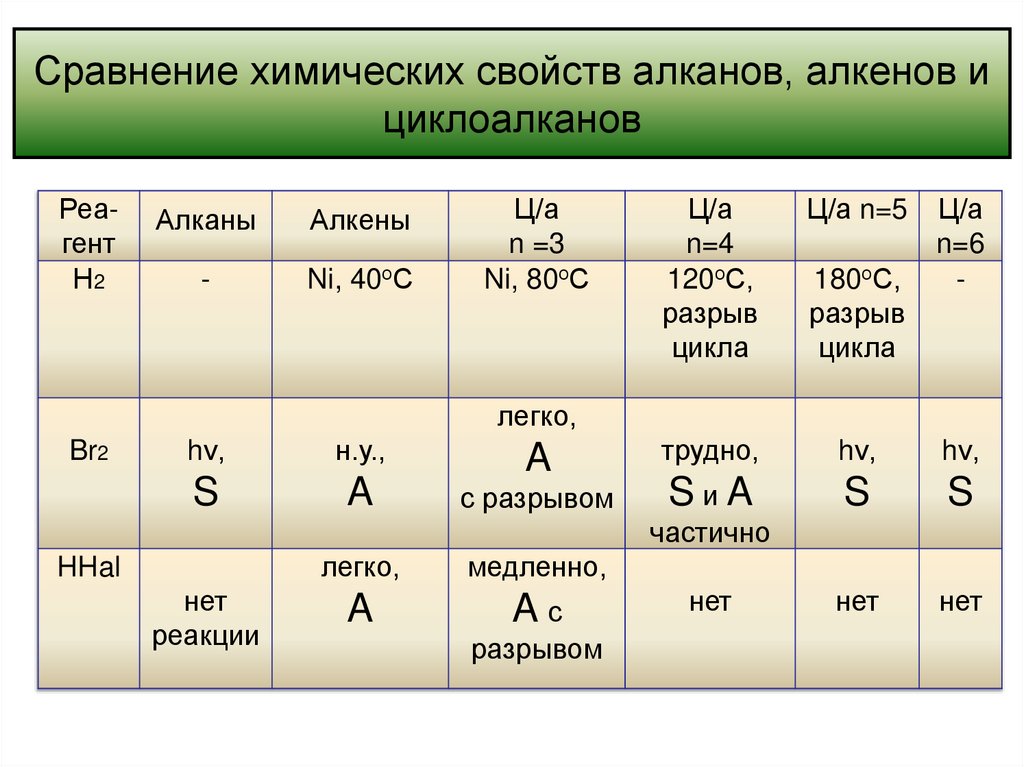
циклогексен44. Сравнение химических свойств алканов, алкенов и циклоалканов
РеагентН2
Алканы
Алкены
-
Ni, 40оС
Ц/а
n =3
Ni, 80оС
Ц/а
n=4
120оС,
разрыв
цикла
Ц/а n=5
трудно,
hν,
hν,
SиA
S
S
нет
нет
180оС,
разрыв
цикла
Ц/а
n=6
-
легко,
Br2
hν,
н.у.,
S
A
A
с разрывом
частично
HHal
нет
реакции
легко,
медленно,
A
Aс
разрывом
нет
45. Применение циклоалканов
• Наибольшее практическое значение имеютциклогексан, этилциклогексан.
• Циклогексан используется для получения
циклогексанола, циклогексанона, адипиновой
кислоты, капролактама, а также в качестве
растворителя.
• Циклопропан используется в медицинской практике в
качестве ингаляционного анестезирующего средства.
46.
47. Подведем итог
• Циклоалканы имеют различноестроение, в зависимости от размера
цикла.
• Способны проявлять свойства,
подобные алкенам и алканам.
• Основные реакции: присоединение,
замещение.
• Для С6 – ароматизация.
48.
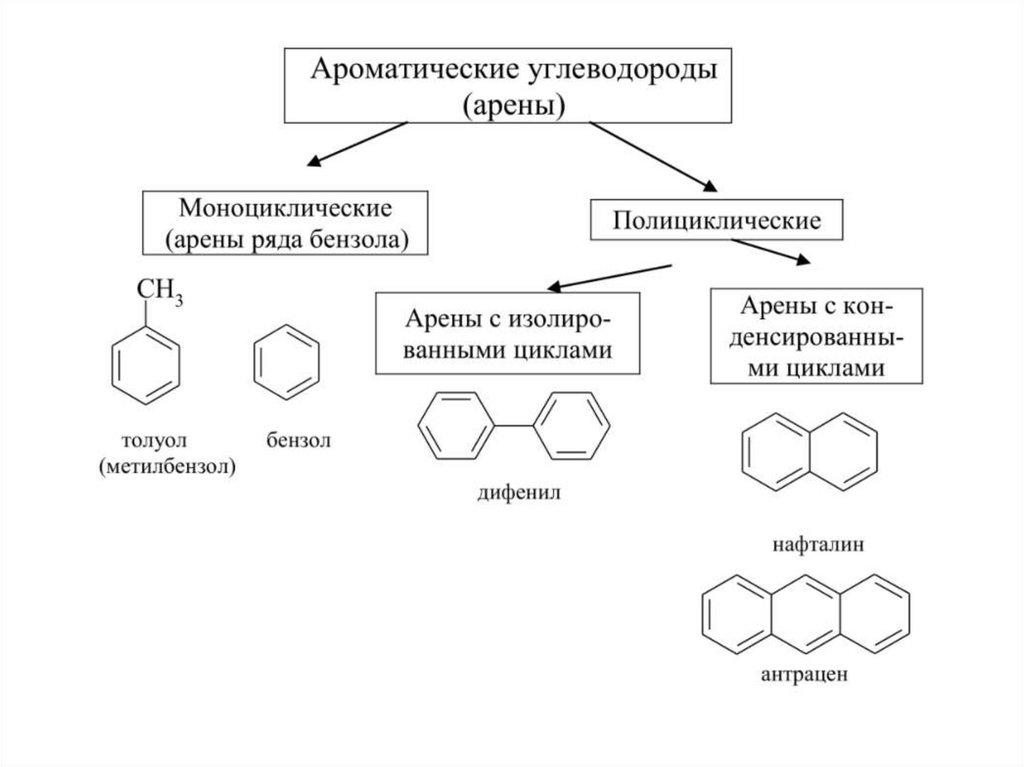
Ароматические углеводороды (арены)Представители ароматических углеводородов
— бензол С6Н6 и его гомологи имеют
циклическое строение. Они могут иметь
насыщенные или ненасыщенные боковые
цепи. Некоторые из производных бензола
обладают приятным запахом. Поэтому
сохранилось их прежнее историческое
название — ароматические углеводороды
49.
50.
51.
52.
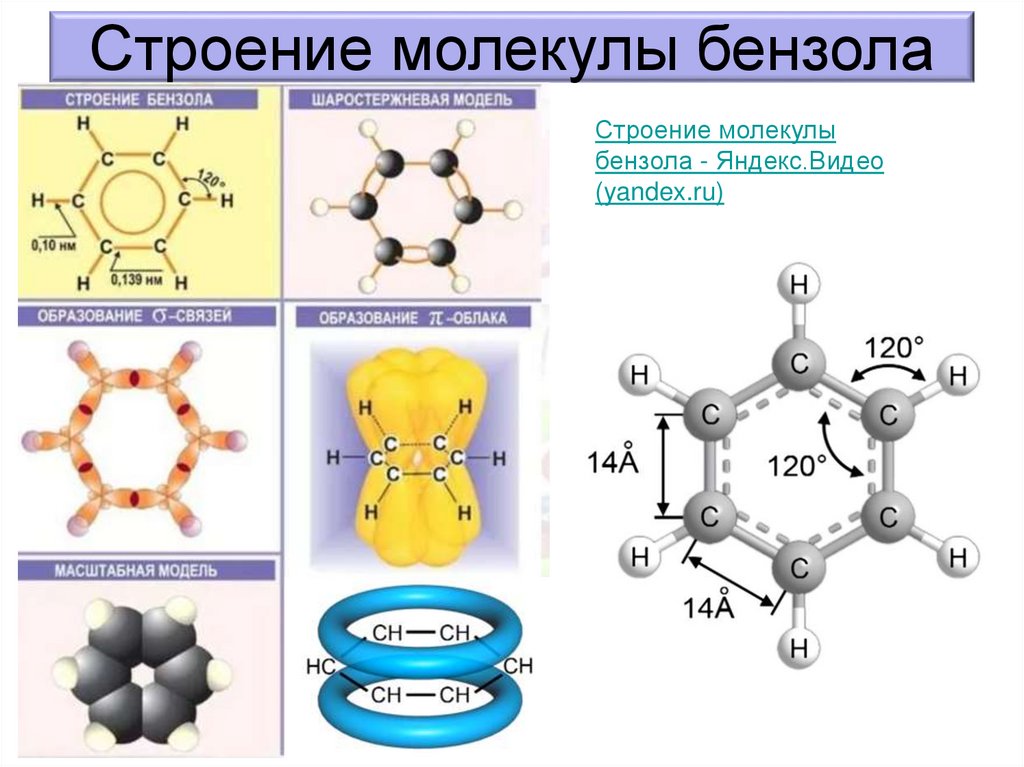
Строение молекулы бензолаСтроение молекулы
бензола - Яндекс.Видео
(yandex.ru)
53.
54.
в молекуле бензола у каждого атома углерода одно s- и два рэлектронных облака гибридизованы (sp2 -гибридизация), а одно рэлектронное облако негибридизованное. Все три гибридизованныхэлектронных облака, перекрываясь с гибридизованными облаками
соседних атомов углерода и s-облаками атомов водорода, образуют три
σ-связи, которые находятся в одной плоскости. Негибридизованные рэлектронные облака атомов углерода расположены перпендикулярно
плоскости направления σ -связей. Эти облака тоже перекрываются друг с
другом. В цикле молекулы бензола нет трех отдельных двойных связей:
негибридизованное р-электронное облако первого атома углерода
перекрывается с негибридизованными р-электронными облаками второго
и шестого атомов углерода, а р-электронное облако второго атома
углерода перекрывается с негибридизованными р-электронными
облаками первого и третьего атомов углерода. Так как электронная
плотность в молекуле бензола распределена равномерно, то
правильнее структурную формулу бензола изображать в виде
шестиугольника с окружностью внутри. Соединения углерода и
водорода, в молекулах которых имеется бензольное кольцо, или
ядро, относятся к ароматическим углеводородам.
55.
56.
Получение бензола и егогомологов
Важнейшими источниками ароматических углеводородов являются
каменноугольная смола, газы, образующиеся при коксовании (пиролизе)
углей, продукты переработки нефти.
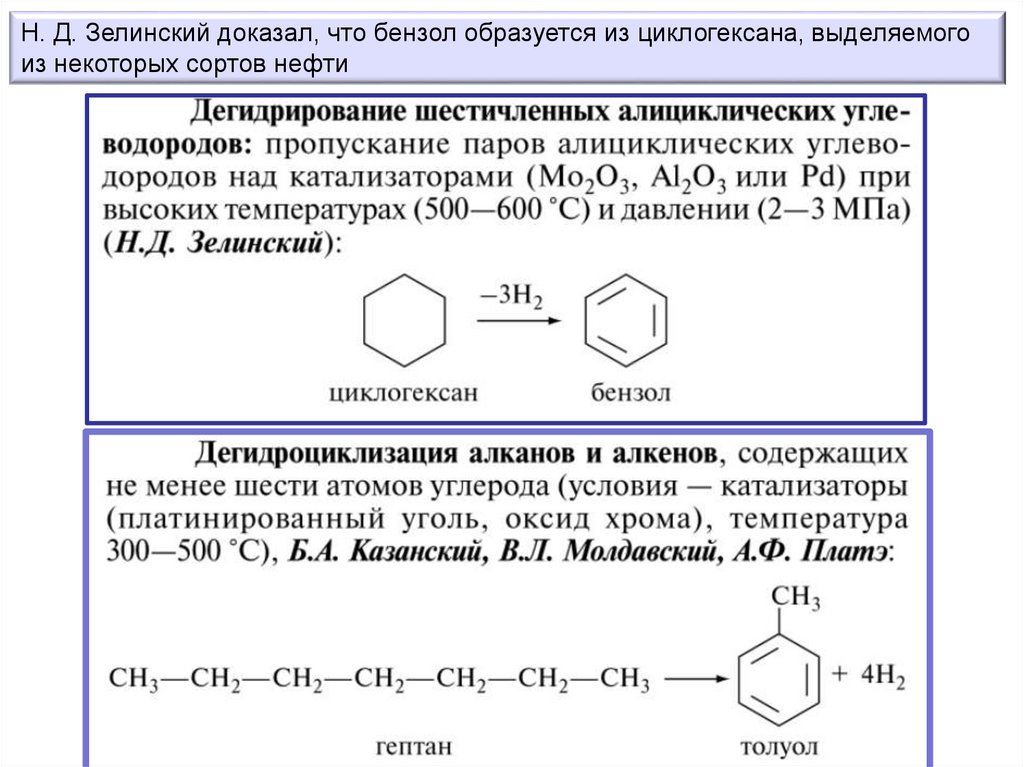
Получение бензола из ацетилена при 450—500 °С над активированным углем
(Н.Д. Зелинский, Б.А. Казанский)
57.
Н. Д. Зелинский доказал, что бензол образуется из циклогексана, выделяемогоиз некоторых сортов нефти
58.
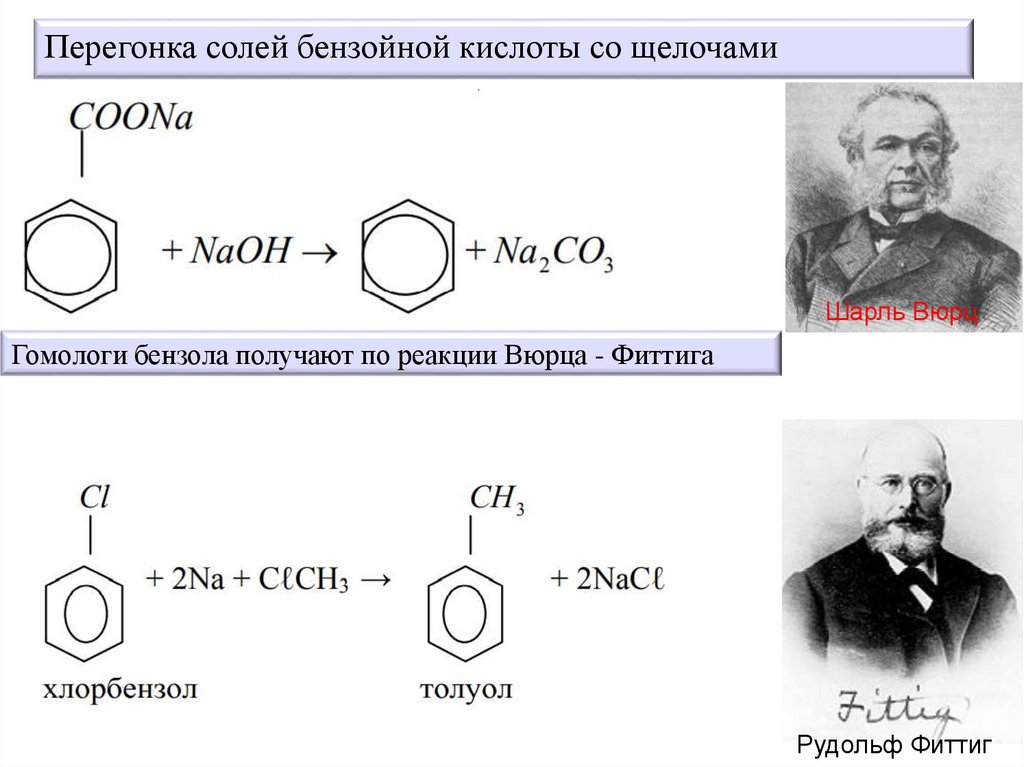
Перегонка солей бензойной кислоты со щелочамиШарль Вюрц
Гомологи бензола получают по реакции Вюрца - Фиттига
Рудольф Фиттиг
59.
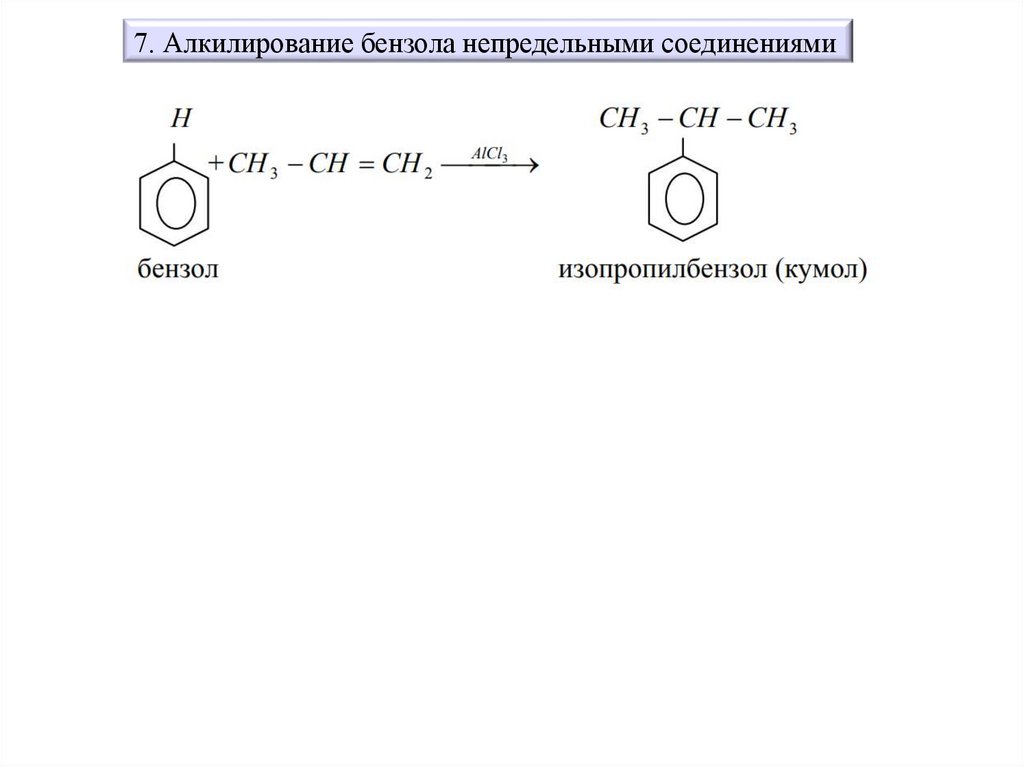
По реакции Фриделя - Крафтса, реакции алкилирования бензола60.
7. Алкилирование бензола непредельными соединениями61.
Химические свойстваДелокализация шести π-электронов в циклической системе понижает
энергию молекулы, что обусловливает повышенную устойчивость
(ароматичность) бензола и его гомологов
Арены не склонны вступать в реакции присоединения или окисления,
которые ведут к нарушению ароматичности.
Для них наиболее характерны реакции, идущие с сохранением
ароматической системы, а именно, реакции замещения атомов водорода,
связанных с циклом. Наличие областей повышенной π-электронной
плотности с двух сторон плоского ароматического цикла ведет к тому, что
бензольное кольцо является нуклеофилом и в связи с этим склонно
подвергаться атаке электрофильным реагентом.
Для ароматических соединений наиболее
типичны реакции электрофильного замещения
62.
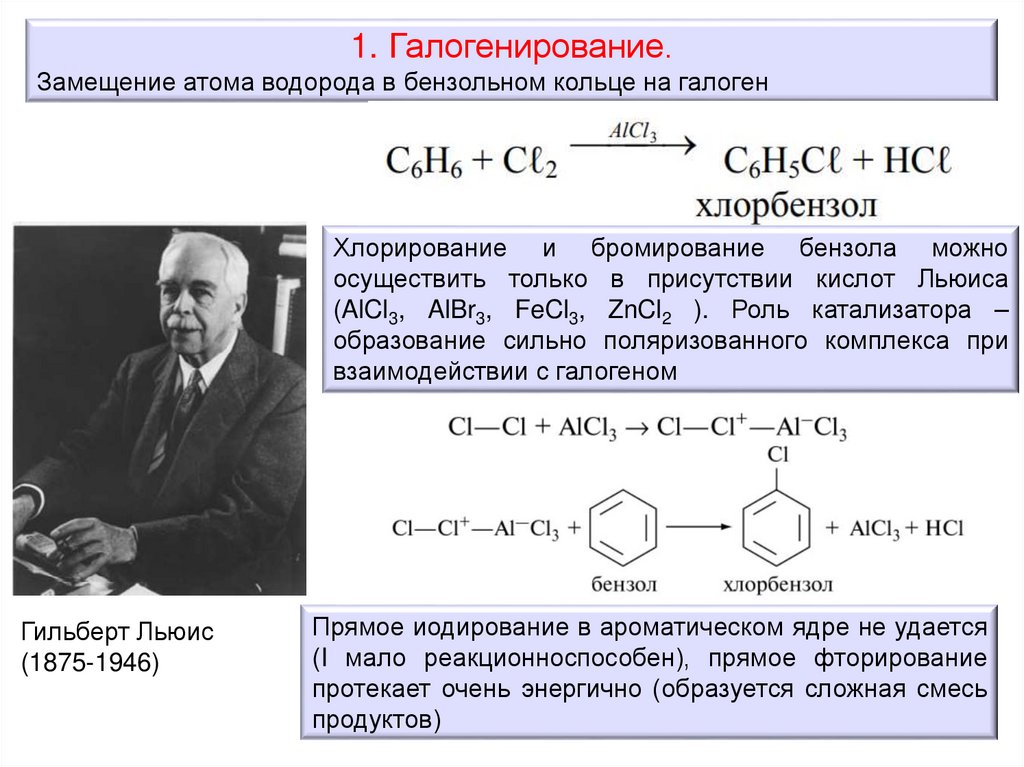
1. Галогенирование.Замещение атома водорода в бензольном кольце на галоген
Хлорирование и бромирование бензола можно
осуществить только в присутствии кислот Льюиса
(AlCl3, AlBr3, FeCl3, ZnCl2 ). Роль катализатора –
образование сильно поляризованного комплекса при
взаимодействии с галогеном
Гильберт Льюис
(1875-1946)
Прямое иодирование в ароматическом ядре не удается
(I мало реакционноспособен), прямое фторирование
протекает очень энергично (образуется сложная смесь
продуктов)
63.
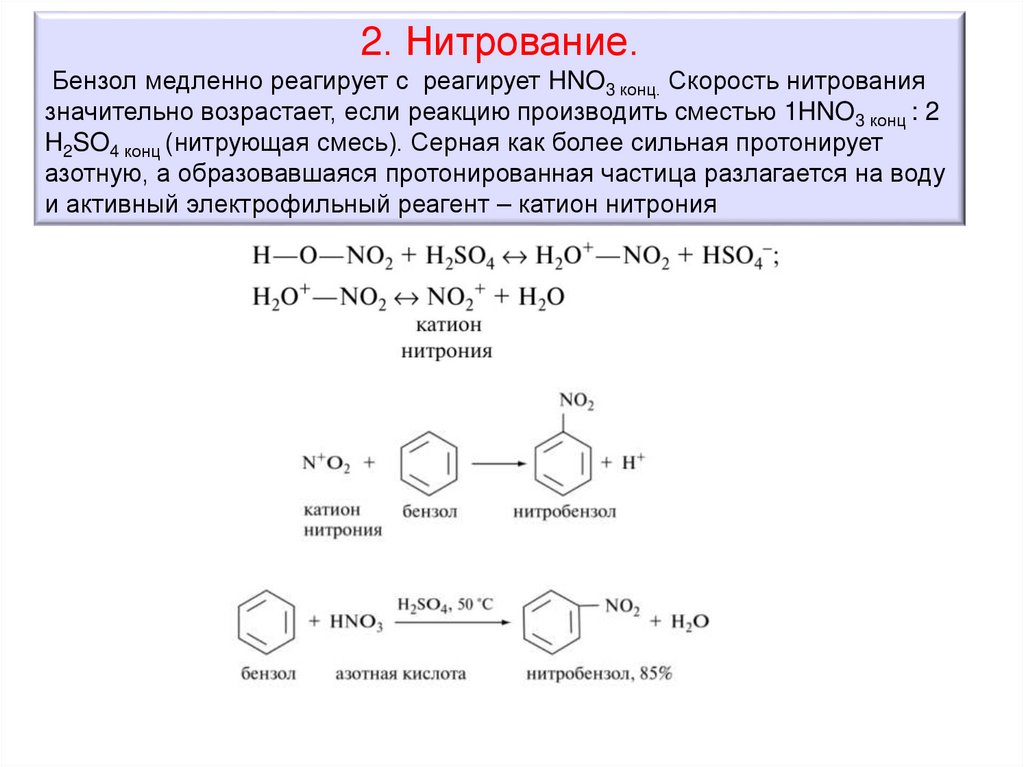
2. Нитрование.Бензол медленно реагирует с реагирует HNO3 конц. Скорость нитрования
значительно возрастает, если реакцию производить сместью 1HNO3 конц : 2
H2SO4 конц (нитрующая смесь). Серная как более сильная протонирует
азотную, а образовавшаяся протонированная частица разлагается на воду
и активный электрофильный реагент – катион нитрония
64.
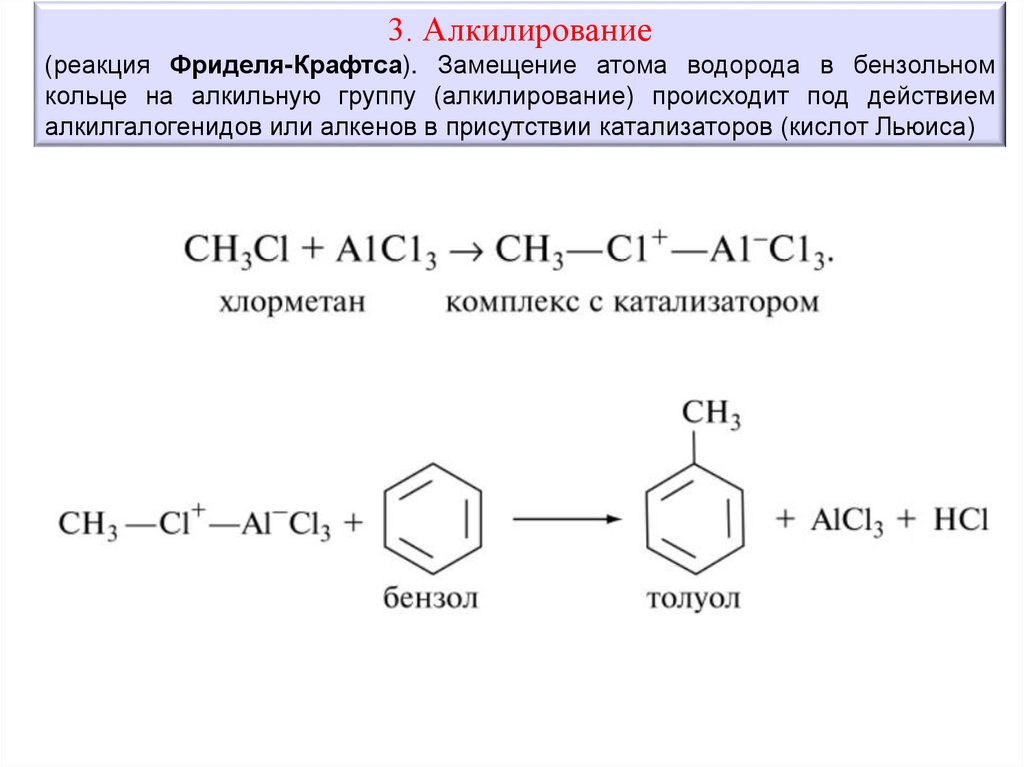
3. Алкилирование(реакция Фриделя-Крафтса). Замещение атома водорода в бензольном
кольце на алкильную группу (алкилирование) происходит под действием
алкилгалогенидов или алкенов в присутствии катализаторов (кислот Льюиса)
65.
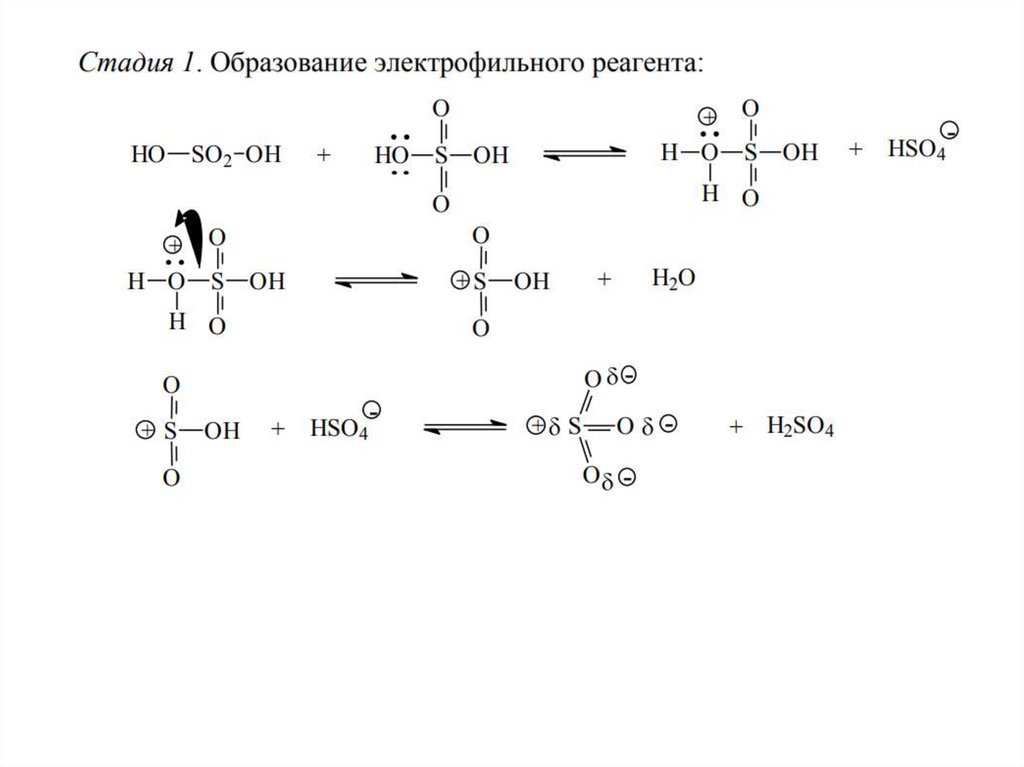
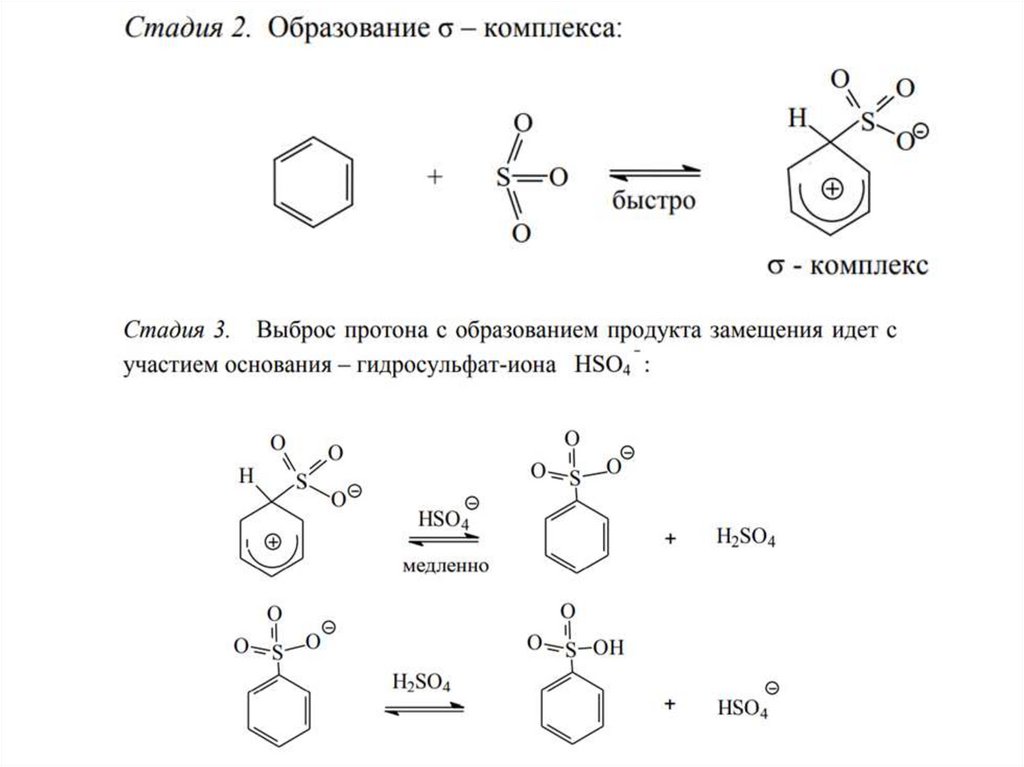
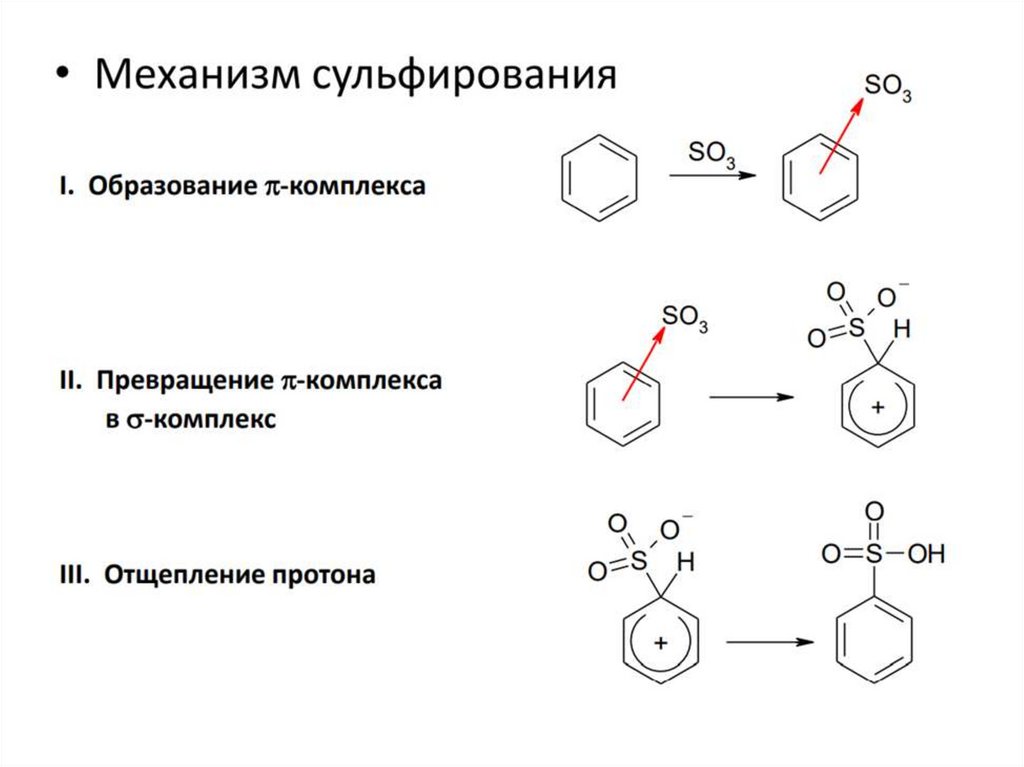
3. СульфированиеДля введения сульфогруппы в бензольное кольцо используют дымящуюся
серную кислоту, т.е. содержащую избыток серного ангидрида SO3 - который
является электрофильным агентом
Реакция сульфирования обратима в отличие от других реакций
электрофильного замещения. При нагревании ароматических сульфокислот
перегретым паром происходит их десульфирование.
66.
67.
68.
69.
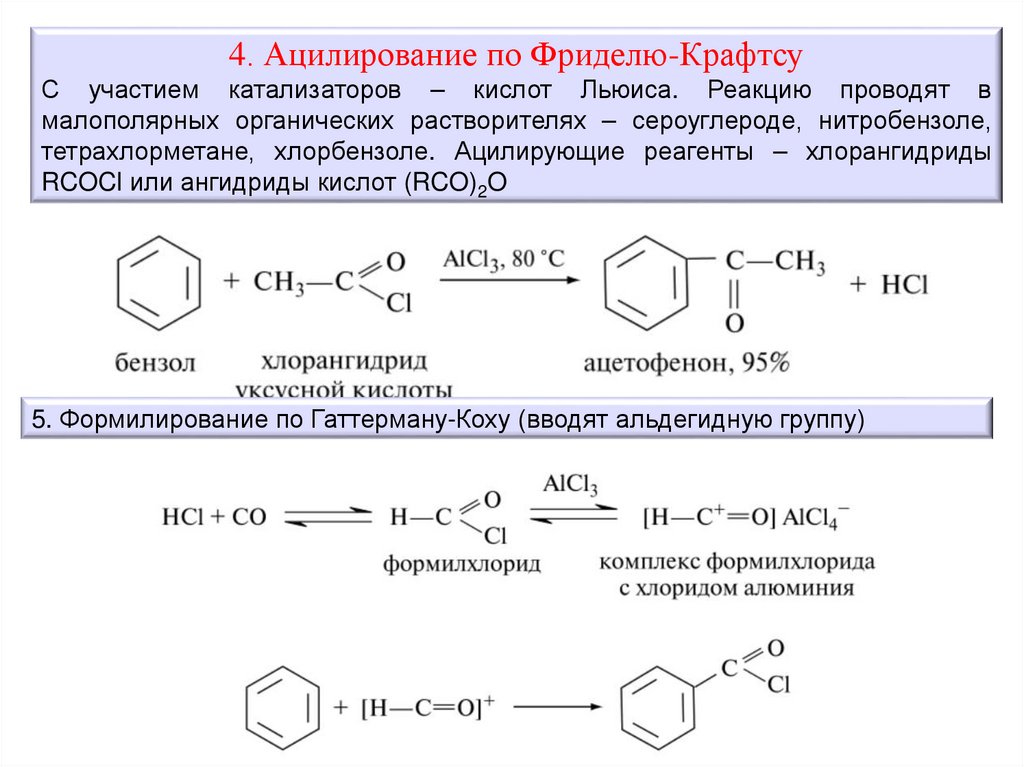
4. Ацилирование по Фриделю-КрафтсуС участием катализаторов – кислот Льюиса. Реакцию проводят в
малополярных органических растворителях – сероуглероде, нитробензоле,
тетрахлорметане, хлорбензоле. Ацилирующие реагенты – хлорангидриды
RCOCl или ангидриды кислот (RCO)2O
5. Формилирование по Гаттерману-Коху (вводят альдегидную группу)
70.
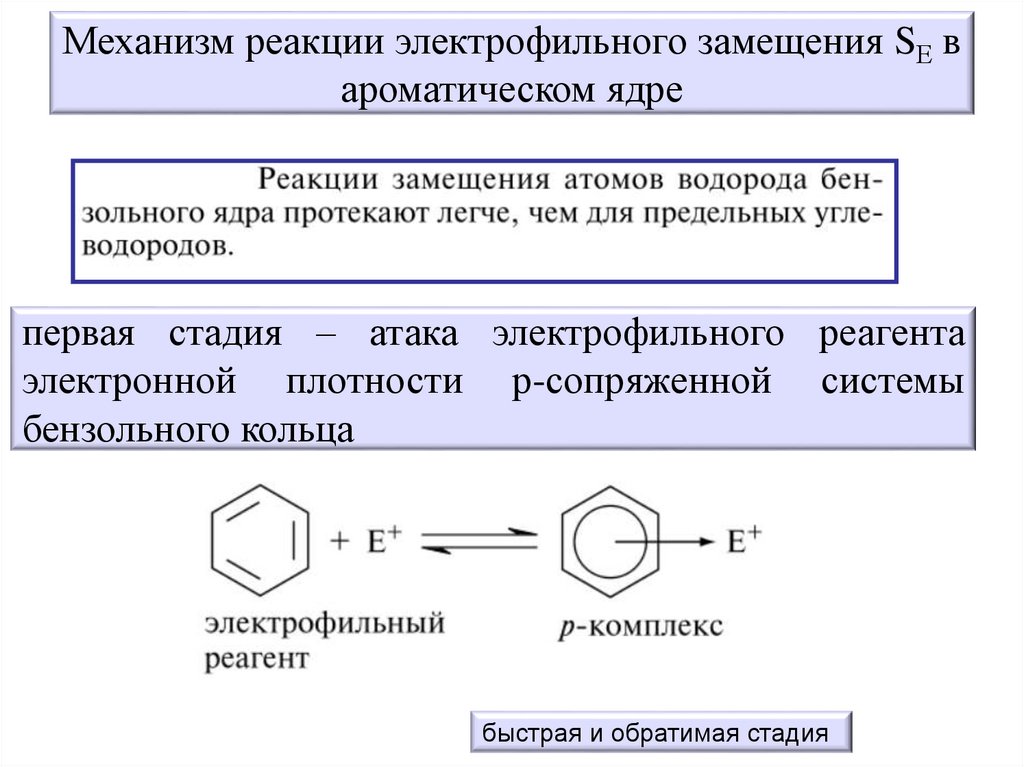
Механизм реакции электрофильного замещения SЕ вароматическом ядре
первая стадия – атака электрофильного реагента
электронной плотности р-сопряженной системы
бензольного кольца
быстрая и обратимая стадия
71.
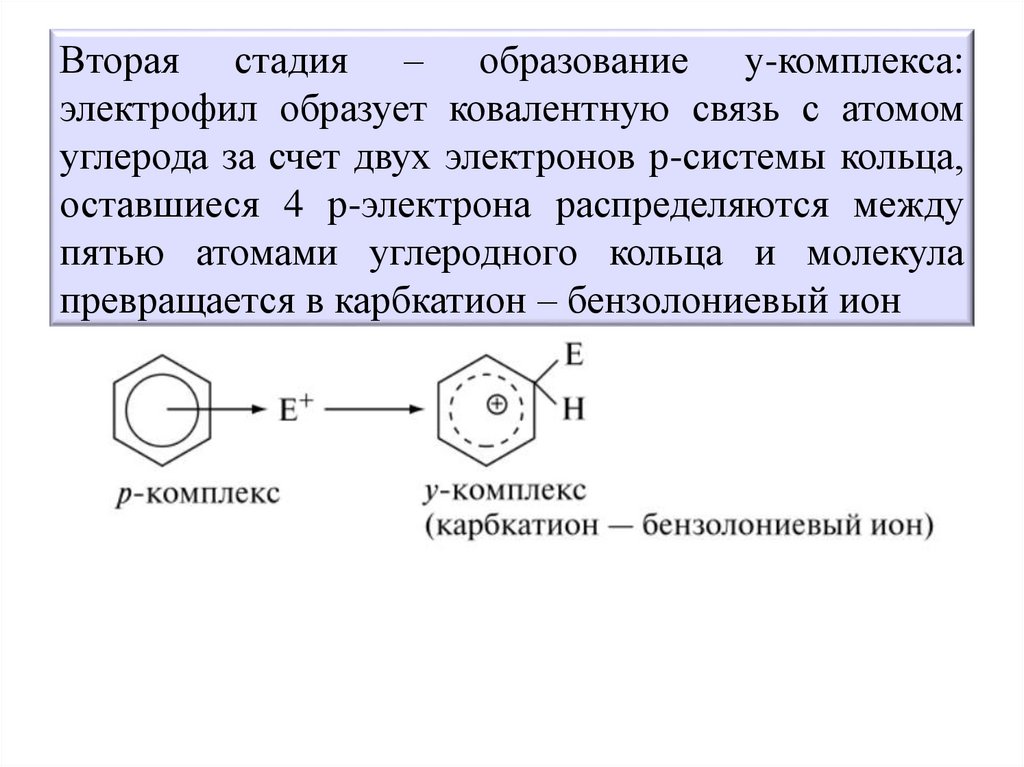
Вторая стадия – образование y-комплекса:электрофил образует ковалентную связь с атомом
углерода за счет двух электронов р-системы кольца,
оставшиеся 4 р-электрона распределяются между
пятью атомами углеродного кольца и молекула
превращается в карбкатион – бензолониевый ион
72.
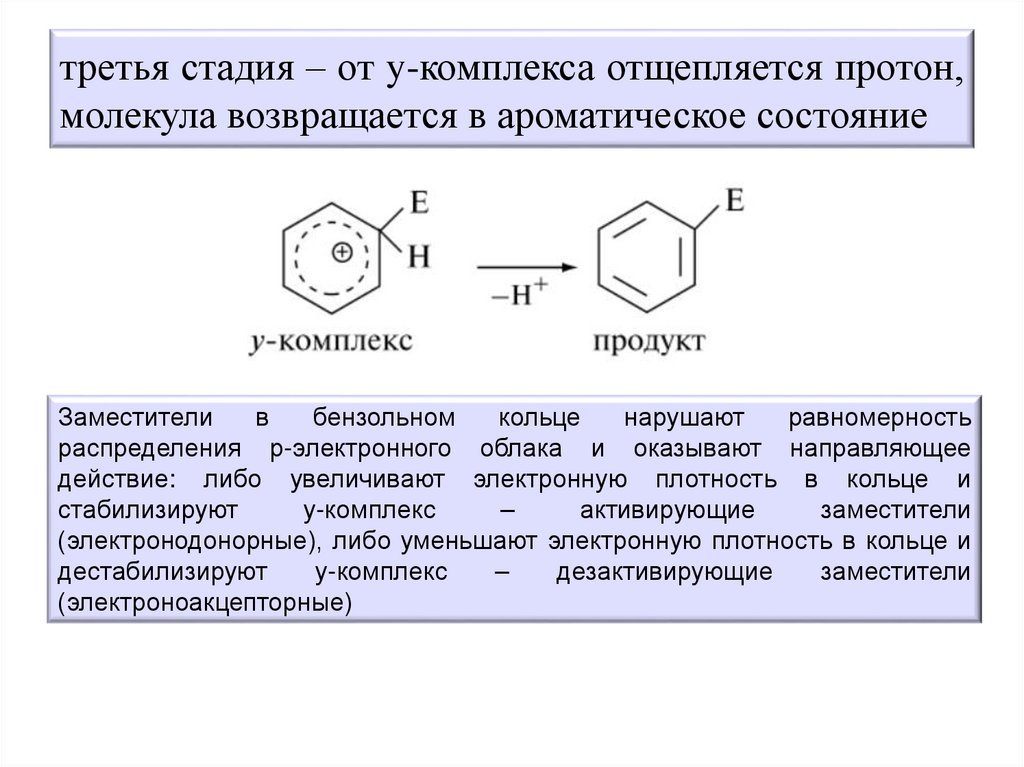
третья стадия – от y-комплекса отщепляется протон,молекула возвращается в ароматическое состояние
Заместители
в
бензольном
кольце
нарушают
равномерность
распределения р-электронного облака и оказывают направляющее
действие: либо увеличивают электронную плотность в кольце и
стабилизируют
у-комплекс
–
активирующие
заместители
(электронодонорные), либо уменьшают электронную плотность в кольце и
дестабилизируют
у-комплекс
–
дезактивирующие
заместители
(электроноакцепторные)
73.
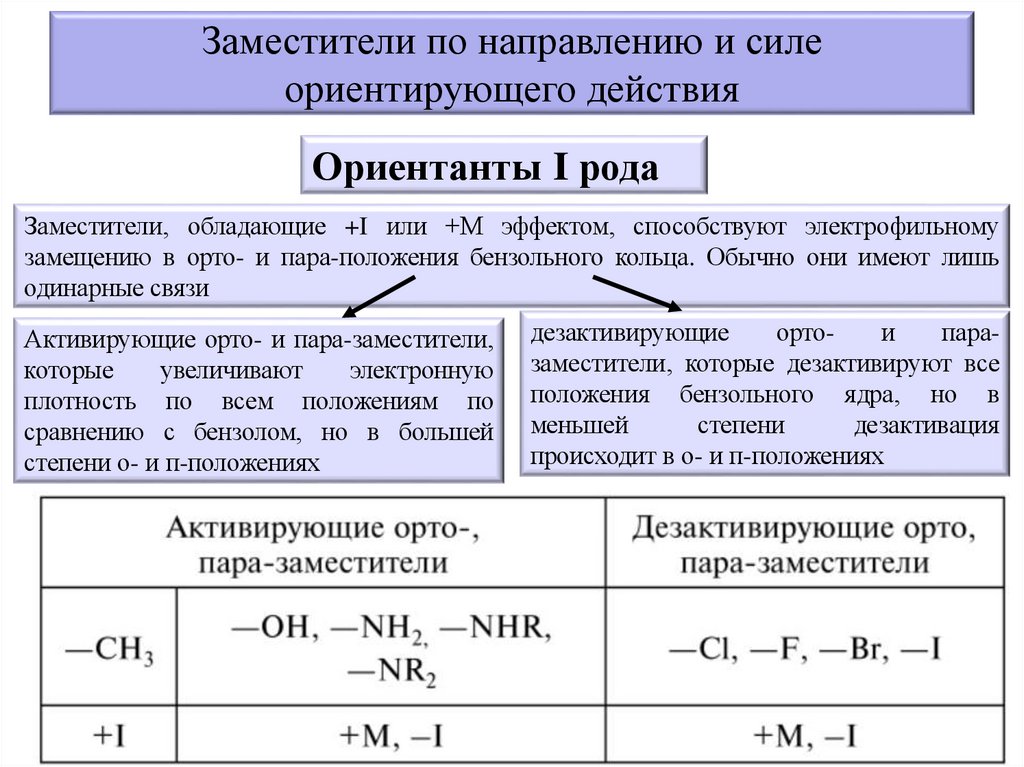
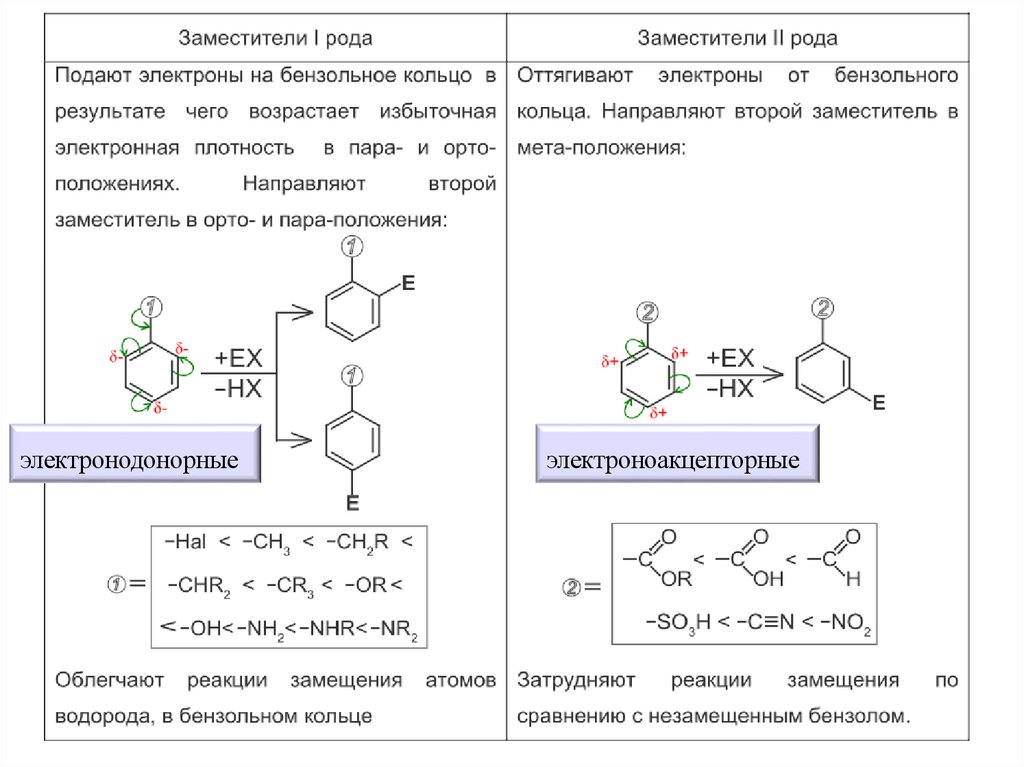
Заместители по направлению и силеориентирующего действия
Ориентанты I рода
Заместители, обладающие +I или +М эффектом, способствуют электрофильному
замещению в орто- и пара-положения бензольного кольца. Обычно они имеют лишь
одинарные связи
Активирующие орто- и пара-заместители,
которые
увеличивают
электронную
плотность по всем положениям по
сравнению с бензолом, но в большей
степени о- и п-положениях
дезактивирующие
ортои
паразаместители, которые дезактивируют все
положения бензольного ядра, но в
меньшей
степени
дезактивация
происходит в о- и п-положениях
74.
Заместители по направлению и силеориентирующего действия
Ориентанты II рода
Заместители, обладающие -I или -М эффектом, способствуют электрофильному
замещению в мета-положения бензольного кольца. Обычно они имеют двойные или
тройные связи.
Они дезактивируют все положения бензольного ядра, но в меньшей степени мположения.
75.
электронодонорныеэлектроноакцепторные
76.
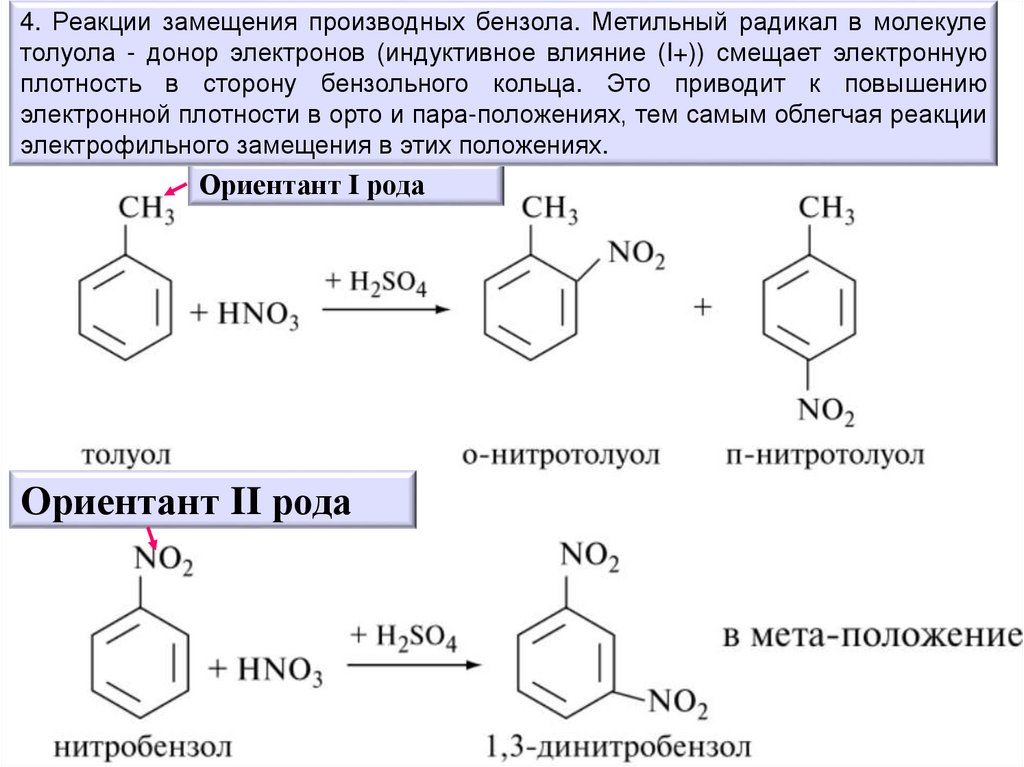
4. Реакции замещения производных бензола. Метильный радикал в молекулетолуола - донор электронов (индуктивное влияние (I+)) смещает электронную
плотность в сторону бензольного кольца. Это приводит к повышению
электронной плотности в орто и пара-положениях, тем самым облегчая реакции
электрофильного замещения в этих положениях.
Ориентант I рода
Ориентант II рода
77.
78.
79.
80.
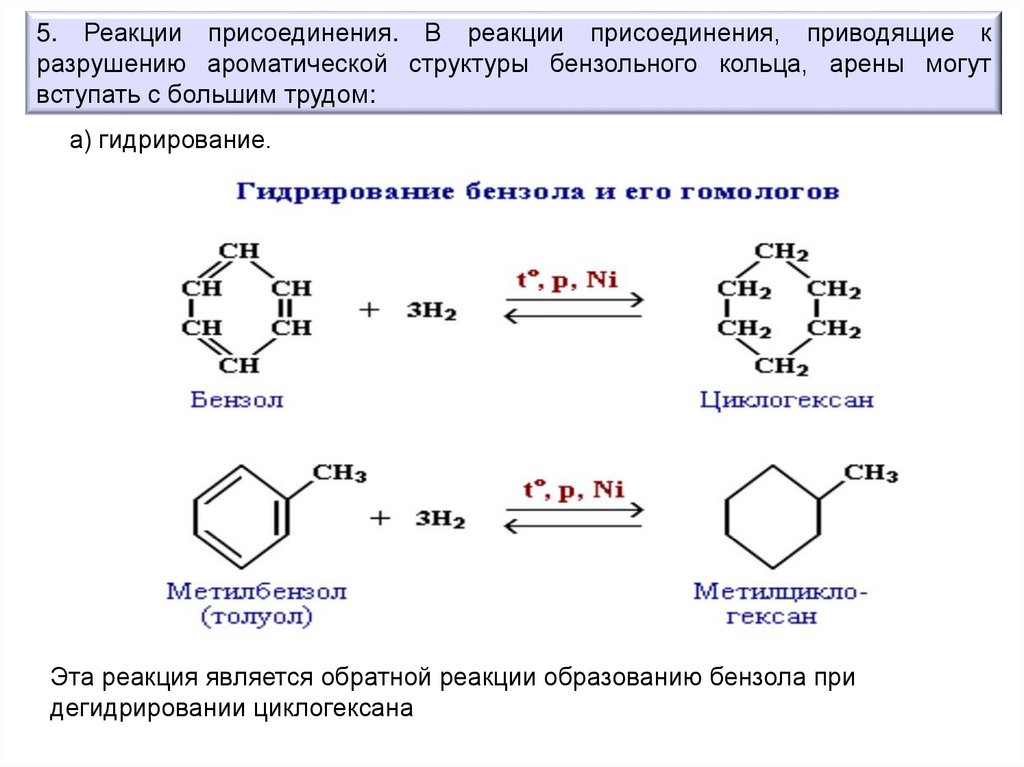
5. Реакции присоединения. В реакции присоединения, приводящие кразрушению ароматической структуры бензольного кольца, арены могут
вступать с большим трудом:
а) гидрирование.
Эта реакция является обратной реакции образованию бензола при
дегидрировании циклогексана
81.
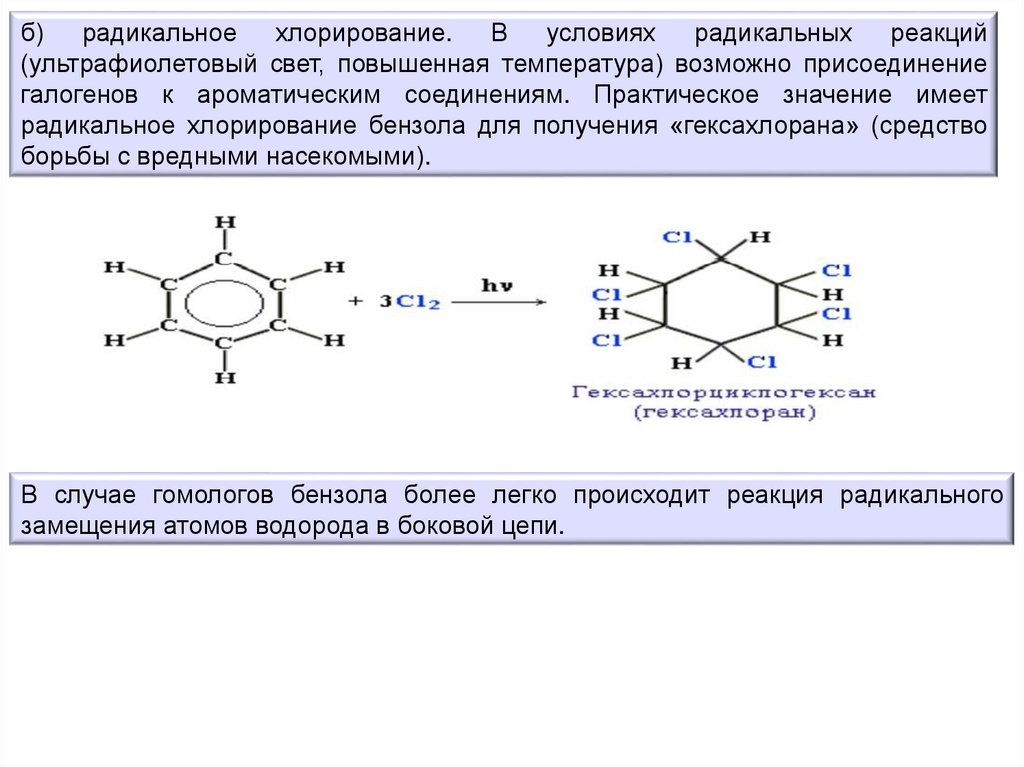
б) радикальное хлорирование. В условиях радикальных реакций(ультрафиолетовый свет, повышенная температура) возможно присоединение
галогенов к ароматическим соединениям. Практическое значение имеет
радикальное хлорирование бензола для получения «гексахлорана» (средство
борьбы с вредными насекомыми).
В случае гомологов бензола более легко происходит реакция радикального
замещения атомов водорода в боковой цепи.
82.
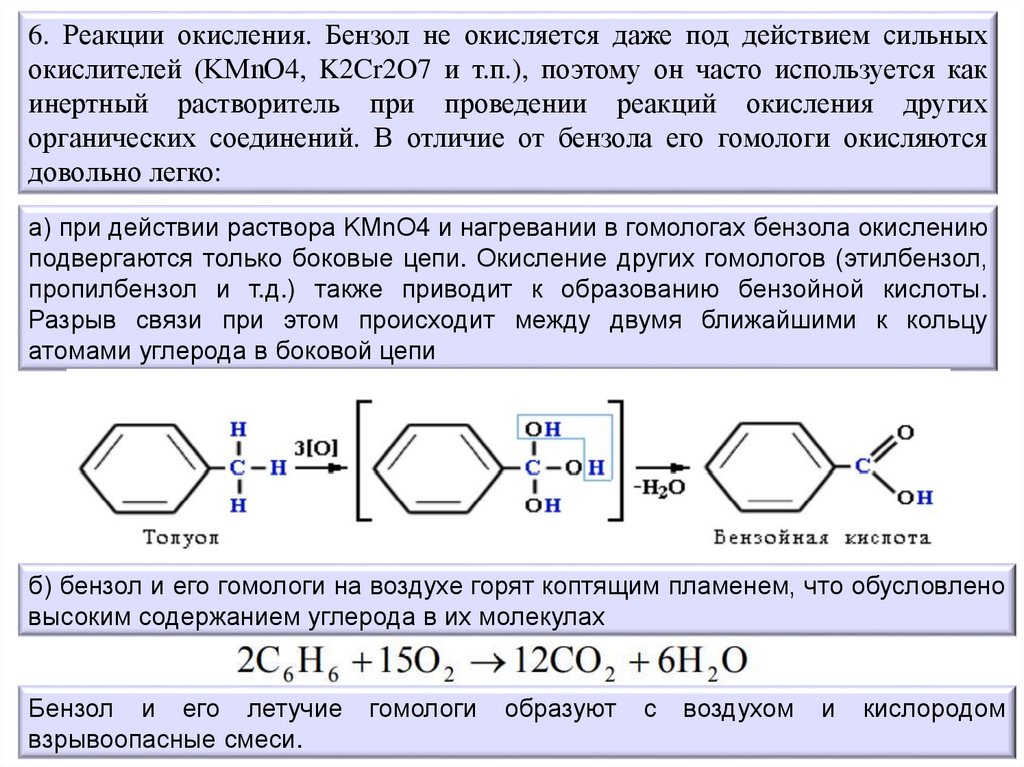
6. Реакции окисления. Бензол не окисляется даже под действием сильныхокислителей (KМnO4, K2Cr2O7 и т.п.), поэтому он часто используется как
инертный растворитель при проведении реакций окисления других
органических соединений. В отличие от бензола его гомологи окисляются
довольно легко:
а) при действии раствора KМnO4 и нагревании в гомологах бензола окислению
подвергаются только боковые цепи. Окисление других гомологов (этилбензол,
пропилбензол и т.д.) также приводит к образованию бензойной кислоты.
Разрыв связи при этом происходит между двумя ближайшими к кольцу
атомами углерода в боковой цепи
б) бензол и его гомологи на воздухе горят коптящим пламенем, что обусловлено
высоким содержанием углерода в их молекулах
Бензол и его летучие
взрывоопасные смеси.
гомологи
образуют
с
воздухом
и
кислородом























 Химия
Химия








