Похожие презентации:
Циклические алифатические углеводороды
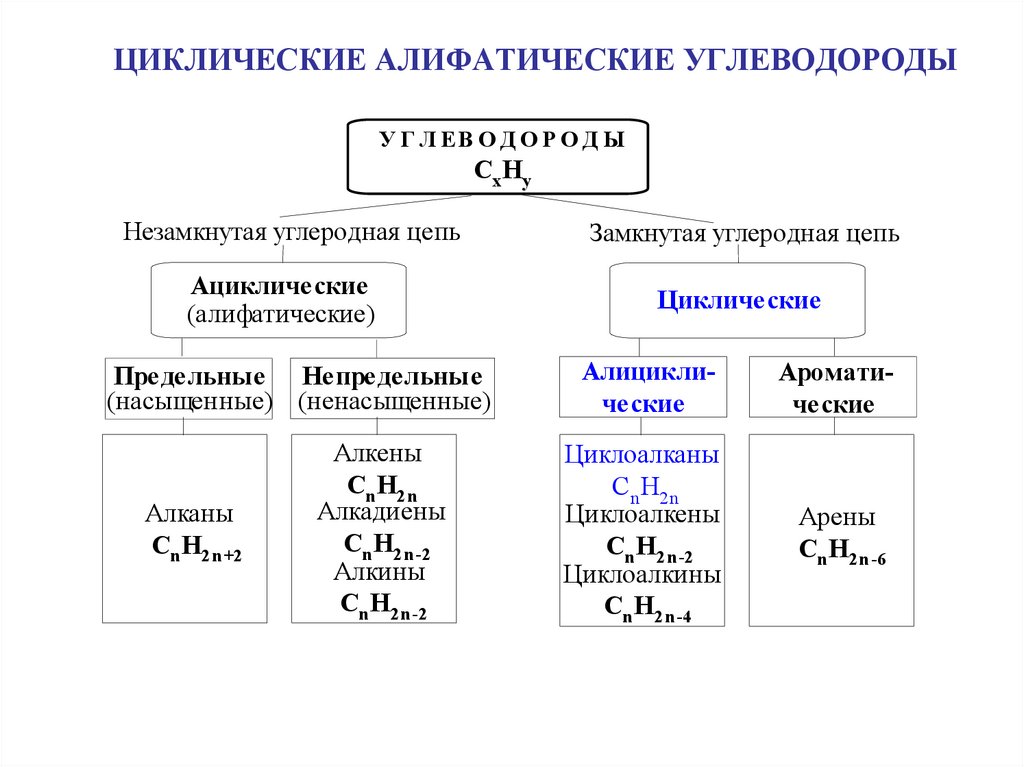
1. ЦИКЛИЧЕСКИЕ АЛИФАТИЧЕСКИЕ УГЛЕВОДОРОДЫ
У Г Л ЕВ О Д О Р О Д ЫCx Hy
Незамкнутая углеродная цепь
Ациклические
(алифатические)
Предельные Непредельные
(насыщенные) (ненасыщенные)
Алканы
Cn H2n+2
Алкены
Cn H2n
Алкадиены
Cn H2n-2
Алкины
Cn H2n-2
Замкнутая углеродная цепь
Циклические
Алициклические
Ароматические
Циклоалканы
Cn H2n
Циклоалкены
Cn H2n-2
Циклоалкины
Cn H2n-4
Арены
Cn H2n-6
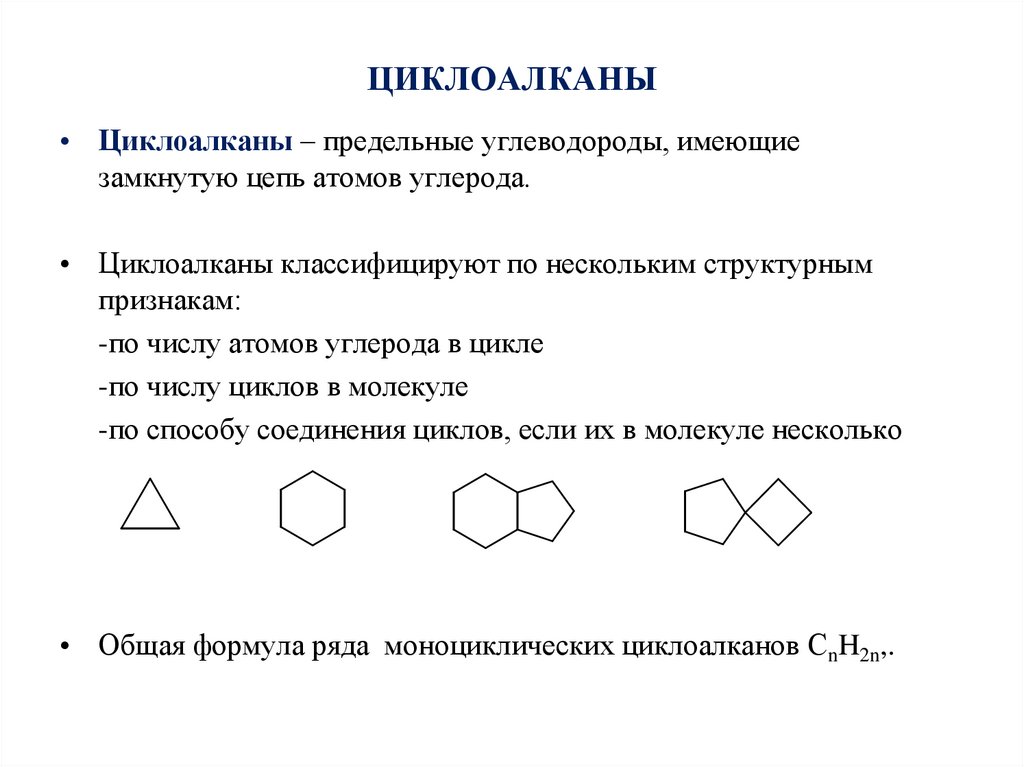
2. ЦИКЛОАЛКАНЫ
• Циклоалканы – предельные углеводороды, имеющиезамкнутую цепь атомов углерода.
• Циклоалканы классифицируют по нескольким структурным
признакам:
-по числу атомов углерода в цикле
-по числу циклов в молекуле
-по способу соединения циклов, если их в молекуле несколько
• Общая формула ряда моноциклических циклоалканов СnH2n,.
3.
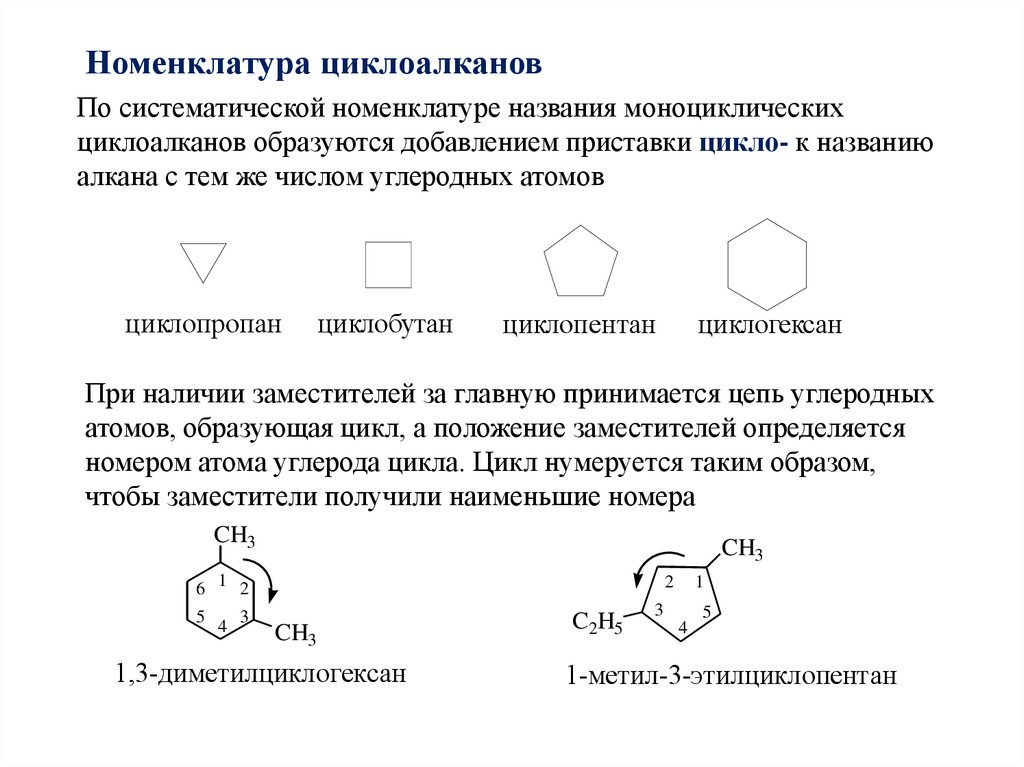
Номенклатура циклоалкановПо систематической номенклатуре названия моноциклических
циклоалканов образуются добавлением приставки цикло- к названию
алкана с тем же числом углеродных атомов
циклопропан
циклобутан
циклопентан
циклогексан
При наличии заместителей за главную принимается цепь углеродных
атомов, образующая цикл, а положение заместителей определяется
номером атома углерода цикла. Цикл нумеруется таким образом,
чтобы заместители получили наименьшие номера
CH3
CH3
6 1 2
5
4
3
2
CH3
1,3-диметилциклогексан
C2H5
1
3
4
5
1-метил-3-этилциклопентан
4.
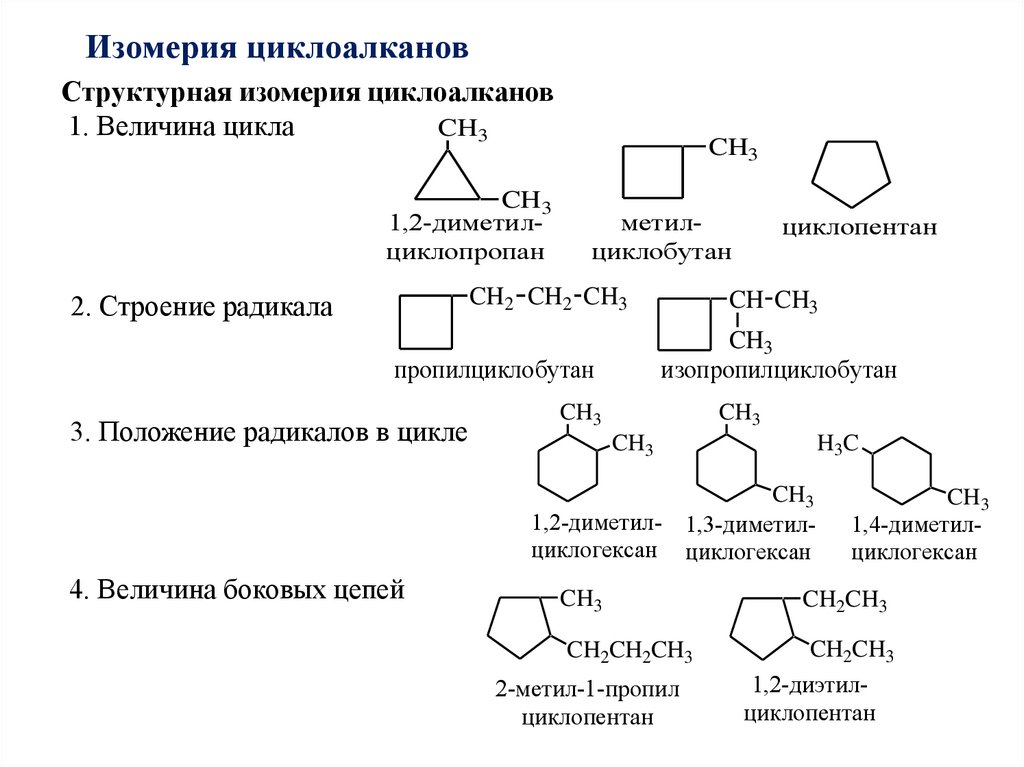
Изомерия циклоалкановСтруктурная изомерия циклоалканов
1. Величина цикла
CH3
CH3
1,2-диметилциклопропан
CH3
метилциклобутан
CH2 CH2 CH3
2. Строение радикала
CH CH3
CH3
изопропилциклобутан
пропилциклобутан
3. Положение радикалов в цикле
циклопентан
CH3
CH3
H 3C
CH3
CH3
1,2-диметил- 1,3-диметилциклогексан циклогексан
4. Величина боковых цепей
CH3
CH2CH2CH3
2-метил-1-пропил
циклопентан
CH3
1,4-диметилциклогексан
CH2CH3
CH2CH3
1,2-диэтилциклопентан
5.
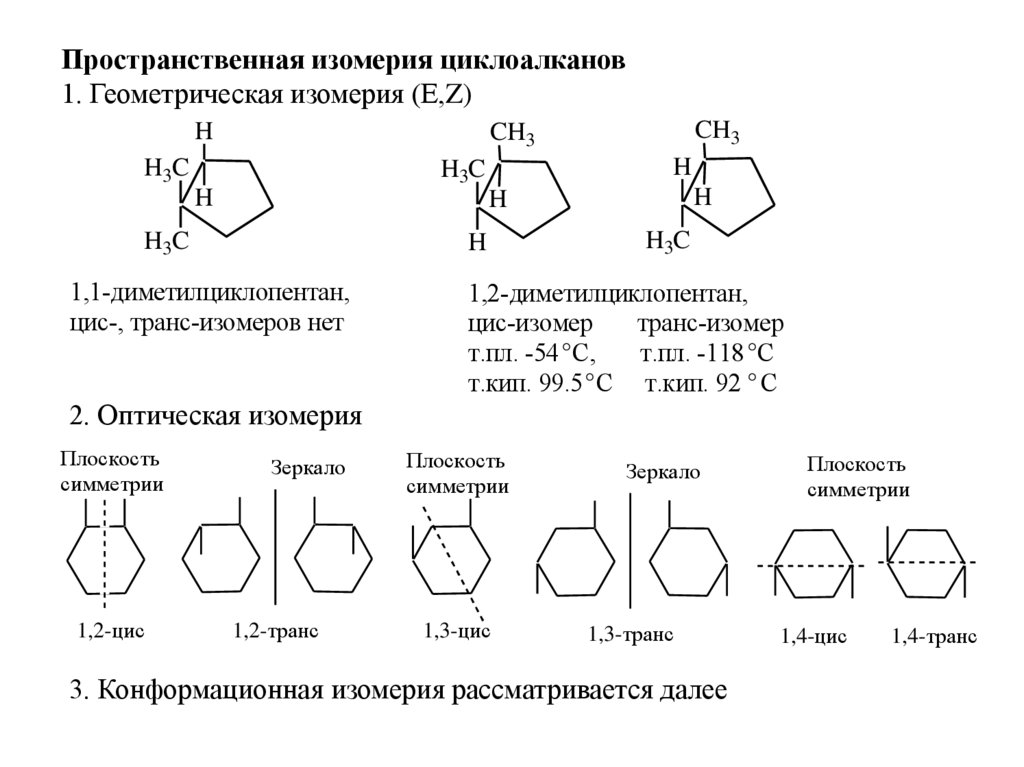
Пространственная изомерия циклоалканов1. Геометрическая изомерия (Е,Z)
H
CH3
CH3
H3C
H
H3C
H
H
H
H3C
H
1,1-диметилциклопентан,
цис-, транс-изомеров нет
H3C
1,2-диметилциклопентан,
цис-изомер
транс-изомер
т.пл. -54 ° С,
т.пл. -118 °С
т.кип. 99.5 ° С т.кип. 92 ° С
2. Оптическая изомерия
Плоскость
симметрии
1,2-цис
Зеркало
1,2-транс
Плоскость
симметрии
1,3-цис
Зеркало
1,3-транс
3. Конформационная изомерия рассматривается далее
Плоскость
симметрии
1,4-цис
1,4-транс
6.
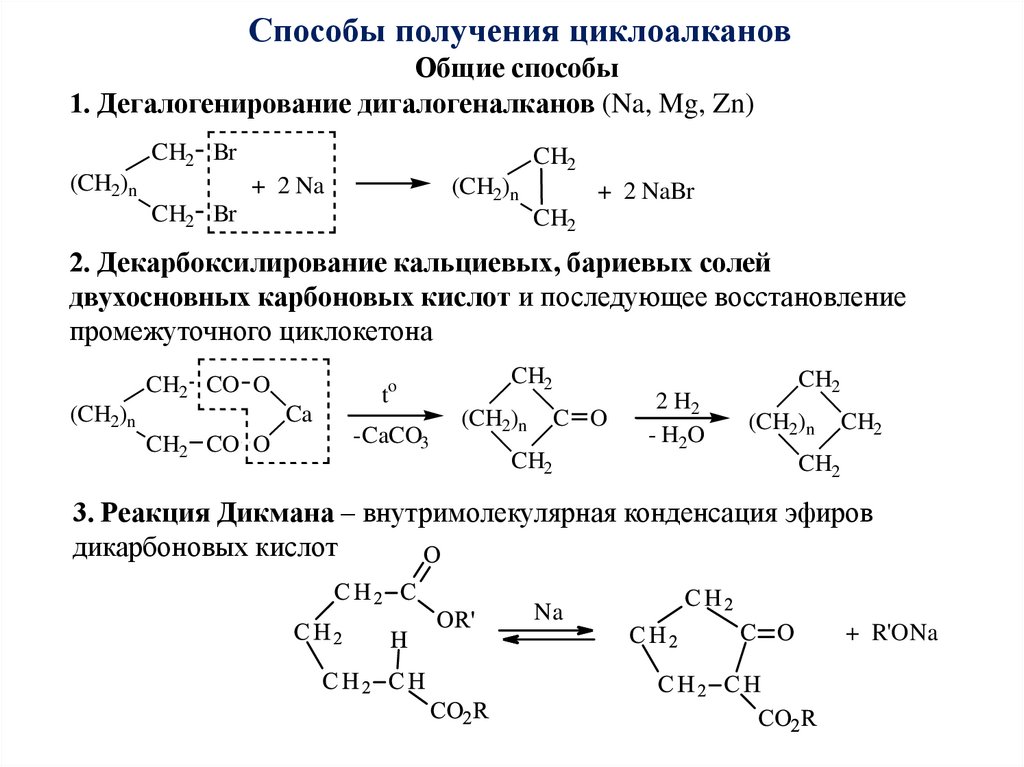
Способы получения циклоалкановОбщие способы
1. Дегалогенирование дигалогеналканов (Na, Mg, Zn)
CH2 Br
(CH2)n
CH2
+ 2 Na
(CH2)n
CH2 Br
+ 2 NaBr
CH2
2. Декарбоксилирование кальциевых, бариевых солей
двухосновных карбоновых кислот и последующее восстановление
промежуточного циклокетона
CH2 CO O
(CH2)n
Ca
CH2 CO O
to
-CaCO3
CH2
(CH2)n
C O
CH2
2 H2
- H2O
CH2
(CH2)n
CH2
CH2
3. Реакция Дикмана – внутримолекулярная конденсация эфиров
дикарбоновых кислот
Na
+ R'ONa
7.
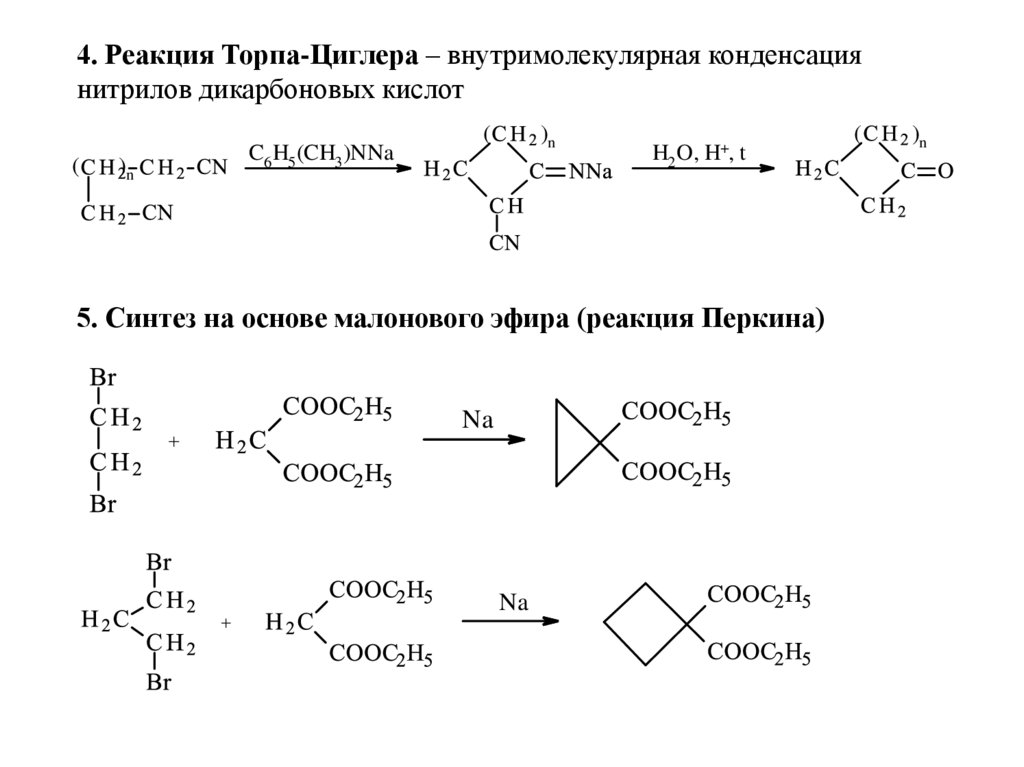
4. Реакция Торпа-Циглера – внутримолекулярная конденсациянитрилов дикарбоновых кислот
(
)n
C6H5(CH3)NNa
(
)n
H2O,
H+,
t
5. Синтез на основе малонового эфира (реакция Перкина)
Na
Na
(
)n
8.
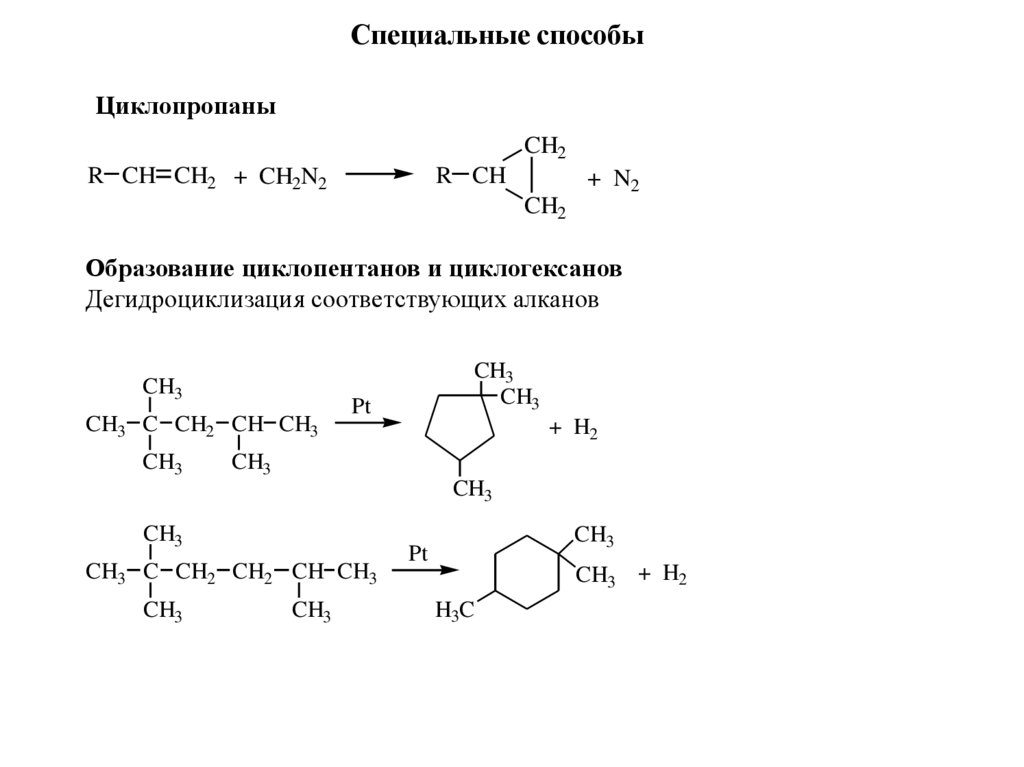
Специальные способыЦиклопропаны
CH2
R CH CH2 + CH2N2
R CH
+ N2
CH2
Образование циклопентанов и циклогексанов
Дегидроциклизация соответствующих алканов
CH3
CH3 C CH2 CH CH3
CH3
CH3
CH3
Pt
+ H2
CH3
CH3
CH3
CH3 C CH2 CH2 CH CH3
CH3
CH3
CH3
Pt
CH3 + H2
H3C
9.
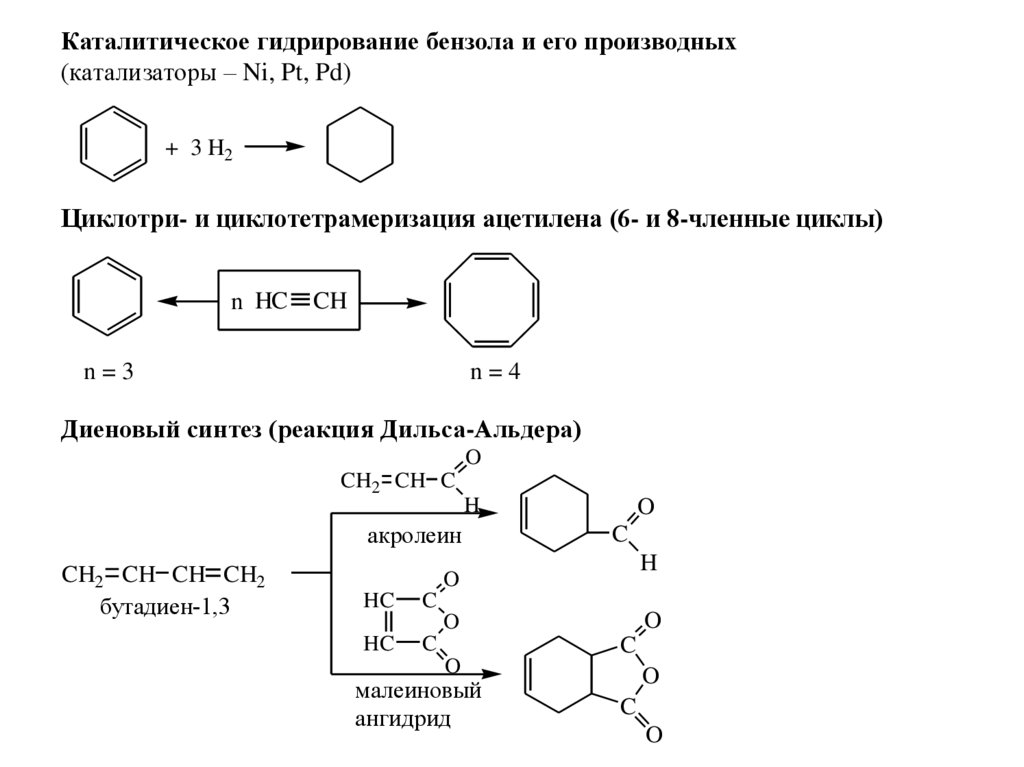
Каталитическое гидрирование бензола и его производных(катализаторы – Ni, Pt, Pd)
+ 3 H2
Циклотри- и циклотетрамеризация ацетилена (6- и 8-членные циклы)
n HC
CH
n=3
n=4
Диеновый синтез (реакция Дильса-Альдера)
O
CH2 CH C
H
акролеин
CH2 CH CH CH2
бутадиен-1,3
O
C
H
O
HC
C
O
O
HC
C
C
O
малеиновый
ангидрид
O
C
O
10.
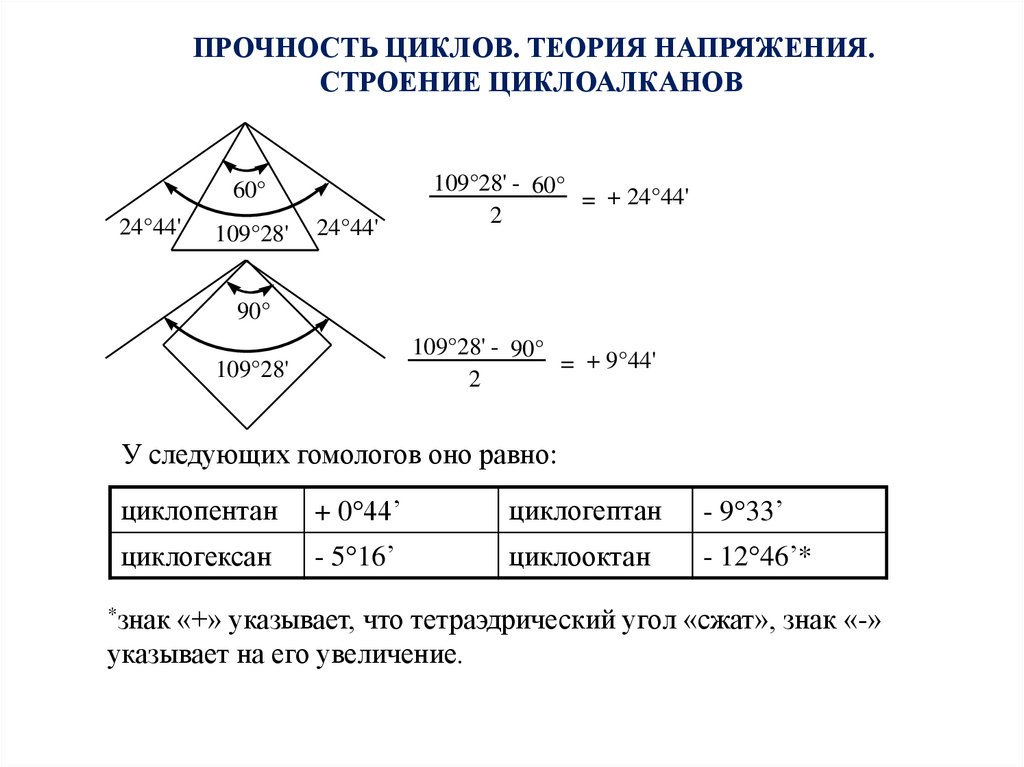
ПРОЧНОСТЬ ЦИКЛОВ. ТЕОРИЯ НАПРЯЖЕНИЯ.СТРОЕНИЕ ЦИКЛОАЛКАНОВ
60°
24°44'
109°28'
24°44'
109°28' - 60°
= + 24°44'
2
90°
109°28' - 90°
= + 9°44'
2
109°28'
У следующих гомологов оно равно:
циклопентан
+ 0 44’
циклогептан
- 9 33’
циклогексан
- 5 16’
циклооктан
- 12 46’*
*знак
«+» указывает, что тетраэдрический угол «сжат», знак «-»
указывает на его увеличение.
11.
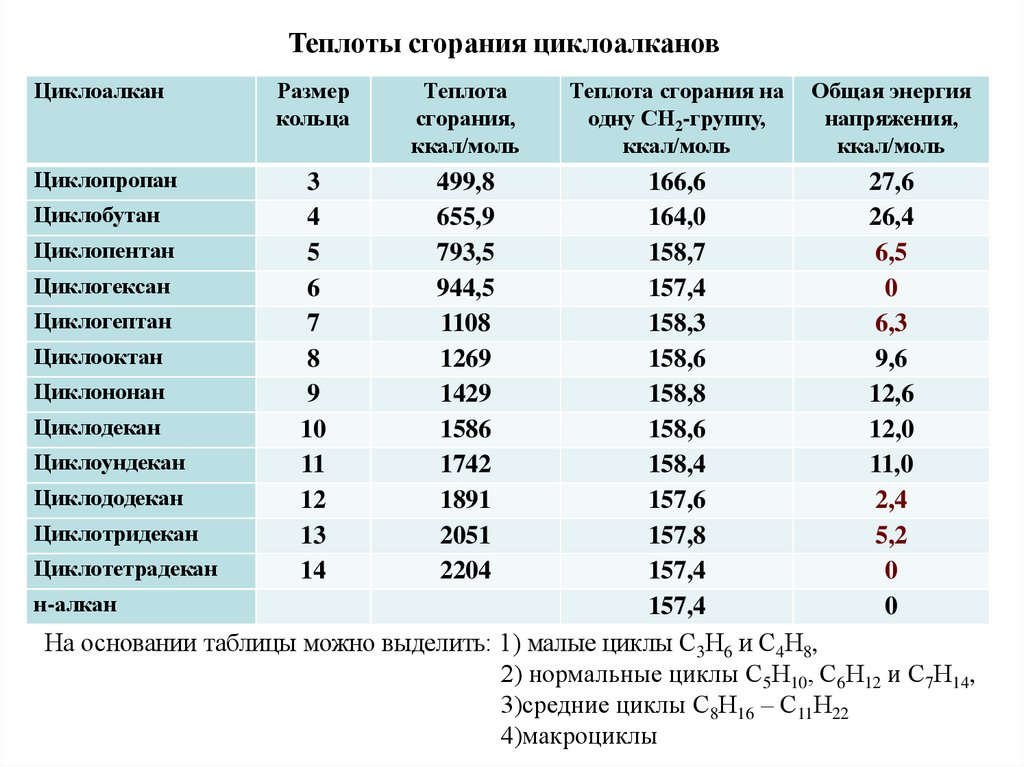
Теплоты сгорания циклоалкановЦиклоалкан
Размер
кольца
Теплота
сгорания,
ккал/моль
Циклопропан
3
4
5
6
7
8
9
10
11
12
13
14
499,8
655,9
793,5
944,5
1108
1269
1429
1586
1742
1891
2051
2204
Теплота сгорания на
одну СН2-группу,
ккал/моль
Общая энергия
напряжения,
ккал/моль
166,6
27,6
Циклобутан
164,0
26,4
Циклопентан
158,7
6,5
Циклогексан
157,4
0
Циклогептан
158,3
6,3
Циклооктан
158,6
9,6
Циклононан
158,8
12,6
Циклодекан
158,6
12,0
Циклоундекан
158,4
11,0
Циклододекан
157,6
2,4
Циклотридекан
157,8
5,2
Циклотетрадекан
157,4
0
н-алкан
157,4
0
На основании таблицы можно выделить: 1) малые циклы С3Н6 и С4Н8,
2) нормальные циклы С5Н10, С6Н12 и С7Н14,
3)средние циклы С8Н16 – С11Н22
4)макроциклы
12.
Общая энергия напряжения является суммой трех основныхсоставляющих:
• Угловое напряжение (напряжение углерод-углеродных связей,
напряжение Байера) вызвано растяжением или сжатием валентных
углов и отклонением их от тетраэдрического 109°29’.
• Торсионное напряжение (напряжение заслоненных С-Н связей,
напряжение Питцера) по своей природе аналогично отталкиванию
атомов водорода в заслоненной конформации этана и других
алканов для двух соседних С-Н связей. Энергия этого
взаимодействия оценивается приблизительно 1 ккал/моль.
• Трансаннулярное напряжение (напряжение Прелога)
обусловлено взаимодействием в пространстве двух или большего
числа атомов водорода при атомах углерода на противоположных
концах цикла. Его следует принимать во внимание, главным
образом, для средних циклов С8-С11.
13.
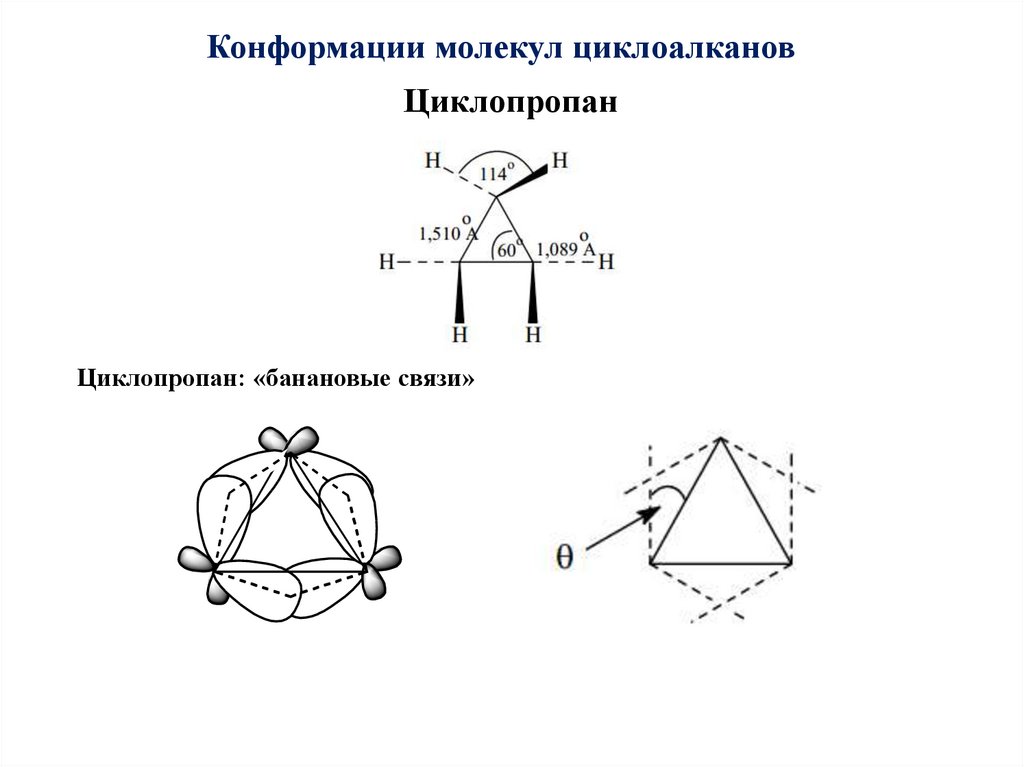
Конформации молекул циклоалкановЦиклопропан
Циклопропан: «банановые связи»
14.
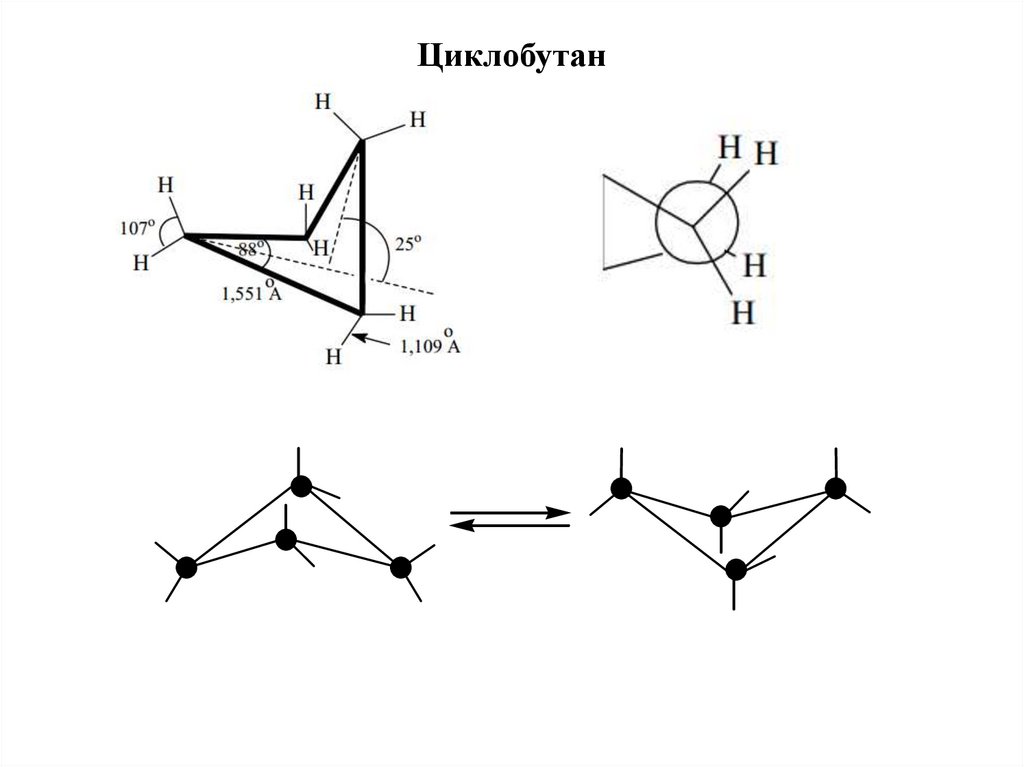
Циклобутан15.
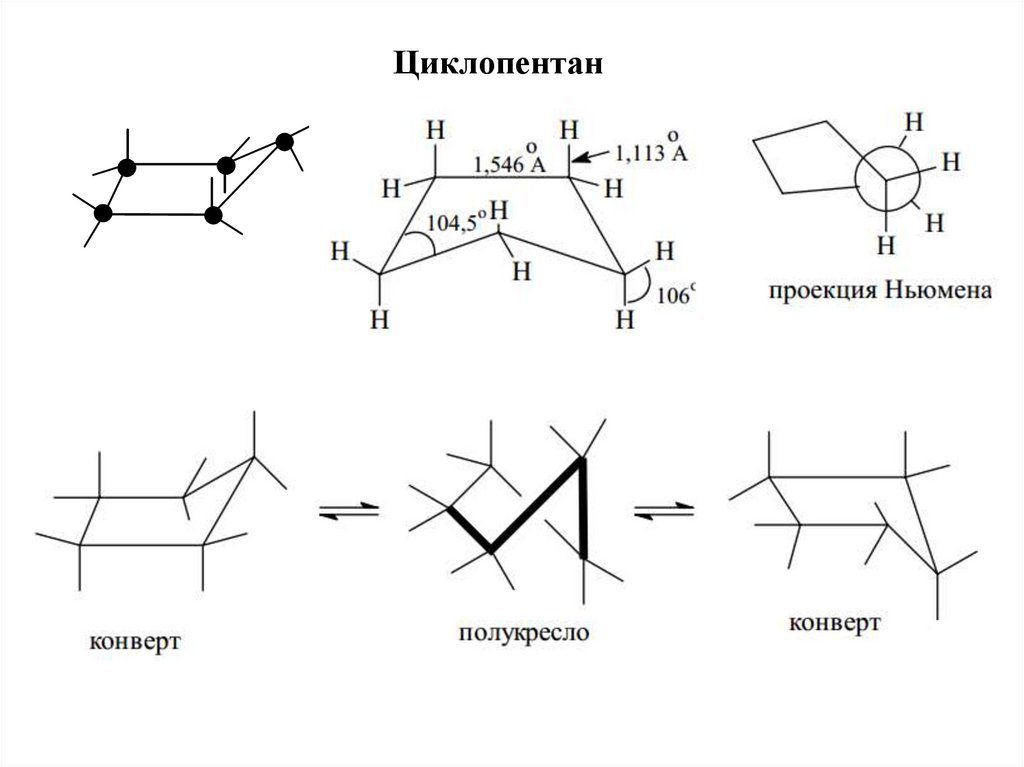
Циклопентан16.
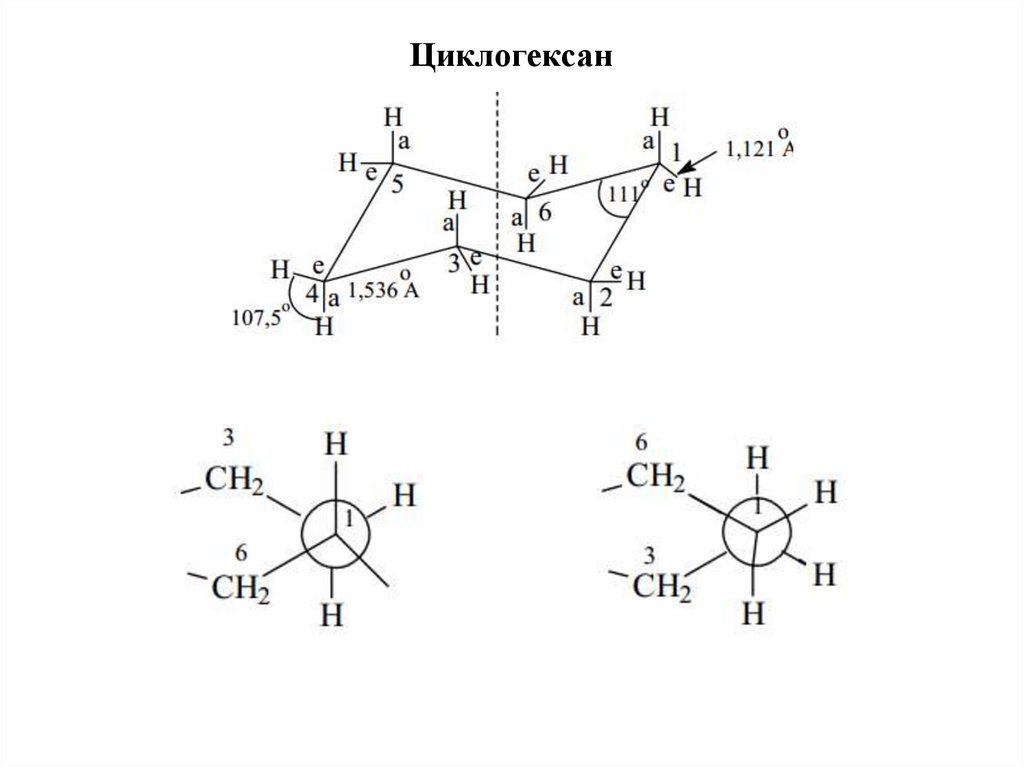
Циклогексан17.
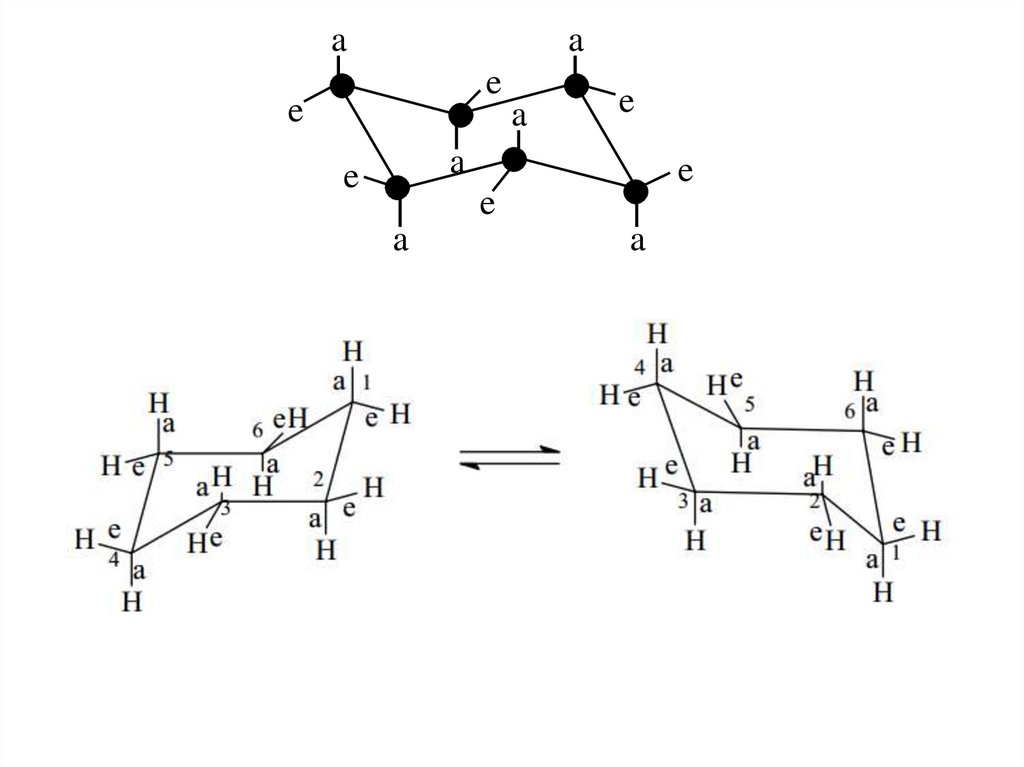
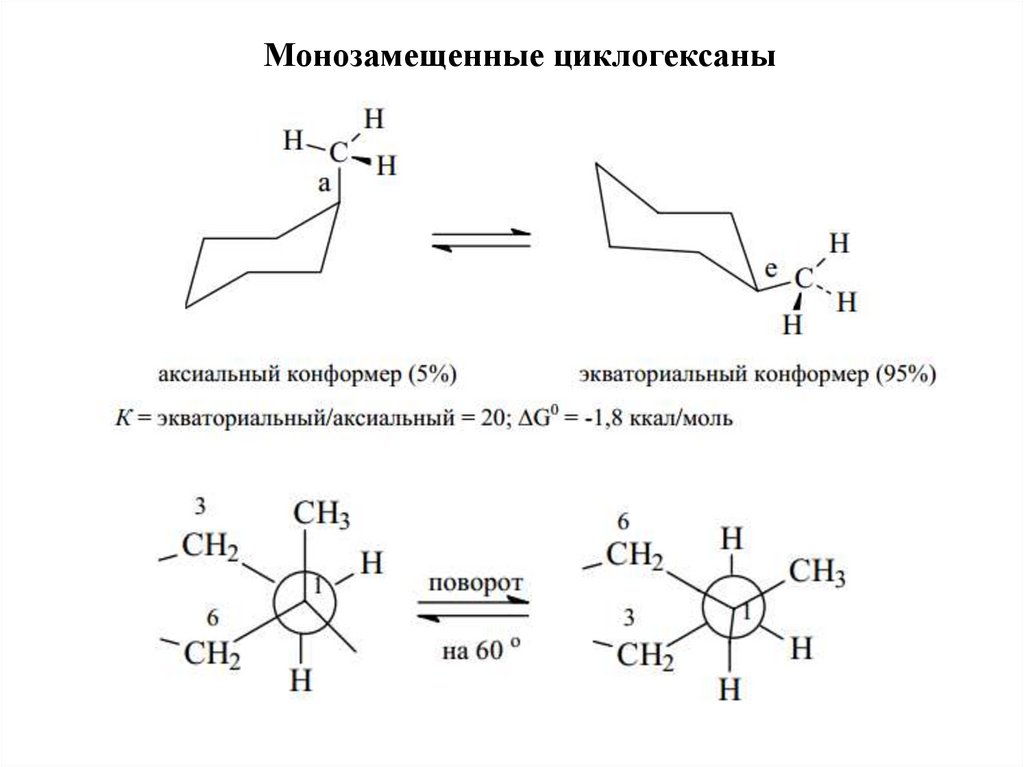
aa
e
e
a
e
a
e
e
e
a
a
18.
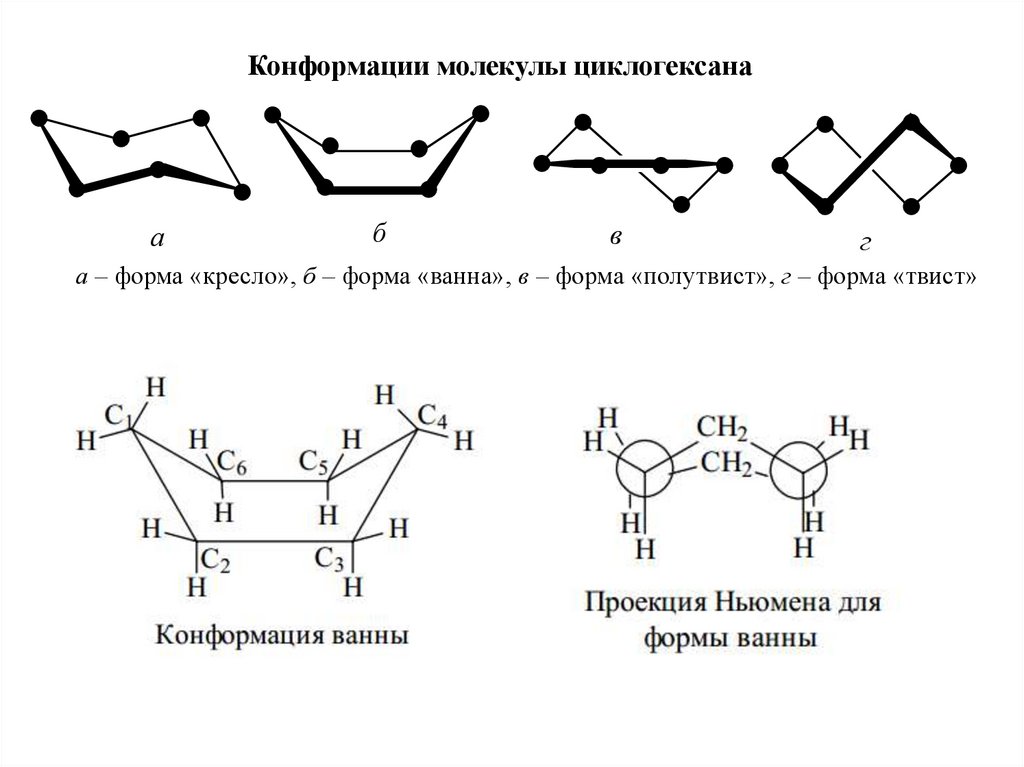
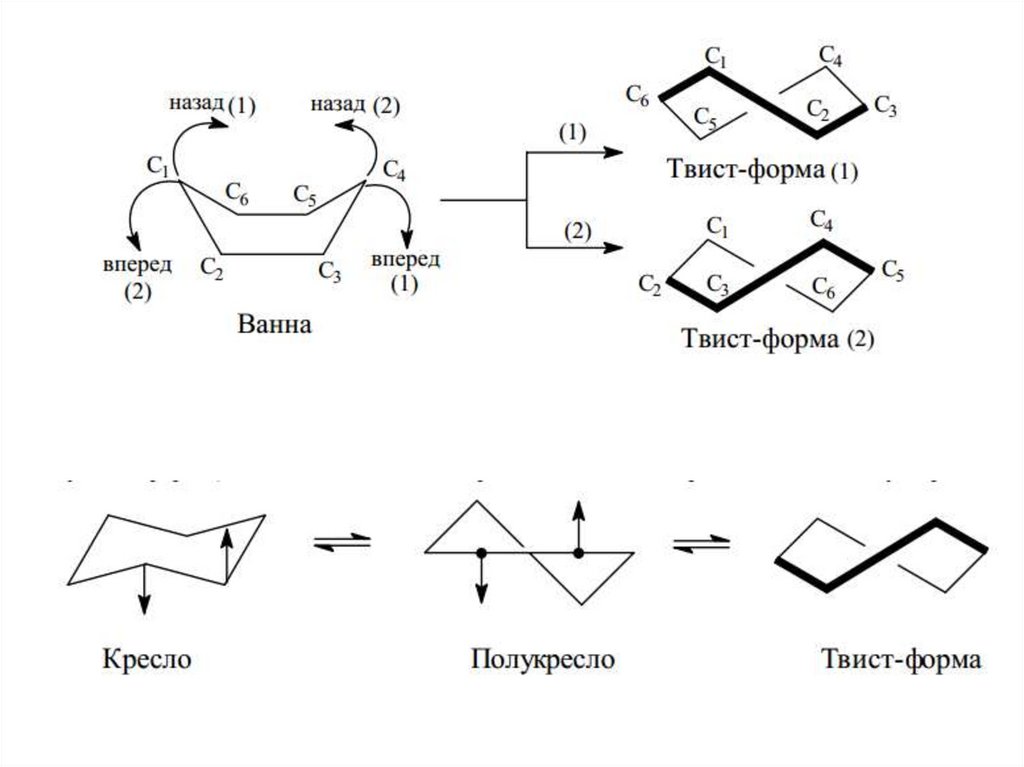
Конформации молекулы циклогексанаа
б
в
г
а – форма «кресло», б – форма «ванна», в – форма «полутвист», г – форма «твист»
19.
20.
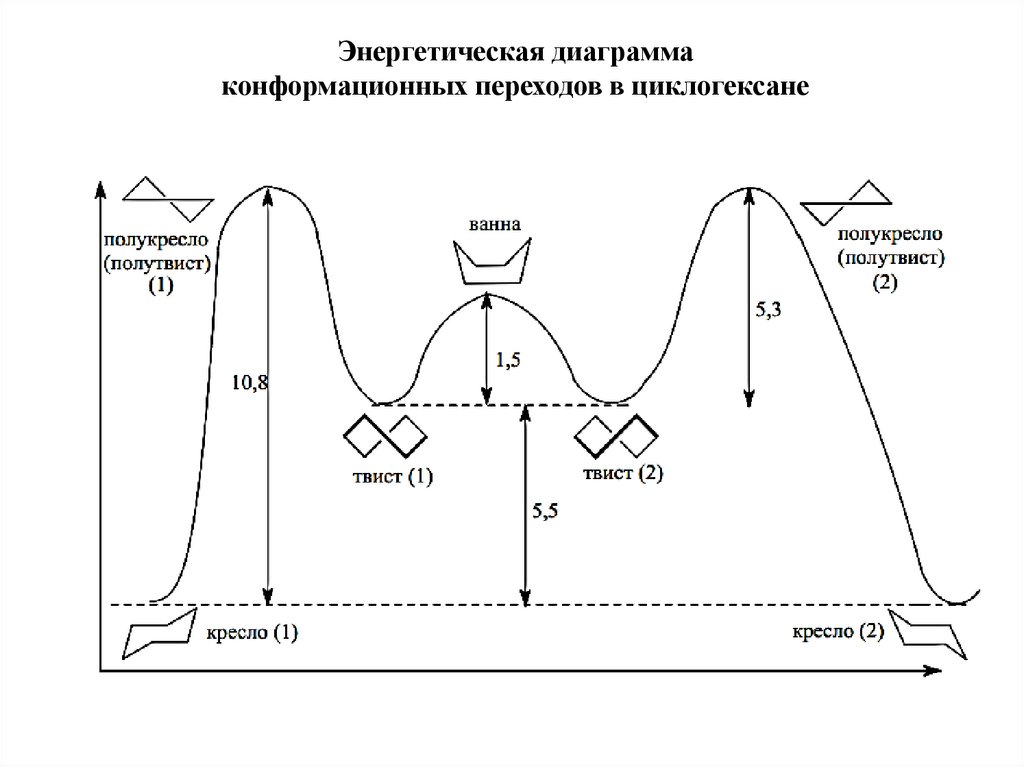
Энергетическая диаграммаконформационных переходов в циклогексане
21.
Монозамещенные циклогексаны22.
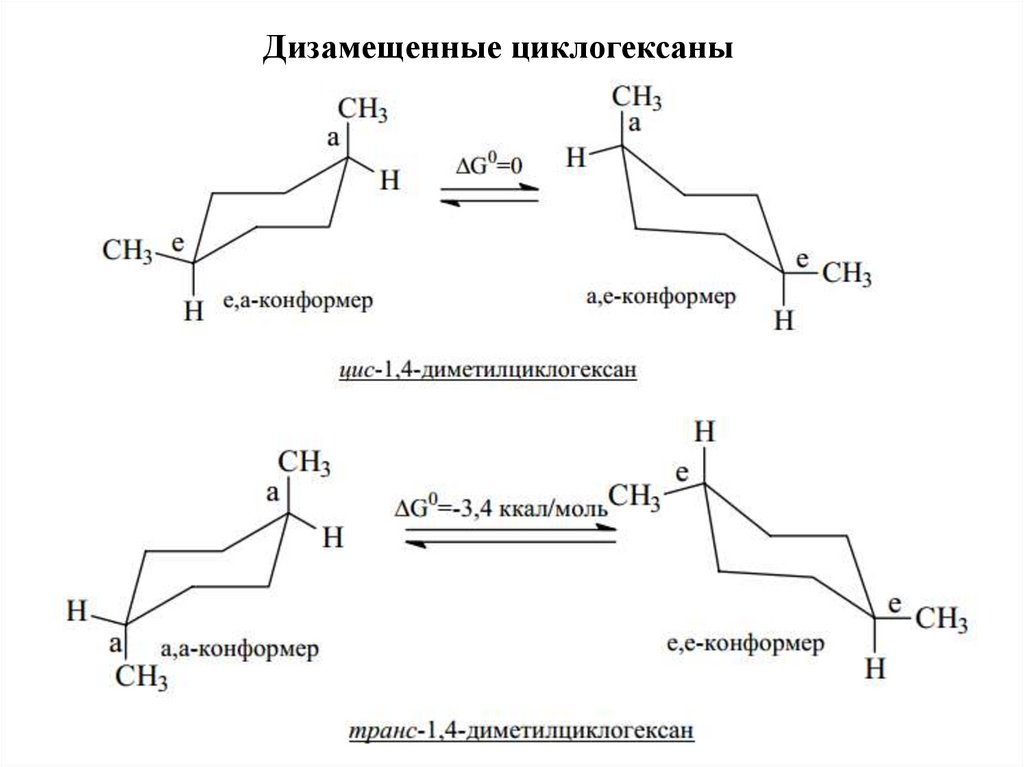
Дизамещенные циклогексаны23.
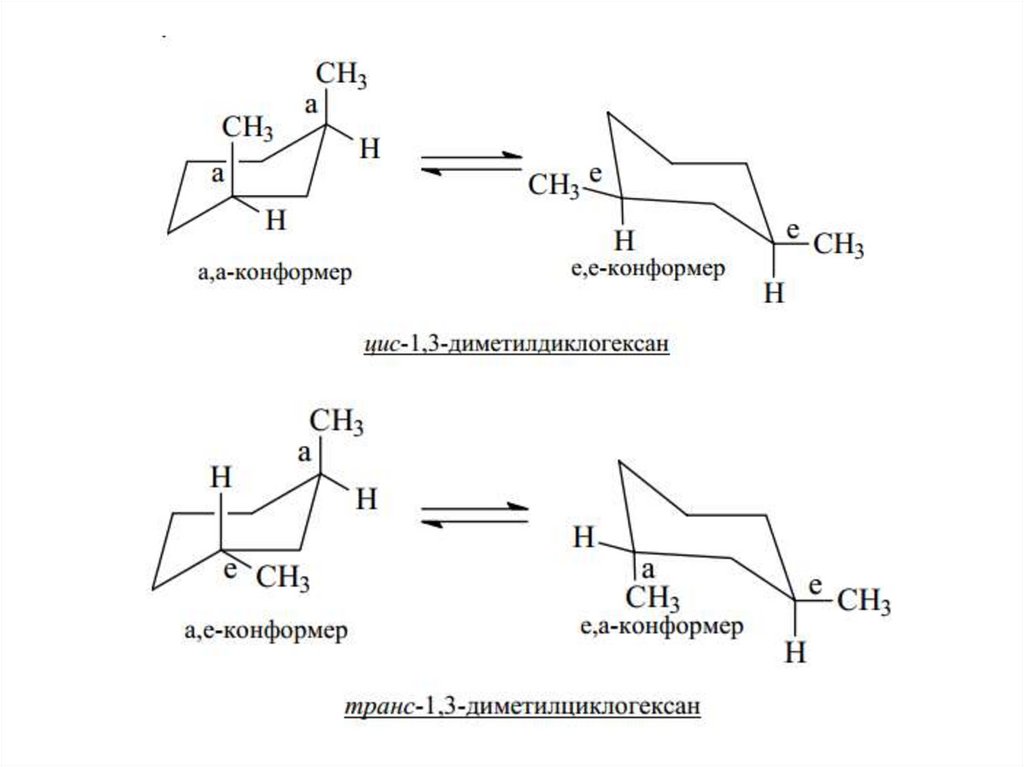
24.
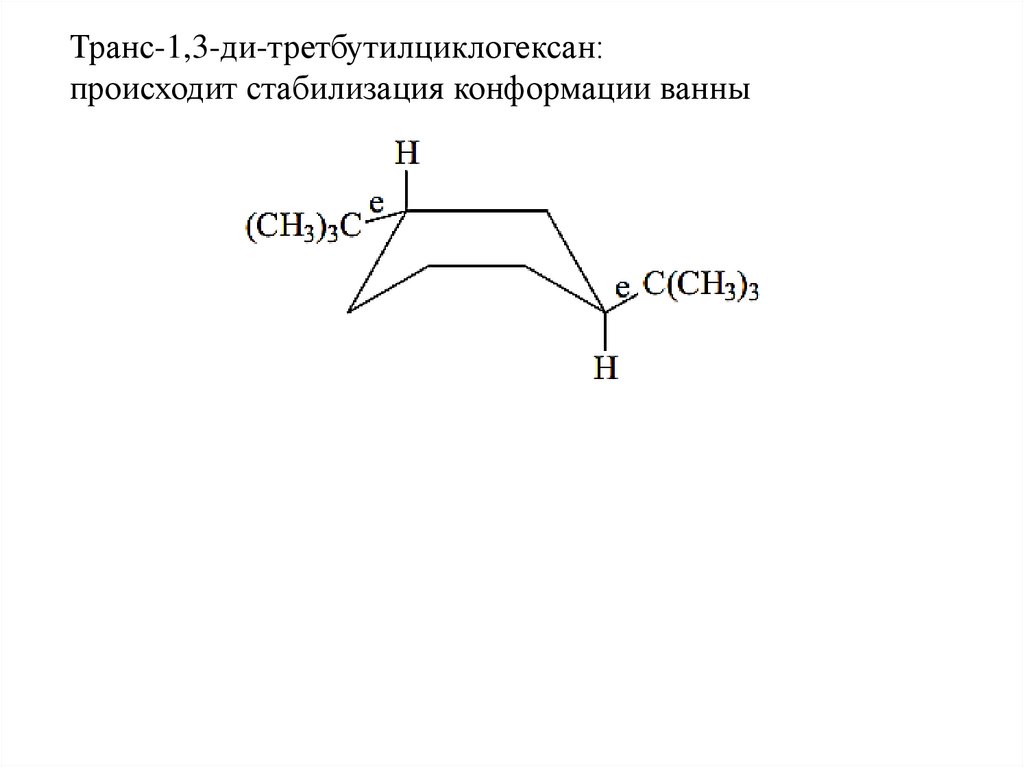
Транс-1,3-ди-третбутилциклогексан:происходит стабилизация конформации ванны
25.
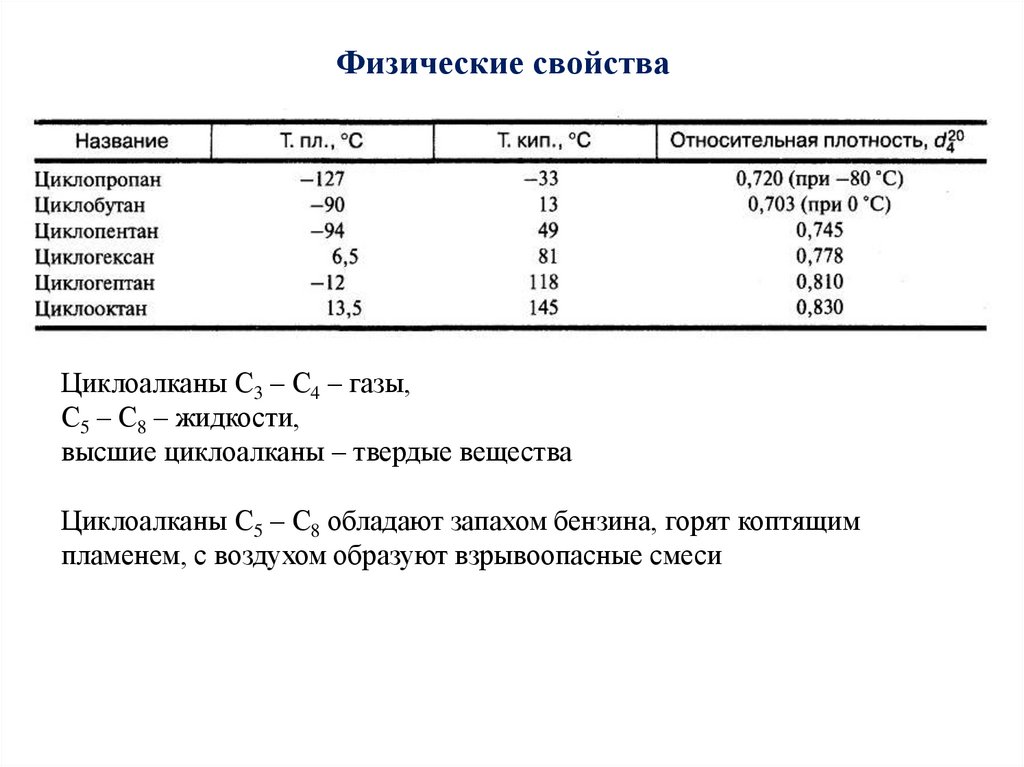
Физические свойстваЦиклоалканы С3 – С4 – газы,
С5 – С8 – жидкости,
высшие циклоалканы – твердые вещества
Циклоалканы С5 – С8 обладают запахом бензина, горят коптящим
пламенем, с воздухом образуют взрывоопасные смеси
26. Химические свойства циклоалканов
Направления химических превращений циклоалканов:• Раскрытие кольца (реакции присоединения подобно
алкенам).
• Замещение атомов водорода при углеродных атомах
кольца, окисление, дегидрирование (подобно
ациклическим аналогам).
• Превращения, обусловленные наличием цикла
(изомеризация циклов: сужение, расширение).
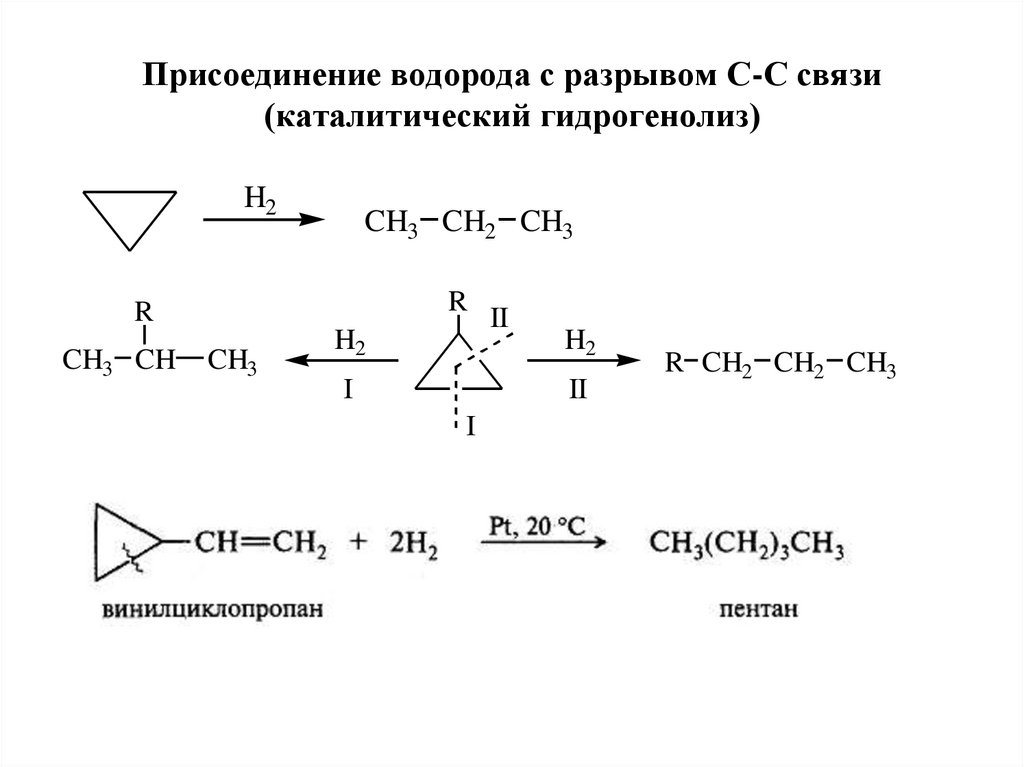
27. Присоединение водорода с разрывом С-С связи (каталитический гидрогенолиз)
H2CH3 CH2 CH3
R
R
CH3 CH
CH3
H2
I
II
H2
II
I
R CH2 CH2 CH3
28.
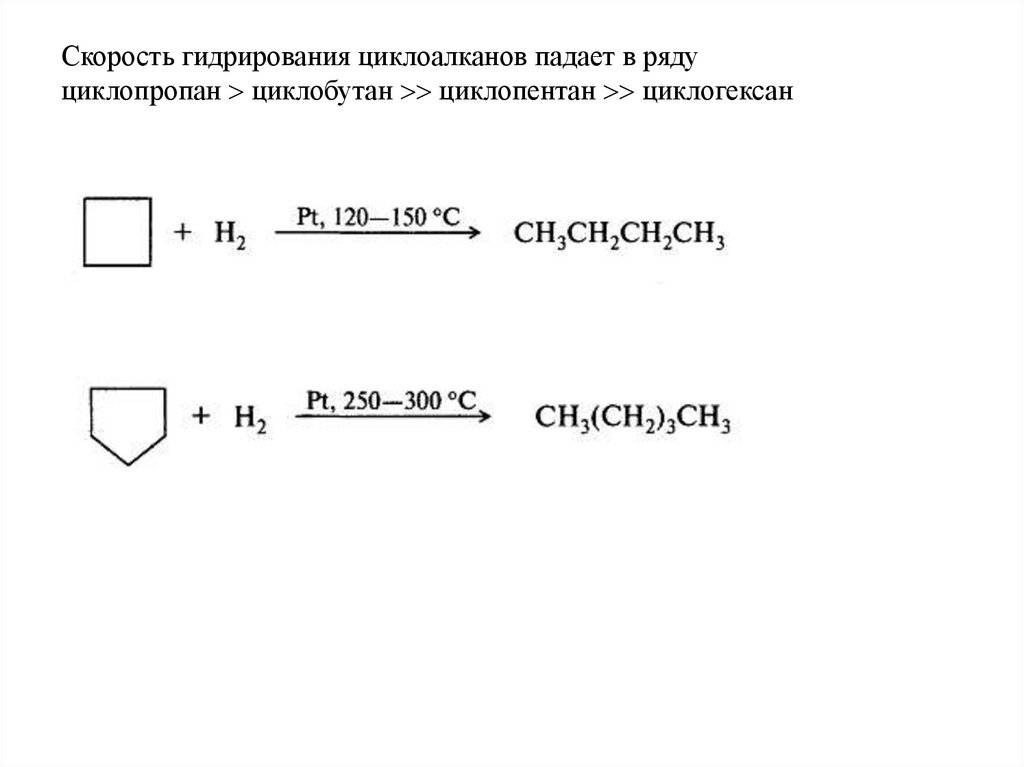
Скорость гидрирования циклоалканов падает в рядуциклопропан циклобутан циклопентан циклогексан
29.
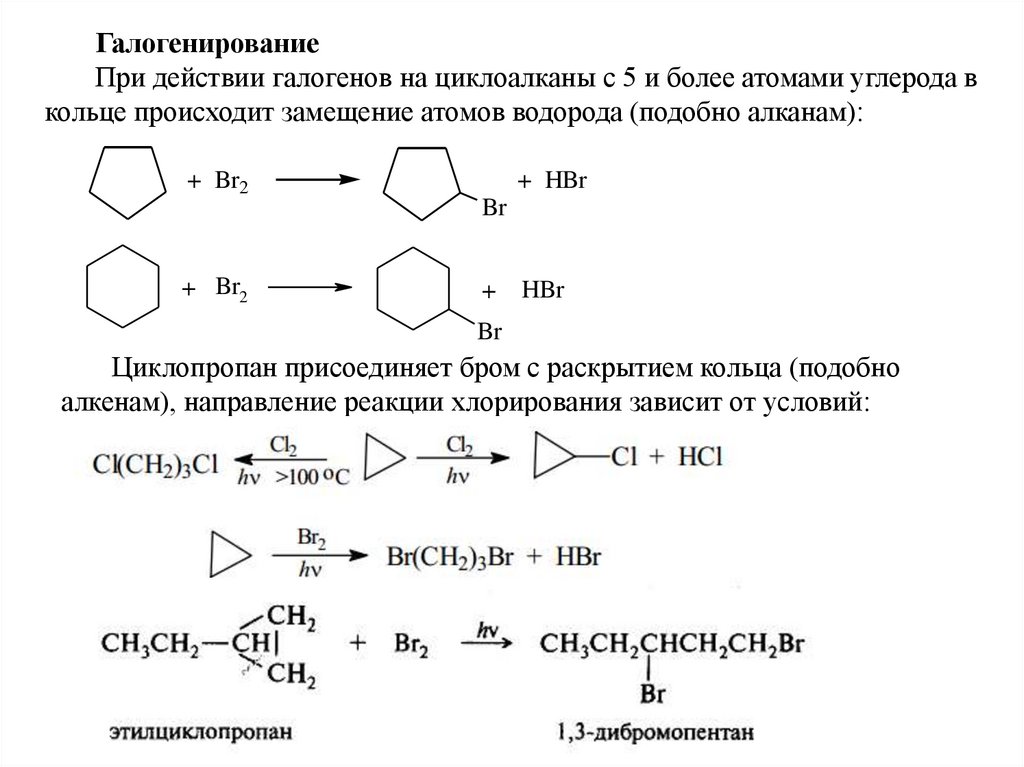
ГалогенированиеПри действии галогенов на циклоалканы с 5 и более атомами углерода в
кольце происходит замещение атомов водорода (подобно алканам):
+ Br2
+ HBr
Br
+ Br2
+
HBr
Br
Циклопропан присоединяет бром с раскрытием кольца (подобно
алкенам), направление реакции хлорирования зависит от условий:
30.
ГидрогалогенированиеH3C
HBr
H3C CH CH2 CH3
Br
2-бромбутан
В водном растворе присоединение идет по правилу Марковникова.
Сухой бромистый водород не расщепляет циклопропановое кольцо и
при 300°С.
Циклобутан и высшие циклоалканы галогеноводородов не
присоединяют
31.
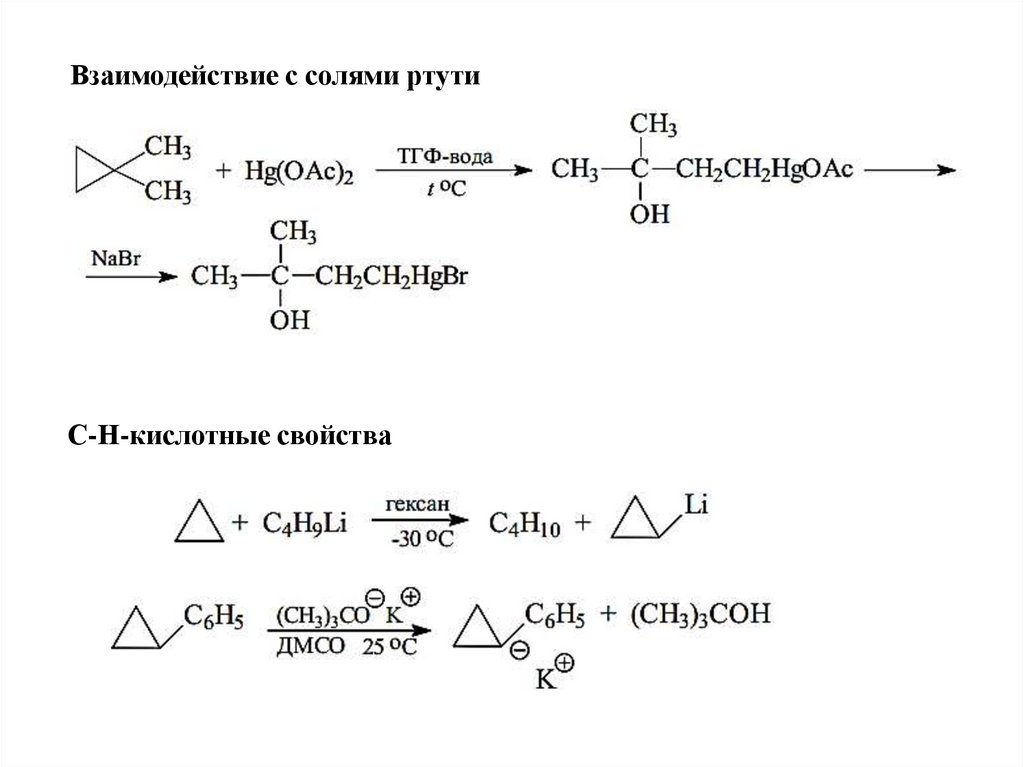
Взаимодействие с солями ртутиС-Н-кислотные свойства
32.
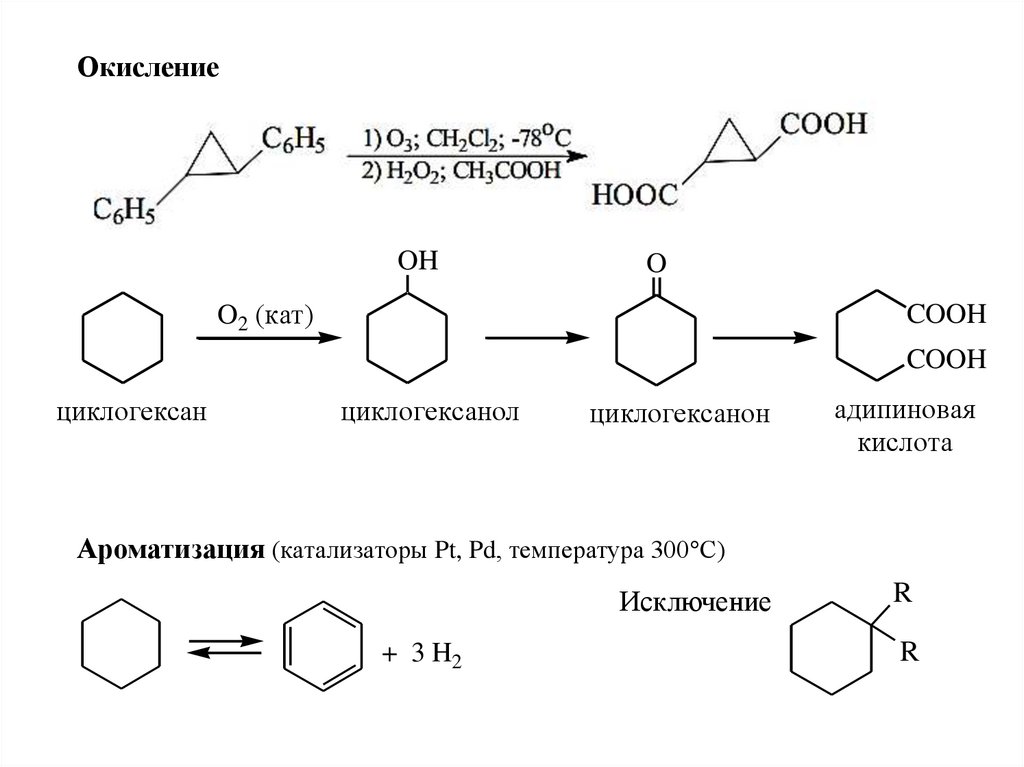
ОкислениеOH
O
O2 (кат)
COOH
COOH
циклогексан
циклогексанол
циклогексанон
адипиновая
кислота
Ароматизация (катализаторы Pt, Pd, температура 300 С)
Исключение
+ 3 H2
R
R
33.
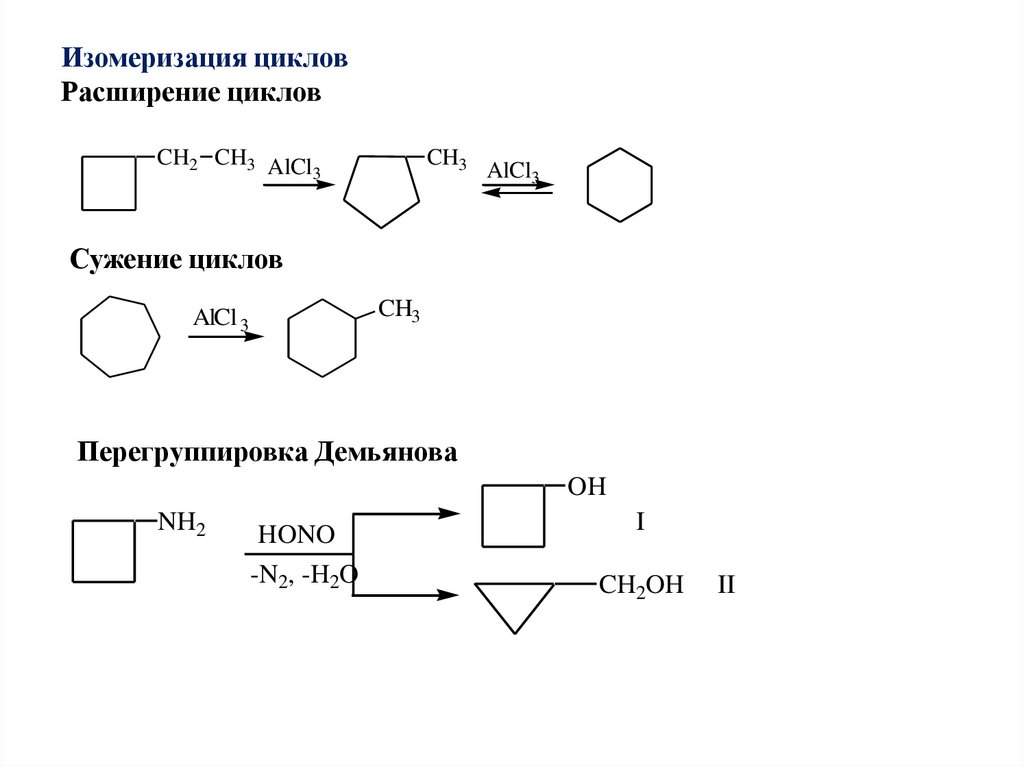
Изомеризация цикловРасширение циклов
CH2 CH3 AlCl
3
CH3
AlCl3
Сужение циклов
CH3
AlCl 3
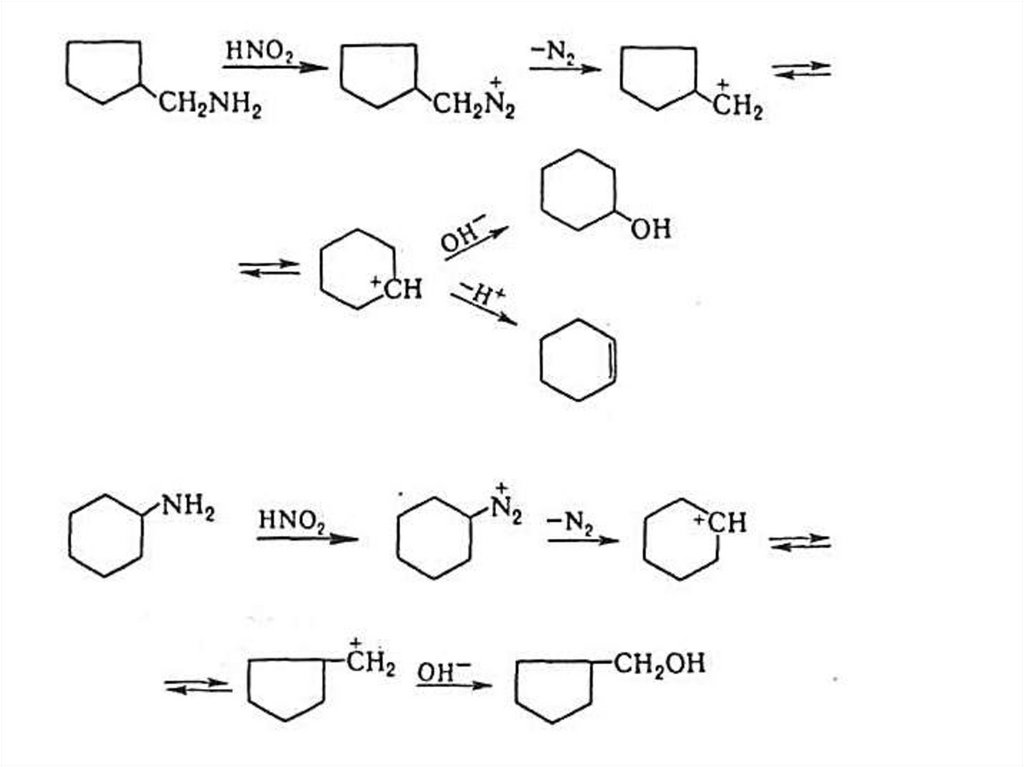
Перегруппировка Демьянова
OH
NH2
HONO
-N2, -H2O
I
CH2OH
II
34.
35.
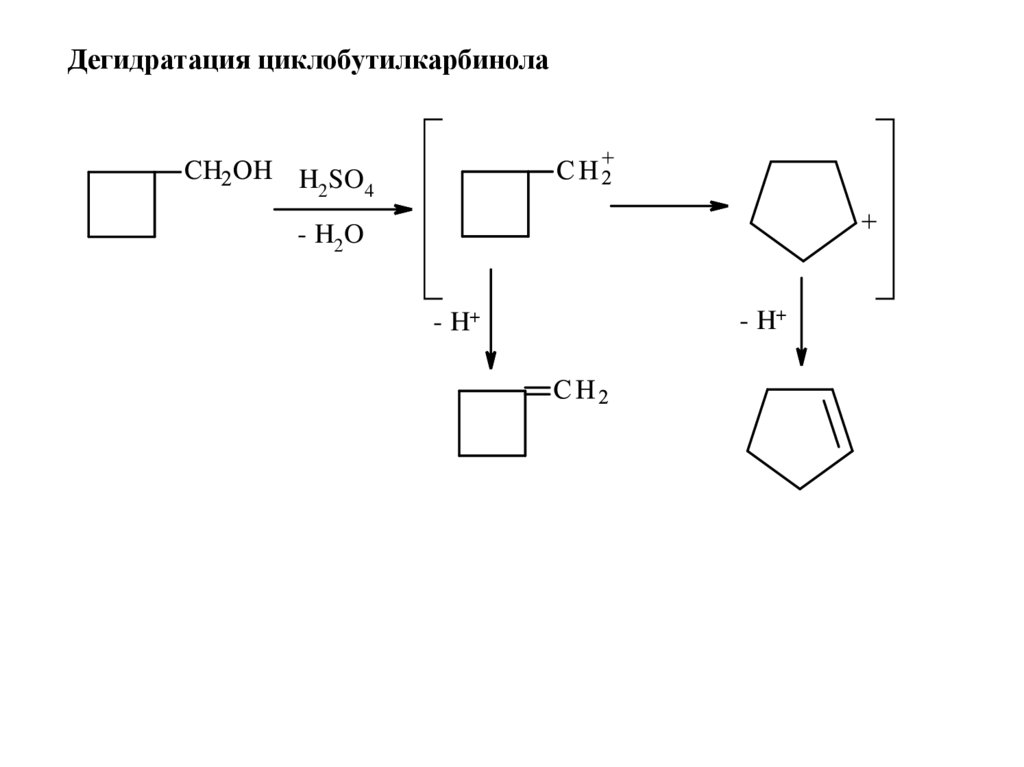
Дегидратация циклобутилкарбинолаH2 SO4
- H2 O
- H+
- H+
36.
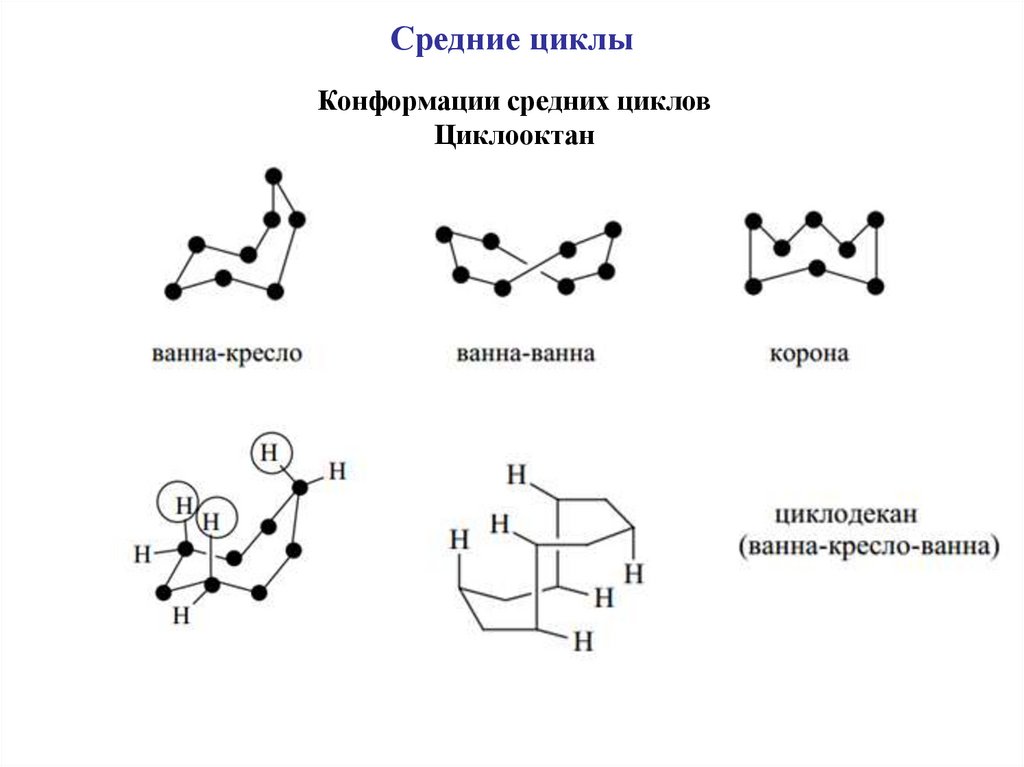
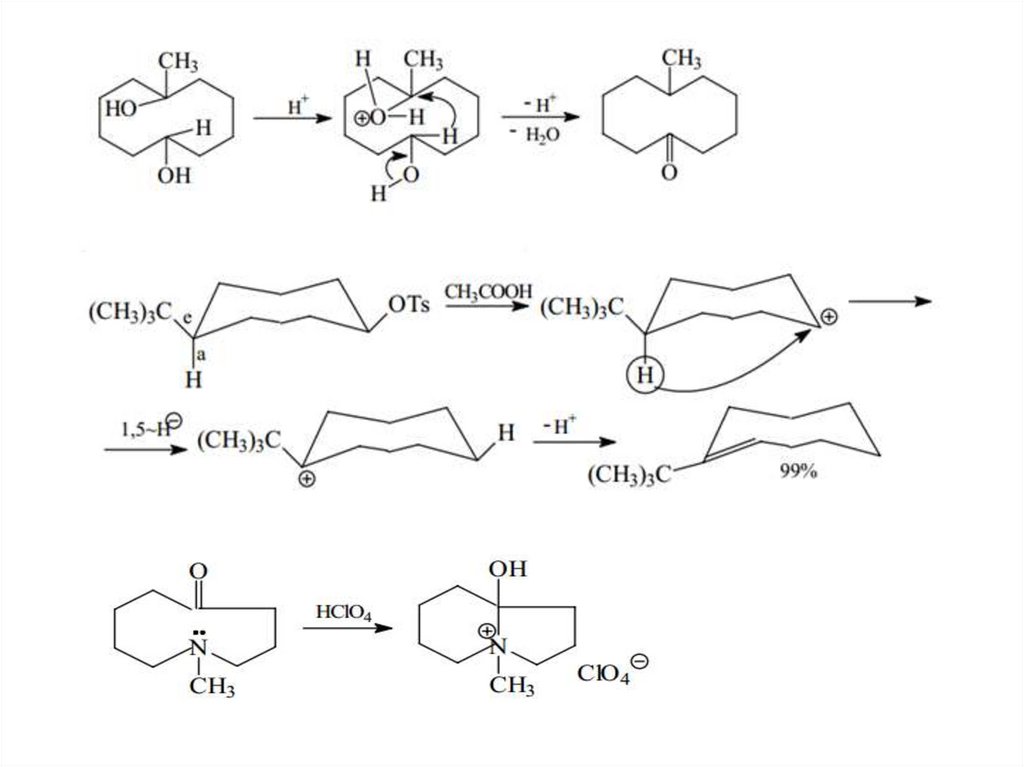
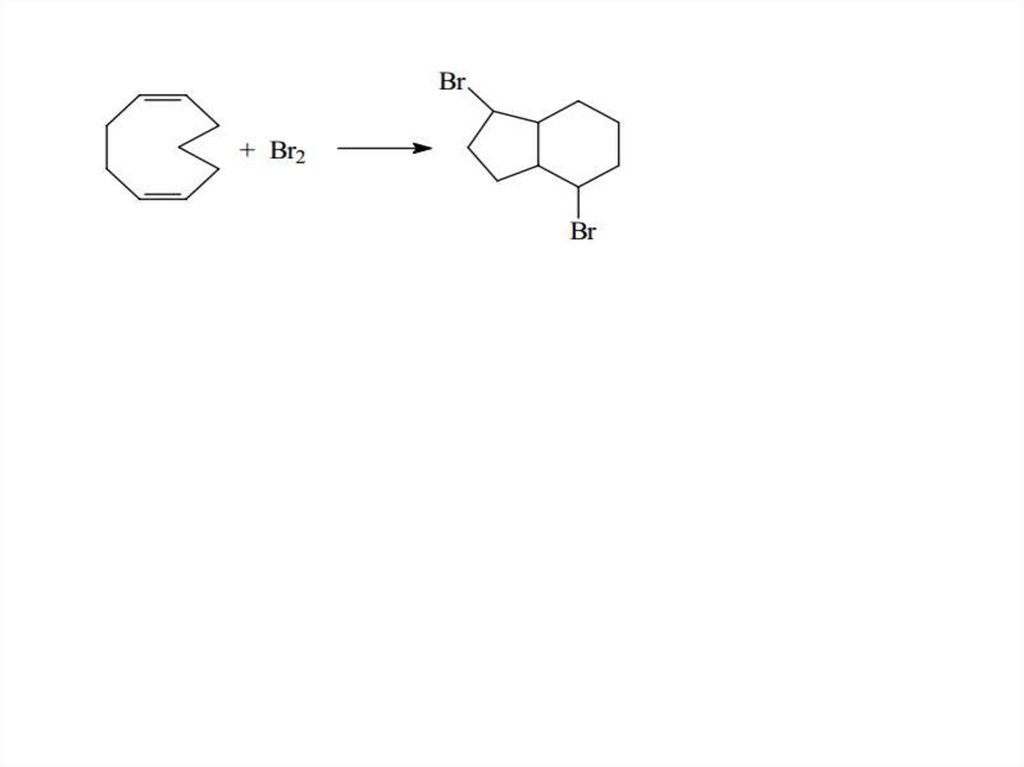
Средние циклыКонформации средних циклов
Циклооктан
37.
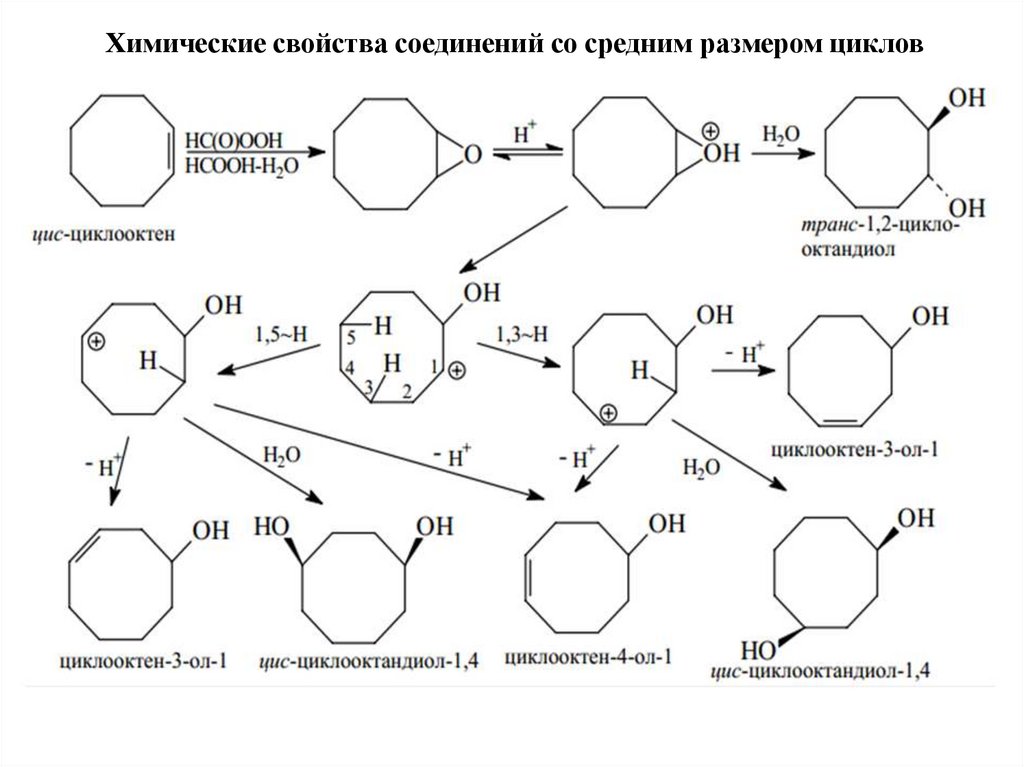
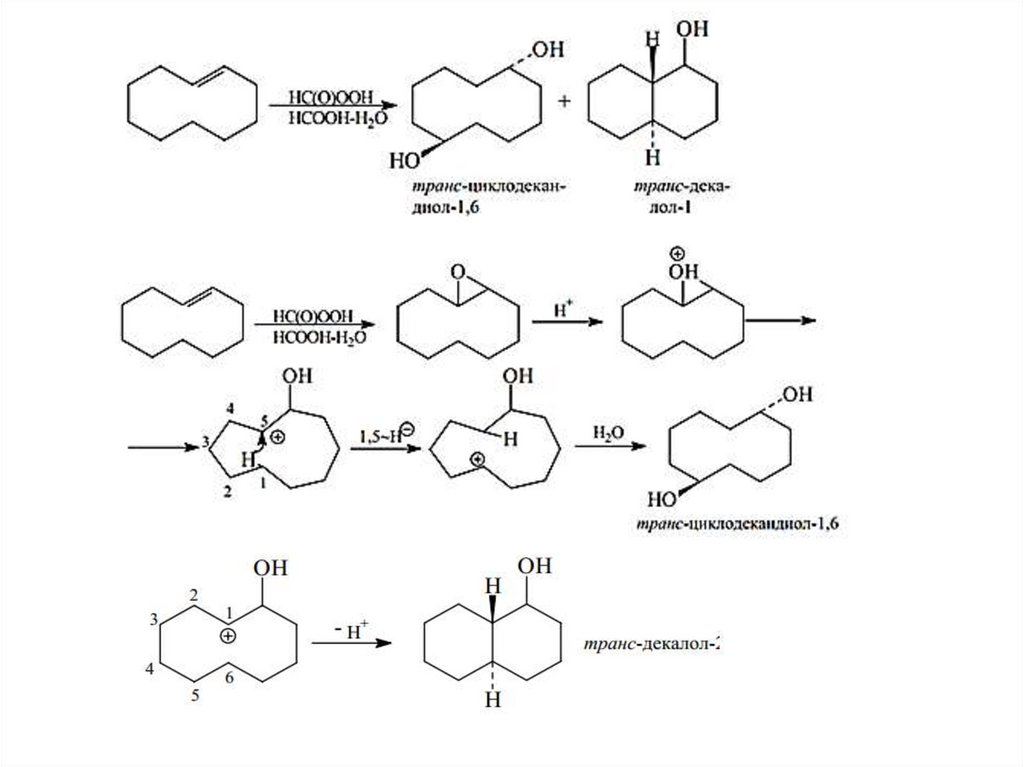
Химические свойства соединений со средним размером циклов38.
39.
40.
41.
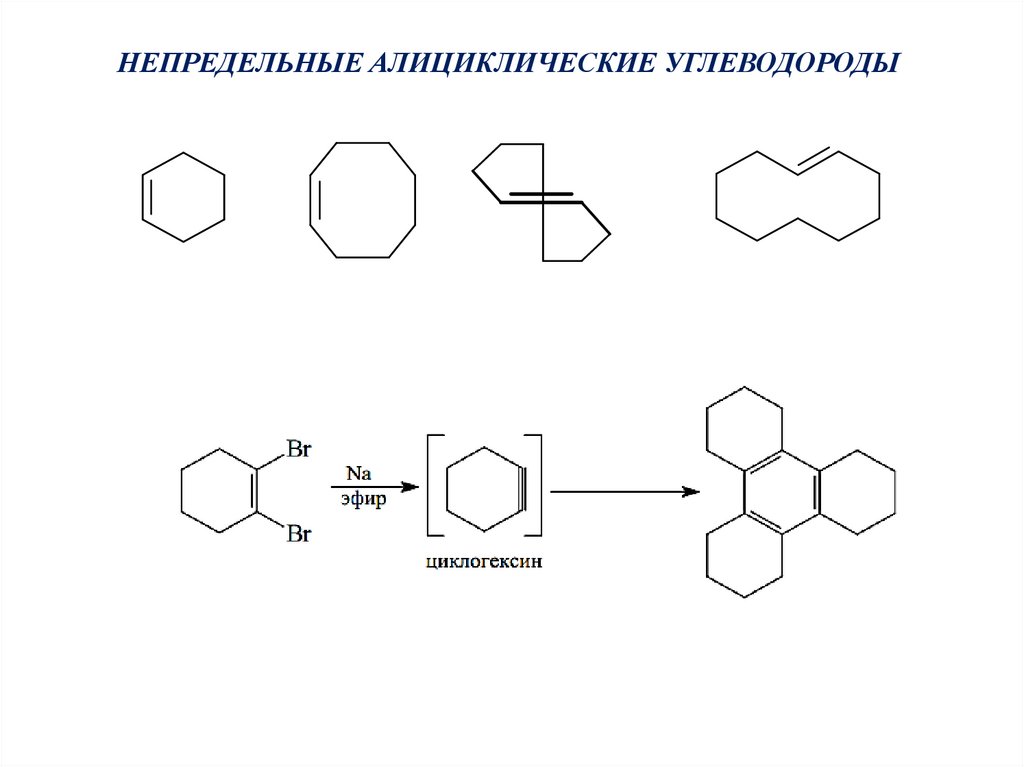
НЕПРЕДЕЛЬНЫЕ АЛИЦИКЛИЧЕСКИЕ УГЛЕВОДОРОДЫ42.
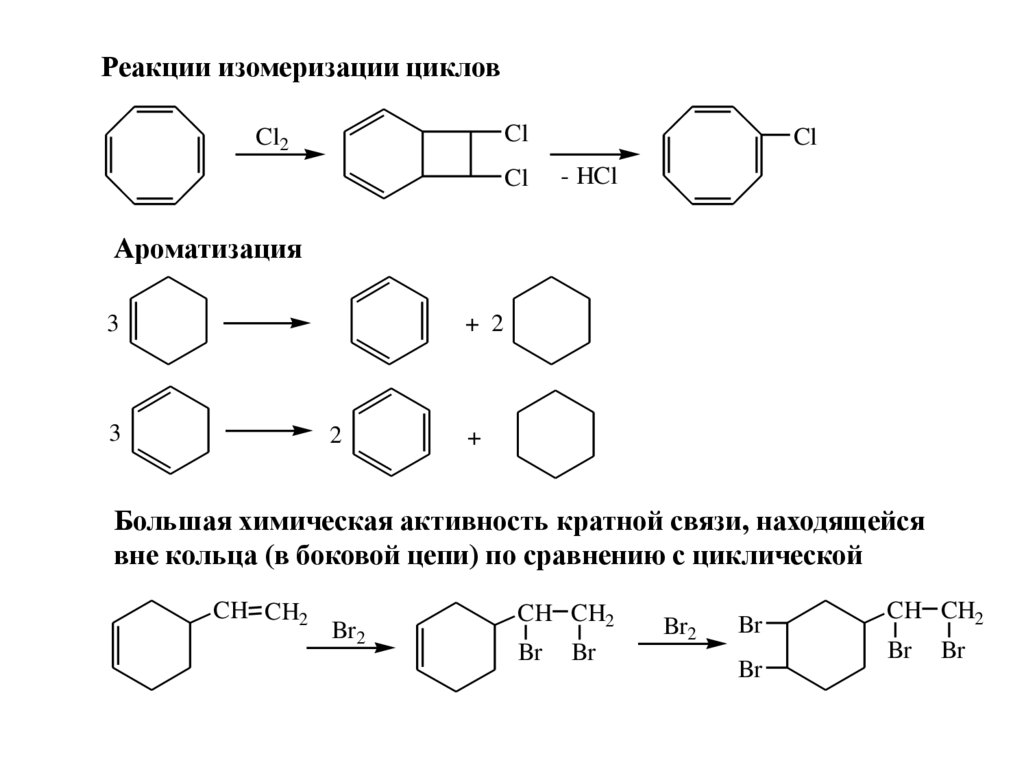
Реакции изомеризации цикловCl
Cl2
Cl
Cl
- HCl
Ароматизация
3
+ 2
3
2
+
Большая химическая активность кратной связи, находящейся
вне кольца (в боковой цепи) по сравнению с циклической
CH CH2
Br2
CH CH2
Br
Br
Br2
Br
Br
CH CH2
Br
Br
43.
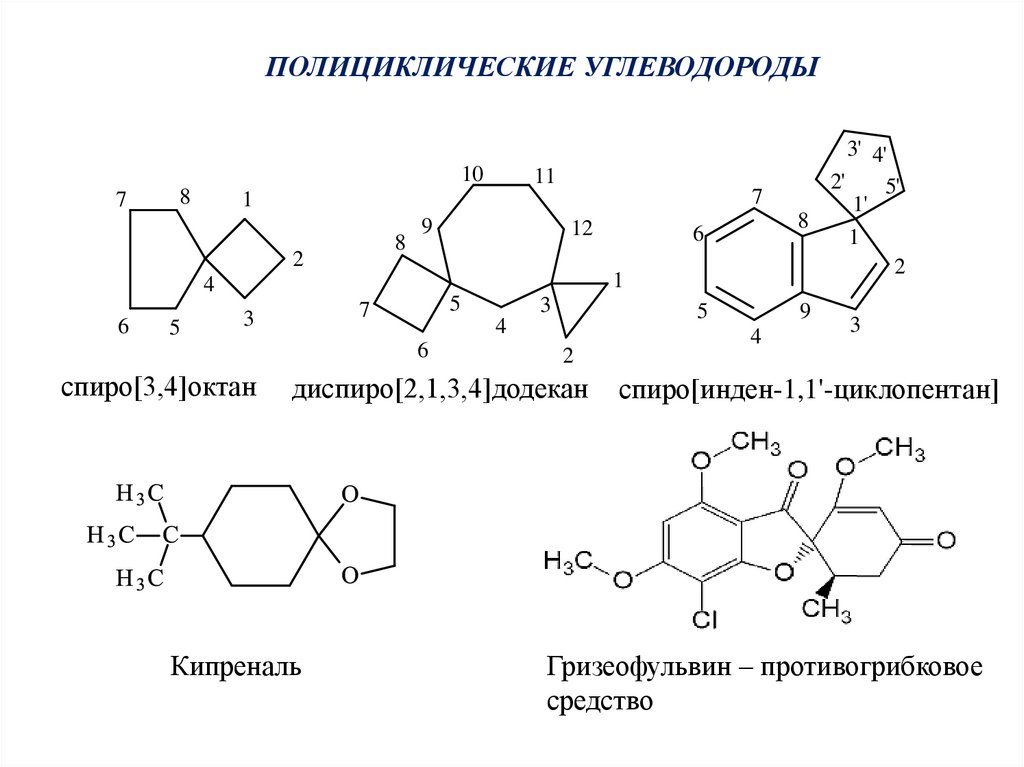
ПОЛИЦИКЛИЧЕСКИЕ УГЛЕВОДОРОДЫ10
7
8
7
1
8
2
9
5
12
6
1
4
6
11
5
7
3
6
спиро[3,4]октан
3
5
4
2
диспиро[2,1,3,4]додекан
Кипреналь
3' 4'
2'
5'
1'
8
1
2
9
4
3
спиро[инден-1,1'-циклопентан]
Гризеофульвин – противогрибковое
средство
44.
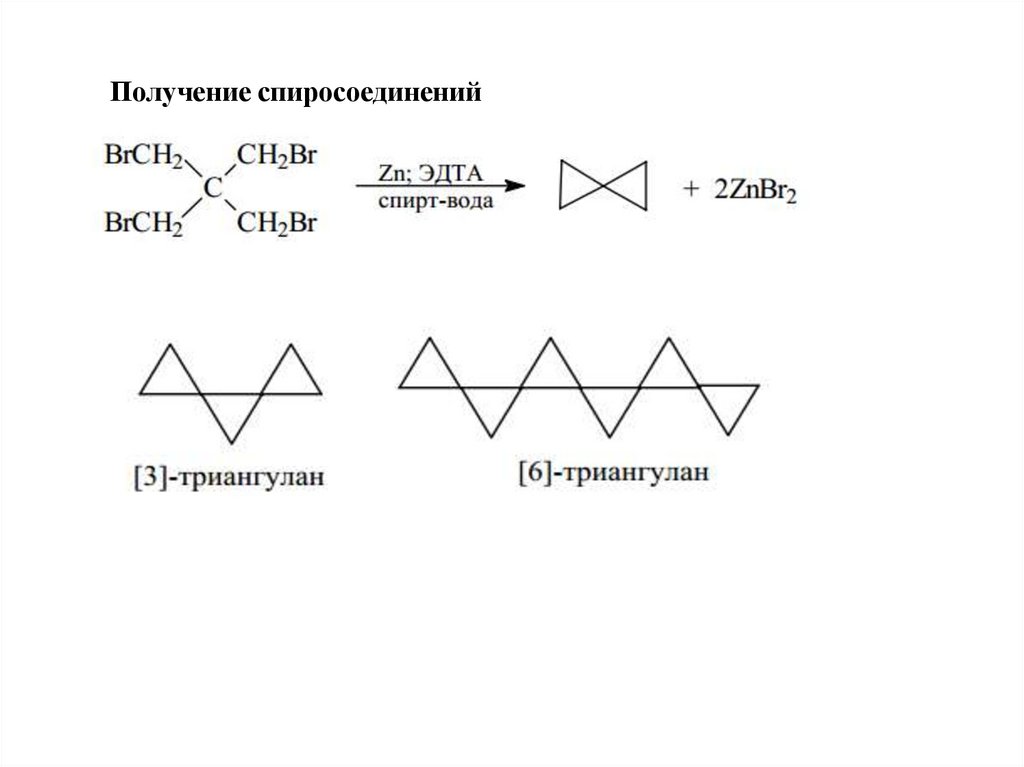
Получение спиросоединений45.
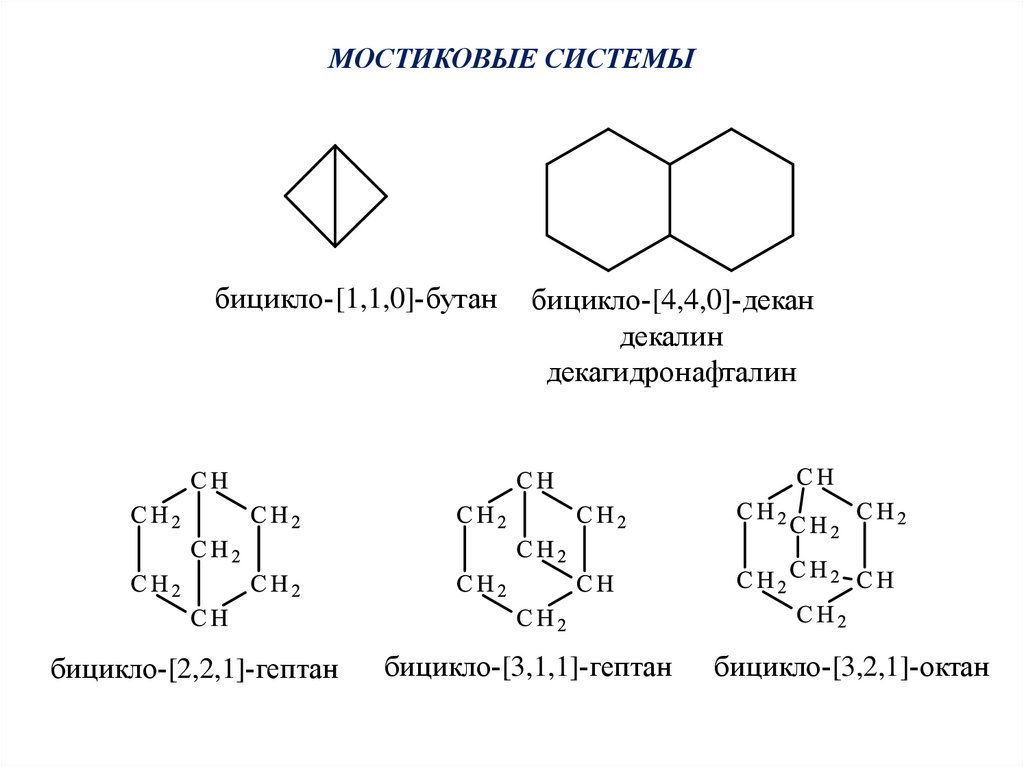
МОСТИКОВЫЕ СИСТЕМЫбицикло-[1,1,0]-бутан
бицикло-[2,2,1]-гептан
бицикло-[4,4,0]-декан
декалин
декагидронафталин
бицикло-[3,1,1]-гептан
бицикло-[3,2,1]-октан
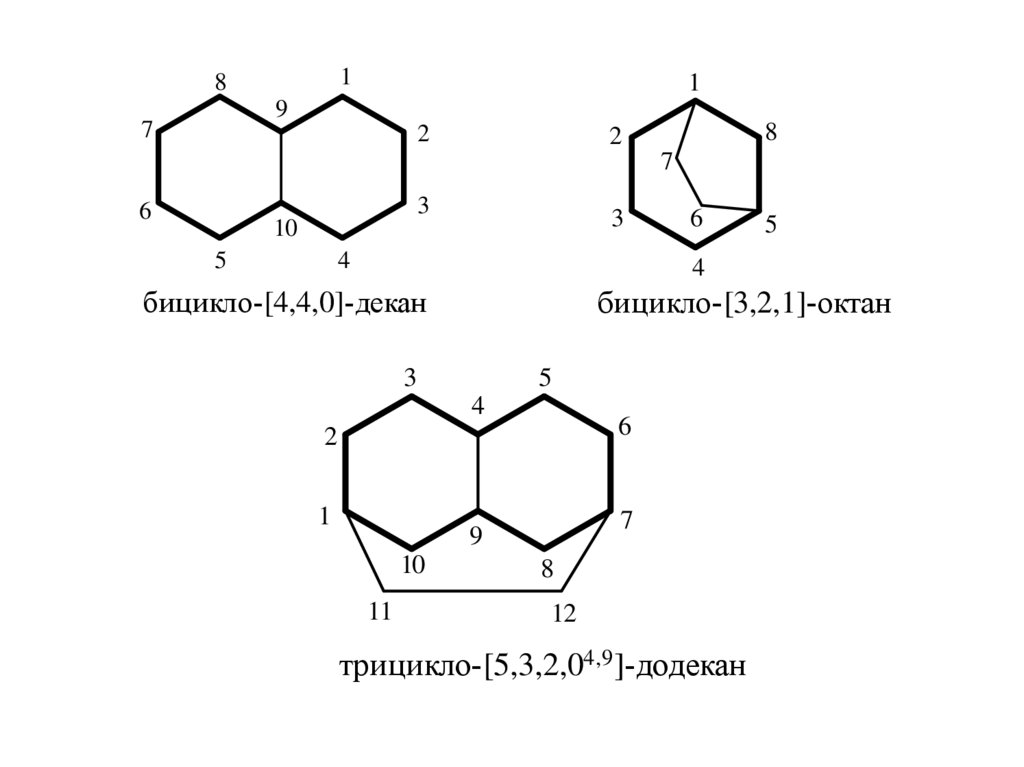
46.
18
1
9
7
2
8
2
7
3
6
3
10
5
4
6
5
4
бицикло-[3,2,1]-октан
бицикло-[4,4,0]-декан
3
5
4
6
2
1
7
9
10
11
8
12
трицикло-[5,3,2,04,9 ]-додекан
47.
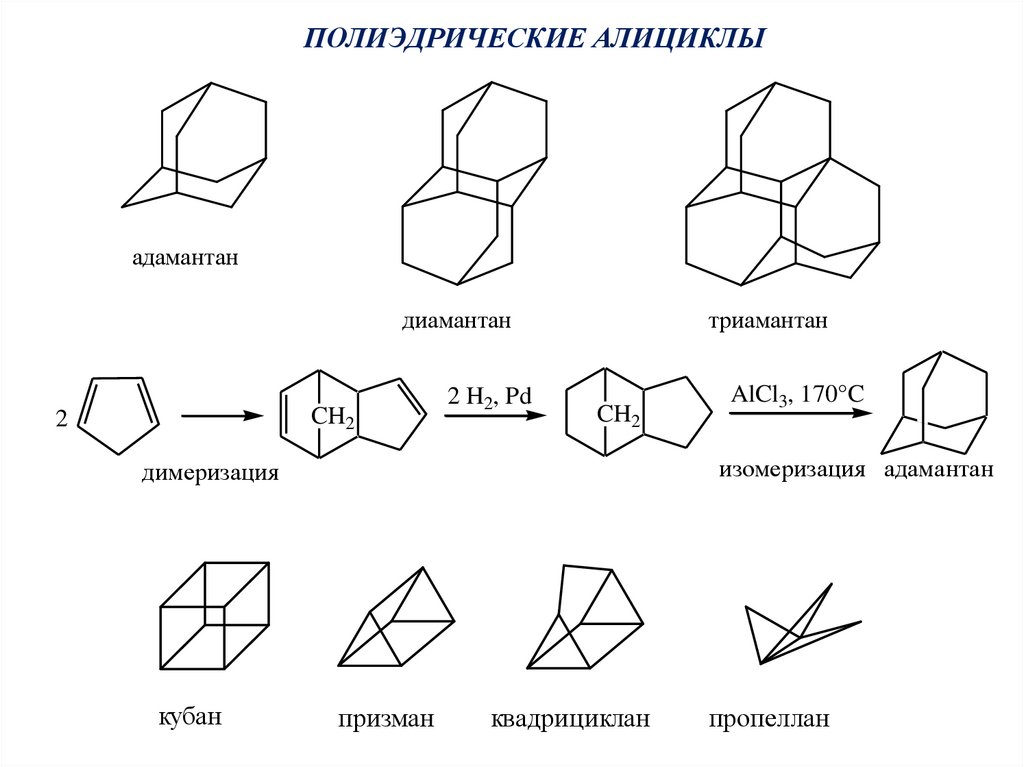
ПОЛИЭДРИЧЕСКИЕ АЛИЦИКЛЫадамантан
диамантан
CH2
2
2 H2, Pd
триамантан
CH2
изомеризация адамантан
димеризация
кубан
AlCl3, 170°C
призман
квадрициклан
пропеллан



 Химия
Химия