Похожие презентации:
Циклоалканы
1.
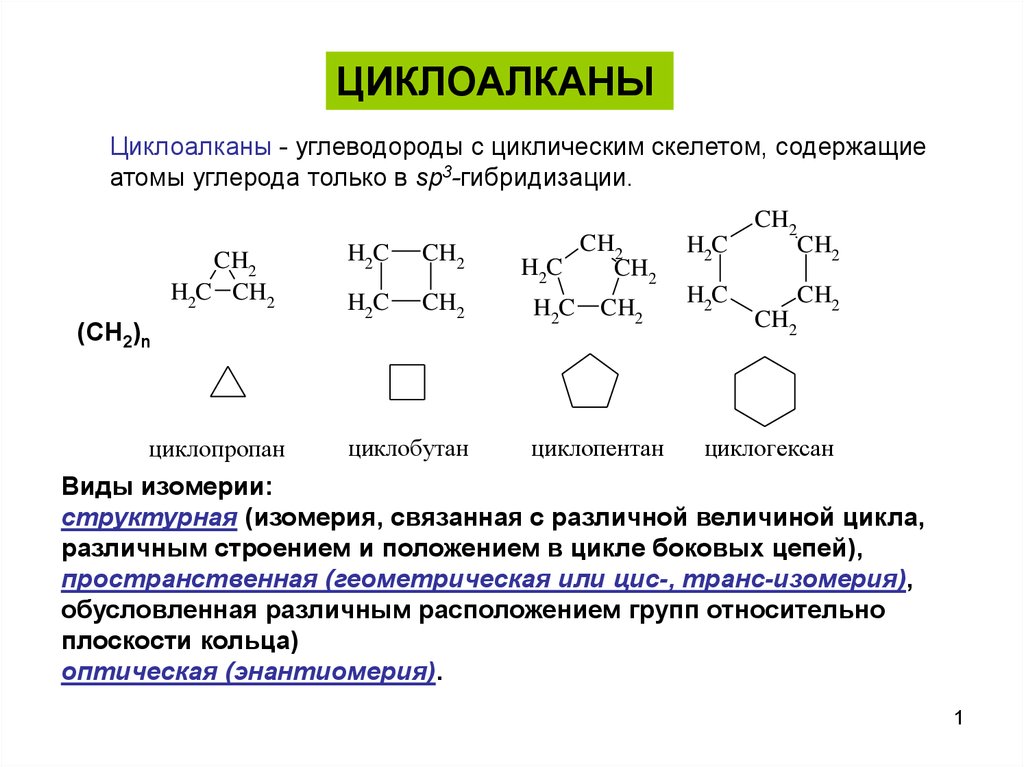
ЦИКЛОАЛКАНЫЦиклоалканы - углеводороды с циклическим скелетом, содержащие
атомы углерода только в sp3-гибридизации.
CH2
H2C CH2
H2C
CH2
H2C
CH2
(CH2)n
циклопропан
циклобутан
CH2
H2C
CH2
H2C
CH2
циклопентан
H2C
H2C
CH2
CH2
CH2
CH2
циклогексан
Виды изомерии:
структурная (изомерия, связанная с различной величиной цикла,
различным строением и положением в цикле боковых цепей),
пространственная (геометрическая или цис-, транс-изомерия),
обусловленная различным расположением групп относительно
плоскости кольца)
оптическая (энантиомерия).
1
2.
Примеры структурных изомеров C6H12:CH3
Циклогексан
CH3
CH3
CH3
CH3
1,2-Диметил- 1,3-ДиметилМетилциклопентан циклобутан
циклобутан
CH3
CH3
C 2H5
CH3
Этилциклобутан
öèêëî ï ðî ï èë
1,2,3-Триметилциклопропан
öèêëî áóòèë
C 2H5
CH3
öèêëî ï åí òèë
H3C
1-Метил-2-этилциклопропан
öèêëî ãåêñèë
H3C
CH3
ì åòèëöèêëî ï ðî ï èë
2-ì åòèëöèêëî ï åí òèë
4-ì åòèëöèêëî ãåêñèë
2
3.
Примеры геометрических изомеров:H
H
H
H
CH3
H
H
H
H
H
H
H
CH3
H
H
H
H
H
CH3
CH3
цис-форма
транс-форма
энантиомеры
CH3
мезо-форма
CH3
CH3
H
H
H
CH3
H
CH3
H
H
CH3
молекула
зеркало
зеркальное отражение
молекулы
3
4.
Бициклические циклоалканыСпироалканы – бициклические углеводороды, имеющие один
общий (узловой) атом.
9
1
8
2
8
7
5
6
9
1
7
4
3
6
4
5
2
3
спиро[3,5]нонан
спиро[4,4]нонан
Бициклоалканы или мостиковые соединения - бициклические
углеводороды, имеющие два общих (узловых) атома.
8
1
7
2
7
3
6
2
1
5
4
бицикло[3,3,0]октан
6
8
3
4
5
бицкло[3,2,1]октан
4
5.
Способы полученияВнутримолекулярная реакция Вюрца дигалогеналканов
CH2 Cl
+ Zn
CH2
CH2 Cl
CH2
CH2
CH2
+
ZnCl2
Эта реакция пригодна для получения циклоалканов с n от 3 до 6.
Пиролиз солей дикарбоновых кислот
С помощью пиролиза кальциевых и бариевых солей дикарбоновых
кислот могут быть получены циклические соединения с n = 5, 6, 7.
O
CH2
CH2
CH2 C
O
O
Ca
300 OC
-CaCO3
O
H2, Pt, T, P
CH2 C
O
5
6.
R1Диеновый синтез
R1
R2
R2
+
R4
R4
R3
R3
Гидрирование ароматических
углеводородов
R
H2, Ni, T
R
Cl
Cl
CHCl3
t-C4H9OK
Cl
Циклопропанирование
C C
CH2Cl2
C4H9Li
CH2 I2
Zn/Cu
6
7.
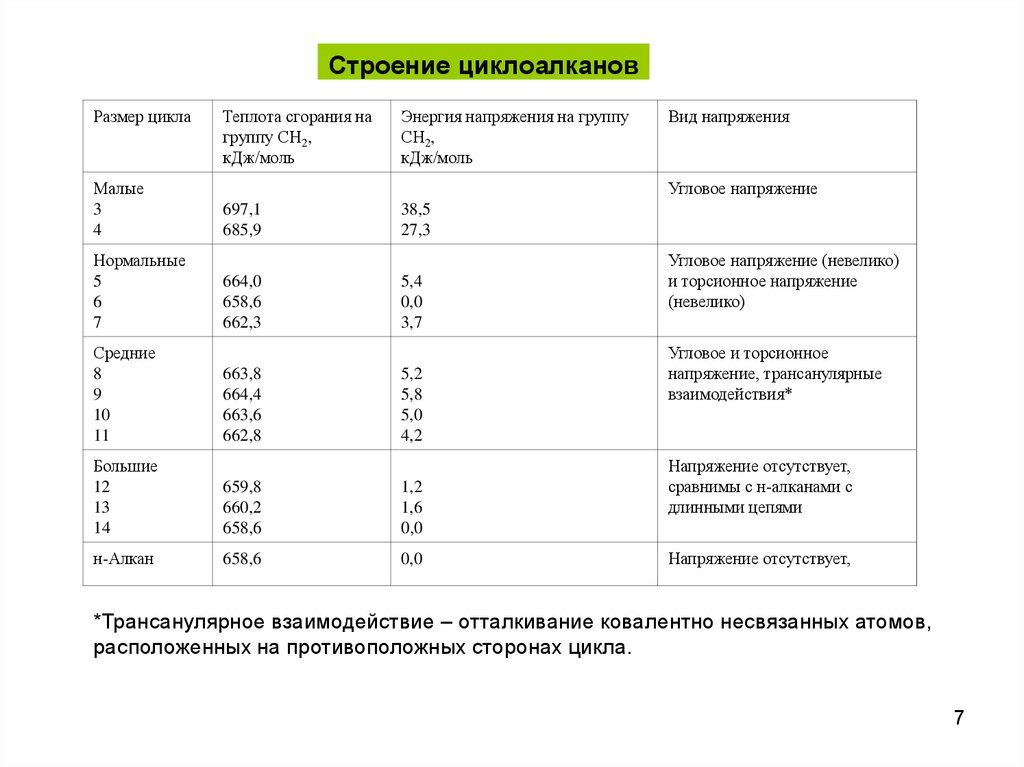
Строение циклоалкановРазмер цикла
Малые
3
4
Теплота сгорания на
группу СН2,
кДж/моль
Энергия напряжения на группу
СН2,
кДж/моль
697,1
685,9
38,5
27,3
Вид напряжения
Угловое напряжение
Нормальные
5
6
7
664,0
658,6
662,3
5,4
0,0
3,7
Средние
8
9
10
11
663,8
664,4
663,6
662,8
5,2
5,8
5,0
4,2
Большие
12
13
14
659,8
660,2
658,6
1,2
1,6
0,0
н-Алкан
658,6
0,0
Угловое напряжение (невелико)
и торсионное напряжение
(невелико)
Угловое и торсионное
напряжение, трансанулярные
взаимодействия*
Напряжение отсутствует,
сравнимы с н-алканами с
длинными цепями
Напряжение отсутствует,
*Трансанулярное взаимодействие – отталкивание ковалентно несвязанных атомов,
расположенных на противоположных сторонах цикла.
7
8.
Теория напряженияА. Байер (1885 г.)
Угловое напряжение (напряжение Байера) вызвано отклонением валентных
углов от нормального тетраэдрического угла 109О28’.
Торсионное напряжение (напряжение Питцера) вызвано отклонением
положения С-Н связей от заторможенной конформации.
Трансанулярное напряжение (напряжение Прелога) вызвано
взаимодействием несвязанных атомов и фрагментов молекулы
через пространство
CH3
109o28'
C
CH3
CH3
109o28'
109o28'
CH3
CH3
C
109o28'
CH3
8
9.
ЦиклопропанCH2
60o
H2C
CH2
9
10.
109o28'109o28'
90o
60o
Чем больше отклонение от
нормального угла 109 028 ,
тем более “напряженной”
является молекула:
для циклопропана отклонение
составляет
1/2(109О28 - 60О)= 24О44 ,
а для плоского циклобутана –
1/2(109О28 - 90О)= 9О44 .
CH3
109o28'
Молекула алкана.
Оси sp3-гибридных
облаков лежат на линии,
соединяющей ядра атомов
109o28'
C
H3C
109o28'
109o28'
CH3
CH3
10
11.
H"Банановая" связь,
sp5-гибридизация
C
60o
109o28'
C
H
C
H
11
12.
ЦиклобутанH
H
H
H
H
H
H
H
12
13.
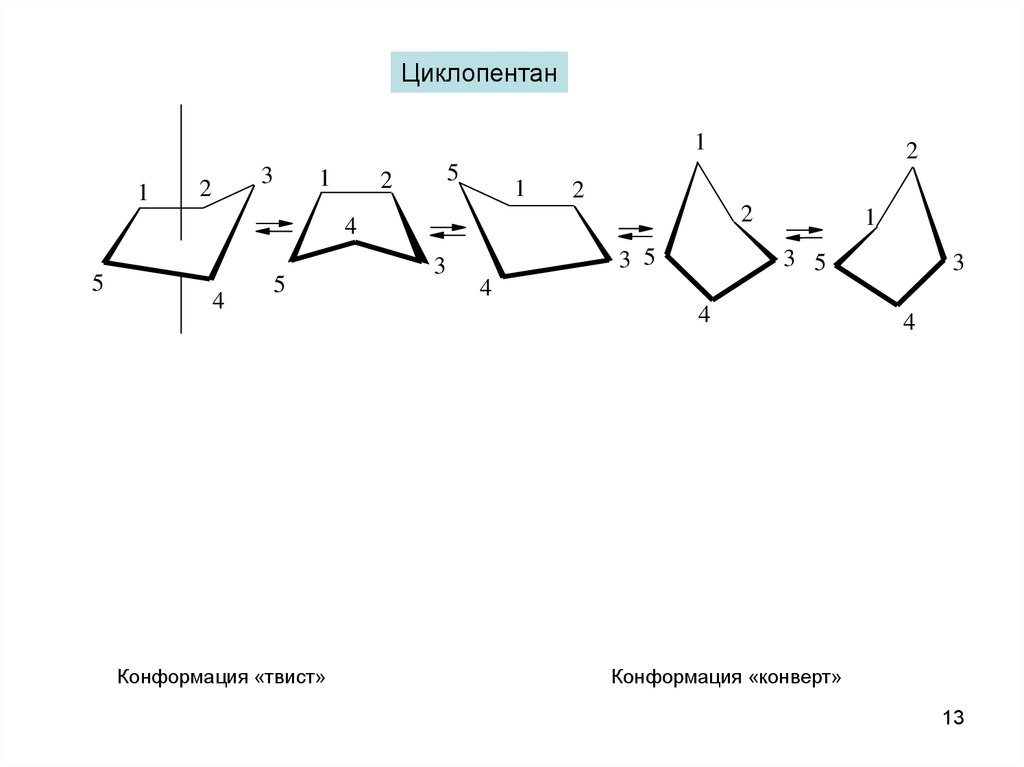
Циклопентан1
1
3
2
1
5
2
1
2
2
4
5
4
5
Конформация «твист»
2
3 5
3
1
3 5
3
4
4
4
Конформация «конверт»
13
14.
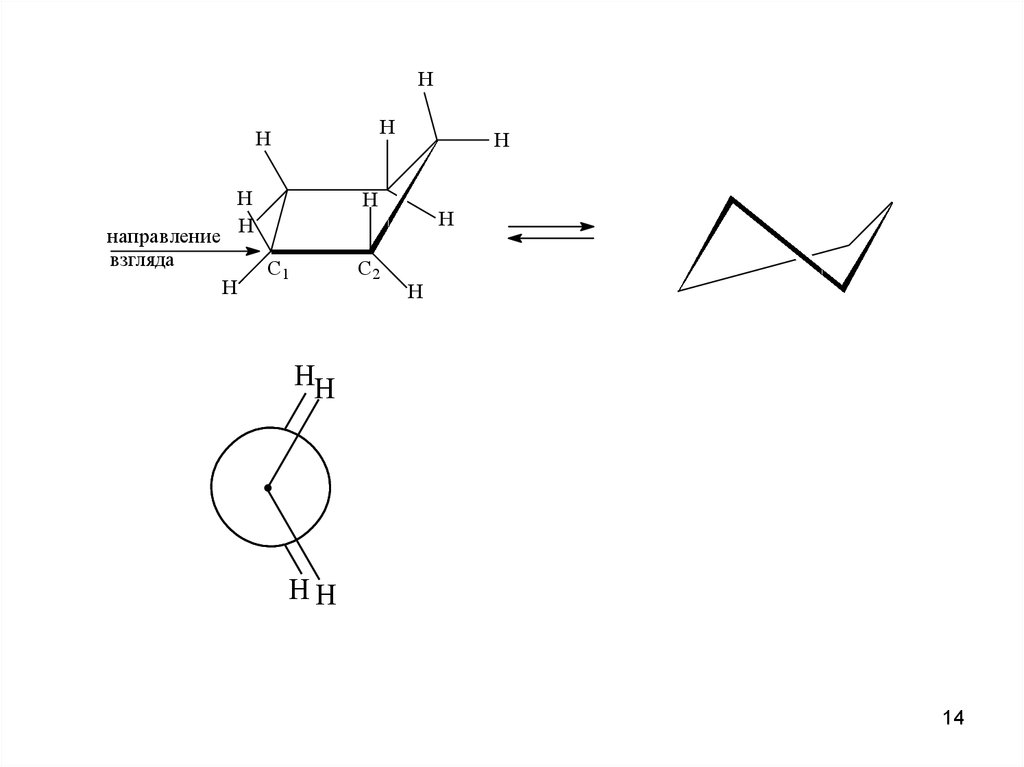
HH
H
H
H
направление
взгляда
H
H
H
C1
C2
H
H
HH
HH
14
15.
ЦиклогексанHa8
Ha12
He11
направление
взгля да
He1
Ha2
Ha4
He3
Ha8
He9
Ha10
Ha6
He7
He5
He9
Ha12
He11
Ha10
Ha4
He7
He5
He1
He3
Ha6
Ha2
проекция Ньюмена
15
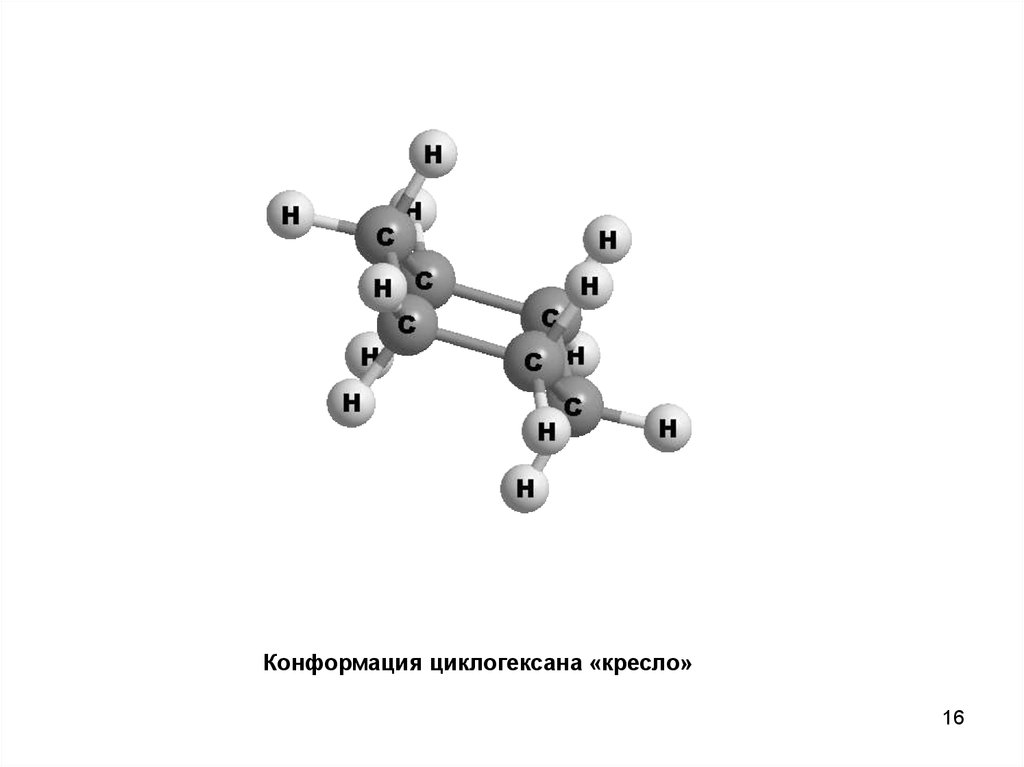
16.
Конформация циклогексана «кресло»16
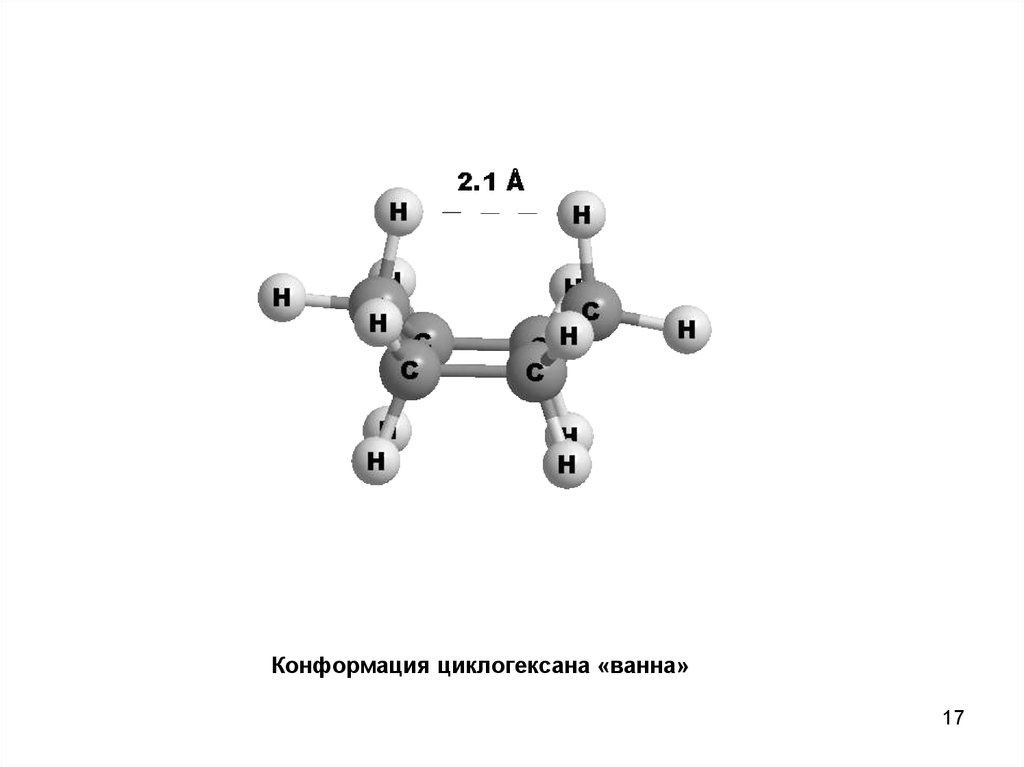
17.
Конформация циклогексана «ванна»17
18.
Конформация циклогексана «твист»18
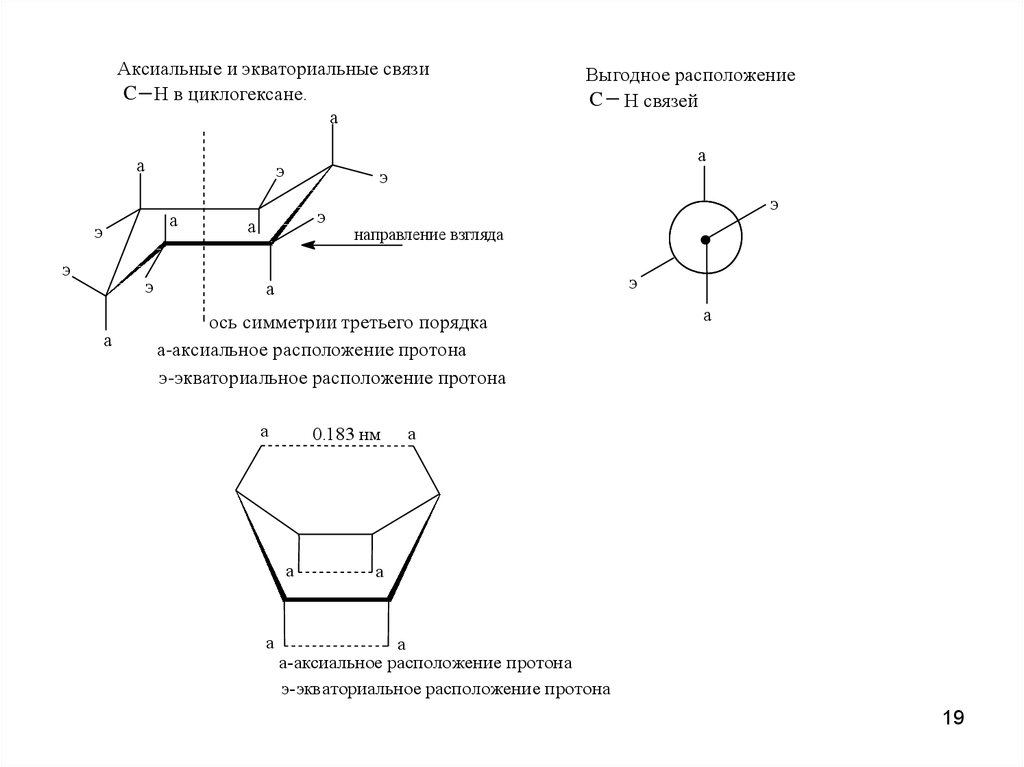
19.
Аксиальные и экваториальные связиC H в циклогексане.
а
а
э
а
э
э
э
а
Выгодное расположение
C H связей
а
э
э
а
э
направление взгляда
э
а
ось симметрии третьего порядка
а-аксиальное расположение протона
э-экваториальное расположение протона
а
0.183 нм
а
а
а
а
а
а
а-аксиальное расположение протона
э-экваториальное расположение протона
19
20.
Eп ,кДж/моль
..
..
полукресло
полукресло
ванна
5,44
твист
твист
46,06
23,45
кресло
кресло
Координата реакции
20
21.
G3
1 H
3
5
5
1
G
H
экваториальная форма
аксиальная форма
Химические свойства
Гидрирование.
Циклопропан реагирует с водородом в присутствии
катализатора (Ni, T = 80 °С) с разрывом кольца.
+ H2
Ni, 80 oC
CH2
H3C
CH3
21
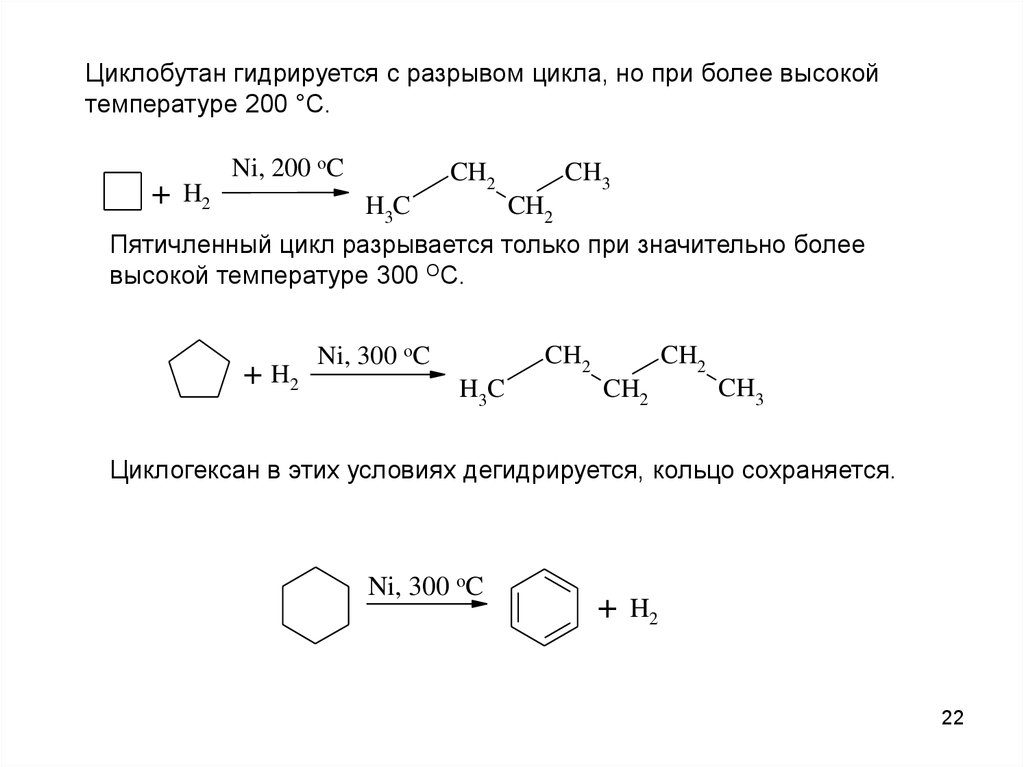
22.
Циклобутан гидрируется с разрывом цикла, но при более высокойтемпературе 200 °С.
+
Ni, 200 oC
CH2
H2
CH3
CH2
H3C
Пятичленный цикл разрывается только при значительно более
высокой температуре 300 ОС.
+ H2
Ni, 300 oC
CH2
CH2
H3 C
CH2
CH3
Циклогексан в этих условиях дегидрируется, кольцо сохраняется.
Ni, 300 oC
+
H2
22
23.
Галогенирование.Cl
h , t<100 OC
+
Cl2
Реакция с бромом идет по-разному в зависимости от размера цикла.
+
Br2
CCl4, h
Br
CH2
CH2
Br
CH2
Циклобутан не взаимодействует с бромом подобным образом.
Br
h
+ Br2
+ HBr
Циклопентан и циклогексан реагируют с галогенами (Cl2, Br2)
по механизму радикального замещения SR.
+ Br2
h
Br
+
HBr
23
24.
Гидрогалогенирование. Циклопропан взаимодействует с иодоводородом,как ненасыщенное соединение - присоединяет галогеноводород,
при этом происходит раскрытие цикла.
+
CH2
HI
CH3
I
CH2
Остальные циклопарафины с галогеноводородами не реагируют.
24
















 Химия
Химия








