Похожие презентации:
Лекция 4. Часть 2
1.
ЛЕКЦИЯ 4Часть 2
Основы
кинетики химических реакций
2.
Химическая кинетика – раздел физической химии,изучающий механизмы химических реакций и
скорости их протекания.
➢ Механизм химической реакции – детальное описание пути,
ведущего от реагентов к продуктам реакции, включающее
наиболее
полную
характеристику
участников
реакции,
промежуточных соединений и переходных состояний.
➢ Скорость химической реакции – количество элементарных
актов реакции, происходящих в единицу времени в единице
объема (в случае гомогенной реакции) или на единице
поверхности раздела фаз (в случае гетерогенной реакции).
2
3.
Элементарным актом реакции называют либо распадодной частицы (молекулы или иона), либо одновременное
взаимодействие двух (в очень редких случаях трех) частиц,
приводящие к перераспределению химических связей.
Молекулярностью называют число частиц, участвующих в
элементарном акте реакции (характеризуется только целыми
числами)
Ca(HCO3)2
CaCO3
CO + Cl2
COCl2
Н2O +
CO2 мономолекулярная
бимолекулярная
3
4.
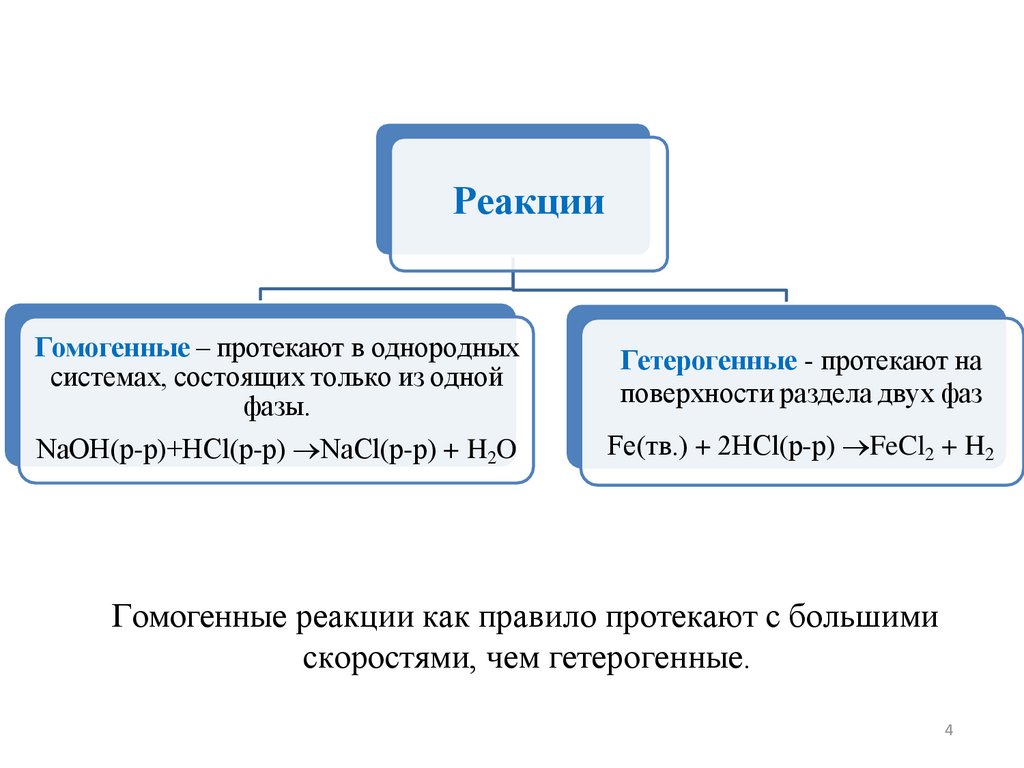
РеакцииГомогенные – протекают в однородных
системах, состоящих только из одной
фазы.
Гетерогенные - протекают на
поверхности раздела двух фаз
NaOH(р-р)+HCl(р-р) →NaCl(р-р) + H2O
Fe(тв.) + 2HCl(р-р) →FeCl2 + H2
Гомогенные реакции как правило протекают с большими
скоростями, чем гетерогенные.
4
5.
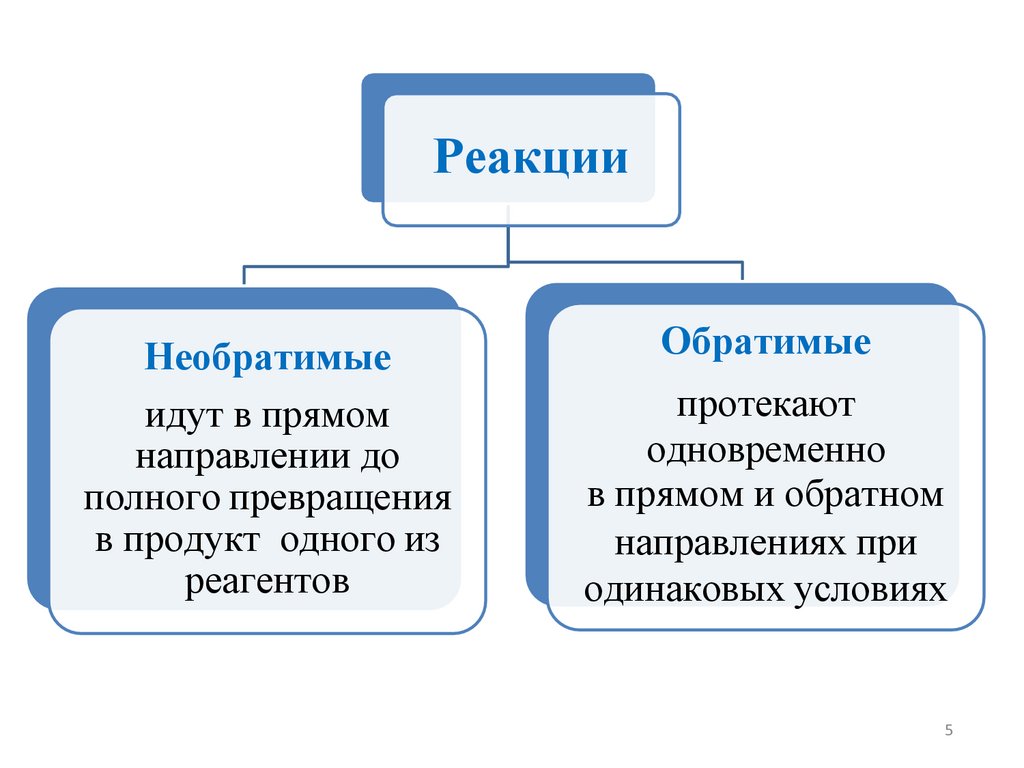
РеакцииНеобратимые
идут в прямом
направлении до
полного превращения
в продукт одного из
реагентов
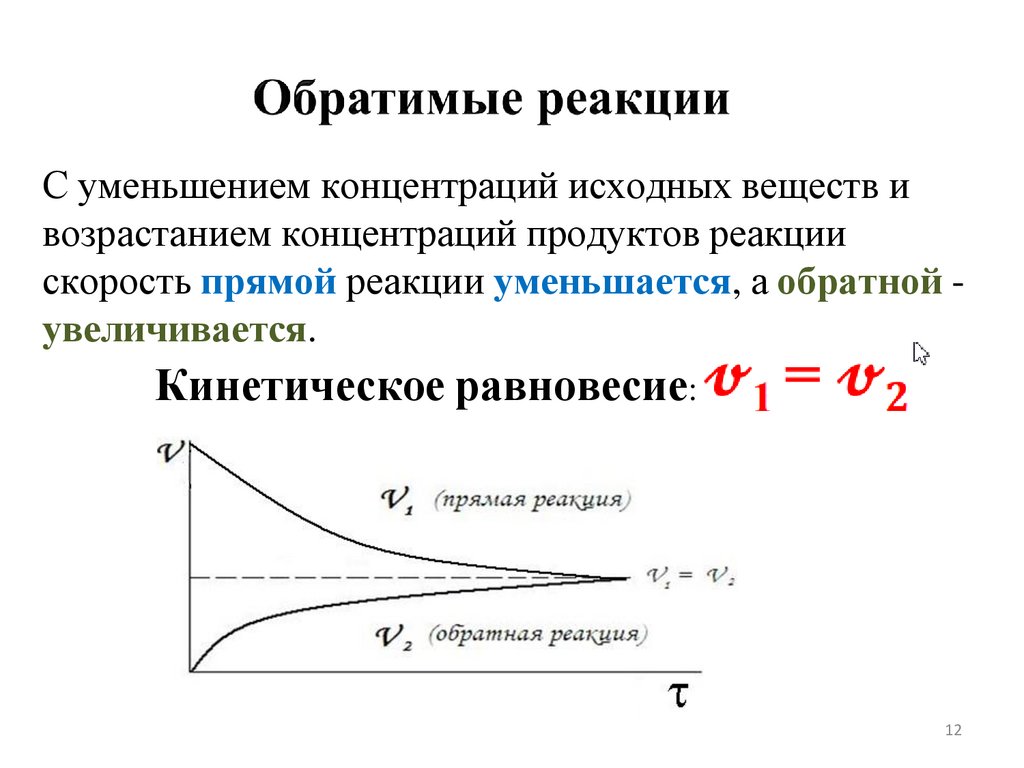
Обратимые
протекают
одновременно
в прямом и обратном
направлениях при
одинаковых условиях
5
6.
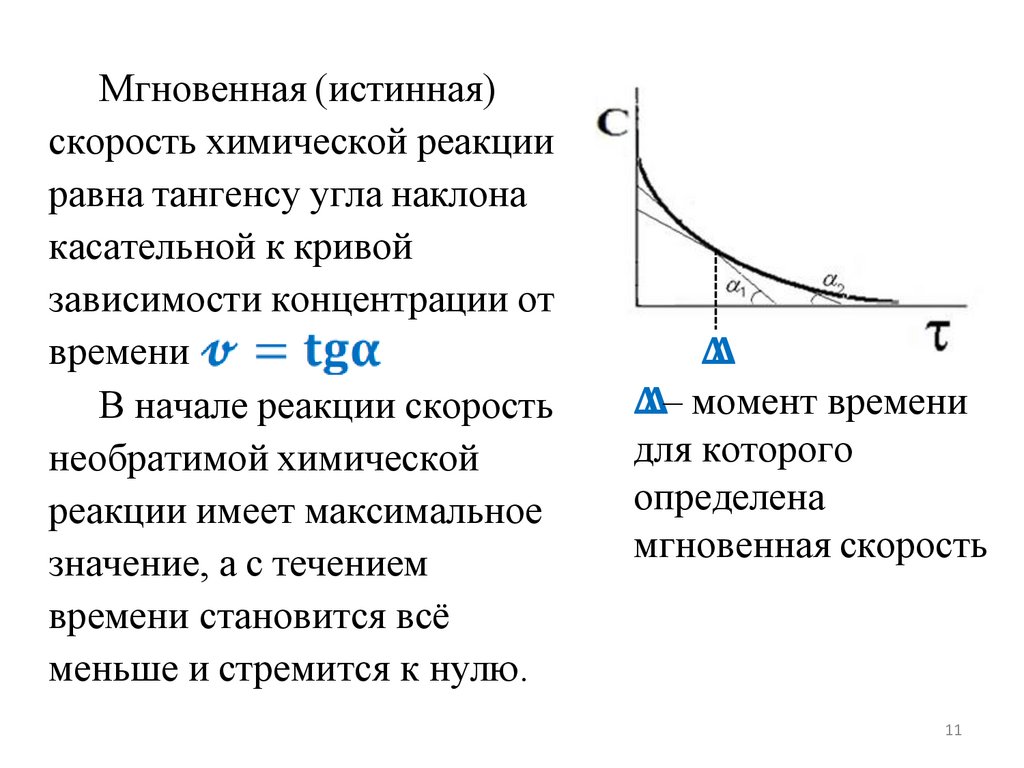
Различают• среднюю скорость химической реакции в
интервале времени τ1 – τ2
• мгновенную (истинную) скорость
химической реакции в данный момент
времени.
6
7.
Средняяскорость
гомогенной
химической
реакции
равна
изменению
молярной
концентрации одного из исходных веществ (или
продуктов реакции) в единицу времени
при
постоянном объёме реакционной системы:
- средняя скорость гомогенной реакции в интервале
времени моль/л·с, СM– молярная концентрация одного из
исходных веществ или продуктов реакции, моль/л; ν–
количество вещества одного из исходных веществ или
продуктов реакции, моль; V- объём реакционной смеси, л; τ–
время, с.
7
8.
➢ Скорость химической реакции может бытьизмерена по любому компоненту.
➢ Она всегда положительна, поэтому знак +/-
определяется тем, является ли вещество
исходным реагентом или продуктом реакции.
➢ Знак (+) используют, если скорость определяют
по продукту, а (-) – если по исходному веществу.
8
9.
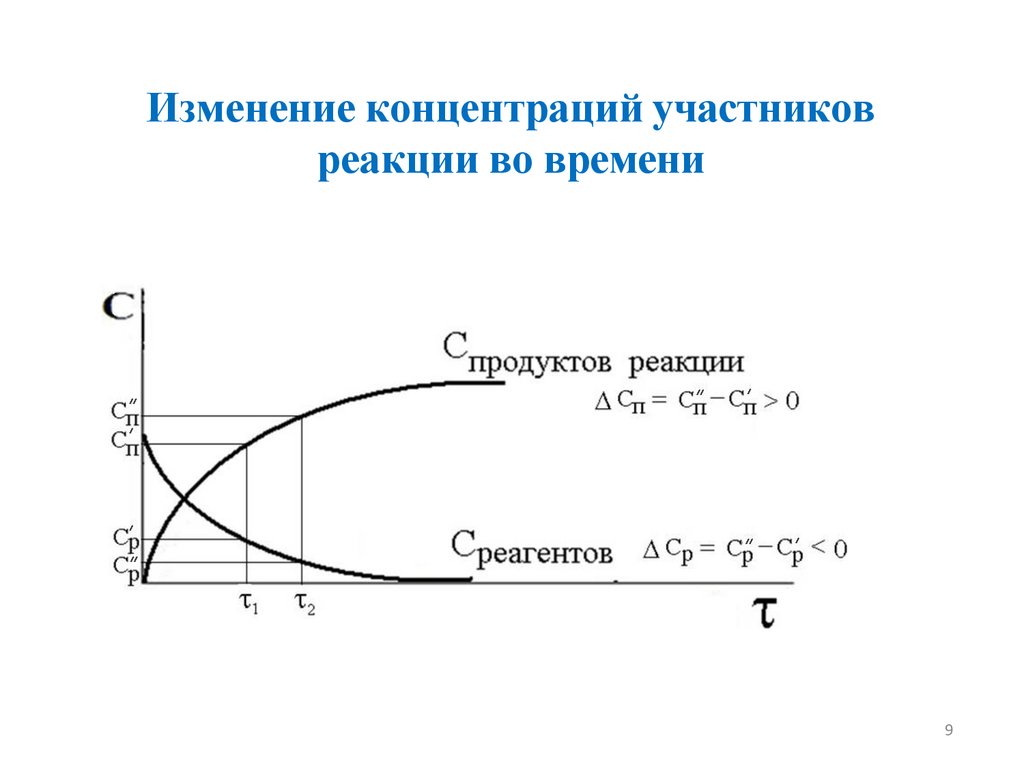
Изменение концентраций участниковреакции во времени
9
10.
Средняяскорость
гетерогенной
химической
реакции равна изменению количества вещества
одного из исходных веществ
(или продуктов
реакции) в единицу времени
на единице
площади поверхности раздела фаз:
где
































 Химия
Химия








