Похожие презентации:
22.01.pptx (1)
1.
Covalent bond andelectronegativity
2. Цели обучения
8.1.4.1 объяснять образованиековалентной связи между атомами
на основе электроотрицательности
3. Ключевая лексика
covalent bondElectronegativity
shared electrons
nonpolar bond
polar bond
4. What is “electron”?
5. What does the term “valence electrons” mean ?
6. Why do atoms bond with each other?
7.
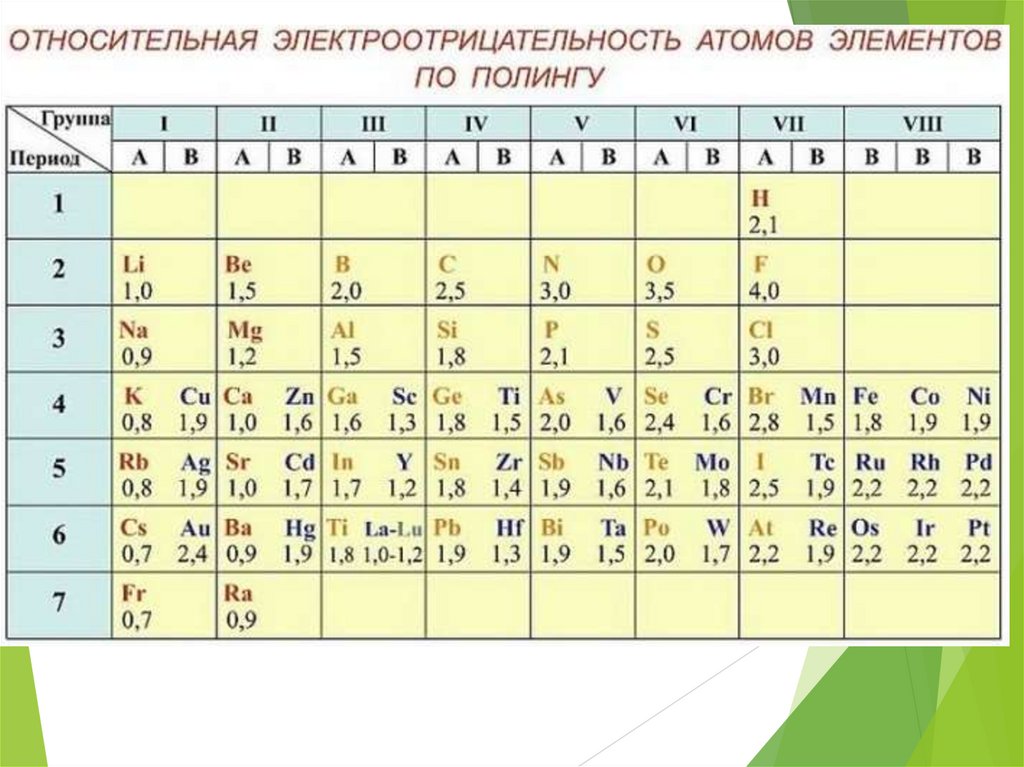
Электроотрицательность – способностьатома притягивать электроны
Electronegativity shows how strongly an
atom attracts electrons.
8.
9.
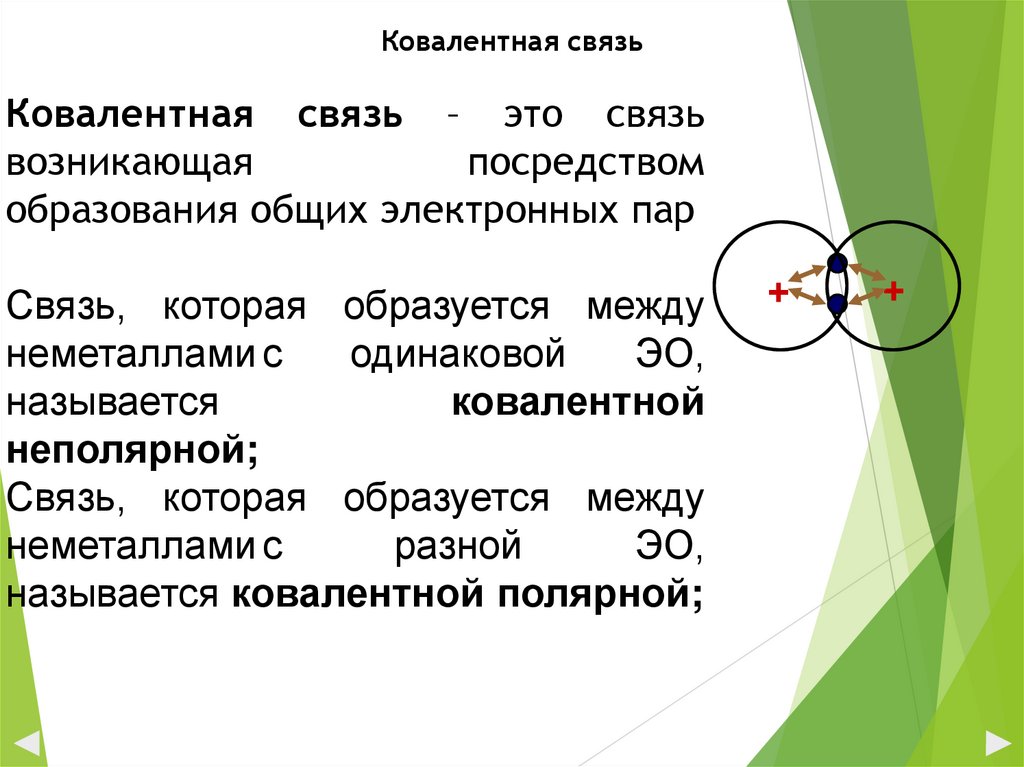
Ковалентная связьКовалентная связь – это связь
возникающая
посредством
образования общих электронных пар
Связь, которая образуется между
неметаллами с
одинаковой
ЭО,
называется
ковалентной
неполярной;
Связь, которая образуется между
неметаллами с
разной
ЭО,
называется ковалентной полярной;
+
+
10.
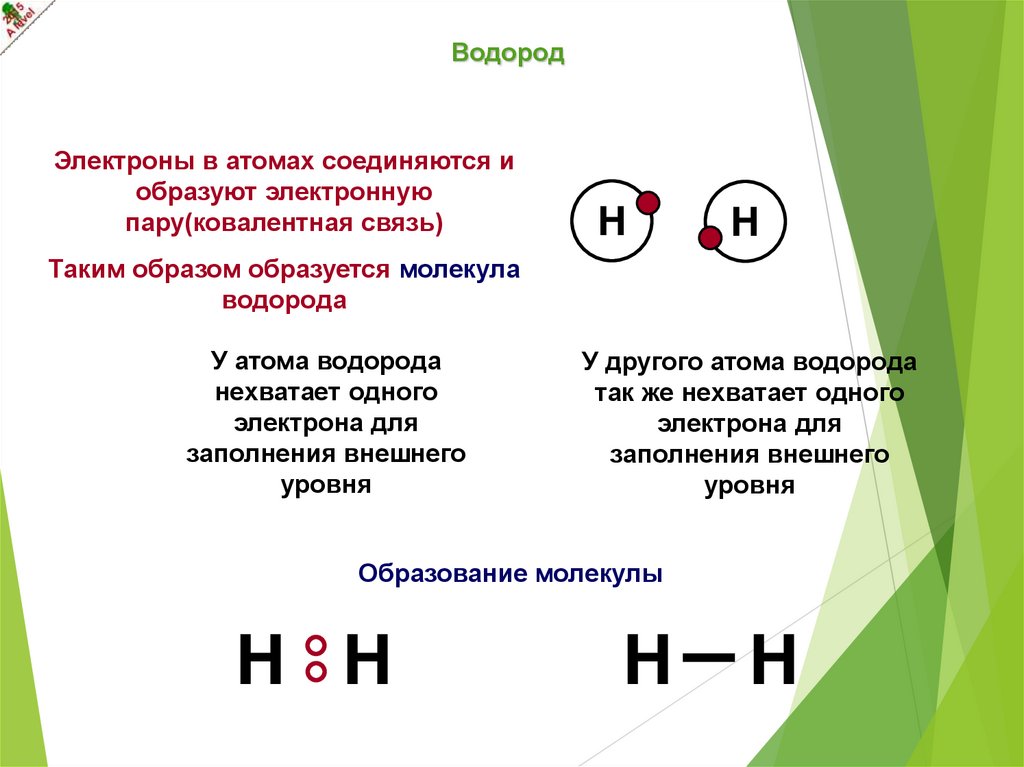
ВодородЭлектроны в атомах соединяются и
образуют электронную
пару(ковалентная связь)
H
H
Таким образом образуется молекула
водорода
У атома водорода
нехватает одного
электрона для
заполнения внешнего
уровня
У другого атома водорода
так же нехватает одного
электрона для
заполнения внешнего
уровня
Образование молекулы
H H
H
H
11.
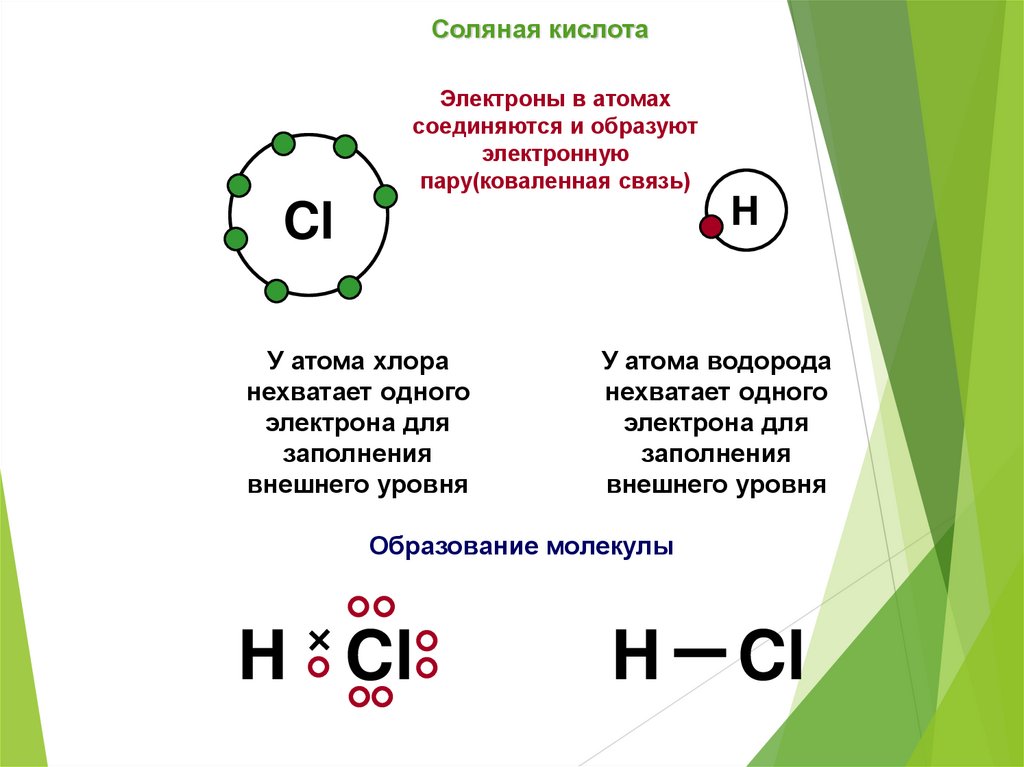
Соляная кислотаЭлектроны в атомах
соединяются и образуют
электронную
пару(коваленная связь)
H
Cl
У атома хлора
нехватает одного
электрона для
заполнения
внешнего уровня
У атома водорода
нехватает одного
электрона для
заполнения
внешнего уровня
Образование молекулы
H Cl
H
Cl
12.
Нарисуйте диаграмму «Точеки крестов» для
водорода
кислорода
азота.
13.
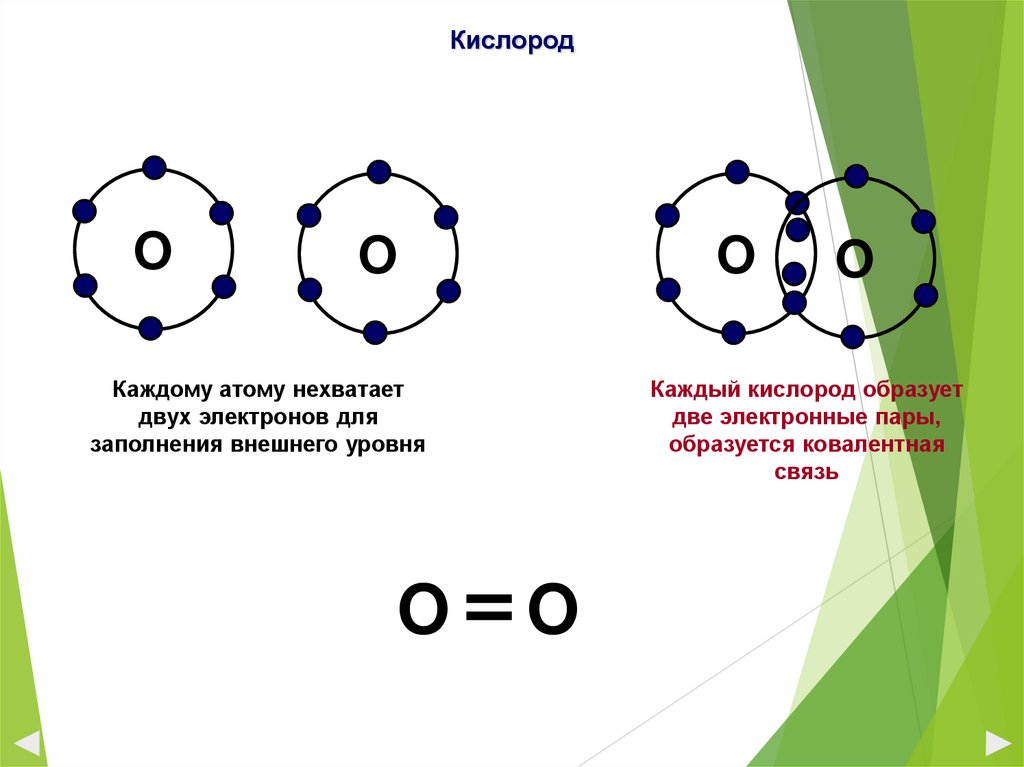
КислородO
O
O
Каждому атому нехватает
двух электронов для
заполнения внешнего уровня
O
O
Каждый кислород образует
две электронные пары,
образуется ковалентная
связь
O
14.
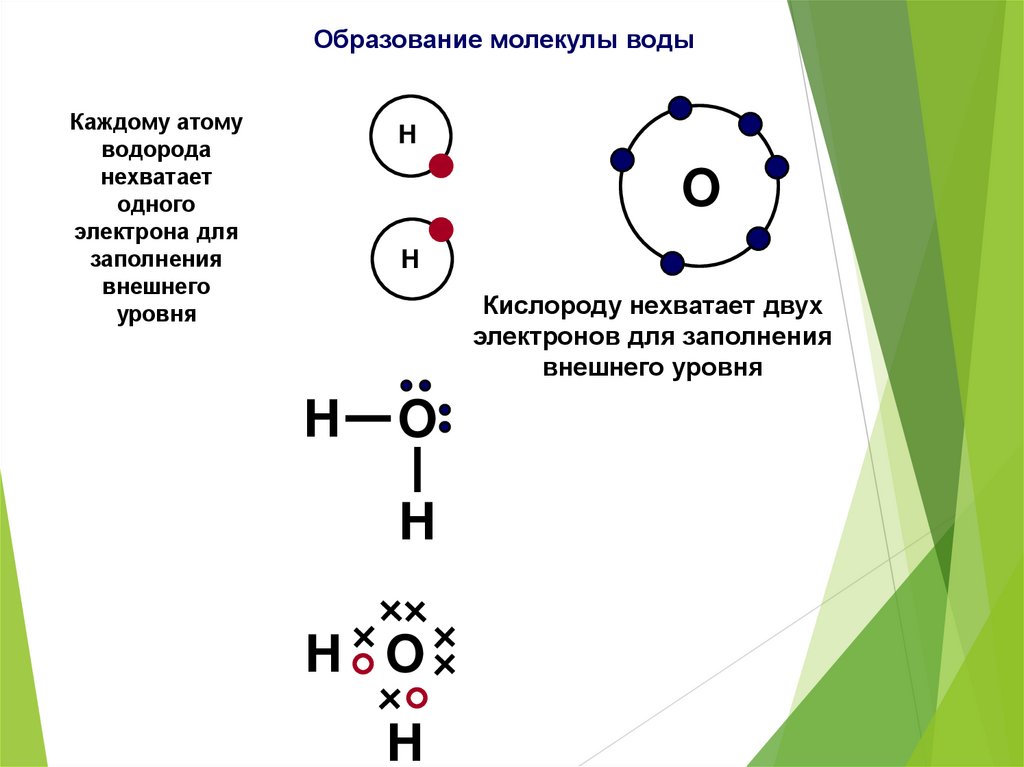
Образование молекулы водыКаждому атому
водорода
нехватает
одного
электрона для
заполнения
внешнего
уровня
H
O
H
Кислороду нехватает двух
электронов для заполнения
внешнего уровня
H
O
H
H O
H
15.
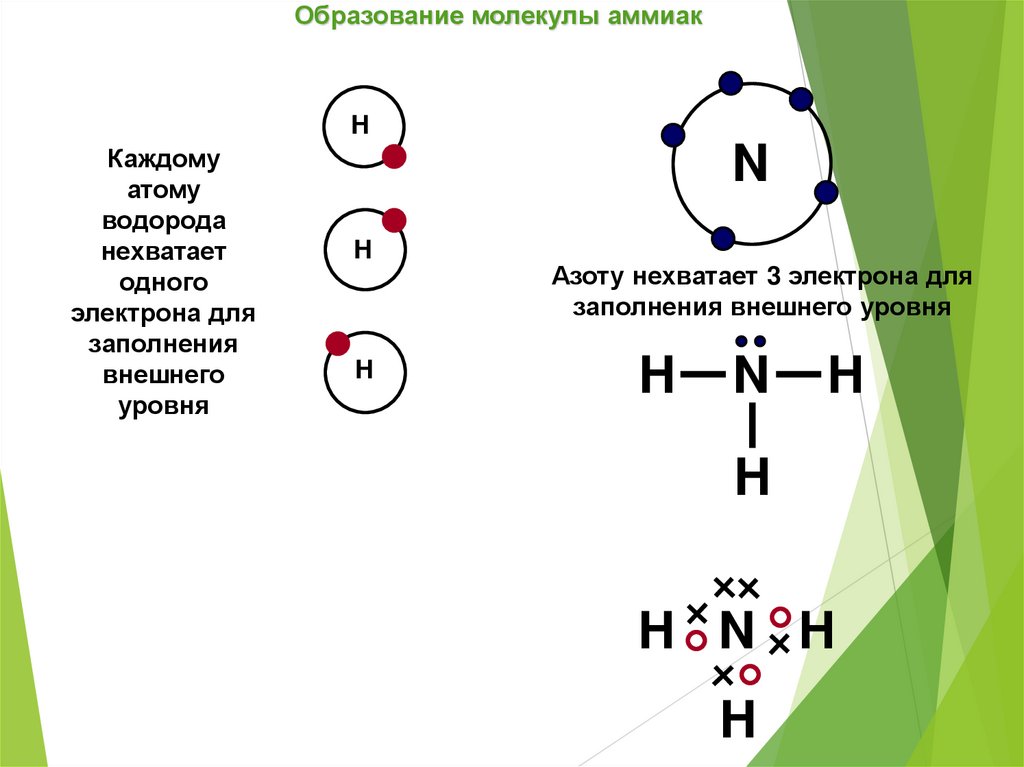
Образование молекулы аммиакH
Каждому
атому
водорода
нехватает
одного
электрона для
заполнения
внешнего
уровня
N
H
H
Азоту нехватает 3 электрона для
заполнения внешнего уровня
H
N
H
H
H N H
H
16.
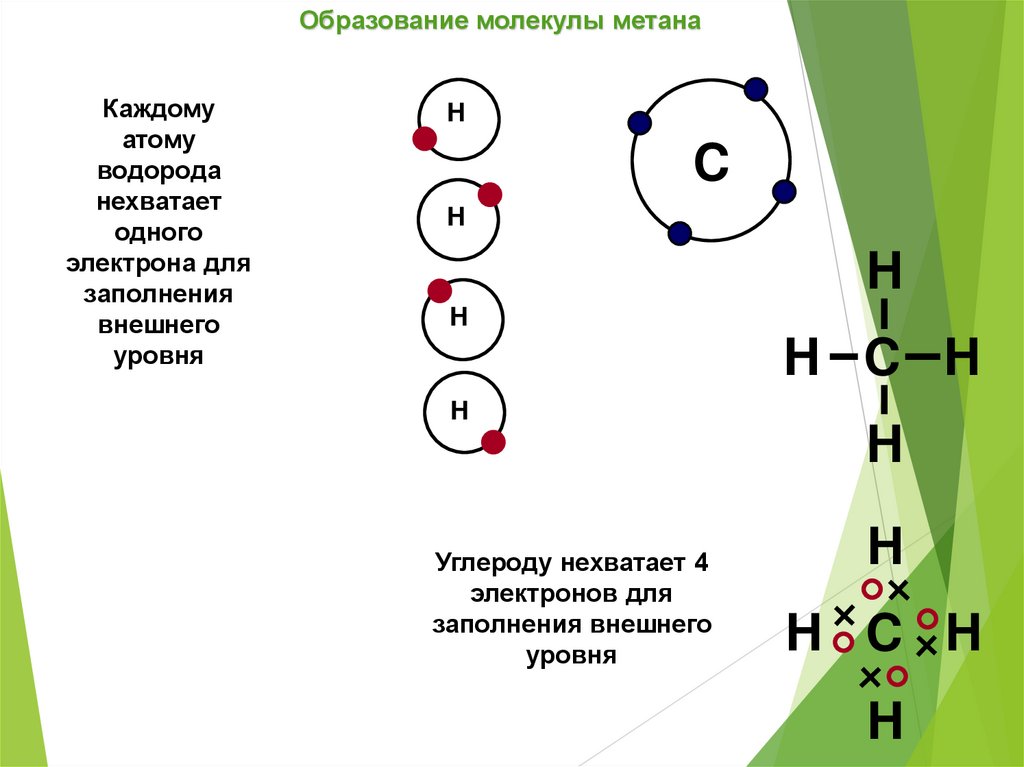
Образование молекулы метанаКаждому
атому
водорода
нехватает
одного
электрона для
заполнения
внешнего
уровня
H
C
H
H
H
H C H
H
H
Углероду нехватает 4
электронов для
заполнения внешнего
уровня
H
H C H
H
17.
Определите тип связи:•H–H
18.
Определите тип связи:•Cl–Cl
19.
Определите тип связи:•O–O
20.
Определите тип связи инаправление смещения
электронной пары:
•H–Cl
21.
Определите тип связи инаправление смещения
электронной пары:
•H–O
22.
А) Н и Р,Б) Fe и Fe,
В) Na и F,
Г)О и О,
Д) S и F,
Е)Са и О.
23.
А) LiFВ) ССl4
Д) ВаО
Б) Вr2
Г) КСl
Е) SO2
24.
а)в)
б)
г)
25.
1) увеличивается3) уменьшается
2) не изменяется
4) сначала уменьшается,
потом увеличивается
26.
а) Oб) B
в) F
г) С
д) N


















 Химия
Химия