Похожие презентации:
3ec36ff061334ab8bdbc508f323021bd
1.
2010 г.Автор: учитель химии Копусь Л.В.
МБОУ г. Иркутска СОШ № 30
2. Состав кислот
IIкислотный остаток
Н2SO4
Валентность кислотного остатка
определяется числом атомов водорода
в молекуле кислоты
3. Кислоты
Кислотами называют сложныевещества, состоящие
из атомов водорода
и кислотных остатков
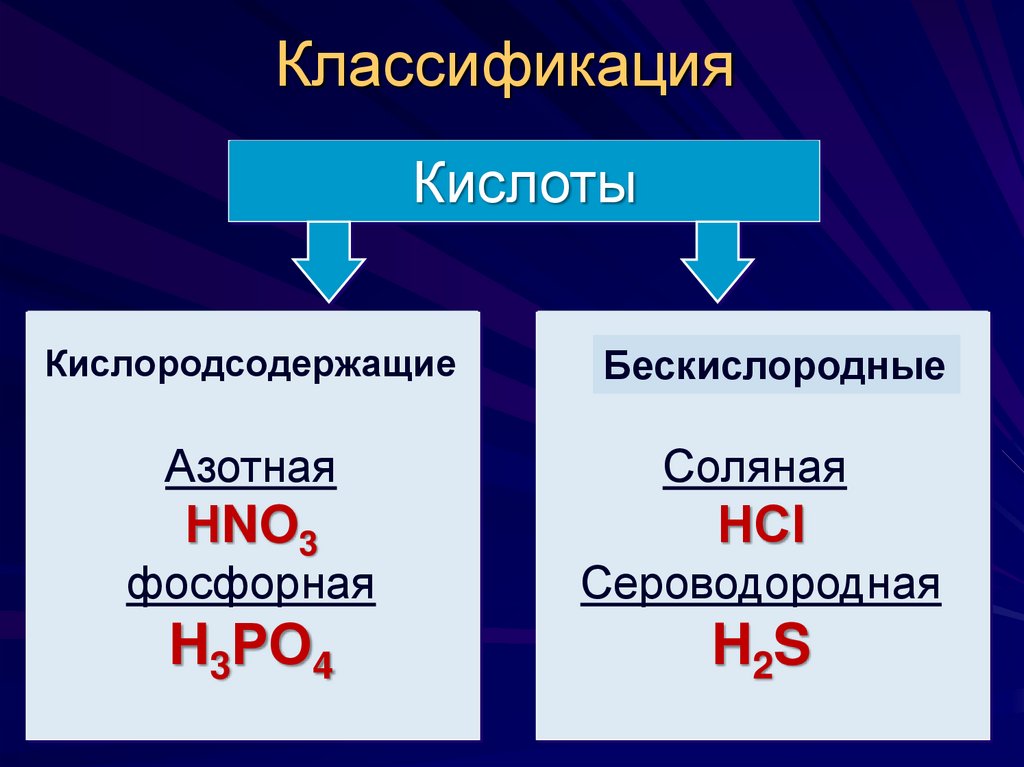
4. Классификация
КислотыКислородсодержащие
Бескислородные
Азотная
Соляная
НNO3
НСl
фосфорная
Сероводородная
H3РО4
H2S
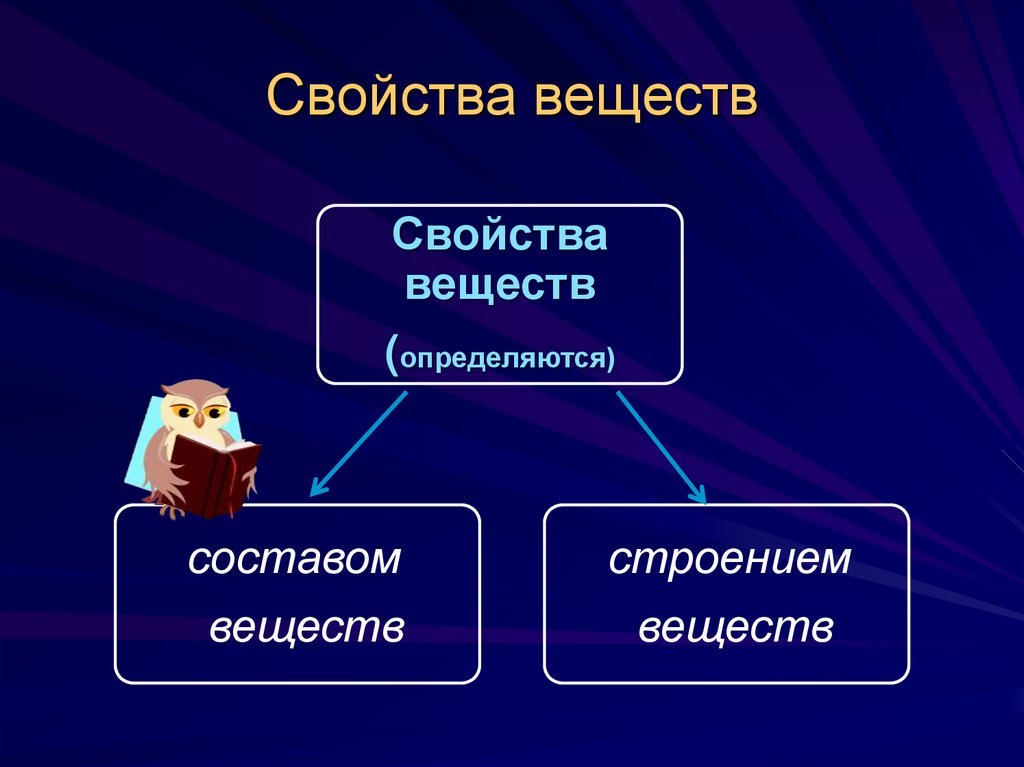
5. Свойства веществ
Свойствавеществ
(определяются)
составом
веществ
строением
веществ
6. Состав кислот
Что общего в составе кислот?– В состав кислот входят подвижные
атомы водорода, которые способны
замещаться на атомы металла.
Именно этим объясняются общие
свойства кислот.
7. Действие растворов кислот на индикаторы
ИндикаторыЛакмус
Фенолфталеин
Метиловый
оранжевый
Нейтральная
среда
Кислотная
среда
8. Взаимодействие с металлами
CuFe
Zn
Mg
Na
Усиление химической активности металлов
9. Взаимодействие с металлами
2II
I
Zn + 2HCl = ZnCl2 + H2
хлорид цинка
10. Взаимодействие с металлами
2II
I
Fe + 2HCl = FeCl2 + H2
хлорид железа (II)
11. Взаимодействие с металлами
3III I
2 Аl+6 HCl = 2 AlCl3 +3H2
хлорид алюминия
12. Реакция с металлами
!Все металлы, стоящие в ряду
активности до водорода,
способны вытеснять водород
из растворов кислот.
стр.
154
13. Фосфорная кислота
Фосфорная кислота применяетсяв фармацевтической и пищевой
промышленности
На этикетках продуктов
питания фосфорную
кислоту обозначают
Е 338
Производство минеральных
удобрений
14. Различия свойств кислот
HClH2SO4
Кислотные остатки в химических
реакциях обычно
сохраняются и переходят из одних
соединений в другие.
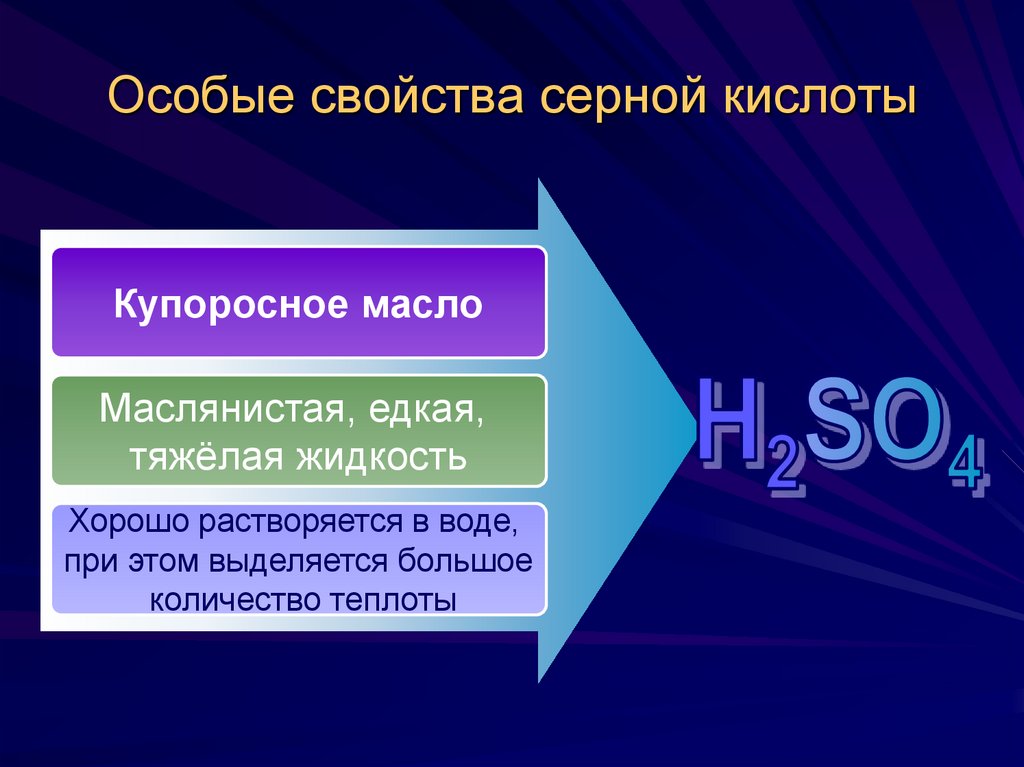
15. Особые свойства серной кислоты
Купоросное маслоМаслянистая, едкая,
тяжёлая жидкость
Хорошо растворяется в воде,
при этом выделяется большое
количество теплоты
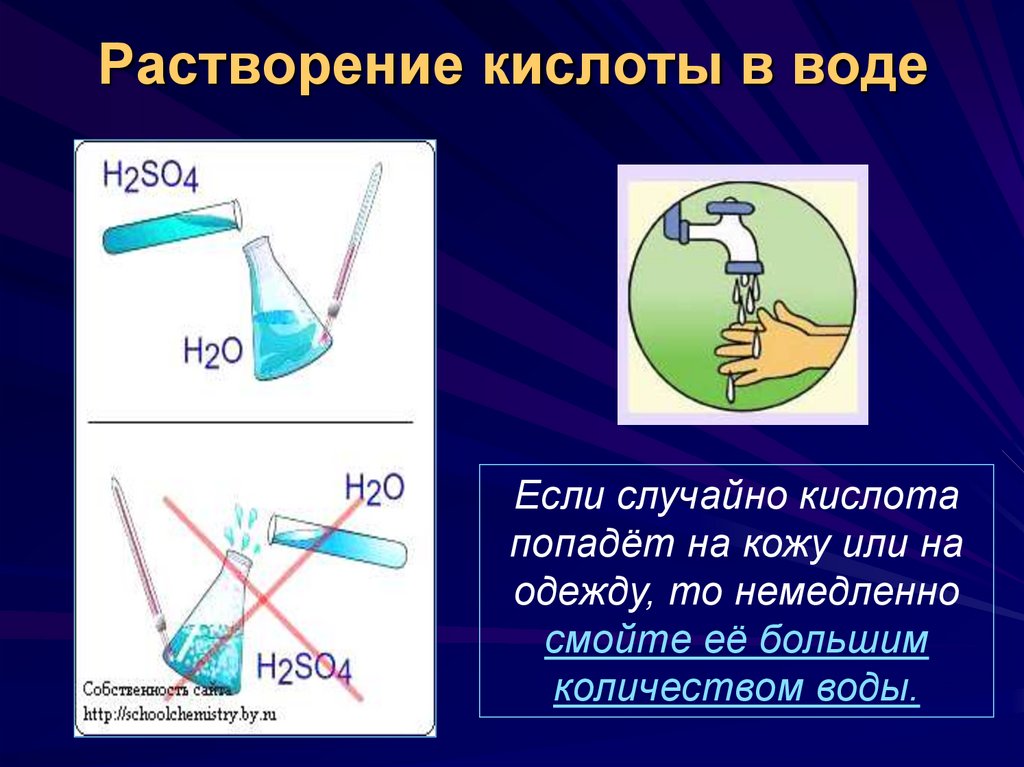
16. Запомните!
Кислота должнадобавляться в
воду!
При приливании воды
к кислоте может
произойти
разбрызгивание кипящей
воды вместе с каплями
кислоты.
17. Растворение кислоты в воде
Если случайно кислотапопадёт на кожу или на
одежду, то немедленно
смойте её большим
количеством воды.
18.
Серная кислота – Н2SO4Серная кислота
гигроскопична!
(способна поглощать влагу)
Её используют для
осушки некоторых
веществ.
19. Серная кислота – Н2SO4
Сахар, древесина, бумага под действиемкислоты обугливаются.
При попадании на кожу вызывает
сильные ожоги.
20. Особые свойства Н2SO4
В результате взаимодействияконцентрированной серной кислоты
с металлами, образуется
оксид серы (IV), а не водород.
Реагирует с малоактивными
металлами, стоящими в ряду
активности правее водорода
21. Соляная кислота - НСl
Соляная кислота разрушает:бумагу
Соляная кислота
дымит на воздухе
ткань
сахар
древесину
22.
Особые свойстваПолучается
при
растворении
газа
хлороводорода
в воде
НСl
Бесцветная,
едкая
жидкость
очень ядовита!
0,1% раствор соляной кислоты
содержится в желудочном
соке человека.
23. Особые свойства НNO3
Разбавленная азотная кислотане имеет цвета и запаха.
Это очень едкое вещество!
На руках оставляет жёлтые пятна.
Концентрированная азотная
кислота имеет резкий запах и
желтоватый цвет.
24. Азотная кислота – НNO3
Появление жёлтой окраскипри действии концентрированной кислоты
свидетельствует о наличии белков
в шерсти, твороге, яичном белке.
25. Особые свойства НNO3
В результате взаимодействияазотной кислоты с металлами
водород не выделяется,
образуются другие газы.
Реагирует с малоактивными
металлами, стоящими в ряду
активности правее водорода
26. Угольная кислота – Н2СО3
Угольная кислота –неустойчивая,
разлагается на воду
и углекислый газ
Лимонады,
шипучие напитки
содержат
угольную кислоту
27. Выводы
1Общие свойства кислот
объясняются тем, что в составе
есть подвижные атомы водорода
2
Различные свойства кислот
объясняются различным
составом кислотных остатков.























 Химия
Химия








