Похожие презентации:
Stroenie_atoma_PSKhE_DISTANT
1. Строение атома
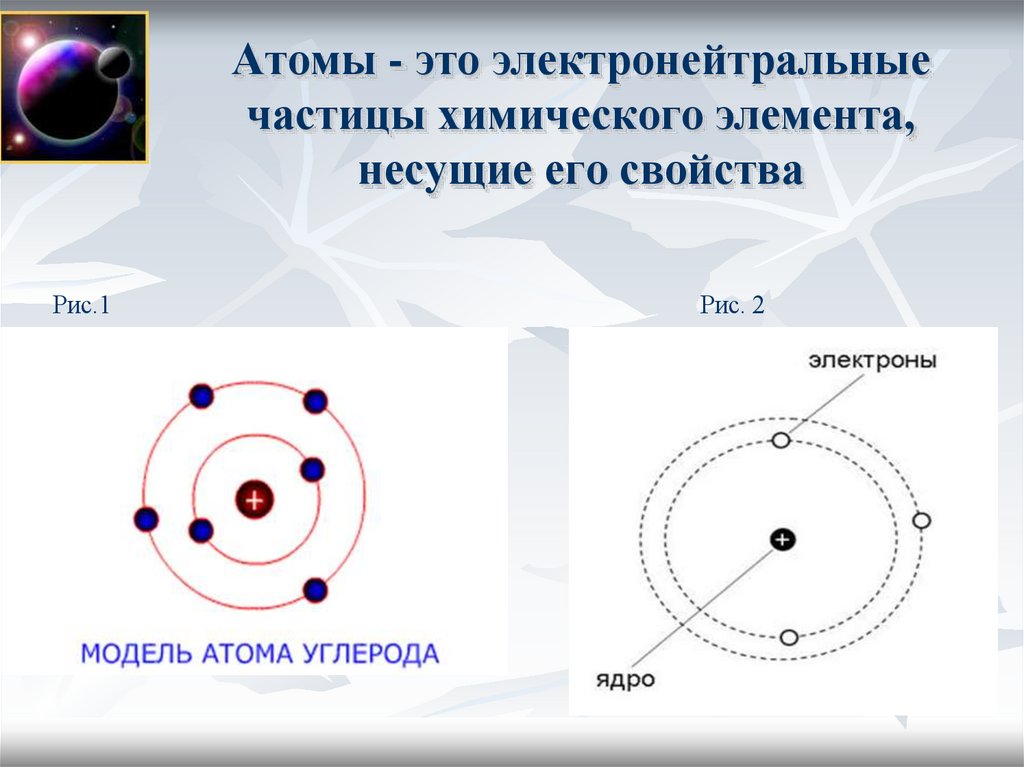
2. Атомы - это электронейтральные частицы химического элемента, несущие его свойства
Рис.1Рис. 2
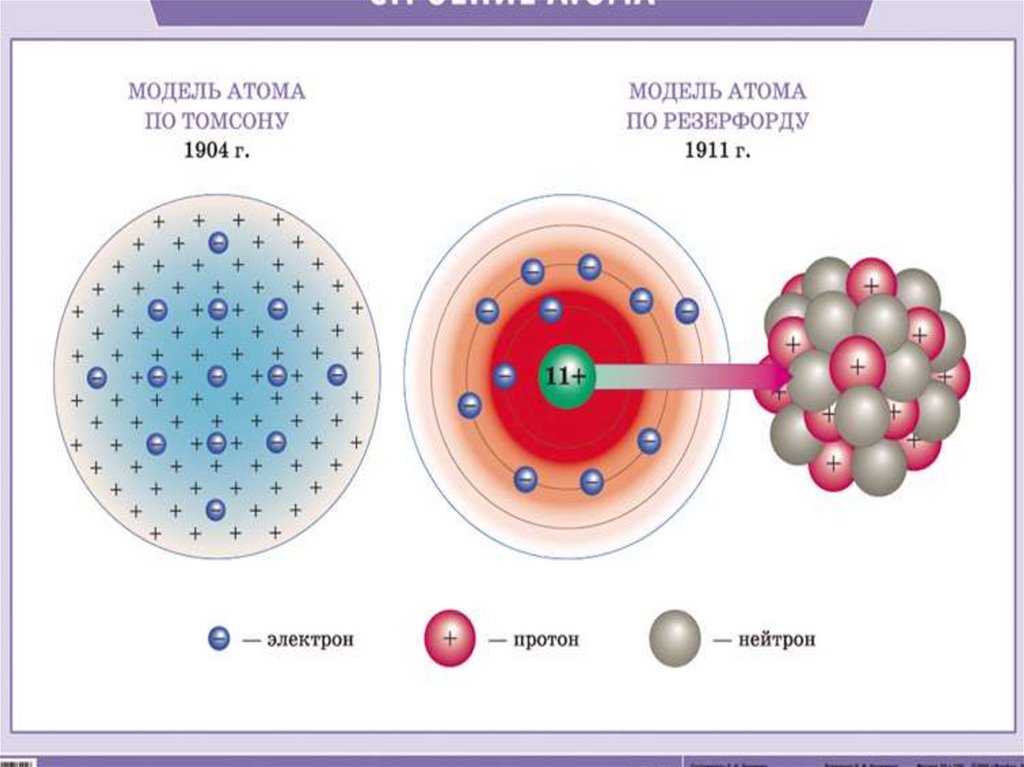
3.
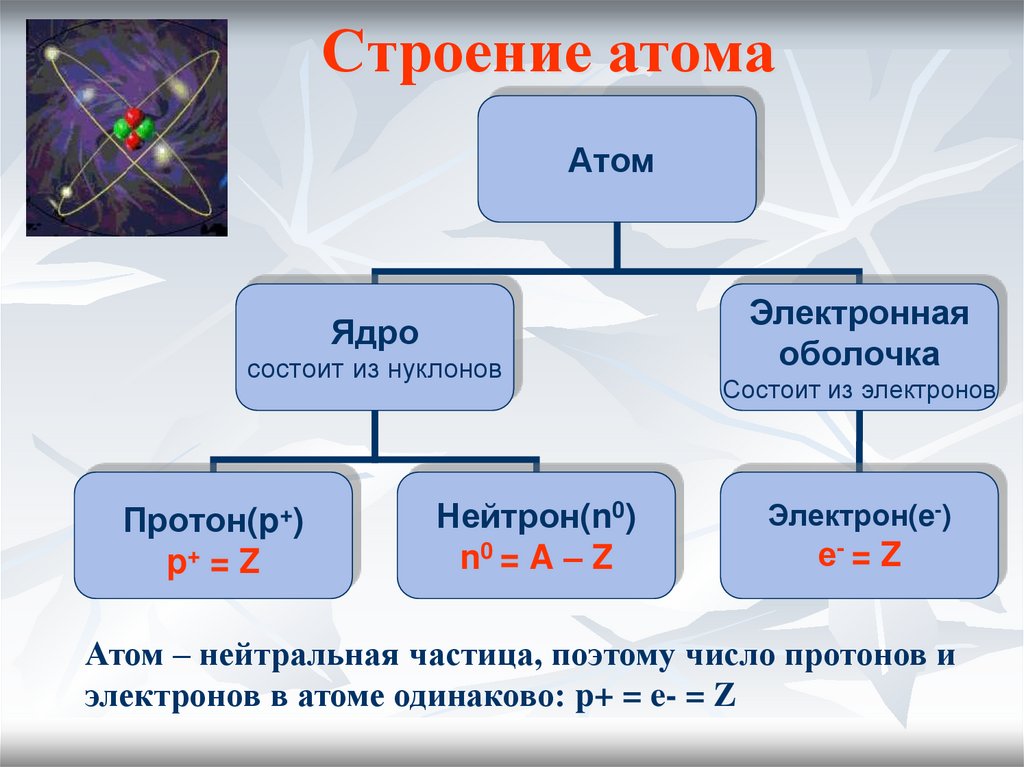
4. Строение атома
АтомЯдро
состоит из нуклонов
Протон(p+)
p+ = Z
Нейтрон(n0)
n0 = A – Z
Электронная
оболочка
Состоит из электронов
Электрон(e-)
е- = Z
Атом – нейтральная частица, поэтому число протонов и
электронов в атоме одинаково: p+ = e- = Z
5. ОПРЕДЕЛИТЬ КОЛ-ВО НУКЛОНОВ В АТОМЕ ХИМ.ЭЛЕМЕНТОВ
Например:Например:
химический элемент № 7 химический элемент № 29
Cu: Z = +29
N: Z = +7
p+ = 29
p+ = 7
n = 64 – 29 = 35
n = 14-7 = 7
e- = 29
e- = 7
6. ОПРЕДЕЛИТЬ КОЛ-ВО НУКЛОНОВ И ЭЛЕКТРОНОВ В АТОМЕ ХИМ.ЭЛЕМЕНТОВ
Химические элементы№ 8, 12, 26, 30, 42
7.
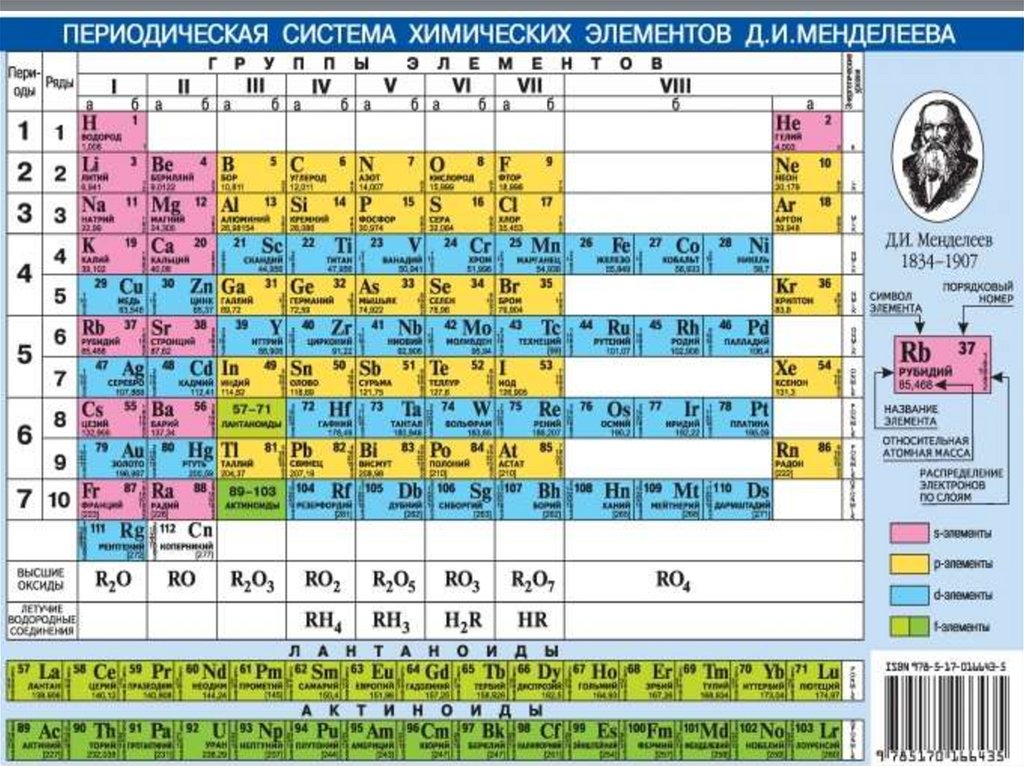
8. Периоды: 1, 2, 3 – малые; 4, 5, 6 – большие; 7 – незавершенный Номер периода = числу энергетических уровней Группы: Главная
подгруппа (элементы ТОЛЬКОмалых периодов)
Побочная подгруппа (элементы И малых И больших
периодов)
Номер группы = числу электронов на последнем
энергетическом уровне = максим. степени
окисления элемента
9.
10.
Порядок заполнения электронами орбиталей атомаопределяется тремя законами природы:
1. Принцип наименьшей энергии - электроны заполняют
орбитали в порядке возрастания энергии орбиталей.
2. Принцип Паули - на одной орбитали не может быть
больше двух электронов.
3. Правило Хунда - в пределах подуровня электроны
сначала заполняют свободные орбитали (по одному), и
лишь после этого образуют электронные пары.
11.
Распределение подуровней по энергиям выражается рядом (впрядке увеличения энергии):
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p ...
Номер Виды
эн
орбитале
уровня й
Макс. кол-во
электронов
на орбитале
1
S
2
S
2
p
S
6
2
p
d
S
6
10
2
p
d
f
6
10
14
2
3
4
Графическое обозначение
Макс.
кол-во ена уровне
2
8
18
32
12. Строение атома на примере магния
1. Порядковый номер магния? _____12______2. Тогда заряд ядра магния? _____+12______
3. Номер периода магния? _____3_____
Тогда кол-во энергетических уровней у магния? _____3_____
13. Показать строение атома КАЛИЯ, ХЛОРА, МЫШЬЯКА: электронную, графическую формулы (смотри на примере магния)
14.
Список литературы1) О. С. Габриелян и др. Химия 11 кл. М., Дрофа, 2002;
2) Г. Е. Рудзитис, Ф. Г. Фельдман. Химия 11 кл. М.,
Просвещение, 2001;
3) Рыбальченко В. С. Химия (начальный курс). Часть 1:
Учебное пособие. - 4-е изд. - М.: РГУ нефти и газа им И.М.
Губкина, 2003;
4) Большая Советская Энциклопедия;
5) Иванова Р. Г., Каверина А. А., Корощенко А. С. Уроки
химии. 10-11 классы. -М.: Просвещение, 2000;
6) Чежина Н. В. Общая и неорганическая химия. Конспект
курса лекций. -СПб.: Питер, 2001.










 Химия
Химия








