Похожие презентации:
угольная кислота
1. Угольная кислота и её соли
2. Угольная кислота
3. Дать характеристику кислоты по плану.
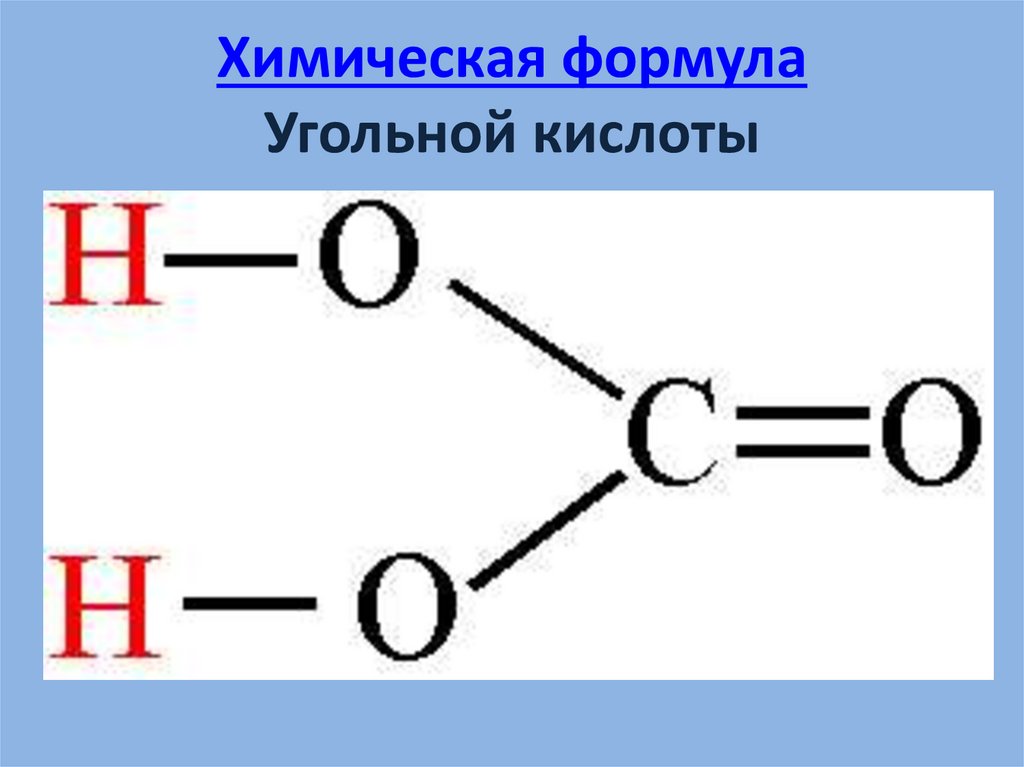
4. Химическая формула Угольной кислоты
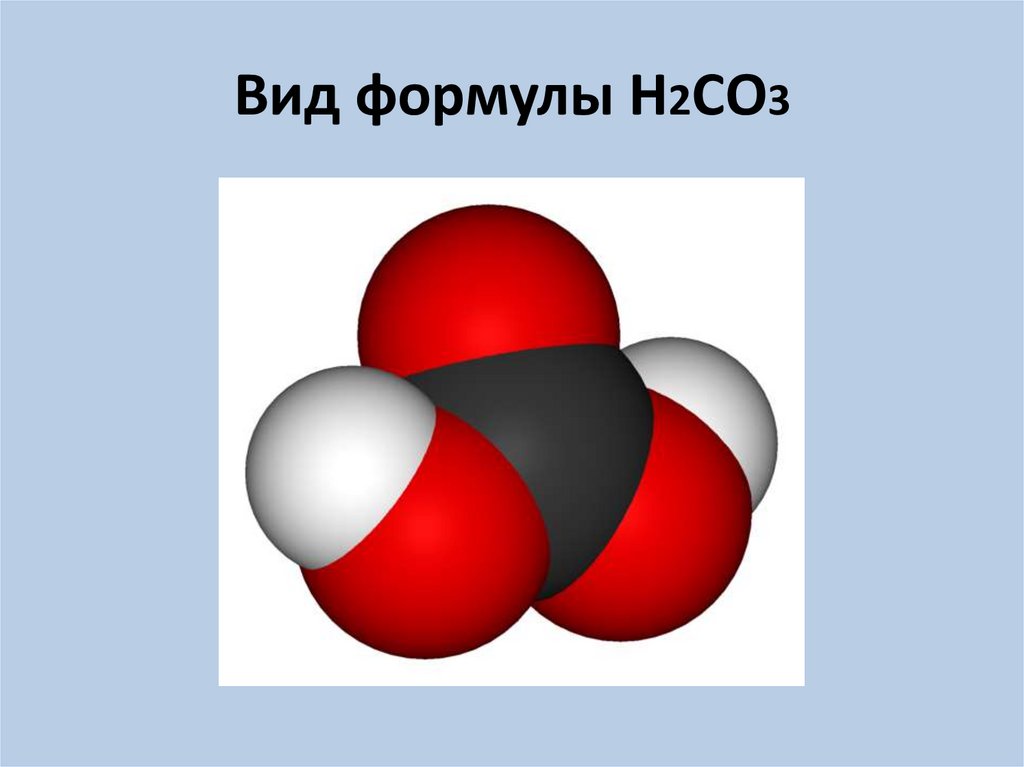
5. Вид формулы Н2СО3
6. Физические свойства Н2СО3
Угольная кислота Н2СО3 слабая, оченьнеустойчивая даже в водных
растворах. В насыщенном водном
растворе практически весь
углекислый газ содержится в виде
молекул СО2, окруженных
молекулами воды.
7. Получение Н2СО3
• Угольная кислота образуется прирастворении в воде диоксида углерода
СО2
• Содержание угольной кислоты в
растворе увеличивается при понижении
температуры раствора и увеличении
давления углекислого газа.
СО2 + Н2О = Н2СО3
8. Получение Н2СО3
• Также угольная кислота образуется привзаимодействии её солей (карбонатов и
гидрокарбонатов) с более сильной
кислотой. При этом бо́льшая часть
образовавшейся угольной кислоты, как
правило, разлагается на воду и диоксид
углерода
Na2CO3 + 2HCl = 2NaCl + CO2 + H2O
9.
10. 2 ряда солей Н2СО3
Средние (Нормальные)• Карбонаты
Na2CO3
CaCO3
Кислые
• Гидрокарбонаты
NaHCO3
Ca(HCO3)2
Трехвалентные металлы (Fe, Al, Cr) карбонатов
вообще не образуют – в соответствующих клетках
таблицы растворимости стоят прочерки
11. Практическое значение солей Н2СО3
• СаСО3 карбонат кальция• Мел
• Мрамор (Плотный
кристаллический
известняк)
• Известняк
• Кальцит(известковый
шпат)
12. Применение СаСО3 карбоната кальция
• Замачивание и стирка белья• Очистка нефти
• Производство стекла
• В текстильной промышленности
• В мыловаренной промышленности
13. Практическое значение солей Н2СО3
• NaHCO3гидрокарбонат натрия
• Питьевая сода
• Пищевая сода
• Двууглекислый натрий
14. Применение NaHCO3 гидрокарбоната натрия
• В огнетушителях• В хлебопечении
• При изготовлении шипучих напитков
15. Практическое значение солей Н2СО3
• Na2CO3 карбонатнатрия
• Стиральная сода
• Кальцинированная
сода
• Нормальный
карбонат
16. Практическое значение солей Н2СО3
• Na2CO3 10H2Oкристаллогидрат
карбоната
натрия
• Кристаллическая
сода
• Натрит
17. Практическое значение солей Н2СО3
• К2СО3 карбонаткалия
• Поташ
• Углекислый
калий
• Белая «зола» от
костра
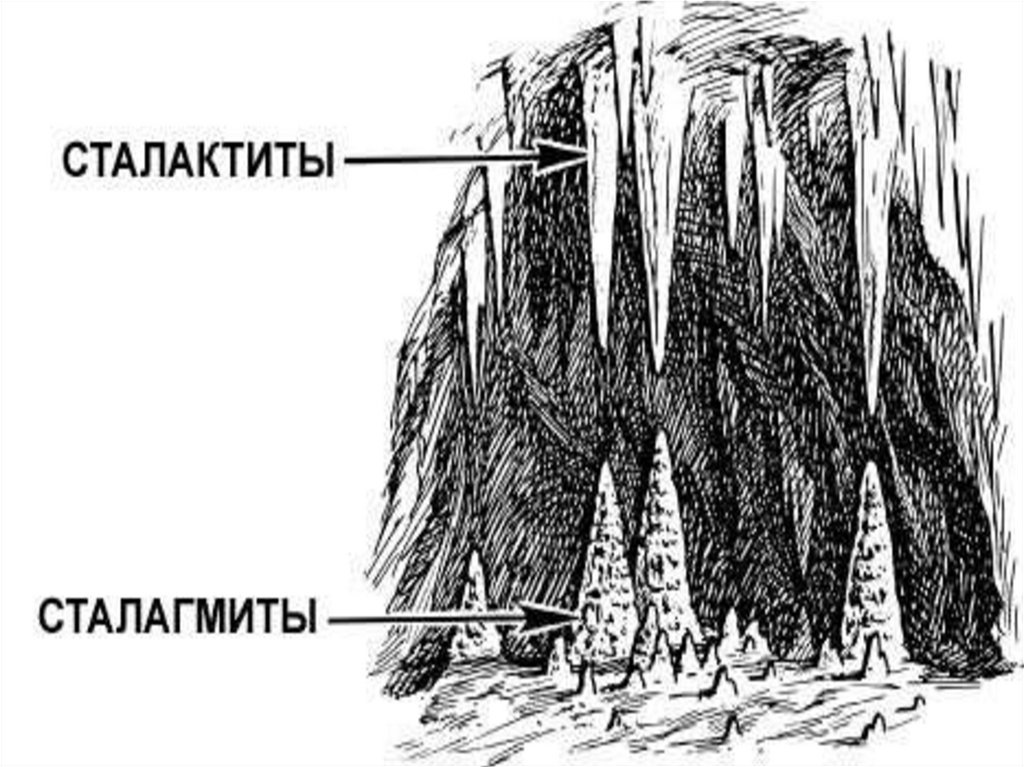
18. Сталактиты и сталагмиты
• сталактитами называют кальцитовые натёчнокапельные образования, имеющие формусосульки с внутренним питающим каналом
• сталагмиты - натечные минеральные
образования (большей частью известковые),
растущие в виде конусов, столбов со дна пещер
и других подземных карстовых полостей
навстречу сталактитам и нередко сливающиеся с
ними.
19.
20. Механизм образования
Вода, проникающая в пещеру, растворяетизвестняк в химической реакции:
2+
CaCO3 + H2O + CO2 <=> Ca + 2 HCO3
При определённых условиях (разница в
парциальном давлении углекислого газа в
растворе и воздухе) реакция идёт в обратную
сторону, и происходит отложение карбоната
кальция — растут сталактиты. Происходит это
весьма медленно, характерное время —
десятки, сотни лет. Длина сталактитов в
отдельных случаях достигает нескольких метров.


























 Химия
Химия








