Похожие презентации:
лекция начало нейтрализации 2023
1. Аналитическая химия
■ Аналитическая химия- наука о методах изучения простых и сложных веществ, ометодах изучения состава вещества, его структуры и количественного
соотношения компонентов в нем. Включает качественный и количественный
анализ.
■ Задачи аналитической химии
■ Теоретическое обоснование и разработка новых методов анализа на основе
законов фундаментальных наук.
ЗНАЧЕНИЕ АНАЛИТИЧЕСКОЙ ХИМИИ
1.Контроль сырья, в том числе токсичные в-ва.
2.Контроль процесса производства(служба аналитического контроля).
3.Контроль качества выпускаемой продукции.
4. Анализ отходов производства с целью их утилизации
5.Охрана окружающей среды.
2.
Качественный анализ■ Решает вопросы идентификации веществ, определяет из каких компонентов
состоит вещество
Количественный анализ
■ Позволяет определить количество вещества и отдельных компонентов в
анализируемой смеси.
3. Методы анализа
1. Химические методы анализа-основаны на использовании различныххимических реакций.
2. Физические методы анализа-основаны на изучении физических свойств
химических веществ.
3. ФХМА(физико-химические методы анализа)-основаны на регистрации
физических величин вещества в результате проведенной химической
реакции.
4. В зависимости от массы вещества взятого на анализ различают:
■ Макрометод m навески от 0,1-1грамма ,V 20-50 литров■ Полумикрометод m навески 0,01-0,1 г, V 2-5 л
■ Микрометод m 0,001-0,01 г, V 0,1-0,5 л
■ Для взвешивания веществ в макрометоде и полумикрометоде используют технические
весы, которые дают возможность взвешивать вещества с точностью до 0,02 г и в
микрометоде применяют аналитические весы ,которые дают возможность взвешивать
вещества с точностью до 0,0001г.
V измеряют с помощью специальной мерной посуды(пипетка, бюретка и мерная колба),
которая дает погрешность до 0,02 мл.
5. Метрология-наука об измерениях, методах и средствах обеспечения их единства и способах достижения требуемой точности. Точность
измерений называется качество измерений, отражающее близостьих результатов к истинному значению определяемой величины.
6.
Погрешность измерений зависит от метода измерений, от класса, точности прибора, отиндивидуальных способностей исследователя.
Различают:
7. Результаты вычисления должен содержать столько значащих цифр, чтобы только последняя была недостоверна
Точность измерений зависит откачества измерений, и обработки полученных результатов измерения
Результаты вычисления должен содержать столько значащих цифр, чтобы только последняя
была недостоверна
■ Значащими цифрами числа называются все цифры числа, кроме нулей стоящих
вначале числа, кроме нулей стоящих вначале числа. Например: 0,0054
■ При вычислении результата точность определяется точностью измерительных приборов
■ В количественном анализе точные концентрации растворов и масса навески
вычисляются до 4 знака после запятой
8. Способы выражения концентрации растворов.
9.
ТА/Х=С(ЭА)х М(Эх)/1000Титр рабочего раствора КМnO4 по железу показывает сколько грамм
железа реагирует с 1 мл КМnO4 и равен
ТМnO4- /Fe2+= C(ЭМnO4-) х М(Э Fe2+)/ 1000
.Массовая доля растворённого вещества определяется в процентах.
Массовая доля растворённого вещества (ωв-ва) выражает отношение массы растворённого
вещества (mв-ва) к общей массе раствора (mр-ра)
И выражается формулой:
ωв.ва = mв-ва/ mр-ра*100%
16% раствор КОН, это значит , что в 100 г раствора содержится 16 г КОН
10. Растворы в титриметрическом методе анализа.
Титрированные растворы – это растворы точно известной концентрации рассчитанные сточностью до 4-х знаков после запятой).
1. Рабочий титрированный раствор (титрант) – это раствор вещество с точно известной
концентрацией , применяемый для проведения реакции с неизвестным количеством
определяемого вещества пошедшего на титрование. Измеряют с помощью бюретки.
2. Раствор установочного вещества (первичный стандарт) – это раствор точно
известной концентрацией ,который используют для установления точной
концентрации титрантов.
3. Раствор определяемого вещества – исследуемый раствор (задача) его титруют
титрантом с целью определения количества вещества в растворе.
11. Способы приготовления титрированных растворов.
■ 1. Приготовление титрованного раствора по точной навеске.■ Таким способом готовят раствор установочного вещества (стандартный раствор).
■ Взвешивают на аналитических весах точную навеску вещества, переносят ее в мерную
колбу, растворяют в дистиллированной воде и доводят объем раствора до метки.
■
По результатам приготовления рассчитывают титр и концентрацию полученного
раствора по соответствующим формулам
■ Т(Х) = m(X) / V
С(Х) = Т(Х) 1000 / М(ЭХ)
12. Приготовление стандартных растворов из фиксаналов. Фиксаналы, или стандарт-титры, представляют собой точно отвешенное
Приготовление стандартных растворов из фиксаналов.Фиксаналы, или стандарт-титры, представляют собой точно отвешенное
количество реактива или его раствора, запаянного в стеклянную ампулу.
■ Как правило, в каждой ампуле содержится 0,1 эквивалента вещества.
При количественном перенесении содержимого подобной ампулы в
мерную колбу на 1 л и доведении объема раствора водой до метки при
20 °С получаются точно 0,1 н. растворы.
■ Выпускаются фиксаналы HCl, H2SO4, NaOH, КОН, Na2CO3, NaCl, Na2C2O4,
H2C2O4-2H2O, K2Cr2O7, K2C2O4, Na2S2O3-5H2O, KMnO4, AgNO3, NH4SCN,
KSCN, NaSCN, BaCl2-2H2O, (NH4)2C2O4-H2O, Na2B4O7-10H2O, KCl, K2CO3,
NH4Cl, I2 и др.
■ Фиксаналы рекомендуется применять во всех случаях, когда требуется
быстро приготовить точный рабочий раствор, не прибегая к
взвешиванию.
13. Требования к установочным веществам.
1. Состав вещества должен строго соответствовать определенной химическойформуле.
2. В-во не должно содержать примесей выше допустимого предела установленного
ГОСТом.
3. В-во должно быть устойчиво при комнатной температуре, не должно изменяться
при высушивании, не должно абсорбировать H20 и CO2 из воздуха.
4.
Р-ры данного в-ва должны быть устойчивы при хранении.
5.
Р-ия между установочным в-ом и титрантом должна протекать быстро и стехиометрически.
6.
В-во должно обладать большой молярной массой.
7.
Агрегатное состояние в-ва твердое или кристалическое.
14. 2.Приготовление рабочих титрованных растворов (титрантов)
■ По точной навеске титранты приготовить нельзя, т.к. среди веществ, используемых дляприготовления рабочих растворов, существует лишь немного таких, которые можно получить в
виде химически чистых препаратов определенного состава, т.е. они не отвечают требованиям,
предъявляемым к установочным веществам. Например, ряд веществ отличается большой
гигроскопичностью и поглощают диоксид углерода из воздуха (NaOH), теряют кристаллизованную
воду (Na2S2O3 5H2O), частично разлагаются при приготовлении и хранении (KMnO4) и т.д.
Поэтому титранты готовят приблизительной концентрации и устанавливают точную концентрацию
с помощью установочного веществ, отсюда способ приготовления- по установочному веществу
15. Химические методы анализа
1.Гравиметрический метод (весовой)- метод количественного
определения, основанный на точном измерении массы определяемого
компонента, выделенного в чистом виде или в виде соединения точно
известного состава.
■ Титриметрический анализ (объемный)- метод количественного определения, основанный
на измерении объема раствора реактива точно известной концентрации, расходуемого
для реакции с определяемым веществом.
■ Титрование –процесс приливания одного раствора, находящегося в бюретке к другому
раствору с целью определения концентрации одного из них.
aA+bB⟶Продукты реакции
А- титруемое в-во, В-титрант, а и в-стехиометрические коэффициенты .
16. Требования к реакциям, применяемым в титриметрическом методе:
1.Реакция должна протекать строго в стехиометрических отношениях.
2.
Реакция должна протекать количественно. Т.е. К равновесия реакции должна быть достаточно
велика.
3.
Реакция должна протекать с большой скоростью .
4.
Не должны протекать побочные реакции
5.
Необходимо иметь возможность точно установить точку эквивалентности (точку
стехиометричности).Т.е. определяемая экспериментально конечная точка титрования должна
быть как можно более близкой к точке эквивалентности.
17. Точка эквивалентности
■ Точка эквивалентности – момент когда раствор прилит копределяемому в-ву в строго эквивалентном количестве. Для
установления момента эквивалентности используют
индикаторы.
■ Индикаторы-это в-ва изменяющие свою окраску при
концентрации реагирующих веществ близких к точке
эквивалентности.
Момент титрования, когда индикатор меняет окраску, называютконечной точкой титрования (к.т.т.).
18. ЗАКОН ЭКВИВАЛЕНТОВ
На понятии эквивалентности реагирующих веществ основанывычисления результатов титриметрического анализа.
Фактор эквивалентности fэкв(Х) = 1/z
где
z - число замещенных (или присоединенных) ионов водорода (для
кислотно-основных реакций) или число отданных (или принятых)
электронов (для окислительно-восстановительных реакций).
19.
Фактор эквивалентности равен или меньше единицы.Для реакции
Н2SO4 + 2NaOH = Na2SO4 + 2H2O
fэкв.( Н2SO4) = 1/2;
fэкв.(NaOH) = 1.
fэкв.(H2SO4) = 1/2 означает, что 1/2 молекулы Н2SO4 дает для данной реакции
один ион водорода;
fэкв.(NaOH) = 1 означает, что одна молекула NaOH соединяется в данной
реакции с одним ионом водорода
20. ЗАКОН ЭКВИВАЛЕНТОВ
■ В основе титриметрического анализа лежит законэквивалентов. Согласно закону эквивалентов массы
реагирующих веществ m(A) и m(B) относятся между собой
как их молярные массы эквивалентов М(ЭА) и М(ЭВ)
■ m(A) / m(B) = М(ЭА) / М(ЭВ) или в объемном выражении:
■ С(Эx) ·V(x)= С(Эу) ·V(у)
21. Способы титрования
1. Способ пипетирования – определенный объем р-ра исследуемого в-ва отбирают припомощи пипетки, переносят в коническую колбу, добавляют индикатор и титруют рабочим
р-ом (титрантом) находящимся в бюретке. . Концентрацию титранта рассчитывают по
формуле:
С(Эр) = С(Эу) Vу / Vр
2. Способ отдельных навесок – точную навеску определяемого (установочного) в-ва помещают
в коническую колбу, растворяют в произвольном объеме воды, добавляют индикатор и
титруют рабочим р-ом, находящимся в бюретке. Концентрацию титранта рассчитывают по
формуле:
■ mу / М(Эу) = С(Эр) Vр / 1000
откуда
■ С(Эр) = mу 1000 / М(Эу) Vр
22. Методы титрования
■ Метод прямого титрования.■ Метод обратного титрования.
■ Метод замещения.
23. Методы титрования
■ Метод прямого титрования.■ Определяемое в-во титруется непосредственно рабочим р-ом.
■
Концентрацию исследуемого раствора рассчитывают по формуле
■ С(Эх) = С(Эр) Vр / Vх
■ где С(Эр) - молярная концентрация эквивалента (нормальная концентрация) рабочего
раствора, моль/л;
■ Vр - объем рабочего раствора, затраченный на титрование, мл.
■
С(Эх) - молярная концентрация эквивалента (нормальная концентрация) исследуемого
раствора, моль/л;
■ Vх – объем исследуемого раствора, взятый на титрование, мл;
24. Метод обратного титрования.
Этот метод применяют в тех случаях, когда скоростьреакции мала или не удается подобрать индикатор.
■ К определяемому в-ву А прибавляют избыток рабочего
р-ра В (точный объем и точной концентрации),
■ в-во А реагирует с в-ом В, а затем остаток в-ва В
(непрореагировавшее количество)
оттитровывают
другим рабочим титрованым р-ом С.
А+В⟶ Продукты реакции + избыток В
В(избыток)+С⟶ Продукты реакции
25. Например, при определении NH3 в солях аммония:
■В коническую колбу при помощи пипетки переносят 10 мл NH4Cl, туда же прибавляют избыток NaOH (Vр0 =20
мл), точно известной концентрации С(Эр1) ,пойдет реакция
■
1) NH4Cl + NaOH = NH4OH + NaCl + остаток NaOH
■
2) какое-то количество щелочи вступит в реакцию а какое –то останется
■
Остаток NaOH оттитровывают вторым рабочим раствором (НСl)
■
NaOH + HCl = NaCl + H2O
■
Вычисления сводятся к следующему:
■
С(Эр1) Vр1 = С(Эр2 HCl ) Vр2 (HCl) ,
■
где Vр1 - остаток (в мл) 1 рабочего раствора после реакции с определяемым веществом
■
Vр1 = С(Эр2) Vр2 / С(Эр1) остаток NaOH
■
Объем раствора (1), пошедший на реакцию с определяемым веществом
■
Vр вс = Vр0 - Vр1 -. NaOH вступивший в реакцию
■
Число моль эквивалентов NH4Cl во взятой навеске соли равно количеству моль эквивалентов
прореагировавшего гидроксида натрия. Следовательно, количество NH3 в навеске составляет
■
С(ЭNH3) = C(Эр1) Vр вс / 1000 = C(Эр1) (Vро - Vр1) / 1000
■
m(X) = C(Эр1) (Vро - Vр1) Vк М(Эх) / 1000 Vx
26. Метод замещения.
■ В ряде случаев необходимо определить содержание такого иона, который непосредственноне реагирует с обычными титрованными р-ми или реагирует не стехиометрично.
■ Например: Окислители иодометоическим методом определяют методом замещения.
■
Для этого вещества, обладающие окислительными свойствами обрабатывают иодидом калия
или натрия, а затем оттитровывают выделившийся при этом в эквивалентном количестве иод
стандартным раствором тиосульфата натрия. Общую схему определения окислителя А можно
представить следующим образом:
■ Аок. +
I-(избыток)
■ I2 + 2S2O32-
Авос. + I2
2I- + S4O62-
■ Количество иода, образовавшегося в результате первой peaкции, эквивалентно количеству А в
анализируемом образце.
27. КЛАССИФИКАЦИЯ МЕТОДОВ ТИТРИМЕТРИЧЕСКОГО АНАЛИЗА
■ В зависимости от типа применяемых реакций методытитриметрического анализа делят на четыре большие
группы. Каждая из этих групп, в свою очередь, обычно
включает несколько различных методов.
■ Методы кислотно-основного титрования основаны на
использовании реакции нейтрализации.
■ В качестве рабочих титрованных растворов применяют
сильные кислоты HCl,НNО3,Н2SO4 и основания NaOH,КОН.
28.
■Методы окисления-восстановления основаны на использовании
реакций окисления-восстановления. В качестве рабочих титрованных
растворов применяют растворы целого ряда окислителей (KMnO4,
K2Cr2O7, I2 и т.д.) и восстановителей Na2S2O3).
■ Методы осаждения основаны на использовании реакций осаждения
ионов в виде малорастворимых соединений. Наиболее часто этот
метод применяют для определения галогенидов. В качестве рабочего
раствора используют раствор нитрата серебра.
■ Методы комплексообразования основаны на использовании реакций
образования комплексных соединений. В последнее время широко
применяется титрование многих катионов посредством
этилендиаминтетрауксусной кислоты (комплексонометрия)
29. Метод кислотно-основного титрования
H++OH-⥂H2OЭтим методом можно определить органические и неорганические кислоты и основания , а также
соли, реагирующие в стехиометрических соотношениях с кислотами и основаниями. Рабочими рми в этом методе являются только сильные кислоты или сильные основания.
Сущность метода сводится к титрованию рабочим р-ом определяемого в-ва и установлению точки
эквивалентности.
1. Если рабочий р-ор – сильное основание, то в качестве установочного в-ва готовят кислоту,
которую готовят согласно требованиям к установочному в-ву.
2. Если рабочий раствор – сильная кислота, то в качестве установочного в-ва берут соли,
(Na2CO3)которые при гидролизе дают ярко выраженную щелочную реакцию среды.
Электролит – это вещество с ионом электропроводимости
Степень электронной диссоциации – число, то показывающее, какое кол-во от растворенного
электролита распадается на ионы.
Рабочими растворами являются только сильные кислоты и основания.
30. Константа эл. Диссоциации (к)
Константа электрической диссоциацией – характеризуетспособность электролита распадаться на ионы.
pH
0
Кислая
среда
7
Щелочная
среда
14
31. PH -это отрицательный логарифм от концентрации ионов водорода рОН-это отрицательный логарифм от концентрации гидрооксид ионов.
■ Величина pH в точке эквивалентности равна 7 только при титровании сильной к-тысильным основанием и наоборот.
■ Так, при титровании слабой к-ты сильным основанием в момент эквивалентности
Ph в момент эквивалентности pH р-ра вследствие гидролиза образующейся при
титровании соли >7
■ При титровании слабого основания сильной кислотой <7
Для фиксирования конечной точки титрования добавляют индикатор, за изменением
окраски которого наблюдают визуально. Индикатор выбирают по кривой титрования.
Индикаторы бывают двухцветными: лакмус (молекулы красные, ионы синие),
метилоранж (молекулы красные, ионы жёлтые) и одноцветными: фенолфталеин
(молекулы бесцветные, ионы малиновые).
32. Расчет pH сильной к-ты и сильного основания
1.HCl⥂ H+ +ClCk=[H+]-lgCk=pH
Если 0,1 моль/л
pH=-lg10-1
pH=1
Если 0,01 моль/л
pH=-lg 10-2
pH=2
2.
NaOH⥂Na++OH-
Сщ=[OH-]
Если Сщ=0,1 моль/л
-lgCщ=pOH
pH=14+lg10-1
pH=14-pOH
pH=14-1
pH=13
33. Расчет pH слабой к-ты и слабого основания
34. Буферные растворы
35. pH для гидролизующихся солей
36. Кривые титрования
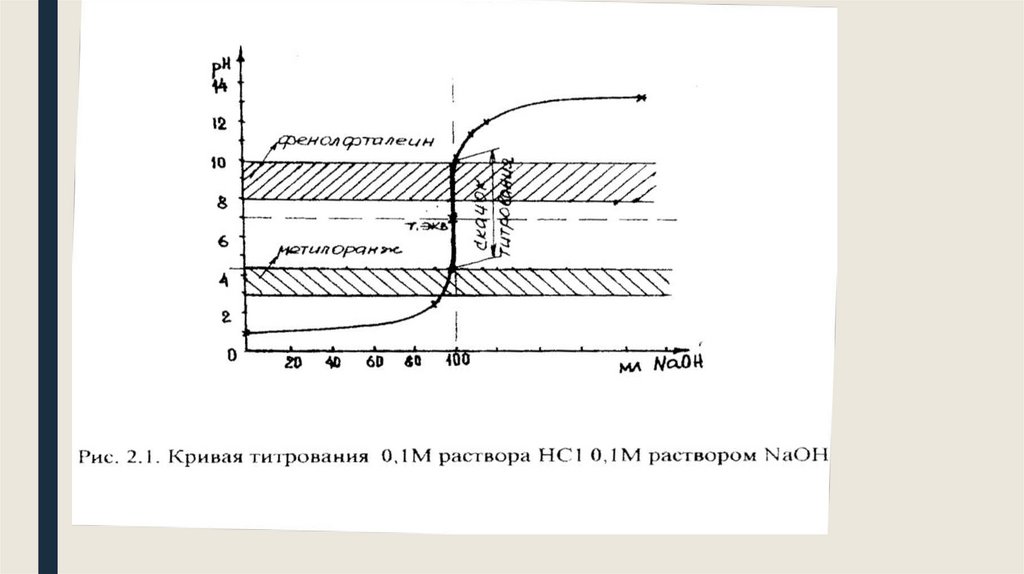
Кривая титрования–это графическое изображение изменения pH в процессе тит-ния.HCl+NaOH⥂NaCl+H2O
Титрование сильной кислоты сильным основанием (или наоборот)
Пусть на титрование взято 100 мл 0,1М р-ра НСl. Титрант - 0,1М р-р NaOH.
Вычислим рН раствора в различные моменты титрования.
а) Начальный момент титрования. В растворе присутствует НСl, концентрация 0,1М;
рН такого раствора вычисляется по формуле
рН = - lg C(НСl) = - lg 10-1 = 1.
б) Любой момент титрования до точки эквивалентности. Пусть к 100 мл, взятого на
титрование 0,1М раствора НСl, прибавлено 90 мл 0,1М раствора NaOH.
В растворе осталось недотитровано10 мл НСl. Рассчитаем концентрацию остатка к-ты:
C(НСl) =10х0,1/100=0,01 (должны делить на190, но делим на 100 для простоты
расчета, ошибка очень небольшая)
рН = - lg C(НСl)= -l g 10-2 = 2
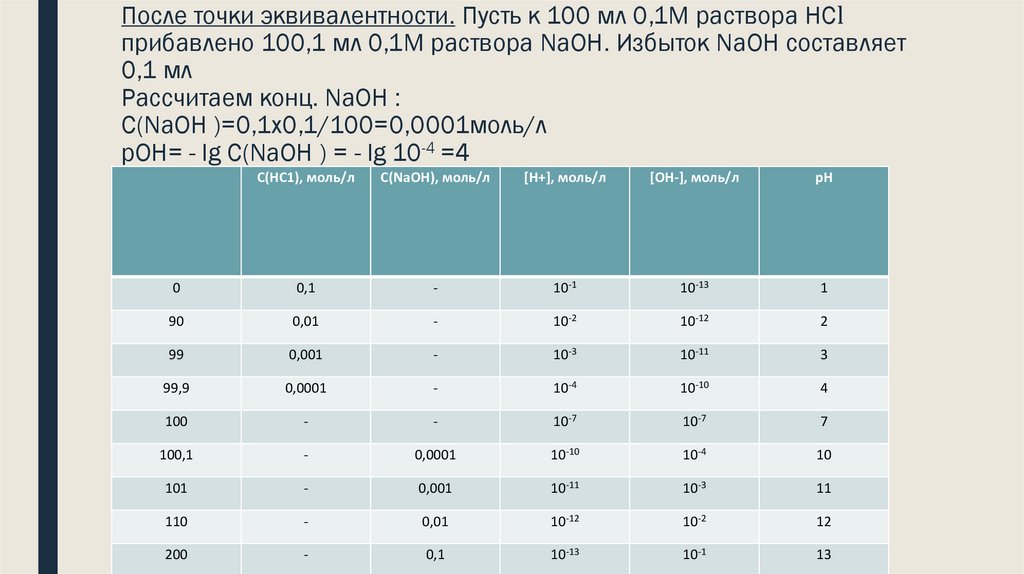
ДАЛЕЕ ДАННЫЕ ТИТРОВАНИЯ СВЕДЕМ В ТАБЛИЦУ
37. После точки эквивалентности. Пусть к 100 мл 0,1М раствора НСl прибавлено 100,1 мл 0,1М раствора NaOH. Избыток NaOH составляет
0,1 млРассчитаем конц. NaOH :
C(NaOH )=0,1х0,1/100=0,0001моль/л
рОН= - lg C(NaOH ) = - lg 10-4 =4
[ОН-], моль/л
рН
рН=14-4=10С(НС1), моль/л С(NaOH), моль/л [Н+], моль/л
0
0,1
-
10-1
10-13
1
90
0,01
-
10-2
10-12
2
99
0,001
-
10-3
10-11
3
99,9
0,0001
-
10-4
10-10
4
100
-
-
10-7
10-7
7
100,1
-
0,0001
10-10
10-4
10
101
-
0,001
10-11
10-3
11
110
-
0,01
10-12
10-2
12
200
-
0,1
10-13
10-1
13
38.
39. Анализ кривой титрования СИЛЬНОЙ К-ТЫ СИЛЬНЫМ ОСНОВАНИЕМ
1. Кривая симметрична относительно линии нейтральности и линии эквивалентности2. Точка эквивалентности совпадает с точкой нейтральности .
3. На кривой тит-вания есть участок, где в-на рН резко изменяется от очень маленьких кол-в
прилитого титранта. Этот участок кривой называют скачок титрования. Скачок титрования
–это резкое изменение рН вблизи т. эквив. От1-2 капель прилитого титранта. Наличие
скачка титрования имеет большое значение для правильного выбора индикатора.
Индикатор для титрования выбирают так ,чтобы изменение его окраски соответственно
входило в скачок титрования. Мы титровали ф/ф изменение его окраски лежит в интервале
значений рН=8-10 (величина)
4. В-на скачка прямо пропорционально концентрации реагирующих в-в(чем меньше
концентрация, тем меньше скачок)
5.
С увеличением тем-ры уменьшается скачок титрования.
40.
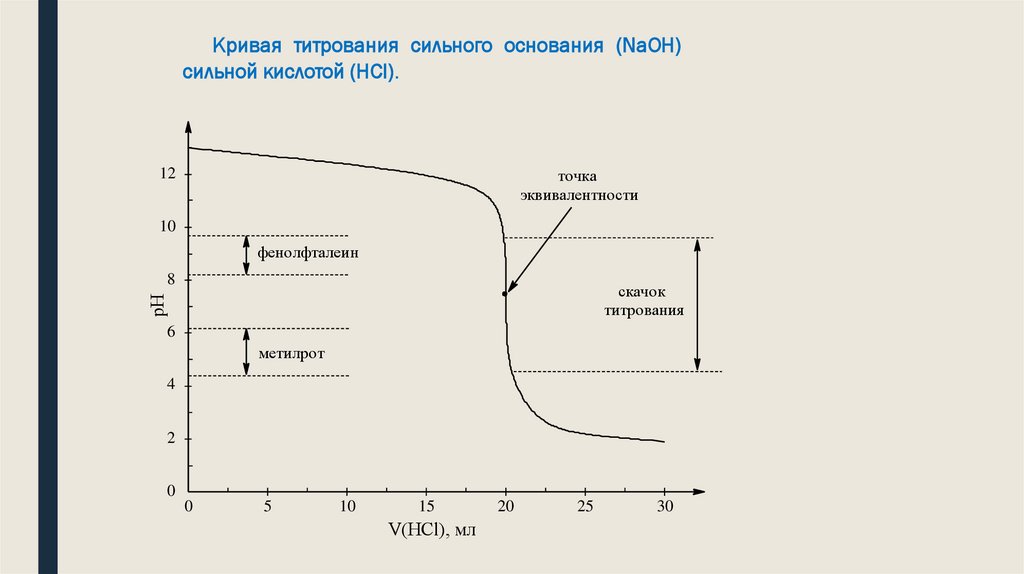
Кривая титрования сильного основания (NaOH)сильной кислотой (HCl).
точка
эквивалентности
12
10
фенолфталеин
8
рН
скачок
титрования
6
метилрот
4
2
0
0
5
10
15
V(HCl), мл
20
25
30
41. Титрование слабой кислоты сильным основанием
Рассмотрим на примере титрования 100 мл 0,1М СН3СООН 0,1М растворомNaOH. Для упрощения расчетов так же, как и в предыдущем случае, будем
считать, что объем при титровании не увеличивается.
■
1. В начальный момент титрования в растворе присутствует только
СН3СООН.
■ рН = 1/2 рКСН3СООН - 1/2 lg С(СН3СООН)
КСН3СООН = 1,74 10-5; рКСН3СООН = 4,76; С(СН3СООН) = 0,1 М
■ рН = 1/2 х4,76 - 1/2 lg 10-1.=2,38+0,5=2,88
42.
2. В любой момент титрования до точки эквивалентности рН растворарассчитывается как для буферной смеси, т.к. в растворе присутствуют СН3СООН и
СН3СООNa.
Тогда
рН = рКСН3СООН - lg C(СН3СООН) / C(СН3СООNa)
Пусть к 100 мл 0,1М раствора СН3СООН прилито 9 мл 0,1М раствора NaОН.
Тогда, 9% уксусной кислоты прореагировав с NaОН, перейдет в соль СН3СООNa
(принимая во внимание, что концентрации СН3СООН и NaОН одинаковы), и 91%
уксусной кислоты останется. Значит в данный момент отношение концентраций
кислоты и соли С(СН3СООН) / С(СН3СООNa) равно 91:9, т.е. равно отношению
числа миллилитров прибавленного NaОН к числу миллилитров неоттитрованной
кислоты
■ рН = 4,76 - lg 91 / 9 = 3,76.
Аналогично можно рассчитать, что когда прибавлено
■
50 мл NaОН рН раствора равен рН = 4,76 - lg 50 / 50 = 4,76.;
■
91 мл NaОН - рН = 4,76 - lg 9 / 91 = 5,76.
■ 99 мл - рН = 4,76 - lg 1 / 99 = 6,76.
■
99,9 мл - рН = 4,76 - lg 0,1 / 99.9 = 7,76.
43.
■ 3. В момент эквивалентности прибавлено 100 мл 0,1М NaОН. Так какизменением объема при титровании пренебрегли, то концентрацию
образовавшейся соли СН3СООNa считаем равной начальной концентрации
кислоты, т.е. 0,1М; рН в данный момент титрования рассчитываем, как для
гидролизующейся соли
■ рН = 7 + 1/2 рКСН3СООН + 1/2 lg C(СН3СООNa), рН = 8,88.
■ 4. После точки эквивалентности рН раствора обусловлен избытком NaOH, так
как в присутствии сильного основания гидролиз соли СН3СООNa подавлен,
■
рН в различные моменты титрования рассчитывается так же, как и в
предыдущем примере (титрование соляной кислоты гидроксидом натрия).
Результаты вычислений рН приведены в таблице.
■ Прибавлено100,1 МЛ 0,1М NaОН. Рассчитаем конц.избытка NaОН:
■ 0,1х0,1/100=0,0001моль/л
■ рОН= - lg C(NaОН)= - lg10-4=4
■ рН= 14- рОН= 14-4=10
44.
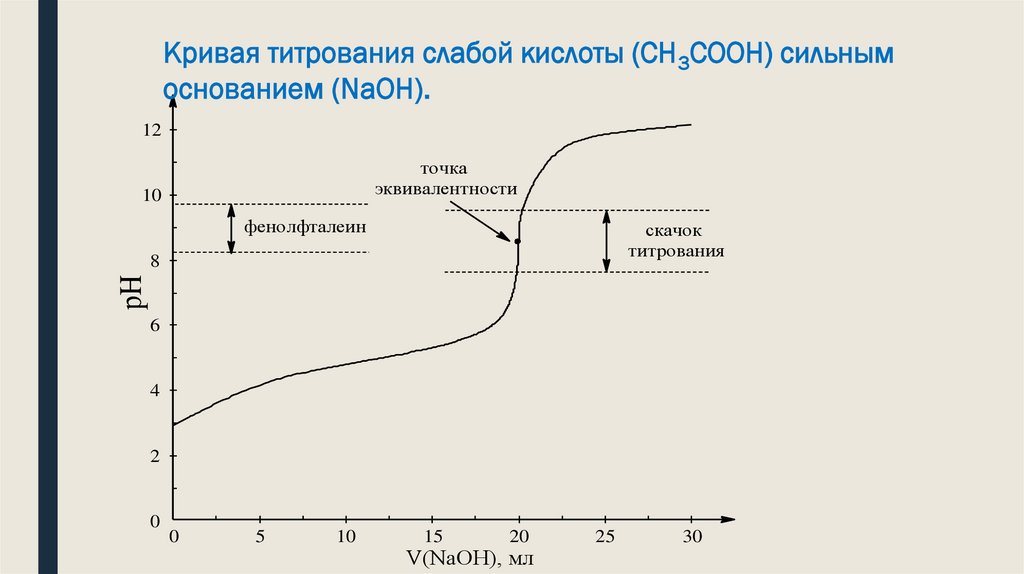
Кривая титрования слабой кислоты (СН3СООН) сильнымоснованием (NaOH).
12
точка
эквивалентности
10
фенолфталеин
скачок
титрования
pH
8
6
4
2
0
0
5
10
15
20
V(NaOH), мл
25
30
45.
Анализ кривой титрования слабой кислоты сильным основаниемКривая имеет ряд особенностей по сравнению с кривой тит-ания сильной кислоты.
Значительно менее резко меняется рН раствора вблизи точки эквивалентности,
меньше скачок рН (7,76 - 10), поэтому при титровании ни в коем случае нельзя
взять в качестве индикатора метиловый оранжевый, т.к. он изменит окраску
задолго до наступления момента эквивалентности. Для титрования подходит
индикатор фенолфталеин.
1.Кривая титрования несимметрична относительно линии нейтральности.
2 т. эквивалентности не совпадает с точкой нейтральности и лежит в щелочной
области, вследствие гидролиза образовавшейся соли.
3.Скачок титрования зависит от Кд к-ты. Титровать можно только ту к-ту у которой
Кд>10-7 иначе отсутствует скачок титрования.
4.Величина скачка титрования уменьшается с уменьшением концентрации растворов
5. С увеличением тем-ры уменьшается скачок титрования
6. Индикатор для титрования выбирают так, чтобы И.П.И. лежал в пределах скачка
титрования
46.
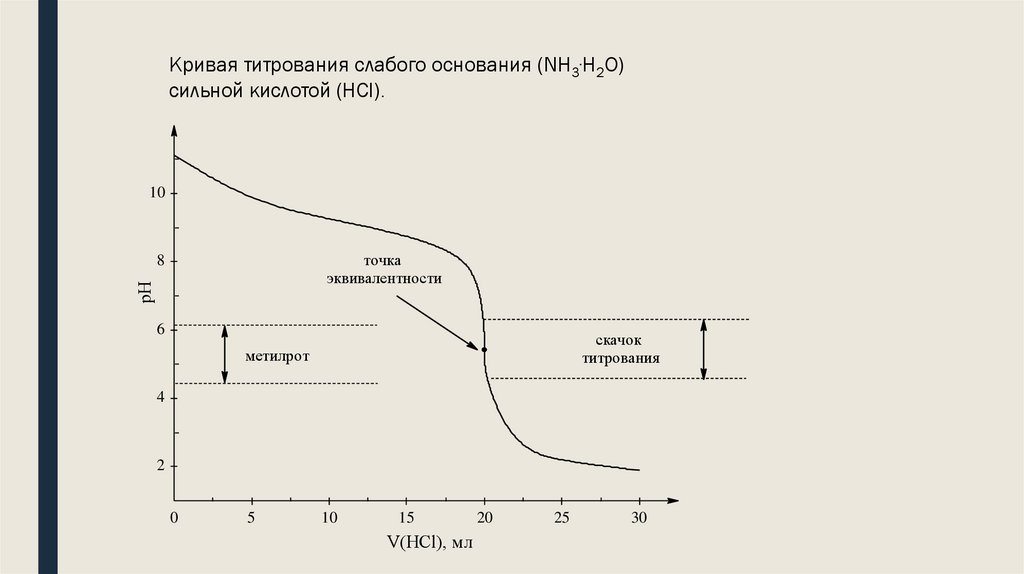
Кривая титрования слабого основания (NH3∙H2O)сильной кислотой (HCl).
10
точка
эквивалентности
рН
8
6
скачок
титрования
метилрот
4
2
0
5
10
15
V(HCl), мл
20
25
30
47. Кривые титрования многоосновных кислот
■ Многоосновные к-ты диссоциируют ступенчато. Многоосновные к-ты – слабые электролиты,константа диссоциации по каждой ступени отличаются друг от друга.
диссоциация H3PO4идет по ступеням:
I.
H3PO4⥱H2PO4-+H+
k1=7,7 ∙
II. H2PO4 ⥱ HPO42-+H+
k2=0,6∙10-7
III. HPO4 ⥱ PO43-+H+
k3=4,2 ∙ 10-13 и
Оттитровать эту кислоту можно по ступеням
1.Кд= 10-3 H3PO4+ NaOH ⥱ NaH2PO4+H2O
2.Кд= 10-7 NaH2PO4 + NaOH ⥱ Na2HPO4+H2O
3.Кд= 10-13 Na2HPO4 + NaOH ⥱ Na3PO4+H2O
48. Кривая титрования солей(Na2CO3 )
Наблюдается несколько перегибов:Na2CO3+НCl⥂NaHCO3+NaCl
NaHCO3+HCl⥂NaCl+CO2↑+H2O
1-я т. обр. NaHCO3 :рН=8,35
2—я т.обр. Н2CO3 :рН=3,75
Исходя из кривой тит-я можно
Увидеть, что в присутствии
Ф/ф Титруется только1/2Na2CO3
в присутствии м/о Na2CO3
можно оттитровать полностью
до Н2CO3











































 Химия
Химия








