Похожие презентации:
111cc2270c8a469dab57faaac14d71bc
1.
Строение веществаКовалентная химическая связь
Айрапетян Л.Р.
2020 г
2.
Ковалентная химическаясвязь
Связь, возникающая между атомами за счет
образования общих электронных пар, называется
ковалентной.
Связь между атомами одного химического
элемента называется неполярной.
Связь между атомами различных химических
элементов называется полярной
3.
Ковалентная химическаясвязь
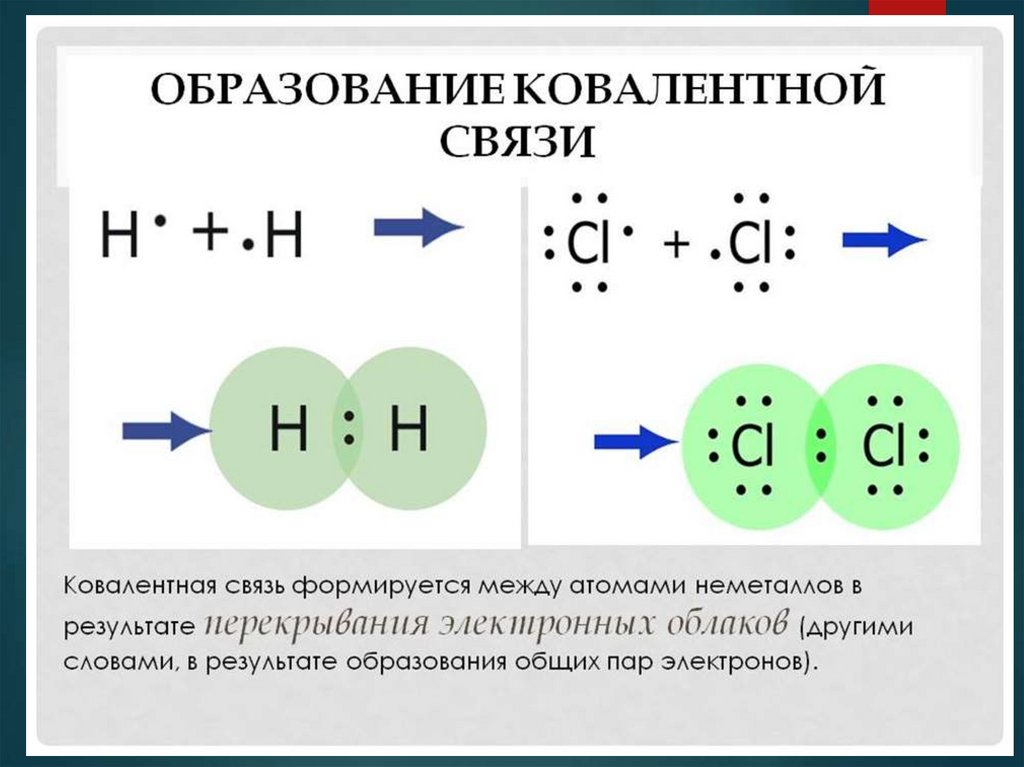
Рассмотрим строение молекулы водорода H2.
Каждый атом водорода на внешнем
энергетическом уровне несет 1 неспаренный
электрон.
H· + H· = H:H
В молекуле водорода одна общая электронная пара и
одна химическая связь H–H. Эта электронная пара не
смещается ни к одному из атомов водорода, т.к.
электроотрицательность у атомов водорода
одинаковая. Такая связь называется ковалентной
неполярной.
4.
Ковалентная химическаясвязь
Переход электронов с атомной орбитали на
молекулярную сопровождается образованием
химической связи:
На внешней орбитали атома азота находятся 3
неспаренных р-электрона. Взаимодействие двух
атомов азота будет происходить по следующей схеме:
5.
Ковалентная связьКратность химической связи — это число общих электронных
пар между двумя атомами в соединении. Кратность связи
достаточно легко можно определить из
значения валентности атомов, образующих молекулу.
В молекуле водорода H2 кратность связи равна 1, т.к. у
каждого водорода только 1 неспаренный электрон на
внешнем энергетическом уровне, следовательно, образуется
одна общая электронная пара.
В молекуле кислорода O2 кратность связи равна 2, т.к. у
каждого атома на внешнем энергетическом уровне есть по 2
неспаренных электрона: O=O.
В молекуле азота N2 кратность связи равна 3, т.к. между у
каждого атома по 3 неспаренных электрона на внешнем
энергетическом уровне, и атомы образуют 3 общие
электронные пары N≡N.
6.
Ковалентная химическаясвязь
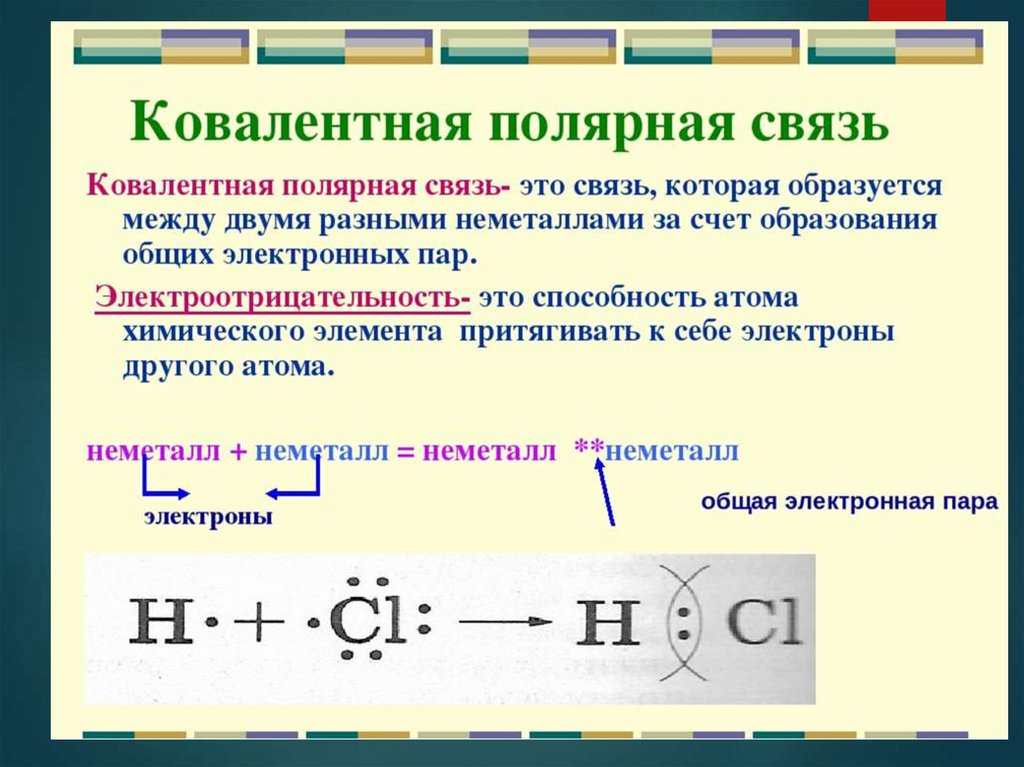
При взаимодействии атома водорода с атомом
хлора оба атома будут стремиться завершить свои
внешние энергетические уровни.
Электронная плотность смещена к более
электроотрицательному атому – следовательно, на
нем возникает частичный отрицательный заряд (δ-),
а на менее электроотрицательном атоме возникает
частичный положительный заряд (δ+).
В молекуле возникают два полюса — положительный
и отрицательный. Такую ковалентную связь называют
полярной.
7.
Ковалентная химическаясвязь
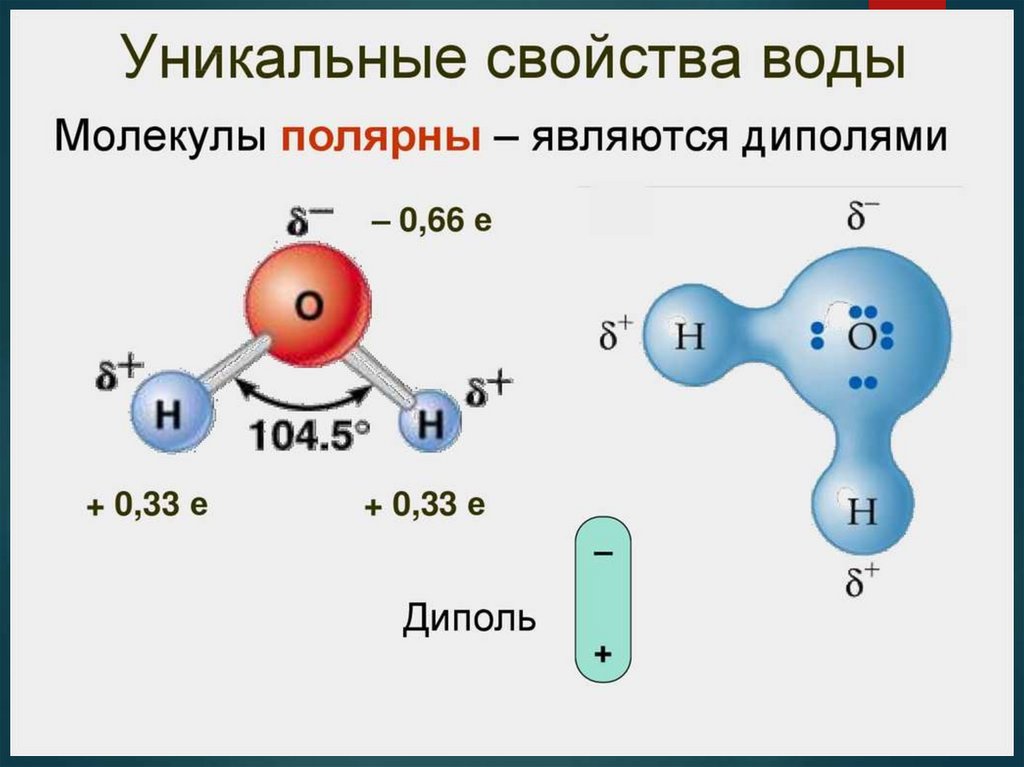
Так как ковалентная связь в линейной молекуле HCl
полярна, полярной будет и сама молекула. В ней
присутствуют два противоположно заряженных
полюса, поэтому такие молекулы называют
диполями. А молекула СН4 (метан), несмотря на
полярность каждой связи С-Н, в целом неполярна, что
связано со строением молекулы – полярность всех
связей взаимно компенсируется.
Вывод – полярность молекулы определяется
полярностью связей и ее геометрическим
строением.
Молекула воды, имеющая угловое строение,
представляет собой диполь.
8.
9.
Механизмы образованияковалентной связи
1. Обменный механизм – это когда каждая частица
предоставляет для образования общей электронной
пары один неспаренный электрон:
А· + · В= А:В
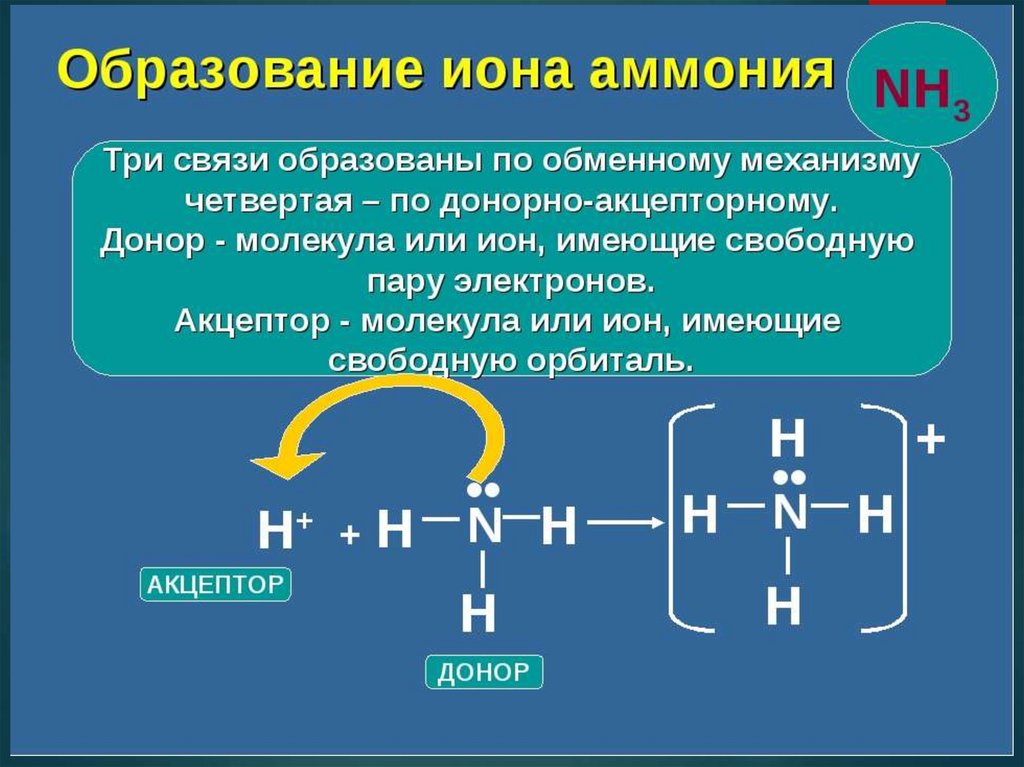
2. Донорно-акцепторный механизм – это такой
механизм, при котором одна из частиц
предоставляет неподеленную электронную пару, а
другая частица предоставляет вакантную орбиталь
для этой электронной пары:
А: +
B= А:В
Один из атомов предоставляет неподеленную
электронную пару (донор), а другой - вакантную
орбиталь для этой пары (акцептор).
10.
11.
12.
13.
14.
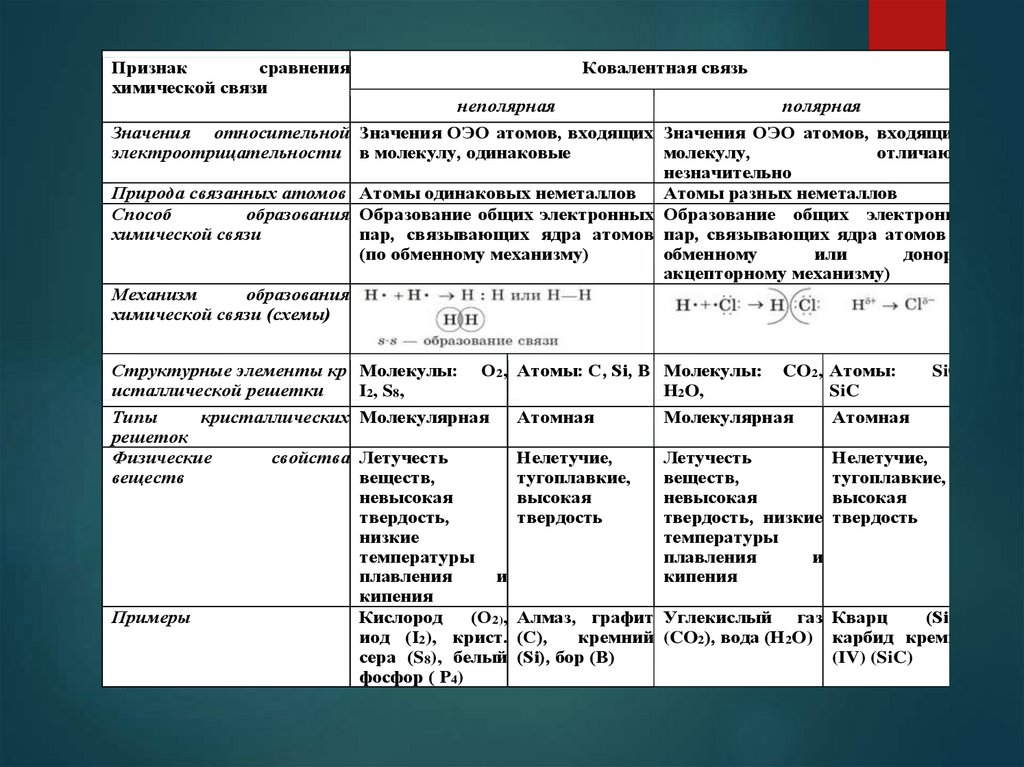
сравненияПризнак
химической связи
Ковалентная связь
неполярная
полярная
Значения относительной Значения ОЭО атомов, входящих Значения ОЭО атомов, входящих в
отличаются
молекулу,
электроотрицательности в молекулу, одинаковые
незначительно
Атомы разных неметаллов
Природа связанных атомов Атомы одинаковых неметаллов
образования Образование общих электронных Образование общих электронных
Способ
пар, связывающих ядра атомов пар, связывающих ядра атомов (по
химической связи
донорноили
обменному
(по обменному механизму)
акцепторному механизму)
образования
Механизм
химической связи (схемы)
Структурные элементы кр Молекулы:
I2, S8,
исталлической решетки
O2, Атомы: C, Si, B Молекулы:
H2O,
CO2, Атомы:
SiC
SiO2,
Атомная
Молекулярная
Атомная
кристаллических Молекулярная
Типы
решеток
Нелетучие,
Летучесть
Нелетучие,
свойства Летучесть
Физические
тугоплавкие,
веществ,
тугоплавкие,
веществ,
веществ
высокая
невысокая
высокая
невысокая
твердость, низкие твердость
твердость
твердость,
температуры
низкие
и
плавления
температуры
кипения
и
плавления
кипения
(SiO2),
(O2), Алмаз, графит Углекислый газ Кварц
Кислород
Примеры
кремний (CO2), вода (H2O) карбид кремния
иод (I2), крист. (C),
(IV) (SiC)
сера (S8), белый (Si), бор (B)
фосфор ( P4)
15.
Домашнее заданиеРаздел 3.2. Контрольные вопросы и задания
№ 1-7 стр. 39.











 Химия
Химия








