Похожие презентации:
Элементы равновесной электрохимии, ионоселективные электроды
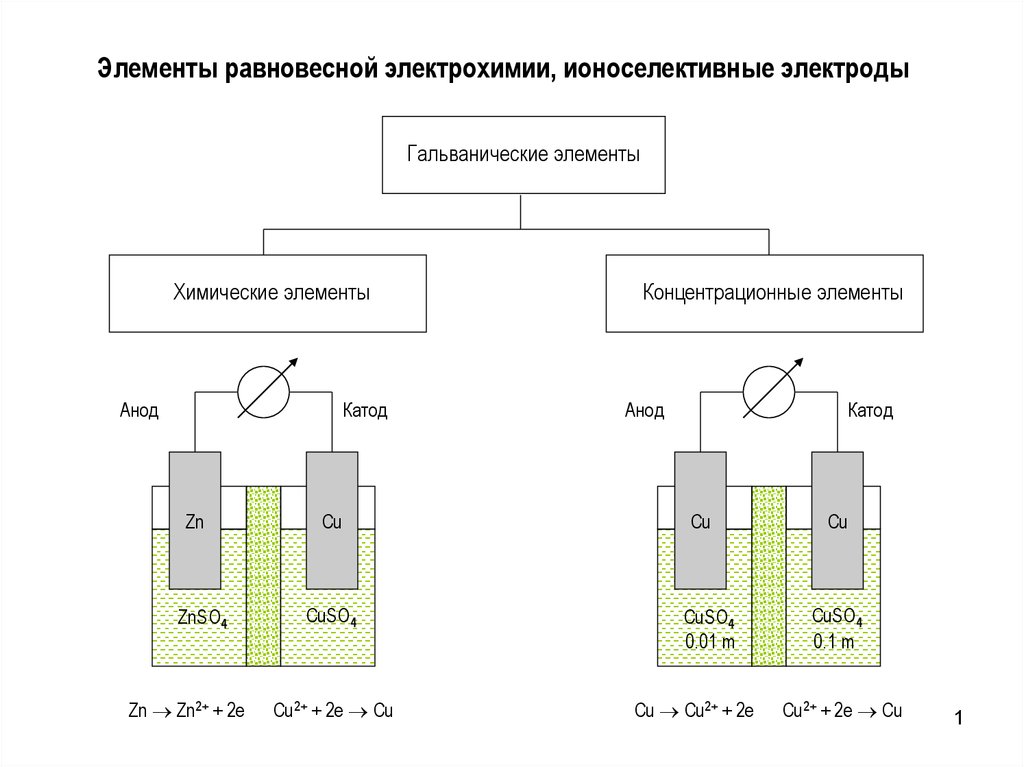
1. Элементы равновесной электрохимии, ионоселективные электроды
Гальванические элементыХимические элементы
Анод
Катод
Zn
ZnSO4
Zn Zn2+ + 2e
Cu
CuSO4
Cu2+ + 2e Cu
Концентрационные элементы
Анод
Катод
Cu
CuSO4
0.01 m
Cu Cu2+ + 2e
Cu
CuSO4
0.1 m
Cu2+ + 2e Cu
1
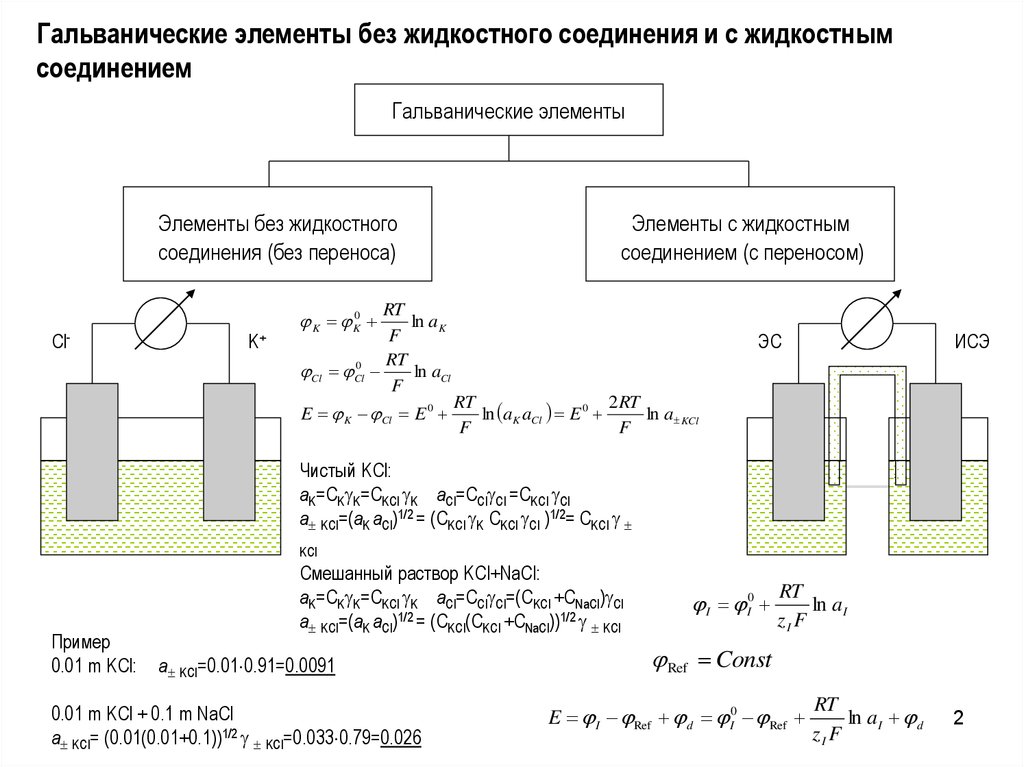
2. Гальванические элементы без жидкостного соединения и с жидкостным соединением
Гальванические элементыЭлементы без жидкостного
соединения (без переноса)
Cl-
K+
RT
ln aK
F
RT
Cl0
ln aCl
F
Элементы с жидкостным
соединением (с переносом)
K K0
Cl
E K Cl E 0
ЭС
ИСЭ
RT
2 RT
ln aK aCl E 0
ln a KCl
F
F
Чистый KCl:
aK=CK K=CKCl K aCl=CCl Cl =CKCl Cl
a KCl=(aK aCl)1/2 = (CKCl K CKCl Cl )1/2= CKCl
KCl
Пример
0.01 m KCl:
Смешанный раствор KCl+NaCl:
aK=CK K=CKCl K aCl=CCl Cl=(CKCl +CNaCl) Cl
a KCl=(aK aCl)1/2 = (CKCl(CKCl +CNaCl))1/2 KCl
a KCl=0.01 0.91=0.0091
0.01 m KCl + 0.1 m NaCl
a KCl= (0.01(0.01+0.1))1/2 KCl=0.033 0.79=0.026
I I0
RT
ln aI
zI F
Ref Const
E I Ref d I0 Ref
RT
ln aI d
zI F
2
3. Э.д.с. элемента с жидкостным соединением
Cl- ИСЭK+ ИСЭ
r
RT
tK
l
tCl
RT
Cl
ln aCl d
d
ln
a
d
ln
a
K
Cl
zCl F
F l z K
zCl
RT
K
ln aKr
zK F
0
Cl
0
K
r
tCl 1 t K
r
E K Cl d K0 Cl0
left
right
r
r
RT
RT
RT
RT
RT aClr
d
t K d ln aK
d ln aCl
t K d ln aCl
t K d ln aK aCl
ln l
F l
F l
F l
F l
F
aCl
r
RT
RT
RT
RT aClr
ln aKr
ln aCll
t
d
ln
a
a
ln l
K
K Cl
F
F
F l
F
aCl
r
RT
RT
E
ln aKr aClr
t K d ln aK aCl
F
F l
0
K
0
Cl
Э.д.с. элемента с жидкостным соединением может быть выражена через
термодинамически-определенные параметры
RT
Уравнение Гендерсона: d
F
z U C
z U C
i
2
i
i
i
r
i
r
i
Cil
zi2U iCir
ln
Cil
zi2UiCil
Каким электролитом заполняют электролитические ключи?
KCl, LiCCl3COO, NH4NO3 Концентрация электролита: 1 моль/л и выше
Диффузионный слой
3
4.
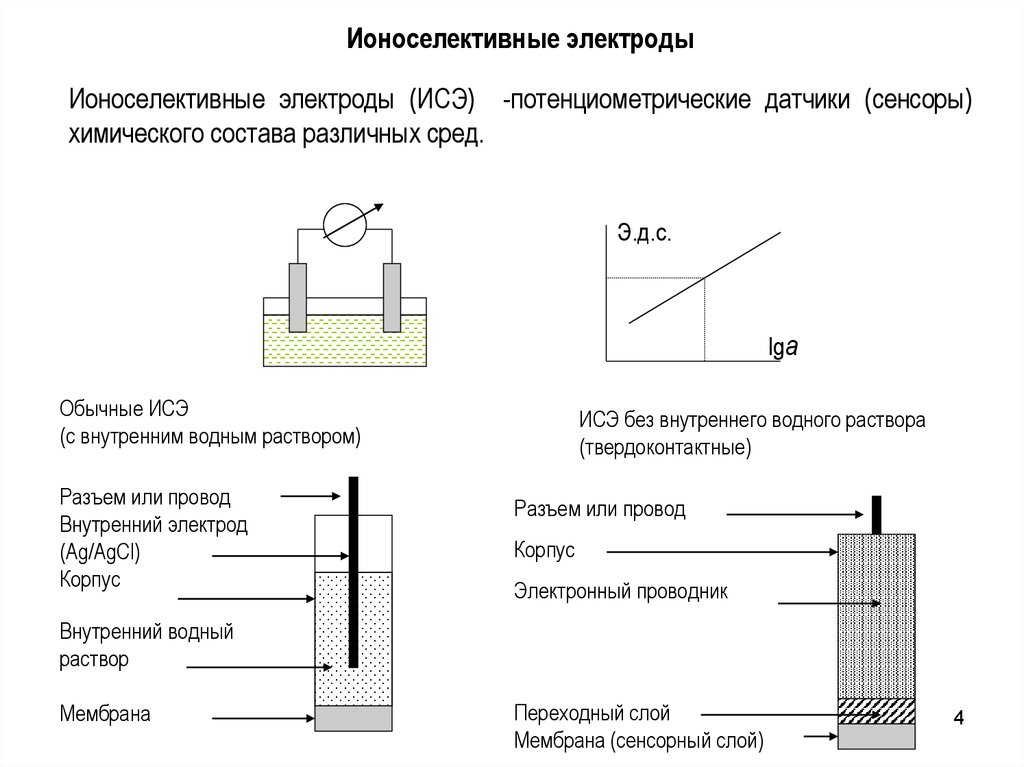
Ионоселективные электродыИоноселективные электроды (ИСЭ) -потенциометрические датчики (сенсоры)
химического состава различных сред.
Э.д.с.
lga
Обычные ИСЭ
(с внутренним водным раствором)
Разъем или провод
Внутренний электрод
(Ag/AgCl)
Корпус
ИСЭ без внутреннего водного раствора
(твердоконтактные)
Разъем или провод
Корпус
Электронный проводник
Внутренний водный
раствор
Мембрана
Переходный слой
Мембрана (сенсорный слой)
4
5. Принципы измерений с потенциометрическими сенсорами - ИСЭ и ионоселективными полевыми транзисторами (ИСПТ)
Измерительныйприбор
ИСЭ
Компенсационная
схема
Электрод
сравнения
Современная схема на
полевых транзисторах
Принцип действия
полевого транзистора
A
от ИСЭ
от ЭС
n
+
n
Ток
p
Э.д.с.
A
5
6. Важнейшие практические задачи, решение которых основано на применении ИСЭ
ЗадачаОсновные контролируемые ионы и вещества
Клинический анализ
pH, K+, Na+, Ca2+, Li+, Cl , HCO3
Агрохимия, почвоведение
pH, NO3 , K+, NH4+, Ca2+, Cl , Na+
Контроль технологических процессов
pH, Cu2+, Ag, Au, NO3 , K+, NH4+, UO22+
Экологический мониторинг
pH, Pb2+, Hg2+, Cu2+, NO3
Пищевая промышленность
pH, Ca2+, CH3COO
Определение газов в воздухе
NH3, NO2, “кислые” газы
Определение ферментов, субстратов и
ингибиторов
Холинэстераза, холин, пестициды
6
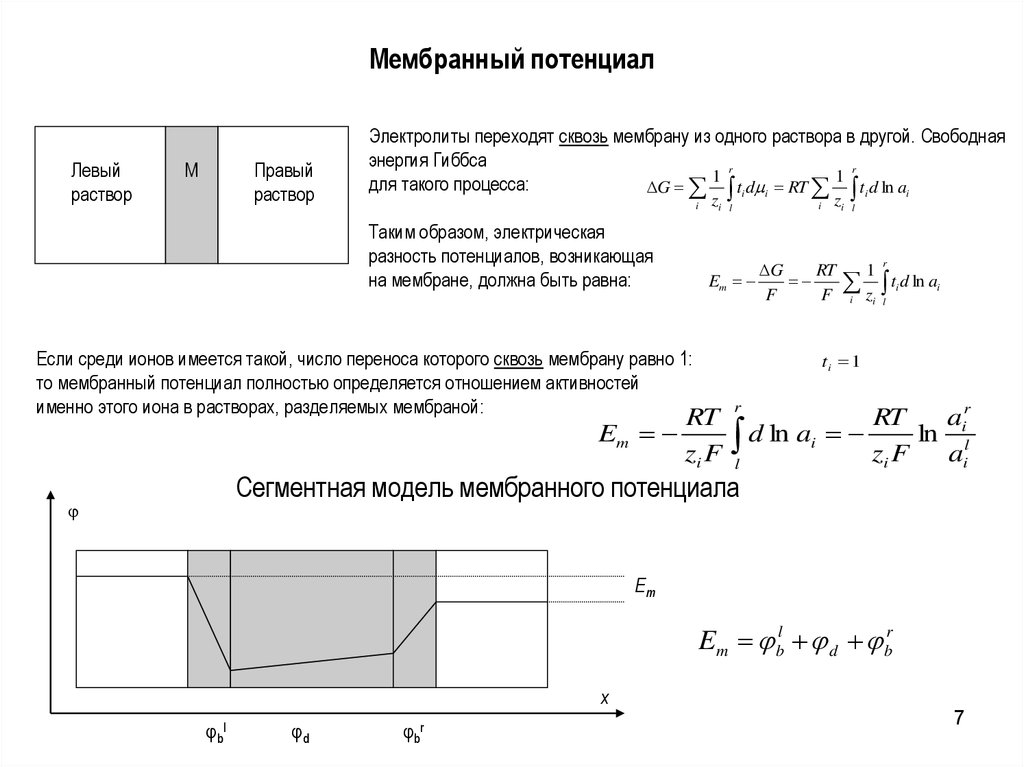
7. Мембранный потенциал
Левыйраствор
М
Правый
раствор
Электролиты переходят сквозь мембрану из одного раствора в другой. Свободная
энергия Гиббса
r
r
1
1
для такого процесса:
G ti d i RT ti d ln ai
i
Таким образом, электрическая
разность потенциалов, возникающая
на мембране, должна быть равна:
Если среди ионов имеется такой, число переноса которого сквозь мембрану равно 1:
то мембранный потенциал полностью определяется отношением активностей
именно этого иона в растворах, разделяемых мембраной:
zi
i
l
Em
zi
G
RT
F
F
l
r
1
i z ti d ln ai
i l
ti 1
RT
Em
zi F
r
air
RT
l d ln ai zi F ln ail
Сегментная модель мембранного потенциала
Em
Em bl d br
x
φbl
φd
φbr
7
8. Межфазный потенциал (потенциал Доннана)
+-
-
-
+
-
+
-
-
-
+
+
+
+
+
+
-
-
+
+
-
-
-
+
-
-
При условии межфазного электрохимического
равновесия электрохимические потенциалы
любого из ионов одинаковы в обеих фазах.
i
( org )
i
( aq )
i0
i0
( org )
( aq )
RT ln ai
RT ln ai
( org )
( aq )
b
i0
zi F
0 ( org )
i
( aq )
RT ln a
( org )
ai
+
-
+
+
-
+
zi F ( org )
zi F ( aq)
( org )
i0
( aq )
RT ln a
i
( org )
ln ai
( aq )
( org )
RT ai
b
ln
zi F ai ( aq)
0
i
zi F
+
+
++
-+ - +
++
-+
+ +
-+ - -
zi F ( org ) zi F ( aq) i0
( aq )
+
При контакте фаз, если одна из них имеет
большее сродство, например, к катионам,
возникает двойной слой и “скачок”
потенциала
Водная и мембранная (органическая) фазы
исходно электронейтральны
( org )
-
+
( aq )
8
9. Внутримембранный диффузионный потенциал
++
+
+
-
+
+
+
-
+
-
-
-
+
-
-
-
+
+
-
+
-
+
Идеальность мембранной фазы:
-
+
+
+
+
-
Ионы I+, J+, R
0
Электрохимический потенциал частиц сорта i i i RT ln ai zi F
-
ai Ci
U I RT
F
+
d
Поток частиц сорта i
i zi F U iCi d RT ln ai zi F
J i U i Ci
dx
dx
(ур-е Нернста-Планка)
Потенциометрические условия (нулевой ток):
i
dC J
dC I
d
d
dC R
d
U I CI F
U J RT
U J CJ F
U R RT
U RCR F
0
dx
dx
dx
dx
dx
dx
d
U I CI U J C J U RCR RT U I dCI U J dC J U R dCR
dx
dx
dx
dx
d
RT d U i Ci d U J C J d U R C R
U I CI U J C J U RCR
dx
F
R
Rtot
Ассоциация
CI C J CR
CR CIR CJR CR
tot
I F zi J i 0
R
IR
J+
I+
Полная диссоциация
CI CJ CR CR
I+
J+
tot
JR
d
RT d U i Ci d U J C J
RT
d ln U I CI U J C J
dx
F U I C I U J C J
F
RT U I CI U J CJ
d
ln
F
U I CI U J CJ l
r
9
10. Полный мембранный потенциал
bmem
aq
i0
zI F
0 , mem
i
, aq
RT ln a
zI F
mem
aI
aq
Ионный коэффициент распределения:
Реакция ионного обмена:
b
0
I
mem
RT aI
ln aq
zI F
aI
d
0,mem I0,aq
k I exp I
RT
I+,mem + J+, aq I+,aq + J+,mem
CJ CI
aJ k J
aI k I
RT U I CI U J CJ
ln
z I F U I CI U J CJ l
r
Потенциалопределяющий ион
задает межфазный потенциал,
остальные под него
подстраиваются
r
aJ k J
r
C
U
U
I I
J
r
l
r
aI k I
RT C I
RT
aI
RT
l
r
mem b b d
ln
ln
ln
Мембранный потенциал
l
z I F aI l z I F CI r z I F
a k
l
C I U I U J J l J
aI k I
r
aJ k J
r U J kJ r
r
aI U I U J r
aI
a J
aI k I
U I kI
RT
RT
mem
ln
ln
l
zI F
zI F l U J k J l
a k
l
aI
a J
aI U I U J J l J
U I kI
aI k I
Уравнение Никольского
Коэффициент селективности
mem
a K IJ aJ
RT
RT
0
l
l
ln I l
mem
ln aI K IJ aJ
l
zI F
zI F
aI K IJ aJ
K IJ
U J kJ
U I kI
r
r
10
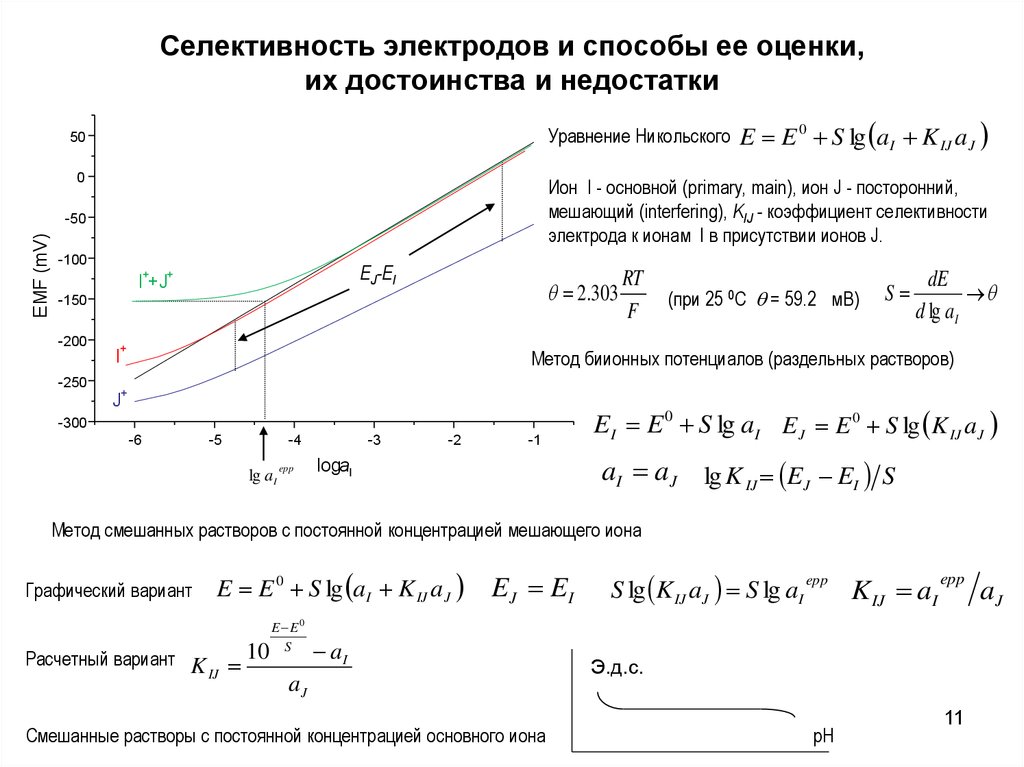
11. Селективность электродов и способы ее оценки, их достоинства и недостатки
Уравнение Никольского50
0
Ион I - основной (primary, main), ион J - посторонний,
мешающий (interfering), KIJ - коэффициент селективности
электрода к ионам I в присутствии ионов J.
EMF (mV)
-50
-100
+
EJ-EI
+
I +J
2.303
-150
-200
+
RT
F
(при 25 0С = 59.2 мВ)
S
dE
d lg aI
Метод биионных потенциалов (раздельных растворов)
I
-250
E E 0 S lg aI K IJ a J
+
J
-300
-6
-5
-4
lg a I
epp
-3
-2
-1
EI E 0 S lg aI E J E 0 S lg K IJ a J
aI aJ lg K IJ EJ EI S
logaI
Метод смешанных растворов с постоянной концентрацией мешающего иона
Графический вариант
E E 0 S lg aI K IJ a J
Расчетный вариант K 10
IJ
E E0
S
E J EI
aI
aJ
Смешанные растворы с постоянной концентрацией основного иона
S lg K IJ aJ S lg aI
epp
K IJ aI
epp
Э.д.с.
pH
11
aJ
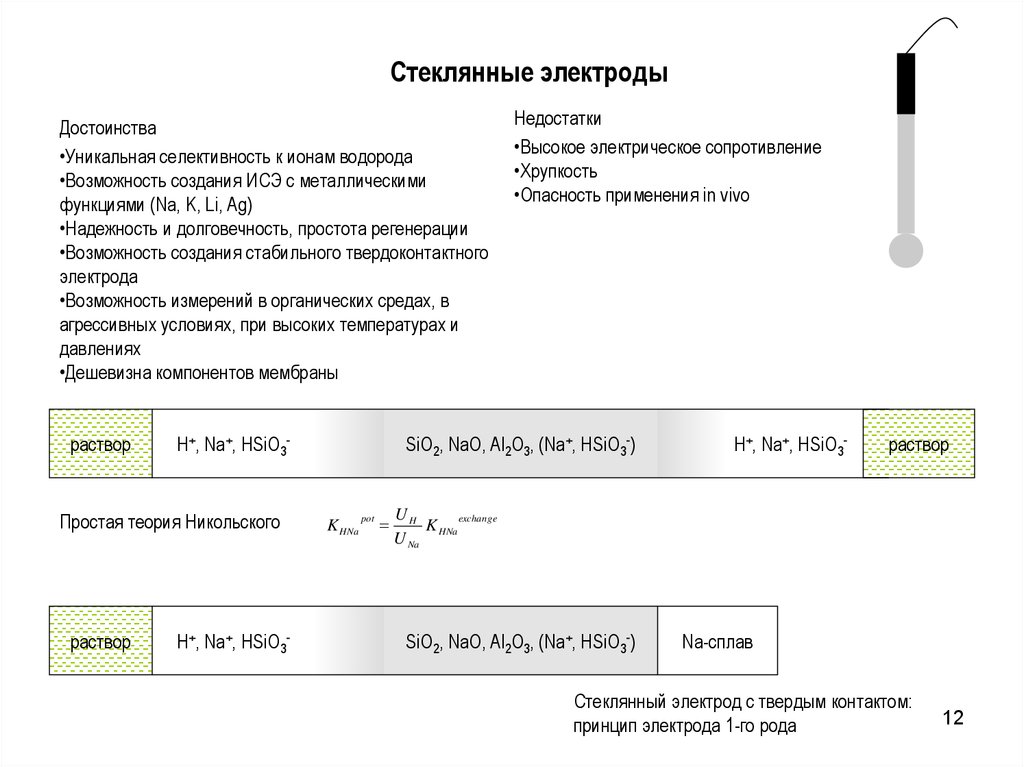
12. Стеклянные электроды
Достоинства•Уникальная селективность к ионам водорода
•Возможность создания ИСЭ с металлическими
функциями (Na, K, Li, Ag)
•Надежность и долговечность, простота регенерации
•Возможность создания стабильного твердоконтактного
электрода
•Возможность измерений в органических средах, в
агрессивных условиях, при высоких температурах и
давлениях
•Дешевизна компонентов мембраны
раствор
H+, Na+, HSiO3-
Простая теория Никольского
раствор
H+, Na+, HSiO3-
Недостатки
•Высокое электрическое сопротивление
•Хрупкость
•Опасность применения in vivo
SiO2, NaO, Al2O3, (Na+, HSiO3-)
K HNa
pot
H+, Na+, HSiO3-
раствор
UH
exchange
K HNa
U Na
SiO2, NaO, Al2O3, (Na+, HSiO3-)
Na-сплав
Стеклянный электрод с твердым контактом:
принцип электрода 1-го рода
12
13. Электроды с поли- и монокристаллическими мембранами
ДостоинстваНедостатки
•Возможность создания ИСЭ с анионными и катионными
•Ограниченный набор ионов, к которым можно
функциями
создать хорошие ИСЭ: галогениды, металлы
•Надежность и долговечность, простота регенерации
сероводородной группы
•Возможность создания стабильного твердоконтактного
электрода
•Возможность измерений в органических средах, в
агрессивных условиях
Анионселективные (X = S2 , Cl , Br , J , SCN , CN )
•Низкое электрическое сопротивление
•Дешевизна компонентов мембраны
раствор
AgX, Ag2S
раствор
•Возможность создания халькогенидных стекол
(допирование As)
Катионселективные (Me = Ag+, Cu2+, Cd2+, Pb2+, ...)
Селективность определяется отношением
произведений
SPAgY
pot
K XY
растворимости
SP
раствор
MeS, Ag2S,
раствор
AgX
раствор
AgX, Ag2S, e
Ag
Кристаллический ИСЭ с твердым контактом:
принцип действия электрода 2-го рода
F
LaF3, EuF2
F
F - ИСЭ с мембраной из монокристалла LaF3
13
14. ИСЭ с жидкими и полимерными мембранами (на основе ионофоров)
Достоинства•Возможность создания самых разнообразных ИСЭ, в
том числе - для потенциометрического определения
нейтральных компонентов (НПАВ, фенолов и др.)
раствор
Полимер (ПВХ) - 33%
пластификатор - 66%
ионофор(ы) - 1%
раствор
Недостатки
•Сравнительно низкая долговечность ( 1 год)
•Высокое электрическое сопротивление
•Возможность измерений только в водных растворах
•Трудность создания стабильного твердоконтактного
варианта
•Дороговизна компонентов мембран
Заряженный ионофор (ионообменник) R J+ aq + IRmem I+ aq + JRmem
Нейтральный ионофор L J+ aq + IL+rmem I+ aq + JL+mem
раствор
Полимер (ПВХ) - 33%
пластификатор - 66%
ионофор(ы) - 1%
Слой со смешанной
электроно-ионной
проводимостью
Металл
(e )
K IJ
K IJ
U J kJ
U I kI
K JR K IR
U J kJ
K JL K IL
U I kI
Твердоконтактный электрод,
разные принципы действия.
В целом, проблема
твердоконтактного ИСЭ с
полимерной мембраной не
решена
14
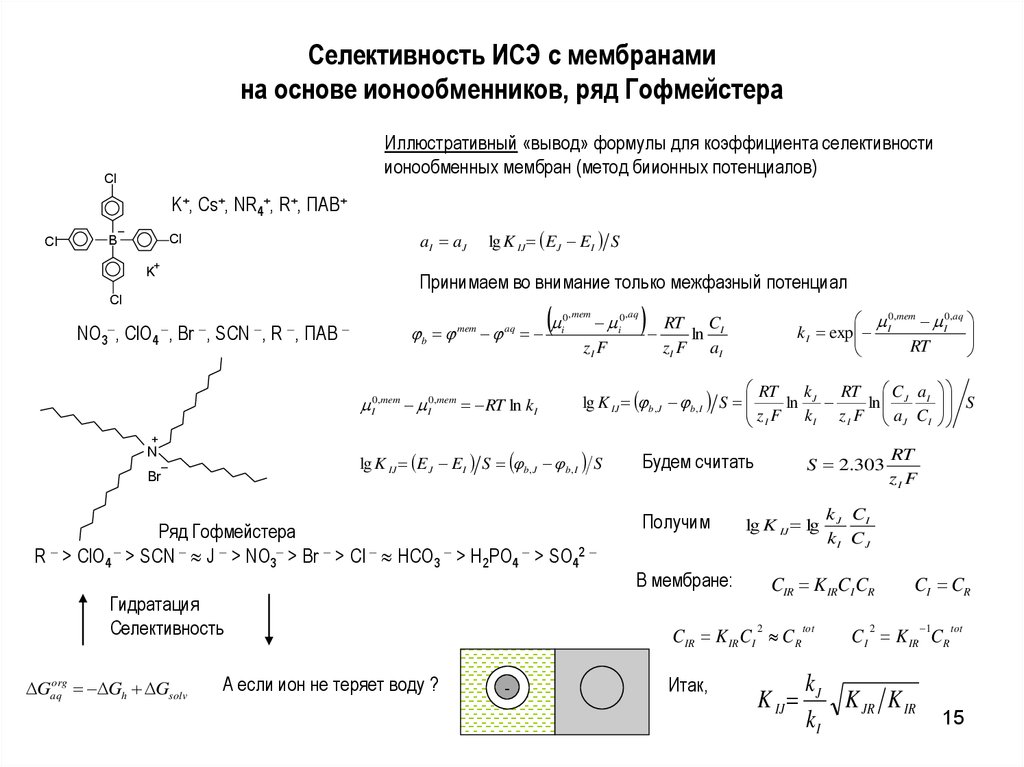
15. Селективность ИСЭ с мембранами на основе ионообменников, ряд Гофмейстера
Иллюстративный «вывод» формулы для коэффициента селективностиионообменных мембран (метод биионных потенциалов)
Cl
K+, Cs+, NR4+, R+, ПАВ+
_
Cl
aI a J
Cl
B
+
K
lg K IJ EJ EI S
Принимаем во внимание только межфазный потенциал
Cl
,
,
NO3 ClO4 Br
,
SCN
,
R
,
ПАВ
b
mem
aq
I0,mem I0,mem RT ln k I
+
N
i0
zI F
0 , mem
i
Br
Ряд Гофмейстера
R > ClO4 > SCN J > NO3 > Br > Cl HCO3 > H2PO4 > SO42
Гидратация
Селективность
org
Gaq
Gh Gsolv
А если ион не теряет воду ?
RT ln C
zI F
0,mem I0,aq
k I exp I
RT
I
aI
RT
k
RT C J aI
S
lg K IJ b , J b , I S
ln J
ln
z
F
k
z
F
a
C
I
I
I
J
I
lg K IJ E J EI S b , J b , I S
_
, aq
Будем считать
Получим
S 2.303
lg K IJ lg
В мембране:
2
-
Итак,
k J CI
kI CJ
CIR K IRCI CR
CIR K IR CI CR
K IJ
tot
RT
zI F
CI CR
1
CI K IR CR
2
kJ
K JR K IR
kI
tot
15
16.
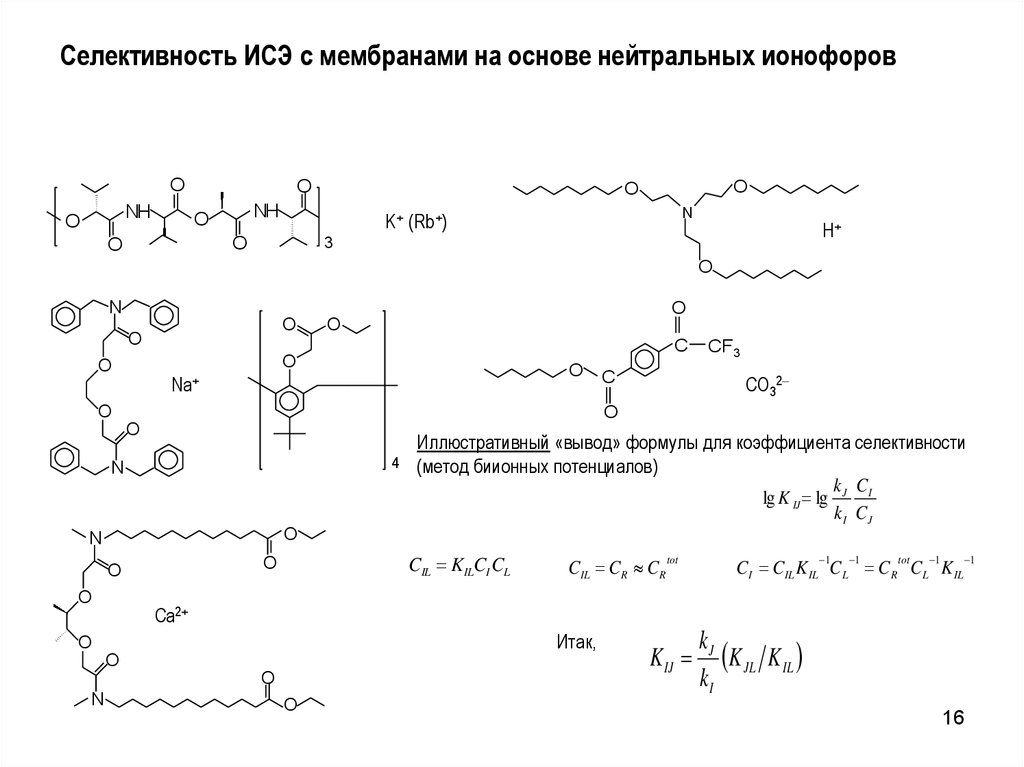
Селективность ИСЭ с мембранами на основе нейтральных ионофоровO
NH
O
O
NH
O
N
K+ (Rb+)
O
O
O
O
H+
3
O
N
O
O
O
O
C
O
O
O
Na+
O
CO32
O
O
4
N
Иллюстративный «вывод» формулы для коэффициента селективности
(метод биионных потенциалов)
k C
lg K IJ lg J I
kI CJ
O
N
O
CIL K ILCI CL
O
O
CIL CR CR
tot
1
1
1
CI CIL K IL CL CR CL K IL
tot
Ca2+
Итак,
O
O
O
N
C
CF 3
O
K IJ
kJ
K JL K IL
kI
16
1
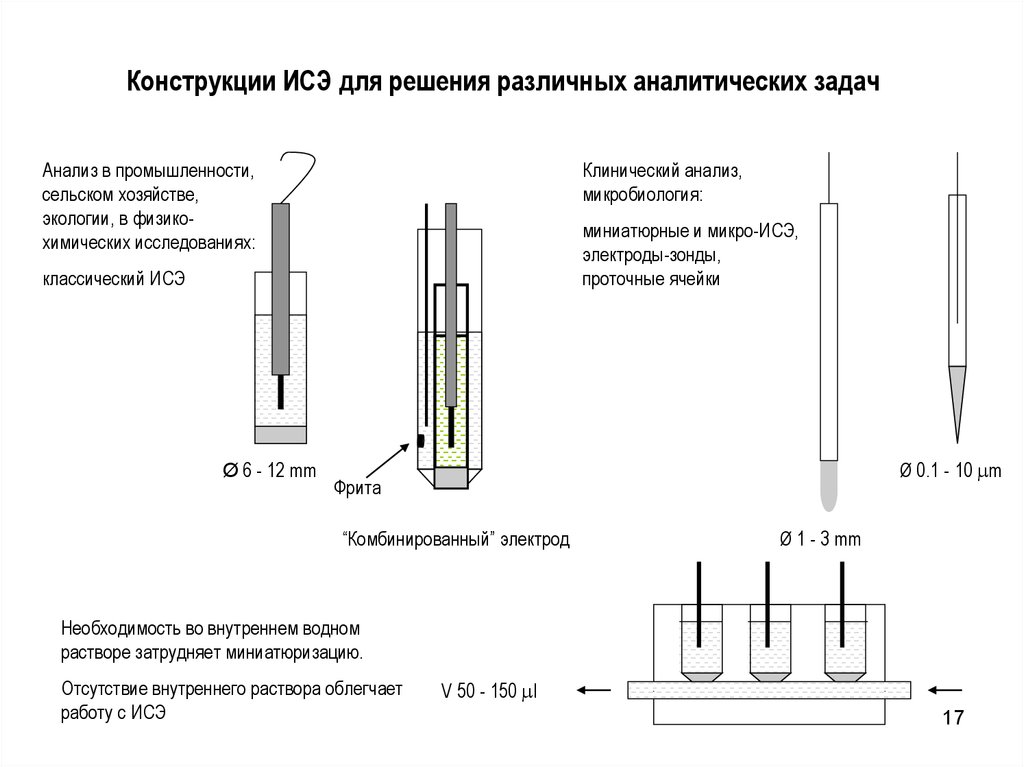
17. Конструкции ИСЭ для решения различных аналитических задач
Анализ в промышленности,сельском хозяйстве,
экологии, в физикохимических исследованиях:
Клинический анализ,
микробиология:
миниатюрные и микро-ИСЭ,
электроды-зонды,
проточные ячейки
классический ИСЭ
Ø 6 - 12 mm
Ø 0.1 - 10 m
Фрита
“Комбинированный” электрод
Ø 1 - 3 mm
Необходимость во внутреннем водном
растворе затрудняет миниатюризацию.
Отсутствие внутреннего раствора облегчает
работу с ИСЭ
V 50 - 150 l
17
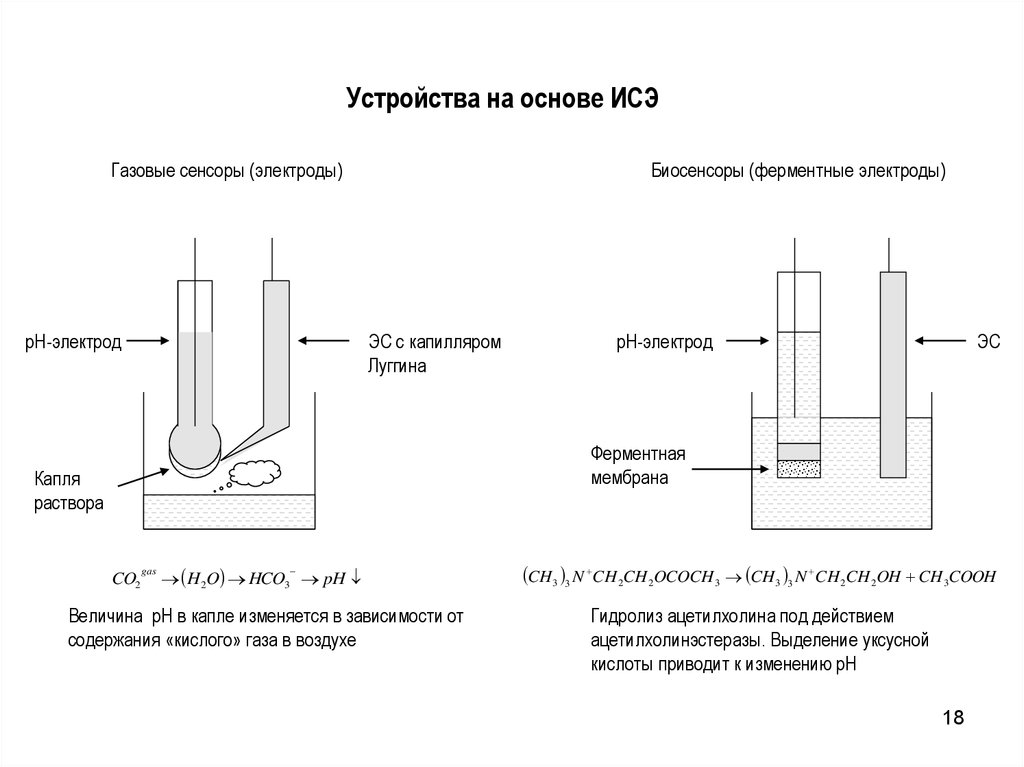
18. Устройства на основе ИСЭ
Газовые сенсоры (электроды)pH-электрод
Биосенсоры (ферментные электроды)
ЭС с капилляром
Луггина
pH-электрод
ЭС
Ферментная
мембрана
Капля
раствора
CO2
gas
H 2O HCO3 pH
Величина pH в капле изменяется в зависимости от
содержания «кислого» газа в воздухе
CH 3 3 N CH 2CH 2OCOCH 3 CH 3 3 N CH 2CH 2OH CH 3COOH
Гидролиз ацетилхолина под действием
ацетилхолинэстеразы. Выделение уксусной
кислоты приводит к изменению pH
18
19.
Элементы химической кинетикиХимическая реакция
1 A1 2 A2 ... l Al 1B1 2 B2 ... m Bm
Скорость химической реакции: количество молекул данного вида, реагирующих
в 1 единицу времени. Удобнее отнести скорость к 1 ед. объема, соответственно,
скорость v – число частиц или число молей вещества, реагирующих в 1 ед.
времени в 1 ед. объема.
Постулируется, что
v kCA1 CA2 ...CAl
n1
n2
nl,
ni – порядок реакции по i-му
веществу. Для одностадийных реакций ni = νi. Константа скорости k=v при
C1=C2= … Cl=1.
Реакция называется двусторонней если она, в принципе, может идти в обоих
направлениях. При равновесии скорости прямого и обратного процессов
равны, но вдали от равновесия эти скорости могут различаться на много
порядков. В этом смысле реакция может быть кинетически односторонней.
Чаще всего – если часть продуктов реакции уходит в другую фазу: выпадает
в осадок, испаряется, и т.п.
19
20.
Молекулярность и порядок реакцииМолекулярность реакции – число частиц, участвующих в элементарном химическом акте.
Мономолекулярные: изомеризация, диссоциация, радиоактивный распад, реакции,
провоцируемые внешними полями или излучениями.
Бимолекулярные: результат столкновения двух молекул, например – ассоциация.
Тримолекулярные: одновременное столкновение трех молекул (очень редко).
Порядок реакции по данному веществу – число, равное показателю степени, в которой данное
вещество входит в кинетическое уравнение
v kCA1 CA2 ...CAl
n1
n2
nl
Порядок реакции в целом – сумма порядков по каждому из исходных веществ:
l
Молекулярность – νi , порядок – ni.
l
i 1
i
Ai
l
v k Ci
i 1
m
j 1
j
Aj
n ni
i 1
Различаются из-за многостадийности большинства реальных
реакций. Экспериментально регистрируется лимитирующая стадия
реакции, которая и описывается кинетическим уравнением.
ni
20
21.
Некоторые элементарные химические реакцииЭлементарная реакция – проходит в одну стадию и скорость описывается уравнением с
целочисленными коэффициентами
Необратимая реакция 0-го порядка (т.е. скорость не зависит от
концентрации данного вещества)
dC
k
dt
x(t ) C0 C(t ) kt
Необратимая реакция 1-го порядка: скорость пропорциональна 1-й степени концентрации
вещества
A B
v( t) kCA(t )
V Const
d n A0 n B ( t )
k
n A0 nB ( t )
dt
V
V
n
dnB (t )
A0
nB (t )
dx(t )
dt
kdt ln n A0 nB ( t ) kt C
C ln n A0
ln
n A0
kt
n A0 n B (t )
C A (t )
n A0 nB (t )
V
k n A0 nB (t )
t 0 ... nB ( t ) 0
nB (t ) n A0 1 e kt
21
22.
Некоторые элементарные химические реакцииОбратимая реакция вида
k
B
A
k
Считаем, что в начальный момент имеется только исходное вещество A, а концентрация
вещества B равна нулю.
d
C A(t ) k C A( t ) k C B (t ) t 0 ... C A( 0 ) C A0 , C B ( 0 ) 0
dt
kC
d
C A(t ) k C A(t ) k C A0 C A(t ) k C A0 k k C A(t ) k k C A(t ) A 0
k k
dt
k
C
d
d
eq
eq
eq
C A ... C A( t ) 0 C A A 0 ,
C A(t ) k k C A(t ) C A
k k dt
dt
k C A0
k
k
C
A0
eq
eq
k k k C A0 k C A0 k C A0 k
C C
C
K eq B eq A0 eq A
k C A0
k C A0
k
CA
CA
22
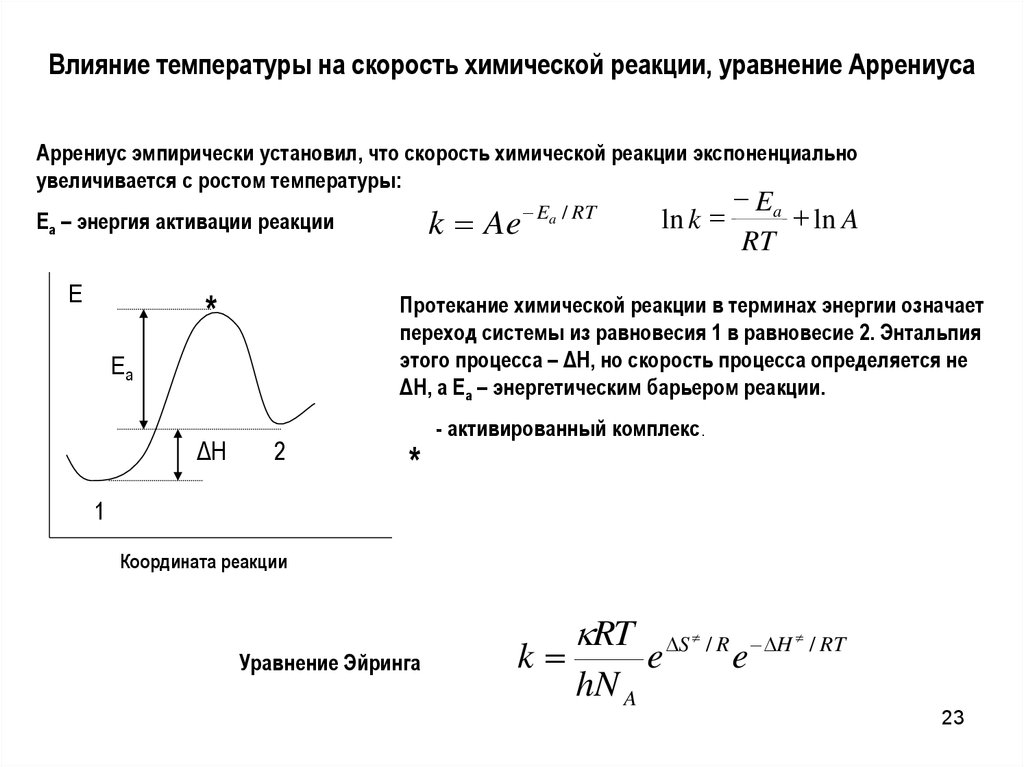
23.
Влияние температуры на скорость химической реакции, уравнение АррениусаАррениус эмпирически установил, что скорость химической реакции экспоненциально
увеличивается с ростом температуры:
k Ae
Ea – энергия активации реакции
Е
*
ln k
Ea
RT
ln A
Протекание химической реакции в терминах энергии означает
переход системы из равновесия 1 в равновесие 2. Энтальпия
этого процесса – ΔH, но скорость процесса определяется не
ΔH, а Ea – энергетическим барьером реакции.
Ea
ΔH
Ea / RT
2
*
- активированный комплекс.
1
Координата реакции
Уравнение Эйринга
k
RT
hN A
e
S / R H / RT
e
23
24.
Ферментативная кинетика, уравнение Михаэлиса-Ментенk1
S+E
Допущения:
1.
Система находится в стационарном
состоянии
2.
Концентрация энзимно-субстратного
комплекса всегда мала по сравнению с
общей концентрацией энзима
ES
k-1
ES
k2
P+E
1 k1C S C E k 1 k 2 C ES 0
2 CE
tot
C E C ES C E
tot
C ES
k1C S C E
k1C S k 1 k 2
tot
k1k 2 C S C E
dC P
v
dt
k1C S k 1 k 2
24













 Химия
Химия








