Похожие презентации:
Титриметрический анализ
1.
Кафедра общей и медицинской химииЛекция
"Титриметрический анализ.
Кривые титрования."
1
2.
Граф структурыАналитическая химия
Химические реакции
Титриметрический анализ
Реакции, лежащие в
Основе метода
Титрованные растворы
Титр,
титр приготовленный, Рабочие Исходные
титр установленный растворы вещества
Нейтрализации
Методы титриметрического
анализа
Оксидиметрии
Осаждения
Расчёты
Комплексонометрии
Способы титрования
Прямое
Обратное
Титрование
заместителя
3.
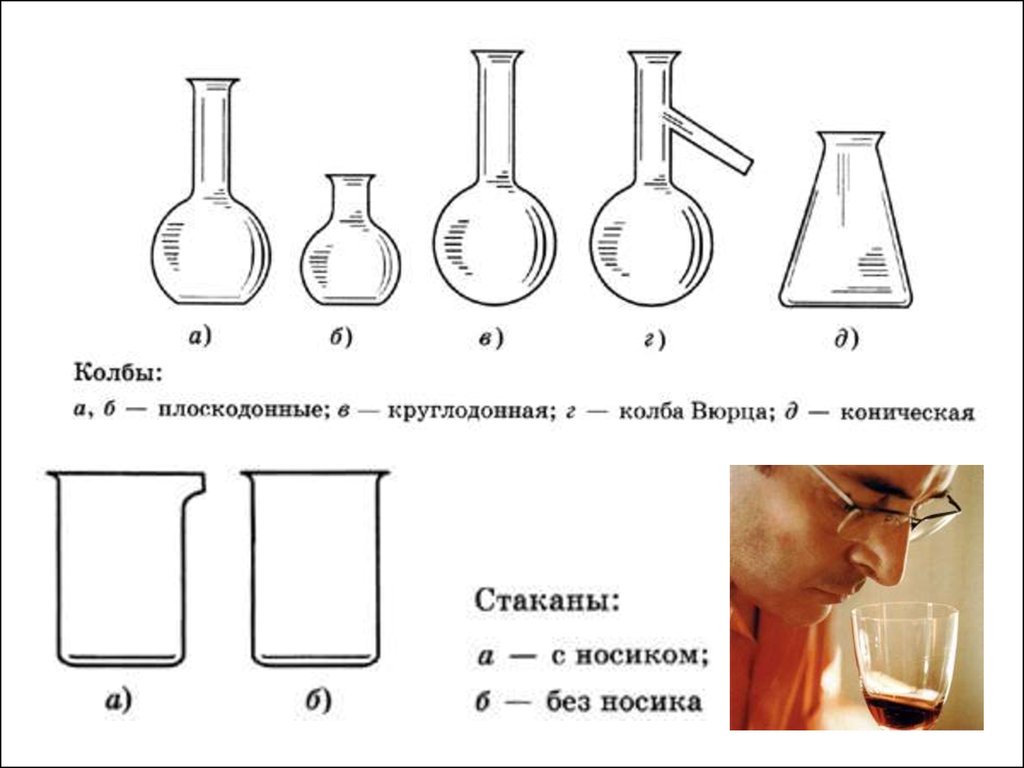
Лабораторное оборудование.4.
5.
6.
7.
8.
9.
Магнитные мешалки10.
Устройства перемешивающие11.
ВоронкиПромывные
склянки
12.
ЭксикаторыХлоркальциевые
трубки
13.
Мерныестаканы
Цилиндры
Мерные
колбы
Мерная
посуда
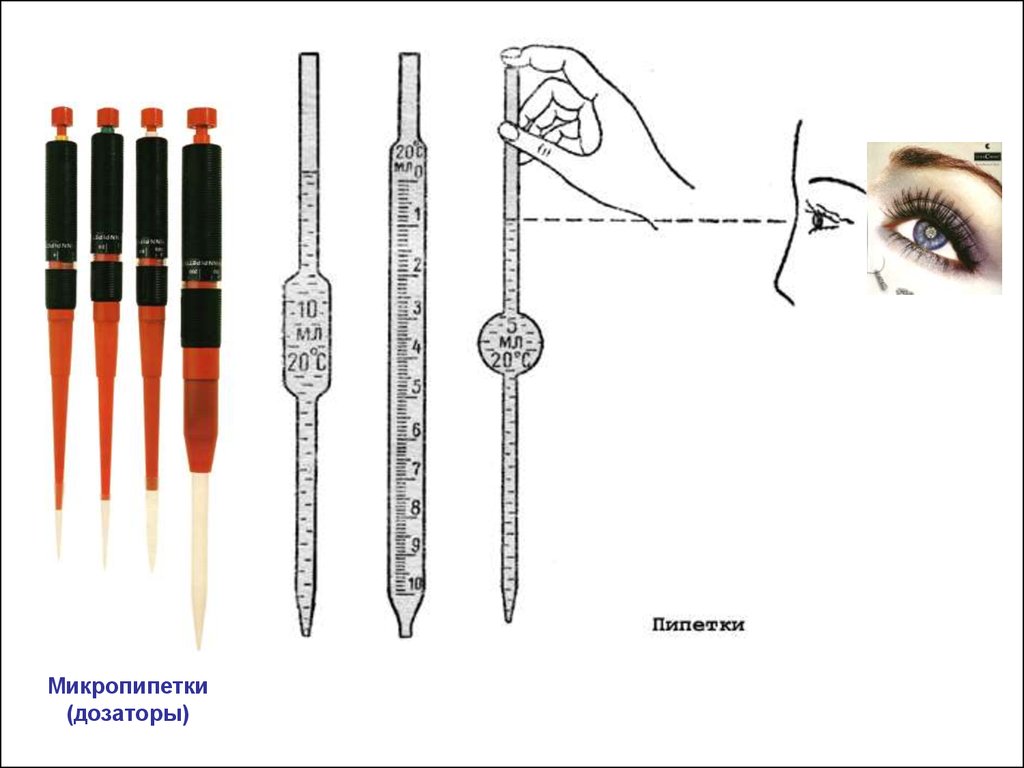
Пипетки
Бюретки
14.
а , б - прозрачные растворыв - цветные растворы
15.
Микропипетки(дозаторы)
16.
Титриметрический анализ.T = m/V ( г/мл )
V1 · N1 V2 · N 2
ОСНОВНЫЕ МЕТОДЫ АНАЛИЗА:
1. Нейтрализации
Н+ + ОН- = Н2О
2. Окислительно-восстановительные
I2 + 2ē = 2IMnO4- + 8H+ + 5ē = Mn2+ + 4Н2О
3. Комплексообразования
Ag+ + 2CN- → [Ag(CN)2]4. Осаждения
Ag+ + Cl- = AgCl↓
17.
Требования к исходным веществам:1. Состав вещества должен соответствовать формуле.
2. Вещество не должно быть гигроскопичным и хорошо
растворимым в воде.
3. Должны быть устойчивы при хранении на воздухе
4. Должны быть без примесей, хорошо очищаться
5. Должно иметь большую молярную массу.
Tпригот. = m / V
18.
Требования к реакциям1. Реакция должна протекать в соответствии со стехиометрическим
уравнением реакции и должна быть практически необратима.
2. Результат реакции должен отображать количество
анализируемого вещества. Константа равновесия реакции
должна быть достаточно велика.
3. Реакция должна протекать без побочных реакций, иначе нельзя
применить закон эквивалентов.
4. Реакция должна протекать с достаточно большой скоростью, т.е.
за 1-3 секунды. Это главное достоинство титриметрического
анализа.
5. Должен существовать способ фиксирования точки
эквивалентности. Окончание реакции должно определяться
достаточно легко и просто.
19.
Если реакция не удовлетворяет хотя бы одному из этих требований,она не может быть использована в титриметрическом анализе!
20.
Титрование- процесс постепенного
добавления раствора с известной
концентрацией к определенному
объему исследуемого раствора
до момента окончания реакции, что
фиксируется по изменению
окраски индикатора.
21.
Кислотно-основное титрованиеБюретка наполнена раствором сильной кислоты (или сильного
основания) известной концентрации. Из бюретки в колбу
медленно добавляют реагент до тех пор, пока в конечной точке
титрования одна капля не заставит индикатор устойчиво
изменить окраску. По уровню жидкости в бюретке,
соответствующему конечной точке титрования, определяют
количество кислоты (или основания), потребовавшееся для
нейтрализации анализируемого раствора.
Vк · N к Vщ · N щ
22.
Метод нейтрализацииМетод
Определяемое
вещество
— щелочи;
— соли, дающие
Ацидиметрия
щелочную
реакцию среды
— кислоты;
— соли, дающие
Алкалиметрия
кислую реакцию
среды
Рабочий
раствор
Исходное
вещество
HCl,
H2SO4
бура
Na2B4O7·10H2O
сода Na2CO3
KOH,
NaOH
щавелевая кислота
H2C2O4·2H2O
янтарная кислота
H 2 C 4 H 4 O4
23.
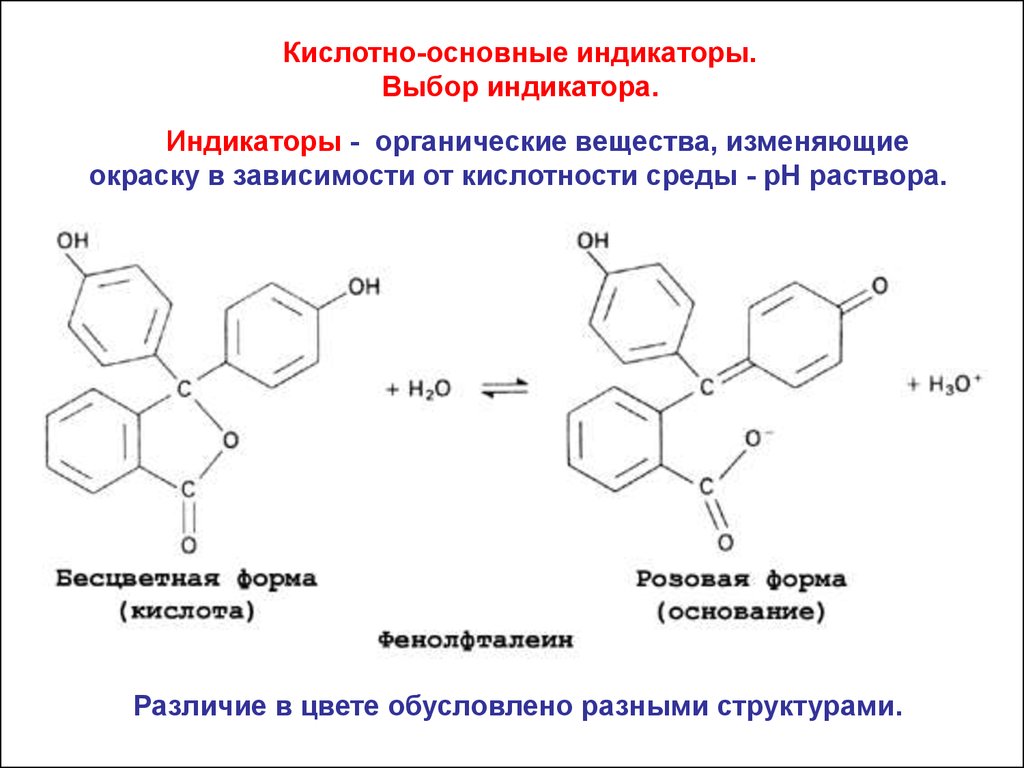
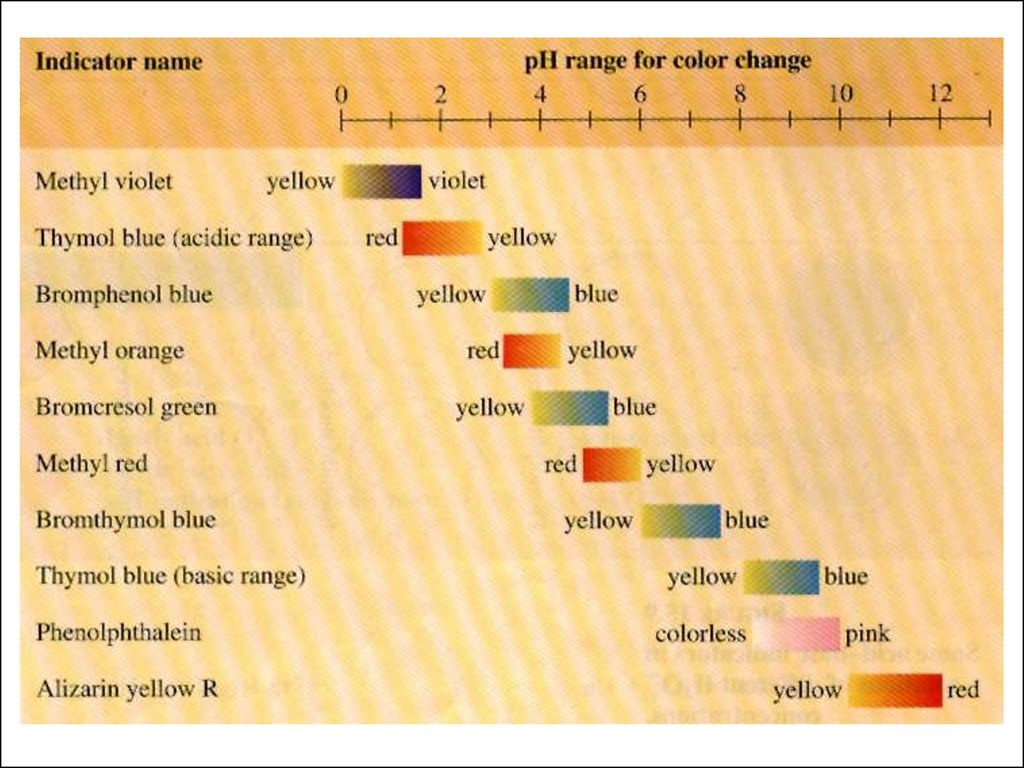
Кислотно-основные индикаторы.Выбор индикатора.
Индикаторы - органические вещества, изменяющие
окраску в зависимости от кислотности среды - рН раствора.
Различие в цвете обусловлено разными структурами.
24.
25.
Зона перемены окраски индикатора(зависит от соотношения концентраций молекулярной и ионизированной
форм)
HInd ↔ H+ + Ind-
[H+][Ind- ]
Кд =
[HInd]
[HInd]
pH = pKинд. - lg
[Ind ]
1. Метилоранж (3,1 – 4,4), рК = 4,0
26.
2. Лакмус (5,0 – 8,0), рК = 73. Фенолфталеин (8,1 – 10,0), рК = 9
Зона перемены окраски индикатора должна
совпасть со скачком титрования!!
27.
Изменение цвета индикаторов28.
КРИВЫЕ ТИТРОВАНИЯ1.Титрование сильной кислоты щелочью
НСl + NaOH = NaCl + Н2О
V 0.05 мл
рНт.э. = 7
29.
2. Титрование слабой кислоты щелочьюCH3COOH + NaOH = CH3COONa + Н2О
рН т.э.
1
1
7 рК к lg Cc
2
2
30.
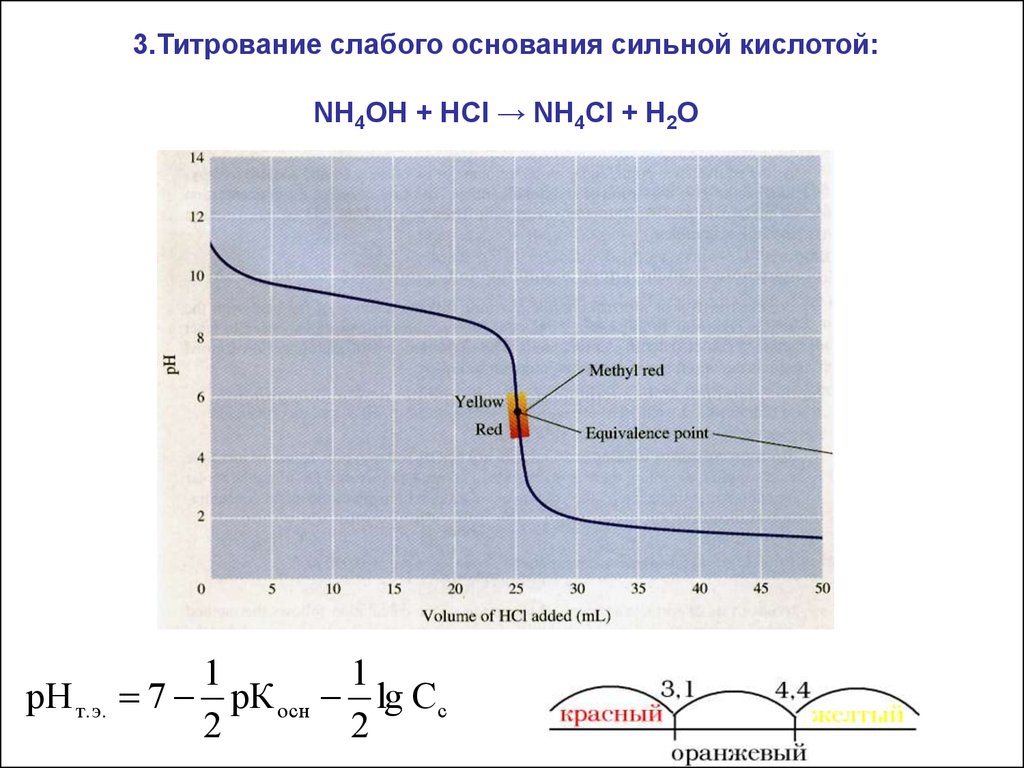
3.Титрование слабого основания сильной кислотой:NH4OH + HCl → NH4Cl + H2O
рН т.э.
1
1
7 рК осн lg Cc
2
2
31.
Необходимо помнить, что принципы работы индикаторов вдругих методах титрования – иные, поскольку рН растворов
остается неизменным!!!
В иодометрии
индикатор
крахмал дает
синюю окраску с I2.
В перманганатометрии
индикатор не требуется,
так как раствор
Mn2+ бесцветен, а MnO4имеет розово-фиолетовую
окраску.
32.
Способ титрования в методе нейтрализациипрямое титрованиеHCI + NaOH = NaСI + H2O
К 100мл желудочного сока добавляем 0.1н
раствор NaOH (индикатор –фенолфталеин). В точке
эквивалентности появится розовая окраска.
Рассчитать рН желудочного сока, если на титрование
израсходовано 44мл раствора щелочи.
VHCI · N HCI VNaOH · N NaOH
N HCI
VNaOH 0,1 44 0.1
0.044 моль - экв/л
100
100
рН - Ig 0.044 1.36
33.
Клинический анализ желудочного содержимого.Кислотность желудочного сока –
количество мл 0,1 н раствора щелочи, необходимого для
нейтрализации 100 мл профильтрованного желудочного
содержимого.
Норма
Пониженная кислотность
Повышенная кислотность
– 40-60 мл 0,1 н NaOH;
– 30 мл 0,1 н NaOH;
– 60 мл н NaOH.
33
34.
Задача.Для устранения кислого характера сточных растворов часто
применяется известняковая мука. Если суточный объем очищаемой
воды равен 2000 м3, значение рН исходного раствора равно 4, то с
учетом 80 %-го содержания действующего вещества в пересчете на
карбонат кальция в известняковой муке ее расход составит ______ кг
в сутки
35.
Для устранения кислого характера сточных растворов частоприменяется известняковая мука. Если суточный объем
очищаемой воды равен 2000 м3, значение рН исходного
раствора равно 4, то с учетом 80 %-го содержания действующего
вещества в пересчете на карбонат кальция в известняковой муке
ее расход составит ______ кг в сутки
1/2∙200 = 100 ← 200 моль
CaCO3 + 2H+ = Ca2+ + CO2↑ + H2O
n H 2 103 103 10 4 200 моль
mСаСО 3
1
nСаСО 3 200 100 моль
2
M n 100 100 10000 г 10 кг(чист.)
mСaCO3 ( с прим есям и)
10
12.5 кг
0.8






























 Химия
Химия








