Похожие презентации:
Гидролиз солей
1. Гидролиз солей
Теория2.
• Гидролиз солей (разложение водой)химическое взаимодействие ионов соли сионами воды , приводящее к образованию
слабого электролита –кислоты(или кислой
соли),или основания( или основной соли)
3.
• В зависимости от того какой ион соливступает во взаимодействие с водой ,
различают 3 типа гидролиза:
1) Гидролиз по катиону
2) Гидролиз по аниону
3) Гидролиз по катиону и аниону
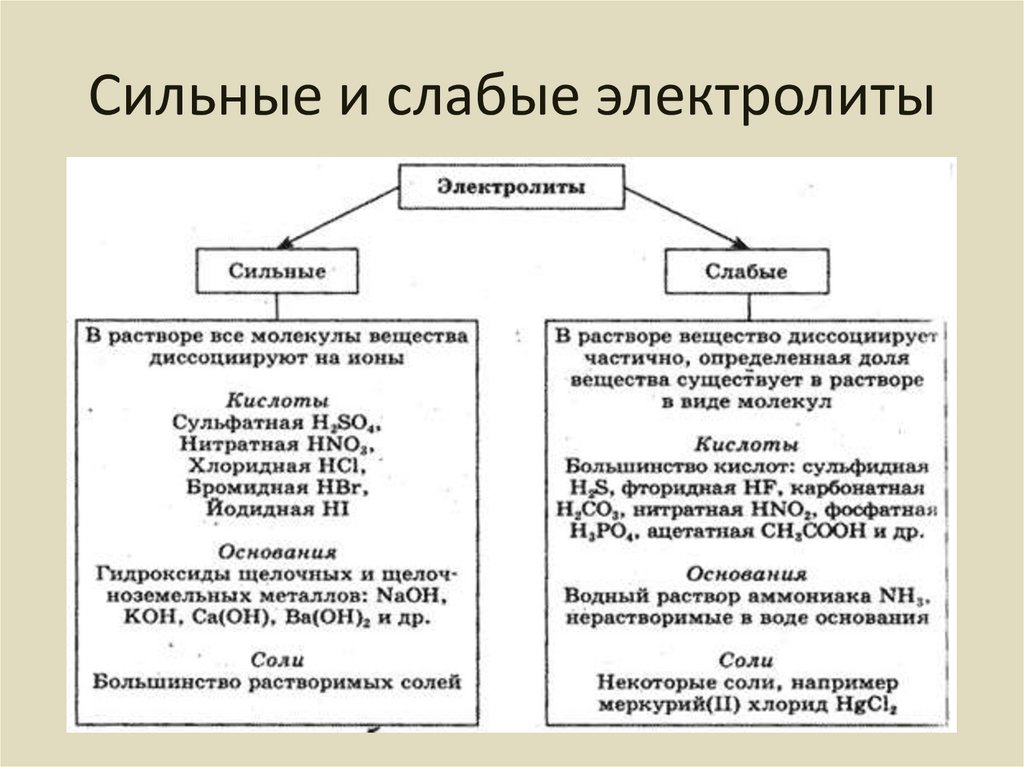
4. Сильные и слабые электролиты
5. Соли , образованные сильной кислотой и слабым основанием
• Среда раствора-кислая• Гидролиз по катиону
• При гидролизе солей, образованных
слабыми основаниями и сильной кислотой ,
получаются основные соли и кислота
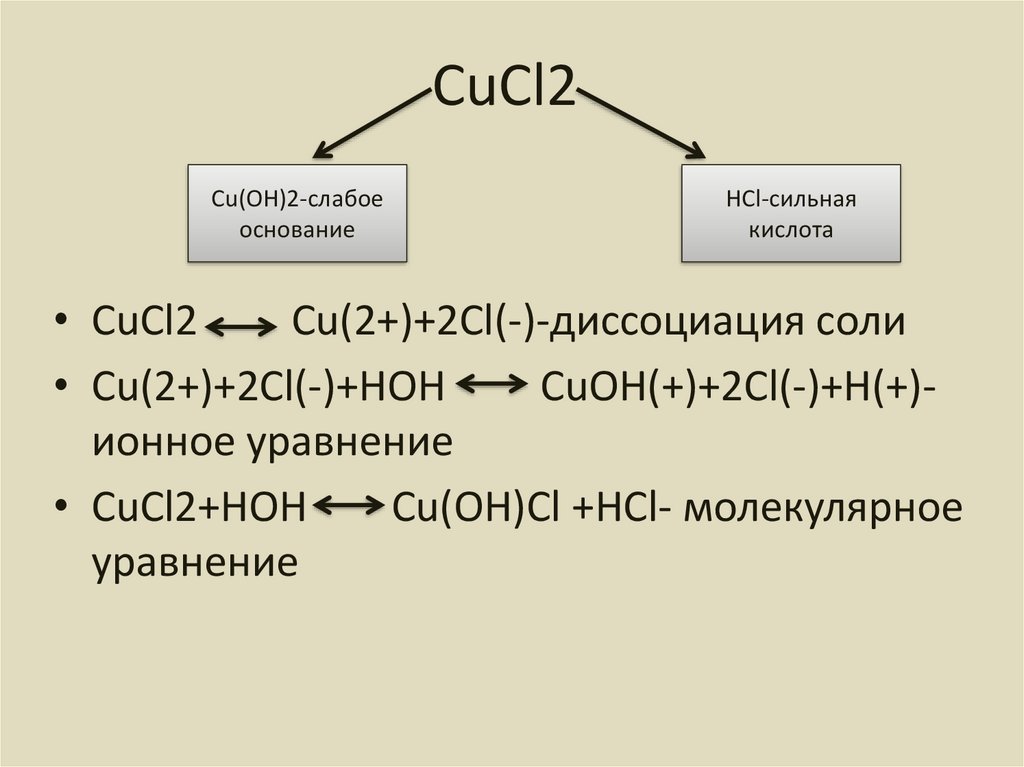
6. СuCl2
Cu(OH)2-слабоеоснование
HCl-сильная
кислота
• CuCl2
Cu(2+)+2Cl(-)-диссоциация соли
• Cu(2+)+2Cl(-)+HOH
CuOH(+)+2Cl(-)+H(+)ионное уравнение
• CuCl2+HOH
Cu(OH)Cl +HCl- молекулярное
уравнение
7. CuCl2
ClCu
+
HOH
Cl
CuCl2+HOH
CuCl2+2H2O
Cu(OH)Cl+HCL
Cu(OH)2+2HCl
8. Соли , образованные слабой кислотой и сильным основанием
• Среда раствора-щелочная• Гидролиз по аниону
• При гидролизе солей , образованных
слабой кислотой и сильным основанием,
получаются кислые соли и щелочь
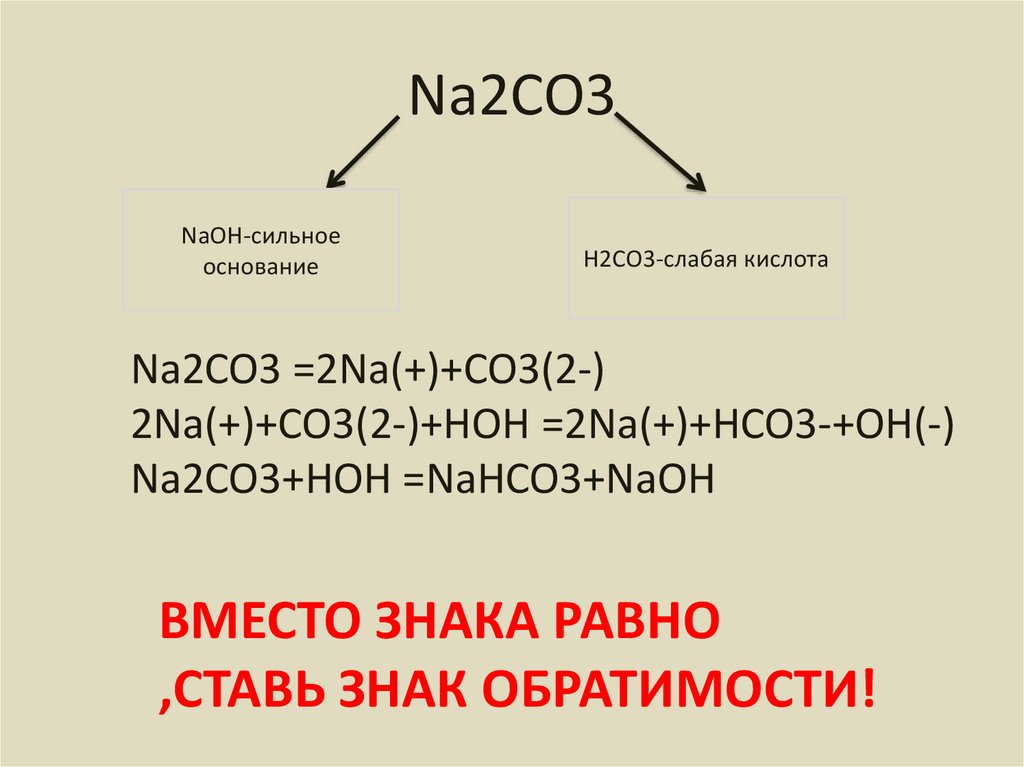
9. Na2CO3
NaOH-сильноеоснование
H2CO3-слабая кислота
Na2CO3 =2Na(+)+CO3(2-)
2Na(+)+CO3(2-)+HOH =2Na(+)+HCO3-+OH(-)
Na2CO3+HOH =NaHCO3+NaOH
ВМЕСТО ЗНАКА РАВНО
,СТАВЬ ЗНАК ОБРАТИМОСТИ!
10. Соли , образованные слабой кислотой и слабым основанием
• Среда раствора зависит от степенидиссоциации продуктов. Если преобладают
ионы OH(-)-щелочная,H(+)-кислая , если
одинаковое число-нейтральная.
• Гидролиз по катиону и аниону
11.
12.
• Zn(2+)S(2-)+H(+)OH(-)=По законам физикиплюс идет к минусу , минус к плюсу
• Zn(OH)2+H2S
13. Соли , образованные сильным основанием и сильной кислотой
ГИДРОЛИЗ НЕ ИДЕТ!!!
ГИДРОЛИЗ НЕ ИДЕТ!!!
ГИДРОЛИЗ НЕ ИДЕТ!!!
ГИДРОЛИЗ НЕ ИДЕТ!!!
ГИДРОЛИЗ НЕ ИДЕТ!!!
ГИДРОЛИЗ НЕ ИДЕТ!!!
ГИДРОЛИЗ НЕ ИДЕТ!!!
ГИДРОЛИЗ НЕ ИДЕТ!!!
ГИДРОЛИЗ НЕ ИДЕТ!!!










 Химия
Химия