Похожие презентации:
Гидролиз солей
1. Гидролиз солей
2. Гидролиз солей
химическое взаимодействие катионовили анионов соли с молекулами воды.
В результате образуется слабый
электролит.
3. Классификация солей
Соли, образованные …слабым основанием и слабой кислотой
сильным основанием и слабой кислотой
слабым основанием и сильной кислотой
сильным основанием и сильной кислотой
4.
Сильные кислоты:HCl - соляная кислота
HBr - бромоводород
HI - йодоводород
HNO3 - азотная кислота
HClO4 - хлорная кислота
H2SO4 - серная кислота
Сильные основания:
Гидроксиды металлов I и II групп, но только главных
подгрупп
(LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2,
Ra(OH)2)
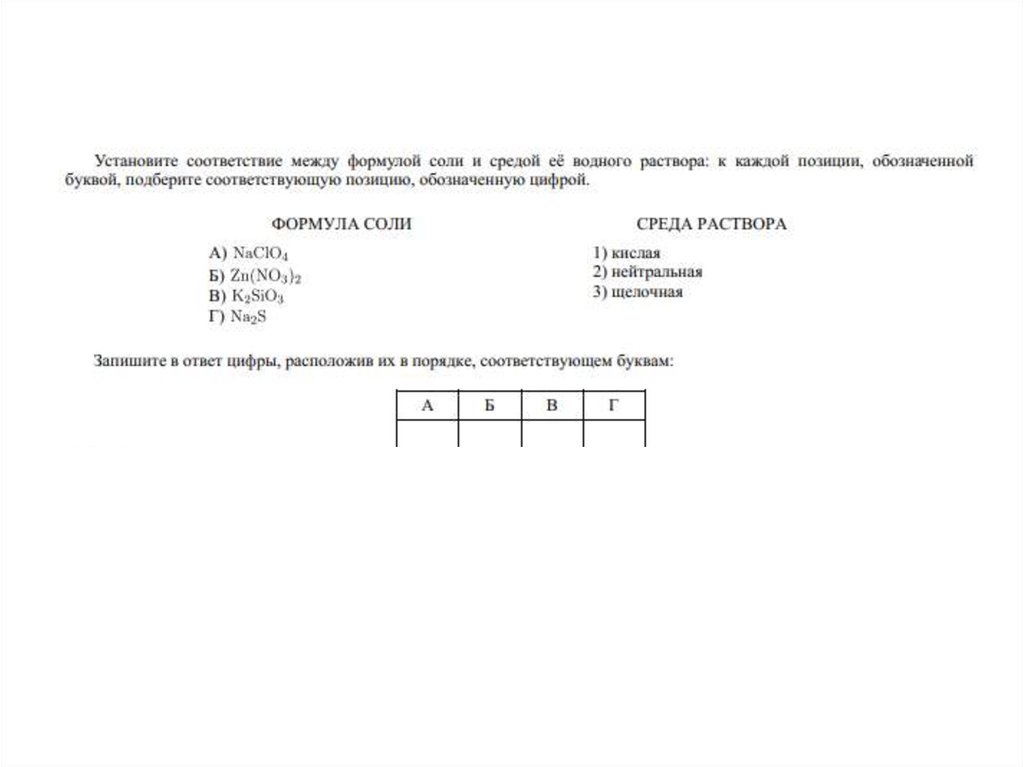
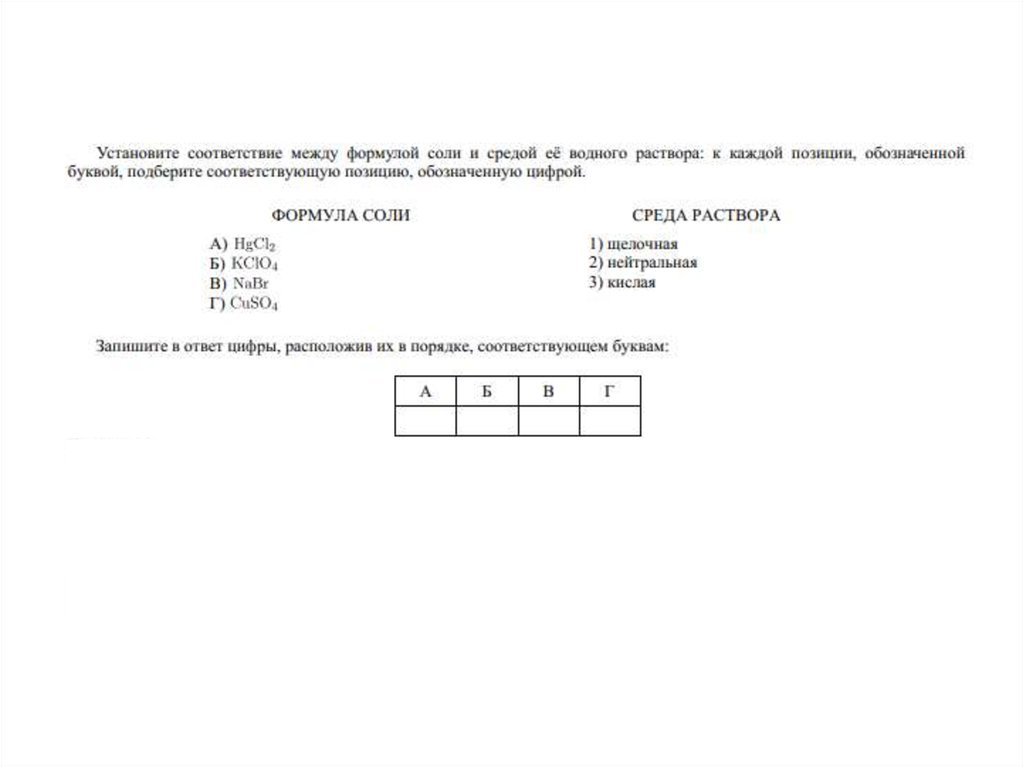
5. 1) Гидролиз солей, образованных слабым основанием и слабой кислотой
гидролизуется и по катиону, и поаниону
реакция среды - нейтральная,
(слабокислая или слабощелочная)
Al2S3 + 6H2O =>2Al(OH)3↓+ 3H2S↑
(в результате образуются малодиссоциирующие
основание и кислота)
6. 2) Гидролиз солей, образованных сильным основанием и слабой кислотой
гидролизируется по анионуреакция среды – щелочная
K2SiO3 + НОH <=>KHSiO3 + KОН
2K+ +SiO32- + Н+ + ОH-<=> НSiO3- + 2K+ + ОН(образуется слабый электролит, гидроксидион ОН- и другие ионы)
7. 3) Гидролиз солей, образованных слабым основанием и сильной кислотой
гидролизуется по катионуреакция среды – кислая
FeCl2 + HOH <=>Fe(OH)Cl + HCl
Fe2+ + 2Cl- + H+ + OH- <=> FeOH+ + 2Cl- + Н+
(образуется слабый электролит, ион H+ и
другие ионы)
8. 4) Гидролиз солей, образованных сильным основанием и сильной кислотой
не гидролизируетсяреакция среды – нейтральная
9.
ИндикаторЛакмус
Нейтральная
фиолетовый
Метилоранж оранжевый
Щелочная
Кислая
синий
красный
желтый
розовый













 Химия
Химия