Похожие презентации:
Аминокислоты. Белки
1. Аминокислоты
2.
Жизнь – есть способ существованиябелковых тел.
Ф. Энгельс
2
3.
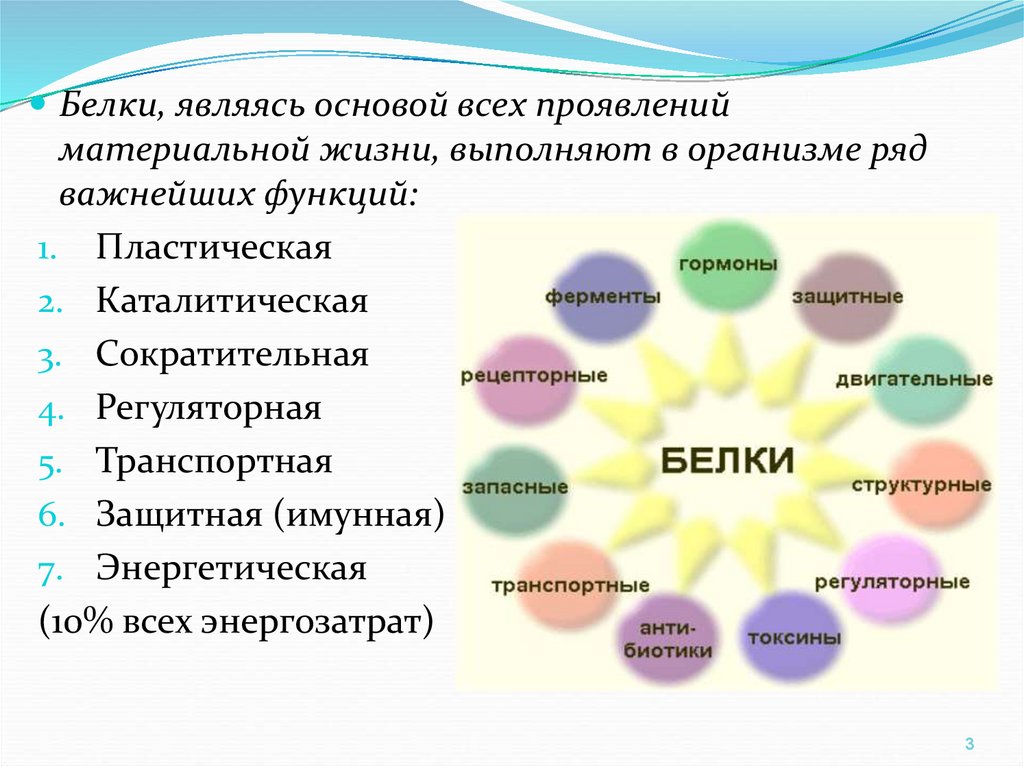
Белки, являясь основой всех проявленийматериальной жизни, выполняют в организме ряд
важнейших функций:
1. Пластическая
2. Каталитическая
3. Сократительная
4. Регуляторная
5. Транспортная
6. Защитная (имунная)
7. Энергетическая
(10% всех энергозатрат)
3
4.
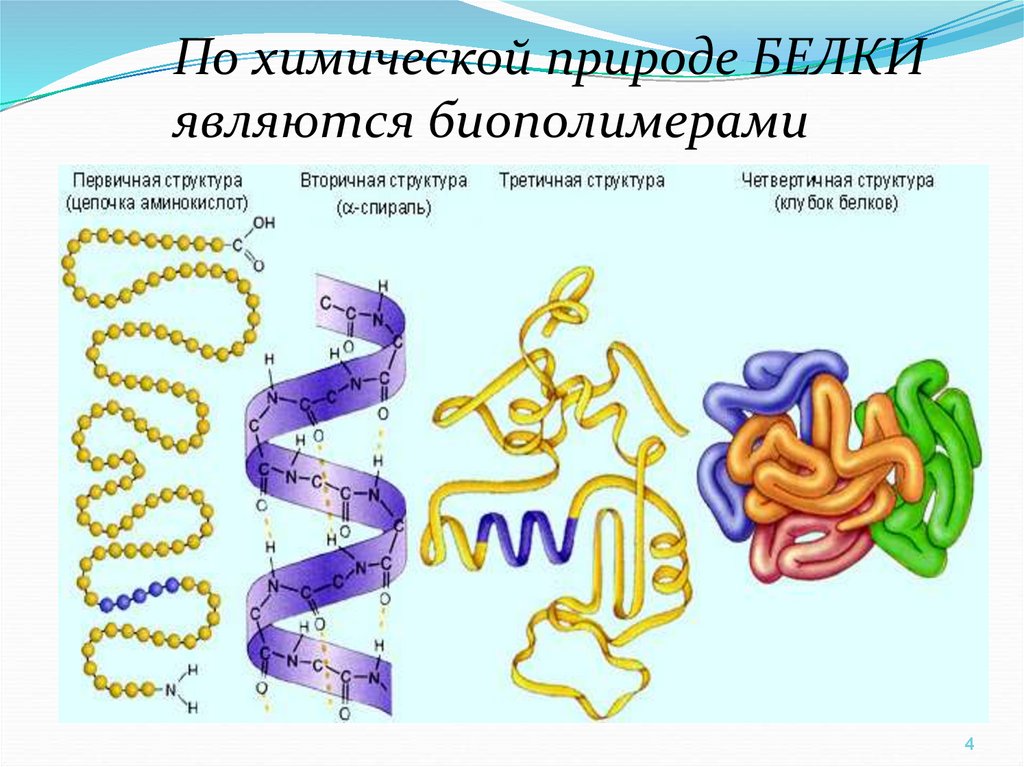
По химической природе БЕЛКИявляются биополимерами
4
5.
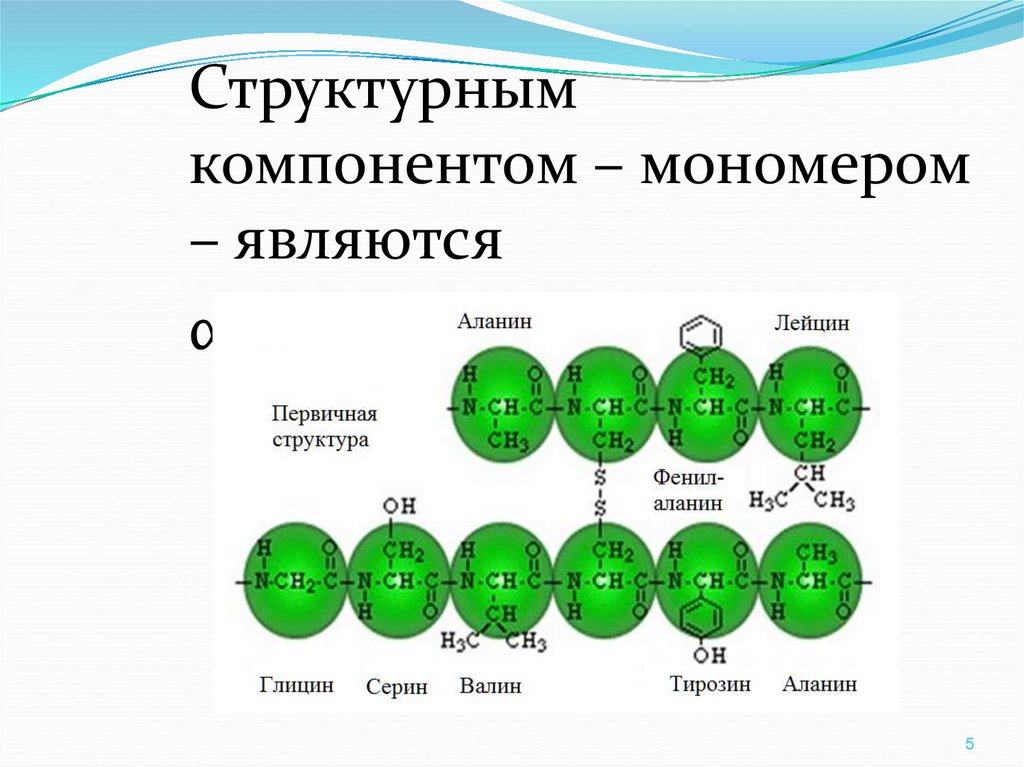
Структурнымкомпонентом – мономером
– являются
α-АМК
5
6.
Аминокислоты – этогетерофункциональные органические
соединения, производные КК у которых у
a-углеродного атома водород замещен на
аминогруппу
6
7.
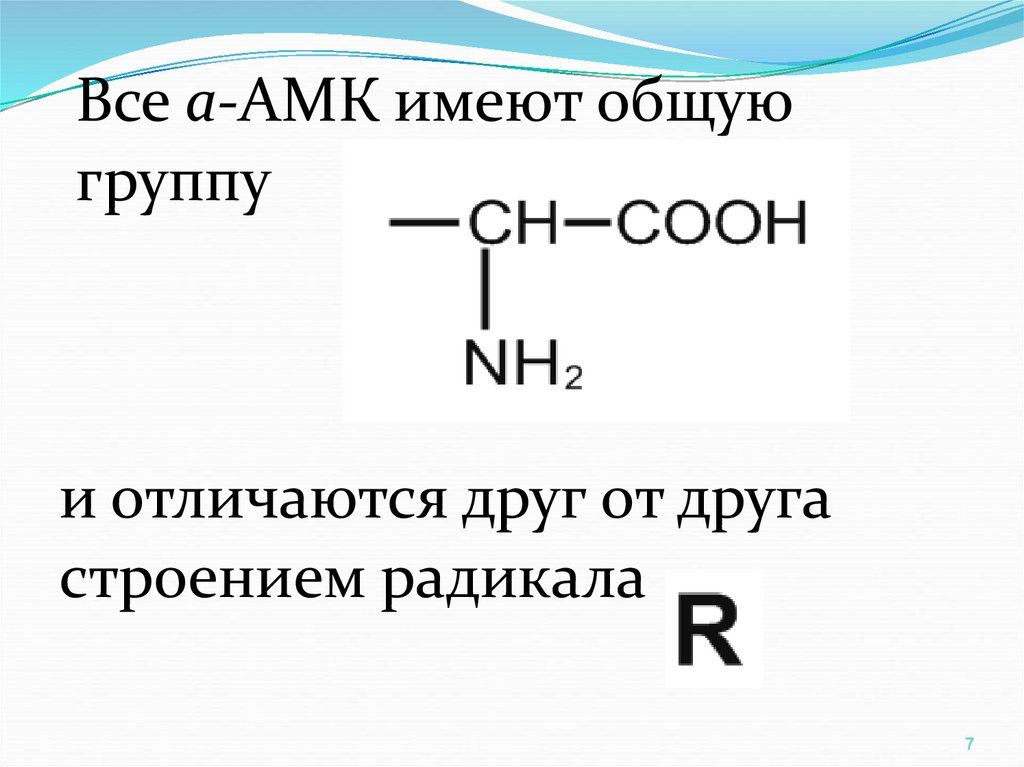
Все a-АМК имеют общуюгруппу
и отличаются друг от друга
строением радикала
7
8.
В состав белковживотного и
растительного
происхождения
входит:
19 АМК,
2 амида АМК
2 иминокислоты.
8
9. Стереохимия аминокислот
Во всех природных АМК, заисключением глицина, a-С атом
ассиметричен и a-АМК обладают
оптической активностью.
Растворы АМК вращают плоскость
поляризованного света вправо (10
АМК) либо влево (8 АМК).
9
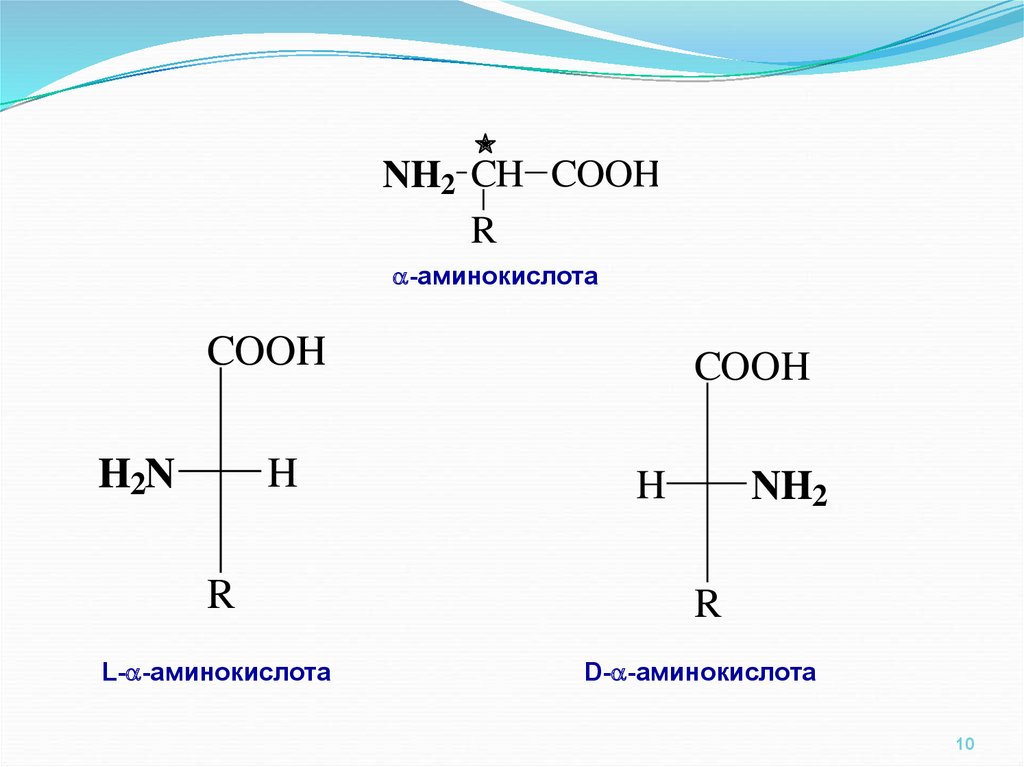
10.
NH2 CH COOHR
-аминокислота
COOH
H
H2N
R
L- -аминокислота
COOH
H
NH2
R
D- -аминокислота
10
11. Классификация, строение, номенклатура a-АМК
1112. I. По химической природе радикала и характеру содержащихся в нем заместителей:
1. АЛИФАТИЧЕСКИЕ2. ЦИКЛИЧЕСКИЕ
12
13. Алифатические а-АМК в зависимости от количества в их составе аминогрупп и карбоксильных групп подразделяют на:
1. МАМК2. МАДК
3. ДАМК
13
14. К МАМК аминокислотам относят:
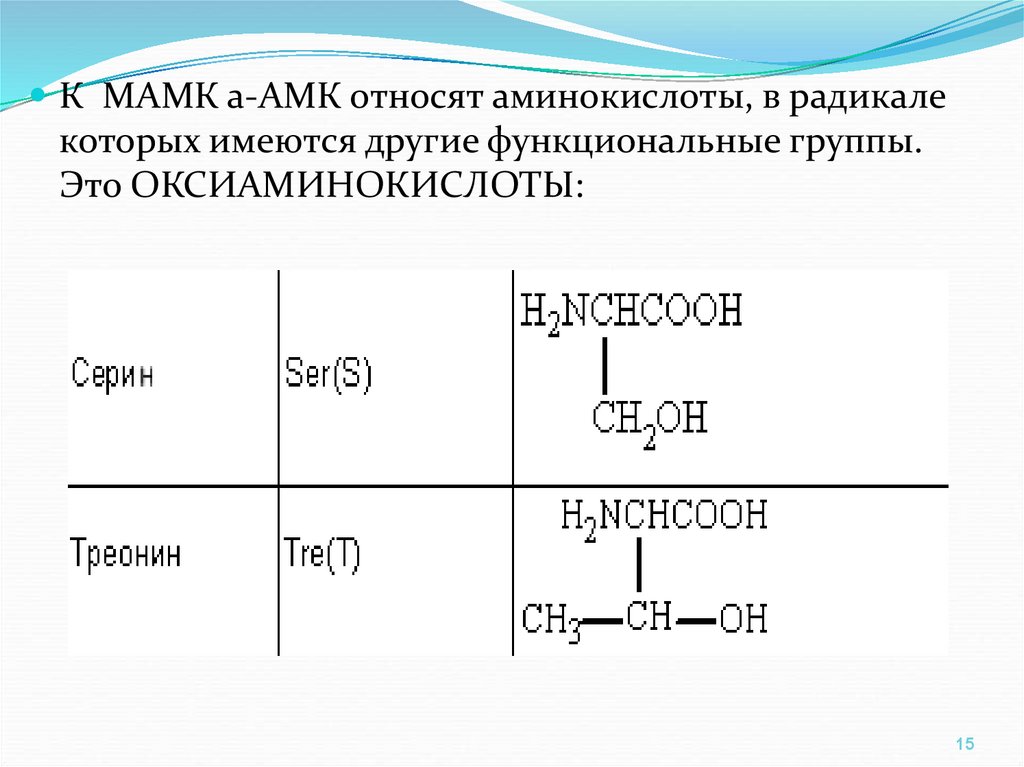
1415.
К МАМК а-АМК относят аминокислоты, в радикалекоторых имеются другие функциональные группы.
Это ОКСИАМИНОКИСЛОТЫ:
15
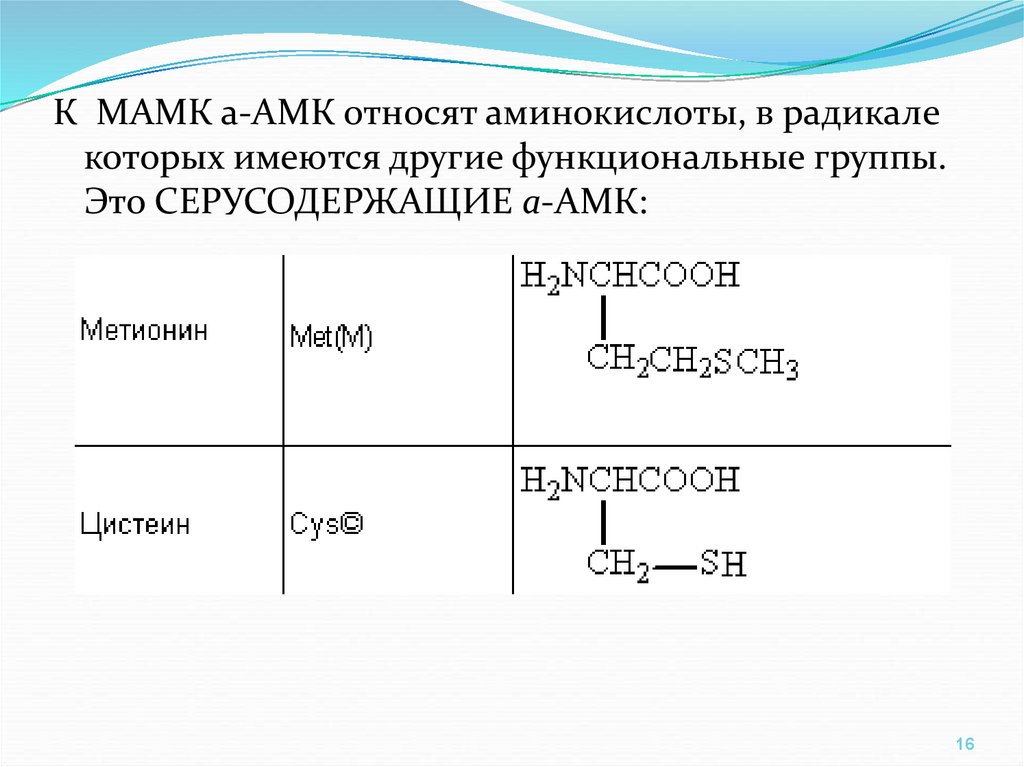
16.
К МАМК а-АМК относят аминокислоты, в радикалекоторых имеются другие функциональные группы.
Это СЕРУСОДЕРЖАЩИЕ а-АМК:
16
17. К МАДК аминокислоты представлены:
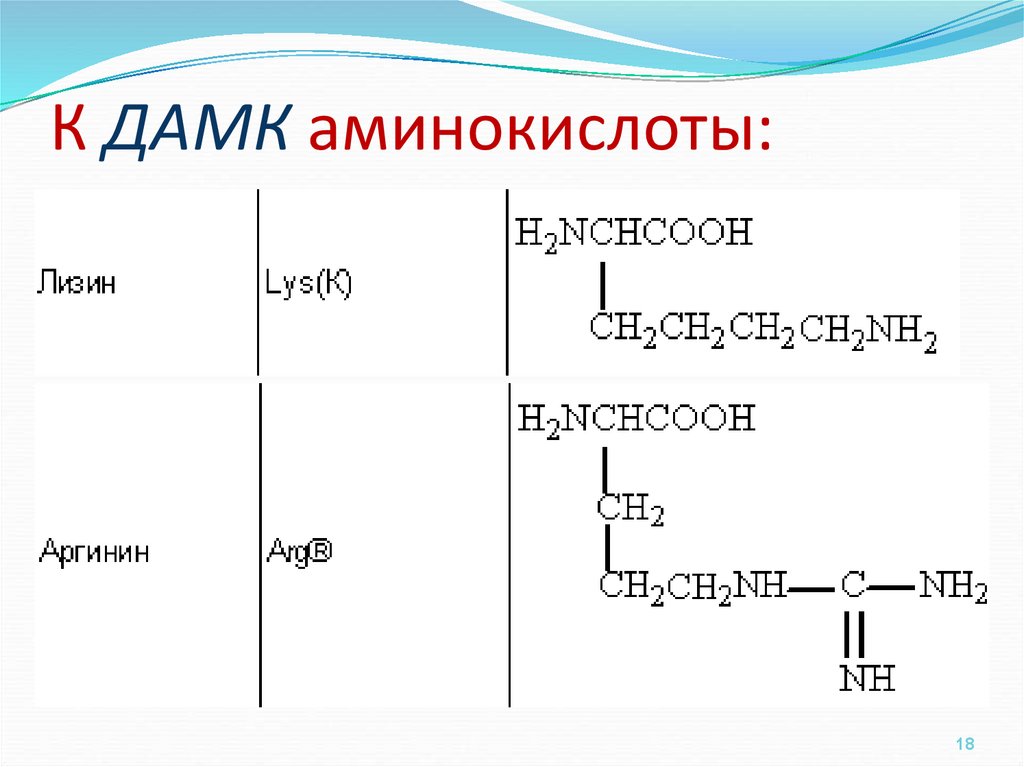
1718. К ДАМК аминокислоты:
1819. Циклические аминокислоты в зависимости от природы цикла делятся на: 1. карбоциклические 2. гетероциклические
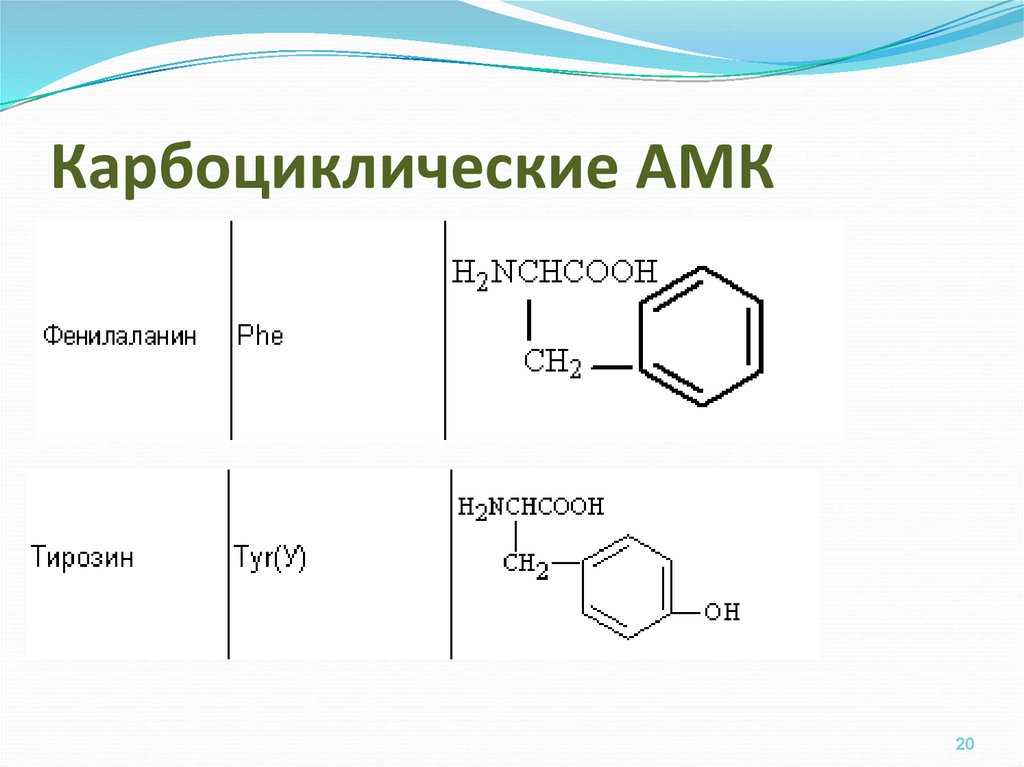
1920. Карбоциклические АМК
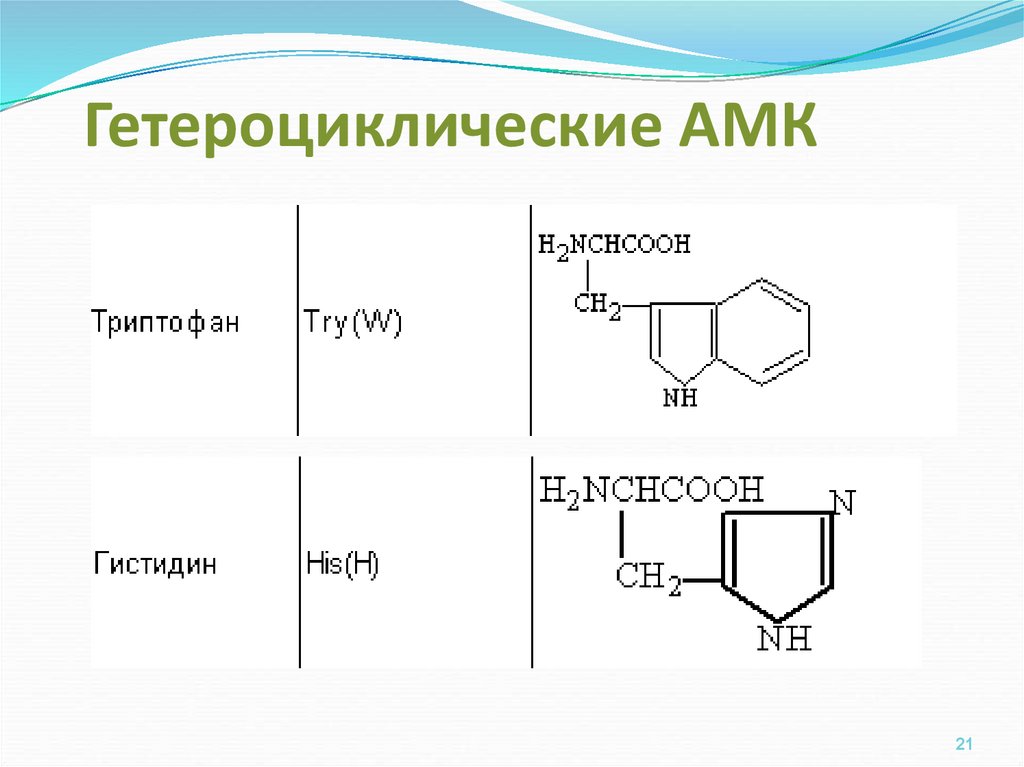
2021. Гетероциклические АМК
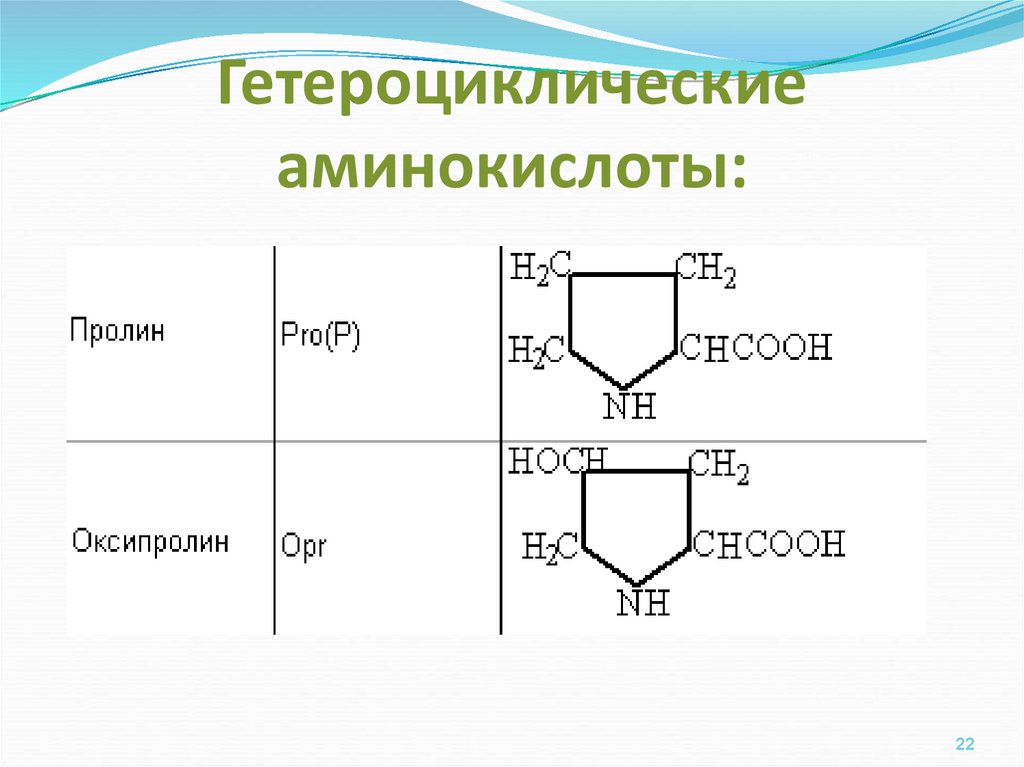
2122. Гетероциклические аминокислоты:
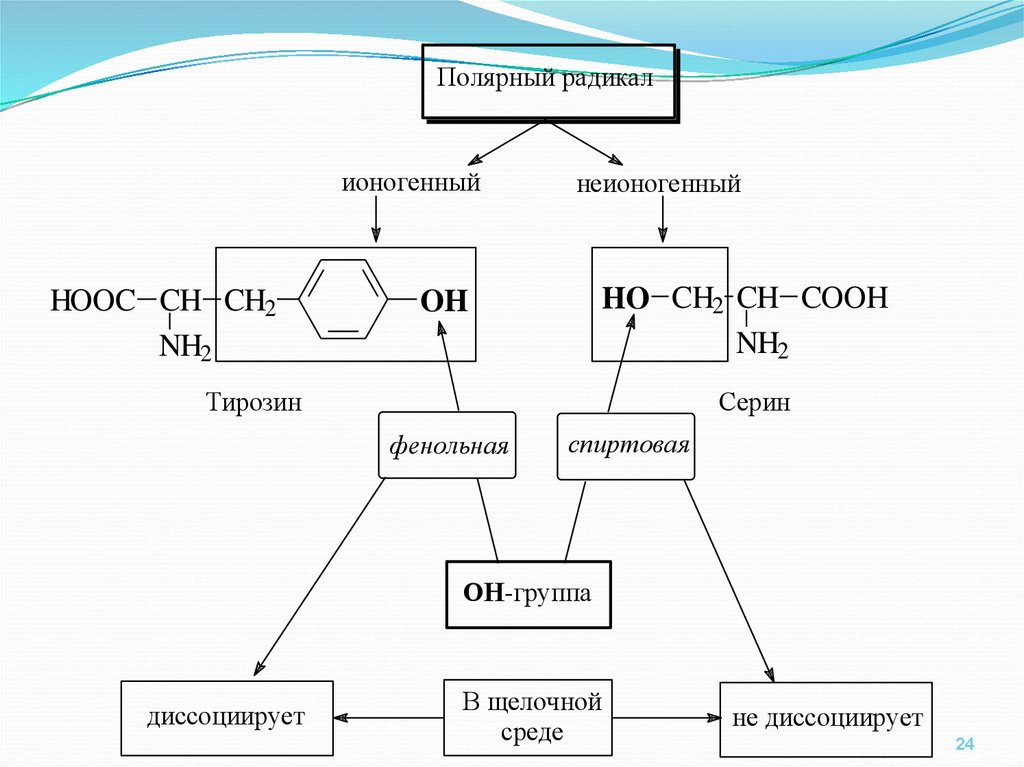
2223. II. По полярности радикала:
1. ПОЛЯРНЫЕ2. НЕПОЛЯРНЫЕ
23
24.
Полярный радикалионогенный
HOOC CH CH2
NH2
неионогенный
HO CH2 CH COOH
NH2
OH
Тирозин
Серин
фенольная
спиртовая
ОН-группа
диссоциирует
В щелочной
среде
не диссоциирует
24
25.
К НЕПОЛЯРНЫМ АМКотносят аминокислоты не
содержащие полярных
функциональных групп:
глицин, аланин, валин,
лейцин, изолейцин,
фенилаланин.
25
26.
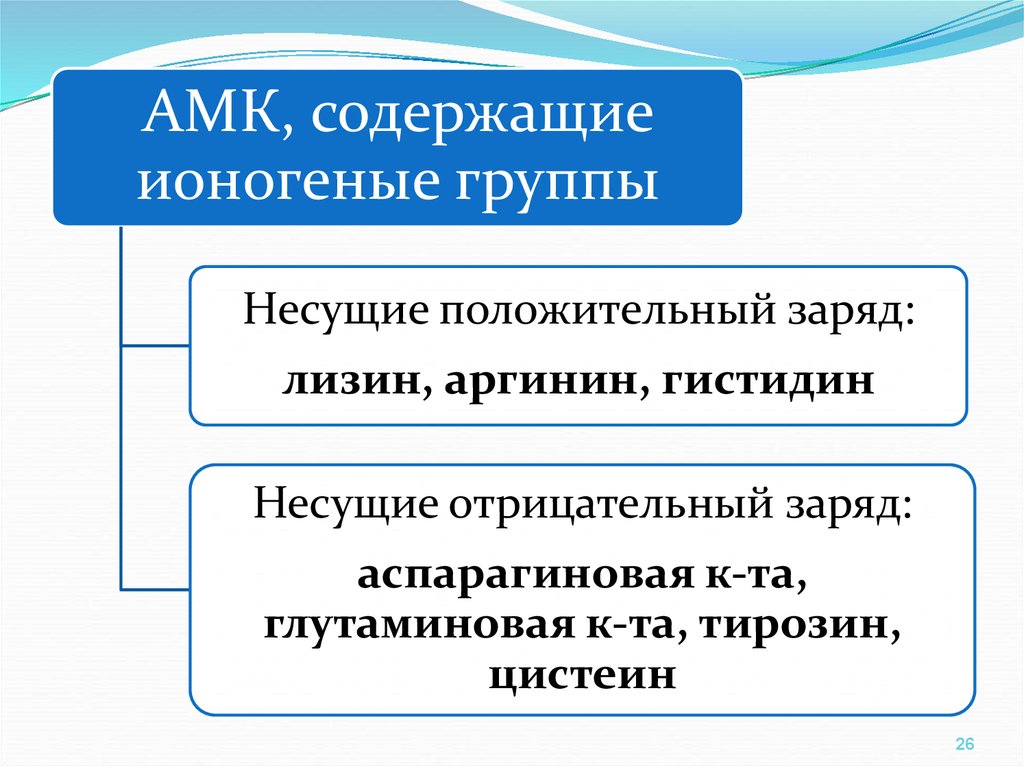
АМК, содержащиеионогеные группы
Несущие положительный заряд:
лизин, аргинин, гистидин
Несущие отрицательный заряд:
аспарагиновая к-та,
глутаминовая к-та, тирозин,
цистеин
26
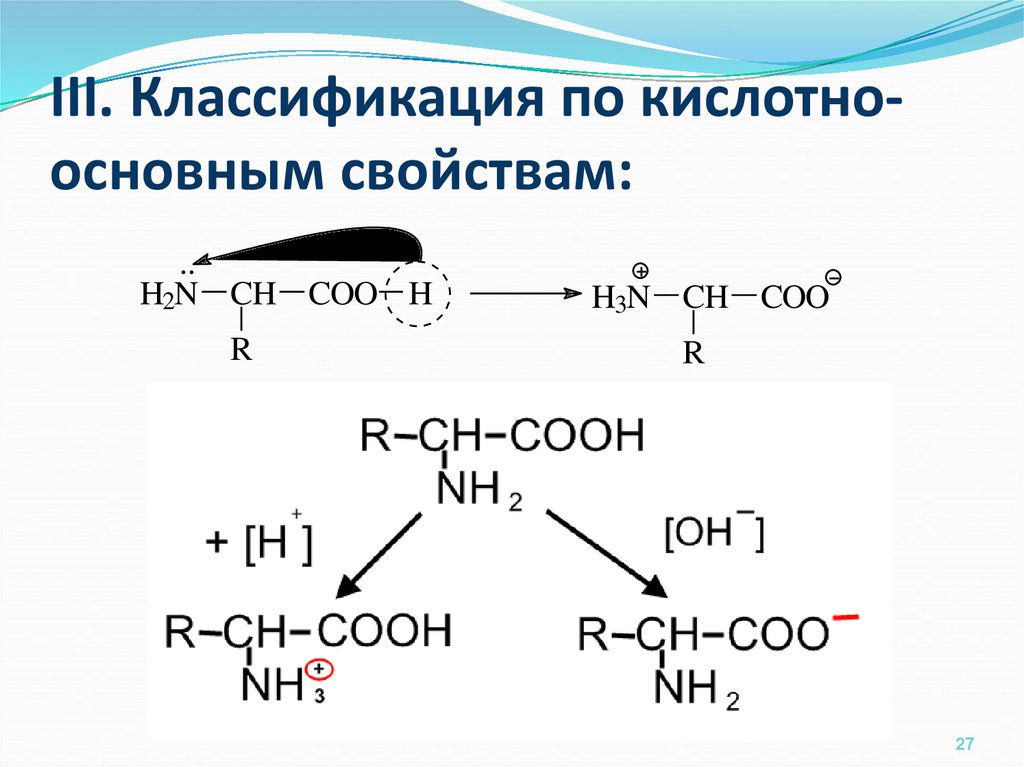
27. III. Классификация по кислотно-основным свойствам:
III. Классификация по кислотноосновным свойствам:H2N CH COO H
R
Несуществующая
в природе форма!
H3N CH COO
R
Биполярный ион
(цвиттер-ион),
внутренняя соль
27
28.
Значение рН, при которомконцентрация дипольных
форм АМК максимальна, а
концентрация анионных и
катионных форм минимальна
или равны, называется
изоэлектрической точкой
(pI).
28
29.
pI: 5,5-6,3pI: менее 5,5
• Нейтральные
АМК: метионин,
пролин, тирозин,
триптофан,
фенилаланин ...
(резкокислая среда)
• Кислые АМК:
аспарагиновая,
глутаминовая
кислоты, цистеин
pI: более 6,3
(резкощелочная
среда)
• Основные АМК:
лизин, аргинин,
гистидин
29
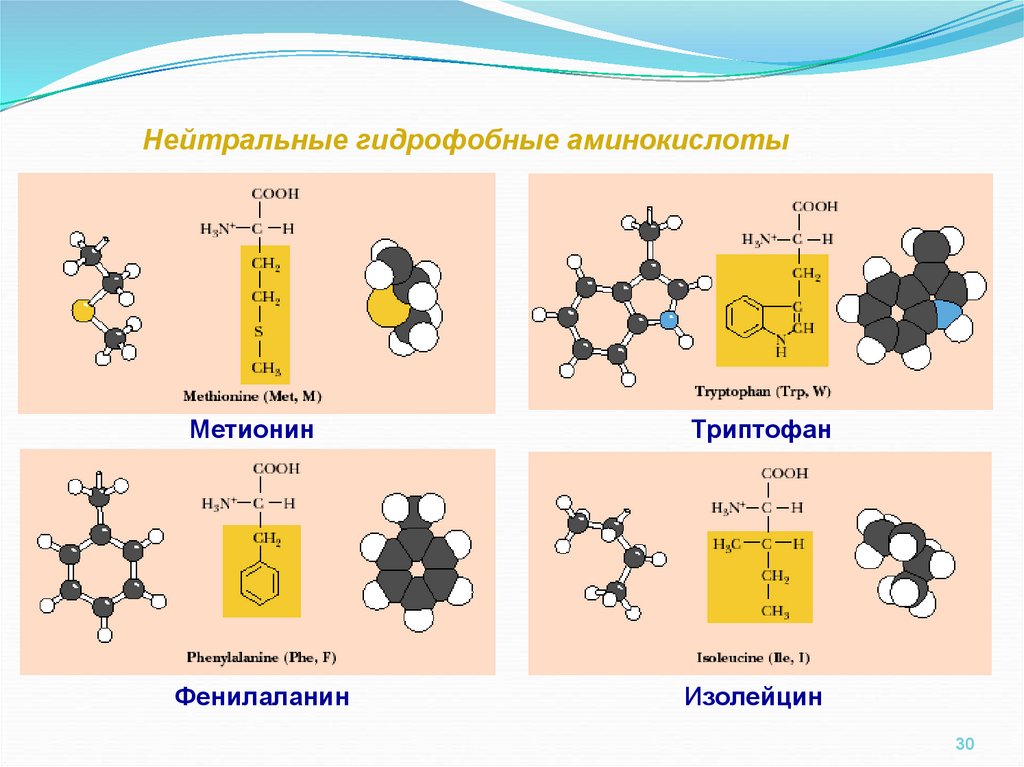
30.
Нейтральные гидрофобные аминокислотыМетионин
Фенилаланин
Триптофан
Изолейцин
30
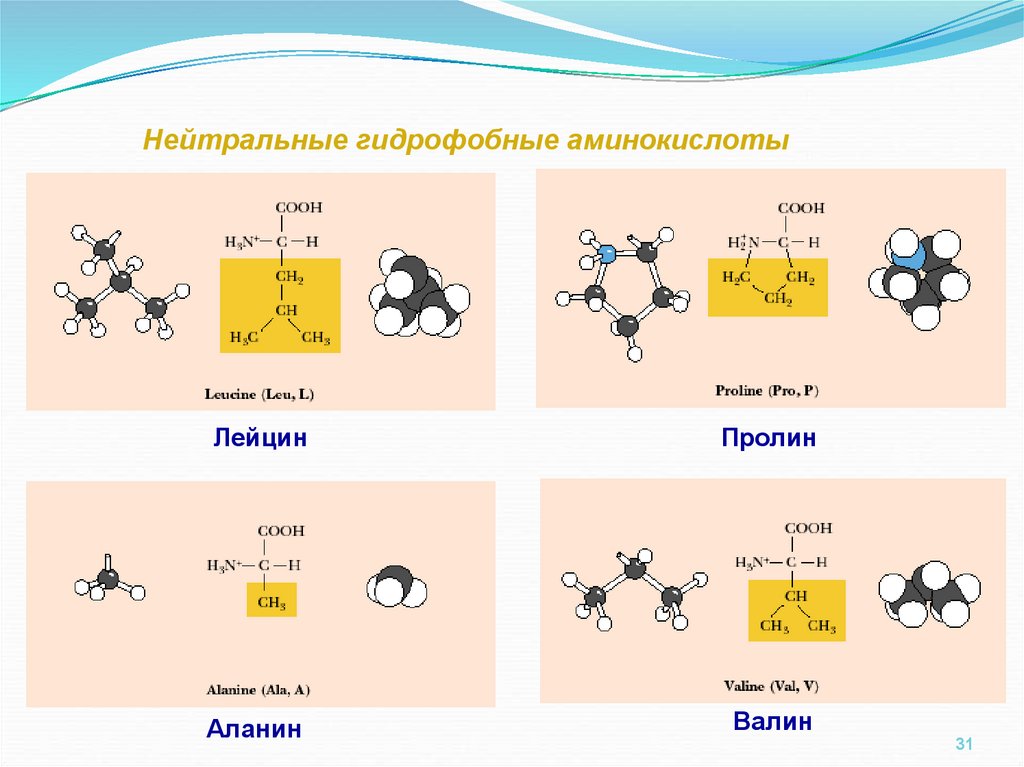
31.
Нейтральные гидрофобные аминокислотыЛейцин
Пролин
Аланин
Валин
31
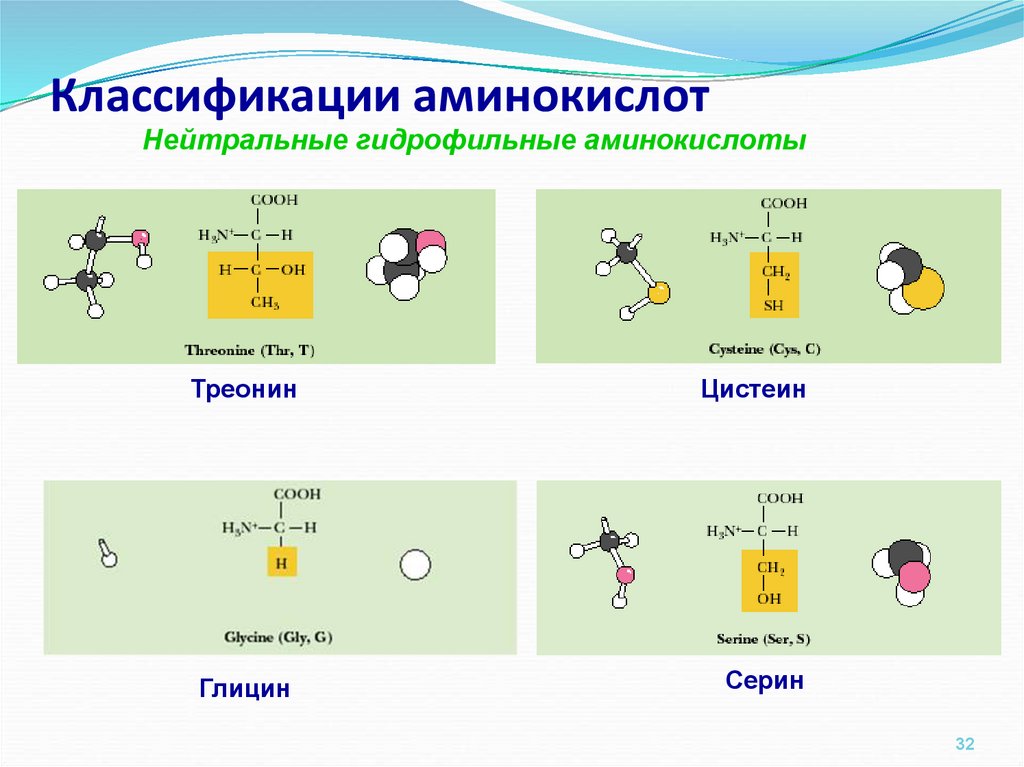
32. Классификации аминокислот
Нейтральные гидрофильные аминокислотыТреонин
Цистеин
Глицин
Серин
32
33.
Нейтральные гидрофильные аминокислотыТирозин
Аспарагин
Глутамин
33
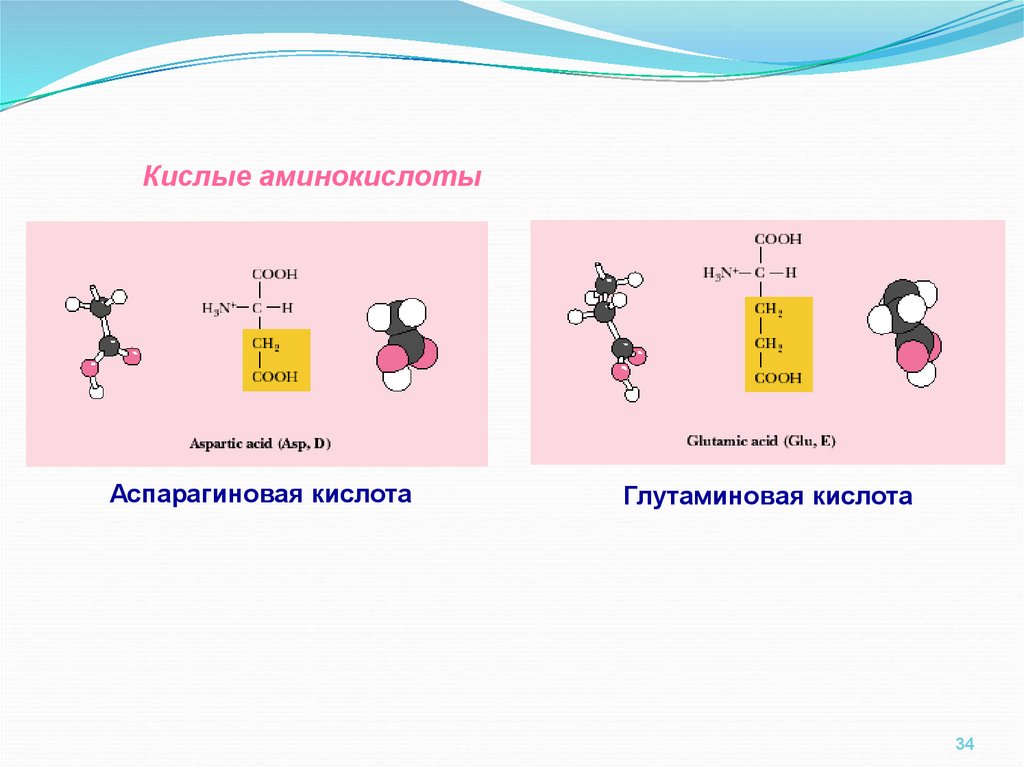
34.
Кислые аминокислотыАспарагиновая кислота
Глутаминовая кислота
34
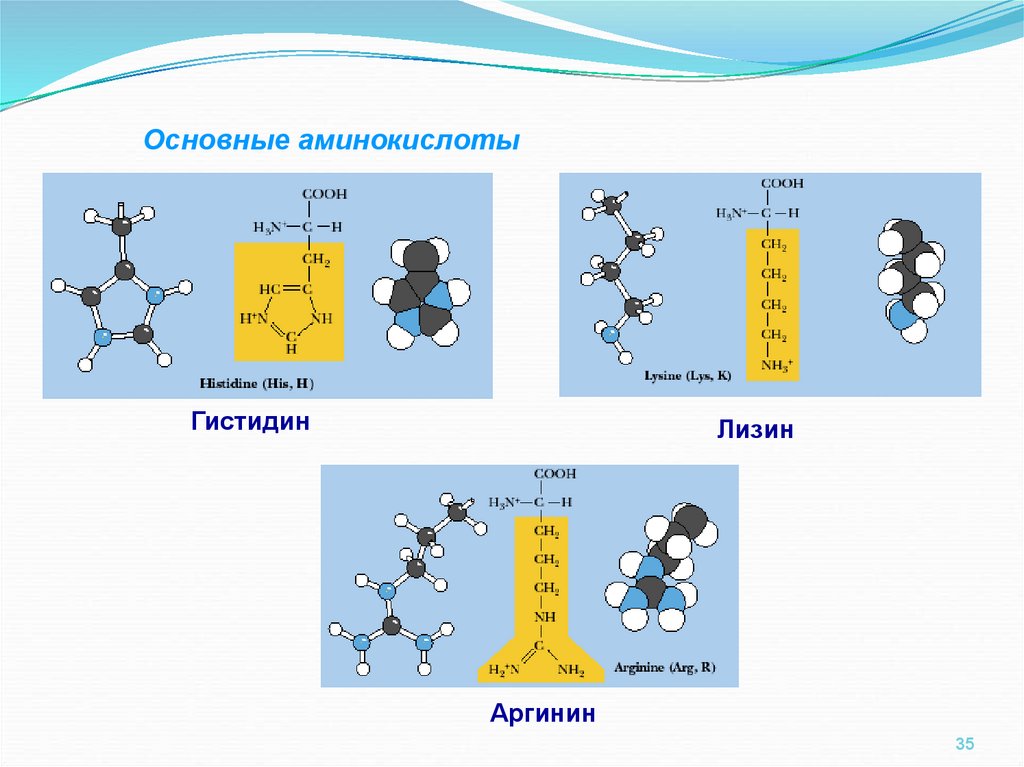
35.
Основные аминокислотыГистидин
Лизин
Аргинин
35
36. III. Классификация АМК по биологическому принципу:
1. ЗАМЕНИМЫЕ2. НЕЗАМЕНИМЫЕ
36
37.
Незаменимые - несинтезируются в организме
и должны поступать с
пищей:
валин, лейцин, изолейцин,
треонин, метионин,
лизин, фенилаланин,
триптофан, аргинин.
37
38. Номенклатура аминокислот
Названия аминокислот произошли в основномот исходных материалов, из которых они
были впервые выделены;
аспарагин (от лат. asparagus — спаржа) получен
из сока спаржи,
цистеин и цистин (от греч. cystis — мочевой
пузырь) — из камней мочевого пузыря,
глутамин и глутаминовая кислота (от нем. das
Gluten — клейковина) — из клейковины
пшеницы, серин (от греч. seros —
шелковичный червь) — из шелка,
тирозин (от греч. tyros — сыр) — из сыра.
38
39.
Другие названия связаны с методамивыделения:
аргинин (от лат. argentum — серебро)
был впервые получен в виде серебряной
соли,
триптофан выделен при расщеплении
белка с помощью трипсина.
39
40.
Структурные связи с другимиприродными соединениями также
внесли вклад в названия некоторых
аминокислот:
валин назван как производное
валериановой кислоты,
треонин структурно связан с
моносахаридом треозой,
название «пролин» происходит от
рационального обозначения
пирролидин-2-карбоновой кислоты.
40
41.
Аминоацильные остатки общей формулыNH2-CHR-CO- называют, добавляя к
корню слова окончание –ил
(исключение: триптофан и
аминодикарбоновые кислоты*)
*Поскольку у аспарагиновой и глутаминовой
кислот и их полуамидов одинаковые корневые
слова, остатки глутамина и аспарагина
называют обычно «глутаминил» и
«аспарагинил», остатки же глутаминовой и
аспарагиновой кислот получили названия
«глутамил» и «аспарагил».
41
42. Синтез аминокислот
Восстановительноеаминирование
a-кетонокислот
Переаминирование или
трансаминирование
42
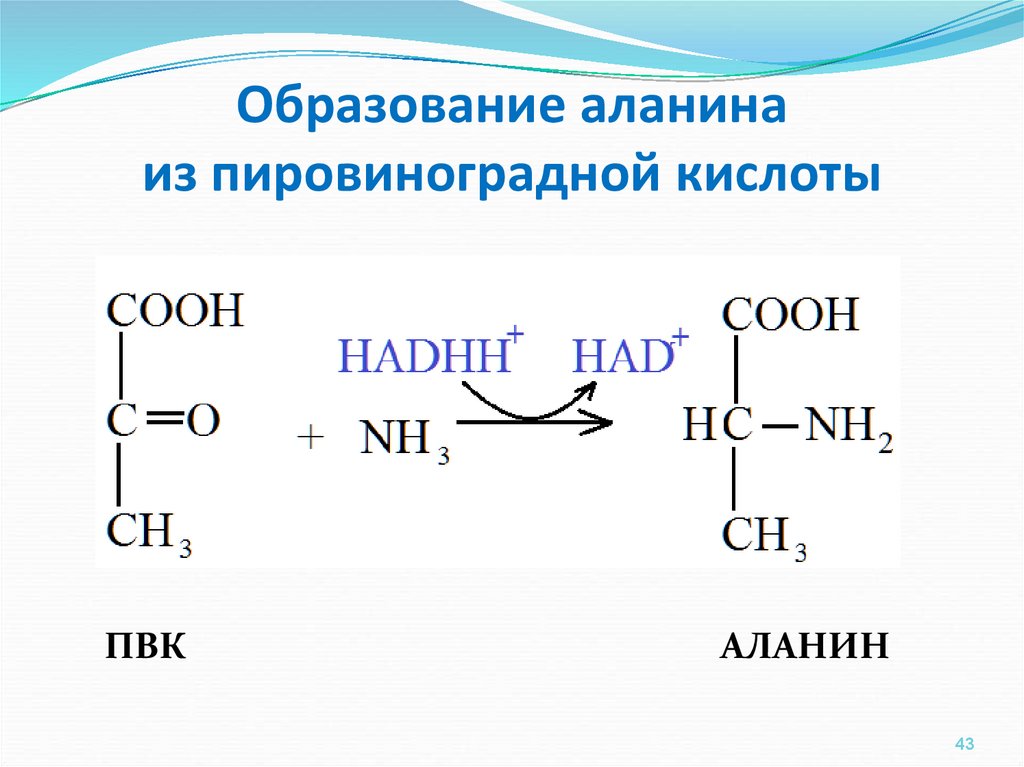
43. Образование аланина из пировиноградной кислоты
ПВКАЛАНИН
43
44.
Аналогичным образомсинтезируется из
a-кетоглутаровой кислоты
глутаминовая кислота
44
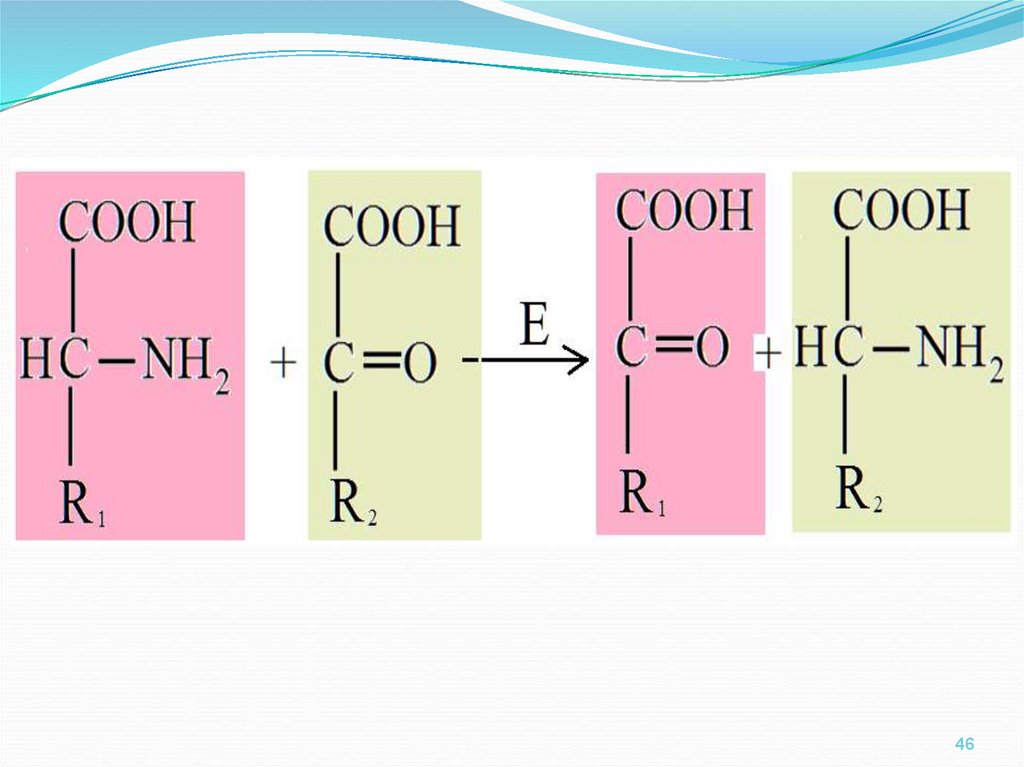
45. Реакции переаминирования
Сущность этого процессазаключается в ферментативном
переносе аминогруппы с
α-аминокислоты на αкетонокислоту с образованием
новой α-аминокислоты и новой αкетонокислоты.
45
46.
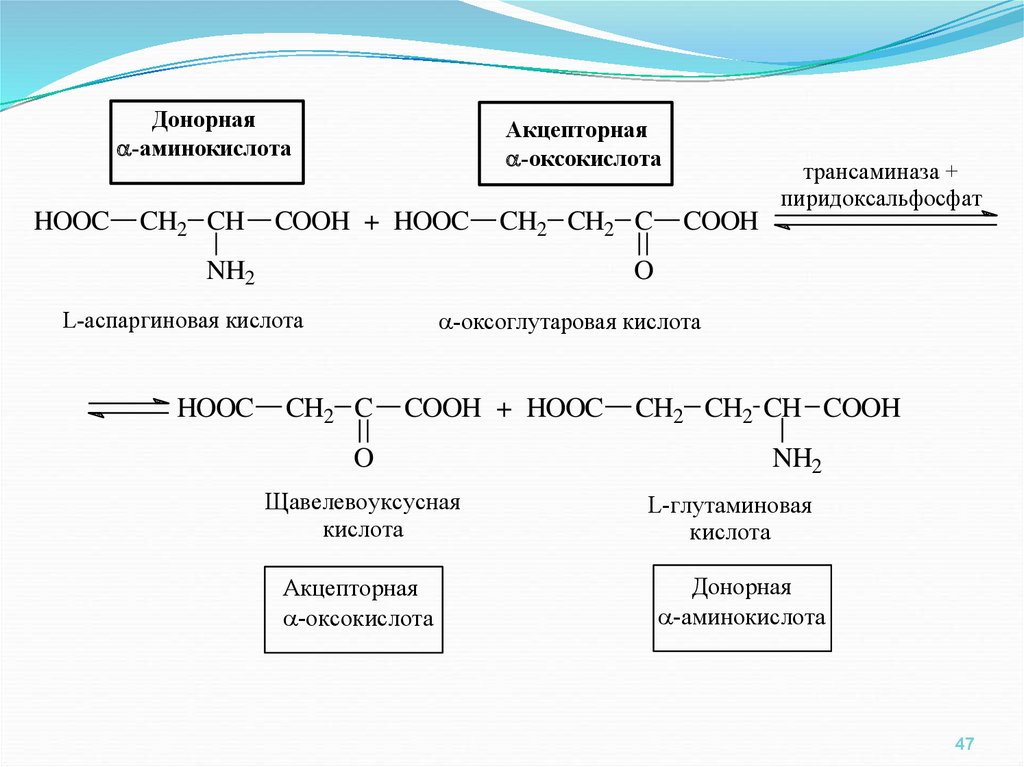
4647.
Донорная-аминокислота
HOOC
CH2 CH
Акцепторная
-оксокислота
COOH + HOOC
CH2 CH2 C
NH2
COOH
O
-оксоглутаровая кислота
L-аспаргиновая кислота
HOOC
трансаминаза +
пиридоксальфосфат
CH2 C
COOH + HOOC
O
Щавелевоуксусная
кислота
Акцепторная
-оксокислота
CH2 CH2 CH COOH
NH2
L-глутаминовая
кислота
Донорная
-аминокислота
47
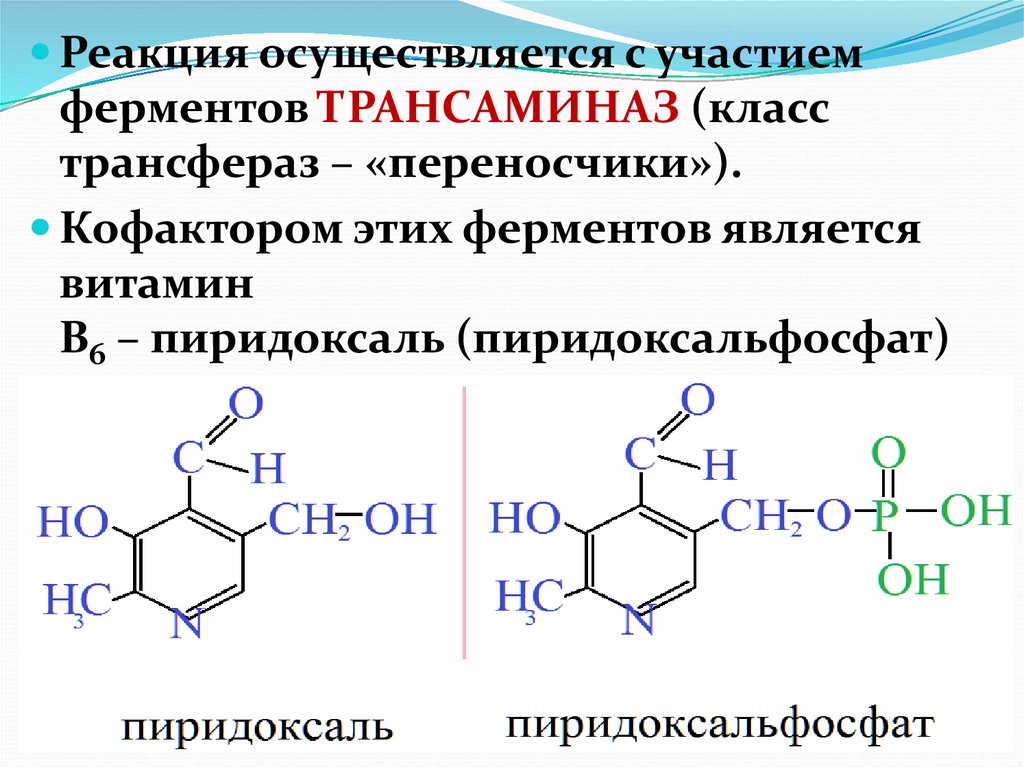
48.
Реакция осуществляется с участиемферментов ТРАНСАМИНАЗ (класс
трансфераз – «переносчики»).
Кофактором этих ферментов является
витамин
В6 – пиридоксаль (пиридоксальфосфат)
48
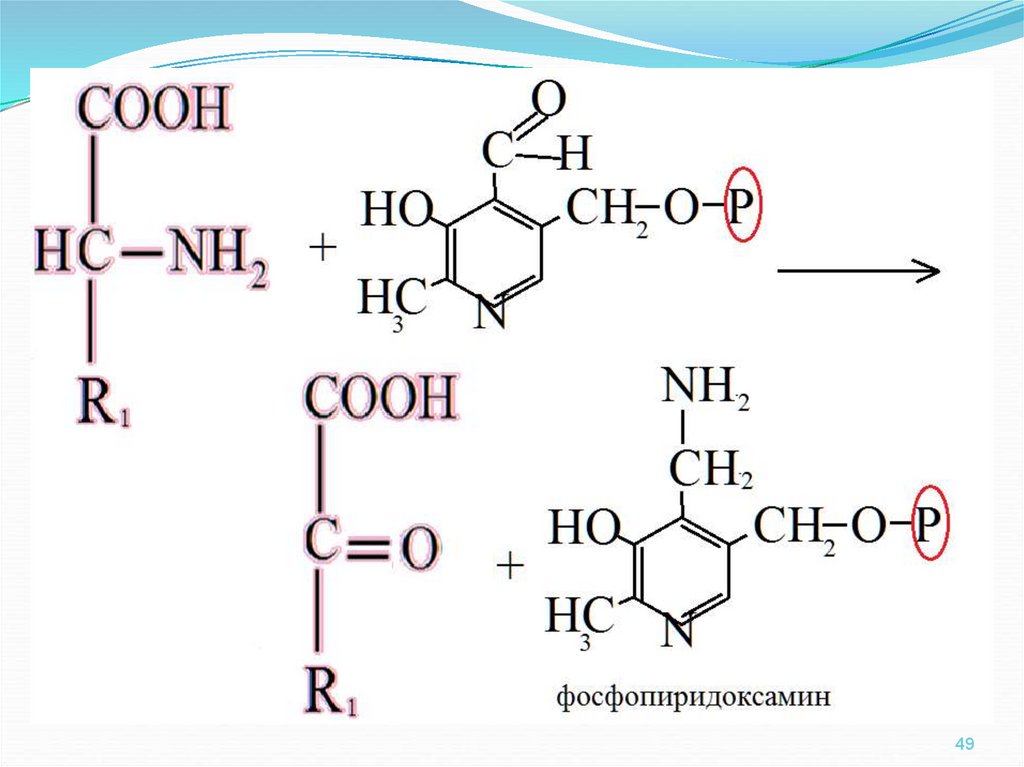
49.
4950.
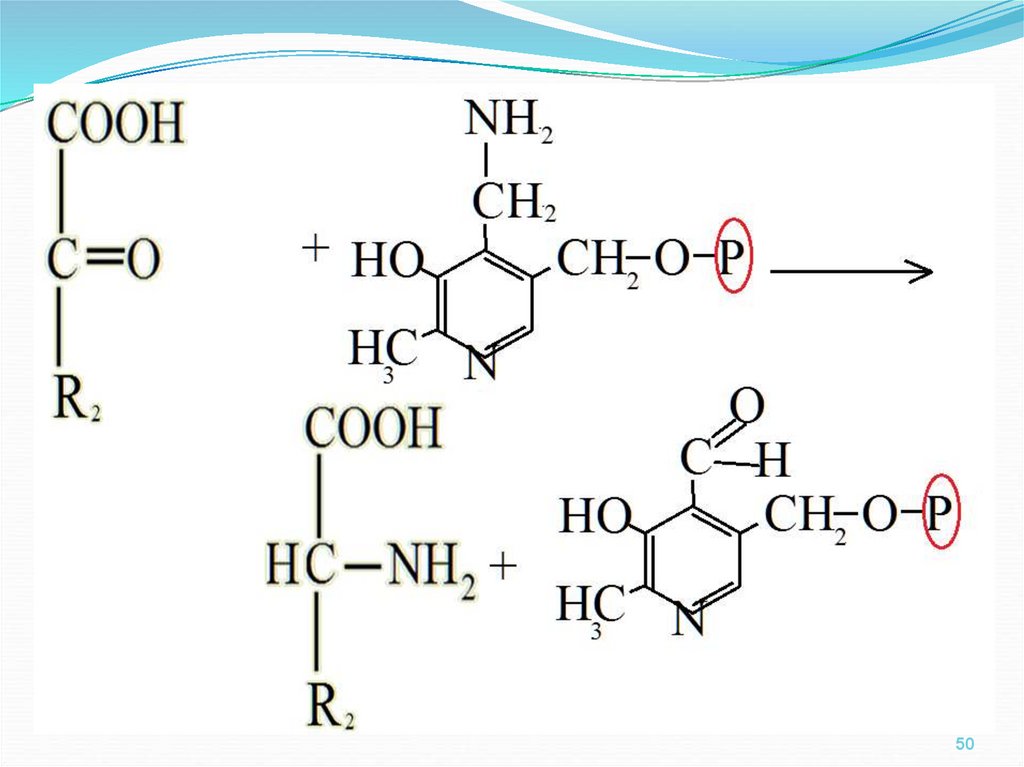
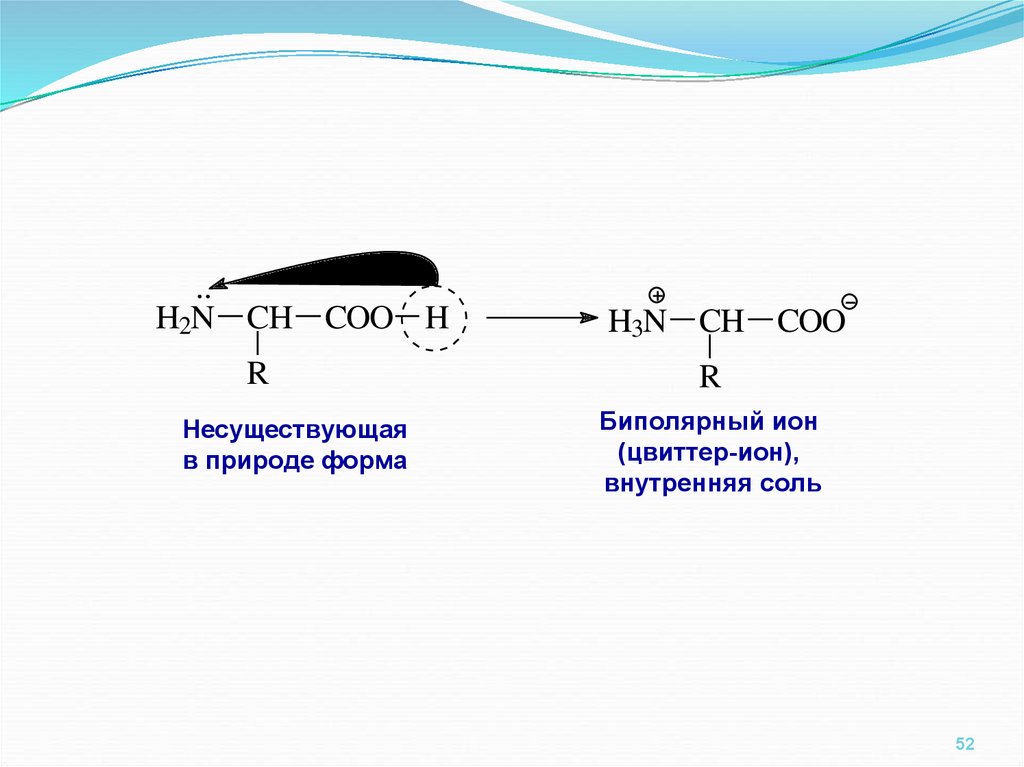
5051. Химические свойства аминокислот
5152.
H2N CH COO HH3N CH COO
R
Несуществующая
Несуществующая
в природе
природеформа
форма!
в
R
Биполярный
ионион
Биполярный
(цвиттер-ион),
(цвиттер-ион),
внутренняя соль
внутренняя соль
52
53.
Кислотно-основные свойстваpH 1 Заряд +1
pH 7 Заряд 0
Катионная форма
Цвиттерион (нейтральный)
pH 13 Заряд -1
Анионная форма
53
54.
1)NH2 – CH2 – COOH + НС| → [NH3 – CH2 – COOH ] С|
как основание
2)
NH2 – CH2 – COOH + Na OH → NH2 – CH2 – COONa + H2O
как кислота
54
55.
Химические свойстваопределяемые карбоксильной
группой
Образование эфиров
R CH COOH + CH3OH
NH2
HCl (сухой)
-H2O
NH3
R CH COOCH3
R CH COOCH3
-NH4Cl
NH3+ClNH2
метиловый эфир
-аминокислоты
Э. Фишер (1901)
55
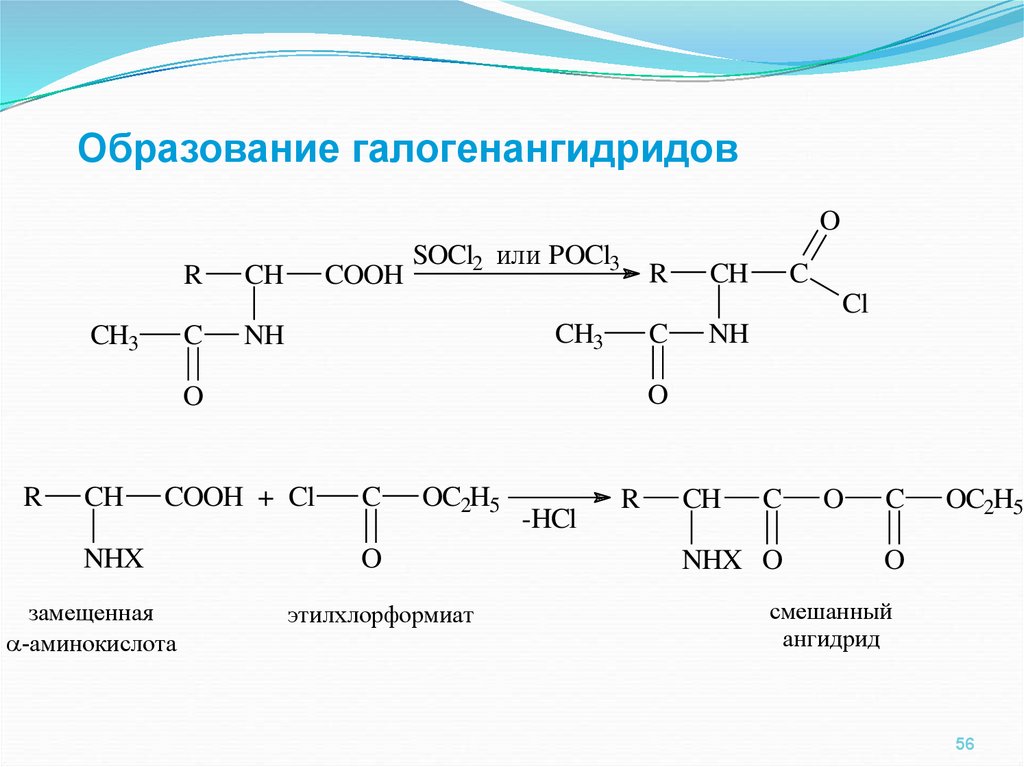
56.
Образование галогенангидридовO
R
CH
COOH
SOCl2 или POCl3
R
CH
C
Cl
CH3
C
CH3
NH
C
O
O
R
CH
COOH + Cl
NHX
замещенная
-аминокислота
NH
C
OC2H5
O
этилхлорформиат
-HCl
R
CH
C
NHX O
O
C
OC2H5
O
смешанный
ангидрид
56
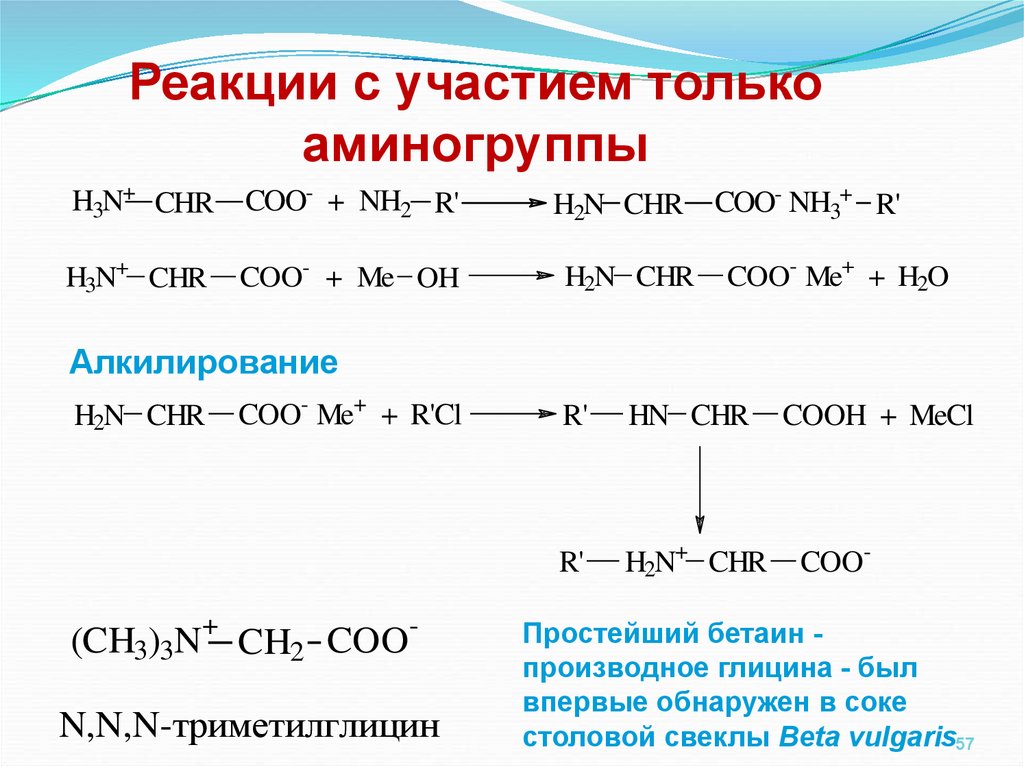
57.
Реакции с участием толькоаминогруппы
H3N+ CHR
COO- + NH2 R'
H3N+ CHR
COO- + Me OH
H2N CHR
H2N CHR
COO- NH3+ R'
COO- Me+ + H2O
Алкилирование
H2N CHR
+
COO- Me+ + R'Cl
(CH3)3N CH2 COO
-
N,N,N-триметилглицин
R'
HN CHR
R'
H2N+ CHR
COOH + MeCl
COO-
Простейший бетаин производное глицина - был
впервые обнаружен в соке
столовой свеклы Beta vulgaris57
58.
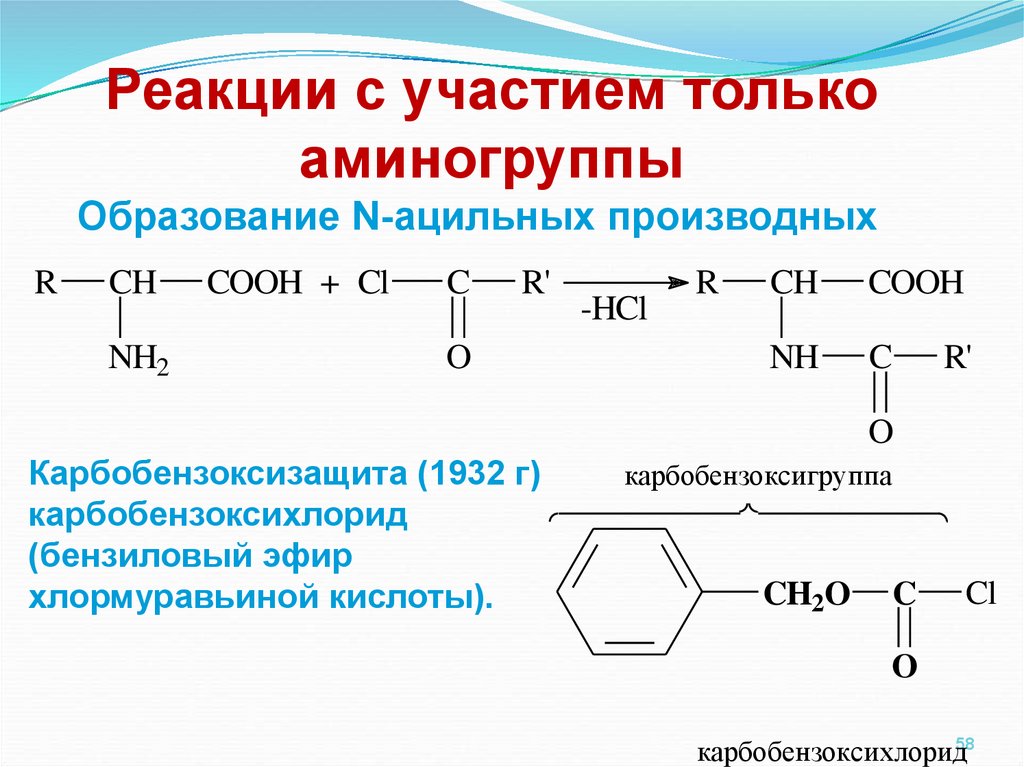
Реакции с участием толькоаминогруппы
Образование N-ацильных производных
R
CH
NH2
COOH + Cl
C
R'
O
-HCl
R
CH
COOH
NH
C
R'
O
Карбобензоксизащита (1932 г)
карбобензоксихлорид
(бензиловый эфир
хлормуравьиной кислоты).
карбобензоксигруппа
CH2O
C
Cl
O
карбобензоксихлорид58
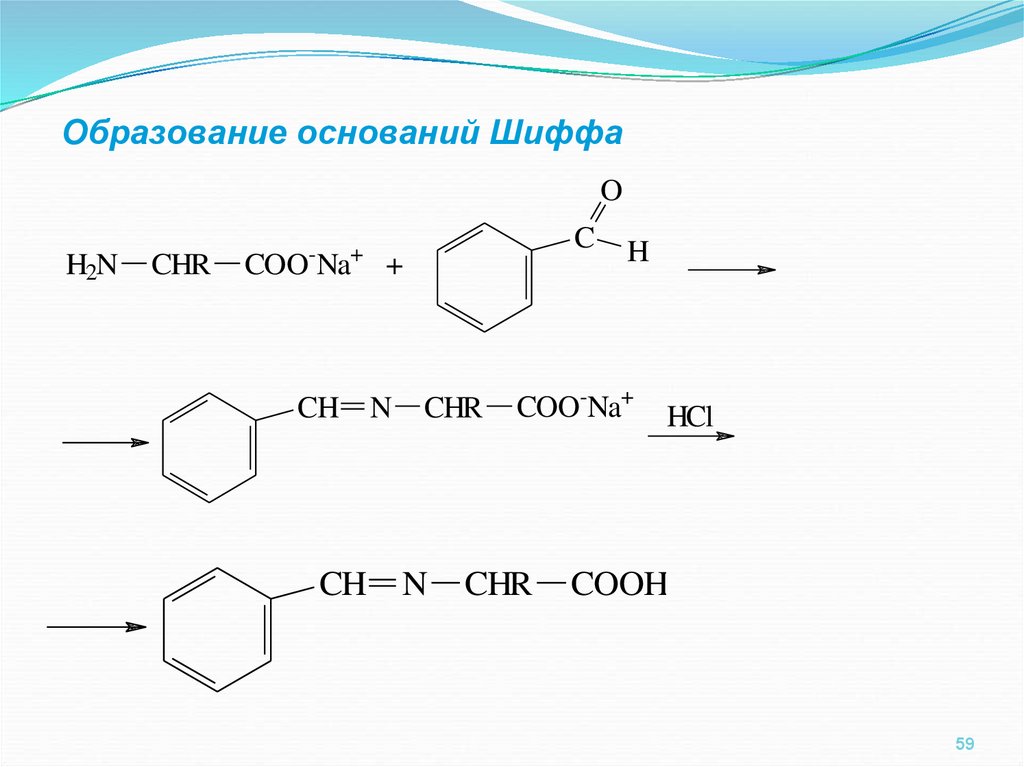
59.
Образование оснований ШиффаO
H2N
CHR
-
+
COO Na
CH
CH
C
+
N
CHR
N
H
COO-Na+
CHR
HCl
COOH
59
60.
Образование оснований ШиффаCH
N
CH
N
и т.д.
60
61. Биологически значимые реакции
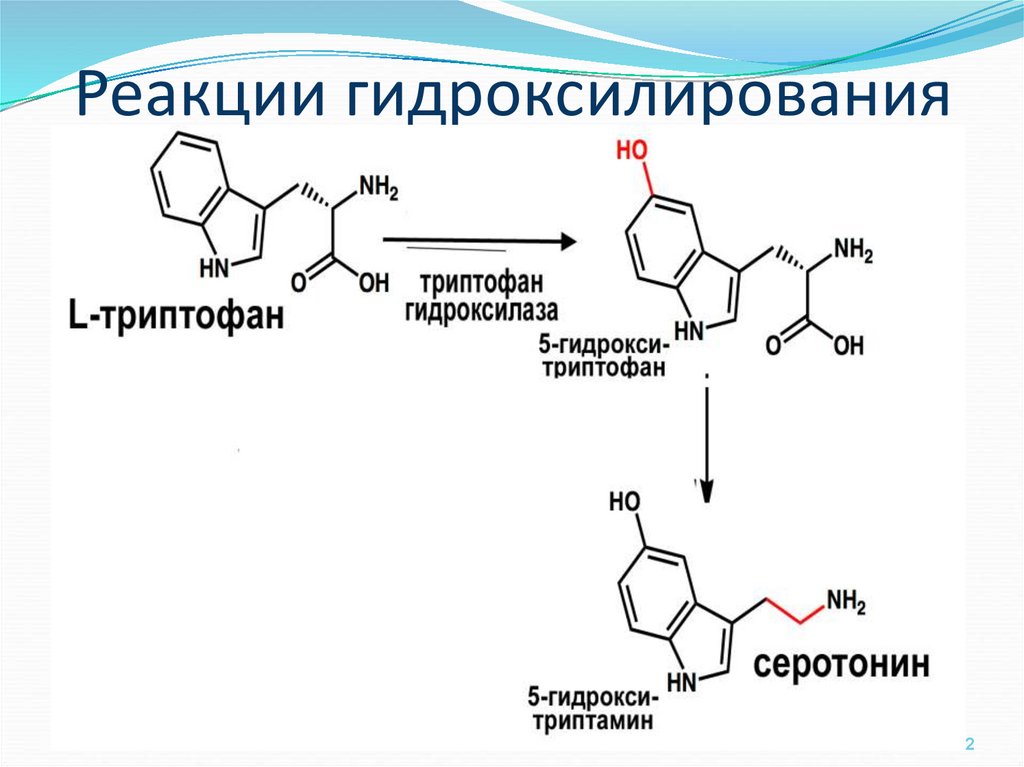
6162. Реакции гидроксилирования
6263.
Дезаминирование аминокислотOH
H3N+ CHR
COO- + HNO2
RCH
COOH + N2 + H2O
Метод Ван-Слайка
А. Внутримолекулярное дезаминирование
R
CH2 CH
COO-
R
CH
CH
COOH + NH3
NH3+
(таким образом у некоторых микроорганизмов и высших
растений аспарагиновая кислота превращается в
фумаровую)
63
64.
Б. Восстановительное дезаминированиеNH3+ CHR
COO- + 2H+
CH2 COOH + NH3+
R
(у некоторых микроорганизмов )
В. Гидролитическое дезаминирование
NH3+ CHR
COO- + H2O
R
CH COOH
OH
(тип дезаминирования, характерный для
микроорганизмов)
64
65.
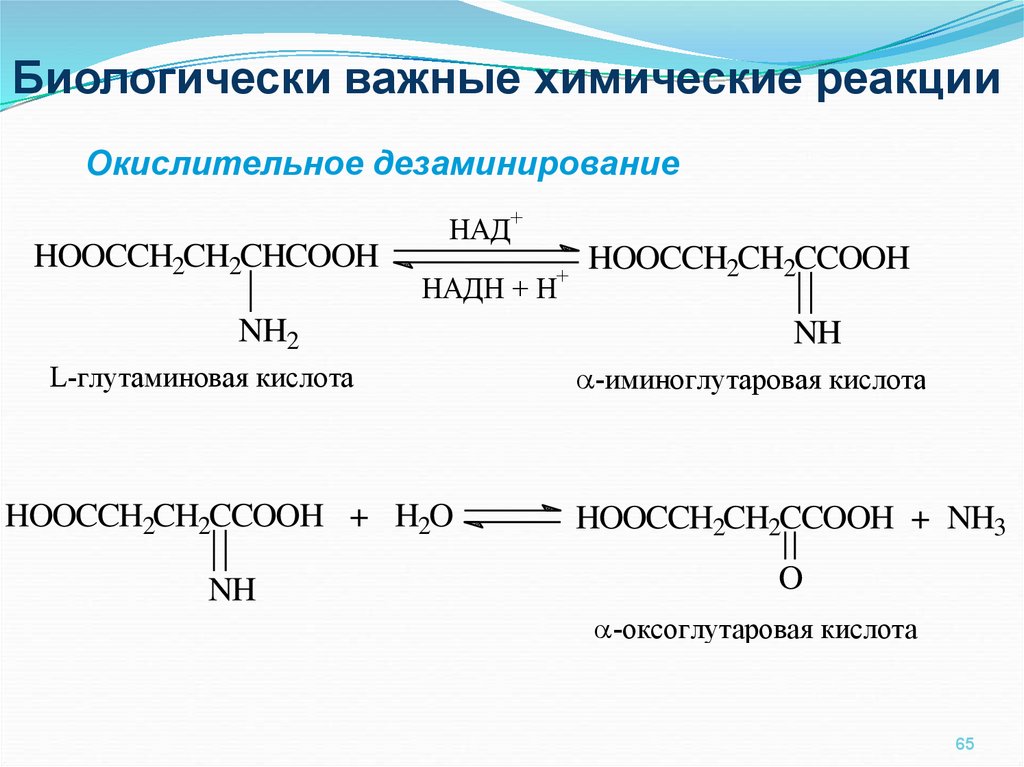
Биологически важные химические реакцииОкислительное дезаминирование
+
HOOCCH2CH2CHCOOH
НАД
+
НАДН + Н
NH2
L-глутаминовая кислота
HOOCCH2CH2CCOOH
NH
-иминоглутаровая кислота
HOOCCH2CH2CCOOH + H2O
HOOCCH2CH2CCOOH + NH3
NH
O
-оксоглутаровая кислота
65
66.
Биологически важные химические реакцииДекарбоксилирование
-OOC
CH
Декарбоксилаза
+ пиридоксальфосфат
+
NH3
RCH2NH2 + CO2
R
-аминокислота
амин
66
67. Биологически важные химические реакции
Декарбоксилирование в организмеДекарбоксилирование
глютаминовой
кислоты приводит к
образованию
у-аминомасляной
кислоты
67
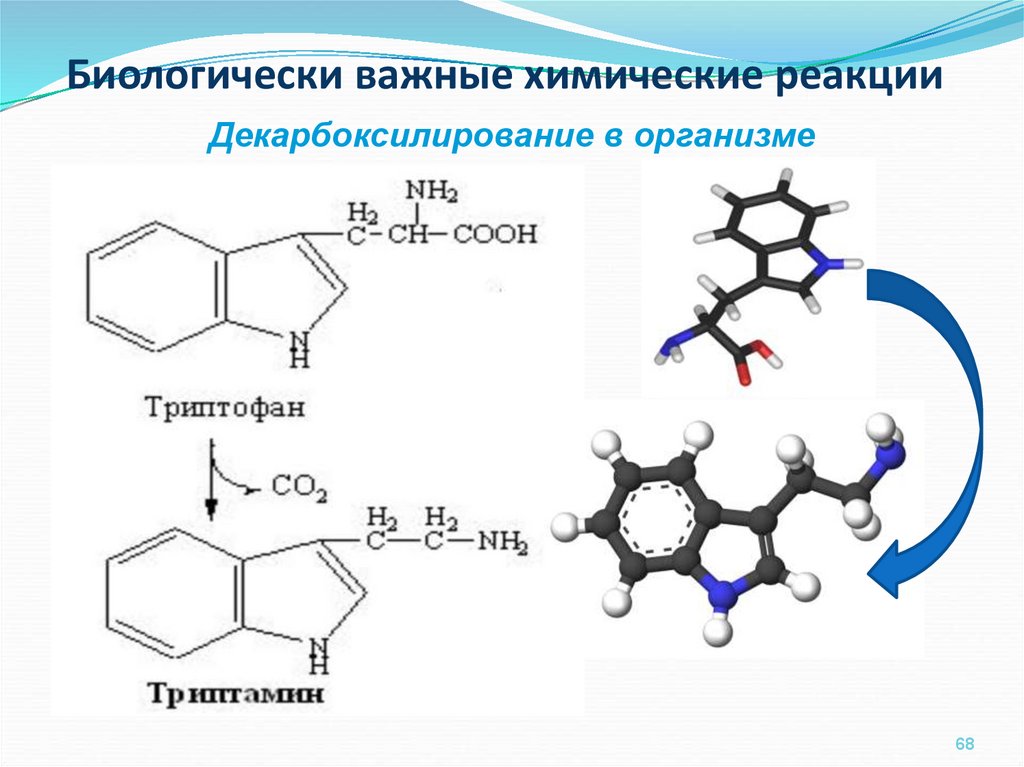
68. Биологически важные химические реакции
Декарбоксилирование в организме68
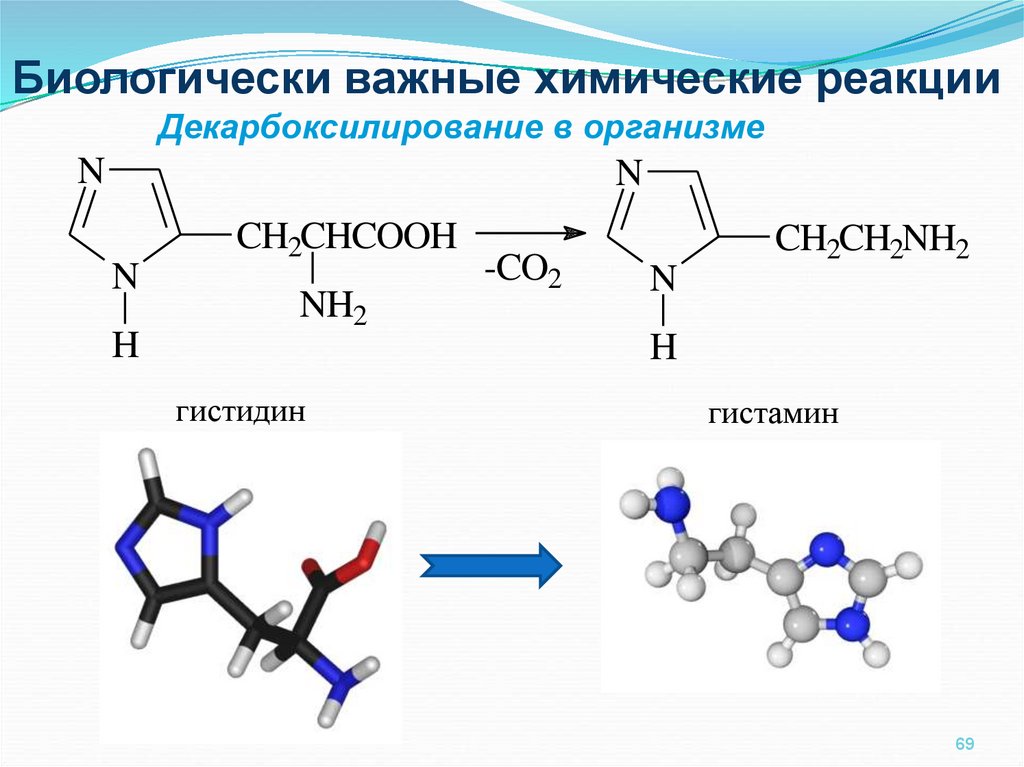
69.
Биологически важные химические реакцииДекарбоксилирование в организме
N
N
N
H
CH2CHCOOH
NH2
-CO2
N
CH2CH2NH2
H
гистидин
гистамин
69
70.
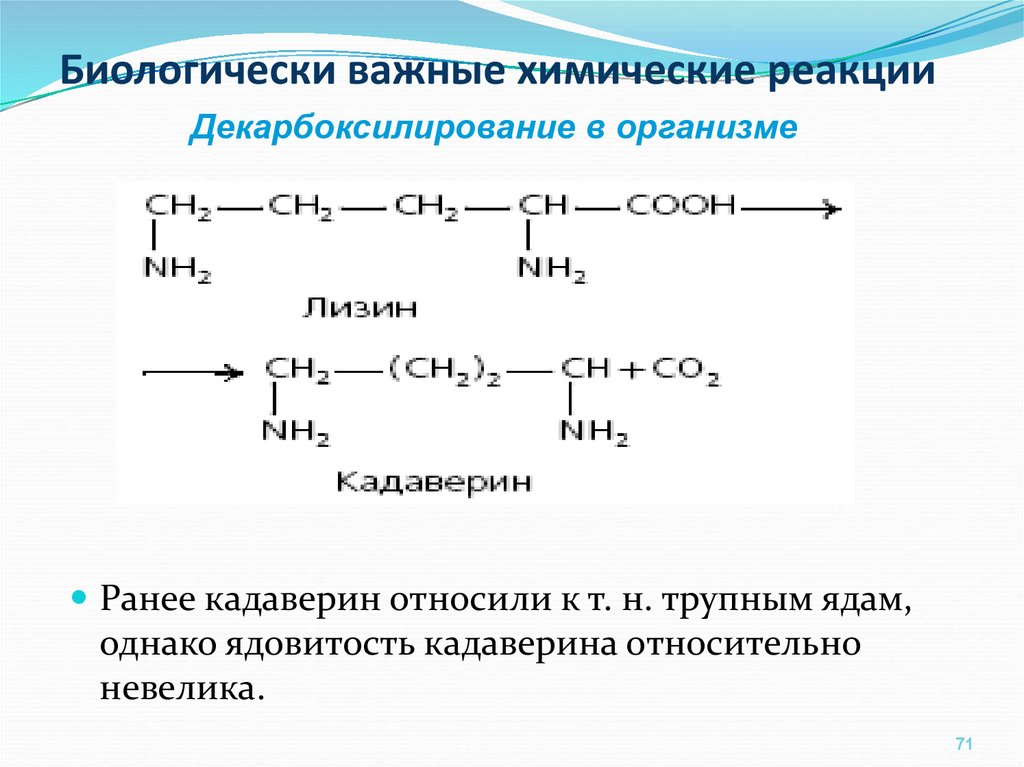
7071. Биологически важные химические реакции
Декарбоксилирование в организмеРанее кадаверин относили к т. н. трупным ядам,
однако ядовитость кадаверина относительно
невелика.
71
72.
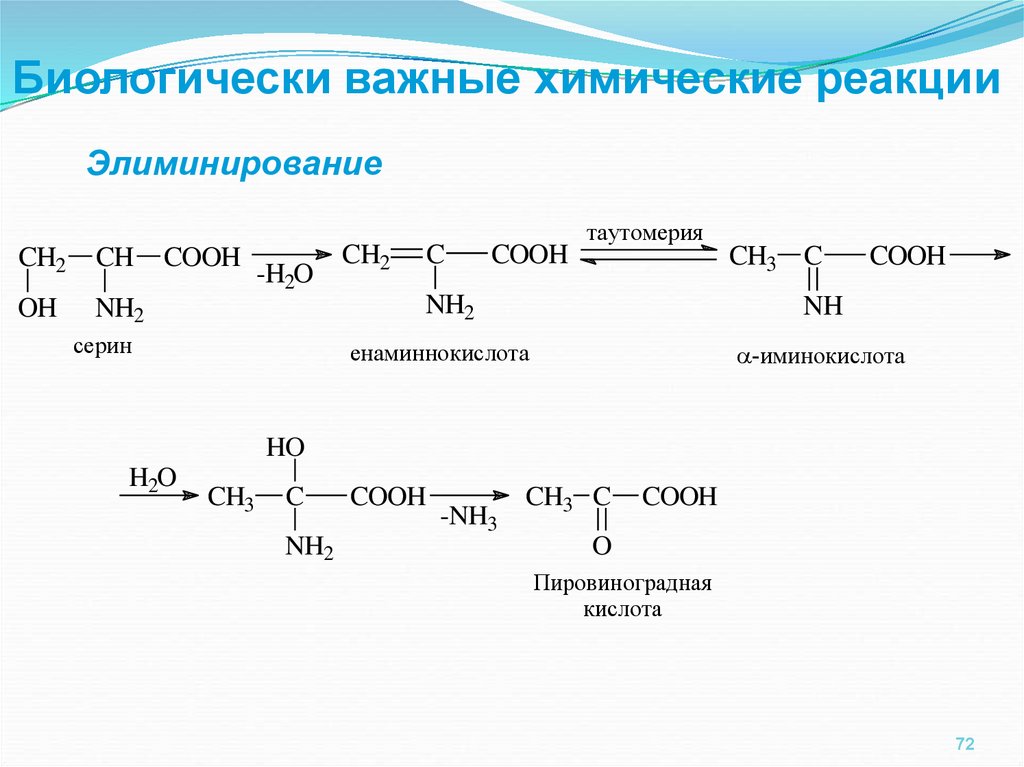
Биологически важные химические реакцииЭлиминирование
CH2
CH
OH
NH2
COOH
-H2O
CH2
C
COOH
таутомерия
CH3 C
NH2
серин
COOH
NH
енаминнокислота
-иминокислота
HO
H2O
CH3
C
NH2
COOH
-NH3
CH3 C
COOH
O
Пировиноградная
кислота
72
73.
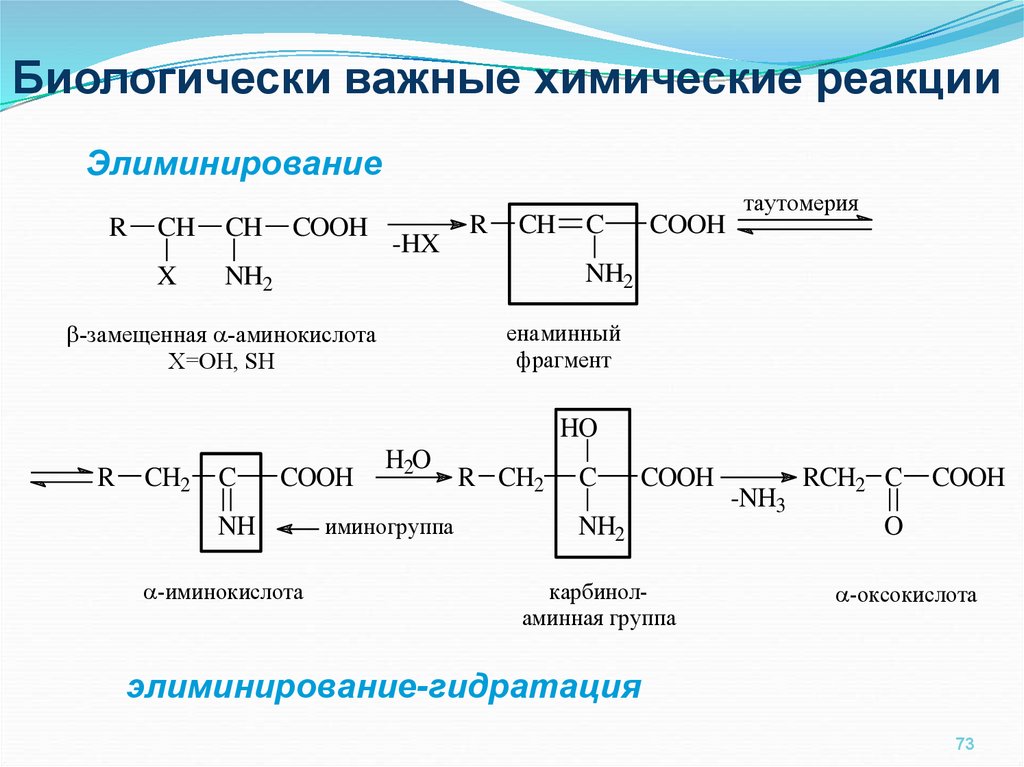
Биологически важные химические реакцииЭлиминирование
R
CH
CH
X
NH2
COOH
-HX
R
CH
C
COOH
таутомерия
NH2
-замещенная -аминокислота
X=OH, SH
енаминный
фрагмент
HO
R
CH2
C
COOH
NH
-иминокислота
H2O
иминогруппа
R CH2
C
COOH
NH2
карбиноламинная группа
-NH3
RCH2 C
COOH
O
-оксокислота
элиминирование-гидратация
73
74.
Биологически важные химические реакцииАльдольное расщепление
H
HOCH2 CH
NH3+
серин
COO-
CH2 COO- +
NH3+
глицин
C
O
H
формальдегид
74
75.
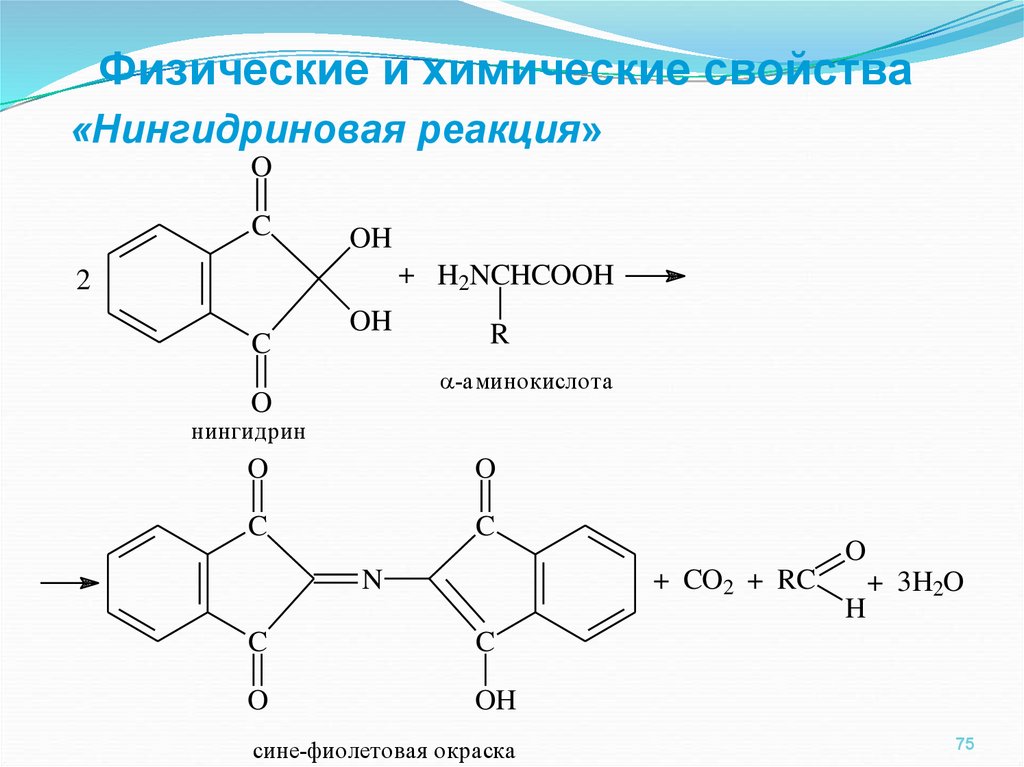
Физические и химические свойства«Нингидриновая реакция»
O
C
OH
+ H2NCHCOOH
2
C
OH
R
-аминокислота
O
нингидрин
O
O
C
C
N
O
+ CO2 + RC
C
C
O
OH
сине-фиолетовая окраска
H
+ 3H2O
75



































 Химия
Химия








