Похожие презентации:
Химическая связь
1. Химическая связь
к.х.н., доц. Губанов Александр Иридиевич2. Что читать?
Чупахин А. П. Общая химия. Химическая связь и строение вещества.Карапетьянц М. Х., Дракин С. И. Общая и неорганическая химия.
Ахметов Н. С. Общая и неорганическая химия.
Глинка Н.Л. Общая химия.
3. Сближение атомов
Образование молекулярной орбиталив результате перекрывания двух 1s-АО:
а — распределение электронной
плотности;
Перекрывание 1s-АО
б — МО
при сближении атомов водорода
4. Кулоновские силы
При сближении двух атомов водорода электрон атома Aпритягивается к ядру атома B, а электрон атома B к ядру атома A. Это
взаимодействие
электростатическое,
то
есть
сила
притяжения F описывается уравнением Кулона
Потенциальная энергия E этого процесса
5. Силы в природе
Гравитационное взаимодействие
Слабое ядерное взаимодействие
Электромагнитное взаимодействие
Сильное ядерное взаимодействие
• При сближении ядер «включается»
сильное ядерное заимодействие E ̴ 1/r9
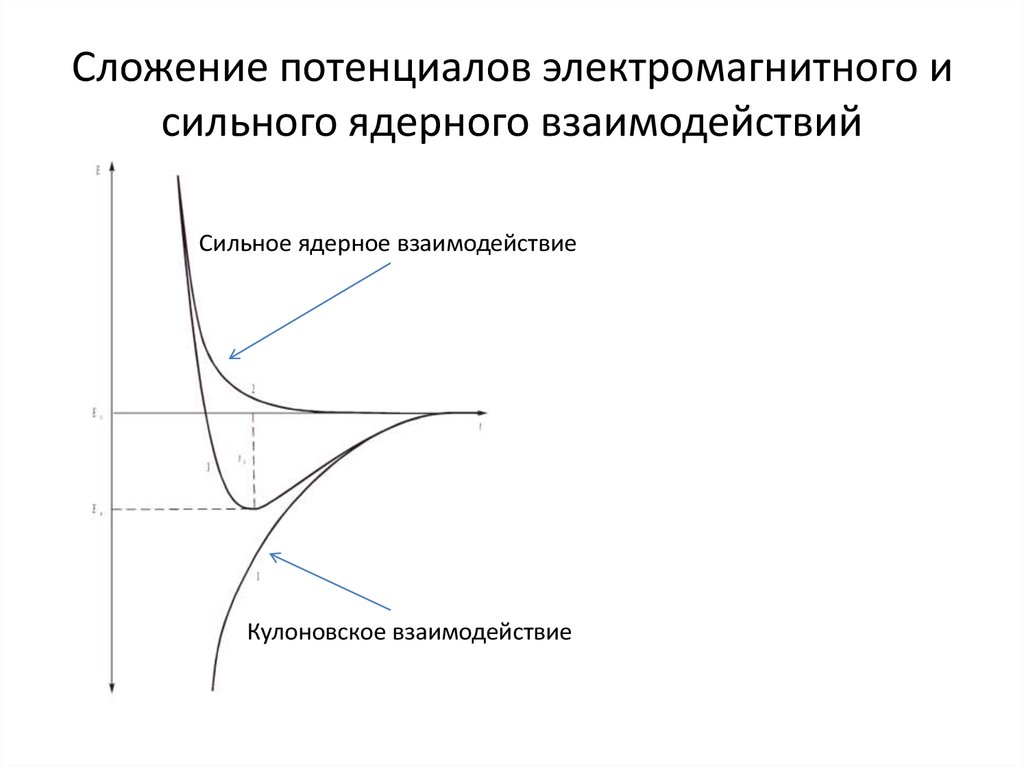
6. Сложение потенциалов электромагнитного и сильного ядерного взаимодействий
Сильное ядерное взаимодействиеКулоновское взаимодействие
7. Уравнение Шредингера
энергия связи молекулы водорода длясостояний с параллельными и
антипараллельными спинами; б распределение электронной плотности в
молекуле водорода для состояний с
антипараллельными и параллельными
спинами.
8. Диаграмма сближения атомов водорода
9. Химическая связь
• Химическая связь это энергетическивыгодное взаимодействие атомов,
приводящие к образованию устойчивых
групп атомов (молекул).
• Взаимодействия, скрепляющие в единое
целое молекулы, полимеры (а часто –
кристаллы и жидкости,), принято называть
химической связью.
10. Молекула
– Молеќ ула (новолат. molecula, уменьшительноеот лат. moles — масса) — электрически
нейтральная частица, образованная из двух
или более связанных ковалентными связями
атомов частица, образованная из двух или
более
связанных
ковалентными
связями атомов
11. Таблица типов связи
Тип связейКовалентная
Нековалентная
Ионная
Металлическая
Чем
характеризуется
Обобществление
электронов
Полный переход
электрон(а/ов)
Обобществление
всех электронов
На что похоже
Кооперация
Грабеж
Коммунизм
Что образуется в
результате
Молекулы
Твердые тела
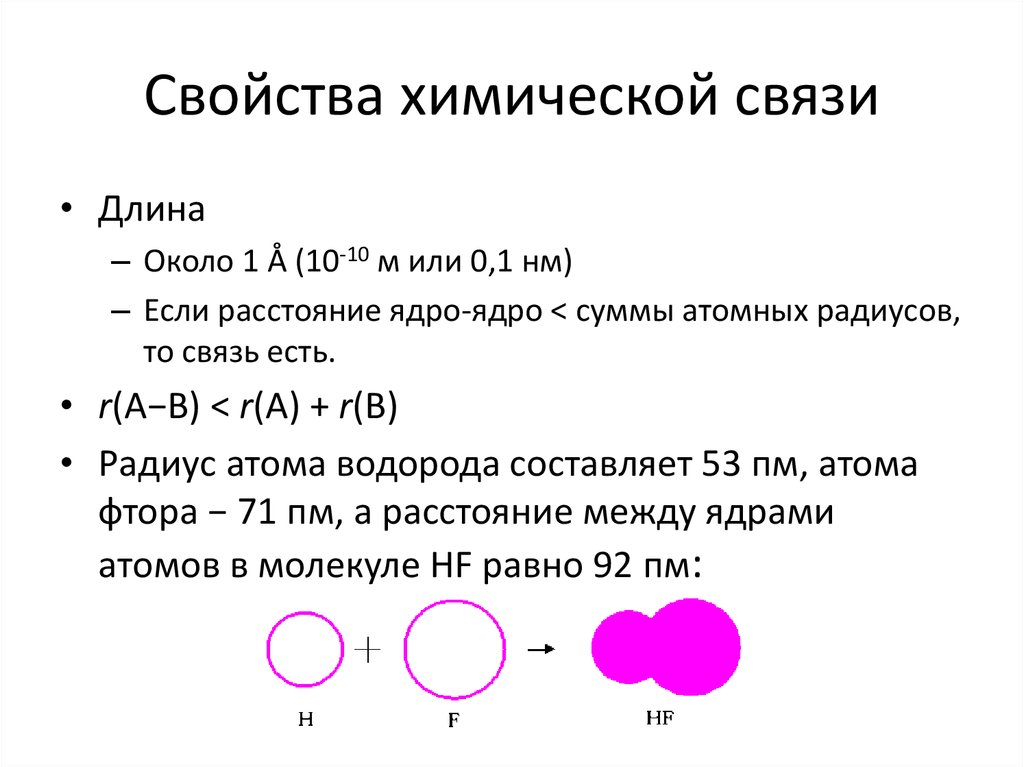
12. Свойства химической связи
• Длина– Около 1 Å (10-10 м или 0,1 нм)
– Если расстояние ядро-ядро < суммы атомных радиусов,
то связь есть.
• r(A−B) < r(A) + r(B)
• Радиус атома водорода составляет 53 пм, атома
фтора − 71 пм, а расстояние между ядрами
атомов в молекуле HF равно 92 пм:
13.
• Прочность– энергия гомолитического разрыва.
гомо AB → А + В
гетеро AB → А+ + Вот 200 до 1000 кДж/моль
• Полярность.
– Смещение электронной плотности в сторону
одного из атомов
14. Ковалентные связи
• Ковалентные химические связи обычно образуютсяпри обобществлении принадлежащих
первоначально разным атомам неспаренных
электронов с различными спинами:
–
– или
– или
А↑+ ↓В
А· + ·В
А· + ·В
=
=
=
А↑↓В
А··В,
А–В.
• Вступающие в связь атомы как бы обмениваются
электронами – такой механизм образования
ковалентной связи называется обменным.
15. Ковалентные связи
• Донорно-акцепторный механизм образованияковалентной связи когда один из пары
образующих связь атомов предоставляет пару
электронов (донор), а другой принимаетее
(акцептирует), предоставляя для этого вакантную
АО:
–
–
А↑↓ +
А:
+
□В
□В
= А↑↓В
= А··В
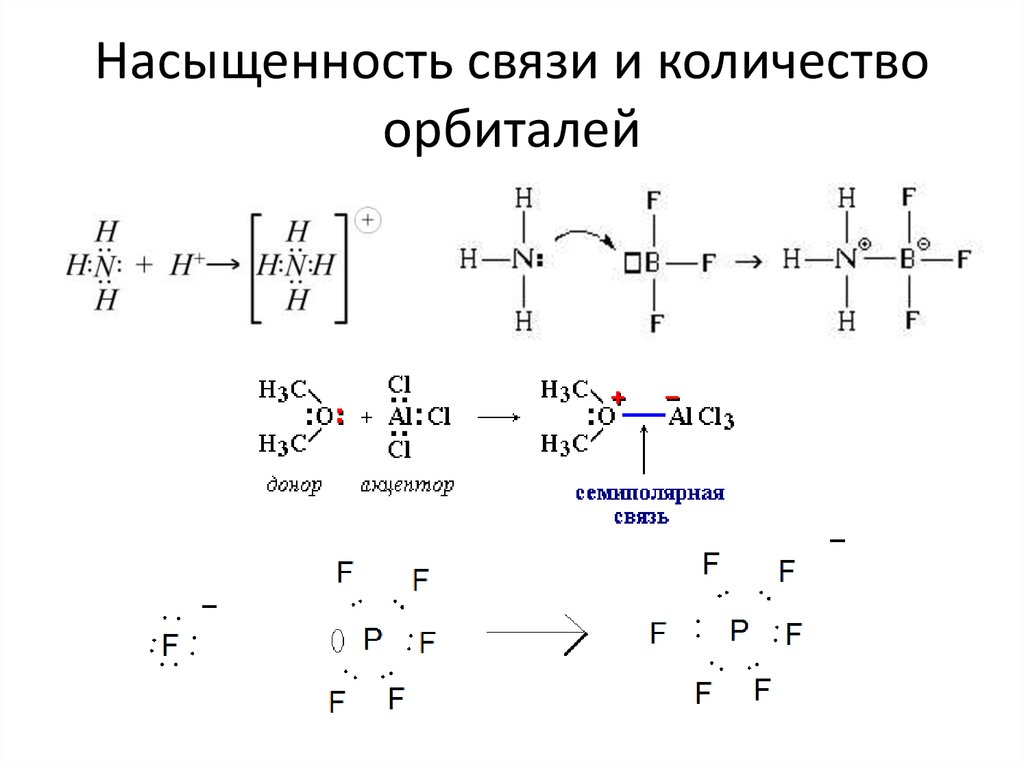
16. Примеры донорно-акцепторной связи
• H3O+ H2O : + □ H+ = H3O+• Все комплексные (координационные) соединения
основаны на взаимодействии между акцепторами –
катионами (часто d-элементов) и такими донорами НП,
как Н2О,NН3, Cl− , С2О42− : [Cr(H2O)6]3+, [Cu(NH3)4]2+,
[Co(NH3)5Cl]2+, [AlF6]3− и др.
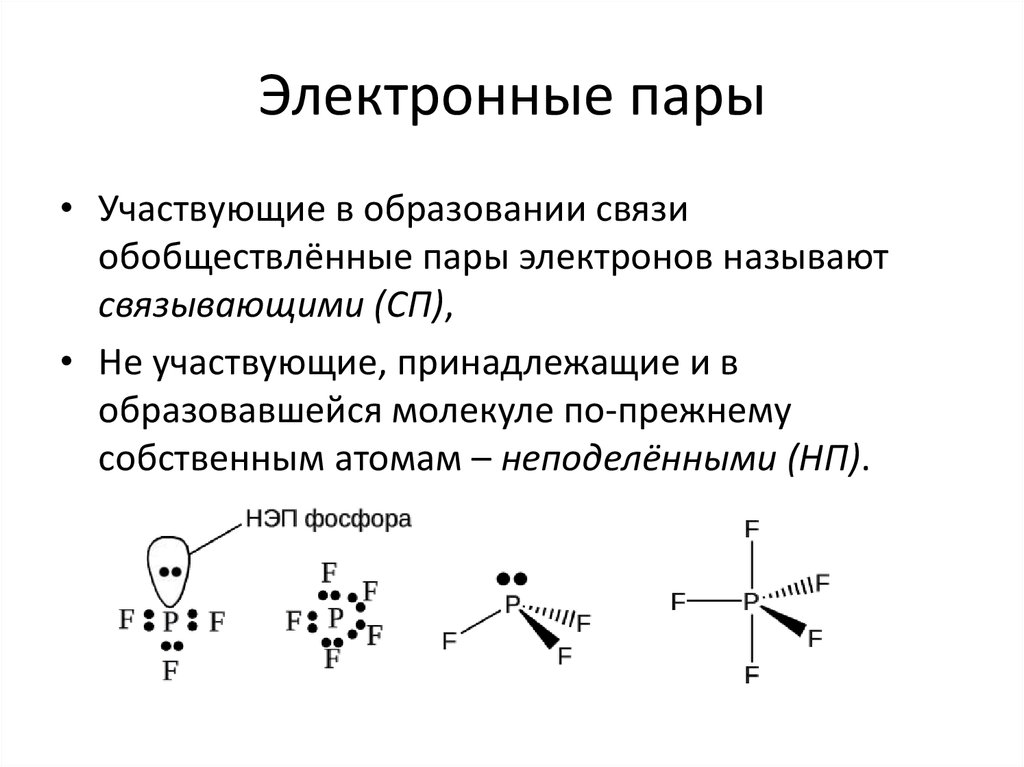
17. Электронные пары
• Участвующие в образовании связиобобществлённые пары электронов называют
связывающими (СП),
• Не участвующие, принадлежащие и в
образовавшейся молекуле по-прежнему
собственным атомам – неподелёнными (НП).
18. Электронные пары
19. Радикалы
• Частицы с неспаренными электронаминазываются радикалами.
• Примеры радикалов: Н·, Сl·, ·ОН, ·СН3.
• Стабильные радикалы редки, из
неорганических отметим ·NO и ·NО2.
20. Электронные формулы
• Электроны изображаются точками21. Структурные формулы
• Химические связи (связывающие электронныепары) обозначается черточками.
22. Стехиометрические формулы
• В стехиометрических формулах, (HCl, BCl3,H2O, H2S2, SO32– ит. п.), указан только состав
частицы или химического соединения.
23. Формулы
ЭлектроныЭлектронная
Структурная
Стехиометрическая
Электроны
указываются
точками
СП указываются
черточками
-
НП не
указываются
Формулой
устанавливается
строение,
химический
состав, НП
строение и
химический
состав
химический состав
(заряд частицы)
24. Химическое соединение
• Химическое соединение – вещество, состоящееиз разных элементов в определенных
соотношениях, т.е. имеющее определенный
химический состав
• Вещества, состоящие из атомов одного
элемента, называют простыми веществами
(например, двухатомный кислород О2, озон
О3; алмаз, графит, карбин, фуллерены –
различные модификации углерода, С).
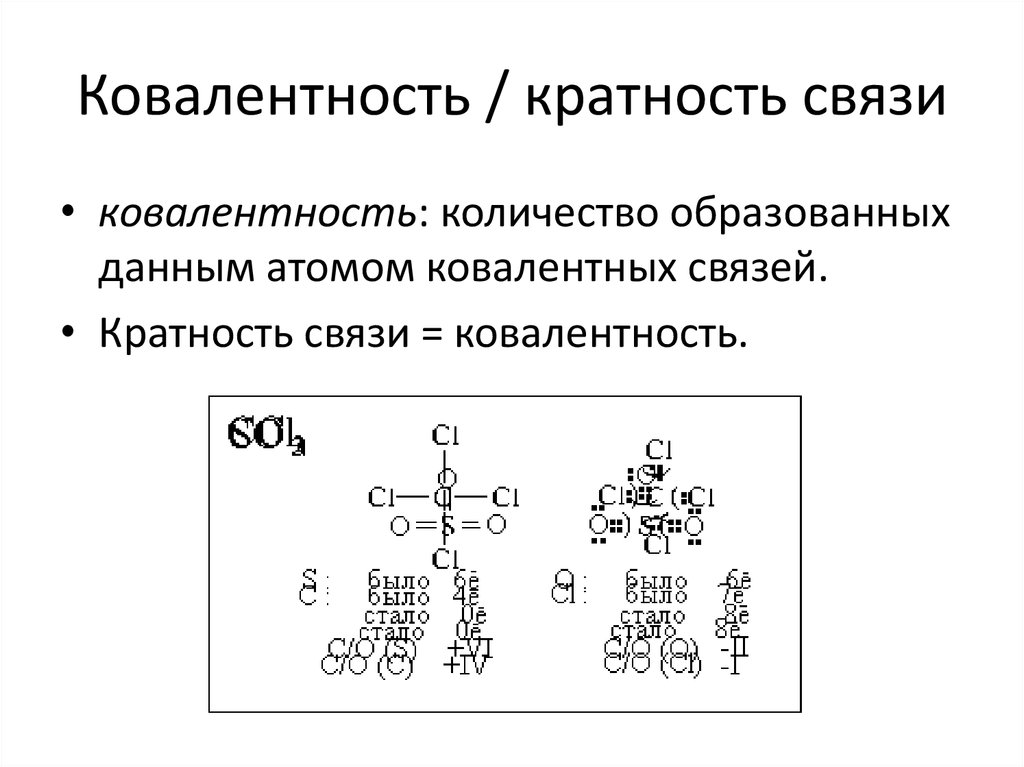
25. Ковалентность / кратность связи
• ковалентность: количество образованныхданным атомом ковалентных связей.
• Кратность связи = ковалентность.
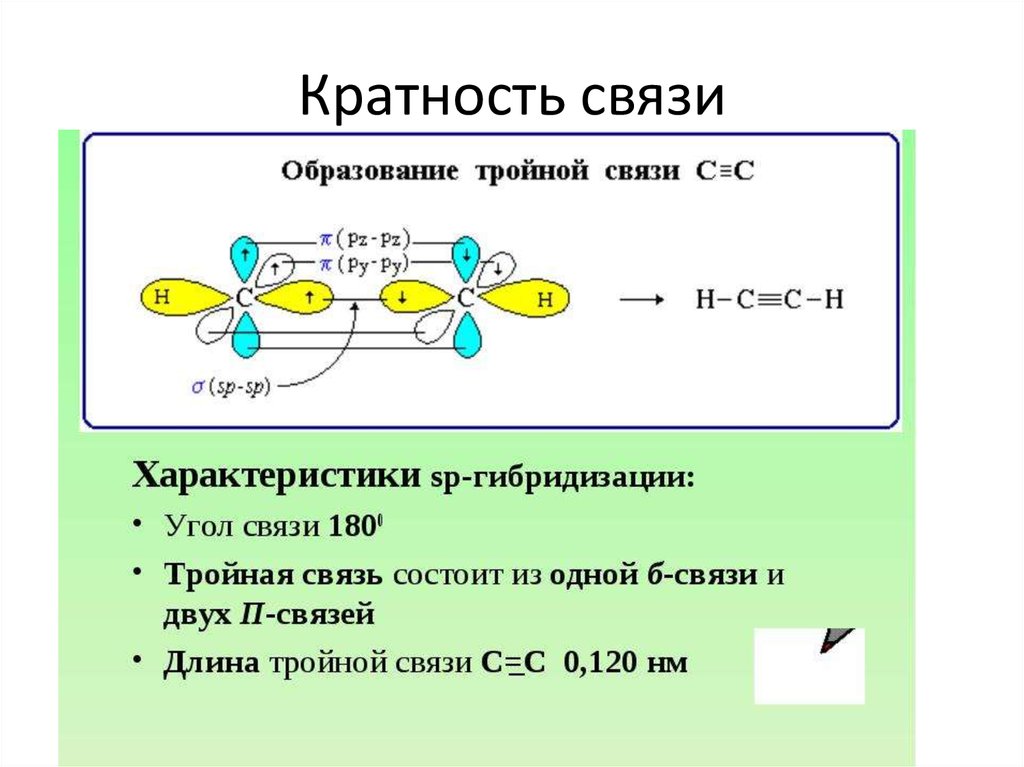
26. Кратность связи
• Откуда так много электронов между атомами?• Сигма- и пи- связи (Ϭ- и π-)
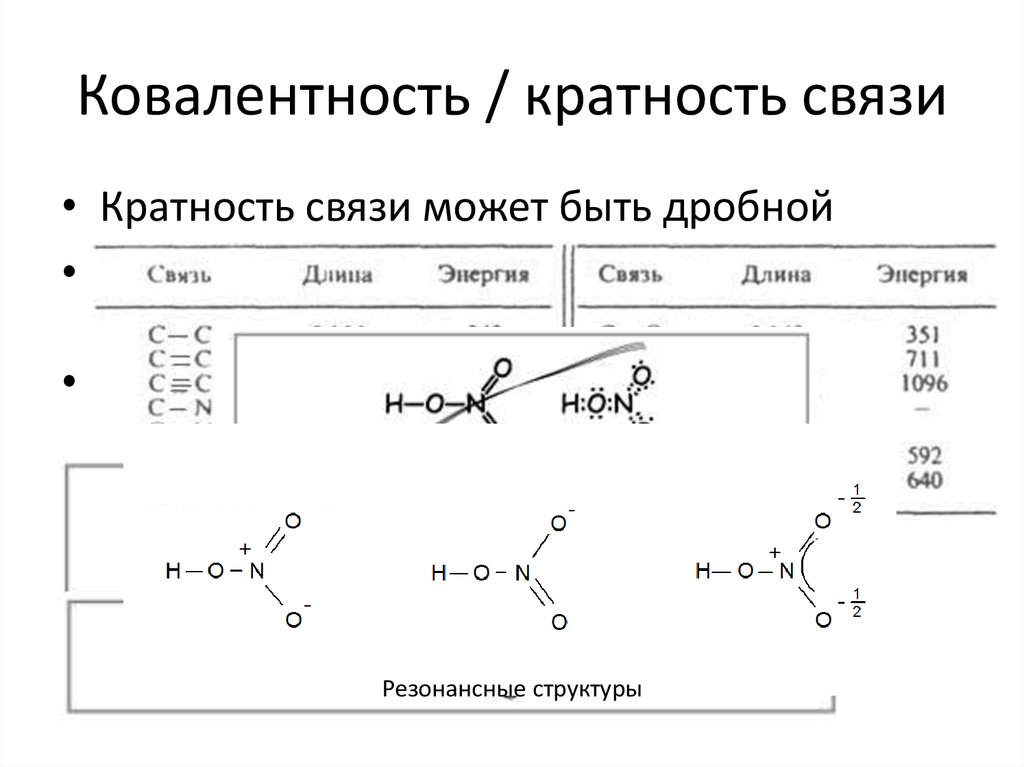
27. Ковалентность / кратность связи
• Кратность связи может быть дробной• H2+
H • H+
H … H+
• HNO3
Резонансные структуры
28. Сопряжение связей
• Сопряжение в частицах СО2, N2О, ВО33− наоснове резонанса
29. Насыщенность связи
• Насыщенность связи - максимальновозможная ковалентность/кратность.
Определяется:
– количеством орбиталей. Взаимодействие
орбиталей крайне необходимо для
образования хим. связи.
– количеством электронов.
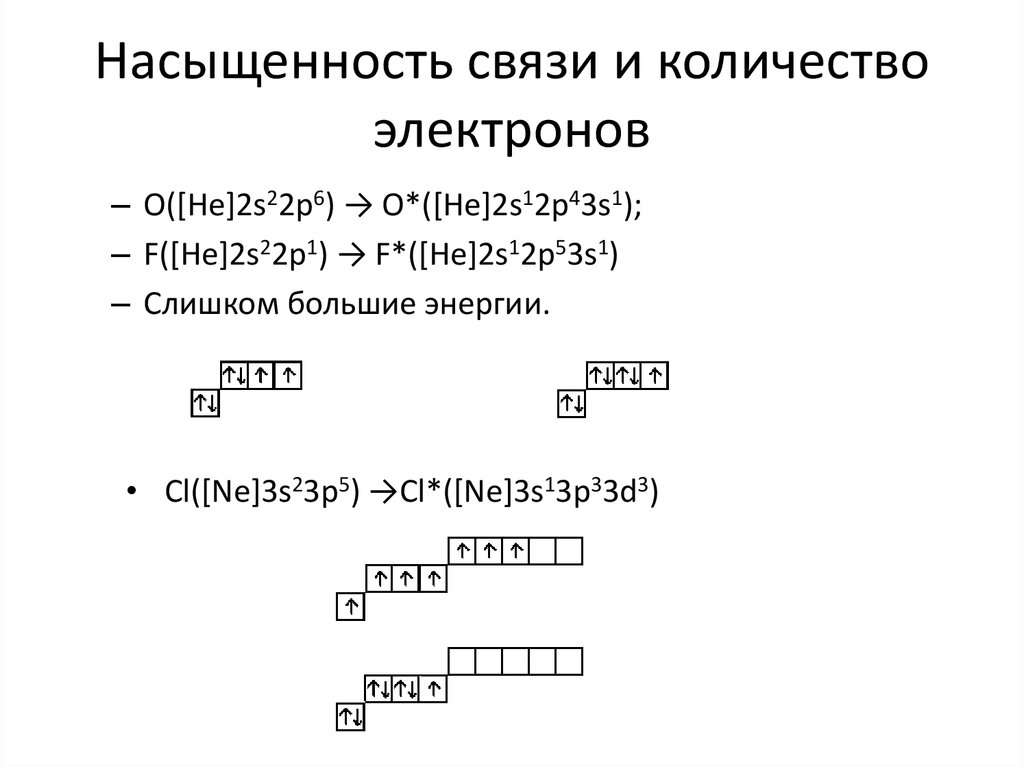
30. Насыщенность связи и количество электронов
• Переход электронов на более высокие уровни(промотирование):
– Be([He]2s2) → Be*([He]2s12p1);
– B([He]2s22p1) → B*([He]2s12p2);
– С([He]2s22p2) →С*([He]2s12p3)
31. Насыщенность связи и количество электронов
• N([He]2s22p3) →N*([He]2s12p33s1)Нужно много энергии.
Да и валентность 1.
32. Насыщенность связи и количество электронов
• P([Ne]3s23p3) →P*([Ne]3s13p33d1)33. Насыщенность связи и количество электронов
– O([He]2s22p6) → O*([He]2s12p43s1);– F([He]2s22p1) → F*([He]2s12p53s1)
– Слишком большие энергии.
• Cl([Ne]3s23p5) →Cl*([Ne]3s13p33d3)
34. Насыщенность связи и количество орбиталей
35. КЧ
• Количество ближайших к выделенномуатому соседних атомов (ближайших
соседей) называют координационным
числом(КЧ).
• Для частиц с ковалентными связями КЧ
равно числу σ-связей.
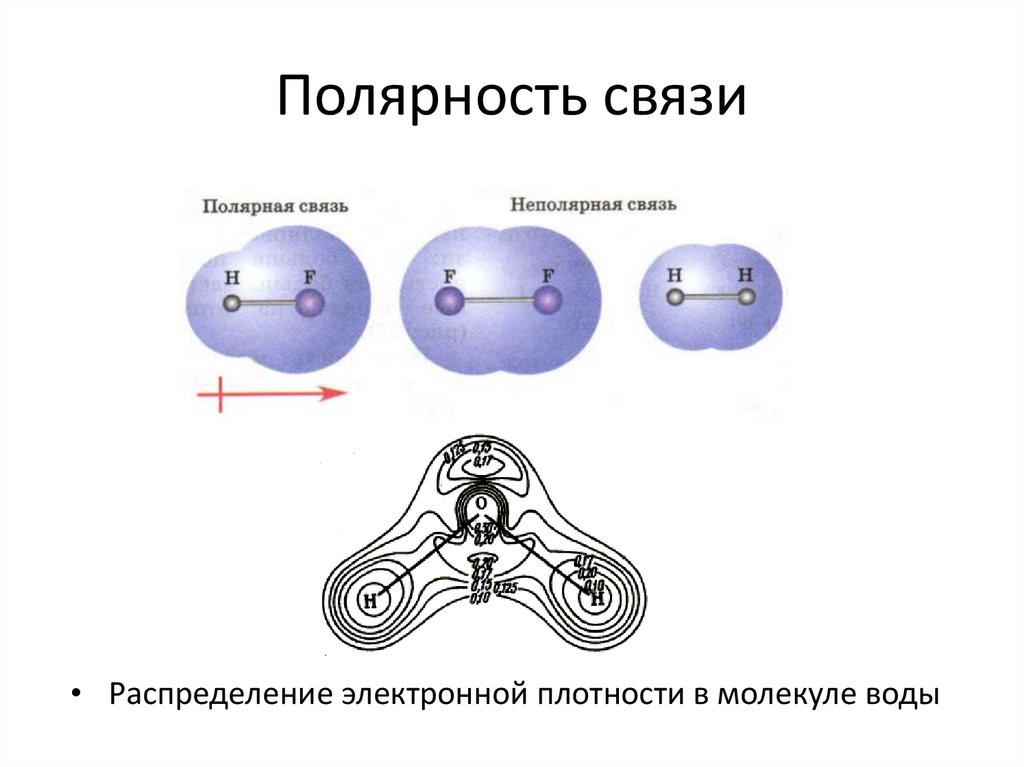
36. Полярность связи
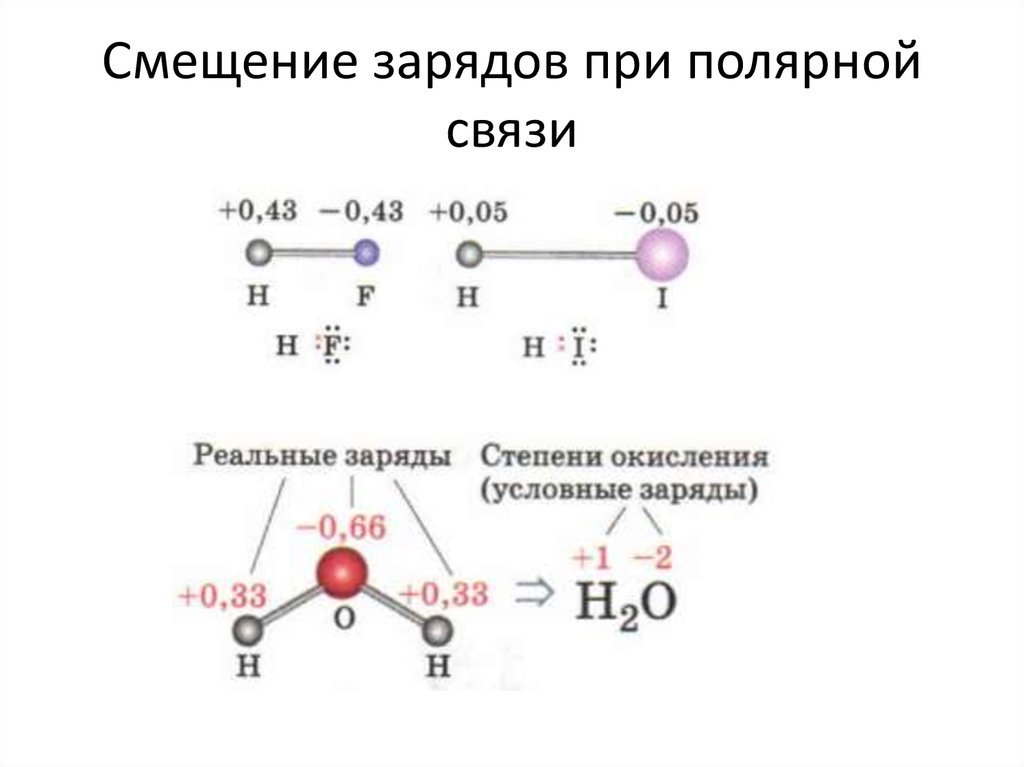
• Распределение электронной плотности в молекуле воды37. Смещение зарядов при полярной связи
38. Электроотрицательность
• Кто у кого забирает электроны?• Электроотрицательность (ЭО) это свойство атомов
оттягивать на себя электронную плотность при
образовании ковалентной связи.
• Существует несколько количественных шкал ЭО.
• По Малликену, ЭО = (IА+ ЕА)/2, где IА – энергия ионизации и
ЕА – сродство к электрону
Второй
период
ЭО
Li
Be
B
C
N
O
F
1,0
1,5
2,0
2,5
3,0
3,5
4,0
Третий период Na
Mg
Al
Si
P
S
Cl
ЭО
1,2
1,5
1,8
2,1
2,5
3,0
0,9
Электроотрицательность атомов элементов по Полингу
39. Степень окисления
• Степень окисления (СО) – условный заряд атома всоединении, если считать все связи полностью
ионными.
• Степень окисления (СО) – условный заряд, который
бы возник на атоме в случае полного перехода
электронов при образовании связи.
• С использованием степени окисления записывается
последовательность элементов в химических
формулах, названия соединений, уравниваются
окислительно восстановительные реакции.
• Именно соотношение ЭО атомов определяет CO.
40. СО
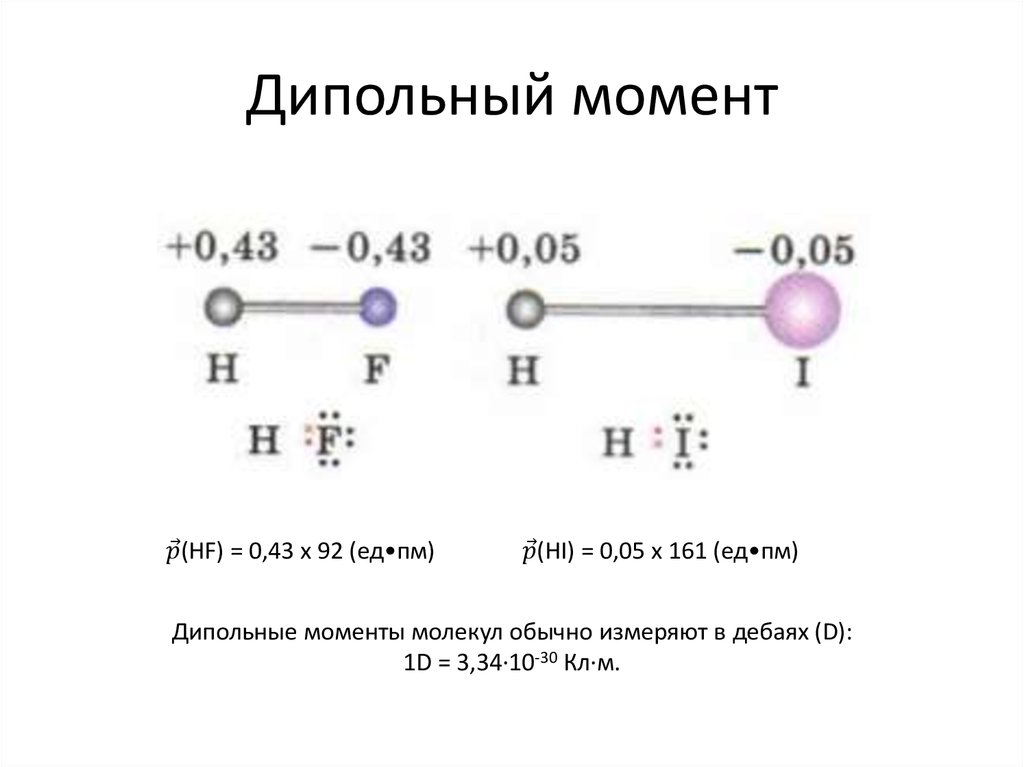
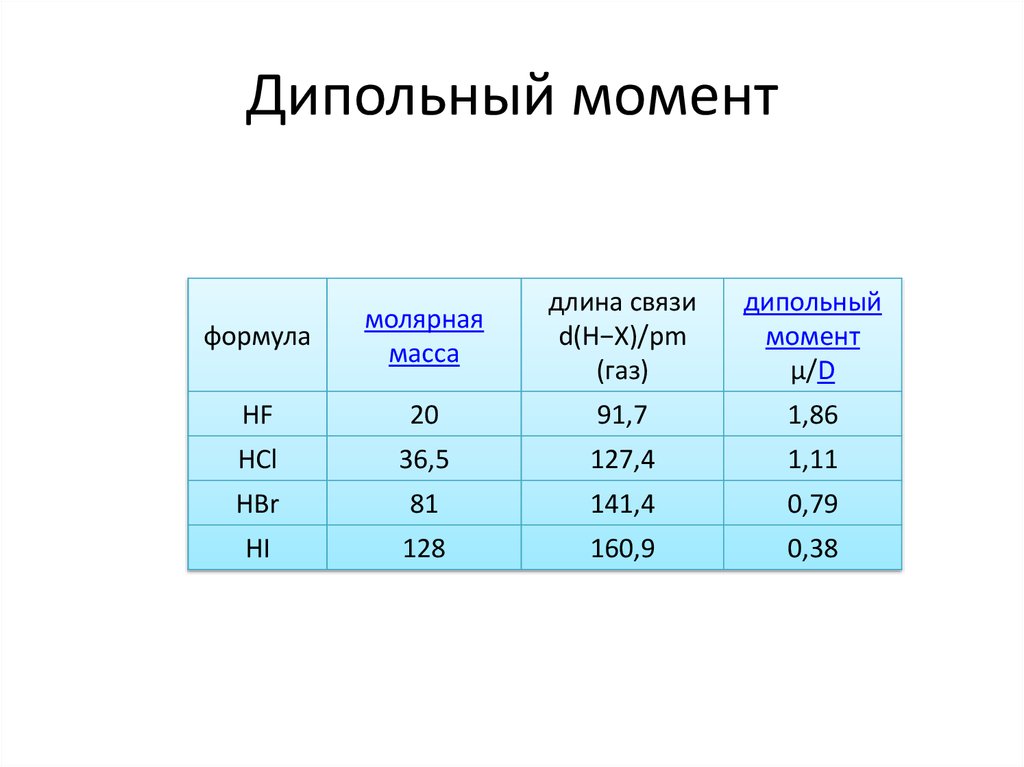
41. Дипольный момент
• Электри́ческий ди́польный моме́нт —векторная
физическая
величина,
характеризующая, электрические свойства
системы заряженных частиц в смысле
создаваемого ею поля и действия на нее
внешних полей.
•































 Химия
Химия








