Похожие презентации:
Растворы. Свойства растворов не электролитов и электролитов
1.
Растворы. Свойстварастворов
не электролитов
и электролитов.
2.
Растворы – этомакроскопически однородные
смеси двух или большего числа
веществ (компонентов),
образующие
термодинамически
равновесные системы.
Растворитель – это…
Растворенное вещество -
3. Пример: Вода – это растворитель, если растворить твердое вещество (глюкозу) или газ (СО2 ). - А если спирт и вода? - Если 3 % раствор спирта, то ра
* Пример:Вода – это растворитель, если
растворить твердое вещество
(глюкозу) или газ (СО2 ).
- А если спирт и вода?
- Если 3 % раствор спирта, то
растворитель вода, если 90 % раствор
спирта, то растворитель спирт, если
50 % раствор спирта, то есть право
выбора растворителя.
Самым распространенным
растворителем на Земле является
вода.
4. Содержание и распределение воды в организме человека
*Содержание и распределениеводы в организме человека
~ 60 % от общей массы тела человека
составляет вода. (На 70 кг приходится
45 л воды).
70%
всей воды организма
внутриклеточная
30% внеклеточная
Их состав сильно отличается :
5.
ВеществоВнутриклеточная
жидкость
Внеклеточная
жидкость
Na+
10 ммоль/л
140 ммоль/л
К+
140 ммоль /л
4 ммоль /л
Са2+
0,1 ммоль /л
2,5 ммоль /л
Mg2+
30 ммоль /л
1,5 ммоль /л
С1–
4 ммоль /л
100 ммоль /л
НСО3–
10 ммоль /л
27 ммоль /л
РO43–
60 ммоль /л
2 ммоль /л
Глюкоза
0 1 ммоль /л
5,5 ммоль /л
Белок
16 г /дл
2 г /дл
6.
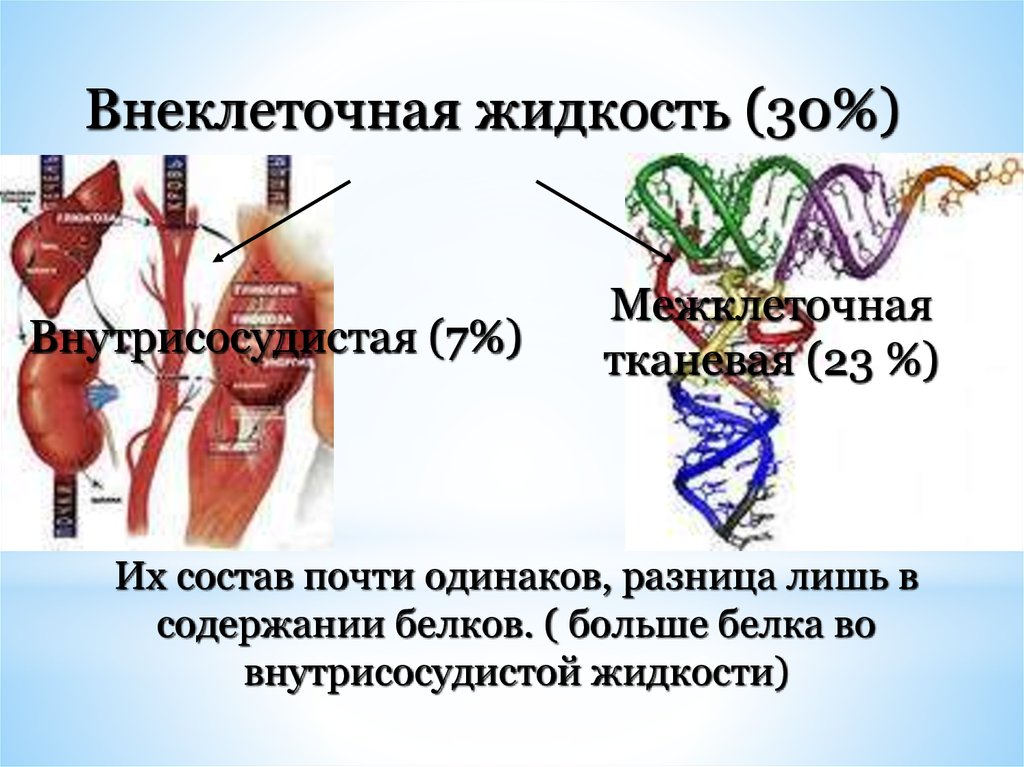
Внеклеточная жидкость (30%)Внутрисосудистая (7%)
Межклеточная
тканевая (23 %)
Их состав почти одинаков, разница лишь в
содержании белков. ( больше белка во
внутрисосудистой жидкости)
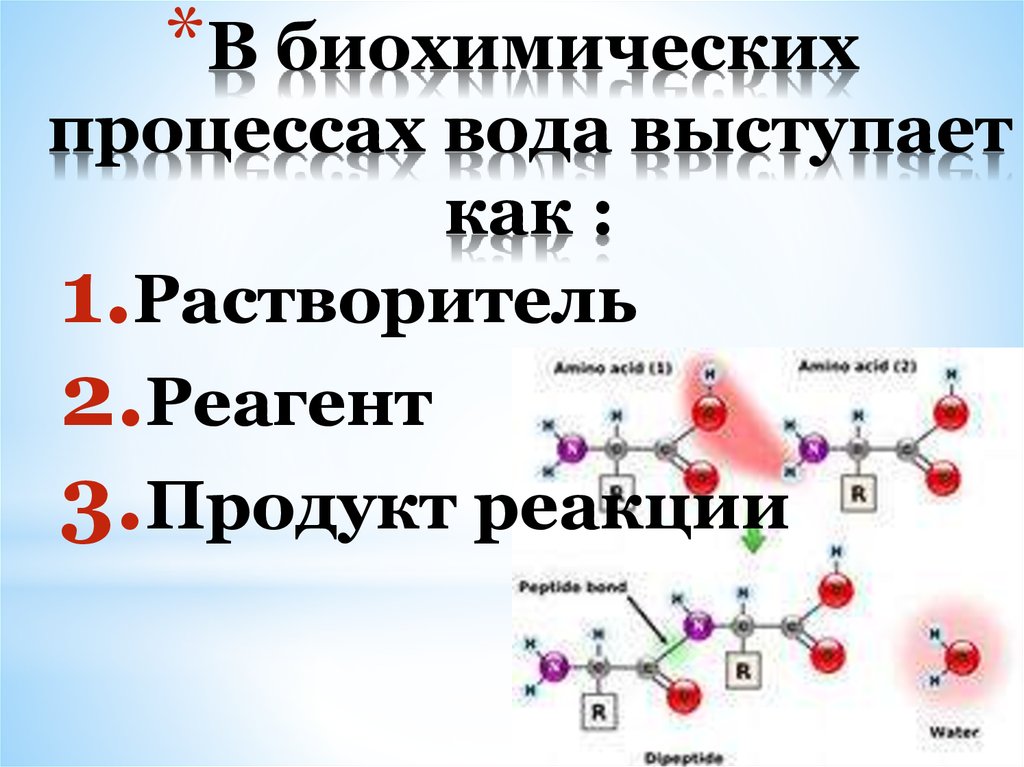
7. В биохимических процессах вода выступает как :
*В биохимическихпроцессах вода выступает
как :
1.Растворитель
2.Реагент
3.Продукт реакции
8. Вода- универсальный растворитель
Существование межмолекулярныхводородных связей определяет аномальные
физические свойства воды:
1. Высокая теплоемкость -…
2. Высокая температура кипения
3. Большая теплота испарения
4. Высокое поверхностное натяжение
5. Низкая вязкость
6. Более высокая плотность в жидком
состоянии, чем в твердом .
7. Высокая диэлектрическая
проницаемость (ε = 80)
9.
Н2О – универсальныйрастворитель, наличие
аномальных свойств ее играет
важную физиологическую и
биологическую роль.
Биохимические процессы в
организме протекают в водных
растворах или при ее (воды)
участии как реагента и
продукта реакции.
10. «Вода! У тебя нет ни вкуса, ни цвета, ни запаха, тебя не опишешь, тобой наслаждаешься, не понимая, что ты такое. Ты не просто необходима для жиз
«Вода! У тебя нет ни вкуса,ни цвета, ни запаха, тебя не
опишешь, тобой
наслаждаешься, не
понимая, что ты такое. Ты
не просто необходима для
жизни, ты и есть жизнь.»
Антуан де Сент-Экзюпери
11. Термодинамика процесса растворения
Растворение – процесссамопроизвольный, поэтому
∆Gрастворения < 0.
Gрастворения = ∆Н растворения –Т ∆Sрастворения
∆
12. Энергетическая характеристика растворения
1. Рассмотрим растворение твердого вещества сионной связью в воде.
∆Н растворения = ∆Н фаз. перехода + ∆Н гидратации
> 0
< 0
Разрушение к.р. –
эндотермический процесс
Образование хим. связи
–экзотермический
процесс
13.
1. Если |∆Н ф. п. |> |∆Н гидр. |,то ∆Н растворения > 0, эндо-процесс,
раствор охлаждается (КNO3, NH4NO3)
2. Если |∆Н ф. п. |<|∆Н гидр. |,
то ∆Н растворения < 0, экзо-процесс,
раствор нагревается (NaOH )
Т.о. при растворении тв./ж.
0 < ∆ Н растворения < 0
14. Энтропийная характеристика растворения
∆Sрастворения = ∆S фаз. перехода + ∆S гидратации>> 0
< 0,
т.к. уменьшается
число частиц в
единице объёма
Т.о., |∆S ф. п. |> |∆S гидр. |, поэтому
∆Sрастворения тв. вещ-в > 0
15.
2. Рассмотрим растворениегазообразного вещества в воде.
Обычно ∆Sрастворения газов < 0,
∆Gрастворения = ∆Н растворения – Т ∆Sрастворения
∆Нрастворения=∆G растворения + Т ∆Sрастворения
∆Gраств. < 0 и ∆Sраств. < 0 ;
∆Н растворения газов < 0
16. Реальные и идеальные растворы
∆Н р-ния = 0, ∆Gр-ния =– Т ∆Sр-ния∆Sр-ния >0
17. Коллигативные свойства растворов
*1. осмотическое давление
2. понижение давления насыщенного пара
растворителя над раствором по сравнению с
давлением насыщенного пара растворителя
над чистым растворителем.
3. повышение температуры кипения раствора по
сравнению с температурой кипения чистого
растворителя
4. понижение температуры замерзания раствора
по сравнению с температурой замерзания
чистого растворителя.
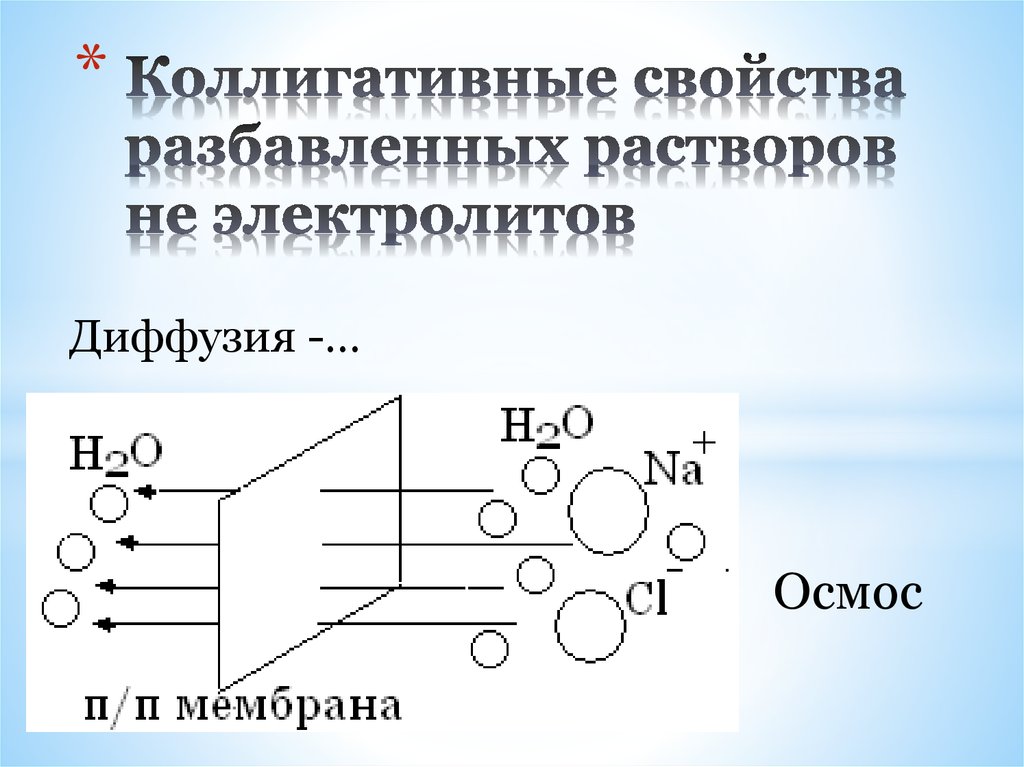
18. Коллигативные свойства разбавленных растворов не электролитов
*Диффузия -…
Осмос
19.
давлениеп/п мембрана
Уровень
жидкости
повысится
Н2О
Конц.
раствор
Разб.
раствор
20.
В 1886 г. Вант-Гофф экспериментальноустановил, что
Р осм. =СМRT – уравнение Вант-Гоффа.
СM
nв
V р ра
mв
М V р ра
[ моль / л]
моль
Дж
,
Т
К
,
R
8
,
31
,
3
м
моль K
моль
Дж
Дж Н м Н
К
2 Па ( Паскаль)
3
3
3
м
моль К
м
м
м
если С М
то
Росм.
1м3 = 1000 л; 1Па =10-3 кПа
СМ= моль/л, Росм.= кПа.
21.
если R 0,082л атм.
моль К
моль
, СМ
, Т К,
л
то Росм. атм.
Росм.
nв
V р ра
RT
Росм. V р ра nв RT
РVгаза= nRT
уравнение Менделеева-Клапейрона.
22.
Закон Вант-Гоффа: «Осмотическое давлениераствора равно тому давлению, которое
оказывало бы растворенное вещество, если бы
оно, находясь в газообразном состоянии
занимало бы объем равный объему раствора.»
Пример: 1 моль/л раствор С6Н12О6 . Чему равно
Росм?
Росм.
nв
V р ра
1 0,082 273
RT
22,4 атм.
1
mв
Росм.
RT
М в V р ра
чем М, тем ↓ Р осм.
(белки)
23. Осмос и осмотические явления в биологических системах
*Осмос и осмотическиеявления в биологических
системах
1.
распределение воды между
внутриклеточной жидкостью и
внеклеточной
2.
распределение воды между сосудистым
руслом и внесосудистым пространством.
Осмолярность - … моль/л
Осмоляльность - … моль/ кг
(определяется криометрией)
р-ля
24.
Для плазмы крови осмоляльность = 292 ммоль/кг.Она обусловлена:
1. низкомолекулярными веществамиэлектролитами: соли Na+, K+, Mg2+ , Ca2+ .
2. низкомолекулярными веществами не
электролитами: глюкоза, мочевина.
3. ВМС – белки.
25.
Форменные элементыкрови на Росм. не влияют.
Р осм. внутри и вне клетки
одинаково, т.е. осмоляльность
внутриклеточной жидкости
равна осмоляльности плазмы
крови ~ 292 ммоль /кг Н2О.
Такое состояние – изоосмия.
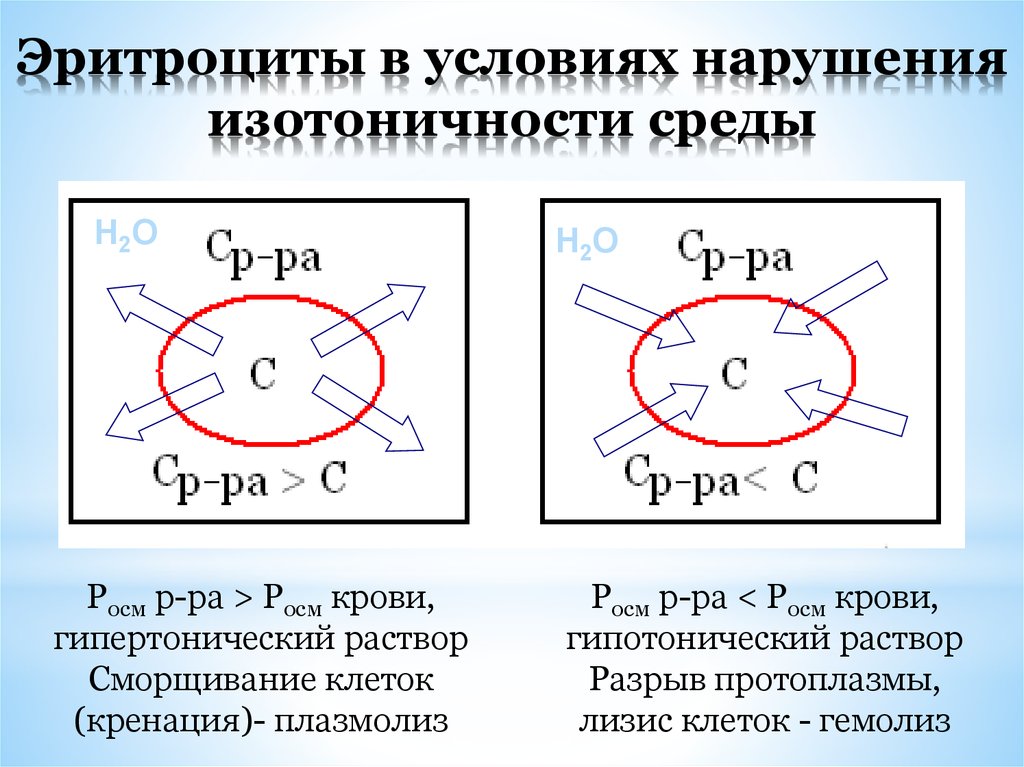
26. Эритроциты в условиях нарушения изотоничности среды
Н2ОРосм р-ра > Росм крови,
гипертонический раствор
Сморщивание клеток
(кренация)- плазмолиз
Н2О
Росм р-ра < Росм крови,
гипотонический раствор
Разрыв протоплазмы,
лизис клеток - гемолиз
27.
Если раствор имеет Росм одинаковое склеткой, то это изотонический раствор.
При кровопотерях вводят растворы
изотоничные плазме крови.
Это 0,85-0,9 % (0,15 моль/л) NaCl ;
5% (0,3 моль/л) С6Н12О6
Физиологический раствор:
1. р-р Рингера- Локка - в 1л:
глюкоза 1,0 г , NaCl 9,0 г , КCl о,2 г
1. солевой инфузин и др.
28. II. Давление насыщенного пара растворителя
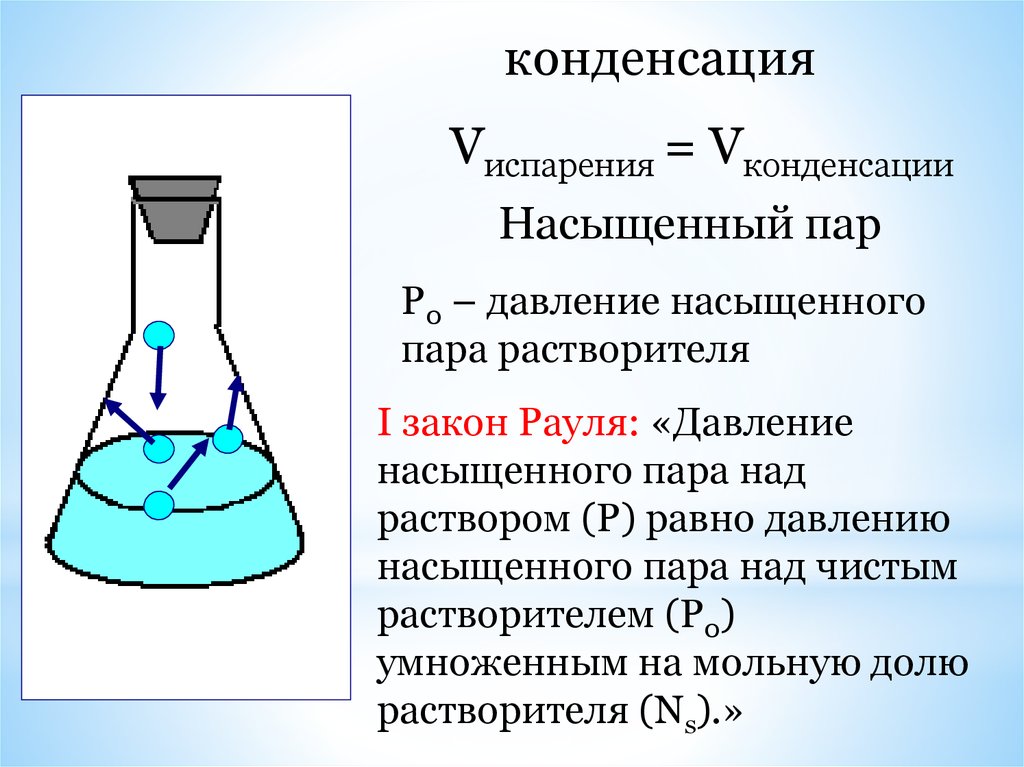
испарение29.
конденсацияVиспарения = Vконденсации
Насыщенный пар
Р0 – давление насыщенного
пара растворителя
I закон Рауля: «Давление
насыщенного пара над
раствором (Р) равно давлению
насыщенного пара над чистым
растворителем (Р0)
умноженным на мольную долю
растворителя (Ns).»
30.
Р = Р0 N sР0 – Р = ΔР ;
абсолютное понижение
давления насыщенного пара р-ля над р-ом
Р0 Р
Р0
nS
NS
nS ni
ΔР-
относительное понижение
давления нас. пара над раствором.
NS + Ni= 1,
P = P0(1- Ni) = P0 - P0 Ni;
P0 – P = P0 Ni ;
ΔР=Р0 N i
NS =1- Ni
Р
Ni
Р0
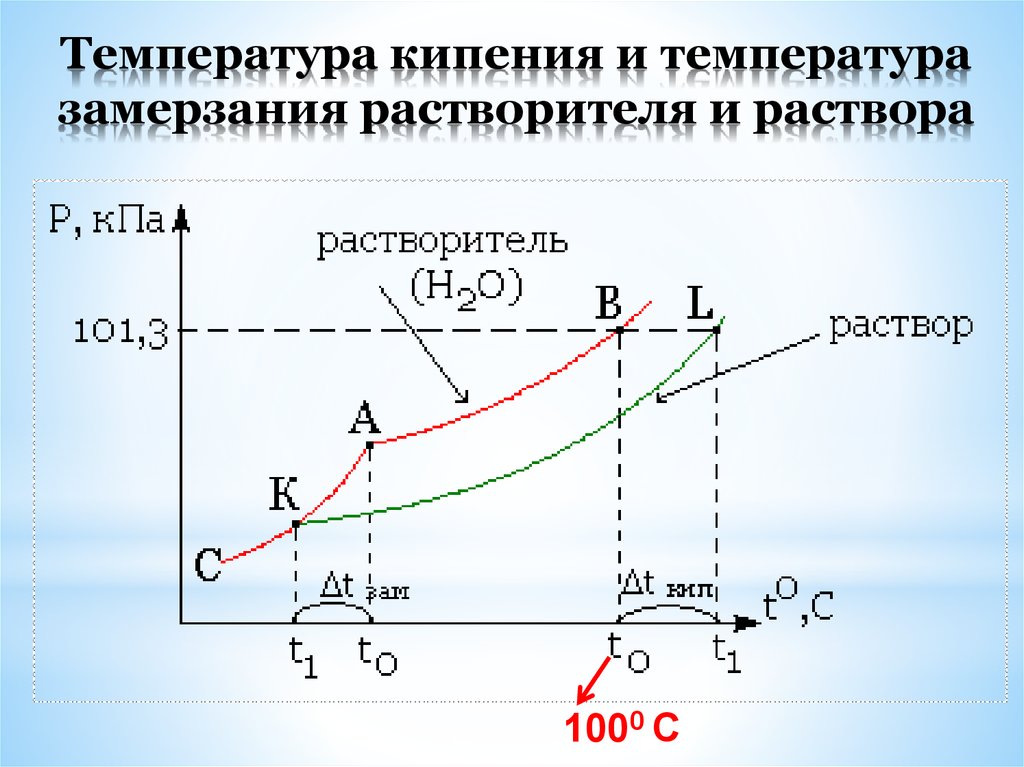
31. Температура кипения и температура замерзания растворителя и раствора
1000 С32.
РастворРастворитель (Н2О)
Р,
кПа
B
101,3
L
A
K
C
∆ t зам.
t
t0
0
∆ t кип
t0
100
t0, С
t
33.
II закон Рауля (1882) : «Повышение tкип. ипонижение tзам. растворов пропорционально
моляльности растворенного вещества.»
tкип. =Е Сm , tзам. = K Сm
Е- эбулиоскопическая постоянная,
К- криоскопическая постоянная,
Сm- моляльность раствора.
Для Н2О: Е= 0,53 кг град / моль,
К=1,86 кг град / моль.
34. Криометрия, эбулиометрия
t замnв
mв
К Сm K
К
m ( H 2O) кг
М в m ( H 2O) кг
К mв
Мв
t зам. m ( H 2O) кг
35. Коллигативные свойства разбавленных растворов электролитов
1. Росм = См R T2. P = P0 Ns
3. Ткип.=Е Сm
4. Тзам.=К Сm
Только для р-ров
неэлектролитов
36.
В 1887 г. Вант-Гофф ввелизотонический коэффициент – i (i>1)
Росм = i См R T
P = i P0 N s
Ткип.= i Е Сm
Тзам.= i К Сm
i= (n-1) + 1
i 1
n 1
37.
Электролитами называютсявещества, которые в растворе или
в расплаве
частично или полностью
распадаются на ионы и проводят
электрический ток за счет
движения ионов.
38.
СвантеАррениус
В 1887г. шведский
учёный
С. Аррениус для
объяснения
особенностей
водных растворов
веществ предложил
теорию
электролитической
диссоциации.
39.
1.Молекулы электролитов прирастворении или расплавлении
распадаются на ионы (+) и (-)
заряженные.
Процесс распада молекул
электролитов на ионы
называется электролитической
диссоциацией или ионизацией.
40.
2. Ионы движутся хаотически, а припропускании электролитического тока
(+) заряженные частицы (Kat)
двигаются к (-) заряженному электроду
- катоду (CuOH+; FeOH²+; NH4+),
а (-) заряженные частицы(An) - к (+)
заряженному электроду аноду
(Cl-; SO3²-; Cr2O7²-; H2PO4-; HCO3-).
41.
3. Диссоциация - процессобратимый. Наряду с ионизацией распадом молекул на ионы идет
процесс ассоциации или молизации
(соединение ионов)
Na2SO4 ↔ 2Na+ + SO4²-
4. Общая сумма зарядов (Kat)
равна общей сумме зарядов
(An) и противоположна по
знаку.
42.
В зависимости от структурыисходного вещества в ионизации
возможны два случая:
Ионизация кристаллов с ионной
структурой (ион-дипольное
взаимодействие)
43.
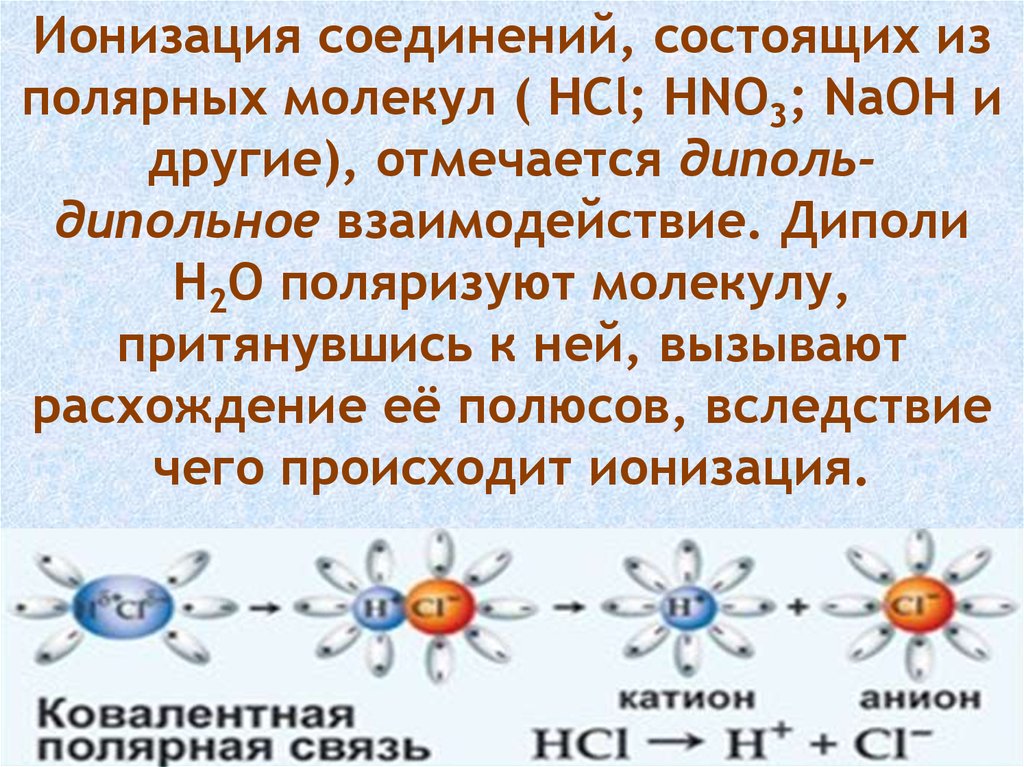
Ионизация соединений, состоящих изполярных молекул ( HCl; HNO3; NaOH и
другие), отмечается дипольдипольное взаимодействие. Диполи
H2O поляризуют молекулу,
притянувшись к ней, вызывают
расхождение её полюсов, вследствие
чего происходит ионизация.
44.
Теория Аррениуса не учитывала влияниерастворителя на процесс ионизации.
Д. И. Менделеев
и И. А. Каблуков
дополнили теорию электролитической
диссоциации: роль растворителя
заключается не только в поляризации и
разделении ионов противоположного знака,
а также и в молизации, т.к. в результате
диссоциации образуются не свободные
ионы, а гидратированные (H2O) или
сальватированные (с другим
растворителем).
45.
Образование гидратных (сальватных)оболочек способствует уменьшению
электростатического взаимодействия
ионов. Ослабление этого процесса
происходит тем сильнее, чем больше
величина диэлектрической проницаемости
(ε) растворителя. Ионизация возможна в
полярных растворителях (ε > 30): H2O-81;
HCN-95; H2SO4-84. Малополярные
растворители (ε=10-30): пиридин-12,5;
этанол-25; не полярные растворители
(ε<10): сероуглерод-2,7; бензол-2,3;
гексан -1,9 не обладают диссоциирующей
способностью.
46.
Для количественной характеристикиполноты ионизации введено
понятие степени ионизации
электролита - это отношение числа
молекул, распавшихся на ионы, к
общему числу его молекул,
введенных в раствор:






































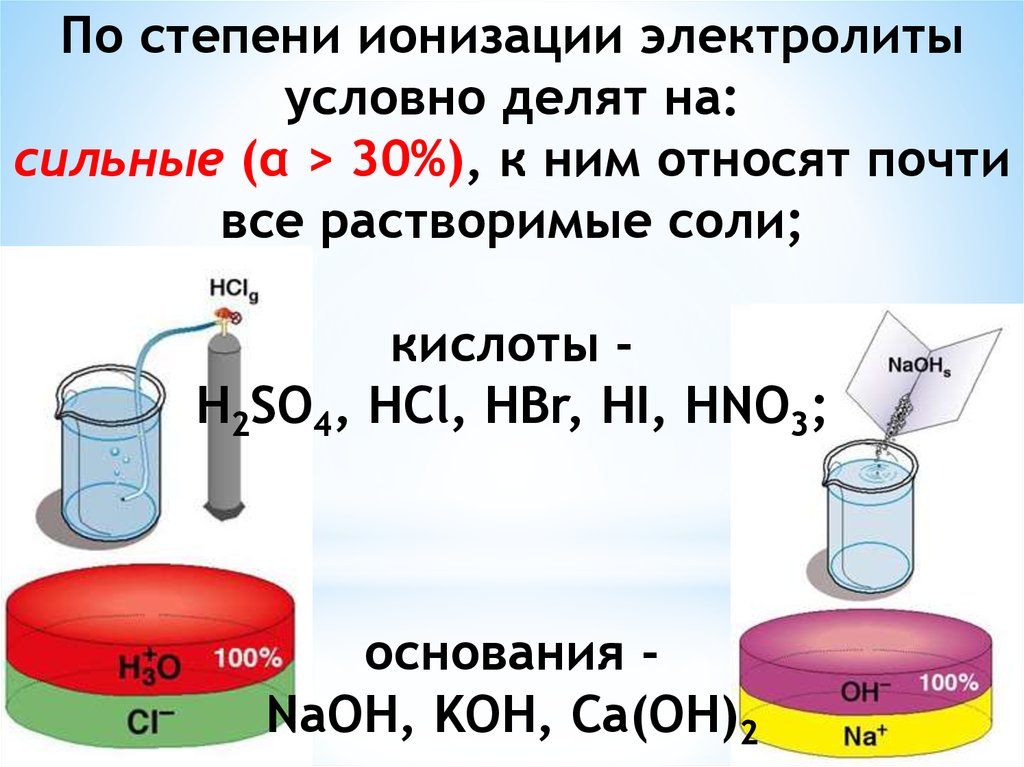
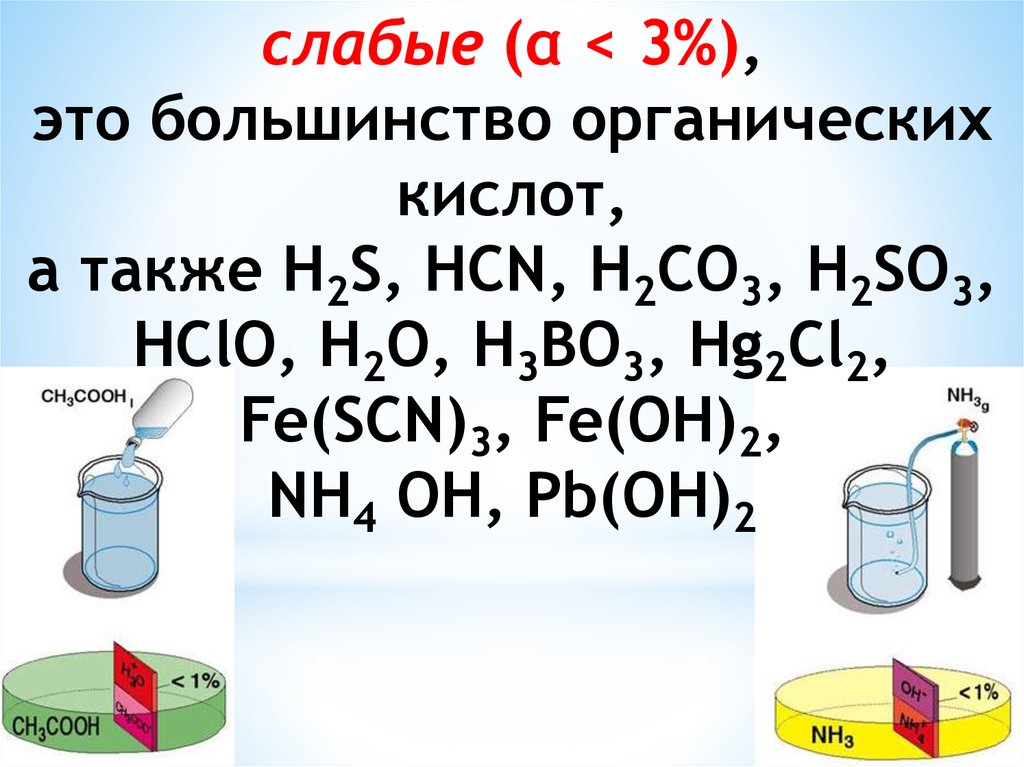
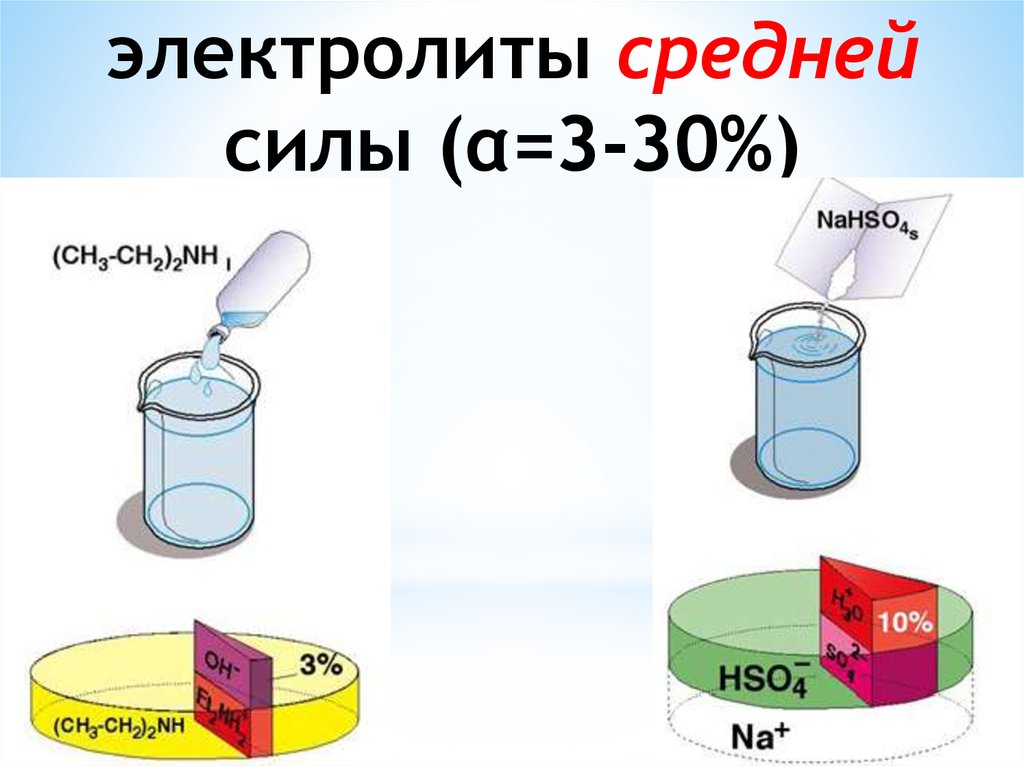



















 Химия
Химия








