Похожие презентации:
Становление органической химии как отдельной науки. (Модуль 1)
1.
CH3N
O
Мультимедийный курс для студентов
биологического отделения ФЕН и МедФ
Резников В.А.
НГУ - 2009
подготовлен в рамках реализации
Программы развития НИУ-НГУ»
2.
МОДУЛЬ 1Становление органической химии как отдельной науки
Велер 1828 г.
Бутлеров 1861 г.
NH4CNO
CH2O
H+
t
H2NCONH2
мочевина (карбамид)
(CH2O)n углеводы
Фридрих
Велер
Бутлеров
Александр Михайлович
Отличительные особенности (сложность) органической химии
1. Длинные углерод-углеродные цепи
2. Изомерия
C20H42 > 300 000 изомеров
C30H62 > 4x109 изомеров
В год синтезируется больше органических
соединений, чем известно соединений
неорганических!
1
3.
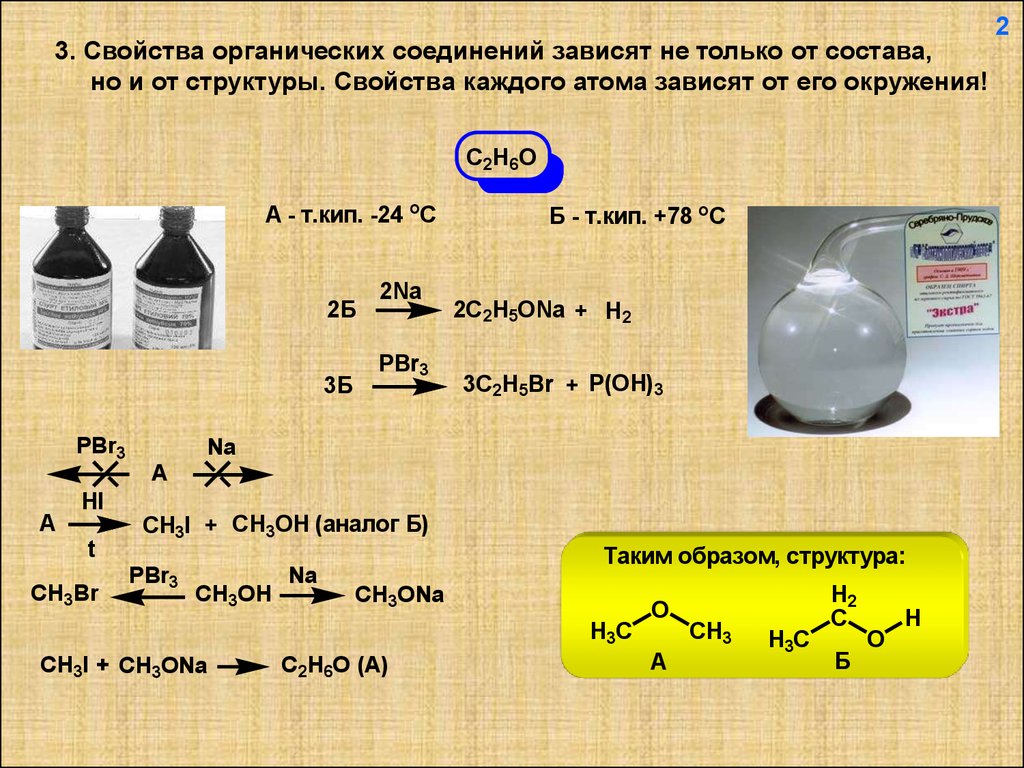
3. Свойства органических соединений зависят не только от состава,но и от структуры. Свойства каждого атома зависят от его окружения!
C2H6O
A - т.кип. -24 оС
2Б
3Б
PBr3
2Na
PBr3
Б - т.кип. +78 оС
2C2H5ONa + H2
3C2H5Br + P(OH)3
Na
A
HI
A
t
CH3Br
CH3I + CH3OH (аналог Б)
PBr3
CH3OH
Na
Таким образом, структура:
CH3ONa
H3C
CH3I + CH3ONa
C2H6O (A)
H2
C
O
CH3
A
H3C
Б
H
O
2
4.
Установление состава органического соединения1. Установление индивидуальности
2. Элементный анализ (сжигание)
Вещество
O2
o
900
CO2 + H2O
Прегль
Нобелевская
премия, 1923 г.
Mg(ClO4)2 - "ангидрон"(улавливание H2O)
NaOH/асбест - "аскарит"
(улавливание CO2)
Дюма
Вещество
CuO / CO2
1000o
NO + NO2
Cu
o
650
Определение эмпирической формулы
N2
3
5.
3. Определение молекулярной массы(эбулиоскопия или криоскопия)
M
= k
1000m
Mp t
M - молекулярная масса
m - масса навески
Mp - масса растворителя
t - изменение температуры плавления (кипения)
k - константа
Брутто-формула
4. Определение строения – спектральные методы
и химические свойства
4
6.
От атомов к молекулам5
Химическая связь
1. Ионная, разница в электроотрицательностей атомов (> 1.7 единиц)
2. Ион-дипольное взаимодействие (сольватация)
3. Диполь-дипольное взаимодействие (водородные связи)
4. Ковалентная связь
Необходимое (но недостаточное!) условие образования связи –
наличие двух электронов (по одному от каждого атома или два от
любого из атомов, образующих связь)
Неполярная ковалентная связь – только между одинаковыми атомами,
все остальные ковалентные связи являются полярными
+
H
H
C
-
H
H
полярная
ковалентная связь
H
H
H
C
C
H
H
H
неполярная
ковалентная связь
7.
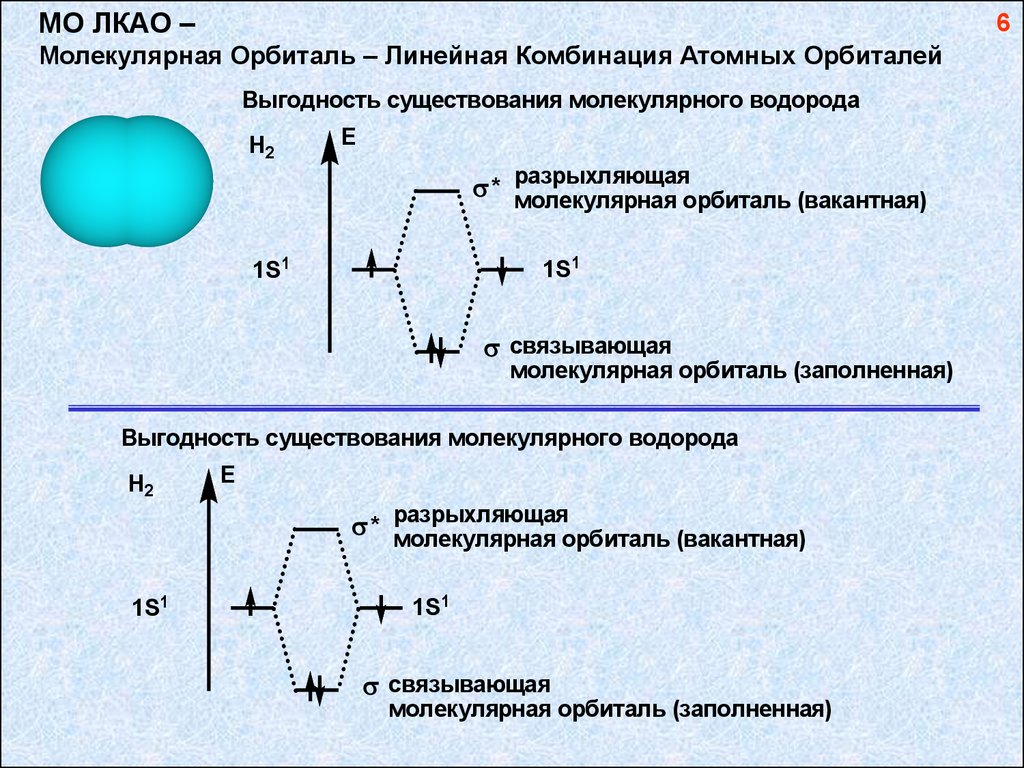
МО ЛКАО –6
Молекулярная Орбиталь – Линейная Комбинация Атомных Орбиталей
Выгодность существования молекулярного водорода
H2
E
* разрыхляющая
молекулярная орбиталь (вакантная)
1S1
1S1
связывающая
молекулярная орбиталь (заполненная)
Выгодность существования молекулярного водорода
H2
E
* разрыхляющая
молекулярная орбиталь (вакантная)
1S1
1S1
связывающая
молекулярная орбиталь (заполненная)
8.
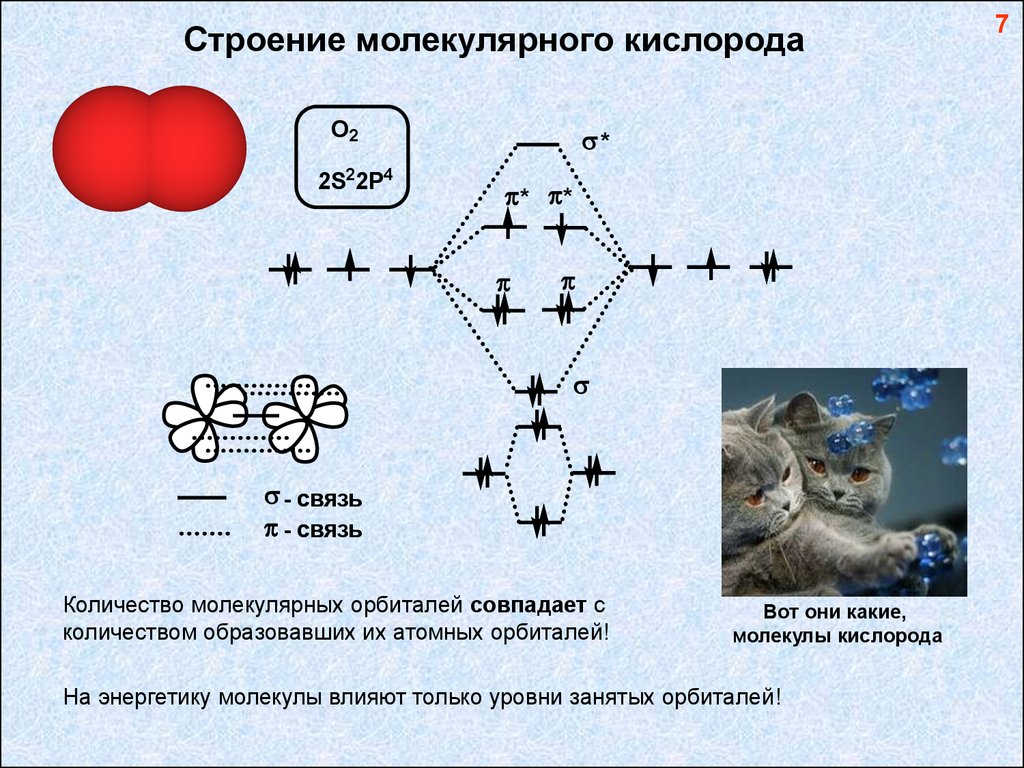
Строение молекулярного кислородаO2
2S2 2P4
*
* *
- связь
- связь
Количество молекулярных орбиталей совпадает с
количеством образовавших их атомных орбиталей!
Вот они какие,
молекулы кислорода
На энергетику молекулы влияют только уровни занятых орбиталей!
7
9.
8Структуры Льюиса
структуры
Льюиса
CH4
C 2S22P2четыре электрона
H 1S1 один электрон
H
H С H
метан
H
N 2S22P3 пять электронов
H N H
H
O
H N H
H
структурные
формулы
O
H N H
H
H
H C H
H
H N H
H
аммиак
O
H N H
H
O
H N H
H
оксид аммония
N
O
образование ковалентной
N O донорно-акцепторной связи
10.
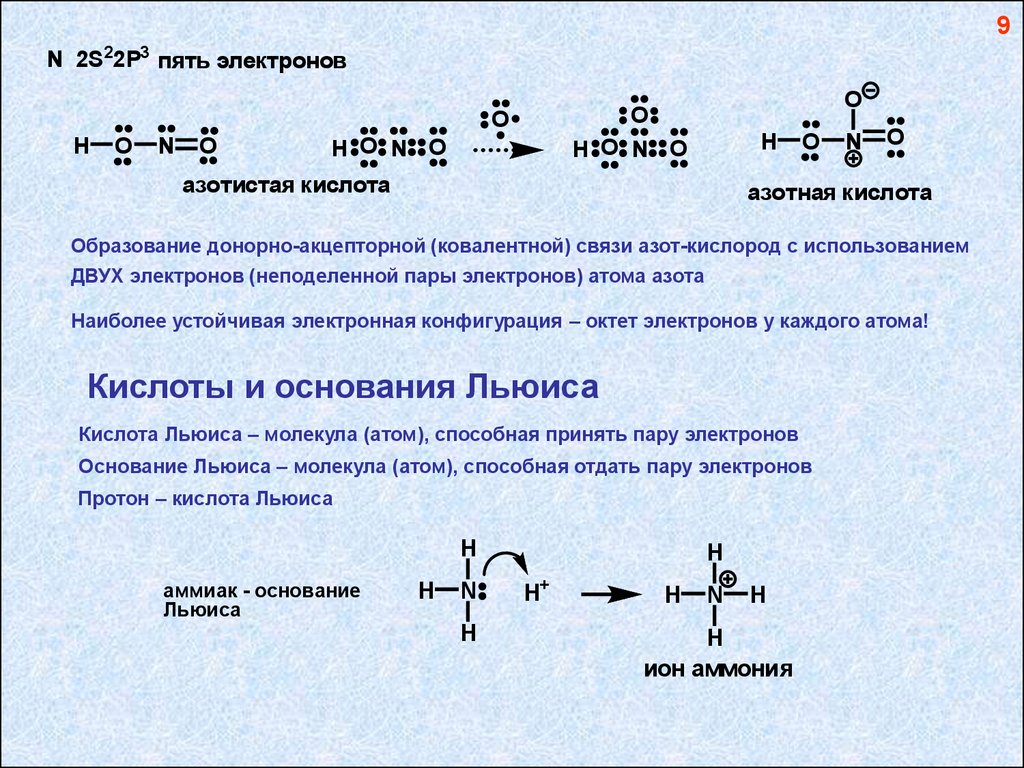
9N 2S22P3 пять электронов
O
H
O
N
O
O
O
H O N O
H O N O
H
азотистая кислота
O
N
O
азотная кислота
Образование донорно-акцепторной (ковалентной) связи азот-кислород с использованием
ДВУХ электронов (неподеленной пары электронов) атома азота
Наиболее устойчивая электронная конфигурация – октет электронов у каждого атома!
Кислоты и основания Льюиса
Кислота Льюиса – молекула (атом), способная принять пару электронов
Основание Льюиса – молекула (атом), способная отдать пару электронов
Протон – кислота Льюиса
H
аммиак - основание
Льюиса
H
N
H
H
H+
H
N
H
H
ион аммония
11.
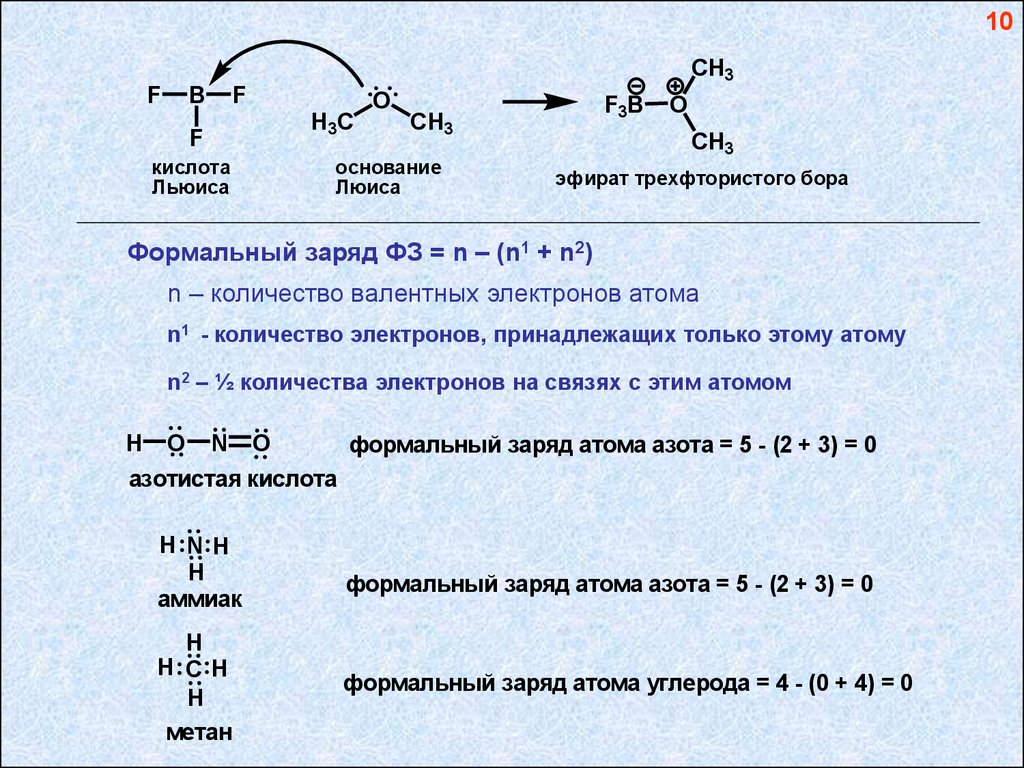
10CH3
F
B
F
O
H3C
F
кислота
Льюиса
F3B
CH3
основание
Люиса
O
CH3
эфират трехфтористого бора
Формальный заряд ФЗ = n – (n1 + n2)
n – количество валентных электронов атома
n1 - количество электронов, принадлежащих только этому атому
n2 – ½ количества электронов на связях с этим атомом
H
O
N
O
формальный заряд атома азота = 5 - (2 + 3) = 0
азотистая кислота
H N H
H
аммиак
формальный заряд атома азота = 5 - (2 + 3) = 0
H
H СH
H
метан
формальный заряд атома углерода = 4 - (0 + 4) = 0
12.
H С HH
формальный заряд атома углерода = 4 - (1 + 3) = 0
11
метильный радикал
H С H
H
формальный заряд атома углерода = 4 - (2 + 3) = 1
(превышение количества электронов над присущим атому означает заряд "минус")
метильный анион
Гибридизация
Из четырех неэквивалентных атомных орбиталей (одной S и трех Р)
«образуется» ЧЕТЫРЕ эквивалентные «гибридизованные» SP3 – гибридные орбитали.
13.
1214.
13Сигма-связь ( -связь) может быть образована в результате
перекрывания двух либо s-орбиталей, либо гибридной орбитали с sорбиталью, либо двух гибридных орбиталей таким образом, чтобы
максимум плотности вероятности нахождения электронов, образующих
эту связь, располагался на оси, соединяющей ядра атомов, связанных
этой связью.
Пи-связь ( -связь) образуется в результате «бокового» перекрывания
двух гибридизованных орбиталей, в результате которого максимум
плотности вероятности нахождения электронов лежит вне оси
(над и под ней), соединяющей ядра атомов.
15.
14Гибридизованые орбитали располагаются в пространстве максимально далеко друг от
друга - лежат в одной плоскости, угол между ними 120о. Негибридизованная р-орбиталь
перпендикулярна этой плоскости.
16.
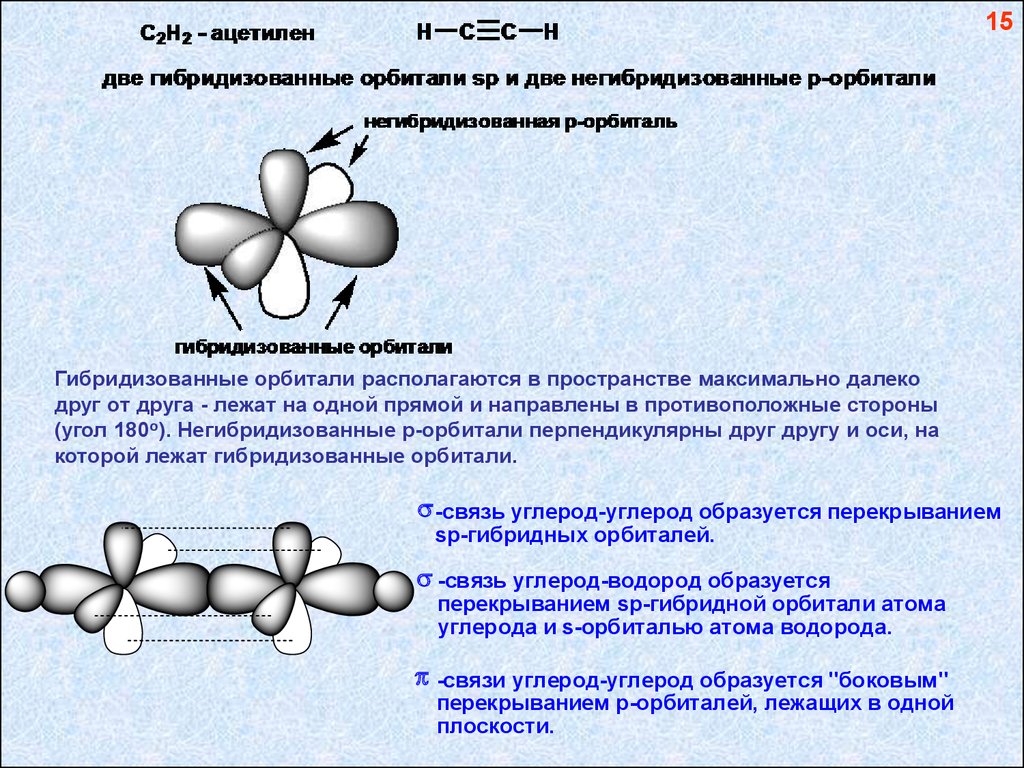
15Гибридизованные орбитали располагаются в пространстве максимально далеко
друг от друга - лежат на одной прямой и направлены в противоположные стороны
(угол 180о). Негибридизованные р-орбитали перпендикулярны друг другу и оси, на
которой лежат гибридизованные орбитали.
-связь углерод-углерод образуется перекрыванием
sp-гибридных орбиталей.
-связь углерод-водород образуется
перекрыванием sp-гибридной орбитали атома
углерода и s-орбиталью атома водорода.
-связи углерод-углерод образуется "боковым"
перекрыванием р-орбиталей, лежащих в одной
плоскости.
17.
Распределение заряда в молекуле16
1. Индуктивный эффект
Индуктивный эффект заместителя – перераспределение электронной плотности по
-связи вследствие различных электроотрицательностей атомов, образующих
эту связь.
+
А
Б
Более электроотрицательный атом (Б) является акцептором по индуктивному эффекту
H
+ C Cl
H
H
H
H
+
H
H
Полярными являются связи и С-Н, и С-Cl, но последняя значительно более полярна
вследствие высокой электроотрицательности атома хлора. Поэтому, для
определения величины и знака заряда достаточно учесть только влияние одного
заместителя - атома хлора.
- Поскольку индуктивный эффект передается по малополяризуемым
+ OH
H
-связям,
он быстро затухает, и помимо атома, связанного с акцепторным заместителем,
в небольшой мере ощущается только на следующем углеродном атоме.
18.
2. Мезомерный эффект, теория резонансаМезомерный эффект заместителя – перераспределение электронной плотности
по -связям вследствие того, что заместитель может подавать электронную
плотность (сопряжение неподеленной пары с - системой), либо размещать на
себе (делокализовывать) электронную плотность с -системы.
Теория (метод) резонанса – способ описания сопряженных -систем,
демонстрирующий подвижность -электронов под действием заместителей,
обладающих мезомерным эффектом.
-Система – цепочка рядом расположенных атомов, каждый из которых имеет
р-орбиталь, либо неподеленную пару электронов. Такие системы называются
сопряженными.
17
19.
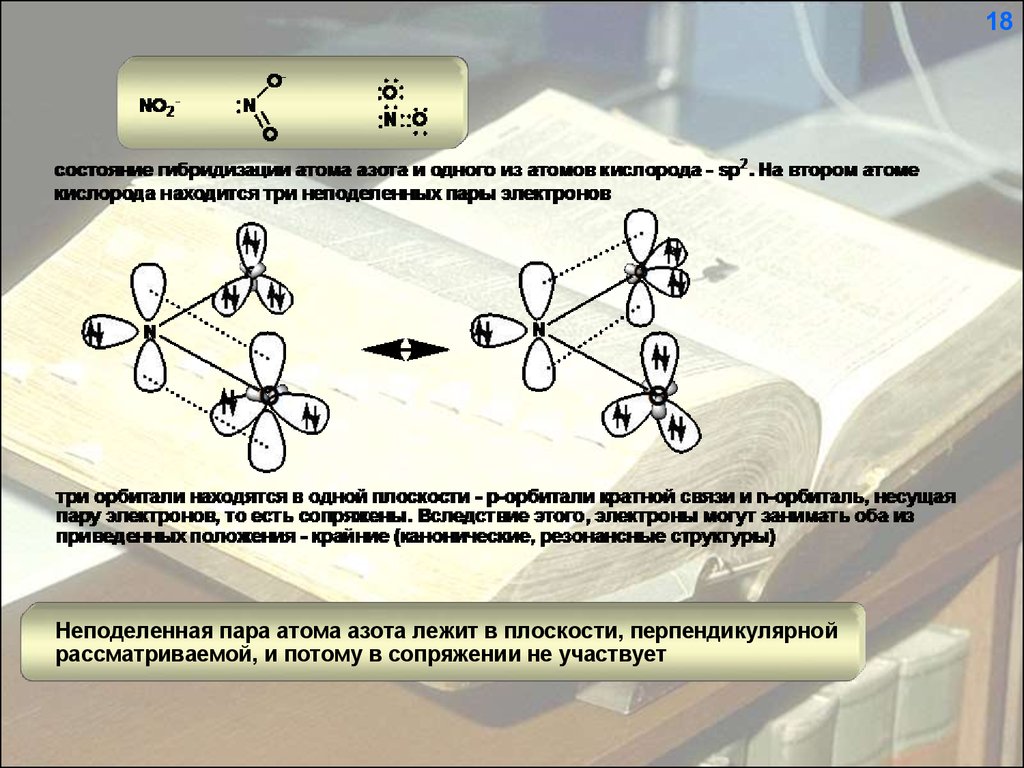
18Неподеленная пара атома азота лежит в плоскости, перпендикулярной
рассматриваемой, и потому в сопряжении не участвует
20.
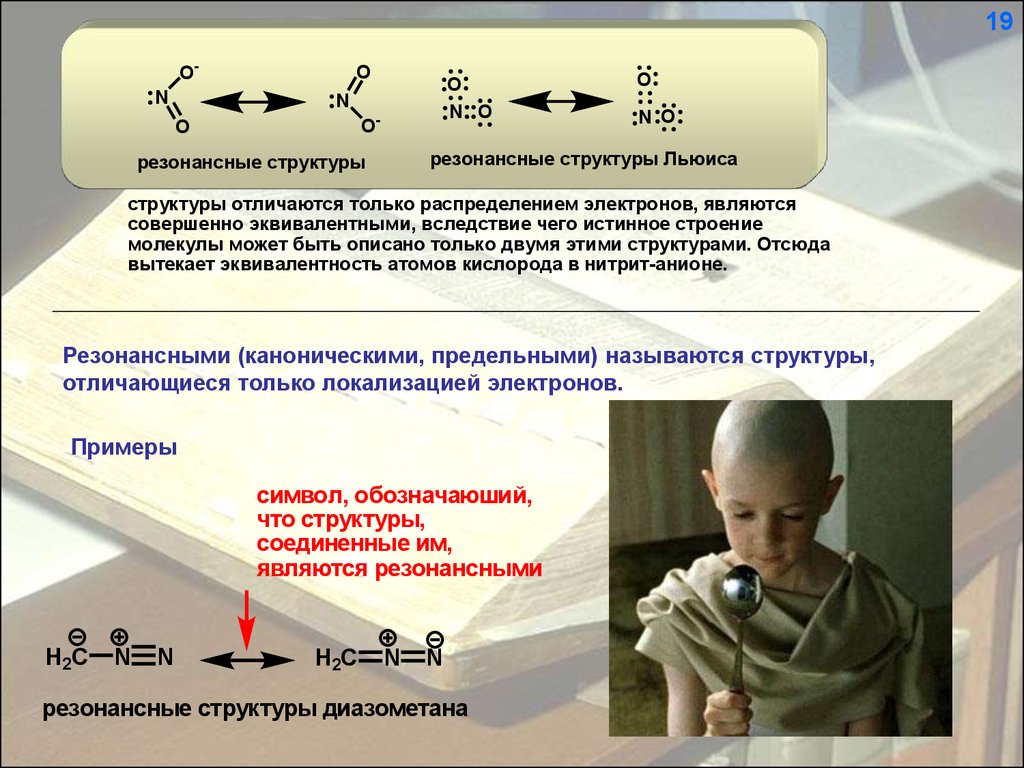
19ON
O
O
N O
N
O-
O
O
N O
резонансные структуры Льюиса
резонансные структуры
структуры отличаются только распределением электронов, являются
совершенно эквивалентными, вследствие чего истинное строение
молекулы может быть описано только двумя этими структурами. Отсюда
вытекает эквивалентность атомов кислорода в нитрит-анионе.
Резонансными (каноническими, предельными) называются структуры,
отличающиеся только локализацией электронов.
Примеры
символ, обозначаюший,
что структуры,
соединенные им,
являются резонансными
H2C
N
N
H2C
N
N
резонансные структуры диазометана
21.
20H2C
CH2
H2C
H2C
CH2
CH2
H2C
CH2
возможные (но неравнозначные!) резонансные структуры этилена
Критерии значимости резонансных структур
1. Наименьшее количество неспаренных электронов
2. Минимальное разделение заряда (и по величине, и по расстоянию)
3. Наличие октета электронов на каждом атоме
4. Отрицательный заряд на более электроотрицательном атоме
H
H
C
H
C
O
H
H
1
O
C
O
H
2
3
Значимость структур: 1 > 2 >> 3
Структура 2 показывает наличие небольшого положительно заряда на атоме
углерода, что находится в соответствии с большей электроотрицательностью
атома кислорода по сравнению с атомом углерода
22.
21H
C
H
O
H+
H
H
C
C
OH
OH
H
H
1
2
Значимость структур: 1 > 2 (на атоме углерода 6 электронов!)
23.
22H
C
H2C
H
C
H2C + X
X - донор или акцептор?
X
X = O, N, S, P, Cl, Br, F, I - акцепторы по индуктивному эффекту
НО!
X = OCH3
H
C
H2C
OCH3
H2C
H
C
H
C
OCH3
результат сопряжения неподеленной
пары электронов на атоме кислорода
с -связью!
H2C
-
OCH3
+
распредение заряда в молекуле
Выводы:
1. Атом кислорода является донором по мезомерному эффекту.
2. Мезомерный эффект оказывает значительно большее влияние на распределение
заряда в молекуле потому, что влияет на сравнительно более подвижные
-электроны.
24.
23H
C
X = CHO - акцептор как по индуктивному, так и по мезомерному эффекту
X
H2C
H
C
H
C
O
C
H
H2C
H2C
H
C
O
C
H
H2 C
O
C
H
H
O
+ C
C +
H2C
H
H
C
H
C
HC
CH
HC
CH
HC
CH
HC
CH
C
H
C
H
+
H
H
C
резонансные структуры
N
C
N
H+
C
NH
не резонансные структуры - изомеры
25.
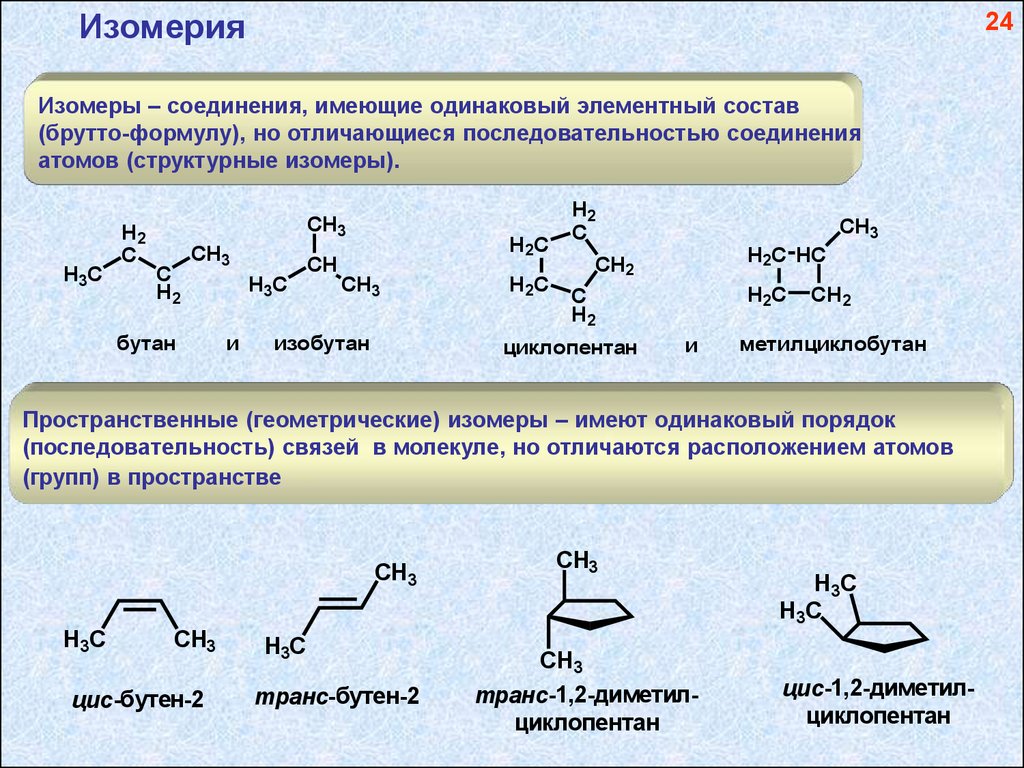
Изомерия24
Изомеры – соединения, имеющие одинаковый элементный состав
(брутто-формулу), но отличающиеся последовательностью соединения
атомов (структурные изомеры).
H3C
H2
C
CH3
C
H2
CH3
бутан
CH
H3C
и
H2C
CH3
изобутан
H2C
H2
C
CH2
C
H2
циклопентан
CH3
H2C HC
H2C
и
CH2
метилциклобутан
Пространственные (геометрические) изомеры – имеют одинаковый порядок
(последовательность) связей в молекуле, но отличаются расположением атомов
(групп) в пространстве
CH3
H3C
CH3
цис -бутен-2
H3C
транс-бутен-2
CH3
CH3
транс-1,2-диметилциклопентан
H3C
H3C
цис-1,2-диметилциклопентан
26.
25Гомологи
–соединения, брутто-формула которых отличается на «гомологическую
разницу» - (CH2)n и которые обладают одинаковыми существенными
структурными признаками.
H2
C
H3C
CH3
H3C
C3H8
C
H2
H2
C
H2C
CH2
C3H6
H3C
CH4O
CH3
гомологи
C4H10
H2
C
CH2
C
H
не гомологи (циклоалкан и алкен - разные
классы соединений
C4H8
OH
H3C
H2
C
H3C
H2
C
O
OH
C2H6O
гомологи (спирты)
H3C
C
H2
C3H8O
CH3
не гомолог (простой эфир)
27.
26Оптическая изомерия
Энантиомеры – зеркальные антиподы, несовпадающие друг с другом
Хиральность
Молекула является хиральной, если не совпадает со своим зеркальным изображением.
Необходимое условие наличия хиральности – отсутствие плоскости симметрии.
Наиболее частая причина хиральности молекулы – наличие асимметрического центра –
атома в состоянии гибридизации sp3, несущего четыре различных заместителя.
b
a
Z c
d
b
c Z a
d
Z = углерод, азот, фосфор,
сера и др.
энантиомеры
неподеленная пара электронов как один из заместителей может
обеспечить хиральность, но, как правило, не обеспечивает
существование индивидуальных энантиомеров вследствие легкого
взаимопревращения последних (инверсия)
a
a
N
b
c
c
N b
b N a
c
конфигурационно-неустойчивые энантиомеры
28.
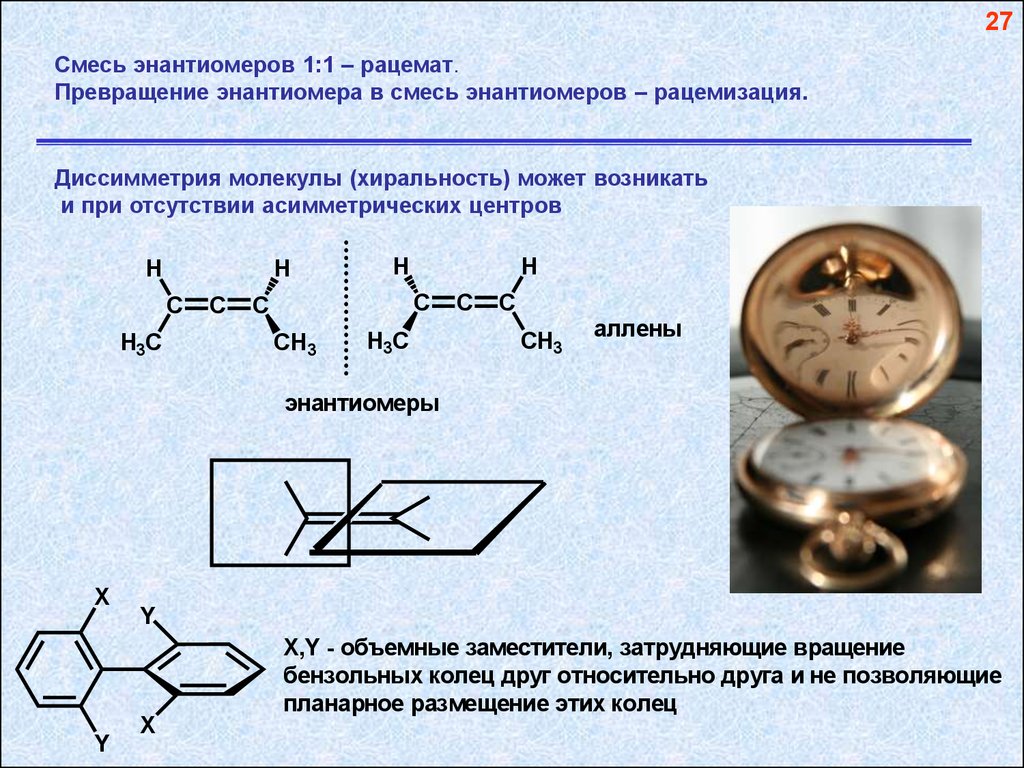
27Смесь энантиомеров 1:1 – рацемат.
Превращение энантиомера в смесь энантиомеров – рацемизация.
Диссимметрия молекулы (хиральность) может возникать
и при отсутствии асимметрических центров
H
H
С
H3C
С
H
H
С
С
CH3
H3C
С
С
CH3
аллены
энантиомеры
X
Y
X,Y - объемные заместители, затрудняющие вращение
бензольных колец друг относительно друга и не позволяющие
планарное размещение этих колец
Y
X
29.
28X
(CH2)n
коронен
(CH2)n
парациклофаны
катенан
узел
30.
29Проекции Фишера
b
b
a
a
c
d
таких изображений возможно 12 для одного энантиомера!
c
d
перестановка двух заместителей = переход к другому энантиомеру
b
a
поворот на 90о = переход к другому энантиомеру
d
с
проекция Фишера
поворот на 180о = тот же самый энантиомер
b
b
a
d
d
d
a
d
энантиомеры
31.
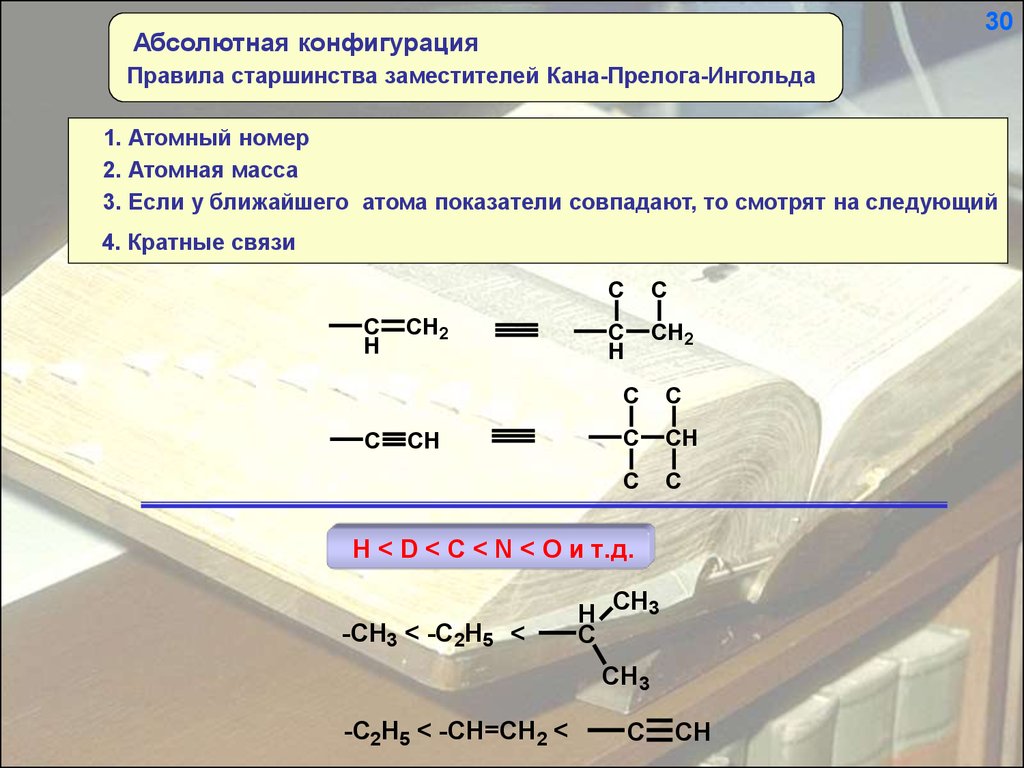
30Абсолютная конфигурация
Правила старшинства заместителей Кана-Прелога-Ингольда
1. Атомный номер
2. Атомная масса
3. Если у ближайшего атома показатели совпадают, то смотрят на следующий
4. Кратные связи
C
H
C
CH2
CH
C
C
C
H
CH2
C
C
C
CH
C
C
H < D < C < N < O и т.д.
-CH3 < -C2H5 <
H CH3
C
CH3
-C2H5 < -CH=CH2 <
C
CH
32.
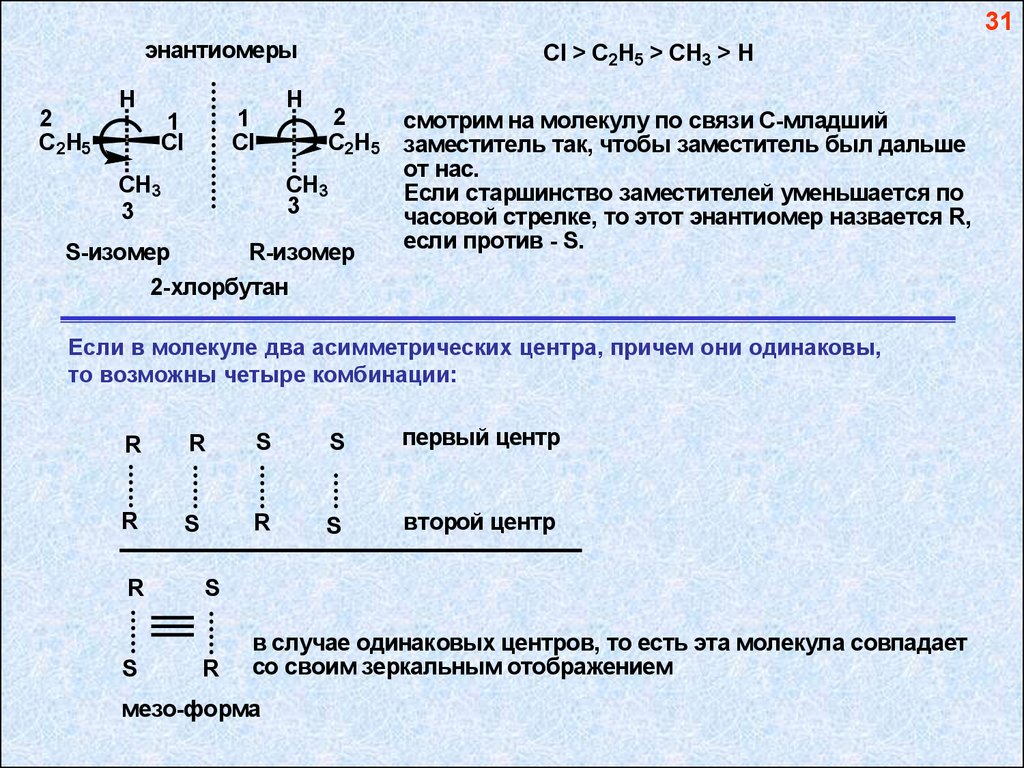
31энантиомеры
2
C2H5
H
H
1
Cl
1
Cl
CH3
3
Cl > C2H5 > CH3 > H
2
C2H5
CH3
3
S-изомер
R-изомер
смотрим на молекулу по связи С-младший
заместитель так, чтобы заместитель был дальше
от нас.
Если старшинство заместителей уменьшается по
часовой стрелке, то этот энантиомер назвается R,
если против - S.
2-хлорбутан
Если в молекуле два асимметрических центра, причем они одинаковы,
то возможны четыре комбинации:
R
R
S
S
первый центр
R
S
R
S
второй центр
R
S
S
R
в случае одинаковых центров, то есть эта молекула совпадает
со своим зеркальным отображением
мезо-форма
33.
Мезо-форма – молекула, имеющая более одного асимметрического центраи плоскость симметрии; ахиральна, оптически неактивна
32
энантиомеры
R
R
S
S
R
S
R
S
диастереомеры
Диастереомеры – оптические изомеры, не являющиеся зеркальным изображением
друг друга
OH
HO2C H CH
C
CO2H
OH
винная кислота
Эпимеры – диастереомеры,
отличающиеся конфигурацией
только одного асимметрического центра
34.
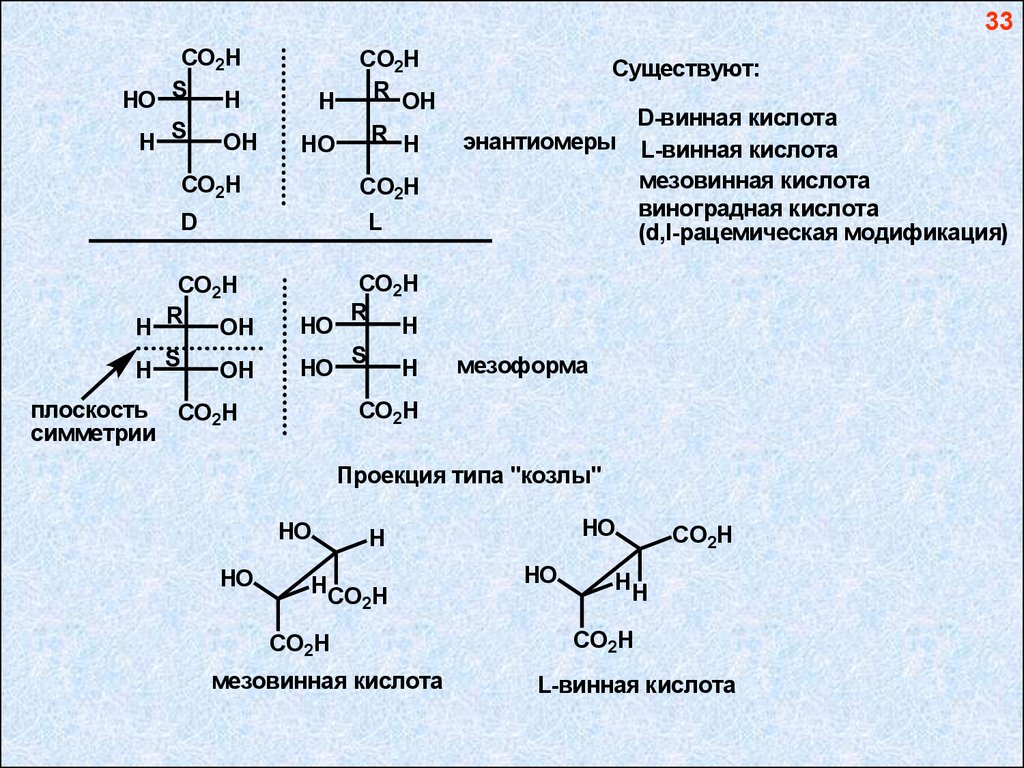
33CO2H
HO S
H
S
H
OH
H
HO
CO2H
CO2H
R OH
R H
CO2H
D
L
CO2H
R
H
OH
H S
OH
CO2H
R
HO
H
S
HO
H
плоскость CO2H
симметрии
Существуют:
D-винная кислота
энантиомеры L-винная кислота
мезовинная кислота
виноградная кислота
(d,l-рацемическая модификация)
мезоформа
CO2H
Проекция типа "козлы"
HO
HO
HO
H
HCO H
2
CO2H
мезовинная кислота
HO
CO2H
HH
CO2H
L-винная кислота
35.
34Молекула с двумя разными асимметрическими центрами,
также возможно четыре комбинации:
энантиомеры
R1
R1
S1
S1
первый центр
R1
S1
R2
S2
R2
S2
второй центр
S2
R2
диастереомеры
Существует две диастереомерных пары, состоящих из энантиомеров –
всего четыре оптических изомера
Br
Cl
2-бром-3-хлорбутан
36.
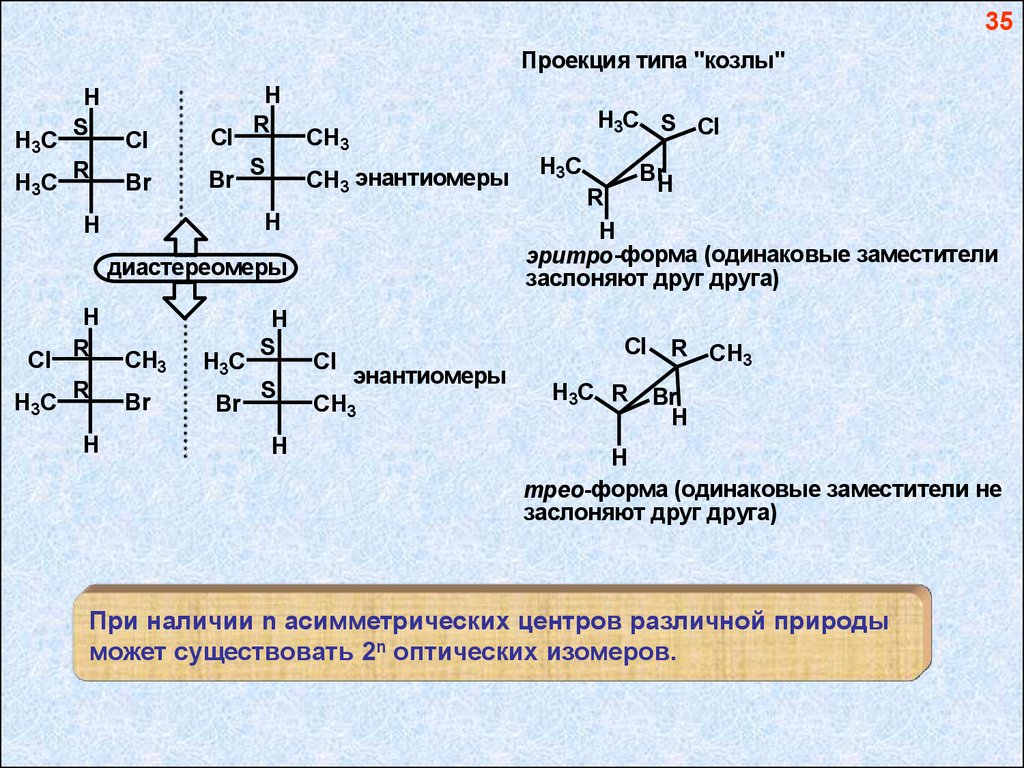
35Проекция типа "козлы"
H3C
H3C
H
S
R
Cl
Cl
Br
Br
H
R
S
H3C S Cl
CH3
CH3 энантиомеры
H
H
диастереомеры
H
Cl R
R
H3C
H
CH3
Br
H3C
Br
H
S
S
H
Cl
H3C
BrH
R
H
эритро-форма (одинаковые заместители
заслоняют друг друга)
Cl
энантиомеры
CH3
H3C R
R CH3
Br
H
H
трео-форма (одинаковые заместители не
заслоняют друг друга)
При наличии n асимметрических центров различной природы
может существовать 2n оптических изомеров.
37.
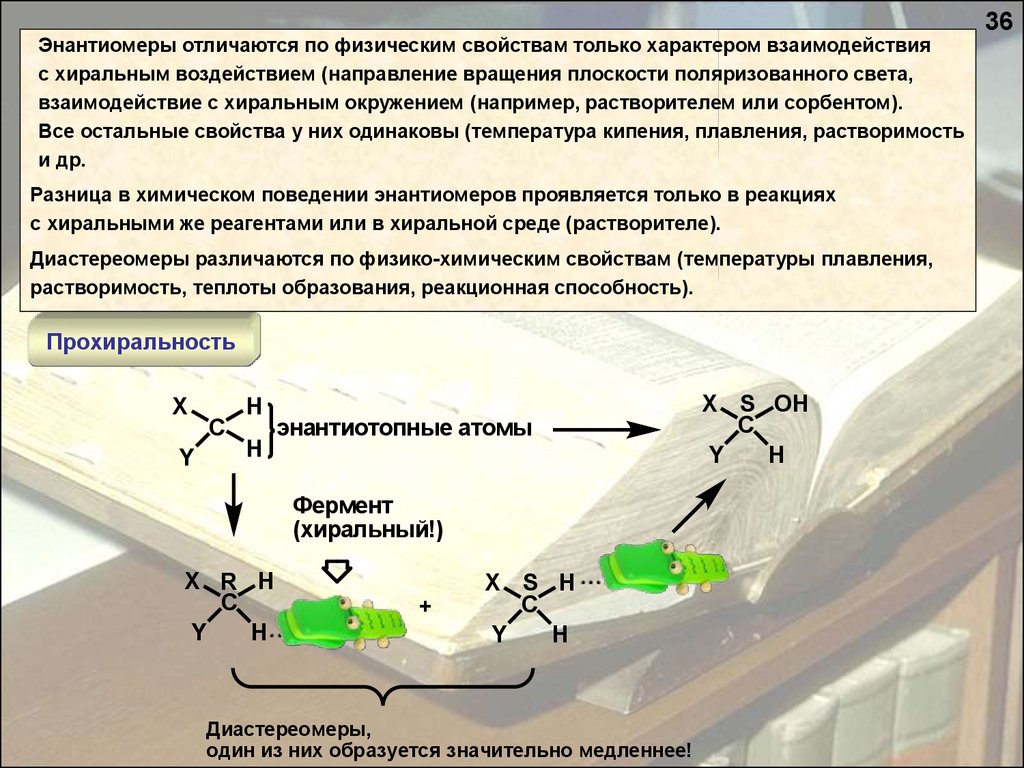
Энантиомеры отличаются по физическим свойствам только характером взаимодействияс хиральным воздействием (направление вращения плоскости поляризованного света,
взаимодействие с хиральным окружением (например, растворителем или сорбентом).
Все остальные свойства у них одинаковы (температура кипения, плавления, растворимость
и др.
Разница в химическом поведении энантиомеров проявляется только в реакциях
с хиральными же реагентами или в хиральной среде (растворителе).
Диастереомеры различаются по физико-химическим свойствам (температуры плавления,
растворимость, теплоты образования, реакционная способность).
Прохиральность
X
H
C
Y
H
энантиотопные атомы
Фермент
(хиральный!)
X R H
C
Y
H
+
X S H
C
Y
H
Диастереомеры,
один из них образуется значительно медленнее!
X S OH
C
Y
H
36
38.
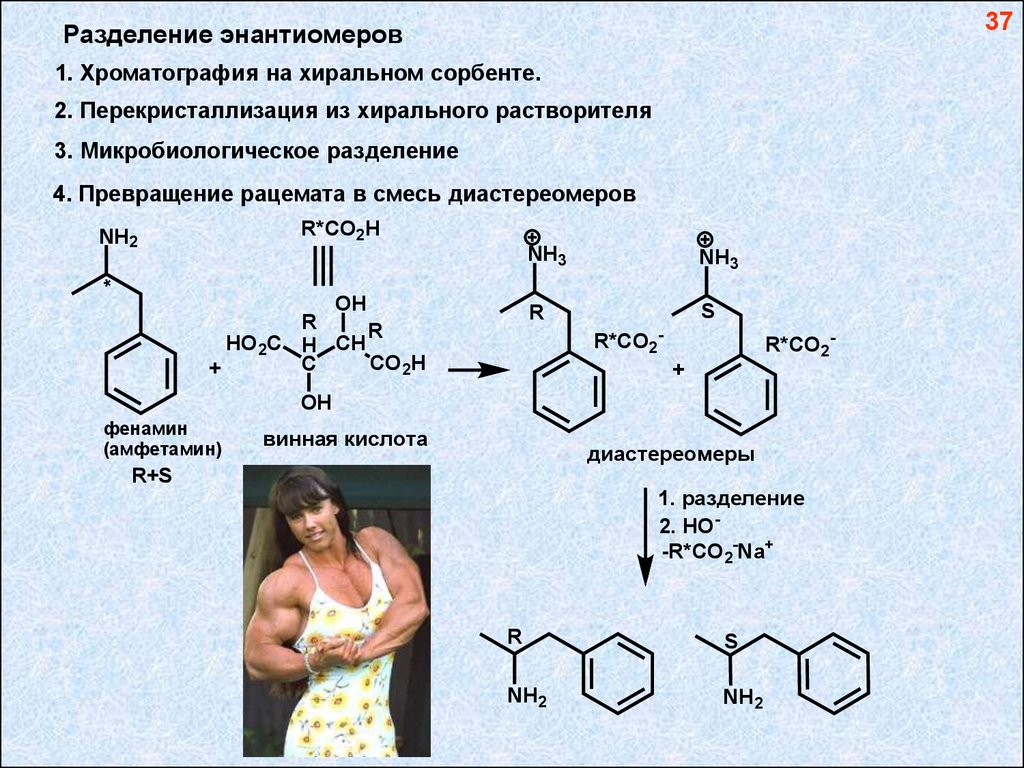
37Разделение энантиомеров
1. Хроматография на хиральном сорбенте.
2. Перекристаллизация из хирального растворителя
3. Микробиологическое разделение
4. Превращение рацемата в смесь диастереомеров
R*CO2 H
NH3
NH3
R
S
*
NH2
OH
R
R
HO2C H CH
CO2H
C
+
R*CO2 -
R*CO2 +
OH
фенамин
(амфетамин)
винная кислота
диастереомеры
R+S
1. разделение
2. HO-R*CO2-Na+
R
S
NH2
NH2
39.
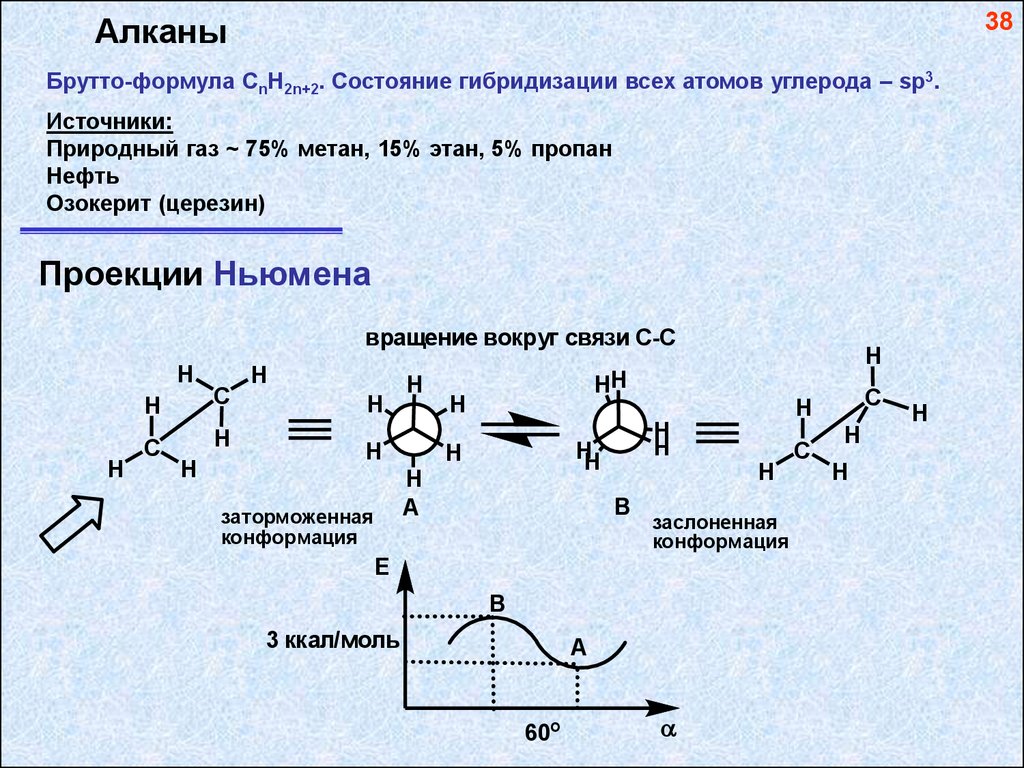
38Алканы
Брутто-формула СnH2n+2. Состояние гибридизации всех атомов углерода – sp3.
Источники:
Природный газ ~ 75% метан, 15% этан, 5% пропан
Нефть
Озокерит (церезин)
Проекции Ньюмена
вращение вокруг связи С-С
H
C
H
H
C
H
H
H
H
H
H
HH
H
C
H
H
H
HH
H
H
A
заторможенная
конформация
H
H
B
заслоненная
конформация
E
B
3 ккал/моль
A
60о
C
H
H
H
40.
39Конформации бутана
H2
C
H3 C
E
H3C CH3
H CH3
5 ккал/моль
C
H2
CH3
H
H
H
H
CH3
H
H
H
H CH3
CH3
H
H
H
CH3
CH3
CH3
H
H3 C
HH
CH3H
H
H
HH
H
H
H
H
CH3
41.
Методы синтеза алканова) Промышленные
1. Ректификация газа и нефти
2. Синтетический бензин, газификация угля
500o
С + H2
CnH2n+2
250 атм.
Fe
3. Синтез Тропша
CO + H2
200o
Fe/Co
CnH2n+2 + H2O
4. Крекинг нефти
CnH2n+2
500-700o
алюмосиликаты
алканы + алкены
40
42.
Лабораторные методы синтеза алканов1.
Al4C3
H2O
CH4
2. Декарбоксилирование
CH3CO2Na
NaOH
t
CH4 + Na2CO3
3. Реакция Вюрца
2Na
2RX
R-R
X = I, Br > Cl
R - первичный алкил > вторичный алкил,
но не третичный!
4. Электрохимический синтез Кольбе
анод
RCO2-
-e
RCO2
R
R
- CO2
R-R
41
43.
425. Восстановление
HI
RX
RH
t
X = галоген, ОН, OR
7. Гидролиз реактивов Гриньяра
H2O
Mg
RMgX
RX
эфир
RH
X = I, Br, Cl
8. Гидрирование алкенов, алкинов
RCH=CHR1
H2
катализатор
RCH2CH2R1
H2
катализатор
R
R1
катализатор = Pt, Pd, Ni-Ренея
9. Диалкилкупраты лития
Li
RX
RLi
-LiX
CuI
R2CuLi
R'X
R-R'
X = I, Br, Cl
R = алкил R' = алкил (первичный или вторичный), винил
44.
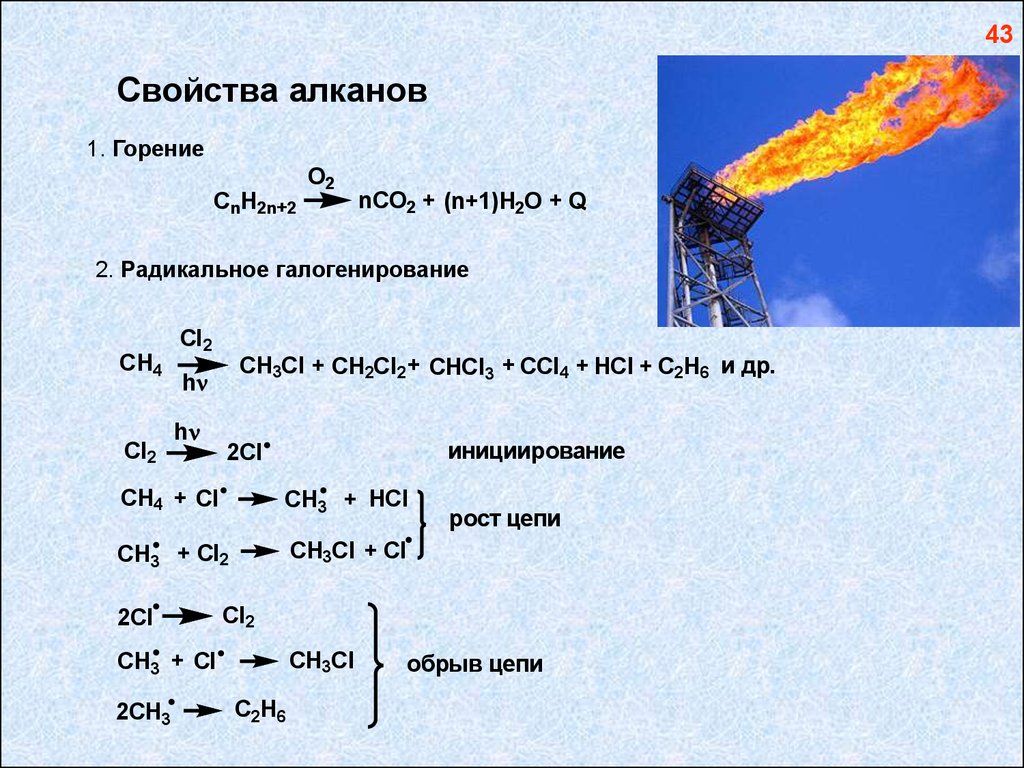
43Свойства алканов
1. Горение
CnH2n+2
O2
nCO2 + (n+1)H2O + Q
2. Радикальное галогенирование
CH4
Cl2
Cl2
CH3Cl + CH2Cl2 + CHCl3 + CCl4 + HCl + C2H6 и др.
h
h
инициирование
2Cl
CH4 + Cl
CH3 + HCl
CH3 + Cl2
CH3Cl + Cl
2Cl
Cl2
CH3 + Cl
2CH3
рост цепи
CH3Cl
C2H6
обрыв цепи
45.
HH
C
H
Cl
H
H
-HCl
C
CH3 + HCl
CH3 + Cl2
CH3Cl + Cl
E
Cl
H
Cl
-Cl
H
CH4 + Cl
44
H
H
C
Cl
H
Лимитирующая стадия реакции
переходное состояние (активированный комплекс)
промежуточный продукт (метильный радикал)
энергия
активации
продукты реакции
координата реакции
46.
CH3H3C
CH
Cl2
h
CH2Cl
H3C
CH
+
H3C
CH3
CH3
:
CH3
Cl
5
а не 9:1!
CH3
CH2
CH
C
CH3
9
H3C
45
CH3
+
H3C
C
CH3
Во всех случаях, когда в молекуле присутствует «нештатное» количество
электронов: радикал, катион, анион – молекула тем более устойчива, чем
в большей степени эта «нештатность» распределена (делокалазована)!
47.
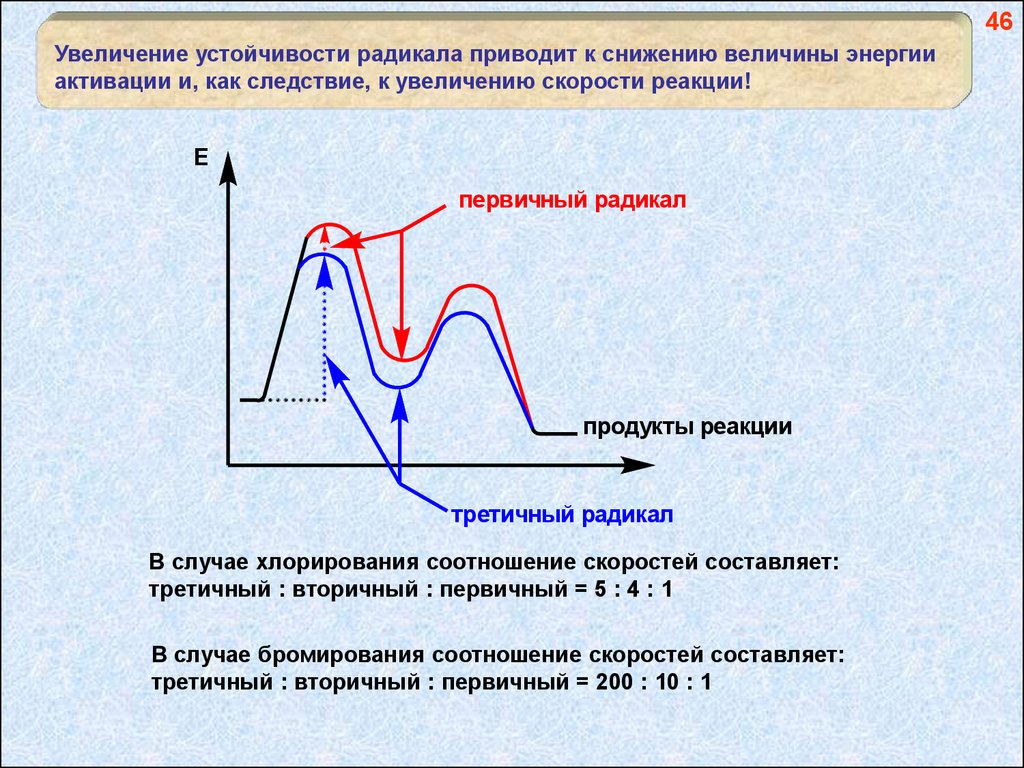
46Увеличение устойчивости радикала приводит к снижению величины энергии
активации и, как следствие, к увеличению скорости реакции!
E
первичный радикал
продукты реакции
третичный радикал
В случае хлорирования соотношение скоростей составляет:
третичный : вторичный : первичный = 5 : 4 : 1
В случае бромирования соотношение скоростей составляет:
третичный : вторичный : первичный = 200 : 10 : 1
48.
47Пример расчета соотношения продуктов моногалогенирования
Cl
Cl2
h
Cl
+
+
А
Cl
Cl
Б
соотношение продуктов
монохлорирования
В+Г
А : Б : (В+Г) = 1х5 : 2х4 : 9х1 = 5 : 8 : 9
Иодирование алканов не происходит,
при фторировании алканов происходит разрыв всех связей С-С
CH4 + F2
CoF2
CnH2n+2
F2
взрыв!
CoF3
CoF3
nCF4 + (2n+2)HF
49.
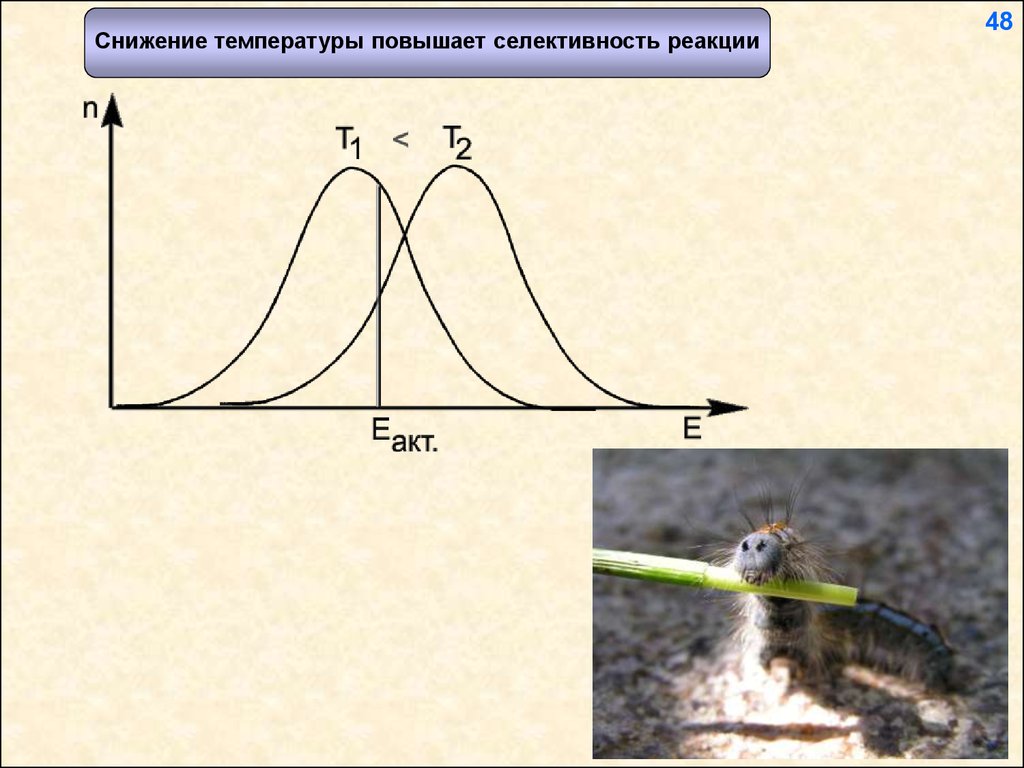
Снижение температуры повышает селективность реакции48
50.
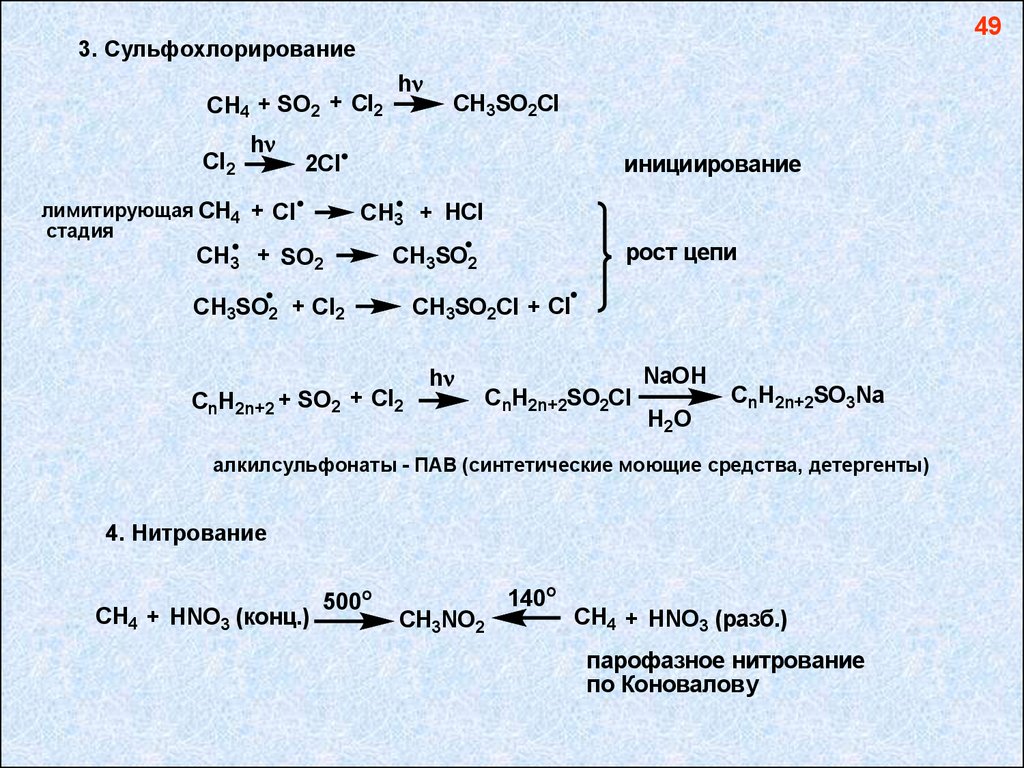
493. Сульфохлорирование
CH4 + SO2 + Cl2
Cl2
h
h
CH3SO2Cl
инициирование
2Cl
лимитирующая CH4 + Cl
стадия
CH3 + HCl
CH3 + SO2
рост цепи
CH3SO2
CH3SO2 + Cl2
CH3SO2Cl + Cl
CnH2n+2 + SO2 + Cl2
h
NaOH
CnH2n+2SO2Cl
H2 O
CnH2n+2SO3Na
алкилсульфонаты - ПАВ (синтетические моющие средства, детергенты)
4. Нитрование
CH4 + HNO3 (конц.)
500о
140o
CH3NO2
CH4 + HNO3 (разб.)
парофазное нитрование
по Коновалову
51.
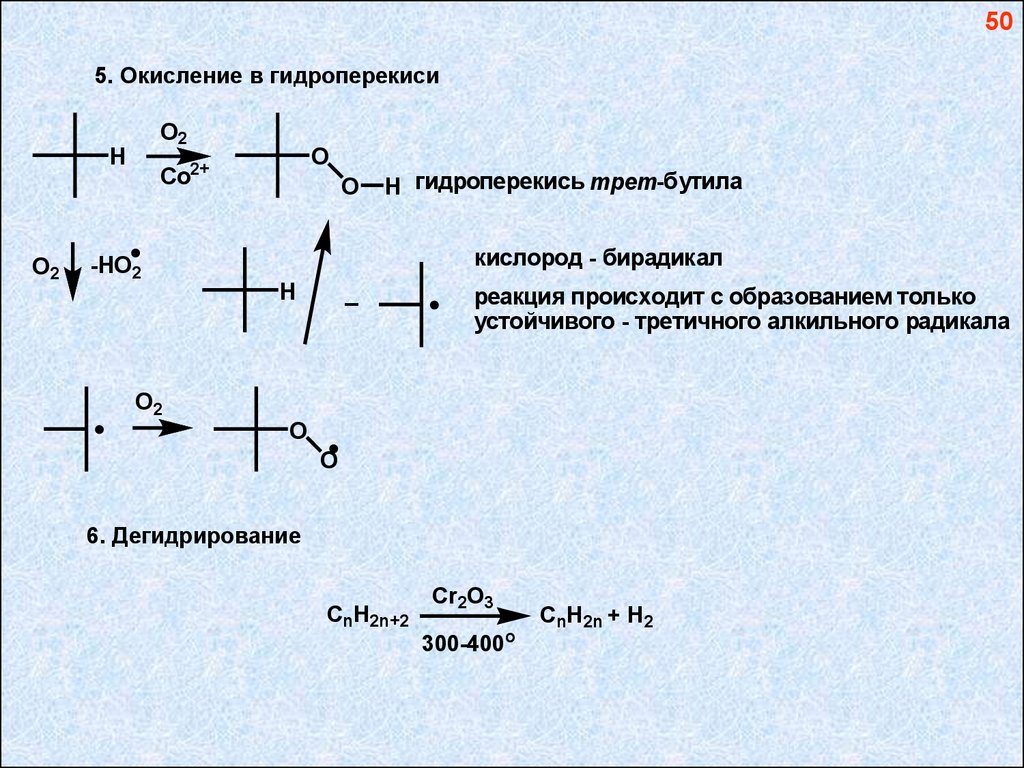
505. Окисление в гидроперекиси
O2
H
O2
O
2+
Co
O
H гидроперекись трет-бутила
кислород - бирадикал
-НO2
H
_
реакция происходит с образованием только
устойчивого - третичного алкильного радикала
O2
O
O
6. Дегидрирование
CnH2n+2
Cr2O3
o
300-400
CnH2n + H2
52.
51Взаимодействие с метиленом (карбеном)
h
H2C N N
диазометан - N2
синглетный
карбен (s)
H3C
H2
C
CH2
CH2
триплетный
карбен (t)
H
s
CH2
CH3
t
s
H3C
H2
C
C
H2
H2
C
H2C
H
+
и др.
CH
H3C
CH3
неселективное внедрение синглетного карбена по связям С-Н
53.
52Циклоалканы
циклогексан
H
декалин
Спиро[5,5]ундекан
Бицикло[2.2.2]октан
H
H
H
H
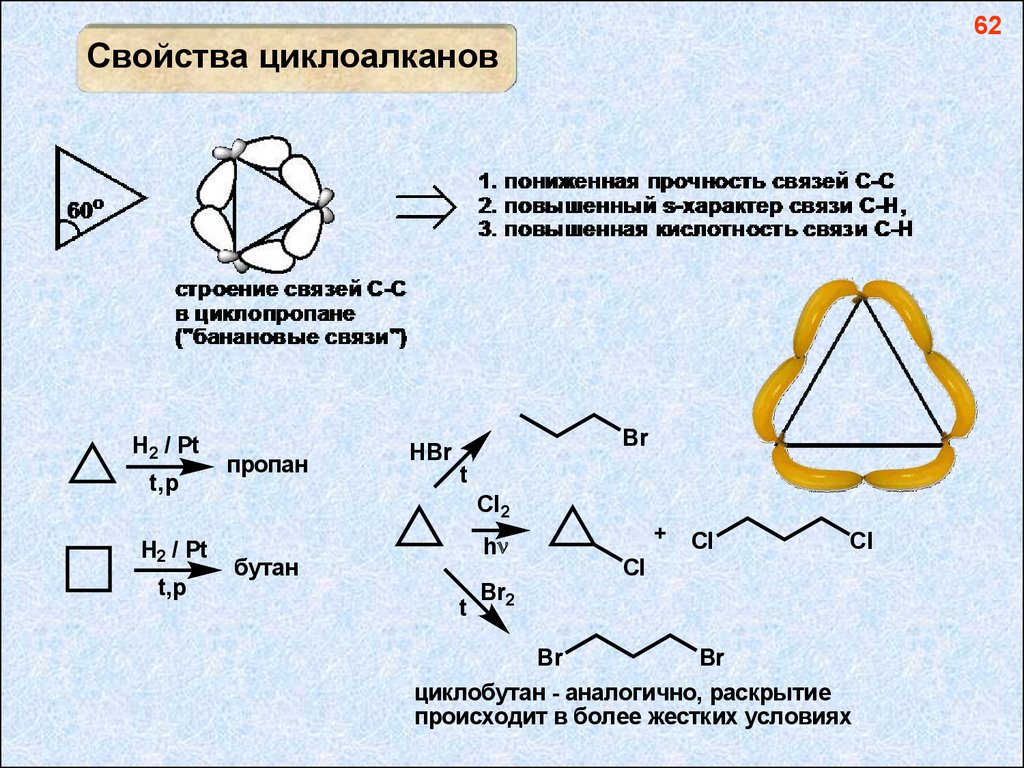
циклопропан - плоский цикл, напряженный (валентный угол < 109o,
все атомы водорода находятся в заслоненной конформации
H
H
H
H
H
H
H
H
H
H
H
H
H
H циклобутан - если бы цикл был плоским,
то все атомы водорода находились бы в
заслоненной конформации, что невыгодно,
H H
поэтому он неплоский
H
"псевдовращение" циклопентана в конформации "конверт"
54.
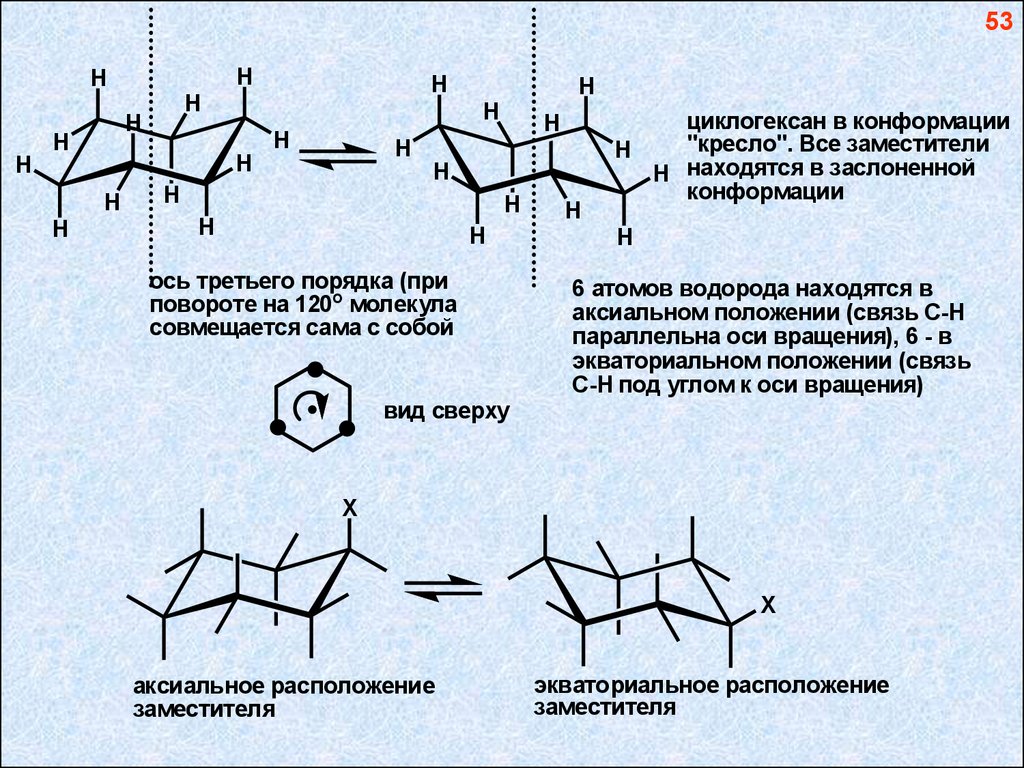
53H
H
H
H
H
H
H
H
H
H
H
H
H
H
H
H
H
H
H
H
ось третьего порядка (при
повороте на 120о молекула
совмещается сама с собой
H
циклогексан в конформации
"кресло". Все заместители
H
H находятся в заслоненной
конформации
H
6 атомов водорода находятся в
аксиальном положении (связь С-Н
параллельна оси вращения), 6 - в
экваториальном положении (связь
С-Н под углом к оси вращения)
вид сверху
X
X
аксиальное расположение
заместителя
экваториальное расположение
заместителя
55.
Xa
54
X
аксиальное расположение
заместителя
экваториальное расположение
заместителя
a
H
H
X
H
e
H
H
H
H
H
H
X
e
H
H
H
H
H
экваториальное расположение заместителя тем более выгодно по
сравнению с аксиальным, чем больше объем этого заместителя
H
H
H
H
H
CH3
H
H
H
H
CH3
H
H3C CH3
H
H
единственный реально
существующий е-конформер
H
H3 C
CH3
H
H
H
H
H
H
H
H
H
56.
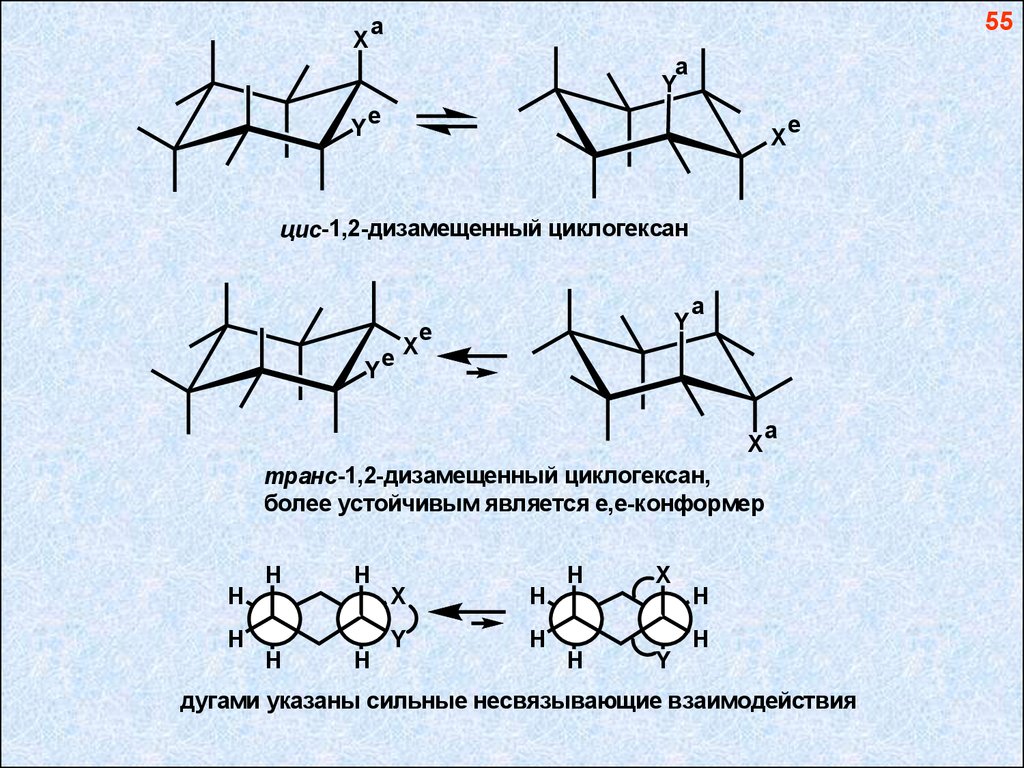
55a
X
a
Y
Y
e
X
e
цис-1,2-дизамещенный циклогексан
Y
e
X
Y
e
a
X
a
транс-1,2-дизамещенный циклогексан,
более устойчивым является е,е-конформер
H
H
H
X
H
X
H
H
H
Y
H
H
H
H
H
Y
дугами указаны сильные несвязывающие взаимодействия
57.
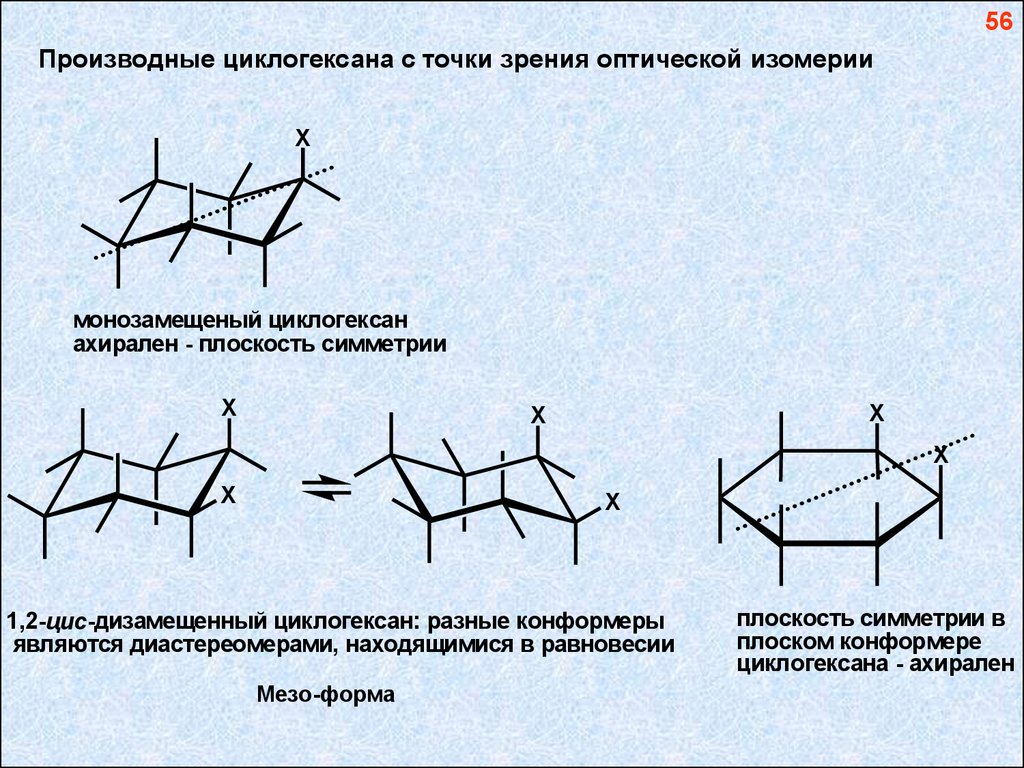
56Производные циклогексана с точки зрения оптической изомерии
X
монозамещеный циклогексан
ахирален - плоскость симметрии
X
X
X
X
X
X
1,2-цис -дизамещенный циклогексан: разные конформеры
являются диастереомерами, находящимися в равновесии
Мезо-форма
плоскость симметрии в
плоском конформере
циклогексана - ахирален
58.
57X
X
Y
Y
энантиомеры
X
дистереомеры
X
Y
Y
энантиомеры
транс- (и цис-)-1X,2Y-циклогексаны могут быть разделены на
энантиомеры - d,l-форма
59.
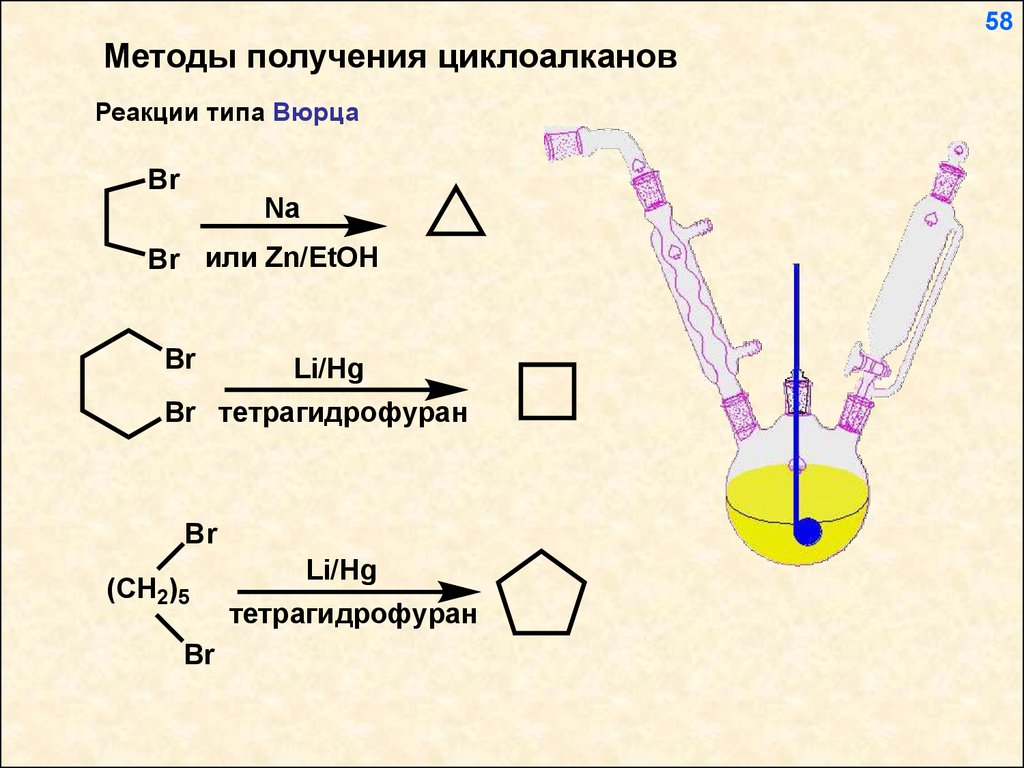
58Методы получения циклоалканов
Реакции типа Вюрца
Br
Na
Br или Zn/EtOH
Br
Li/Hg
Br тетрагидрофуран
Br
(CH2)5
Br
Li/Hg
тетрагидрофуран
60.
Превращение алкенов в производные циклопропанаh
H2C N N
- N2
диазометан
t
CH2
в растворе алкена
газовая фаза
t
CH2
+
s
CH2
s
CH2
t
CH2
H2C
59
s
CH2
синглетный
карбен (s)
триплетный
карбен - бирадикал
61.
60CH2I2
CH2I2
Cu/Zn
Cu/Zn
CH2N2
Cu/t
- N2
N
N
реакция 1,3-диполярного
циклоприсоединения - синхронный
процесс
Реакции типа Дильса-Альдера
F
h
2
CF2
CF2
h
F
F
F
F
F
F
F
62.
61Пиролиз солей дикарбоновых кислот
O
O
(CH2)n
Ca
O
t
-CaCO3
(CH2)n
O
n 4
O
Гидрирование производных бензола
H2/катализатор
X
X
H2/катализатор
X = алкил, OH, NH2
Pt
алканы
t
производные циклогексана + H2
63.
62Свойства циклоалканов
H2 / Pt
t,p
пропан
Br
HBr
t
Cl2
H2 / Pt
t,p
+
h
бутан
Cl
Cl
Cl
t
Br2
Br
Br
циклобутан - аналогично, раскрытие
происходит в более жестких условиях
64.
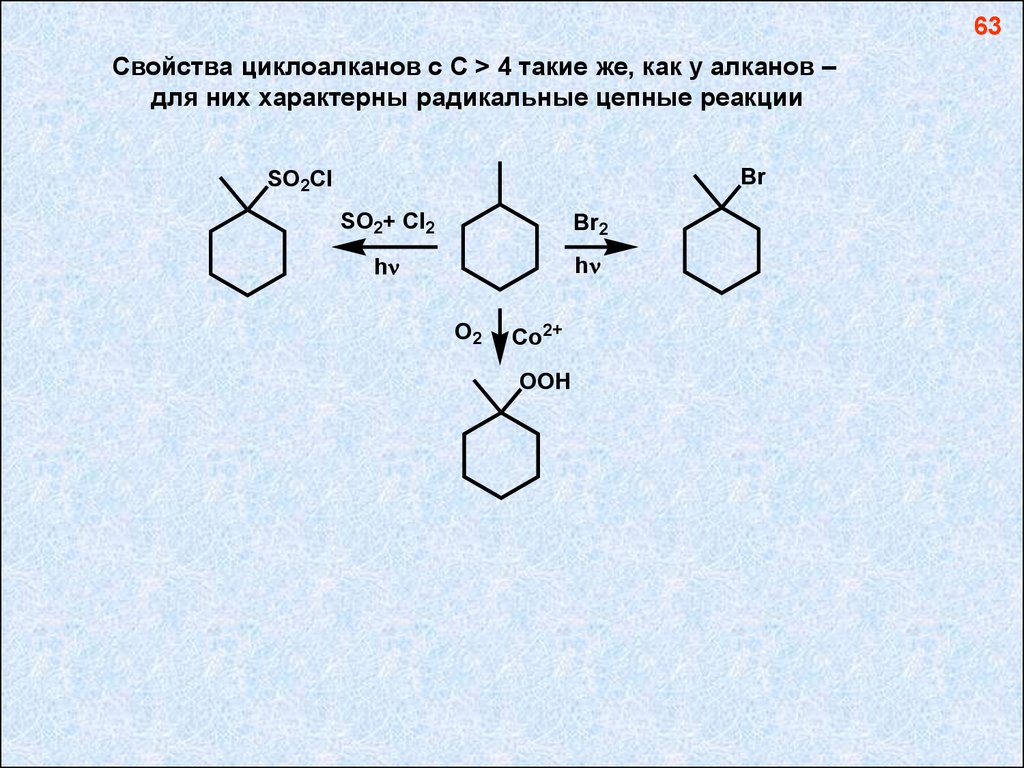
63Свойства циклоалканов с С > 4 такие же, как у алканов –
для них характерны радикальные цепные реакции
Br
SO2Cl
SO2+ Cl2
Br2
h
h
O2
Co2+
OOH



































 Химия
Химия